ช่องทางการผ่าตัดมดลูก (Route of Hysterectomy)
น.พ. ธนัท จิรโชติชื่นทวีชัย
อ.ที่ปรึกษา ร.ศ.น.พ. กิตติภัต เจริญขวัญ
บทนำ
การผ่าตัดมดลูก (hysterectomy) เป็นหนึ่งในการผ่าตัดทางนรีเวชที่สำคัญที่สุด ในแต่ละปีมีการผ่าตัดมดลูก ประมาณ 32,000 รายในประเทศไทย (1) โดยแบ่งเป็นวิธีการผ่าตัดมดลูกผ่านทางหน้าท้อง
วิธีการผ่าตัดมดลูกผ่านทางช่องคลอด วิธีการผ่าตัดมดลูกผ่านการส่องกล้อง และล่าสุดในปัจจุบัน ได้มีวิธีการผ่าตัดมดลูกผ่านการส่องกล้อง โดยใช้หุ่นยนต์ช่วยอีกทางหนึ่ง ซึ่งส่วนใหญ่การเลือกช่องทางการผ่าตัดนั้นควรจะต้องมีการตกลงระหว่างผู้ป่วยและแพทย์ร่วมกัน โดยขึ้นอยู่กับอาการของผู้ป่วย ข้อบ่งชี้ในการผ่าตัด และความเชี่ยวชาญของแพทย์โดยส่วนใหญ่ อย่างไรก็ตามแพทย์มักมีบทบาทในการเลือกช่องทางการผ่าตัดมากกว่า
ข้อบ่งชี้ในการผ่าตัดมดลูก (indications)
- เนื้องอกของกล้ามเนื้อมดลูก (uterine leiomyomata)
- เยื่อบุโพรงมดลูกเจริญผิดที่ (endometriosis)
- ภาวะกระบังลมหย่อน (pelvic organ prolapse)
- เลือดออกผิดปกติจากโพรงมดลูก (abnormal uterine bleeding)
- โรคมะเร็งในอวัยวะสืบพันธ์เพศหญิง (malignant and premalignant disease)
ประเภทการผ่าตัดมดลูก
- การตัดมดลูกและปากมดลูกออก (total hysterectomy)
- การตัดเฉพาะส่วนของมดลูกเหลือปากมดลูกไว้ (subtotal hysterectomy)
เนื่องจากบางคนยังเชื่อในเรื่องความพึงพอใจในการมีเพศสัมพันธ์หลังผ่าตัด โดยความจริงไม่มีข้อบ่งชี้ในการผ่าตัดวิธีนี้ เนื่องจากไม่มีความแตกต่างเมื่อเทียบกับการการตัดมดลูกและปากมดลูกออกทั้งหมด(2) ในภาวะแทรกซ้อน การเสียเลือด และผลลัพธ์หลังการผ่าตัด ทั้งภาวะปัสสาวะผิดปกติ หรือ ความรู้สึกในการมีเพศสัมพันธ์ แต่ยังมีการทำวิธีนี้ เมื่อการตัดปากมดลูกมีความยากลำบากในการผ่าตัด หรือเป็นความต้องการของผู้ป่วยหลังจากได้รับข้อมูลการตัดสินใจแล้ว อย่างไรก็ตาม กรณีที่มีปากมดลูกเหลืออยู่ ต้องมีการตรวจมะเร็งปากมดลูกประจำปี และอาจมีภาวะเลือดออกผิดปกติทางช่องคลอดได้
- การผ่าตัดมดลูกและรังไข่ร่วมด้วย (elective oophorectomy)
แยกเป็นการตัดหนึ่งข้างหรือทั้งสองข้าง โดยพิจารณาจากอายุผู้ป่วย ความเสี่ยง และพยาธิสภาพของรังไข่ทั้งสองข้าง ในกรณีที่มีการตัดรังไข่ทั้งสองข้าง จะมีภาวะขาดฮอร์โมนเอสโตรเจน เช่นเดียวกับผู้ที่หมดระดูแล้ว ซึ่งจะต้องพิจารณาถึงความจำเป็นในการให้ฮอร์โมนทดแทนต่อไป ในประเทศไทยพบว่า 55% ของผู้ที่รับการตัดมดลูก จะได้รับการตัดรังไข่ไปพร้อมกัน ช่วงอายุที่ตัดรังไข่ส่วนใหญ่อยู่ระหว่าง 45–65 ปี คิดเป็น 72% ของผู้ป่วยทั้งหมด (1)
ช่องทางการผ่าตัดมดลูก (route of hysterectomy)
ในปัจจุบันมีช่องทางในการทำการผ่าตัดมดลูกหลายช่องทาง รวมถึงการใช้หลายช่องทางร่วมกัน กล่าวคือ
- การผ่าตัดทางหน้าท้อง (abdominal hysterectomy)
- การผ่าตัดทางช่องคลอด (vaginal hysterectomy)
- การผ่าตัดมดลูกผ่านการส่องกล้อง (conventional laparoscopic hysterectomy)
- วิธีการผ่าตัดมดลูกผ่านการส่องกล้อง โดยใช้หุ่นยนต์ช่วย (robot-assisted laparoscopic hysterectomy)
โดยทั่วไปการเลือกช่องทางการผ่าตัดขึ้นอยู่กับ ข้อบ่งชี้ในการผ่าตัด ความปลอดภัยของผู้ป่วย ผลข้างเคียง และคำนึงถึงวิธีการที่บาดเจ็บน้อยที่สุดก่อนเสมอ (3)
การเปรียบเทียบระหว่างการผ่าตัดทางหน้าท้อง กับการผ่าตัดทางช่องคลอด (abdominal versus vaginal hysterectomy)
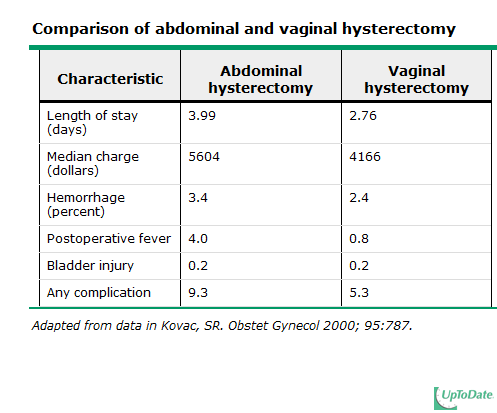
จากการศึกษาส่วนใหญ่ได้ข้อสรุปว่าการผ่าตัดทางช่องคลอดมีภาวะแทรกซ้อนน้อยกว่า ระยะเวลาในการพักฟื้นน้อยกว่า นอนโรงพยาบาลสั้นกว่า รวมทั้งค่าใช้จ่ายทั้งหมดต่ำกว่าการผ่าตัดทางหน้าท้อง (5-6)
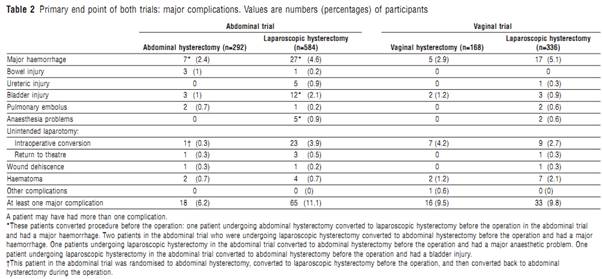
อย่างไรก็ตามในปัจจุบันการผ่าตัดทางหน้าท้อง (abdominal hysterectomy) ก็ยังเป็นวิธีหลักที่ใช้กันทั่วไป เนื่องจาก ยังมีความเชื่อว่าการผ่าตัดที่ยาก ซับซ้อนไม่สามารถทำการผ่าตัดทางช่องคลอดได้ (7-8)
ข้อห้ามในการผ่าตัดทางช่องคลอด(9)
- มดลูกขนาดใหญ่กว่า 280 กรัม หรือเกินกว่า 12 สัปดาห์ (ขนาดปกติประมาณ 70-125 กรัม) (uterine enlargement)
- ช่องคลอดแคบกว่า 2 นิ้วมือ หรือไม่เคยคลอดทางช่องคลอด (narrow vagina)
- มดลูกขยับได้ (lack of uterine mobility)
- มีพยาธิสภาพที่รังไข่ร่วมด้วย (adnexal disease)
- เคยมีประวัติผ่าตัดคลอดหรือ เคยผ่าตัดบริเวณอุ้งเชิงกราน (prior pelvic surgery)
- โรคมะเร็ง (malignancy)
- กระดูกเชิงกรานแคบ (contracted pelvis)
- จำเป็นต้องทำการตรวจสอบหรือผ่าตัดบริเวณช่องท้องส่วนบน (need to explore the upper abdomen )
แต่เนื่องจากข้อห้ามดังกล่าวยังไม่มีการศึกษาอย่างชัดเจน ในเวลาต่อมาเมื่อมีการศึกษาวิจัยมากขึ้น ข้อห้ามหลายข้อก็เป็นที่ถกเถียง และถูกลดความน่าเชื่อถือลง (8,10-13)
1. ความยืดหยุ่นของตำแหน่งมดลูก (uterine mobility)
ในผู้ป่วยที่มีมดลูกอยู่สูง หรือขยับได้น้อย เนื่องจากไม่เคยคลอดบุตร (nulliparous) หรือเคยมีประวัติผ่าตัดคลอด เป็นหนึ่งในข้อห้าม แต่จากคำแนะนำว่า การผ่าตัดมดลูกในกรณีที่มิใช่มะเร็ง ควรใช้การผ่าตัดทางช่องคลอด (vaginal hysterectomy) เป็นทางเลือกแรก(11) จากการศึกษานี้ ผู้ป่วยที่มีภาวะกระบังลมหย่อน (pelvic organ prolapse) ภาวะมะเร็ง ขนาดมดลูกมากกว่า 16สัปดาห์ การผ่าตัดเยื่อบุโพรงมดลูกเจริญผิดที่รุนแรง (extensive endometriosis) ถูกแยกออกจากกลุ่มวิจัย มีการผ่าตัดทางหน้าท้อง 97 ราย มีการผ่าตัดทางช่องคลอด175 ราย ตลอดระยะการศึกษาทั้งหมด 5 ปีสรุปภาวะแทรกซ้อนไม่แตกต่างกัน ถึงแม้จะมีการตัดรังไข่ร่วมด้วยก็ตาม
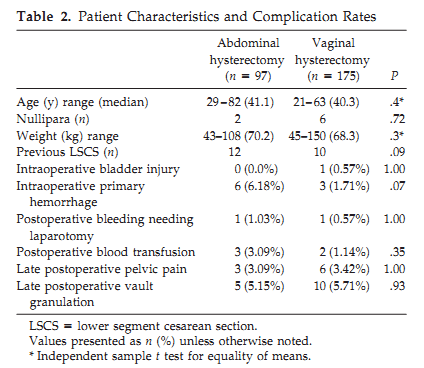
จากการศึกษานี้ความยืดหยุ่นของตำแหน่งมดลูก (uterine mobility) ไม่มีความสำคัญในการตัดสินใจเปลี่ยนเป็นการผ่าตัดทางหน้าท้อง แต่อย่างไรก็ตามในผู้ป่วยที่มีภาวะพังผืดแน่นในอุ้งเชิงกราน เช่นจากภาวะเยื่อบุโพรงมดลูกเจริญผิดที่รุนแรง (severe endometriosis) ก็ควรได้รับการผ่าตัดทางหน้าท้อง หรือผ่านการส่องกล้องช่วย
2. ขนาดมดลูก (uterine size)
จากการศึกษาในผู้ป่วยเนื้องอกมดลูก 204 รายที่มีขนาดมดลูกตั้งแต่ 280 – 2,000 กรัม และหรือมีข้อห้ามในการผ่าตัดทางช่องคลอดร่วมด้วย อย่างน้อยอีกหนึ่งข้อ (เช่น เคยผ่าตัดในอุ้งเชิงกราน, ไม่เคยคลอดบุตร, มีพยาธิสภาพที่รังไข่ร่วมด้วย)(8) ในทุกรายมีการตัดมดลูกออกทางช่องคลอด ร่วมกับการตัดย่อยมดลูก(vaginal morcellation) มี ผู้ป่วย 4 รายต้องใช้การส่องกล้องช่วยผ่าตัด 2 รายเปลี่ยนเป็น ผ่าตัดทางหน้าท้อง(laparotomy) และการตัดรังไข่ร่วมด้วยสามารถทำได้ 90.6% จากทั้งหมด
จะเห็นว่าขนาดของมดลูกไม่เป็นอุปสรรคในการผ่าตัดทางช่องคลอด
3. ประวัติการผ่าตัดคลอด (prior cesarean delivery)
จากประวัติเคยผ่าตัดคลอดมีความกังวลต่อเรื่อง แผลเป็นบริเวณส่วนล่างของมดลูกกับ กระเพาะปัสสาวะ ว่าอาจทำให้มีพังผืดติด และอาจเกิดการบาดเจ็บต่อกระเพาะปัสสาวะขณะผ่าตัดทางช่องคลอดได้
จากการศึกษาแบบ retrospective study ในผู้ป่วย 220 ราย ที่มีประวัติเคยผ่าตัดคลอด (ตั้งแต่ 1 ครั้งขึ้นไป) เปรียบเทียบกับผู้ป่วย 200ราย ที่ไม่เคยมีประวัติผ่าตัดในอุ้งเชิงกราน (14) ปรากฏว่ามีเพียง 3 จาก 200ราย (1.5%) ที่มีการบาดเจ็บต่อทางเดินปัสสาวะจากการศึกษาปัจจัยที่สัมพันธ์กับความสำเร็จในการผ่าตัดทางช่องคลอดคือ เคยผ่าตัดคลอดเพียง1ครั้งแต่ถ้ามีประวัติแผลผ่าตัดติดเชื้อจะมีความเสี่ยงมากขึ้น เนื่องจากจะมีพังผืดมากระหว่างมดลูกกับกระเพาะปัสสาวะ
จากการศึกษาดังกล่าว ประวัติเคยผ่าตัดคลอด ไม่น่าเป็นข้อห้ามในการผ่าตัดมดลูกทางช่องคลอด
4. ไม่เคยคลอดบุตรทางช่องคลอด (nulliparity)
จากความคิดว่า ผู้ป่วยที่ไม่เคยคลอดบุตรน่าจะมีช่องคลอดที่แคบ มดลูกอยู่สูง ทำให้การผ่าตัดมดลูกทางช่องคลอดยาก
จากการศึกษาแบบ comparative prospective ในผู้ป่วยที่ไม่เคยคลอดบุตร 52 ราย กับผู้ป่วยที่เคยคลอดบุตร 293 ราย (15) สรุปว่า ในผู้ป่วยที่ไม่เคยคลอดบุตร ใช้เวลาในการผ่าตัดนานกว่า 15 นาที (95 กับ 80 นาที) มีภาวะแทรกซ้อนมากกว่า (13% กับ 4%), เสียเลือดมากกว่า (7.7% กับ 1.7%) แต่จำนวนผู้ป่วยที่ผ่าตัดสำเร็จ 50/52 ราย และ 292/293 รายในผู้ที่เคยคลอดบุตร
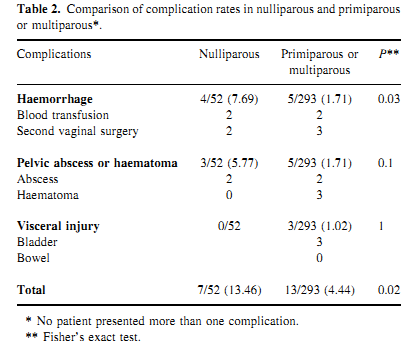
จะเห็นว่าในผู้ป่วยไม่เคยคลอดบุตร ก็สามารถทำการผ่าตัดมดลูกทางช่องคลอดได้ แต่ควรต้องพิจารณา ถึงความเหมาะสมเป็นรายๆไป
5. จำเป็นต้องตัดรังไข่ร่วมด้วย (need for oophorectomy)
จากการศึกษาในหลายการศึกษา พบว่าสามารถผ่าตัดรังไข่พร้อมกับการผ่าตัดมดลูกทางช่องคลอดได้ ประมาณ95% โดยในบางราย มีการใช้กล้องส่องทางหน้าท้องช่วย จึงสรุปได้ว่ากรณีที่ต้องตัดรังไข่ร่วมด้วย ก็สามารถผ่าตัดมดลูกทางช่องคลอดได้ (15-20)
6. ภาวะอ้วน (obesity)
ในผู้ป่วยที่มีภาวะอ้วน มีผลทำให้การผ่าตัดยากขึ้นในระดับหนึ่งอยู่แล้วไม่จะทางหน้าท้อง หรือทางช่องคลอด แต่จากการทบทวนวรรณกรรม พบว่าการผ่าตัดมดลูกทางช่องคลอดมีภาวะแทรกซ้อนจากการผ่าตัดน้อยกว่า (21-23)
ตั้งแต่ปี 1999 the Society of Pelvic Reconstructive Surgeons ได้ออก guidelines สำหรับเลือก ช่องทางการผ่าตัดมดลูก (route of hysterectomy) หลังจากนั้นก็มีการผ่าตัดมดลูกทางช่องคลอดมากขึ้น ค่าใช้จ่าย ภาวะแทรกซ้อนจากการผ่าตัด ระยะเวลาการนอนโรงพยาบาลน้อยลง (24,25)
จากที่กล่าวไปจะเห็นว่าการผ่าตัดมดลูกทางช่องคลอดเป็น ทางเลือกการผ่าตัดมดลูกอันดับแรกที่ควรทำ ในกรณีที่ไม่มีข้อห้าม หลังจากการศึกษาวิจัยต่างๆ ทำให้มีการปรับเปลี่ยนคำแนะนำในการเลือกการผ่าตัดมดลูกทางช่องคลอด(26) ดังนี้


การผ่าตัดมดลูกทางช่องคลอดโดยใช้กล้องช่วย (laparoscopic assisted vaginal hysterectomy)
ในกรณีที่จากการประเมินผู้ป่วยแล้ว คาดว่าจะมีปัญหาอื่นที่ทำให้การผ่าตัดมดลูกทางช่องคลอดมีปัญหา เราอาจใช้กล้องส่องประเมินพยาธิสภาพในช่องท้องในการผ่าตัดก่อนได้ ( diagnostic laparoscopy ) เช่นในภาวะเยื่อบุโพรงมดลูกเจริญผิดที่(endometriosis), พยาธิสภาพที่รังไข่, เคยมีประวัติติดเชื้อในอุ้งเชิงกราน (27) หรือในกรณีที่มีปัญหาระหว่างการผ่าตัดมดลูกทางช่องคลอด อาจสามารถใช้การผ่าตัดผ่านกล้องช่วย เพื่อให้สามารถทำการผ่าตัดทางช่องคลอดต่อได้
การเปรียบเทียบระหว่างการผ่าตัดมดลูกผ่านการส่องกล้องทั้งหมด กับการผ่าตัดทางช่องคลอด (total laparoscopic versus vaginal hysterectomy)
จากการศึกษาวิจัยส่วนใหญ่ได้ผลสรุปใกล้เคียงกันว่า มีภาวะแทรกซ้อนใกล้เคียงกัน ยกเว้นเรื่องระยะเวลาในการผ่าตัดผ่านการส่องกล้องใช้ระยะเวลานานกว่า แต่ภาวะเจ็บปวดหลังผ่าตัดน้อยกว่า โดยระยะเวลาการนอนโรงพยาบาลไม่ต่างกันอย่างมีนัยสำคัญทางคลินิก (28)
แต่อย่างไรก็ตามการผ่าตัดมดลูกผ่านการส่องกล้อง ต้องมีระยะการฝึกฝนที่นานกว่า และต้องอาศัยอุปกรณ์ที่มีค่าใช้จ่ายแพงกว่าการผ่าตัดทางช่องคลอด ความเป็นไปได้ในการปรับใช้ในประเทศไทย การผ่าตัดทางช่องคลอดจึงยังมีความได้เปรียบมากกว่า
วิธีการผ่าตัดส่องกล้องที่กำลังอยู่ในการศึกษา
วิธีการผ่าตัดมดลูกผ่านการส่องกล้อง โดยใช้หุ่นยนต์ช่วย (robot-assisted laparoscopic hysterectomy)
เป็นอีกหนึ่งวิธีที่กำลังเป็นที่สนใจในขณะนี้ แต่ด้วยข้อจำกัดในการฝึกอบรม ตลอดจนอุปกรณ์การผ่าตัด ทำให้ยังไม่เป็นที่แพร่หลายในขณะนี้ ในด้านของการผ่าตัด มีข้อด้อยกว่าในแง่ของ ความรู้สึกในการสัมผัส (tactile feedback) แต่ได้ภาพจากกล้องที่ชัดเจนกว่า เป็นสามมิติเสมือนจริง และเครื่องมือมีการเคลื่อนไหวได้ละเอียดอ่อนใกล้เคียงกับการใช้มือจริงๆ มาทดแทน
จากการศึกษาแบบ systematic review การศึกษาที่ใหญ่ที่สุด รวบรวมมีข้อมูลจากผู้ป่วย 36,188 ราย 358 โรงพยาบาล แบ่งเป็นข้อมูลจากการผ่าตัดมดลูกผ่านการส่องกล้อง 34,527 ราย (95%) และจากการผ่าตัดมดลูกผ่านการส่องกล้อง โดยใช้หุ่นยนต์ช่วย 1,661 ราย (5%) สรุปได้ว่า ภาวะแทรกซ้อนจากการผ่าตัดไม่แตกต่างกัน แต่ระยะเวลาในการผ่าตัดโดยใช้หุ่นยนต์ช่วย นานกว่า และค่าใช้จ่ายสูงกว่า ตลอดจนแพทย์ที่สามารถทำการผ่าตัดได้ยังมีไม่มาก ยังคงต้องมีการศึกษาเพิ่มเติมต่อไปในอนาคต(32)
นอกจากนี้ หากพิจารณาจากการศึกษาแบบ systematic review อีกการศึกษาที่รวบรวมข้อมูล แผลผ่าตัดมดลูกในช่องคลอดแยกพบว่าการผ่าตัดมดลูกผ่านการส่องกล้องปกติ มีแผลแยกน้อยกว่า การผ่าตัดมดลูกผ่านการส่องกล้อง โดยใช้หุ่นยนต์ช่วย โดยการเย็บปิดแผลผ่าตัดมดลูกผ่านทางช่องคลอดจะช่วยลด โอกาสแผลแยกได้มากขึ้น (33)
การผ่าตัดมดลูกผ่านกล้องแบบรูเดียวบริเวณสะดือ (single port laparoscopic hysterectomy)
เป็นพัฒนาการจากการผ่าตัดแบบหลายแผล มาเป็นแผลเดียวบริเวณสะดือ ซึ่งจากการศึกษาพบว่าแบบแผลเดียว มีอาการปวดแผลหลังผ่าตัดน้อยกว่า ใช้ยาแก้ปวดน้อยกว่า โดยระยะเวลาการผ่าตัด ภาวะแทรกซ้อนไม่ต่างกัน (34)
การเปรียบเทียบระหว่างการผ่าตัดทางหน้าท้อง การผ่าตัดมดลูกผ่านการส่องกล้อง และการผ่าตัดทางช่องคลอด (abdominal versus vaginal versus laparoscopic hysterectomy)
Cochrane Systematic review (5) ซึ่งรวบรวมข้อมูลจาก 34 randomized trials โดยมีจำนวนผู้ป่วยทั้งสิ้น 4,495 ราย เพื่อหาช่องทางการผ่าตัดที่เหมาะสมที่สุดในการผ่าตัดมดลูกที่ไม่ใช่มะเร็ง ได้ข้อสรุป ดังนี้
- เมื่อเปรียบเทียบระหว่างการผ่าตัดทางหน้าท้องกับการผ่าตัดทางช่องคลอด พบว่าการผ่าตัดทางช่องคลอด มีความเจ็บปวดหลังผ่าตัดน้อยกว่า หายเร็วกว่า นอนพักฟื้นสั้นกว่า แต่ระยะเวลาในการผ่าตัดสรุปได้ไม่ชัดขึ้นอยู่กับประสบการณ์ของผู้ผ่าตัด
- เมื่อเปรียบเทียบระหว่างการผ่าตัดมดลูกผ่านการส่องกล้องกับการผ่าตัดทางหน้าท้อง
พบว่าการผ่าตัดมดลูกผ่านการส่องกล้อง มีความเจ็บปวดหลังผ่าตัดน้อยกว่า หายเร็วกว่า นอนพักฟื้นสั้นกว่า เสียเลือดน้อยกว่า ไข้และแผลติดเชื้อน้อยกว่า แต่ต้องใช้ระยะเวลาในการผ่าตัดนานกว่า และมีความเสี่ยงต่อการบาดเจ็บของทางเดินระบบปัสสาวะมากกว่า
- เมื่อเปรียบเทียบระหว่างการผ่าตัดมดลูกผ่านการส่องกล้อง กับการผ่าตัดทางช่องคลอด ว่าต้องใช้เวลาผ่าตัดนานกว่า ค่าใช้จ่ายสูงกว่า เสียเลือดมากกว่า และใช้ยาแก้ปวดในวันที่สองหลังการผ่าตัดมากกว่า
- การผ่าตัดทางช่องคลอดควรเป็นช่องทางที่ควรพิจารณาเป็นลำดับแรก สำหรับการตัดมดลูก แต่ถ้ามีข้อห้ามหรือข้อจำกัด ให้เลือกการผ่าตัดมดลูกผ่านการส่องกล้องเป็นทางเลือกลำดับถัดไป ก่อนพิจารณาทำการผ่าตัดทางหน้าท้อง อย่างไรก็ตามขึ้นอยู่กับการตัดสินใจของผู้ป่วย และความเชี่ยวชาญของแพทย์ร่วมด้วย
The eVALuate study: two parallel randomized trials
การศึกษานี้เป็นการเปรียบเทียบ 2 กลุ่ม ระหว่างการผ่าตัดมดลูกผ่านการส่องกล้อง เทียบกับการผ่าตัดทางหน้าท้อง และ ระหว่าง การผ่าตัดมดลูกผ่านการส่องกล้อง เทียบกับการผ่าตัดทางช่องคลอด โดยผู้ป่วยที่ผ่าตัดเนื่องจากโรคะมะเร็ง ภาวะกระบังลมหย่อนตั้งแต่ ระดับ2 ขึ้นไป หรือขนาดมดลูกใหญ่กว่า 12 สัปดาห์ จะถูกแยกออกจากการศึกษา(29)
จากการศึกษานี้ได้ข้อสรุปว่า ในผู้ป่วยที่ได้รับการผ่าตัดมดลูกผ่านการส่องกล้องนั้น มีอาการเจ็บหลังผ่าตัดน้อยกว่า หายเร็วกว่า นอนโรงพยาบาลสั้นกว่า คุณภาพชีวิตในระยะสั้นดีกว่า การผ่าตัดทางหน้าท้อง แต่ก็ต้องแลกกับการผ่าตัดที่นานกว่า และอาจเกิดภาวะแทรกซ้อนได้มากกว่า ในส่วนของการเปรียบเทียบระหว่างการผ่าตัดมดลูกผ่านการส่องกล้อง เทียบกับการผ่าตัดทางช่องคลอด มีภาวะแทรกซ้อนไม่แตกต่างกัน ยกเว้นระยะเวลาในการผ่าตัดทางช่องคลอดที่สั้นกว่า แต่ด้วยจำนวนผู้ป่วยไม่มากพอ ควรต้องมีการศึกษาเพิ่มเติม
กล่าวโดยสรุป การผ่าตัดมดลูกผ่านการส่องกล้อง ไม่คุ้มค่าเท่ากับการผ่าตัดทางช่องคลอด และมีผลความคุ้มค่าใกล้เคียงกันเมื่อเทียบกับการผ่าตัดทางหน้าท้อง เมื่อเทียบระหว่างค่าใช้จ่ายกับผลที่ได้รับ(30)
[A comparative analysis of hysterectomies]
เป็นการศึกษาแบบ retrospective review เปรียบเทียบผู้ป่วยทั้งหมด 602 ราย ที่ได้รับการผ่าตัดมดลูกวิธีต่างๆไป ระหว่างปี 2004-2005 เป็นการผ่าตัดมดลูกผ่านการส่องกล้อง 51 ราย(8.5%) เทียบกับการผ่าตัดทางช่องคลอด 203 ราย (33.7%) และเทียบกับการผ่าตัดทางหน้าท้อง 348 ราย (57.8%) พบว่า ภาวะแทรกซ้อนจากการผ่าตัดทางหน้าท้องมากที่สุด ทั้งการเสียเลือด ระยะการนอนโรงพยาบาล โดยภาวะแทรกซ้อนใกล้เคียงกันระหว่างการผ่าตัดทางช่องคลอด และผ่านกล้อง (31)
คำแนะนำและแนวทางการปฎิบัติ (recommendations and guidelines)
จะเห็นว่า แนวทางในการเลือกช่องทางในการทำผ่าตัดเพื่อตัดมดลูก ยังมีความหลากหลาย ดังที่กล่าวมาข้างต้น จากการศึกษาในประเทศไทย ณ โรงพยาบาลศิริราช ได้วิเคราะห์ข้อมูลเกี่ยวกับ ช่องทางในการตัดมดลูก ระหว่างปี 2001-2006 (34) สรุปว่าถึงแม้ว่าจะเป็นที่ทราบกันว่า น่าจะเป็นทางเลือกแรกในการผ่าตัด แต่จำนวนผู้ป่วย ที่ได้รับการผ่าตัดมดลูกทางช่องคลอด ก็ยังนับเป็นส่วนน้อย คือคิดเป็น ประมาณ 7.5% โดยมีการผ่าตัดทางหน้าท้องลดลง การผ่าตัดผ่านการส่องกล้องมากขึ้นจาก 4% เป็น 8.7% แต่การผ่าตัดทางหน้าท้องก็ยังคงเป็นสัดส่วนที่มากที่สุดเช่นเดิม
จากการศึกษาจะเห็นว่า การให้ข้อมูล คำแนะนำถึงแนวทางการปฎิบัติ ในการพิจารณาช่องทางการผ่าตัดมดลูกในปัจจุบัน ยังคงต้องดำเนินการต่อไป โดยคำแนะนำและแนวทางการปฎิบัติ มีดังนี้
1. จากคำแนะนำของ ACOG (American College of Obstetricians and Gynecologists) (4)
ถ้าเป็นไปได้ ให้เลือกการผ่าตัดทางช่องคลอดก่อนเสมอ ในการผ่าตัดมดลูกที่ไม่ใช่ภาวะมะเร็ง เนื่องจากมีข้อมูลสนับสนุนชัดเจนถึงข้อดี และภาวะแทรกซ้อนที่ต่ำกว่า ส่วนการผ่าตัดมดลูกผ่านการส่องกล้องเป็นทางเลือก ที่แนะนำก่อนการผ่าตัดทางหน้าท้อง ในกรณีถ้าการผ่าตัดทางช่องคลอดไม่สามารถทำได้
2. Determining the route and method of hysterectomy(7)
เมื่อต้องเลือกช่องทางการผ่าตัดมดลูก ในผู้ป่วยที่ไม่ได้เป็นมะเร็ง ให้ทำการประเมินลักษณะทางคลินิกต่างๆตามลำดับ ดังนี้
- มดลูกสามารถผ่าตัดออกทางช่องคลอดหรือไม่
- พยาธิสภาพ ของโรคจำกัดอยู่แต่ในมดลูกหรือไม่
- จำเป็นต้องใช้กล้องช่วย ในการผ่าตัดมดลูกทางช่องคลอดหรือไม่
โดยให้พิจารณาตามลำดับตามตารางนี้
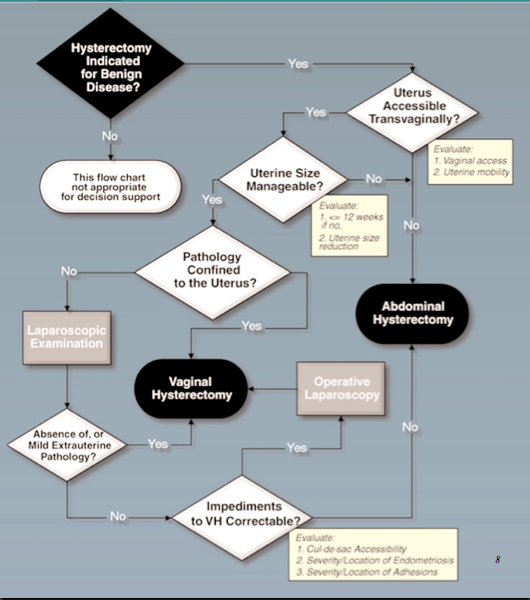
ข้อควรระวังในการเลือกช่องทางการผ่าตัดทางช่องคลอด คือ
- มดลูกไม่สามารถถูกดึงลง หรือมีภาวะมดลูกติด
- ช่องคลอดแคบกว่า 2 นิ้วมือ โดยเฉพาะ บริเวณด้านบนของช่องคลอด
3. จากคำแนะนำของ UpToDate (35)
- แนะนำการผ่าตัดมดลูกทางช่องคลอดเป็นอันดับแรก เมื่อเทียบกับวิธีอื่น – Grade 1B
- แนะนำการผ่าตัดมดลูกผ่านการส่องกล้องทั้งหมด (total laparoscopic hysterectomy) หรือ การผ่าตัดมดลูกทางช่องคลอดโดยใช้กล้องช่วย (laparoscopic assisted vaginal hysterectomy) ในรายที่การผ่าตัดมดลูกทางช่องคลอดไม่สามารถทำได้ หรือมีความ จำเป็นต้องทำการประเมินพยาธิสภาพในอุ้งเชิงกรานเพิ่มเติม – Grade 2B
Reference
- สันธา ศรีสุภาพ กลุ่มงานสูติ นรีเวชศาสตร์ โรงพยาบาลราชวิถี กรมการแพทย์ กระทรวงสาธารณสุข “การตัดมดลูกและรังไข่ในสตรีไทย พ.ศ. 2548-2553”
- (Lethaby A, Ivanova V, Johnson NP,Cochrane .Total versus subtotal hysterectomy for benign gynaecological conditions. Database Syst Rev. 2006;
- Jonsdottir GM, Jorgensen S,Cohen SL, Wright KN, Shah NT, Chavan N, Einarsson JI,Increasing minimally invasive hysterectomy: effect on cost and complications. Obstet Gynecol. 2011;117(5):1142.
- ACOG Committee Opinion No. 444. American College of Obstetricians and Gynecologists. Choosing the route of hysterectomy for benign diseaseObstet Gynecol 2009; 114:1156.
- TE Nieboer, N Johnson,A Lethaby ,Surgical approach to hysterectomy for benign gynaecological disease. Cochrane Database Syst Rev. 2009 Jul 8; (3):CD003677.
- Kovac SR,Hysterectomy outcomes in patients with similar indications. Obstet Gynecol. 2000;95(6 Pt 1):787.
- (Kovac SR. Guidelines to determine the route of hysterectomy. Obstet Gynecol. 1995;85(1):18.
- Sizzi O, Paparella P, Bonito C, Paparella R, Rossetti A,Laparoscopic assistance after vaginal hysterectomy and unsuccessful access to the ovaries or failed uterine mobilization: changing trends. JSLS. 2004;8(4):339.
- Kovac SR,Hysterectomy outcomes in patients with similar indications. Obstet Gynecol. 2000;95(6 Pt 1):787.
- Doucette RC, Sharp HT, Alder Am J, Challenging generally accepted contraindications to vaginal hysterectomy. Obstet Gynecol. 2001;184(7):1386.
- Varma R, Tahseen S, Lokugamage AU, Kunde D,Vaginal route as the norm when planning hysterectomy for benign conditions: change in practice.Obstet Gynecol. 2001;97(4):613.
- Sheth SS, Malpani AN, Vaginal hysterectomy following previous cesarean section. Int J Gynaecol Obstet. 1995;50(2):165.
- Unger JB, Meeks GR,Vaginal hysterectomy in women with history of previous cesarean delivery. Am J Obstet Gynecol. 1998;179(6 Pt 1):1473.
- Sheth SS, Malpani AN, Vaginal hysterectomy following previous cesarean section. Int J Gynaecol Obstet. 1995;50(2):165.
- Agostini A, Bretelle F, Cravello L, Maisonneuve AS, Roger V, Blanc B,Vaginal hysterectomy in nulliparous women without prolapse: a prospective comparative study. BJOG. 2003;110(5):515.
- Ballard LA, Walters MD,Transvaginal mobilization and removal of ovaries and fallopian tubes after vaginal hysterectomy. Obstet Gynecol. 1996;87(1):35.
- Sheth SS,The place of oophorectomy at vaginal hysterectomy. Br J Obstet Gynaecol. 1991;98(7):662.
- Hefni MA, Davies AE,Vaginal endoscopic oophorectomy with vaginal hysterectomy: a simple minimal access surgery technique. Br J Obstet Gynaecol. 1997;104(5):621.
- Kovac SR, Cruikshank SH,Guidelines to determine the route of oophorectomy with hysterectomy. Am J Obstet Gynecol. 1996;175(6):1483.
- Agostini A, Vejux N, Bretelle F, Collette E, De Lapparent T, Cravello L, Blanc B,Value of laparoscopic assistance for vaginal hysterectomy with prophylactic bilateral oophorectomy. Am J Obstet Gynecol. 2006;194(2):351.
- Isik-Akbay EF, Harmanli OH, Panganamamula UR, Akbay M, Gaughan J, Chatwani AJ,Hysterectomy in obese women: a comparison of abdominal and vaginal routes. Obstet Gynecol. 2004;104(4):710.
- Rafii A, Samain E, Levardon M, Darai E, Deval B,Vaginal hysterectomy for benign disorders in obese women: a prospective study. BJOG. 2005;112(2):223.
- Rasmussen KL, Neumann G, Ljungström B, Hansen V, Lauszus FF,The influence of body mass index on the prevalence of complications after vaginal and abdominal hysterectomy. Acta Obstet Gynecol Scand. 2004;83(1):85.
- Kovac SR,Transvaginal hysterectomy: rationale and surgical approach. Obstet Gynecol. 2004;103(6):1321.
- Kovac SR,Decision-directed hysterectomy: a possible approach to improve medical and economic outcomes. Int J Gynaecol Obstet. 2000;71(2):159.
- SR Kovac, S Barhan, M Lister, L Tucker, Guidelines for the selection of the route of hysterectomy: Application in a resident clinic population,Am J Obstet Gynecol, 2002
- Nezhat C, Nezhat F, Admon D, Nezhat AA,Proposed classification of hysterectomies involving laparoscopy. J Am Assoc Gynecol Laparosc. 1995;2(4):427.
- Candiani M, Izzo S, Bulfoni A, Riparini J, Ronzoni S, Marconi A, Laparoscopic vs vaginal hysterectomy for benign pathology. Am J Obstet Gynecol. 2009 Apr;200(4):368.e1-7. Epub 2009 Jan 10.
- Garry R, Fountain J, Mason S, Hawe J, Napp V, Abbott J, Clayton R, Phillips G, Whittaker M, Lilford R, Bridgman S, Brown J,The eVALuate study: two parallel randomised trials, one comparing laparoscopic with abdominal hysterectomy, the other comparing laparoscopic with vaginal hysterectomy. BMJ. 2004;328(7432):129
- Cost effectiveness analysis of laparoscopic hysterectomy compared with standard hysterectomy: results from a randomised trial.Sculpher M, Manca A, Abbott J, Fountain J, Mason S, Garry R,BMJ. 2004;328(7432):134.
- Aniuliene R, Varzgaliene L, Varzgalis M.A comparative analysis of hysterectomies,. Medicina (Kaunas). 2007;43(2):118-24.
- Sarlos D, Kots LA. Robotic versus laparoscopic hysterectomy: a review of recent comparative studies. Curr Opin Obstet Gynecol. 2011 Aug;23(4):283-8.
- Uccella S, Ghezzi F, Mariani A, et al. Vaginal cuff closure after minimally invasive hysterectomy: our experience and systematic review of the literature. Am J Obstet Gynecol 2011; 205:119.e1.
- Chen YJ, Wang PH, Ocampo EJ, et al. Single-port compared with conventional laparoscopic-assisted vaginal hysterectomy: a randomized controlled trial. Obstet Gynecol 2011; 117:906.
- Chalermchockcharoenkit, P.Tanmahasamut, The Trend Shift in Hysterectomy Technique in Siriraj Hospital. A. Siriraj Med J 2007; 59: 325-327
- Tommaso F, Howard TS, Sandy JF, Overview of hysterectomy,UpToDate, Jun 2012, Topic 3272 Version 18.0