งานสัมมนาภาควิชา 2555
งานสัมมนาประจำปี 2555 ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ วันที่ 18 สิงหาคม 2555 ณ เชียงใหม่ไนท์ซาฟารี จ. เชียงใหม่
งานสัมมนาประจำปี 2555 ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ วันที่ 18 สิงหาคม 2555 ณ เชียงใหม่ไนท์ซาฟารี จ. เชียงใหม่
 MFM มช (สนับสนุนโดยสกว.). จัด workshop เชิงลึก เรื่อง Fetal echocardiography III วันที่ 1-2 ตุลาคม 2555 เน้นประชากรเป้าหมาย คือ พี่ ๆ น้อง ๆ MFM ทั้งหลาย ครั้งนี้เน้นเทคนิค tips & tricks ในการตรวจหัวใจทารกในครรภ์ และการตรวจหัวใจพิการโดย disorder-based approach สามารถดาว์โหลด brochure และหลักฐานการร่วมประชุมโดยไม่ถือเป็นวันลา ได้ที่นี่
MFM มช (สนับสนุนโดยสกว.). จัด workshop เชิงลึก เรื่อง Fetal echocardiography III วันที่ 1-2 ตุลาคม 2555 เน้นประชากรเป้าหมาย คือ พี่ ๆ น้อง ๆ MFM ทั้งหลาย ครั้งนี้เน้นเทคนิค tips & tricks ในการตรวจหัวใจทารกในครรภ์ และการตรวจหัวใจพิการโดย disorder-based approach สามารถดาว์โหลด brochure และหลักฐานการร่วมประชุมโดยไม่ถือเป็นวันลา ได้ที่นี่
 เรียนเชิญ อาจารย์,แพทย์ และเจ้าหน้าที่ สาย ข,ค ทุกท่าน
เรียนเชิญ อาจารย์,แพทย์ และเจ้าหน้าที่ สาย ข,ค ทุกท่าน
ร่วมงานแสดงมุฑิตาจิตเกษียณอายุราชการ..
รศ.พญ.พรรณี ศิริวรรธนาภา
คุณรัตติยา รัตนเดชากร
วันพุธที่ 19 กันยายน 2555
ณ ห้องประชุมชั้น 3 อาคารราชนครินทร์
เวลา 12.00 – 14.30 น.
สมาคมโรคมะเร็งแห่งประเทศสหรัฐอเมริกา (American cancer society) ได้สนับสนุนให้แพทย์อภิปรายเกี่ยวกับหัวข้อการมีบุตรในผู้ป่วยมะเร็งที่อยู่ในวัยเจริญพันธุ์ เพื่อนำไปใช้ประโยชน์ในผู้ป่วยโรคมะเร็งที่ยังมีความต้องการมีบุตร (1) ซึ่งเป็นเหตุผลหนึ่งที่มีอิทธิพลต่อทางด้านจิตใจและสังคมอย่างมีนัยสำคัญ ผู้ป่วยส่วนมากมีประสบการณ์ความรู้สึกหดหู่ ความเศร้าโศกเสียใจ ความเครียดและความรู้สึกทางเพศที่ลดลง (2, 3)
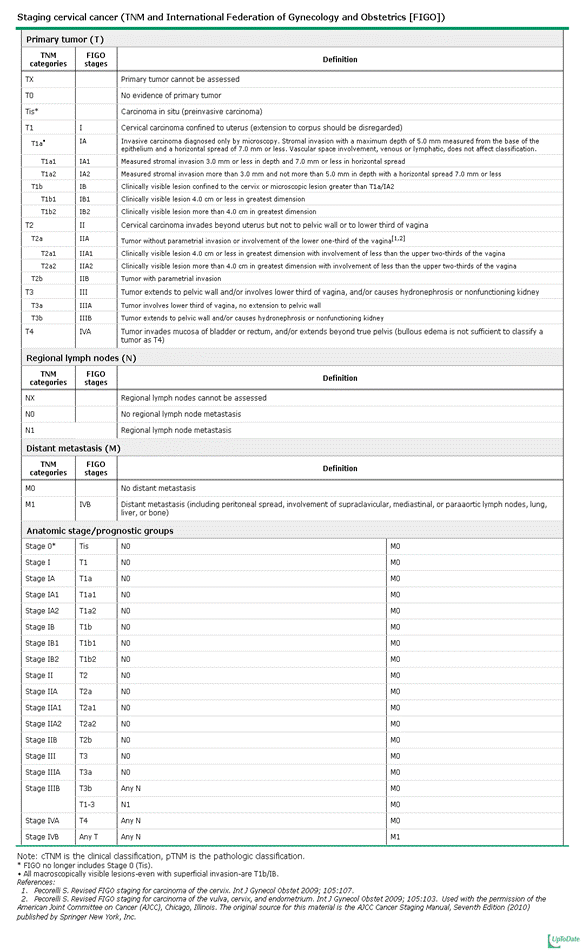
มีความน่าเป็นห่วงเกี่ยวกับการอนุรักษ์ภาวะการดำรงพันธุ์ในผู้ป่วยทางมะเร็งนรีเวช พบว่าร้อยละ 42 ของผู้ป่วยที่เป็นมะเร็งปากมดลูก ได้รับการวินิจฉัยเมื่ออายุน้อยกว่า 45 ปี (4) โดยผู้ป่วยกลุ่มนี้ได้รับการผ่าตัดเพื่อรักษาการดำรงพันธุ์ไว้ ได้แก่การผ่าตัด Radical trachelectomy, เมื่อได้รับการวินิจฉัยโรคระยะต้น (ตารางที่ 1) พบว่ามีโอกาสรอดชีวิตมากกว่าร้อยละ 90 (4) การศึกษานี้เป็นการศึกษาแบบสังเกตติดตาม (Observational study) ถูกตีพิมพ์ครั้งแรกเมื่อ 10 ปีที่ผ่านมา และพบว่ามีผลลัพธ์ที่ดีทั้งด้านมะเร็งและทางสูติศาสตร์
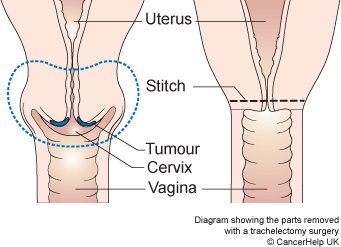
การตัดปากมดลูก(Conization) ในผู้ป่วยมะเร็งปากมดลูกระยะที่ IA1 (ตารางที่ 1) โดยจะทำเมื่อยังไม่มีการแพร่กระจายไปยังหลอดน้ำเหลือง (LVSI) ผู้ป่วยกลุ่มนี้จะได้รับการคัดเลือกให้ทำการรักษาโดยการตัดปากมดลูกเพียงอย่างเดียว (Cold knife conization) (5) จากข้อมูลการศึกษาของสถาบันมะเร็งแห่งชาติ จำนวน 1409 ราย ที่อายุน้อยกว่า 40 ปี ที่ได้รับการวินิจฉัยว่าเป็นมะเร็งปากมดลูกระยะที่ IA1 พบว่าไม่มีความแตกต่างกันในเรื่องของการมีชีวิตอยู่ในช่วง 5 ปี (5 yrs survival) ของผู้ป่วยที่ได้รับการตัดปากมดลูก เทียบกับการผ่าตัดมดลูก (Hysterectomy) คิดเป็นร้อยละ 98 และร้อยละ 99 ตามลำดับ (6)
การตัดปากมดลูกและช่องคลอด (Vaginal radical trachelectomy) หรือ VRT ถูกพัฒนาขึ้นโดย Professor Danlel Dargent จาก Lyon ประเทศฝรั่งเศสตั้งแต่ปี ค.ศ. 1980s (7)
การคัดเลือกผู้ป่วย – เกณฑ์การคัดเลือกผู้ป่วยที่จะเข้ารับการผ่าตัด VRT ยังคงมีความสำคัญและถูกใช้มาตั้งแต่ครั้งแรกเมื่อปี ค.ศ.1998 และไม่ถูกเปลี่ยนแปลงจนถึงปัจจุบัน (8)
การใช้เกณฑ์การคัดเลือกใน 1 กลุ่ม เฉลี่ยมีผู้ป่วยร้อยละ 40 ที่ผ่านการคัดเลือกเข้ารับการผ่าตัด VRT(9) อย่างไรก็ตาม เฉลี่ยร้อยละ 10-12 ของผู้ป่วย พบว่ามีการแผ่ขยายของรอยโรคเข้าไปในปากมดลูกเมื่อถึงเวลาผ่าตัดจริง หรือพบว่ามีการแพร่กระจายไปที่ต่อมน้ำเหลืองจากการตัดชิ้นเนื้อแช่แข็ง (Frozen) ซึ่งต้องทำการรักษาในขั้นตอนต่อไปเช่น การฉายแสง หรือการผ่าตัดโดยสมบูรณ์ (Radical hysterectomy) (10-13)
ก่อนเริ่มทำการผ่าตัด เป็นข้อตกลงกันให้ใช้การตรวจทางคลื่นแม่เหล็กไฟฟ้า(MRI) ดูภายในอุ้งเชิงกรานของผู้ป่วยทุกราย ที่มีก้อนเนื้องอกที่สามารถมองเห็นได้ด้วยตาเปล่า (14) จากภาพตัดขวางระดับ T2 จะเห็นภาพที่ชัดเจนทั้งด้านขนาดและตำแหน่งของก้อน ระดับความกว้างที่เข้าสู่ปากมดลูกด้านใน ความยาวของปากมดลูก และระยะห่างของขอบบนสุดของรอยโรคและ isthmus (15) ในระยะหลัง การวัดขนาดต้องพิถีพิถันเป็นพิเศษ เพราะว่าในรายที่ระยะห่างน้อยกว่า 1 เซนติเมตร มีสิทธิที่จะได้รับการให้ Neoadjuvant chemotherapy (NACT) ครั้งแรกและก่อนผ่าตัด VRT ต่อไป
วิธีการปฏิบัติ
การผ่าตัดส่องกล้องเพื่อเลาะต่อมน้ำเหลืองนั้นสามารถทำได้ตั้งแต่ครั้งแรก นอกจากรายที่มีการแพร่กระจายไปที่ต่อมน้ำเหลืองแล้ว ซึ่งเป็นข้อห้ามในการผ่าตัดแบบดำรงพันธุ์(16) แม้ว่าจะมีการทำแผนที่ sentinel node มาแทนวิธีนี้
ซึ่งน่าเชื่อถือกว่า ซึ่งสามารถใช้ได้ในการรักษามะเร็งปากมดลูกระยะเริ่มแรก แต่ก็ยังไม่มีการยืนยันแน่นอน
รายละเอียดประกอบคำบรรยายของการผ่าตัด VRT สามารถสรุปขั้นตอนได้ 6 ขั้นตอนดังนี้
วิธีที่ดีที่สุดของการทำ cerclage ยังเป็นที่ถกเถียงกัน เราใช้ permanent nonresorbale monofilament เบอร์ 0 (Polypropylene) เป็นวัสดุในการเย็บ(13) ซึ่งมีความเหนียวและแข็งแรง และสามารถลดความเสี่ยงต่อการติดเชื้อได้ด้วย สิ่งสำคัญคือ ต้องไม่เย็บลึกลงไปใน cervical stroma เพื่อหลีกเลี่ยงการเซาะเข้าไปในปากมดลูกด้านใน (endocervical canal)
ศัลยแพทย์บางท่านได้แนะนำการใช้ Mersilene tape(19) แต่ทางคณะผู้ประพันธ์เห็นว่าเป็นการเพิ่มความเสี่ยงต่อการเกิดการกัดเซาะ และเพิ่มความเสี่ยงต่อการติดเชื้อมากขึ้น และไม่มีความแข็งแรงพอ
Dargent ใช้วิธี Saling(20) เพราะว่าสามารถเย็บปิดปากมดลูกได้ทั้งหมด แต่ก็ไม่ได้ปรากฏว่าจะช่วยเพิ่มผลลัพท์ที่ดีมากกว่าการใช้ cerclage ทั่วไป และสัมพันธ์กับการเพิ่มภาวะแทรกซ้อนที่มากขึ้น (19,22,23) ซึ่งสรุปว่าควรใช้ในกรณีที่ผู้ป่วยไม่สามารถทำ cerclage แบบทั่วไปได้เท่านั้น (23)
ตรวจหารอยโรคที่สามารถมองเห็นได้ด้วยตาเปล่า เราจะทำการส่งตรวจชิ้นเนื้อแบบแช่แข็ง(25, 26) โดยนักพยาธิวิทยาจะเริ่มทำการตัดชิ้นเนื้อแช่แข็งในแนวยาว (จาก exocervix ไปยัง endocervix) จนถึงระดับของรอยโรค เพื่อที่จะกำหนดระยะห่างระหว่างขอบบนสุดของ endocervical tumor margin และขอบชิ้นเนื้อที่ตัดออกมา ซึ่งดีที่สุดควรมีชิ้นเนื้อปกติติดออกมาด้วย 8-10 มิลลิเมตร อีกกรณีนึงถ้าต้องตัดชิ้นเนื้อเพิ่มเติม ถ้าก้อนเนื้อนั้นแผ่ขยายมากกว่า และเข้ามาใน endocervical canal และยังมีขอบเขตบวก (positive margin) หรือชิดกับรอยโรคมากเกินไป (น้อยกว่า 5 มิลลิเมตร) ซึ่งจำเป็นต้องได้รับการผ่าตัดแบบ Radical hysterectomy ต่อไป
หากมองไม่เห็นรอยโรคจากการตรวจร่างกาย (เช่น หลังจากทำ diagnostic cone) เราแนะนำให้เก็บชิ้นส่วนจากการผ่าตัด trachelectomy เพื่อใช้ในการวิเคราะห์ผลพยาธิวิทยาขั้นตอนสุดท้ายต่อไป
อัตราการป่วยจากการทำผ่าตัด radical trachelectomy นั้นใกล้เคียงหรือน้อยกว่าการผ่าตัด Radical hysterectomy หนึ่งในการศึกษาในงานวิจัยที่ใหญ่ที่สุดของสถาบันแห่งหนึ่ง เปรียบเทียบ perioperative morbidity
จากการทำการผ่าตัด Laparoscopic assisted vaginal radical trachelectomy (LAVRT n=118) เทียบกับการผ่าตัดส่องกล้อง Laparoscopic assisted vaginal radical hysterectomy (LAVRH n=139) (10) พบว่าอัตราการเกิดภาวะแทรกซ้อนขณะทำการผ่าตัดและหลังทำการผ่าตัดของทั้งสองกลุ่มใกล้เคียงกัน (ภาวะแทรกซ้อนขณะผ่าตัด มีร้อยละ 2.5 และ 5.8 ตามลำดับ) และภาวะแทรกซ้อนหลังผ่าตัดเป็นร้อยละ 21.2 และร้อยละ 19.4 ตามลำดับ ซึ่งพบว่าผลการศึกษาใกล้เคียงกันกับการศึกษาอื่นๆ (11,12,27,28)
การศึกษาอื่นๆที่เปรียบเทียบการทำ VRT กับการทำผ่าตัด Radical hysterectomy ผ่านทางหน้าท้อง (ARH) (29), พบว่า VRT เป็นการผ่าตัดที่เล็กกว่าและใช้เวลาน้อยกว่าการทำ ARH แต่พบว่ามีการรายงานของ long term morbidity ในคนที่ทำ VRT ที่ยังเหลือมดลูกอยู่ และยังคงมี cerclage อยู่ก็ได้รับการรายงาน เช่น สารคัดหลั่งบริเวณช่องคลอด การมีเลือดออกผิดปกติ การปวดท้องประจำเดือนอย่างลึก และ cerclage erosion นอกจากนี้ผู้ป่วยที่ได้รับการทำ VRT ไปจะกลายเป็นผู้หญิงที่ไม่มีประจำเดือน
ร้อยละ 10-15 ของผู้ป่วย ที่มีปัญหาของการตีบแคบของปากมดลูก หลังจากการทำ VRT(29,30) โดยผู้ป่วยส่วนมากไม่มีอาการ แต่มักมีประสบการณ์ในเรื่องปวดท้องประจำเดือน มีเลือดคั่งในโพรงมดลูก(Hematometra), hematosalpinx, หรือเยื่อบุมดลูกเจริญผิดที่ (endometriosis) (31) และการที่มีการตีบแคบของปากมดลูก อาจเป็นปัญหาของผู้หญิงที่ต้องใช้เทคโนโลยีช่วยในการเจริญพันธุ์ ได้แก่ การใส่อุปกรณ์หรือการย้ายตัวอ่อนหลังจากการทำ in vitro fertilization (31-34)
การกลับเป็นซ้ำของโรค (Recurrence)- จากผู้ป่วยจำนวน 550 ราย ที่เป็นมะเร็งปากมดลูกที่ได้รับการผ่าตัดแบบ VRT ได้ถูกกล่าวถึงในงานวิจัย พบว่ามีอุบัติการณ์การกลับเป็นซ้ำน้อยกว่าร้อยละ 5 และมีอัตราการเจ็บป่วย (mortality) ร้อยละ 2-3 (10,12) เปรียบเทียบผลลัพธ์หลังการผ่าตัดแบบ Radical hysterectomy ในขนาดใกล้เคียงกัน (10) ซึ่งใกล้เคียงกันกับรายงานฉบับอื่นๆ (24,25)
ประมาณร้อยละ 40 ของผู้ป่วยที่กลับเป็นโรคซ้ำ ซึ่งพบว่าเกิดที่บริเวณ Parametrium หรือ pelvic side wall ซึ่งเป็นไปได้ว่าอาจจะสัมพันธ์กับการตัดเลาะ parametrium ออกไม่เพียงพอ หรือยังมีรอยโรคที่มองไม่เห็นด้วยตาเปล่าซ่อนอยู่ (LVSI) (36), ร้อยละ 25 ของผู้ป่วยที่เกิดโรคซ้ำ เกิดที่ต่อมน้ำเหลืองตำแหน่ง paraaortic และ supraclavicular (12) ในอนาคตการใช้แผนที่ต่อมน้ำเหลือง sentinel node อาจช่วยในการประเมินการแพร่กระจายของโรคมะเร็งที่มีขนาดเล็กมากๆได้ หรือถ้าตรวจพบต่อมน้ำเหลืองที่มีการระบายน้ำเหลืองผิดปกติไป อาจจะหมายถึงว่ามีการเกิดซ้ำของโรค (12,16) , มีการรายงานตรวจพบการเกิดโรคซ้ำที่ 5 ตำแหน่งศูนย์กลางในอุ้งเชิงกราน ซึ่ง 4 ตำแหน่งพบในผู้ป่วยที่เป็น Adenocarcinoma ซึ่งอาจจะสัมพันธ์กับ multifocal nature ของรอยโรคชนิดนั้น(37)
ยังไม่มีข้อมูลเชิงคุณภาพที่ดีพอในการเปรียบเทียบ VRT กับการผ่าตัด radical hysterectomy ในการรักษามะเร็งปากมดลูก, มีการศึกษา case control study 137 ราย ที่ได้รับการทำผ่าตัดแบบ VRT เปรียบเทียบกับกลุ่ม control ที่ได้รับการทำ radical hysterectomy(38) พบว่าไม่มีการกลับเป็นซ้ำของโรคภายใน 5 ปี โดยอัตราเท่าๆกับทั้งสองกลุ่ม คือ ร้อยละ 95 และ 100 ตามลำดับ
การรักษาแบบส่งเสริม เป็นการรักษาที่เหมาะสำหรับผู้ป่วยมะเร็งปากมดลูกที่มีความเสี่ยงสูงต่อการกลับเป็นซ้ำของโรค แต่อาจจะเพิ่มความเสี่ยงต่อการเกิดรังไข่หยุดทำงานก่อนวัย (Premature ovarian failure) และสูญเสียภาวะการดำรงพันธุ์อย่างถาวร
การรักษาแบบ adjuvant สามารถให้การรักษาได้อย่างปลอดภัยแต่ควรหลีกเลี่ยงในรายที่ยังไม่ได้กำหนดระยะของโรคชัดเจน, การรักษาแบบอนุรักษ์ด้วยการตรวจติดตามอย่างใกล้ชิด อาจเป็นการเพิ่มความเสี่ยง ต้องมีการชั่งน้ำหนักกันระหว่างความเสี่ยงสูงต่อการเกิดรอยโรคซ้ำหรือจะเสียภาวการณ์ดำรงพันธุ์ไปอย่างถาวรจากการได้รับ adjuvant ซึ่งข้อมูลการศึกษายังมีจำกัด:
ยังไม่มีแนวทางการตรวจติดตามผู้ป่วยหลังจากการผ่าตัด VRT ที่ชัดเจน โดยทั่วไปการตรวจด้วยการส่องกล้อง Colposcope ร่วมกับการตรวจทางเซลล์วิทยา (Cytology) โดยจะทำ endocervical curettage หรือไม่ก็ได้ นั้นแนะนำให้ทำทุก 3-4 เดือน ในช่วง 3 ปีแรกหลังทำการผ่าตัด และทุก 6 เดือนใน 2 ปีถัดไป และทุก 1 ปีหลังจากนั้น(44) ผู้เชี่ยวชาญบางท่านแนะนำให้ทำ pelvic MRI ในการตรวจติดตามที่ 6, 12 และ 24 เดือน(44) ซึ่งผลการอ่านควรเป็นจากผู้อ่านคนเดียวกันในผู้ป่วยแต่ละรายที่เคยได้รับการผ่าตัด VRT, ในผู้ป่วยบางรายที่มีการเปลี่ยนแปลงทางกายวิภาค เนื่องจากการผ่าตัด อาจมีการผิดพลาดในการแปลผลว่ามีการกลับเป็นซ้ำของโรค(45)
การตรวจติดตามทางเซลล์วิทยา หลังจากการทำ VRT เป็นประจำแสดงให้เห็นว่ามีความผิดปกติ และการตรวจด้วยการส่องกล้อง colposcope เหมาะสำหรับใช้ในผู้ป่วยที่สื่อสารได้ดีและเป็นการตรวจโดยผู้เชี่ยวชาญทางพยาธิ เพื่อหลีกเลี่ยงการประเมิน benign smear ที่ไม่จำเป็น(11)
การศึกษาย้อนหลังในผู้ป่วยจำนวน 197 ราย ที่ได้รับการตรวจ pap smear หลังทำ VRT รายงานพบ false positive ร้อยละ 2, ซึ่งบ่อยครั้งยังมี atypical endometrial cell อยู่, และมากกว่าร้อยละ 41 ของการตรวจ pap smear เป็น squamous cell(46), ซึ่งเห็นว่าควรมีการเสนอผลอ่านเป็น “Unsatisfactory” ใน 2 ปีแรก และ “Negative for intraepithelial neoplasia” หรือ cancer ในปีถัดมา(44), อย่างไรก็ตาม ในบางรายเกิดการกลับเป็นซ้ำก่อนที่จะมีอาการแสดง ดังนั้นต้องตรวจติดตามอย่างระมัดระวัง(46)
การตรวจติดตามผู้ป่วยที่มีความเสี่ยงสูงต่อการติดเชื้อ HPV อาจจะมีประโยชน์ต่อผู้ป่วยหลังผ่าตัด trachelectomy ซึ่งยังมีความเสี่ยงต่อการเกิด HPV positive ควรได้รับการตรวจติดตามอย่างระมัดระวัง และมีความเสี่ยงต่อการเกิดโรคซ้ำที่ตำแหน่งเดิมสูงมากขึ้น และผู้ป่วยกลุ่มนี้ควรได้รับการฉีดวัคซีน HPV ด้วย
การผ่าตัดมดลูกเมื่อเคยผ่านการคลอดบุตรมาแล้ว (Hysterectomy when childbearing is completed)
การอภิปรายกันถึงการผ่าตัดมดลูกหลังจากการคลอดบุตรแล้ว ยังคงเป็นที่ถกเถียงกันอยู่ ยังไม่มีข้อมูลที่เปรียบเทียบกันในระยะยาวเทียบระหว่างผู้ที่ตัดมดลูกและผู้ที่ไม่ได้ตัดมดลูก แต่ทางคณะผู้แต่งเห็นว่ายังไม่แนะนำให้ทำการตัดมดลูกในทุกราย แต่ควรได้ให้คำแนะนำหรือพูดคุยกับผู้ป่วยที่ต้องการตัดมดลูกเฉพาะบางราย และทางคณะผู้แต่งยังไม่แนะนำให้ทำการตัดมดลูกหลังการผ่าตัดคลอดบุตร นอกเสียจากว่ามีเหตุการณ์ฉุกเฉิน แต่แนะนำให้ทำในรายที่การตั้งนั้นจะเป็นการตั้งครรภ์บุตรคนสุดท้ายแล้ว(3)
Fertility – การให้คำปรึกษาและเซ็นสัญญาข้อตกลงยินยอมผ่าตัดรักษา ในผู้ป่วยที่คาดหวังว่าสามารถเก็บรักษาภาวะดำรงพันธุ์ไว้ได้หลังจากทำ VRT (47), ผู้หญิงที่อายุมากแล้วหรือทราบว่าตัวเองมีปัญหาในเรื่องการมีบุตรยาก ควรได้รับคำแนะนำก่อนการผ่าตัดจากผู้เชียวชาญทางด้านการมีบุตรยาก (Infertile) (27) อย่างไรก็ตาม ปัจจัยเสี่ยงทางด้านการมีบุตรยาก ก็ยังไม่ใช่ข้อห้ามในการผ่าตัดทำ VRT เนื่องจากผู้ป่วยเหล่านี้อาจสามารถช่วยใช้เทคโนโลยีด้านการเจริญพันธุ์ช่วยให้มีบุตรได้ (24,27,30,48)
มีการรายงานอุบัติการณ์ของการมีบุตรยากหลังจากการผ่าตัด VRT พบได้ตั้งแต่ ร้อยละ 14-41 (24,30) หนึ่งในการศึกษาแบบ prospective study พบว่าผู้ป่วย 12 รายจาก 15 ราย ทีมีปัญหาการมีบุตรยากตั้งแต่แรก และสามารถตั้งครรภ์ได้ในที่สุด(24) หลังจากผ่าตัด VRT, ปัจจัยเกี่ยวกับปากมดลูก เช่นการตีบแคบของปากมดลูก พบได้ประมาณร้อยละ 40-75 ที่ทำให้มีปัญหาทางด้านการมีบุตร และยังคิดว่าเป็นต้นเหตุให้มีบุตรยาก ซึ่งไม่สัมพันธ์กับการผ่าตัด VRT (19,24,32,40)
ทั้งนี้ผู้หญิงที่มีปัญหาด้านการมีบุตรยาก ควรได้รับการตรวจประเมินปากมดลูกและสาเหตุอื่นๆ รวมถึงปัจจัยจากฝ่ายชายตามความเหมาะสมและจัดการแก้ไขเมื่อมีการตีบแคบของปากมดลูกและรอยแผลบริเวณทางเข้าปากมดลูก (50)
จากการทบทวนวรรณกรรม จำนวนผู้ป่วยที่ตั้งครรภ์ทั้งสิ้น 200 ราย พบว่ามีร้อยละ 66 สามารถตั้งครรภ์ได้หลังผ่าตัด radical trachelectomy ในตอนสุดท้ายหลังคลอด(22) และร้อยละ 42 ของการตั้งครรภ์ทั้งหมด สามารถคลอดครบกำหนดได้ มีเพียงร้อยละ 25 ที่คลอดก่อนกำหนด (อายุครรภ์น้อยกว่า 37 สัปดาห์) แต่มีเพียงครึ่งหนึ่งของการคลอดทั้งหมดที่สัมพันธ์กับการคลอดก่อนอายุครรภ์ 32 สัปดาห์
การแท้งบุตรในช่วงไตรมาสที่สอง- พบว่าอัตราการแท้งบุตรสูงกว่าเมื่อเทียบกับประชากรทั่วไป (ร้อยละ 9.5 เทียบกับร้อยละ 4) (22,30) สมมติฐานว่าเกิดจากการติดเชื้อในน้ำคร่ำและการกระตุ้นโดย cytokine จะเป็นสาเหตุชักนำให้เกิดการแตกของถุงน้ำก่อนกำหนด (PPROM)
ผู้ป่วยส่วนใหญ่สามารถขับ conceptive product ออกมาได้โดยไม่จำเป็นต้องตัด cerclage หรือเพียงทำการขยายปากมดลูกและคีบออก (Dilatation& Evacuation) โดยทำการขยายเพียงพอที่จะใส่หัวขูดเข้าไปได้เท่านั้น และมีบางรายเสนอให้เอา cerclage ออก หลังจากที่กระตุ้นคลอดด้วย Misoprostol, ส่วนการทำ Hysterotomy นั้นพบน้อยมาก (30)
การคลอดก่อนกำหนด- เป็นสิ่งที่กังวลมากหลังจากการผ่าตัดทำ VRT พบว่ามีอัตราส่วนที่สูงขึ้น โดยสมมติฐานเกี่ยวข้องกับที่ 1 และ 2 ปัจจัย ได้แก่ ปัจจัยด้านกลไก (Mechanical factor) มดลูกบีบตัวแรงมาก ในขณะที่ปากมดลูกสั้น ทำให้เกิดการคลอดก่อนกำหนด หรือปัจจัยด้านการติดเชื้อ (การสร้างมูกเพื่อปิดกั้นบริเวณปากมดลูกไม่ดีพอ) ทำให้เกิดการติดเชื้อง่ายขึ้น (49)
อัตราการคลอดก่อนกำหนด แตกต่างกันมากระหว่างกลุ่มที่เคยทำผ่าตัด VRT(22) เราเชื่อว่ามีอัตราส่วนที่ต่ำมากหากความยาวของ endocervix ยังอยู่อย่างน้อย 1 เซนติเมตร หลังจากผ่าตัด trachelectomy; เพื่อช่วยผยุงบริเวณส่วนล่างของมดลูก เปรียบเทียบกับกลุ่มที่ตัดชิ้นส่วนตรงไปที่ isthmus โดยไม่เหลือชิ้นส่วนของปากมดลูกไว้เลย (23,49) ข้อมูลทางมะเร็งวิทยา ยังไม่สนับสนุนสมมติฐานว่าการเหลือชิ้นเนื้อบริเวณปากมดลูกไว้มากขึ้น จะเพิ่มโอกาสต่อการเกิดมะเร็งซ้ำบริเวณนั้น (52)
การศึกษาแบบ prospective ในผู้ป่วย 106 รายที่ตั้งครรภ์ หลังจากทำ Vaginal trachelectomy พบว่า ร้อยละ 20 และร้อยละ 3 มีอัตราการแท้งบุตรในช่วงไตรมาสแรกและไตรมาสที่สอง และร้อยละ 75 ของผู้ป่วยสามารถตั้งครรภ์ต่อจนถึงไตรมาสที่สามและคลอดครบกำหนดด้วย (24)
ยังไม่ชัดเจนว่าการทำ cerclage จะเป็นการเพิ่มความเสี่ยงต่อการเกิดการติดเชื้อในโพรงมดลูกและเพิ่มความเสี่ยงต่อการแตกของถุงน้ำก่อนกำหนด (PPROM) (22) เป็นไปได้ว่าผลข้างเคียงจากการทำ cerclage อาจหมายรวมถึงการมีสารคัดหลั่งเรื้อรังและอาจตรวจพบเชื้อ Actinomyces จากผลเซลล์วิทยาได้ (54,55)
หากมีการนำ cerclage ออก ต้องมีการใส่อันใหม่มาแทนขณะตั้งครรภ์ในช่วงอายุครรภ์ 12-14 สัปดาห์, การทำ cerclage ทางช่องท้องอาจจะจำเป็นหากปากมดลูกสั้นมาก หรือมีแผลเป็นหลังจากทำการผ่าตัด trachelectomy(56)
แนะนำให้ผู้ป่วยรออย่างน้อย 6 เดือนหรือถ้าเป็นไปได้ 12 เดือน หลังจากทำ VRT ก่อนที่จะพยายามตั้งครรภ์ใหม่(23) มีการศึกษาเกี่ยวกับการคลอดก่อนกำหนดและถุงน้ำคร่ำแตกก่อนกำหนดในผู้หญิงที่ได้รับการวินิจฉัยว่าเป็นมะเร็งปากมดลูก แต่ข้อมูลยังไม่เพียงพอ(52) และยังไม่มีข้อมูลจากการทดลอง Randomize control trail หลังจากการทำ VRT ศึกษาในเรื่องความหลากหลายในการทำ Intervention, การใช้ยาปฏิชีวนะป้องกันตั้งแต่แรก, การนอนพัก และ/หรือลดกิจกรรม และการใช้ยาสเตียรอยด์เพื่อกระตุ้นการเจริญของปอดเด็กก่อนที่จะคลอดก่อนกำหนด(49) ด้วยเหตุนี้แพทย์แผนกดูแลทารกปริกำเนิดจึงควรมีบทบาทในการดูแลและให้คำแนะนำร่วมด้วย(57)
ทางคณะผู้ประพันธ์ยังไม่แนะนำให้ผู้ป่วยลดกิจกรรมระหว่างตั้งครรภ์ จนกว่าจะตรวจพบว่ามี Cervical shortening และถ้ามีความเสี่ยงต่อการคลอดก่อนกำหนด หรือมีโอกาสแท้งบุตรในช่วงไตรมาสที่สอง ควรจะได้รับการตรวจติดตามอย่างใกล้ชิด ด้วยการอัลตราซาวล์วัดความยาวของปากมดลูก (Cervical length) และส่งเสริมการให้ยา Glucocorticoid ก่อนคลอดตามข้อบ่งชี้ และไม่แนะนำให้ให้ยาปฏิชีวนะไปก่อนในผู้ป่วยที่ถุงน้ำคร่ำยังไม่แตก จากการศึกษาพบว่าไม่มีส่วนช่วยป้องกันการคลอดก่อนกำหนดได้
หากมีการแตกของถุงน้ำคร่ำก่อนกำหนด จะแนะนำให้คลอดเมื่อตรวจพบหลักฐานของการเกิดการติดเชื้อในน้ำคร่ำ (Chorioamnionitis) หรือเมื่ออายุครรภ์ 32-34 สัปดาห์, การทำ cerclage จะถูกละทิ้งไว้ที่เดิม และให้ยาปฏิชีวนะและ expectant management.
ควรหลีกเลี่ยงการคลอดทางช่องคลอดเนื่องจากมีโอกาสที่จะเกิดการฉีกขาดบริเวณด้านข้างของปากมดลูกได้ และอาจเกิดกายฉีกขาดที่ขยายเข้าบริเวณหลอดเลือดใกล้เคียงเกิดการสูญเสียเลือดที่รุนแรงตามมาได้ ด้วยเหตุนี้จึงแนะนำให้คลอดบุตรโดยการผ่าตัดคลอด อายุครรภ์ที่เหมาะสมคือ 37-38 สัปดาห์ โดยแนะนำให้ลงแผลผ่าตัดแบบ low transverse incision แต่บางท่านอาจลงแผลแบบ low vertical incision กรณีที่มีความเสี่ยงต่อการบาดเจ็บของเส้นเลือด ด้านข้างปากมดลูก แต่ก็ยังพบว่าความเสี่ยงต่ำมาก(11,44)
การผ่าตัด ART พบมีมีความคล้ายคลึงกับการผ่าตัดทางหน้าท้องแบบ Radical hysterectomy ซึ่งถูกพัฒนาขึ้นโดยคุณ Smith และคณะ เมื่อปี ค.ศ. 1997 (59) โดยมีการดัดแปลงเทคนิคเล็กน้อยจากต้นแบบ (60) เบื้องต้นได้มีการรายงานเกี่ยวกับการใช้หุ่นยนต์ช่วยผ่าตัดส่องกล้องในการทำ Radical hysterectomy แล้ว (61)
โดยสรุปขั้นตอนการผ่าตัด ลงแผลกึ่งกลาง หลังจากเลาะต่อมน้ำเหลืองในอุ้งเชิงกรานทั้งสองข้าง เปิด paravesicle และ pararectal space แยก round ligament ออกจากกัน, แยก uterine vessel ออกจากต้นกำเนิดของ hypogastric vessel อย่างระมัดระวัง และพยายามเก็บ infundibulopelvic และ tuboovarian ligament ไว้ เนื่องจากเป็นเส้นเลือดที่จะไปเลี้ยงมดลูก, parametrium และ paracolpos ตลอดแนวหลอดเลือด uterine vessel, ถูกเคลื่อนย้ายโดยการทำ trachelectomy specimen ตัด ureteral dissection ผ่านทาง parametrium tunnel ซึ่งจำเป็นในการผ่าตัด Radical hysterectomy type III, ด้านหลังของ Cul-de-sac ถูกตัดและต้องตัด Uterosacral ligament ออก
การกำหนดความยาวในการตัดปากช่องคลอด ตัดออกเป็นวงกลมผ่านทาง anterior colpotomy และชิ้นส่วนนั้นก็จะแยกออกโดยสมบูรณ์จากส่วนปลายของช่องคลอด อาจใช้ vaginal cylinder(กระบอกกลม) เพื่อเป็นโครงสร้างให้กับช่องคลอดก่อน แล้วตัดด้านชิดกับตัวก้อนซึ่งควรตัดต่ำกว่าตำแหน่งนั้น 5 มิลลิเมตร และต่ำกว่าปากมดลูกด้านใน และส่งชิ้นเนื้อแช่แข็งเพื่อวิเคราะห์ผล หากมั่นใจว่าขอบที่ตัดนั้นครอบคลุมดีแล้ว ก็พิจารณาทำ cerclage ได้ทันทีที่ตำแหน่ง isthmus แม้ขณะนี้ทางผู้ประพันธ์จะยังไม่ได้กำหนดตำแหน่งที่ทำ cerclage ไว้ทั้งหมดอย่างชัดเจน สุดท้ายทำการเย็บมดลูกส่วนล่างเชื่อมเข้ากับยอดของปากช่องคลอดแบบ interrupted ด้วยไหมละลายอีก 6-8 ครั้ง
ข้อได้เปรียบของการผ่าตัดทางหน้าท้องคือ ใช้เวลาในการเรียนรู้น้อยและไม่ต้องใช้ทักษะในด้านการส่องกล้อง หรือการผ่าตัดทางช่องคลอด, ข้อเสียคือ ต้องลงแผลในแนวกลางหน้าท้อง เสียเลือดมากกว่า ใช้เวลาในการนอนโรงพยาบาลนานกว่า และต้องเสียเส้นเลือด uterine artery ไปทั้งสองข้าง ซึ่งอาจเป็นสาเหตุให้เกิดการฝ่อไปของกล้ามเนื้อมดลูก และเกิดการตีบแคบของปากมดลูกได้ เกิดเป็นแผลเป็นได้
โอกาสการเกิดโรคซ้ำน้อยมาก มีการรายงานไว้หลังจากทำ ART อย่างน้อย 2 ราย จากจำนวนผู้ป่วย 91 ราย ที่มีรอยโรคขนาดใหญ่ (3.8 และ 5 เซนติเมตร) (63-66)
ข้อคิดเห็นกับการผ่าตัดแบบรักษาการดำรงพันธุ์ มีความก้าวหน้าและกว้างขว้างในแวดวงแพทย์ทางมะเร็งวิทยา และเป็นทางเลือกที่ของผู้ป่วยหญิงที่อายุน้อย แต่ก็ยังมีบางส่วนที่ปฏิเสธการผ่าตัดเนื่องจากขนาดของรอยโรค ซึ่งการใช้ Neoadjuvant chemo therapy (NACT) เป็นทางเลือกฉุกเฉินในผู้ป่วยเท่านั้น ในทางตรงข้ามถ้ามีรอยโรคขนาดเล็ก การผ่าตัดแบบครอบคลุม(extensive nature) ของการทำ radical trachelectomy อาจจะมากเกินไป ซึ่งอาจจะทำแค่การผ่าตัดเฉพาะที่ก็คงเพียงพอแล้ว
ขนาดรอยโรคที่ใหญ่กว่า 2 เซนติเมตร พบว่ามีความสัมพันธ์กับการกลับเป็นซ้ำของโรคหลังจากผ่าตัด VRT (72,73) , NACT ใช้เพื่อลดขนาดของก้อน และเชื่อว่าจะทำให้ตอบสนองดีต่อการผ่าตัดแบบดำรงพันธุ์หลังจากได้ยาเคมีบำบัด(72,74,75) โดยสูตรยาที่ใช้ได้แก่ Toxol, ifosfamide, cisplatin (TIP)
แนวคิดการให้ NACT เป็นที่ดึงดูดความสนใจและควรที่จะได้รับการศึกษาต่อไปในอนาคต และมีการกล่าวถึง non-gonadotoxic ว่าอาจจะรุนแรงน้อยกว่าการให้ยาเคมีบำบัด ก็ควรได้รับไว้พิจารณาเพื่อลดความกระทบกระเทือนที่อาจมีต่อรังไข่ (76)
มีการศึกษาในผู้ป่วย 7 รายที่ได้รับการให้ NACT ที่มีรอยโรคขนาด 3-4.5 เซนติเมตร (77) พบว่าที่ 22 เดือนหลังติดตามอาการ ไม่มีรายใดเลยที่กลับเป็นซ้ำของโรค และมีหนึ่งรายที่สามารถตั้งครรภ์ได้
ความคิดเกี่ยวกับการผ่าตัดเพื่อดำรงพันธุ์ ในผู้ป่วยที่เป็นมะเร็งปากมดลูกระยะต้น (IA2 และ Early IB1) พบว่าการผ่าตัดทำ Radical trachelectomy ไม่มีประโยชน์เนื่องจากมีความเสี่ยงต่ำมากที่จะเกิดการกระจายของก้อนเนื้องอกไปที่บริเวณ parametrium (78)
นอกจากนั้นยังพบว่าร้อยละ 62-67 ในผู้ป่วย ไม่มี residual cancer ในชิ้นเนื้อที่ได้จากการตัด trachelectomy ออกมาตรวจอย่างละเอียด ดังนั้นเราอาจทำแค่ Diagnostic cone (10,11,13) ก็อาจจะเพียงพอ การผ่าตัด simple trachelectomy หรือการผ่าตัด cold knife cone ขนาดใหญ่เพื่อเอาส่วนของชิ้นเนื้อบริเวณปากมดลูกออกให้มากที่สุด ก็อาจจะเพียงพอสำหรับผู้ป่วย แต่อย่างไรก็ตามถ้ามีความเสี่ยงต่อการเกิดการแพร่กระจายไปที่ต่อมน้ำเหลือง ก็อาจจะพิจารณาผ่าตัดส่องกล้องเพื่อเลาะต่อมน้ำเหลืองหรือทำ sentinel lymph node mapping
มีการทำการศึกษาแบ่งการประเมินเป็น 2 ขั้นตอน รักษาแบบผู้ป่วยนอก ผู้ป่วยจำนวน 26 ราย ทีเป็นมะเร็งปากมดลูกระยะต้น IA1-IB2 (79) ผู้ป่วยจะได้รับการส่องกล้องทำ sentinel node mapping และทำ Frozen section ตามด้วยการเลาะต่อมน้ำเหลืองในอุ้งเชิงกรานอย่างสมบูรณ์
1 สัปดาห์ต่อมาแยกผู้ป่วยนอกเป็นผู้ป่วยที่ได้รับการทำ simple trachelectomy และทำในผู้ป่วยที่ยังไม่มีการแพร่กระจายไปยังต่อมน้ำเหลือง ตรวจพบว่าผู้ป่วย 4 รายที่มีการแพร่กระจายไปที่ต่อมน้ำเหลืองจากการตรวจชิ้นเรื้อแช่แข็ง และได้รับการผ่าตัด Radical hysterectomy ต่อมา, 1 ราย มีการกลับเป็นซ้ำของโรคและเข้ารับยาเคมีบำบัดต่อ อีก 15 ราย สามารถตั้งครรภ์ได้ โดยมี 8 รายที่คลอดเมื่ออายุครรภ์ 24 สัปดาห์, 34 สัปดาห์ 1 ราย, 36 สัปดาห์ 1 ราย และคลอดครบกำหนด 5 ราย (79)
อีกกลุ่มหนึ่ง เป็นการผ่าตัดรักษาแบบอนุรักษ์ (Conservative Surgery) ในผู้ป่วย 5 รายที่เป็นมะเร็งปากมดลูกระยะ IB2 (73) โดยผู้ป่วยทั้งหมดขนาดรอยโรคกว้างน้อยกว่า 2 เซนติเมตร และมีการรุกราน superficial stromal infiltration ลึกน้อยกว่า 2 มิลลิเมตร และปริมาตรชิ้นเนื้อน้อยกว่า 500 มิลลิเมตร(3) ใช้ Loop cone ร่วมกันหรือไม่ก็ได้การผ่าตัดส่องกล้องเพื่อเลาะต่อมน้ำเหลืองในตอนสุดท้าย และพบว่าไม่มีการเกิดโรคซ้ำหรือเกิดการแพร่กระจายไปยังต่อมน้ำเหลืองในชิ้นเนื้อชิ้นสุดท้ายจากข้อมูลในขณะนี้
ความคิดเห็นเกี่ยวกับการทำ ultraconservative treatment ควรได้รับการสืบค้นต่อไป เพื่อประเมินความปลอดภัยและกำหนดเกณฑ์การคัดเลือกผู้ป่วยที่จำกัดและรายละเอียดเกี่ยวกับการรายงานผลชิ้นเนื้อที่ได้จากการตัดปากมดลูก (cone specimen) มีความสำคัญมากเพื่อหลีกเลี่ยงการกลับเป็นซ้ำของโรคและการเสียชีวิตในผู้ป่วยที่สามารถรักษาให้หายได้ ส่วนผลกระทบต่อการคลอดบุตรในผู้ป่วยที่เคยได้รับการตัดปากมดลูกเป็นรูปกรวยขนาดใหญ่ยังคงต้องได้รับการศึกษาต่อไป
สำหรับผู้หญิงที่เป็นมะเร็งปากมดลูกความเสี่ยงต่ำ ที่ยังไม่มีบุตร แนะนำให้ทำ Radical trachelectomy มากกว่าการทำ Radical hysterectomy เพื่อที่จะรักษาภาวะดำรงพันธุ์เอาไว้ (Grade 2C)
การทำ MRI อุ้งเชิงกราน นั้นแนะนำให้ทำก่อนการผ่าตัด ในผู้ป่วยที่มีรอยโรคมองเห็นด้วยตาเปล่า
ก่อนที่จะทำ Radical trachelectomy การผ่าตัดส่องกล้องเลาะต่อมน้ำเหลืองเพื่อที่จะแยกว่ามีการแพร่กระจายไปที่ต่อมน้ำเหลืองหรือไม่ หากรอยโรคมองเห็นได้ด้วยตาเปล่า จากนั้นส่งชิ้นเนื้อแช่แข็ง เพื่อประเมินขอบเขตว่าตัดออกได้เพียงพอหรือไม่
ผลที่ตามมาหลังจากการผ่าตัด Radical trachelectomy อาจมีสารคัดหลั่งออกจากช่องคลอดได้ มีเลือดออกผิดปกติ มีอาการปวดประจำเดือนแบบลึกๆ มีรอยถลอกบริเวณที่ทำ cerclage ขาดประจำเดือน และมีปากช่องคลอดตีบแคบ
กรณีที่ขนาดรอยโรคใกล้เคียงกัน พบว่าอัตราการกลับเป็นซ้ำของโรคก็ใกล้เคียงกันระหว่างการทำ Radical trachelectomy กับ Radical hysterectomy
ในผู้หญิงที่เคยผ่าตัด Radical trachelectomy แล้ว ที่มีบุตรเพียงพอแล้ว ก็ไม่ได้แนะนำให้ทำการตัดมดลูก(Hysterectomy) ในทุกราย
2 ใน 3 ของผู้ป่วยสามารถตั้งครรภ์ได้หลังจากผ่าตัด Radical trachelectomy และพบว่าสามารถคลอดบุตรมีชีวิตได้ พบว่าร้อยละ 40 สามารถตั้งครรภ์ครบกำหนดและคลอดบุตรที่สุขภาพแข็งแรงได้
อัตราการแท้งและการคลอดบุตรก่อนกำหนดพบว่าสูงขึ้นมากกว่าหญิงตั้งครรภ์ทั่วไป
การคลอดทางช่องคลอดควรหลีกเลี่ยง เนื่องจากมีโอกาสฉีกขาดของผนังด้านข้างของปากมดลูก ในบริเวณที่เป็นรอยแผลที่ปากมดลูก อาจเกิดการแผ่ขยายออกไปยังหลอดเลือดข้างเคียง เป็นผลให้เสียเลือดอย่างรุนแรง ซึ่งแนะนำให้ผ่าตัดคลอดบุตร โดยอายุครรภ์ที่เหมาะสมคือ 37-38 สัปดาห์
ในอนาคตการใช้ Neoadjuvant chemotherapy หลังจากการได้รับการผ่าตัด Radical trachelectomy อาจได้รับการพิสูจน์ว่าเป็นทางเลือกหนึ่งของผู้ป่วยที่มีรอยโรคขนาดใหญ่ และในทางกลับการผู้ป่วยหญิงที่มีรอยโรคขนาดเล็ก อาจใช้การรักษาโดยการผ่าตัดเฉพาะตำแหน่งเอาได้
 ภาควิชามีความยินดีที่อาจารย์นก (ทวิวัน) กลับมาจากการศึกษาต่อจากประเทศออสเตรเลีย หลังจากไปฝึกฝน (research felllow) เป็นเจ้าแม่ PCO อยู่เป็นเวลานาน มาถึงแล้วสวย (เท่า) กว่าเดิม
ภาควิชามีความยินดีที่อาจารย์นก (ทวิวัน) กลับมาจากการศึกษาต่อจากประเทศออสเตรเลีย หลังจากไปฝึกฝน (research felllow) เป็นเจ้าแม่ PCO อยู่เป็นเวลานาน มาถึงแล้วสวย (เท่า) กว่าเดิม
รังไข่มีหน้าที่สำคัญในการสร้างฮอร์โมนเพศ ซึ่งจำเป็นต่อการพัฒนาของระบบสืบพันธุ์ และความแข็งแรงของกระดูก การที่รังไข่มีหน้าที่ลดลงหรือหมดหน้าที่ไป แต่เดิมเราเรียกว่า Premature ovarian failure (POF) หรือ Premature menopause(1) แต่ปัจจุบัน Dr. Fuller Albright และ Dr.Lawrence Nelson (2) พบว่าการใช้คำว่า Primary ovarian insufficiency (POI) น่าจะเหมาะสมกว่า(3) เนื่องจากผู้ป่วยในภาวะนี้ ไม่ได้มีรังไข่หยุดทำงานจริงแต่หมายถึง การที่รังไข่ทำงานผิดปกติไปจากเดิม โดยมี การทำงานของรังไข่เปลี่ยนแปลงและคาดเดาไม่ได้ ซึ่งอาจเกิดเพียงชั่วคราวและยัง สามารถตั้งครรภ์และมีบุตรได้ถึง 5-10% (4)
Primary ovarian insufficiency (POI) มี criteria ในการวินิจฉัย ดังนี้ (2, 5)
การที่ใช้อายุ 40 ปีนั้น มาจาก incidence ของ ovarian insufficiency ในแต่ละช่วงอายุ ผู้หญิงทั่วไป จะเข้าสู่วัยหมดระดูที่อายุเฉลี่ย 51 ปี (40-60 ปี) โดย age-specific incidence ของ spontaneous primary ovarian insufficiency ที่มีโครโมโซมปกติ (46,XX) ประมาน 1 : 250 ที่อายุ 35 ปี และ 1 : 100 ที่อายุ 40 ปี(6)
อย่างไรก็ตาม เนื่องจาก Primary ovarian insufficiency คือ การที่รังไข่ทำงานผิดปกติไปจากเดิม โดยอาจมีไข่ตกได้ครั้งคราวถึง 50%(4) ดังนั้น อาจวินิจฉัยภาวะนี้ในผู้ป่วยรายที่อายุน้อยกว่า 40 ปี ที่มี serum FSH > 40 IU/L โดยที่ไม่จำเป็นต้องประจำเดือนขาดเกิน 4 เดือน (อาจมีแค่ประวัติประจำเดือนที่ผิดปกติเท่านั้น)
ผู้ป่วยที่มีประวัติสงสัยภาวะรังไข่ทำงานผิดปกติ โดยมักมาด้วยประวัติประจำเดือนขาด ดังกล่าวข้างต้น จำเป็นต้องมีการซักประวัติ ตรวจร่างกาย และส่งตรวจเพิ่มเติมทั้งเพื่อวินิจฉัยและเพื่อหาสาเหตุต่อไป
1. Evaluation for diagnosis: การส่งตรวจเพิ่มเติมเพื่อวินิจฉัยแยกโรค
อย่างไรก็ตาม ควรประเมิน ovarian function ก่อน ในกรณีที่สงสัยภาวะนี้ ซึ่งถ้า ovarian function ปกติ ค่อยไปตรวจหาสาเหตุอื่นต่อ
Evaluation of ovarian function *
สรุป Ovarian failure คือ low estrogen production และ high serum FSH level (หลังวินิจฉัยแยกโรคอื่นแล้ว)
อย่างไรก็ตาม ไม่มีวิธีใดวิธีหนึ่งที่เป็นค่าที่วินิจฉัยได้แน่นอน ดังนั้นจำเป็นต้องตรวจหลายตัวร่วมกัน โดยใช้ประวัติเข้ามาช่วยวินิจฉัยร่วมด้วย
2. Specific evaluation
หลังจากวินิจฉัยว่าเป็น ovarian insufficiency ควรมีการตรวจหาสาเหตุต่อไป ถึงแม้ว่าส่วนใหญ่ ไม่ทราบสาเหตุก็ตาม
สรุป ในผู้ป่วยที่วินิจฉัย Primary ovarian insufficiency แนะนำตรวจเพิ่มเติม ดังนี้
Primary ovarian insufficiency (POI) เกิดขึ้นผ่าน 2 กลไกหลัก คือ(2)
สาเหตุของ Primary ovarian insufficiency (POI) ได้แก่ โครโมโซมผิดปกติ, Fragile X syndrome, autoimmune, radiation therapy, chemotherapy, galactosemia หรืออาจเกิดจากความผิดปกติของ follicular development อย่างไรก็ตามประมาน 75 – 90% ของคนไข้ POI ที่ไม่ทราบสาเหตุ(12)
จำนวนและโครงสร้างของโครโมโซมที่ผิดปกติเป็นสาเหตุที่พบบ่อยที่สุด ถึง 50% ของ spontaneous ovarian failure ที่มาด้วยไม่เคยมีประจำเดือน (primary amenorrhea)(16) แต่พบน้อยในผู้ป่วยที่ขาดประจำเดือนในภายหลัง (secondary amenorrhea) โดยแบ่งเป็นความผิดปกติของจำนวนโครโมโซม ได้แก่ X chromosome mosaicism (45,X, 46,XX, และ 47,XXX) , Y chromosome mosaicism (46,XY, 47,XYY, และ 47,XXY), X chromosome translocations, deletions และ ความผิดปกติของโครงสร้างโครโมโซม
ความผิดปกติของ X chromosome พบได้บ่อยในผู้ป่วยที่มีประวัติคนในครอบครัวเป็น POI ดังนั้นแนะนำให้วางแผนครอบครัวต่อไป โดย X monosomy หรือ Turner syndrome เป็นภาวะที่พบได้บ่อย ซึ่งมีการทำลายของไข่ (follicle) ตั้งแต่อยู่ในครรภ์ จึงมักมาด้วยอาการที่ไม่เคยมีประจำเดือน สำหรับ X chromosome translocations และ deletions พบว่ามักจะเกิดที่ตำแหน่ง Xq 13-26 บ่อยที่สุด
มีผู้ป่วย ovarian insufficiency ประมาน 10-15% ที่มีประวัติญาติสายตรง(first-degree family relative)เป็นเหมือนกัน(16) Fragile X syndrome เกิดจากการผิดปกติของ CGG repeat sequence ใน FMR1 gene ที่ แขนยาวของ X chromosome (Xq27.3) โดยปกติ FMR1 gene ของคนปกติ จะมีการซ้ำของ CGG ประมาน 30 ครั้ง แต่ลักษณะของ Fragile X syndrome จะพบการซ้ำกันของ CGG ได้ถึง 200 ครั้งหรือมากกว่านั้น สำหรับ premutation หมายถึงการซ้ำกันของ CGG ในช่วง 55-200 ครั้ง ซึ่งสัมพันธ์กับโรค 2 ลักษณะที่แตกต่างไปจาก Fragile X syndrome คือ Fragile X-associated tremor/ataxia (FXTAS) ซึ่งมักพบในผู้ชาย และ POF ซึ่งพบได้ประมาน 15% ของผู้หญิงที่มี premutation อย่างไรก็ตาม ในผู้ป่วยที่ไม่เคยมีประวัติ POF ในครอบครัวมาก่อน อาจพบ premutation ได้ถึง 1-7% (12)
Fragile X syndrome เป็นโรคที่พบได้ไม่บ่อย คือผู้หญิงประมาณ 1 ใน 4000-8000 ราย แต่เป็นโรคที่พบได้บ่อยที่สุดของ hereditable mental retardation(9) โดยการเกิด premutation ของโรคนี้แตกต่างไปจากระยะแฝง (carrier) ของโรคอื่น คือ premutation ของโรคนี้มีโอกาสพัฒนาไปเป็นโรคได้ ในหญิงที่มี FMR1 premutation มักจะแสดงอาการของการหมดระดู โดยเริ่มจากระยะเวลาของรอบเดือนและระยะ follicular phase สั้นลง จนเข้าสู่วัยหมดระดูก่อนหญิงทั่วไปประมาน 5 ปี แม้ส่วนใหญ่มักมีประวัติประจำเดือนปกติมาก่อน แต่พบโรคนี้ได้ประมาณ 1 % ที่ประจำเดือนขาดในวัยรุ่น ก่อนอายุ 18 ปี(9) โดยสำหรับกลไกการเกิดยังไม่ทราบแน่ชัด แต่เชื่อว่าเกี่ยวข้องกับ overexpression ของ mRNA ทำให้ไข่ฝ่อ (follicular atresia)
การถ่ายทอดของ FMR1 premutation และ mutation มีลักษณะคล้าย X-link คือผู้หญิงจะถ่ายทอดไปสู่ลูกหลานได้ 50% แต่จะแตกต่างกันที่ลักษณะการถ่ายทอดนั้นจะมีโอกาส CGG repeat sequence เพิ่มขึ้นโดยขึ้นกับขนาดของการซ้ำกัน ดังนั้นลูกหลานจะมีโรคที่รุนแรงขึ้น จึงแนะนำให้ ตรวจ FMR1 premutations ในหญิงอายุน้อยกว่า 40 ปี ที่มี serum FSH สูง ทุกราย และจำเป็นต้อง genetic counseling ต่อไป
โรคบกพร่องทางภูมิคุ้มกันเป็นหนึ่งในสาเหตุของภาวะรังไข่ทำงานผิดปกติ ซึ่งพบได้ประมาน 4% โดย autoimmune oophoritis อาจเกิดจากโรค thyroid disease (25%), Addison disease (3%), type 1 diabetes (2.5%) นอกจากนี้ยังเกิดได้ในโรค autoimmune polyglandular syndrome (APS) , systemic lupus erythematous หรือ myasthenia gravis เป็นต้น
สำหรับกลไกการเกิดภาวะรังไข่ทำงานผิดปกติจากภูมิคุ้มกันบกพร่องนั้นยังไม่ทราบแน่ชัด แต่เชื่อว่าอาจจะเกิดจากเชื้อไวรัส หรือสาเหตุอื่นที่ทำลายเนื้อรังไข่ โดยการวินิจฉัยอาศัย anti-adrenal antibodies (CYP21) แต่พิจารณาตรวจในรายที่มีประวัติสงสัยเท่านั้น ซึ่งจะพบได้ประมาน 50%(16) เมื่อตรวจพบแล้ว แนะนำให้ตรวจหา adrenal insufficiency ต่อไป เนื่องจากพบร่วมกันได้บ่อย(12) สำหรับการตัดชิ้นเนื้อรังไข่เพื่อวินิจฉัยนั้นพบว่าไม่จำเป็นและไม่แนะนำ ในกรณีที่สงสัยสาเหตุของ POI จาก autoimmune thyroiditis ซึ่งพบได้ 14-27% แนะนำให้ตรวจ thyroid peroxidase และ thyroglobulin antibodies ร่วมด้วย
ภาวะรังไข่ทำงานผิดปกติเป็นผลข้างเคียงอย่างหนึ่งจากการฉายรังสี โดยขึ้นกับอายุผู้ป่วย ปริมาณรังสี(dose) และบริเวณที่โดนรังสี(radiation field) โดยในผู้ป่วยอายุน้อย มักมีประจำเดือนขาดเพียงชั่วคราวหลังฉายรังสี (ประมาน 6 ถึง 18 เดือน) อย่างไรก็ตามผู้ป่วยบางรายอาจมีประจำเดือนขาดทันทีและถาวรหลังฉายรังสี โดยเฉพาะผู้ป่วยที่อายุมากจะไว ต่อการฉายรังสีมากกว่า กล่าวคือ ขนาดรังสีที่มากกว่า 6 Gy (1 Gy = 100 rads) ส่วนใหญ่ทำให้รังไข่หยุดทำงานในหญิงที่อายุมากกว่า 40 ปี ในขณะที่หญิงอายุน้อยยังมีการทำงานของรังไข่ที่ปกติและสามารถตั้งครรภ์ได้หลังได้รับการฉายรังสีขนาดเดียวกัน (12) โดยทั่วไปหลังได้รับขนาดรังสีที่2 Gy มักจะเหลือไข่ (oocyte) ที่รอดประมาน 50% และพบว่าการฉายรังสีบริเวณอุ้งเชิงกรานมากกว่า 10 Gy ทำให้เกิดภาวะรังไข่หยุดทำงานฉับพลันได้(9)
อย่างไรก็ตาม สำหรับ radiation field ที่นอกเหนือจากอุ้งเชิงกรานนั้น ไม่มีผลต่อการทำงานของรังไข่แต่อย่างใด แต่เมื่อมีความจำเป็นต้องฉายรังสีบริเวณรังไข่นั้น อาจมีวิธีเพื่อช่วยให้ตั้งครรภ์ต่อไปได้ เช่น การย้ายรังไข่ออกจาก radiation field (ovarian transposition)(12) หรือ การใช้เทคนิคช่วยการเจริญพันธุ์ ซึ่งจะกล่าวต่อไป อย่างไรก็ตามหากมีการตั้งครรภ์ต่อไป ไม่พบว่าหลังการฉายรังสีจะเพิ่มความเสี่ยงต่อความผิดปกติของเด็ก แต่อาจเพิ่มภาวะแท้งบุตร การคลอดก่อนกำหนด หรือเด็กน้ำหนักน้อยได้
มีการศึกษา(16) พบว่าผู้ป่วยที่เป็นมะเร็ง ประมาน 6.3% มีภาวะรังไข่หยุดทำงานฉับพลันหลังรักษา โดยพบว่าหลังจากติดตามคนที่เหลือต่อไป จะเข้าสู่ภาวะรังไข่หยุดทำงานเพิ่มอีก 8% โดยส่วนใหญ่เกิดในผู้ป่วยมะเร็งโลหิต
ยาเคมีบำบัดทำให้ primordial follicular pool ลดลง และมักจะสัมพันธ์กับปริมาณยาที่ได้รับ ยาเคมีบำบัดมีหลายชนิด แต่ละชนิดมีผลต่อการทำงานของรังไข่ต่างกัน ดังตาราง(12) โดยยาที่พบได้บ่อยมักเป็นกลุ่ม alkylating agents(9) อย่างไรก็ตาม การให้ยาเคมีบำบัดส่วนใหญ่ให้หลายชนิดพร้อมกัน ดังนั้นค่อนข้างยากในการคาดการณ์โอกาสเกิดภาวะรังไข่ทำงานผิดปกติ
การเกิดรังไข่ทำงานผิดปกติหลังได้รับยาเคมีบำบัดขึ้นกับหลายปัจจัย นอกเหนือไปจากชนิดและปริมาณของยา ได้แก่ อายุ การสูบบุหรี่ และปัจจัยอื่นๆที่มีผลต่อการตกไข่(16)โดยผู้ป่วยที่อายุมากจะมี follicle เหลืออยู่น้อย สัดส่วนในการถูกทำลายจากยาจะมากกว่า อย่างไรก็ตาม การศึกษาส่วนใหญ่ติดตามเพียงอาการขาดประจำเดือน 6 เดือน ถึง 5 ปีหลังรักษาเท่านั้น ไม่ได้มีการตรวจวัด ovarian reserve เช่น ระดับ FSH, estradiol, inhibin B หรือ AMH ในเลือด ดังนั้นหญิงที่มีอายุมากกว่าย่อมเกิดอาการขาดประจำเดือนก่อน
Long-acting GnRH agonist เช่น leuprolide acetate ได้ถูกนำมาใช้อย่างแพร่หลายเพื่อกระตุ้น hypogonadal state ก่อนให้ยาเคมีบำบัด เพื่อลดผลข้างเคียงเรื่องการทำงานของรังไข่ที่ผิดปกติและเพื่อการเจริญพันธุ์ต่อไป โดยพบว่า น้อยกว่า 10% ของผู้ป่วยที่ได้รับ GnRH agonist เกิด irreversible POI เทียบกับ 40-70% ในกลุ่มที่ไม่ได้รับยาก่อนให้ยาเคมีบำบัด นอกจากนี้ยังมีการศึกษาพบว่า GnRH agonist ยังสามารถช่วยยืดช่วงการเจริญพันธุ์ออกไปได้มากกว่า 7 ปี(12) จาก Cochrane review ปี 2011(17) ถึงเรื่องการให้ GnRH analog เพื่อป้องกันภาวะรังไข่ทำงานผิดปกติจากยาเคมีบำบัด พบว่าการให้ GnRH agonist ในรูปฉีดเข้ากล้ามเนื้อหรือฉีดใต้ผิวหนังก่อนให้ยาเคมีบำบัดช่วยให้ผู้ป่วยกลับมามีประจำเดือนและไข่ตกได้มากกว่าผู้ป่วยที่ไม่ได้รับ แต่ความประสบความสำเร็จในการตั้งครรภ์ไม่แตกต่างกัน อย่างไรก็ตาม ยังมีการถกเถียงกันในเรื่องประสิทธิภาพและความปลอดภัยของการใช้ GnRH agonist ซึ่งต้องรอการศึกษาต่อไป
Galactosemia เป็นโรคที่ผิดปกติของ galactose metabolism จาการขาด enzyme galactose 1-phosphate uridyl transferase ซึ่งเป็นโรคพันธุ์กรรมแบบ autosomal recessive ที่อาจเกิด ovarian insufficiency ได้ แต่น้อยมาก โดยมีกลไกทำให้ primordial follicle ลดลง จากการ toxicity ที่สะสม ของ galactose metabolism บน germ cell migration อย่างไรก็ตาม การวินิจฉัยโรคนี้มักเกิดในช่วง 2-3วันแรกหลังคลอด เมื่อพบอาการเหลือง อาเจียน หรือเลี้ยงไม่โตหลังดูดนมแม่หรือนมวัว
HORMONE THERAPY
การที่รังไข่ทำงานลดลงหรือหยุดทำงาน ส่งผลให้ระดับฮอร์โมนเอสโตรเจนในร่างกายลดลง ซึ่งถ้าไม่ได้รับฮอร์โมนทดแทนจะส่งผลให้เกิด ภาวะกระดูกบางหรือกระดูกพรุน, โรคหัวใจก่อนวัยอันควร, กระบวนการคิดผิดปกติ (cognitive function) หรืออาการของวัยหมดระดู ต่างๆตามมา เป็นต้น โดยมีการศึกษาพบว่า ในผู้ป่วย POI มีอัตราการตายจากภาวะแทรกซ้อนจากการขาดฮอร์โมนเอสโตรเจน สูงกว่าหญิงที่หมดประจำเดือนหลังอายุ 50 ปี(16, 18)
ดังนั้นจึงแนะนำให้ ฮอร์โมนทดแทนแก่ผู้ป่วย POI ทุกรายที่ไม่มีข้อห้าม รวมไปถึงแนะนำให้ออกกำลังกาย รับประทานอาหารที่มี calcium (1000 mg ต่อวัน) และ vitamin D (800 IU ต่อวัน) ที่เพียงพอ แนะนำให้งดเหล้าและหยุดบุหรี่ร่วมด้วย อย่างไรก็ตาม ต้องตระหนักว่าผู้ป่วย POI นั้นแตกต่างจากหญิงวัยหมดระดูทั่วไป โดยเฉพาะเรื่องประโยชน์และความเสี่ยงของการได้ฮอร์โมนทดแทนนั้นแตกต่างกัน แม้ว่าจากการศึกษาของ WHI study(20) ดังที่ได้กล่าวไปแล้ว ยังไม่พบหลักฐานชัดเจนถึงประโยชน์หรือความเสี่ยงจากการใช้ฮอร์โมนทดแทนเพื่อป้องกันโรคหัวใจ อย่างไรก็ตามการไม่ได้รับฮอร์โมนทดแทนในหญิง POI ซึ่งอายุน้อยนั้น จะเพิ่มโอกาสการเกิดภาวะแทรกซ้อนจากการขาดฮอร์โมนเอสโตรเจน เพิ่มขึ้นได้มากเมื่อเทียบกับหญิงอายุมาก ดังนั้น หญิงกลุ่มนี้ควรได้รับฮอร์โมนทนแทนไปจนถึงอายุอย่างน้อย 50 ปี (12)
ฮอร์โมนทดแทนหลัก คือ 17beta-estradiol โดยหลักการการให้ฮอร์โมนทดแทนในหญิง POI นั้น เพื่อให้การทำงานของรังไข่กลับมาสู่ปกติที่สุด (ที่ระดับเอสโตรเจนประมาน 104 pg/mL)(24) การให้ฮอร์โมนทดแทน ให้ได้ในหลายรูปแบบการกิน หรือ การใช้แผ่นแปะ โดยฮอร์โมนชนิดแผ่นแปะ มีข้อดี คือ เป็น 17beta-estradiol ซึ่งมีโครงสร้างตามต้องการ ไม่ต้องผ่านกระบวนการต่างๆที่ตับ ระดับฮอร์โมนค่อนข้างคงที่ ลดโอกาสเกิดโรคของถุงน้ำดีและสามารถลดการเกิดลิ่มเลือดอุดตันในหลอดเลือดดำ(venous thromboembolism) ได้ดีกว่ารูปแบบกิน(25, 26) อย่างไรก็ตามในผู้หญิงที่ยังมีมดลูก การให้ฮอร์โมนเอสโตรเจนอย่างเดียวจะเพิ่มโอกาสการเกิดมะเร็งในโพรงมดลูกและเยื่อบุโพรงมดลูกหนาตัวได้ ดังนั้นแนะนำให้ฮอร์โมนโปรเจสเตอโรนร่วมด้วย ดังตาราง(9)
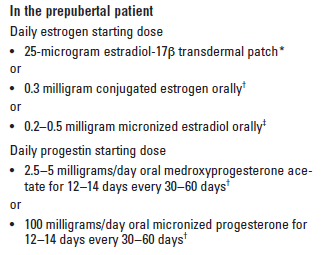
การให้ combined hormonal contraception ไม่แนะนำใช้เป็นการรักษาหลักในผู้ป่วยอายุน้อยที่ยังเข้าสู่วัยสาวไม่สมบูรณ์ เนื่องจากจำเป็นต้องได้รับฮอร์โมนอีกหลายชนิด จึงแนะนำปรึกษาแพทย์ผู้เชี่ยวชาญด้านการเจริญเติบโตร่วมด้วย โดยการรักษาในวัยรุ่นนั้น แนะนำเริ่มต้นด้วยฮอร์โมนเอสโตรเจนระดับต่ำๆก่อน จนกระทั่งมีเลือดออกมา (แต่ไม่เกิน 2 ปี) ค่อยเริ่มให้ฮอร์โมนโปรเจสตรินเพื่อให้มีประจำเดือนปกติ โดยขนาดของฮอร์โมนจะค่อยๆเพิ่มขึ้นทุก 6-12 เดือน ในช่วง 2-4 ปี ขึ้นกับการเจริญของวัยสาว (9)

ในผู้ป่วยที่รังไข่ทำงานผิดปกติ จะทำให้ฮอร์โมนแอนโดรเจน (Androgen) ลดลง และเกิดอาการอ่อนเพลียเชื่องช้า (lethargy) และความต้องการทางเพศลดลง (loss of libido) ตามมา มีการศึกษาและผู้เชี่ยวชาญบางรายแนะนำให้ฮอร์โมนแอนโดรเจนทดแทน ในผู้ป่วยที่มีอาการ (13) อย่างไรก็ตามปัจจุบันยังไม่มีเกณฑ์การวินิจฉัยภาวะขาดฮอร์โมนแอนโดรเจนและยังไม่มีการแนะนำให้ใช้ นอกจากนี้ยังเกิดผลข้างเคียง ได้แก่ สิว ขนดก และการทำงานของไขมันบกพร่องเพิ่มขึ้นได้(12)
NON-HORMONAL TREATMENT (2)
ในกรณีที่ผู้ป่วยมีข้อห้ามในการให้ ฮอร์โมนเอสโตรเจนทดแทน หรือเป็นมะเร็งที่ไวต่อการให้ฮอร์โมน (เช่น มะเร็งเต้านมที่ estrogen-receptor positive) หรือเป็นผู้ป่วยที่มีความเสี่ยงสูงต่อการเกิดลิ่มเลือดอุดตันในหลอดเลือดดำ (venous thromboembolism) อาจเลือกวิธีการรักษาที่ไม่ใช้ฮอร์โมน เช่น serotonin re-uptake inhibitors (SSRIs), venlafaxine หรือ gabapentin แทน ซึ่งสามารถลดอาการได้บ้าง แต่ไม่สามารถลดผลระยะยาวจากการขาดฮอร์โมนเอสโตรเจนได้ทั้งหมด ดังนั้น แนะนำให้ดูประโยชน์และความเสี่ยงเป็นรายๆไป
CONTRACEPTION
เนื่องจาก POI ไม่ใช้ภาวะล้มเหลวของการทำงานของรังไข่ แต่เป็นการทำงานที่ผิดปกติไป ดังนั้นรังไข่มีโอกาสที่จะกลับมาทำงานได้ โดยมีประมาณ 5-10% ของผู้ป่วย POI มีโอกาสตั้งครรภ์ได้เอง(4) ดังที่ทราบว่า การให้ฮอร์โมนทดแทนในหญิงหมดประจำเดือนนั้น ระดับฮอร์โมนไม่เพียงพอที่จะสามารถป้องกนการตั้งครรภ์ได้ ดังนั้นในรายที่ไม่ต้องการมีบุตร แนะนำให้คุมกำเนิดด้วยวิธีอื่นเสริม เช่น การใช้ถุงยางอนามัย หรืออาจใส่ห่วงอนามัย เป็นต้น(2, 16)
ในกรณีผู้ป่วยต้องการเลือกวิธีการกินยาคุมกำเนิดด้วยวิธีการกิน อาจต้องแนะนำว่าผู้ป่วยอาจมีอาการ vasomotor symptoms ได้ ในช่วง 4-7 วัน ของ pill-free interval สำหรับเรื่องการป้องกันภาวะกระดูกพรุนนั้นมีบางรายงานกล่าวว่าสามารถใช้ยาคุมกำเนิดทดแทนได้ อย่างไรก็ตามยังไม่มีการศึกษาที่ชัดเจนในเรื่องปริมาณฮอร์โมนที่เหมาะสม ต้องรอการศึกษาต่อไป(27)
FERTILITY
การทำงานของรังไข่ในผู้ป่วย ovarian insufficiency สามารถกลับมาปกติได้ประมาณ 50% ของผู้ป่วยทั้งหมด และมีประมาน 5-10% ที่สามารถตั้งครรภ์ได้(4) อย่างไรก็ตาม ผู้ป่วยกลุ่มนี้ส่วนใหญ่มีโอกาสกลับมาตั้งครรภ์ได้เองน้อย ดังนั้นจึงต้องอาศัยวิธีต่างๆเพื่อช่วยให้มีบุตรได้
PSYCHOLOGICAL AND EMOTIONAL SUPPORT
แพทย์ควรแสดงความเสียใจและให้กำลังใจผู้ป่วย โดยเฉพาะเรื่องเรื่องความคาดหวังในการมีบุตรในอนาคต
29. Jahnukainen K, Hou M, Petersen C, Setchell B, Soder O. Intratesticular transplantation of testicular cells from leukemic rats causes transmission of leukemia. Cancer Res. 2001 Jan 15;61(2):706-10.

1. นายชวกิจ ดีอ่วม
2. นายดิว สายอุดม
3. นายชยพงศ์ โตวิวัฒน์
4. นส.ชลลดา บุญเพชร
5. นายธีรพัฒน์ ตันพิริยะกุล
6. นายวาริช เตียวตระกูล