Fetal Death
ทารกในครรภ์เสียชีวิต (Fetal death)
นพ. ณัฐพัชร์ จันทรสกา
อาจารย์ที่ปรึกษา : อ. พ.ญ. สุชยา ลือวรรณ
ความหมาย (Definitions)
คำจำกัดความของ U.S. National Center for Health Statistics (NCHS)หมายถึง การเสียชีวิตของทารกก่อนการคลอดอย่างสมบูรณ์หรือก่อนที่นำทารกออกจากมารดา โดยไม่คำนึงถึงระยะเวลาของการตั้งครรภ์ และไม่ได้เกิดจากการชักนำให้เกิดการคลอด (induced termination) โดยการเสียชีวิตนั้นถูกแสดงให้เห็นจากการที่ทารกไม่หายใจหรือไม่พบหลักฐานของการมีชีวิตอื่นๆ เช่น การเต้นของหัวใจ การคลำชีพจรที่สายสะดือได้ หรือการเคลื่อนไหวของกล้ามเนื้ออย่างชัดเจน หลังจากคลอดหรือนำทารกออกจากมารดา การหยุดเต้นของหัวใจต้องแยกออกจากภาวะ transient cardiac contraction และการหยุดหายใจต้องแยกออกจากการพยายามหายใจชั่วขณะ (fleeting respiratory effort) หรือหายใจเฮือก (gasp)(1)
คำจำกัดความของWHO ทารกในครรภ์เสียชีวิต (fetal death)ไม่รวมถึงการแท้งเอง (spontaneous abortion) ก่อนอายุครรภ์ 12 สัปดาห์ ซึ่งจะมีสาเหตุและการดูแลจัดการแตกต่างจากทารกเสียชีวิตในช่วงไตรมาสสองและสาม สำหรับ stillbirthโดย WHO ให้นิยามคือ ทารกในครรภ์เสียชีวิตในช่วงท้ายของการตั้งครรภ์ประเทศต่างๆอาจจะให้นิยามของทารกในครรภ์เสียชีวิตที่แตกต่างกันตั้งแต่อายุครรภ์ 16 ถึง 28 สัปดาห์อย่างไรก็ตาม NCHS แนะนำว่าทารกในครรภ์เสียชีวิตคือทารกที่มีอายุครรภ์ตั้งแต่ 20 สัปดาห์หรือน้ำหนักทารกมากกว่า 350 กรัมกรณีที่ไม่ทราบอย่างครรภ์(2) บางสถานที่อาจแตกต่างจากนี้ตั้งแต่มากกว่า 350 ถึงมากกว่า 500 กรัม (350 กรัมตรงกับน้ำหนักเปอร์เซนไทล์ที่ 50 ที่อายุครรภ์ 20 สัปดาห์) เช่นเดียวกับ International Stillbirth Alliance ที่กำหนดให้ทารกในครรภ์เสียชีวิตคือทารกที่มีอายุครรภ์ตั้งแต่ 20 สัปดาห์ การสูญเสียทารกในครรภ์จากการยุติการตั้งครรภ์เนื่องจากทารกผิดปกติรุนแรงและการชักนำคลอดไม่จัดอยู่ในกลุ่มทารกเสียชีวิตในครรภ์ ตัวอ่อนเสียชีวิต (embryonic death) หมายถึงการเสียชีวิตที่เกิดขึ้นก่อนอายุครรภ์ 12 สัปดาห์ ทารกในครรภ์เสียชีวิตระยะแรก (early fetal death) หมายถึงการเสียชีวิตตั้งแต่อายุครรภ์ 13 ถึง 19 6/7สัปดาห์ ทารกในครรภ์เสียชีวิตระยะกลาง (intermediate fetal death) หมายถึงการเสียชีวิตตั้งแต่อายุครรภ์ 20 ถึง 27 สัปดาห์ และทารกในครรภ์เสียชีวิตระยะท้าย (late fetal death) หมายถึงการเสียชีวิตที่อายุครรภ์มากกว่า 28 สัปดาห์
ตายคลอด (stillbirth) เป็นศัพท์ที่นิยมในกลุ่มบิดามารดา สามารถใช้เรียกแทนทารกในครรภ์เสียชีวิต (fetal death) ดังนั้นศัพท์นี้ได้ถูกนำมาใช้เพิ่มมากขึ้นในวิจัยระดับชุมชน และโดย ACOG สำหรับทารกในครรภ์เสียชีวิตตั้งแต่อายุครรภ์ตั้งแต่ 20 สัปดาห์หรือน้ำหนักทารกมากกว่า 350 กรัม(3) และศัพท์อื่นๆ ที่ใช้แทนกันได้ได้แก่ stillborn, fetal demise, intrauterine fetal demise (IUFD) หรือ dead fetus in utero สำหรับ unexplained fetal death หมายถึงทารกเสียชีวิตก่อนคลอดโดยไม่สามารถระบุสาเหตุการเสียชีวิตได้หลังจากประเมินหาสาเหตุอย่างครบถ้วนแล้ว
การวินิจฉัย (Diagnosis)
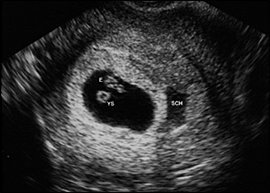
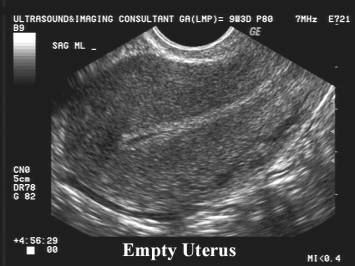
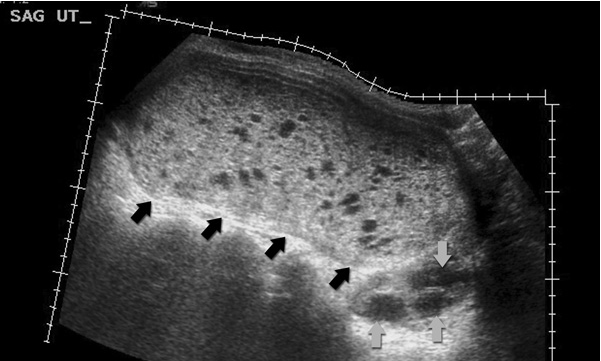
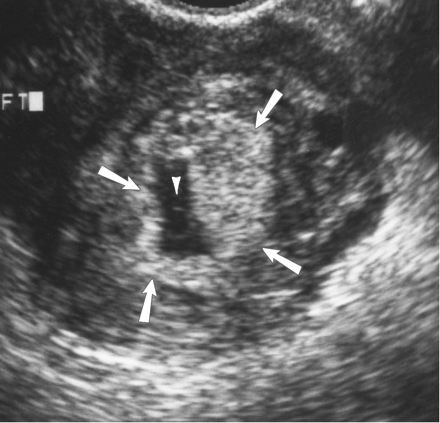
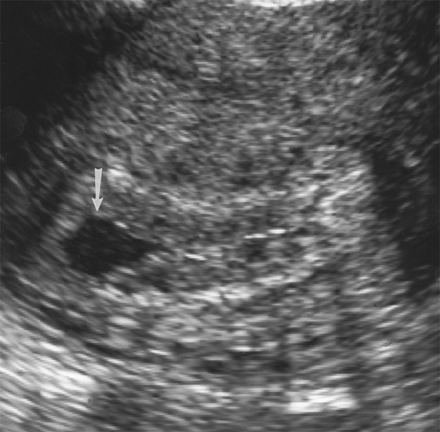
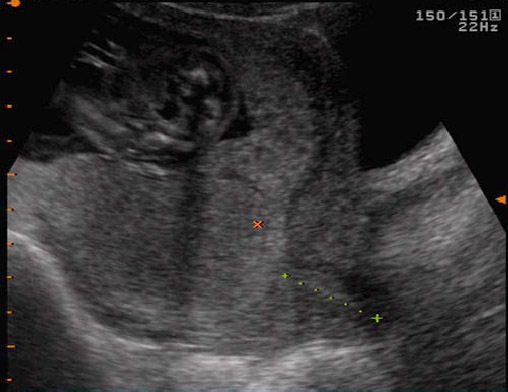
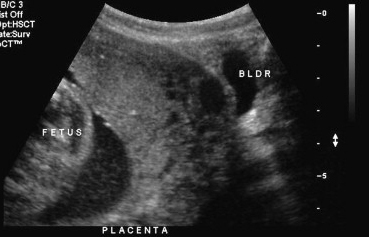
การวินิจฉัยทารกในครรภ์เสียชีวิตควรยืนยันด้วยภาพคลื่นเสียงความถี่สูง (ultrasound) ว่าไม่พบการเคลื่อนไหวของหัวใจ
ระบาดวิทยา (Epidermiology)
ประมาณการพบทารกในครรภ์เสียชีวิตที่อายุครรภ์ตั้งแต่ 28 สัปดาห์หรือน้ำหนักตั้งแต่ 1000 กรัม ทั่วโลกในแต่ละปีมากกว่า 2.6 ล้านรายซึ่งพบว่าลดลงมาตั้งแต่ปี ค.ศ.1995 ร้อยละ 98 ของทารกในครรภ์เสียชีวิตทั้งเกิดพบในกลุ่มประเทศที่มีรายได้ต่ำหรือรายได้ปานกลาง เช่น อินเดีย ไนจีเรีย ปากีสถาน จีน และบังคลาเทศ ถือเป็นห้าประเทศที่มีจำนวนทารกในครรภ์เสียชีวิตสูงที่สุด(4) ในประเทศสหรัฐอเมริกา ในปี ค.ศ.2005 มีรายงานทารกในครรภ์เสียชีวิตตั้งแต่อายุครรภ์ 20 สัปดาห์จำนวน 25,894 ราย คิดเป็นอัตราทารกในครรภ์เสียชีวิต (fetal death rate) 6.2/1,000 การเกิดมีชีพ(3)เกือบครึ่งหนึ่งของการเสียชีวิตเหล่านี้เกิดในช่วงไตรมาสที่สามของการตั้งครรภ์อัตราสตรีที่ทารกในครรภ์เสียชีวิตเพิ่มขึ้นจากอัตราการเพิ่มขึ้นของเบาหวาน ความดันโลหิตสูง รกลอกตัวก่อนกำหนด และน้ำเดินก่อนกำหนดในสตรีเหล่านี้ความถี่ของสาเหตุต่างๆ แตกต่างกันไปตามเชื้อชาติ ซึ่งอาจสัมพันธ์กับปัจจัยการถ่ายทอดทางพันธุกรรม เช่นเดียวกับปัจจัยทางพฤติกรรม อย่างน้อยครึ่งหนึ่งของทารกในครรภ์เสียชีวิตเกิดระหว่างเจ็บครรภ์คลอดและระหว่างคลอด ส่วนใหญ่เกิดขึ้นมาจากขาดทักษะการดูแลการคลอดและไม่สามารถผ่าตัดคลอดได้ ทารกในครรภ์เสียชีวิตก่อนคลอดบ่อยครั้งสัมพันธ์กับการติดเชื้อของมารดาและทารกโตช้าในครรภ์ ภาวะความดันโลหิตสูงในสตรีตั้งครรภ์ที่ไม่ได้รับการตรวจพบและชักนำคลอดอย่างอย่างเหมาะสมเป็นอีกสาเหตุของทารกและมารดาเสียชีวิตความถี่ของสาเหตุต่างๆ แตกต่างกันยังแปรเปลี่ยนไปตามอายุครรภ์ จากการทบทวนพบสาเหตุทารกในครรภ์เสียชีวิตมากที่สุดในช่วงอายุครรภ์ 24 ถึง 27 สัปดาห์คือภาวะติดเชื้อ (ร้อยละ 19) รกลอกตัว (ร้อยละ 14) และความผิดปกติของทางทารก (fetal anomaly ร้อยละ 14) และอายุครรภ์มากกว่า28 สัปดาห์สาเหตุที่พบบ่อยเกิดจาก ไม่ทราบสาเหตุ ทารกโตช้าในครรภ์และรกลอกตัว สำหรับคณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่ ในปี พ.ศ.2555 พบ ทารกในครรภ์เสียชิวิตคิดเป็น 29.38/1,000 การเกิด (นิยามอายุครรภ์ตั้งแต่ 22สัปดาห์หรือน้ำหนักทารกมากกว่า 500กรัม) หรือคิดเป็น 10.24/1,000 การเกิด (นิยามอายุครรภ์ตั้งแต่ 28สัปดาห์หรือน้ำหนักทารกมากกว่า 1,000กรัม) แบ่งเป็นช่วงอายุครรภ์ 22 ถึง 27 สัปดาห์ 41 ราย (ร้อยละ 65.08)และอายุครรภ์มากกว่า28 สัปดาห์ 22ราย (ร้อยละ 34.92)ซึ่งสาเหตุที่พบ เช่น macerated stillbirth, congenital malformation, condition association with immaturity, asphyxia developed in labor
ระบบการจัดประเภท (Classification systems)
การศึกษาสาเหตุที่เฉพาะเจาะจงของทารกในครรภ์เสียชีวิตไม่ได้ถูกศึกษาต่อ เนื่องจากการขาดระเบียบแบบที่เป็นแนวทางเดียวกัน (uniform protocol) ในการประเมินและจัดกลุ่มทารกในครรภ์เสียชีวิต และจากการลดอัตราการชันสูตรทารกลดลง ซึ่งการรับรองการเสียชีวิตทารกในครรภ์ส่วนใหญ่จะเสร็จสมบูรณ์ก่อนที่การประเมินหาสาเหตุการเสียชีวิตหลังเสียชีวิตจะเสร็จสิ้น ระบบการจัดประเภทของสาเหตุทารกในครรภ์เสียชีวิตในปัจจุบันมีมากกว่า 35 ระบบในการแบ่งประเภทการเสียชีวิตทารกปริกำเนิด (perinatal death) ที่ถูกรายงานในวรรณกรรมทางการแพทย์มาตั้งแต่ปี ค.ศ. 1954 และแต่ละระบบสร้างขึ้นมาเพื่อจุดประสงค์เฉพาะตามผู้ศึกษาวิเคราะห์ ระบบการจัดประเภทในระยะแรกได้แบ่งกลุ่มย่อยๆ (subtype) เพียงไม่กี่กลุ่มย่อย เมื่อได้ข้อมูลสาเหตุการเสียชีวิตมากขึ้น ในระบบการจัดประเภทต่อมาได้เพิ่มกลุ่มย่อยมากขึ้น แต่อย่างไรก็ตามการเข้าถึงระบบการจัดประเภททารกในครรภ์เสียชีวิตควรจะจัดตามหลักการป้องกันการเกิดทารกในครรภ์เสียชีวิต
ความสัมพันธ์ ความเสี่ยงและสาเหตุ (Associations, Risk factors, possible etiologies)
มีปัจจัยของมารดาและทารกมากมายที่สัมพันธ์กับการเกิดทารกในครรภ์เสียชีวิต ดังตาราง 1.1 มากถึงร้อยละ 50 ไม่พบความสัมพันธ์กับสาเหตุต่างๆ เหล่านี้และถูกเรียกว่าทารกในครรภ์เสียชีวิตไม่ทราบสาเหตุ มีการแบ่งประเภท (classification) สาเหตุของการเสียชีวิตไว้มากมาย Stillbirth Collaborative Research Network (SCRN) ได้สร้างระบบการแบ่งกลุ่มขึ้นมาใหม่เพื่อให้เป็นแบบแผนเดียวกันและสื่อสารด้วยภาษาธรรมดาทั่วไป อัตราทารกในครรภ์เสียชีวิตเป็นตัวชี้วัดที่สำคัญของคุณภาพของการดูแลสุขภาพ ปัจจัยอื่นที่สัมพันธ์กับทารกในครรภ์เสียชีวิตคือ มารดาอายุมาก เชื้อชาติ non-Hispanicblack race ครรภ์แรกหรือเป็น multiparity(มากกว่า 5 ครรภ์) ไม่ได้สมรถ ด้อยเศรษฐานะ ด้อยการศึกษา ครรภ์แฝด การใช้เทคโนโลยีช่วยเจริญพันธุ์(assisted reproductive technology) และเคยมีประวัติทางสูติศาสตร์ เช่น เคยทารกในครรภ์เสียชีวิตมาก่อน คลอดทารกก่อนกำหนด หรือทารกโตช้า(5-8) ความอ้วน การสูบบุหรี่ การใช้สารเสพติด และการดื่มสุรา ถือเป็นความเสี่ยงทารกในครรภ์เสียชีวิตที่แก้ไขได้ ยาปราบศัตรูพืช การได้รับรังสี และยาช่วยเจริญพันธ์ สัมพันธ์กับทารกในครรภ์เสียชีวิตด้วยเช่นกัน ในประเทศกำลังพัฒนาสาเหตุของทารกในครรภ์เสียชีวิตที่พบบ่อยที่สุดเกิดจากภาวะแทรกซ้อนของการคลอดบุตรและการติดเชื้อ ระยะการคลอดผิดปกติ ครรภ์เป็นพิษ การดูแลภาวะฉุกเฉินทางสูติศาสตร์แบบพื้นฐาน การคลอดในสถานที่ที่พร้อมและสามารถผ่าตัดคลอดได้อย่างปลอดภัย การปรับปรุงโภชนาการ และการป้องกันและรักษาโรคซิฟิลิสและมาลาเรียเป็นการแทรกแซงที่เป็นไปได้และคุ้มค่ามากที่สุดในประเทศกำลังพัฒนาเพื่อลดอุบัติการณ์ของทารกในครรภ์เสียชีวิต ในขณะที่ประเทศพัฒนาแล้วสาเหตุทารกในครรภ์เสียชีวิตเกิดจากความผิดปกติหรือพิการของทารก โครโมโซมผิดปกติ ปัญหาจากรกที่สัมพันธ์ทารกโตช้าในครรภ์ และโรคทางอายุรกรรมของมารดา
Biologic marker
ปัจจุบันยังไม่มีการคัดกรองที่ดีในการประเมินความเสี่ยงของทารกในครรภ์เสียชีวิตในประชากรทั่วไป การทดสอบในสตรีตั้งครรภ์ที่อาจแสดงให้เห็นถึงค่าในการคำนายภาวะนี้ได้คือ
• โปรแกรมการคัดกรอง Down’s syndrome ถ้าผิดปกติ สามารถทำนายผลการตั้งครรภ์ที่ไม่ดีรวมถึงทารกในครรภ์เสียชีวิตได้
• ภาวะเลือดข้น (hemoconcentration) สัมพันธ์กับทารกในครรภ์เสียชีวิต การเพิ่มปริมาณน้ำเลือด (plasma volume expansion) และการลดลงของความเข้มข้น hemoglobin พบในการตอบสนองทางสรีรวิทยา (physiologic response) ต่อการตั้งครรภ์ การเพิ่มปริมาณน้ำเลือดพบว่าเป็นส่วนสำคัญสำหรับการเจริญเติบโตของทารก และภาวะล้มเหลวของ hemodilutionสัมพันธ์กับการเพิ่มเสี่ยงของทารกในครรภ์เสียชีวิต แม้ว่าไม่เกิดทารกโตช้าในครรภ์ จากข้อมูลการศึกษาของสวีเดน พบว่าระดับ hemoglobin จากการเจาะเลือดก่อนคลอดตั้งแต่ระยะแรก แล้วได้ค่าตั้งแต่ 14.6 g/dLรวมกับมีภาวะล้มเหลวของ hemodilution ตลอดการตั้งครรภ์ เพิ่มความเสี่ยงของทารกในครรภ์เสียชีวิต (OR 2.0, 95% CI 1.1-3.8) หลังจากแยกภาวะครรภ์เป็นพิษออกแล้ว
ทารกในครรภ์เสียชีวิตไม่ทราบสาเหตุ (Unexplained fetal death)
คือทารกในครรภ์เสียชีวิตที่ไม่สามารถระบุได้ว่ามาสาเหตุมาจาก ทารก รก มารดา หรือภาวะทางสูติศาสตร์ พบได้ร้อยละ 25 ถึง 60 ของทารกในครรภ์เสียชีวิตทั้งหมด ซึ่งความแตกต่างของอัตราที่พบนี้ขึ้นอยู่กับการประเมินหาสาเหตุและระบบการจัดประเภท ที่อายุครรภ์ใกล้ครบกำหนดจะพบทารกเสียในครรภ์เสียชีวิตไม่ทราบสาเหตุมากกว่าที่อายุครรภ์น้อยกกว่า เช่นการศึกษาที่พบว่า สองในสามของทารกเสียชีวิตไม่ทราบสาเหตุพบว่ามีอายุครรภ์มากกว่า 35 สัปดาห์ อีกการศึกษาพบอัตราทารกเสียชีวิตไม่ทราบสาเหตุที่อายุครรภ์ 40 สัปดาห์เป็นสองเท่าเมื่อเปรียบเทียบกับกลุ่มอายุครรภ์ที่น้อยกว่า จากการศึกษา
ตาราง 1.1 ความสัมพันธ์ ความเสี่ยงและสาเหตุของทารกในครรภ์เสียชีวิต
|
Maternal risk factors |
Fetal risk factors |
|
Chronic hypertension |
Congenital malformations (15-20%) |
|
Preeclampsia |
Chromosome abnormalities (8-13%): Turner’s |
|
Diabetes mellitus, thyroid disorder |
syndrome, trisomy 21, trisomy 18, and trisomy 13 |
|
Renal disease |
Single gene disorder: Hemoglobinopathies, metabolic |
|
Systemic lupus erythematosus |
diseases (Smith-Lemli-Opitz syndrome) |
|
Autoimmune disease |
Glycogen storage diseases |
|
Antiphospholipid syndrome |
Peroximal disorders amino acid disorders |
|
Cholestasis of pregnancy |
Confined placental mosaicism |
|
Alloimmunization |
Placental abruption, placenta and vasa previa |
|
Obesity |
Placental pathology |
|
Substance abuse (especially cocaine, alcohol, coffee >3 cups/day, etc.) |
Chronic villitis Massive chorionic intervillositis |
|
Smoking |
Complications of multifetal gestation (e.g. TTTS, |
|
Viral infection: Parvovirus B19 Cytomegalovirus Enterovirus (e.g., coxsackie virus) Echovirus HSV-1, HSV-2 HIV Bacterial infection: Listeria monocytogenes Escherichia coli Ureaplasmaurealyticum Treponemapallidum |
TRAPS, discordant growth) Umbilical cord complications, fetomaternal hemorrhage Fetal growth restriction Uteroplacental insufficiency Intrauterine asphyxia Preterm labor or rupture of membrane Postterm |
|
Parasitic infection: Toxoplasma gondii |
|
|
Uterine malformations |
|
|
Abdominal trauma |
|
|
(ที่มาMaternal-fetal evidence based guidelines 2nd ed. Informa Healthcare 2012) |
|
ทารกในครรภ์เสียชีวิตไม่ทราบสาเหตุได้รายงานปัจจัยเสี่ยงอิสระ (independent risk factor) จากมารดาที่มีน้ำหนักมากกว่า 68 กิโลกรัม (OR 2.9; 95% CI 1.85-4.68) อัตราส่วนน้ำหนักทารกต่อน้ำหนักเฉลี่ยตามอายุครรภ์ที่ได้ค่าระหว่าง 0.75 ถึง 0.85(OR 2.77; 95% CI 1.48-5.18) หรือได้ค่ามากกว่า 1.15 (OR 2.36; 95% CI 1.26-4.44) ตั้งครรภ์ที่สามขึ้นไป (OR 2.01; 95% CI 1.26-3.20) ตั้งครรภ์แรก (OR 1.74; 95% CI 1.26-2.40)สายสือผูกเป็นห่วง (cord loop; OR 1.75; 95% CI 1.04-2.97) ด้อยเศรษฐานะ (OR 1.59; 95% CI 1.14-2.22) การศึกษานี้ได้แยกทารกในครรภ์เสียชีวิตที่มีน้ำหนักน้อยกว่าเปอร์เซนไทล์ที่ 10 ว่าเป็นทารกในครรภ์เสียชีวิตไม่ทราบสาเหตุแม้ว่าไม่ทราบสาเหตุทารกโตช้าในครรภ์
ทารกโตช้าในครรภ์/รกทำงานผิดปกติ (Fetal growth restriction/placental dysfunction)
รกทำงานผิดปกติเชื่อว่าเป็นสาเหตุของทั้งทารกโตช้าในครรภ์และเสียชีวิต ความเสี่ยงโดยประมาณของทารกโตช้าในครรภ์คิดเป็น 5ถึง 7 เท่าของความเสี่ยงในทารกที่เจริญเติบโตปกติ การศึกษาในประเทศนอร์เวย์พบอายุครรภ์เฉลี่ยจากจากสาเหตุนี้อยู่ที่ 35 สัปดาห์ภาวะที่เป็นมาจากรกทำงานผิดปกติเกิดซ้ำในครรภ์ต่อไปได้ แต่ลักษณะภาวะแทรกซ้อนแสดงออกออกมาได้หลายรูปแบบในครรภ์ต่างๆ เช่น ทารกโตช้า คลอดก่อนกำหนด และทารกในครรภ์เสียชีวิต ความเสี่ยงของทารกในครรภ์เสียชีวิตจะพบสูงขึ้นในทารกที่ภาวะ SGA ก่อนกำหนด และรกทำงานผิดปกติสัมพันธ์กับภาวะหรือโรคทางอายุรกรรมของมารดา
รกลอกตัว (Abruptio placenta)
พบได้ประมาณร้อยละ 1 ในการตั้งครรภ์ทั่วไปแต่จะสูงร้อยละ 10 ถึง 20 ในทารกในครรภ์เสียชีวิต ความเสี่ยงสูงที่สุดเมื่อรกมีพื้นที่ลอกตัวมากกว่าร้อยละ 50 หรือบริเวณลอกตัวอยู่บริเวณตรงกลางของรก
ภาวะติดเชื้อ (Infection)
พบประมาณครึ่งหนึ่งของทารกในครรภ์เสียชีวิตในกลุ่มประเทศที่มีรายได้ต่ำถึงปานกลางและร้อยละ 10 ถึง 25 ในประเทศที่มีรายได้สูง ภาวะติดเชื้อเป็นสาเหตุของการคลอดก่อนกำหนดมากกว่าทารกในครรภ์เสียชีวิตครบกำหนด ภาวะติดเชื้ออาจนำไปสู่ทารกเสียชีวิตจากการเจ็บป่วยรุนแรงของมารดา เช่น ไข้หวัดใหญ่ รกทำงานผิดปกติจากรกติดเชื้อ เช่น มาลาเรีย หรือทารกติดเชื้อเอง เช่น Escherichia coli ทารกสามารถรับเชื้อโรคผ่านทางรกจากเชื้อโรคที่กระจายผ่านทางกระแสเลือด (hematogenous dissemination) หรือผ่านทางปากมดลูกที่ติดเชื้อขึ้นมากจากเชื้อโรคบริเวณทางเดินอวัยวะสืบพันธ์ช่วงล่าง สำหรับไวรัสถือเป็นเชื้อโรคที่ติดต่อทางเลือดผ่านมาทางรกมากที่สุด แบคทีเรีย สไปรูคิต เชื้อรา และโปรโตซัวสามารถติดเชื้อทางนี้ได้เช่นกัน การติดเชื้อ CMV พบได้ทั่วไปและควรพิจารณาในทารกในครรภ์เสียชีวิตที่ไม่ทราบสาเหตุหลังจากชันสูตรแล้ว การวินิจฉัยภาวะในครรภ์เสียชีวิตเนื่องมาจากภาวะติดเชื้อยังไม่มีชัดเจน เพื่อที่จะระบุภาวะติดเชื้อได้ควรมีหลักฐานทางเนื้อเยื่อ (histological evidence) ของการติดเชื้อรกและทารก ส่วนใหญ่ทารกในครรภ์เสียชีวิตที่เกี่ยวกับภาวะติดเชื้อตามหลังถุงน้ำคร่ำแตก ภาวะติดเชื้อนี้ขึ้นมากจากเชื้อโรคบริเวณทางเดินอวัยวะสืบพันธ์ช่วงล่าง มาลาเรียเป็นสาเหตุทารกเสียชีวิตจากภาวะติดเชื้อที่พบได้ในแหล่งที่มีมาลาเรียระบาด พาร์โวไวรัสCMV ท็อกโซพลาสมา ลิสเตอเรีย และไวรัสเริมถือเป็นเชื้อโรคที่เป็นสาเหตุที่ทราบกันในปัจจุบัน หลายการศึกษาพบว่าสตรีที่คลอดทารกในครรภ์เสียชีวิตไม่ทราบสาเหตุ มีจำนวน memory T cell (CD45RO) สูงกว่า naïve T cell (CD45RA) เมื่อเปรียบเทียบกับสตรีที่คลอดทารกมีชีพ ผลการศึกษานี้แสดงให้เห็นว่า ทั้งที่ขาดหลักฐานที่แสดงการติดเชื้ออย่างมีนัยสำคัญทางคลินิกใดๆ มาก่อน ในกลุ่มสตรีเหล่านี้ได้เคยมีการสัมผัสต่อเชื้อโรคที่อาจแสดงออกมาเป็นบทบาทในทารกเสียชีวิต นอกจากนี้ การไม่แสดงลักษณะการตอบสนองการอักเสบของทารก (fetal inflammatory response) ในกรณีที่มีการติดเชื้อในน้ำคร่ำ (chorioamnionitis) ในทารกเสียชีวิตไม่ทราบสาเหตุอาจจะสะท้อนให้เห็นว่าทารกไม่สามารถการตอบสนองทางระบบภูมิคุ้มกัน (immune response) ได้เพียงพอต่อการกระตุ้นให้เกิดการคลอด การคำอธิบายนี้จึงเป็นสาเหตุทารกในครรภ์เสียชีวิต มีการศึกษาที่สอดคล้องได้ทำการศึกษาทารกเสียชีวิตในครรภ์ที่มีผลชิ้นเนื้อที่ยืนยันการติดเชื้อในน้ำคร่ำ 158 รายไม่พบการตอบสนองการอักเสบของทารก 101 ราย คิดเป็นร้อยละ 64 ซึ่งทารกเหล่านี้ค่อนข้างที่จะสัมพันธ์กับทารกในครรภ์เสียชีวิตไม่ทราบสาเหตุก่อนการเจ็บครรภ์คลอด
ความผิดผิดปกติของโครโมโซมและพันธุกรรม (Chromosome and genetic abnormalities)
Aneuploidy ส่วนใหญ่เป็นของสาเหตุของทารกในครรภ์เสียชีวิต บาง aneiploidyเช่น trisomy 21, 18, 13 และ Turner’s syndrome (monosomy X) นอกจากนี้ unbalanced translocation เป็นสาเหตุได้เช่นกันเพิ่มความเสี่ยงของทารกในครรภ์เสียชีวิตแต่ก็สามารถเกิดทารกมีชีพได้ การเสียชีวิตของตัวอ่อน (embryo) หรือทารกในครรภ์จากความผิดปกติของโครโมโซมเกิดขึ้นได้ทุกระยะการตั้งครรภ์ และโดยส่วยใหญ่จะเกิดในการตั้งครรภ์ไตรมาสแรก อัตราทารกในครรภ์เสียชีวิตและทารกแรกเสียชีวิตที่มีโครโมโซมผิดปกติคิดเป็นร้อยละ 6.3 โดยความถี่ความผิดปกติของโครโมโซมในประชากรทารกเกิดมีชีพปกติเป็นร้อยละ 0.7 ทารกในครรภ์เสียชีวิตพบทารกผิดปกติ (fetal anomaly) ร่วมด้วยจะเพิ่มโอกาสโครโมโซมผิดปกติมากขึ้น (ร้อยละ 38) เมื่อเปรียบเทียบกับทารกในครรภ์เสียชีวิตที่ไม่พบความผิดปกติ (ร้อยละ 4.6)Single gene defect, confined placental mosaicismและ microdeletionอาจจะพบได้ในทารกในครรภ์เสียชีวิตถึงแม้ว่าการตรวจโครโมโซมปกติด้วย conventional cytogenetic analysis เทคโนโลยีพันธุศาสตร์ระดับโมเลกุล (molecular genetic technology) อาจช่วยในการระบุสาเหตุในทารกเหล่านี้ได้ confined placental mosacismพบได้ร้อยละ 1 ถึง 2 ของ chorionic villi sampling ร้อยละ 15 ถึง 20 ของการแท้ง ทารกโตช้าในครรภ์และทารกในครรภ์เสียชีวิต
ทารกผิดปกติตั้งแต่กำเนิด (Congenital anomaly)
ร้อยละ 15 ถึง 20 ของทารกในครรภ์เสียชีวิตมี major malformation ร่วมด้วย อัตราความผิดปกติแตกต่างกันไปแต่ละประเทศตามความสามารถมีการทำการวินิจฉัยก่อนคลอด (prenatal diagnosis) และยุติการตั้งครรภ์ ความผิดปกติที่สัมพันธ์กับทารกเสียชีวิตแต่ไม่เกี่ยวกับโครโมโซมผิดปกติที่พบได้ เช่น ผนังหน้าท้องผิดปกติ (abdominal wall defect), ท่อประสาทผิดปกติ (neural tube defect), Pottery syndrome, achondrogenesisหรือ amniotic band syndrome ทารกในครรภ์เสียชีวิตจากความผิดปกติของร่างกายทารกก็ต่อเมื่อมีข้อมูลทางระบาดวิทยาสนับสนุนความสัมพันธ์ ความผิดปกตินี้พบได้น้อยมากในทารกเกิดมีชีพ ทารกแรกเกิดที่พบว่าผิดปกตินี้แล้วเสียชีวิต หรือมีเหตุผลทางชีววิทยาที่สามารถอธิบายความสัมพันธ์นี้ได้
ภาวะเลือดทารกเข้าสู่ระบบไหลเวียนโลหิตของมารดา (Fetomaternal hemorrhage)
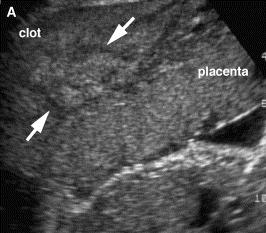
พบได้มากว่าเป็นสาเหตุของทารกในครรภ์เสียชีวิตถึงร้อยละ 5 โดยปกติแล้วไม่สามารถระบุสาเหตุของภาวะนี้ได้ อย่างไรก็ตามบางรายพบว่าสัมพันธ์กับรกลอกตัว, vasa previa, choriocarcinoma, มารดาประสบอุบัติเหตุ, การกลับศีรษะทารก (cephalic version), และการเจาะถุงน้ำคร่ำ (amniocentesis)
ภาวะแทรกซ้อนของสายสะดือ (Umbilical cord complication)
ภาวะแทรกซ้อน เช่น สายสะดือพันคอ (nuchal cord), สายสะดือผูกกัน (knot), ความผิดปกติภายในสายสะดือ พบได้บ่อยว่าเป็นตำแหน่งที่สาเหตุของทารกในครรภ์เสียชีวิตในไตรมาสสาม ถึงแม้ว่าสายสะดือพันคอและสายสะดือผูกกันเป็นสาเหตุที่ได้บ่อย แต่เส้นเลือดสายสะดือหดตัวรุนแรง (severe cord contriction) จะทำให้ทารกในครรภ์เสียชีวิตได้ การพบสายสะดือพันคอและสายสะดือผูกกันอาจทำให้แพทย์และผู้ป่วยสามารถอธิบายสาเหตุการเสียชีวิตของทารกได้ทันที การที่จะกล่าวได้ว่าสาเหตุการเสียชีวิตเกิดจากภาวะแทรกซ้อนของสายสะดือ ก็ต่อเมื่อหาสาเหตุอื่นอย่างละเอียดถี่ถ้วนและมีผลของการสืบค้นอื่นอื่นๆ สนับสนุนการวินิจฉัยนี้ ภาพถ่ายทารกร่วมกับสายสะดือ เช่นขณะสายสะดือพันคอสามารถช่วยในการประเมินได้
ครรภ์แฝดน้ำ (Hydropsfetalis)
อาจจะมีสาเหตุมาจาก immune และ nonimmuneและเป็นสาเหตุของทารกเสียชีวิต
Platelet alloimmunization
ภาวะนี้ ถ้ารุนแรงสามารถเป็นสาเหตุทำให้เลือดออกในสมอง (intracranial hemorrhage) และการเสียชีวิตได้
ความผิดปกติของรก (Placental disorder)
การตรวจรกทั้งทางภายวิภาคและจุลภาคเป็นส่วนสำคัญของการหาสาเหตุทารกในครรภ์เสียชีวิต สาเหตุจากรกรวมถึงรกลอกตัว, vasa previa, รกติดเชื้อ, confined placental mosacism, เนื้องอก, โครงสร้างและหลอดเลือดผิดปกติ, ความผิดปกติของเส้นเลือด (vasculopathy) และการขาดเลือด (infarction) รกขนาดเล็กสัมพันธ์กับทารกโตช้าในครรภ์ และรกขนาดใหญ่สัมพันธ์กับทารกตัวโต สาเหตุทางพยาธิวิทยาของรกขนาดใหญ่พบใน ครรภ์แฝดน้ำ มารดาเป็นเบาหวาน และซิฟิลิส ซึ่งยังเป็นสาเหตุของทารกในครรภ์เสียชีวิตอีกด้วย
ภาวะผิดปกติของมดลูก (Uterine condition)
ภาวะของรกที่พบมากที่สุดที่สัมพันธ์กับทารกในครรภ์เสียชีวิตคือมดลูกแตก (uterine rupture) สาเหตุอื่นๆ ที่ทำให้ลดการไหลเวียนของโลหิตระหว่างมดลูกและรก (impaired uteroplacental blood flow) สามารถนำไปสู่ทารกในครรภ์เสียชีวิต แต่การแท้งและคลอดก่อนกำหนดพบว่าเป็นผลมากจากความผิดปกติของรกได้บ่อยกว่า
มารดาสูงอายุ (Advanced maternal age)
มารดาสูงอายุถือเป็นปัจจัยเสี่ยงอิสระ (independent risk factor) สำหรับทารกในครรภ์เสียชีวิต โรคทางอายุรกรรมที่พบได้บ่อยขึ้นในสตรีสูงอายุ เช่น ความดันโลหิตสูง เบาหวาน ซึ่งทั้งหมดเหล่านี้สัมพันธ์กับการเพิ่มขึ้นของความเสี่ยงของทารกในครรภ์เสียชีวิต ปัจจุบันนี้ทารกในครรภ์เสียชีวิตที่พบบ่อยกว่าปกติในสตรีตั้งครรภ์สูงอายุคือทารกในครรภ์เสียชีวิตไม่ทราบสาเหตุ
ความอ้วน (Obesity)
การตั้งครรภ์ที่มีน้ำหนักมาก (BMI มากกว่า 30 กิโลกรัม/ตารางเมตร)เพิ่มความเสี่ยงต่อทารกในครรภ์เสียชีวิตโดยเฉพาะในช่วงท้ายของการตั้งครรภ์ เหตุผลยังไม่ทราบแน่ชัด อาจจะเนื่องมาจาก พฤติกรรม สังคมเศรษฐกิจ และปัจจัยทางสูติกรรม
ครรภ์แฝด (Multiple gestation)
อัตราทารกในครรภ์เสียชีวิตมากกว่าการตั้งครรภ์เดี่ยวเนื่องมากจากภาวะแทรกซ้อนที่จำเพาะต่อการตั้งครรภ์แฝด เช่น twin-twin transfusion syndrome, twin reverse arterial perfusion sequence, ทารกผิดปกติ, ทารกโตช้าในครรภ์ การลดจำนวนของตัวอ่อน (embryo) ขณะทำ IVF หรือลดจำนวนทารกในครรภ์แฝด จะช่วยลดจำนวนของทารกในครรภ์เสียชีวิตที่เกี่ยวกับครรภ์แฝด
การสูบบุหรี่ (Smoking)
เพิ่มความเสี่ยงจากการสูบบุหรี่ 1.2 ถึง 1.4 เท่า
โรคทางอายุรกรรมของมารดา (Maternal medical disorder)
ความดันโลหิตสูงและเบาหวานเป็นโรคที่พบบ่อยที่สุดที่ทำให้เกิดภาวะแทรกซ้อนระหว่างตั้งครรภ์ และเพิ่มความเสี่ยงของทารกในครรภ์เสียชีวิต นอกจากนี้ยังมีโรคอื่นๆ เพิ่มความเสี่ยง เช่น โรคไต, SLE, thrombophilia, โรคไทรอยด์, โรคหัวใจ, การติดเชื้อ, หอบหืด, cholestasis เป็นต้น
การป้องกัน (Prevention)
บางสาเหตุตามตาราง 1.1 โดยเฉพาะความอ้วน การสูบุหรี่ การใช้สารเสพติด และการดื่มสุรา สามารถแก้ไขหรือควรหลีกเลี่ยง ส่วนใหญ่ทารกในครรภ์เสียชีวิตเกิดในประเทศกำลังพัฒนา การแทรกแซงควรเน้นในเรื่องของการป้องกัน รวมถึงข้อแนะนำดังต่อไปนี้(9)
- เสริมการให้โฟเลตทั้งก่อนและขณะตั้งครรภ์
- ป้องกันและรักษาโรคมาลาเรีย
- ค้นหาและรักษาโรคซิฟิลิส
- ค้นหาและรักษาภาวะความดันโลหิตสูง
- ค้นหาและรักษาเบาหวานระหว่างตั้งครรภ์
- ค้นหาและรักษาภาวะทารกโตช้า
- ชักนำคลอดตั้งแต่อายุครรภ์ 41 สัปดาห์ เพื่อป้องกันภาวะตั้งครรภ์เลยกำหนด
- ทักษะการดูแลขณะคลอด
- การดูแลภาวะฉุกเฉินทางสูติศาสตร์แบบพื้นฐานและแบบครอบคลุม
การดูแลระหว่างตั้งครรภ์ (Pregnancy management)
การให้คำปรึกษา (Counseling)
ให้คำปรึกษาในเรื่องสาเหตุที่อาจจะเป็นไปได้ การค้นหาสาเหตุ (ตาราง 1.2) วิธีการคลอด ภาวะแทรกซ้อนที่อาจจะเกิดขึ้น ดูแลสภาพจิตใจความเสียใจของบิดามารดา ทบทวนความเสี่ยงและการป้องกันของการเกิดซ้ำ และดูแลรักษาอย่างดีที่สุดหลังคลอดเพื่อการตั้งครรภ์ในอนาคต (ตาราง 1.3)
ตาราง 1.2 การสืบค้นสาเหตุของทารกในครรภ์เสียชีวิต
|
Predelivery |
Postdelivery |
|
Amniotic fluid for cytogenetics |
Cord blood for cytogenetics |
|
Screen for coagulopathy (fetal death > 4 weeks) |
Autopsy and placental examination |
|
CBC, antibody screen, urine drug screen |
Protein C, protein S activities |
|
Kleihauer-Betke testing of flow cytometry |
(thrombophilia workup) |
|
Lupus anticoagulant, anticardiolipin antibodies (IgM,IgG) |
|
|
and anti-B2-glycoprotein antibodies (IgM,IgG) |
|
|
Parvovirus B19 titers (IgM,IgG) |
|
|
Syphilis testing |
|
|
TSH |
|
|
OGTT, HbA1C |
|
|
Thrombophilia in cases of severe placental infarction, |
|
|
fetal growth restriction, history of thrombosis (factor V |
|
|
Leiden mutation, prothrombin gene mutation, |
|
|
antithrombin III) |
|
|
(ที่มาMaternal-fetal evidence based guidelines 2nd ed. Informa Healthcare 2012) |
|
การสืบค้น (Workup)
การประเมินหาสาเหตุของทารกในครรภ์เสียชีวิตถือเป็นสิ่งจำเป็นต่อการให้คำปรึกษาเกี่ยวกับความเสี่ยงในการเกิดซ้ำในครรภ์ต่อไป การช่วยเหลือเกี่ยวกับปัญหาหรือความเสียใจของบิดามารดา และช่วยเพิ่มความเข้าใจในการสืบค้นและรักษา(ตาราง 1.2)(3,10-12) การประเมินควรร่วมกันหลากหลายสาขา เช่น สูติแพทย์ แพทย์เฉพาะทางเวชศาสตร์มารดาและทารก พยาธิแพทย์ นักพันธุศาสตร์ รังสีแพทย์ และแพทย์เฉพาะทางทารกแรกเกิด การสื่อสารระหว่างบิดามารดาและผู้ร่วมงานสาขาอื่นถือเป็นสิ่งที่สำคัญ ถ้าทารกเสียชีวิตมีชื่อควรเรียกชื่อแทนทารกนั้น บิดามารดาควรได้รับข้อมูลเกี่ยวกับเหตุผลในการชันสูตรศพ(autopsy) กระบวนการสืบค้นต่างๆ ร่วมถึงค่าใช้จ่ายและความคุ้มค่าจำเป็น ขั้นตอนสำคัญที่สุดของการประเมินหาสาเหตุทารกในครรภ์เสียชีวิตคือ การชันสูตรศพ การตรวจดูรก สายสะดือ และเยื่อรก (membrane) และ karyotype analysis
การประเมินอย่างครบถ้วนสมบูรณ์ควรประกอบไปด้วย(3)
- ทบทวนประวัติที่สำคัญได้แก่ ประวัติมารดา ประวัติระยะคลอด (perinatal) ประวัติครอบครัว และปัจจัยเสี่ยงเพื่อระบุสาเหตุที่อาจจะเป็นไปได้ตามตาราง 1.1 ประวัติครอบครัวควรสนใจในเรื่องประวัติการแท้งบุตร โรคที่ถ่ายทอดทางพันธุกรรม ประวัติสติปัญญาถดถ้อย (mental retardation)ประวัติเบาหวาน ประวัติความผิดปกติแต่กำเนิดในช่วงสามรุ่น
- ก่อนคลอด อาจจะพิจารณาทำ detailed ultrasound, fetal echocardiogram, 3D ultrasound, whole-body X ray หรือ MRI ควรเลือกทำการสืบค้นเหล่านี้ถ้าไม่สามารถส่งทารกชันสูตรได้ การทำ karyotype analysis จากทารกหลังคลอดพบว่าร้อยละ 50 จะไม่ได้ผลเนื่องจากการเพาะเลี้ยงเซลล์ล้มเหลว (cell culture failure)เพื่อเพิ่มโอกาสการเพาะเลี้ยงเซลล์ การทำ amniocentesis หรือ chorionic villi sampling เพื่อดู karyotype และการติดเชื้อทารกร่วมด้วย ถึงแม้ว่าร้อยละ 5-10 ของเซลล์ที่ได้จากน้ำคร่ำของทารกที่เสียชีวิตไม่สามารถเพาะเลี้ยงเพิ่มจำนวนได้ แต่ก็มีโอกาสเพิ่มจำนวนจากการเพาะได้มากกว่า
- ทำการของความยินยอมให้ทำการชันสูตรทารกจากบิดามารดาก่อนคลอด ถ้าบิดามารดาปฏิเสธการชันสูตร ให้ขอความยินยอมชันสูตรเฉพาะส่วน เช่นตรวจภายนอกร่างกายโดยพยาธิแพทย์ หรือตรวจชันสูตรภายในเฉพาะบางอวัยวะ เช่น สมอง อวัยวะในช่องอก หรืออวัยวะในช่องท้อง ตามความเหมาะสม หรือพิจารณาทำ MRI แทน
- ขณะคลอด ตรวจทารกและรกอย่างละเอียด โดยตรวจทันทีหลังคลอด สังเกตดูส่วนที่มีความผิดปกติ ชั่งน้ำหนัก วัดความสูง และวัดความยาวรอบศีรษะ ถ่ายภาพทั้งร่างกาย ทางด้านหน้าและรายละเอียดในส่วนของใบหน้า รยางค์ และฝ่ามือ ถ่ายภายระยะใกล้ในส่วนที่มีความผิดปกติ ชั่งน้ำหนักรกและเปรียบเทียบค่ามาตรฐานที่อายุครรภ์นั้นๆ
- ก่อนชันสูตรทารก ควรทำ karyotype analysis หลังได้รับความยินยอมจากบิดามารดา พบความผิดปกติของโครโมโซมได้มากขึ้นในทารกที่มีภาวะโตช้าในครรภ์ พบความผิดปกติของร่างกาย ทารกบวมน้ำ (hydrops) หรือบิดามารดเป็นพาหะของโครโมโซมผิดปกติแบบ balanced translocation หรือ mosaic karyotypeเนื้อเยื่อรกเป็นเนื้อเยื่อที่เหมาะสมสำหรับการตรวจcytogenetic หรือ molecular genetic studies โดยตัดเนื้อเยื่อรกบริเวณใต้ตำแหน่งที่สายสะดือมาเกาะรกหรือใกล้กับตำแหน่งสายสะดือเกาะมาขนาด 1 x 1 ตารางเซนติเมตรหรือตรวจจากโดยบริเวณผิวรกควรทำความสะอาดด้วยเบตาดีนหรือฮิบิเทนก่อนตัดชิ้นเนื้อออกมา เนื้อเยื่อกระดูกอ่อนจากบริเวณ costochondral junction หรือ กระดูกสะบ้า (patella) เนื้อเยื่อรกยังสามารถส่งตรวจ karyotype เพื่อใช้ตรวจสอบ confined placental mosaicismจากนั้นนำเนื้อเยื่อแช่ในสารละลาย Hanks ที่เป็นสารละลายสีชมพู ถ้าไม่มีใช่แช่ใน normal saline ห้ามแช่ในสารละลายฟอร์มาลิน ในกรณีที่ไม่สามารถเพราะเลี้ยงเซลล์ได้สำเร็จ การใช้เทคนิค fluorescent in situ hybridization (FISH) ที่ใช้ตรวจหา aneuploidy หรือ comparative genomic hybridization (cGH) ที่ตรวจหา small deletion หรือ duplication ในเซลล์ที่ไม่มีชีวิตได้ การตรวจสอบสาเหตุทารกในครรภ์เสียชีวิตที่พบได้น้อยเช่น single gene disorder ควรเลือดทำในรายที่มีลักษณะทางคลินิกสงสัยหรือมีประวัติครอบครัว
- การชันสูตรถือเป็นการทดสอบที่น่าเชื่อถือมากที่สุดในการระบุสาเหตุของทารกในครรภ์เสียชีวิต ไม่เพียงแต่ตรวจความผิดปกติของทารก ยังสามารถช่วยยืนยันภาวะติดเชื้อ, ภาวะซีด, ภาวะขาดออกซิเจน (hypoxia) และ metabolic abnormalities ที่เป็นสาเหตุการเสียชีวิต การชันสูตรช่วยลดจำนวนทารกในครรภ์เสียชีวิตแบบไม่ทราบสาเหตุได้อย่างน้อยร้อยละ 10 ผลของการชันสูตรสามารถเปลี่ยนแปลงการให้คำปรึกษาและความเสี่ยงในการเกิดซ้ำในครรภ์ต่อไปได้ร้อยละ 26 ควรประมาณระยะเวลาเริ่มเสียชีวิตจนคลอดข้อมูลทางคลินิก บันทึกผล ultrasound และความต้องการพิเศษควรมอบให้หรือแจ้งแก่พยาธิแพทย์ บางที่แนะนำให้สูติแพทย์โทรหาพยาธิแพทย์เพื่อช่วยกันวิเคราะห์
- ส่ง รก เยื่อรก และสายสะดือเพื่อตรวจลักษณะโดยรวมและตรวจทางจุลพยาธิวิทยาบางภาวะอาจเป็นสาเหตุหรือช่วยให้เกิดทารกในครรภ์เสียชีวิตอาจได้รับการวินิจฉัยจากรกและสายสะดือ เช่น รกลอกตัว (abruption),รกขาดเลือด (placental infarction),ลิ่มเลือดอุดตันในสายสะดือ (umbilical cord thrombosis),velamentous cord insertion หรือ vasa previaการตรวจรกได้ข้อมูลที่สำคัญเพิ่มขึ้นเกี่ยวกับ ภาวะติดเชื้อ, ความผิดปกติทางพันธุกรรม, ภาวะซีด และ thrombophilia สายสะดือให้สังเกตหา knot อาจสบสันกับ cord entanglement ได้ซึ่งพบได้ในครรภ์ปกติ ร้อยละ 30การตรวจลักษณะเส้นเลือดของรกและเยื่อรกมีประโยชน์โดยเฉพาะในการตั้งครรภ์แฝด
- ถ้าการตรวจพบพยาธิสภาพที่รกหรือมีประวัติสงสัยการติดเชื้อ อาจส่งตรวจเลือดแม่และลูกหาการติดเชื้อ ส่งย้อมพิเศษ หรือตรวจหา nucleic acid ของแบคทีเรียหรือไวรัส แต่ถ้าไม่มีประวัติหรือไม่สงสัยการติดเชื้อยังไม่เป็นที่สรุปว่าการส่งตรวจหาการติดเชื้อเป็นประจำจะมีประโยชน์หรือไม่
- การตรวจเลือดมารดา (ตาราง 1.2)
-
- Kleihauer-Betke testหรือ flow cytometryเพื่อประเมินภาวะ feto-maternal hemorrhage (ส่งตรวจก่อนคลอด)
- Lupus anticoagulant, anticardiolipin antibodies (IgM,IgG), anti-B2-glycoprotein antibodies (IgM,IgG) เพื่อทดสอบภาวะ antiphospholipid syndrome การตรวจพบ titer ของlupus anticoagulant หรือanticardiolipin antibodies ระดับปานกลางถึงสูง (มากกว่า 40 IgM binding/IgG binding หรือมากกว่า 99 percentile) หรือanti-B2-glycoprotein antibodiestiter(มากกว่า 99 percentile) ถือว่าทั้งหมดนี้ให้ผลเป็นบวก (positive)แต่ควรยืนยันโดยตรวจซ้ำอีก 12 สัปดาห์ถัดไป
- Parvovirus B19 titer (IgM,IgG) พิจารณาส่งเฉพาะในรายที่สงสัย เช่น พบว่าเป็นทารกบวมน้ำ หรือทารกมีภาวะซีด CMV toxoplasmosis และไวรัสหรือแบคทีเรียอื่นๆไม่แนะนำให้ส่งตรวจถ้าไม่มีประวัติหรือผลตรวจพยาธิที่บ่งชี้ว่ามีการติดเชื้อ
- ซิฟิลิสให้ส่งตรวจด้วย RPP หรือ VDRL
- คัดกรองเบาหวาน (OGTT, HbA1C) ทำในรายที่ยังไม่ได้ตรวจคัดกรองระหว่างตั้งครรภ์
- สืบค้นภาวะ Thrombophilia ควรส่งตรวจเฉพาะในรายที่มีพยาธิสภาพของรกที่รุนแรง ทารกโตช้าในครรภ์ หรือมีประวัติส่วนตัว ประวัติบิดามารดา พี่น้องหรือลูกเป็นลิ่มเลือดอุดตัน (thrombosis)
10. พิจารณาสืบค้นสาเหตุอื่น ขึ้นกับปัจจัยเสี่ยงที่พบตามตาราง 1.1
ตาราง 1.3 การดูแลรักษาในครรภ์ต่อไปหลังจากทารกในครรภ์เสียชีวิต
|
Preconception or initial prenatal visit |
Second trimester |
|
Detailed medical and obstetrical history |
Fetal anatomic survey at 18 to 20 wk |
|
Evaluation/workup of previous stillbirth |
Quadruple screen: MSAFP, hCG, estriol, and |
|
Determination of recurrence risk |
inhibin-A |
|
Discussion of increased risk of other obstetrical |
Uterine artery Doppler studies at 22 to 24 wk |
|
complications |
Support and reassurance |
|
Smoking cessation |
Third trimester |
|
Weight loss (back to normal BMI) in obese women |
Serial ultrasounds about every 4 wk to rule out |
|
Genetic counseling if family genetic condition exists |
fetal growth restriction, starting at 28 wk |
|
Support and reassurance |
Fetal movement counting staring 28 wk |
|
First trimester |
Antepartum fetal surveillance (e.g. nonstress |
|
Dating ultrasound by crown-lump length (first |
test or biophysical profile) starting at 32 wk or |
|
trimester) |
1 to 2 wk earlier prior to gestational age of |
|
First trimester screen: PAPP-A, hCG, and NT |
previous stillbirth if occurred prior to 32 wk |
|
Diabetes screen |
Support and reassurance |
|
Thrombophilia workup only if stillbirth associated |
Delivery |
|
with severe placental infarcts, fetal growth |
Planned induction at 39 wk, or before 39 wk if |
|
restriction, or in setting of a personal history of |
desired by the couple and lung maturity |
|
thrombosis |
documented by amniocentesis |
|
Support and reassurance |
|
|
(ที่มาMaternal-fetal evidence based guidelines 2nd ed. Informa Healthcare 2012) |
|
การคลอด (Delivery)
เมื่อได้รับการวินิจฉัยแล้ว การให้คำปรึกษาและทางเลือกในการคลอดควรได้รับการสนทนา ทางเลือกในการคลอดได้แก่ การดูแลแบบเฝ้าติดตาม (expectant management)ชักนำคลอด (induction) หรือ การล้วงทารก (dilation and evacuation)
การดูแลแบบเฝ้าติดตาม (Expectant management)
ประมาณร้อยละ 80-90 ของสตรีที่มีทารกในครรภ์เสียชีวิตจะเข้าสู่การเจ็บครรภ์ด้วยตัวเองภายในสองสัปดาห์(13) อัตรามดลูกติดเชื้อ (endomyometritis) จะสูงขึ้นในกลุ่มที่มีการเจ็บคลอดเอง (ร้อยละ 6) เมื่อเปรียบเทียบกับการชักนำคลอด (ร้อยละ 1) ไม่พบความแตกต่างของอัตราการตกเลือดหลังคลอด (postpartum hemorrhage)รกค้าง (retained placenta) หรือความจำเป็นต้องให้เลือด การคงค้างของทารกที่เสียชีวิตในครรภ์สามารถเป็นสาเหตุของ chronic consumptive coagulopathy เนื่องจากมีการปล่อย thromboplastinออกมาอย่างช้าๆ จากรกเข้าสู่ระบบไหลเวียนโลหิตของมารดา โดยปกติภาวะนี้เกิดหลังทารกเสียชีวิตแล้ว 4 สัปดาห์ แต่ก็สามารถเกิดขึ้นเร็วว่านั้นได้ ความผิดปกติของการแข็งตัวของเลือด (coagulation abnormality) พบได้ประมาณร้อยละ 3 ถึง 4 ของผู้ป่วยที่มีทารกในครรภ์เสียชีวิตแบบไม่มีภาวะแทรกซ้อนหลังจาก 4 ถึง 8 สัปดาห์ไปแล้ว และพบมากขึ้นหากมีภาวะรกลอกตัวหรือมดลูกทะลุร่วมด้วย ข้อเสียด้านอื่นๆ ของการดูแลรักษาแบบเฝ้าติดตามคือ ระยะเวลาระหว่างทารกเริ่มเสียชีวิตจนเจ็บครรภ์คลอดเองยาวนาน ทำให้ได้ข้อมูลจากการตรวจหลังคลอดหรือชันสูตรได้จำกัดหรือล่าช้า ยิ่งไปกว่านั้นการดูแลทางจิตใจของสตรีตั้งครรภ์ทารกเสียชีวิตจะยากขึ้น ดังนั้นในผู้ป่วยที่เลือกการรักษาแบบเฝ้าระวังหรือให้เกิดการเจ็บครรภ์คลอดเองโดยเฉพาะระยะเวลาเกิดกว่า 4 สัปดาห์ ควรได้รับการคัดกรองหรือตรวจการแข็งตัวของเลือด (coagulopathy) ได้แก่ ระดับ fibrinogen จำนวนเกร็ดเลือด (platelet) prothrombin time (PT) และ activated partial thromboplastic time (aPTT) ก่อนการทำหัตถการ (invasive procedure)(14)
การล้วงทารก (Dilation and Evacuation)
เมื่อเปรียบเทียบอัตราการเกิดภาวะแทรกซ้อนในผู้ป่วยที่ได้รับหัตถการล้วงทารกกับการใช้ยาชักนำคลอดในช่วงอายุครรภ์ 14 ถึง 24 สัปดาห์ พบว่าการล้วงทารกถือเป็นวิธีที่ปลอดภัยกว่า โดยเฉพาะถ้าทำโดยผู้ที่มีประสบการณ์และร่วมกับทำ ultrasound guidance การยุติการตั้งครรภ์ด้วยวิธีทางศัลยกรรม (surgical termination) ที่อายุครรภ์ระหว่าง 14 ถึง 24 สัปดาห์ พบว่ามีอัตราการเกิดภาวะแทรกซ้อนต่ำกว่า (ร้อยละ 4) เมื่อเปรียบเทียบกับการชักนำคลอด นอกจากนี้การล้วงทารกเป็นไปได้น้อยที่จะล้มเหลวหรือเกิดรกค้าง แต่อย่างไรก็ตามความต้องการได้รับเลือด ภาวะติดเชื้อ ปากมดลูกฉีกขาด การทำลายอวัยวะของมารดา หรือการกลับมาเข้ารักษาตัวในโรงพยาบาลอีกครั้ง (readmission) เท่ากันทั้งสองวิธี(15) จาก Cochrane review เมื่อไม่นานมานี้ได้สรุปว่า การล้วงทารกดีกว่าการใช้ prostaglagin F2a และอาจจะดีกว่า mifespristoneและ misoprostol หากวิเคราะห์ด้านความคุ้มค่าสรุปว่า ในการยุติการตั้งครรภ์ในช่วงไตรมาสที่สอง การล้วงทารกเสียค่าใช้จ่ายน้อยกว่าและมีประสิทธิภาพมากกว่าการชักนำคลอดด้วย misoprostol แต่อย่างไรก็ตามการล้วงทารก ประสิทธิภาพหรือผลการชันสูตรจะลดลง นอกจากนี้การล้วงทารกอาจจำกัดการทำเฉพาะผู้ที่มีประสบการณ์และอายุครรภ์ที่เหมาะ(3) ดังนั้นโดยปกติแล้วการเลือกการคลอดควรขึ้นอยู่กับความต้องการของผู้ป่วย
การชัดนำคลอด (Induction)
การชักนำคลอดในสตรีที่ทารกในครรภ์เสียชีวิตถือเป็นวิธีที่แนะนำ ถ้าผู้ป่วยกังวลปัญหาการจากรักษาแบบเฝ้าระวัง เริ่มการชักนำคลอดได้เมื่อได้การวินิจฉัยว่าทารกในครรภ์เสียชีวิต
กรณีอายุครรภ์ไม่เกิน 28 สัปดาห์
- สามารถเลือกใช้ misoprostol, prostaglandin E2, high-dose oxytocin หรือ hypertonic saline พบว่า misoprostol และ high-dose oxytocin มีความปลอดภัยและประสิทธิภาพดีที่สุด
- จากข้อมูลการศึกษาแบบ RCT สนับสนุนการใช้ vaginal misoprostolเป็นการชักนำคลอดด้วยยาในการยุติการตั้งครรภ์ทารกไม่มีชีวิตที่อายุครรภ์ก่อน 24 สัปดาห์ จากข้อมูลที่มีอยู่น้อย การใช้ misoprostol ในการยุติการตั้งครรภ์ที่อายุครรภ์ 24 ถึง 28 สัปดาห์ พบว่ามีความปลอดภัยและมีประสิทธิภาพ ดังนั้นที่อายุครรภ์ไม่เกิน 28 สัปดาห์การใช้ misoprostol เป็นวิธีชักนำคลอดที่มีประสิทธิภาพที่สุด(3) โดยไม่สนใจ Bishop score โดยทั่วไปขนาดที่ใช้ในการยุติการตั้งครรภ์ใช้ 200 ถึง 400 ไมโครกรัม สอดทางช่องคลอดทุก 4 ถึง 12 ชั่วโมง ซึ่งอัตราความสำเร็จในการคลอดส่วนใหญ่ภายใน 24 ชั่วโมงอยู่ร้อยละ 80 ถึง 100 แต่อย่างไรก็ตามขนาดยาที่มากและการให้ยาที่บ่อย จะเพิ่มผลข้างเคียงจาก misoprostol มากขึ้น
- การให้ high-dose oxytocin ถือเป็นทางเลือกที่ยอมรับได้ในการยุติการตั้งครรภ์ การให้ high-dose oxytocin (oxytocin 200 unit ใน saline 500 มิลลิลิตร ให้อัตรา 50 มิลลิลิตรต่อชั่วโมง) อาจจะนำมาใช้ชักนำคลอดในทารกที่ยังไกลจากครบกำหนด(16) มารดาควรเฝ้าระวังอาการของ water intoxication และความเข้มข้นของเกลือแร่ (electrolyte) โดยติดตามอย่างน้อยทุก 24 ชั่วโมงขณะได้รับ high-dose oxytocinอาการคลื่นไส้และอ่อนเพลียเป็นอาการแรกของภาวะโซเดียมในเลือดต่ำ (hyponatremia) และอาจจะพบระดับความเข้มข้นของโซเดียมในเลือดต่ำกว่า 125 mEq/L ตามมาด้วยอาการปวดศีรษะ ซึมลง ชัก ไม่รู้สึกตัว และหยุดหายใจได้ พบว่าการให้ misoprostol 50 ไมโครกรัมและเพิ่มขนาดเป็นสองเท่าทุก 6 ชั่วโมงจนกว่าการหดรัดตัวของมดลูกดี พบว่าระยะเวลาเฉลี่ยตั้งแต่เริ่มชักนำคลอดจนคลอดทารกจากการให้ oxytocin ยาวนานกว่าจากการให้ misoprostol (23.3 ชั่วโมง ต่อ 12.4 ชั่วโมง) และ misoprostol ราคาถูกว่า oxytocin
- ในอดีตมีการใช้ PGE2 20 มิลลิกรัมเหน็บทางช่องคลอดทุกสี่ชั่วโมงเพื่อช่วยชักนำคลอดก่อนอายุครรภ์ 28 สัปดาห์ ควรลดขนาด PGE2 ลง 5 ถึง 10 มิลลิกรัมในกรณีที่อายุครรภ์มากซึ่งมดลูกจะมีความไวต่อการแตก ผลข้างเคียงที่อาจจะพบได้ เช่น ไข้ คลื่นไส้ อาเจียน และถ่ายเหลว อย่างไรก็ตาม misoprostol ถือว่ามีประสิทธิภาพมากกว่า ปลอดภัยกว่า และราคาถูกกว่า PGE2 ปัจจุบันไม่ได้มีการแนะนำให้ใช้ PGE2 ในการชักนำคลอดที่อายุครรภ์น้อยกว่า 28 สัปดาห์
- Mifepristone (RU 486) เป็น progesterone antagonist จากการศึกษาในการยุติการตั้งครรภ์ทารกในครรภ์เสียชีวิต พบว่า mifepristone สามารถชักนำคลอดและคลอดทารกได้สำเร็จภายใน 72 ชั่วโมงหลังจากเริ่มให้ยาครั้งแรก และ mifepristone สามารถทดต่อการใช้ได้เป็นอย่างดี
กรณีอายุครรภ์เกิน 28 สัปดาห์
สามารถให้ได้ทั้ง oxytocin และ prostaglandin เพื่อชักนำคลอด การผ่าตัดคลอดพิจารณาเฉพาะในสถานการณ์ไม่ปกติ เช่น มีข้อบ่งชี้ของมารดา เพราะการผ่าตัดคลอดสัมพันธ์กับภาวะแทรกซ้อนของมารดาโดยที่ไม่ได้เกิดประโยชน์ในทารก(3)การใช้ misoprostol 25 ไมโครกรัม สอดทางช่องคลอดทุก 3 ถึง 6 ชั่วโมง สามารถช่วยให้ปากมดลูกสุก (cervical ripening) ได้ก่อนการให้ oxytocin ถ้าไม่เคยมีแผลเป็นที่มดลูกมากก่อน อย่างไรก็ตาม WHO แนะนำให้ misoprostol 25 ถึง 50 ไมโครกรัม สอดทางช่องคลอดซ้ำทุก 4 ชั่วโมง (ถ้ามดลูกหดรัดตัวน้อยกว่า 2 ครั้งใน 10 นาที) ให้ซ้ำได้สูงสุด 6 ครั้ง และกรณีให้ยาครั้งแรกแล้วไม่ได้ประสิทธิภาพ ให้เพิ่มขนาดยาครั้งที่ 2 เป็นสองเท่า
สตรีตั้งครรภ์ที่มีประวัติการผ่าตัดหรือแผลเป็นที่มดลูกมาก่อน
สตรีกลุ่มนี้ควรได้รับการรักษาพิเศษและเฉพาะแตกต่างออกไป สำหรับสตรีที่เคยผ่าตัดมดลูกแบบ low transverse incision และขนาดมดลูกน้อยกว่า 28 สัปดาห์โดยปกติทั่วไปจะใช้ misoprostol ในการชักนำคลอด หลายการศึกษาพบว่าการให้ misoprostol ขนาด 400 ไมโครกรัมทุก 6 ชั่วโมง ในการชักนำคลอดทารกในครรภ์เสียชีวิตที่อายุครรภ์ไม่เกิน 28 สัปดาห์และเคยมีแผลเป็นที่มดลูกมากก่อน(3) พบว่าภาวะแทรกซ้อนในสตรีกลุ่มนี้ไม่เพิ่มมากขึ้น กลุ่มที่เคยได้รับผ่าตัดคลอดแบบ low transverse incision พบความเสี่ยงต่อมดลูกแตก (uterine rupture) ประมาณร้อยละ 0.4 ถ้าเคยผ่าตัดคลอดตั้งแต่สองครั้ง พบความเสี่ยงเพิ่มถึงร้อยละ 9 และความเสี่ยงเพิ่มถึงร้อยละ 50 ถ้าเคยผ่าตัดคลอดแบบ vertical incisionปัจจุบันนี้ยังมีข้อมูลเกี่ยวกับประสิทธิภาพ ความปลอดภัย การบริหารยาในสตรีกลุ่มนี้ยังมีอยู่น้อย
สำหรับสตรีที่เคยผ่าตัดมดลูกแบบ low transverse incision และอายุครรภ์มากกว่า 28 สัปดาห์ การให้ oxytocin อาจจะมีประโยชน์ ร่วมกับอาจพิจารณาช่วยให้ปากมดลูกสุก (cervical ripening) โดยการใช้ Foley bulb(3)ผู้ป่วยอาจจะเลือกผ่าตัดคลอดซ้ำแต่ต้องพูดคุยความเสี่ยงและประโยชน์ที่จะได้รับจากการผ่าตัดซ้ำแก่ผู้ป่วยด้วย ซึ่งในทางแท้จริงแล้วควรจะหลีกเลี่ยงการผ่าตัดซ้ำ ดังนั้นจากข้อมูลที่มีอยู่น้อยในปัจจุบัน ในรายที่เคยผ่าตัดคลอดแบบ low transverse incision ยังคงให้คลอดทางช่องคลอดเป็นทางเลือกแรก แต่ในรายที่ผ่าตัดคลอดแบบ classical incision จากข้อมูลในปัจจุบันที่มีน้อย การเลือกทางคลอดให้พิจารณาเป็นรายๆ ไป
การดูแลหลังคลอด (Postpartum)
ก่อนการจำหน่ายผู้ป่วยกลับบ้าน ครอบครัวจำเป็นต้องได้รับคำปรึกษาเกี่ยวกับผลการสืบค้นหาสาเหตุทั้งหมดซึ่งอาจต้องใช้เวลาเป็นเดือนถึงจะสรุปผลออกมาได้หรือในท้ายที่สุดอาจไม่พบสาเหตุของการเสียชีวิตขิงทารกในครรภ์ ผู้ป่วยควรได้รับโอกาสที่ได้เห็นหรือโอบอุ้มทารก ถ่ายภาพหรือลายพิมพ์ฝ่ามือฝ่าเท้าเป็นที่ระลึก การดูแลสภาพจิตใจและความเศร้าโศกควรได้รับการประเมินและรักษาก่อนออกจากโรงพยาบาล อาจจะส่งผู้ป่วยหรือปรึกษาผู้เชี่ยวชาญหรือจิตแพทย์เพื่อช่วยในการดูแล
การป้องกันการเกิดซ้ำและการดูแลในครรภ์ต่อไป
ควรจัดตั้งห้องตรวจผู้ป่วยนอกพิเศษขึ้นมาเพื่อทบทวนผลการสืบค้นสาเหตุและพูดคุยสาเหตุที่อาจจะเป็นไปได้ ซึ่งพบได้ร้อยละ 25 ถึง 50 ทั้งที่พยายามค้นหาสาเหตุแต่ก็ไม่พบ รวมถึงการดูแลในครรภ์ต่อไป (ตาราง 1.3) ถ้าพบโรคหรือปัญหาทางอายุกรรมของมารดาควรรักษาก่อนการตั้งครรภ์ครั้งต่อไป ตัวอย่างเช่น ควบคุมระดับน้ำตาลให้ดีก่อนการตั้งครรภ์เพื่อความเสี่ยงต่อการเกิดทารกพิการ ในอนาคต comparative genomic hybridization, FISH หรือเทคนิคทางพันธุศาสตร์ใหม่ๆ จะเข้ามามีบทบาทในค้นหาสาเหตุโรคทางพันธุกรรมอีกมากมายที่อาจเป็นสาเหตุของมารในครรภ์เสียชีวิต สตรีที่สูญเสียทารกจากสาเหตุโรคเลือดกลุ่ม thrombophilia อาจจะได้รับประโยชน์จากการให้ enoxaparin 40 มิลลิกรัมใต้ผิวหนังทุกวันตั้งแต่อายุครรภ์8 สัปดาห์ ในบางรายที่เกิดจากสาเหตุสายสะดืออุดตัน (cord occlusion) สามารถให้ความมั่นใจแก่มารดาว่าโอกาสน้อยที่จะเกิดซ้ำในท้องต่อไป โดยทั้งหมดแล้วภาวะแทรกซ้อนในครรภ์ต่อไปจะเพิ่มขึ้น เช่น ทารกในครรภ์เสียชีวิต (2.5 ถึง 10 เท่าแล้วแต่การศึกษา) คลอดก่อนกำหนด (OR 2.8, 95% CI 1.9-4.2) ครรภ์เป็นพิษ (OR 3.1, 95% CI 1.7-5.7) และรกลอกตัวก่อนกำหนด (OR 9.4, 95%CI 4.5-19.7)
จะเห็นได้ว่าสิ่งสำคัญคือการพูดคุยสาเหตุที่อาจจะเป็นไปได้ ความเสี่ยงในครรภ์ต่อไปและวางแผนการดูแลในครรภ์ต่อไป ปัจจุบันยังไม่มีข้อมูลที่แนะนำระยะเวลาที่เหมาะสมในการตั้งครรภ์ครั้งต่อไปหลังครรภ์ก่อนเคยทารกในครรภ์เสียชีวิต พบว่าสตรีกลุ่มนี้จะอ่อนไหวต่อความเครียดและการสูญเสีย สตรีส่วนมากจะมีอาการทางจิตดีขึ้นหลังจากทารกในครรภ์เสียชีวิตไปแล้ว 12 เดือน โดยปกติถ้าผู้ป่วยรู้สึกอาการทางจิตใจดีขึ้น จะแนะนำในพร้อมตั้งครรภ์ครั้งไปต่อ 6 เดือนถึง 1 ปีไปแล้ว และยังพบอีกว่าความเสี่ยงของทารกในครรภ์เสียชีวิตลดลงถ้าระยะระหว่างครรภ์ต่อไปห่างมากกว่า 6 เดือนผู้ป่วยส่วนมากได้รับการตรวจสุขภาพทารกเพิ่มมากขึ้นในครรภ์ต่อไป ทำ ultrasound ดูการเจริญเติบโตของทารกและนับลูกดิ้นที่อายุครรภ์ 28 สัปดาห์ เตรียมการตรวจสุขภาพทารกก่อนคลอดที่อายุครรภ์ 32 สัปดาห์ พูดคุยและวางแผนการชักนำคลอดที่อายุครรภ์ 39 สัปดาห์หรือเมื่อตรวจพบว่ามีปอดพัฒนาสมบูรณ์แล้ว(3)
KEY POITNT
- ควรทำ ultrasound ยืนยันทารกในครรภ์เสียชีวิต
- การตรวจที่จะให้ข้อมูลมากที่สุดในการหาสาเหตุทารกในครรภ์เสียชีวิตคือ ชันสูตรศพ, การตรวจรก สายสะดือและเยื่อรก และการส่ง chromosome analysis
- การชักนำคลอดถือเป็นวิธีที่แนะนำในผู้ป่วยที่ทารกในครรภ์เสียชีวิต ถ้ายังไม่มีการเจ็บครรภ์
- ทารกในครรภ์เสียชีวิตที่อายุครรภ์ 14 ถึง 28 สัปดาห์ ให้ใช้ misoprostol (200 ถึง 400 ไมโครกรัม สอดทางช่องคลอดทุก 4 ชั่วโมง หรือ 400 ไมโครกรัมรับประทานทุก 4 ชั่วโมง หรือ 600 ไมโครกรัม สอดทางช่องคลอดทุก 12 ชั่วโมง) ถือเป็นวิธีที่มีประสิทธิภาพที่สุด และมีผลข้างเคียงที่เป็นที่ยอมรับได้ที่อายุครรภ์มากกว่า 28 สัปดาห์สามารถเลือกให้ได้ทั้ง oxytocin และ prostaglandin เพื่อชักนำครรภ์ตาม obstetric protocol
References
- MacDorman MF, Kirmeyer S. Fetal and perinatal mortality, Untited States, 2005. Natl Vital Stat Rep 2009.
- National Center for Health Statistics. Model state vital statistics act and regulations 1992 revision.
- ACOG. Management of stillbirth. ACOG Practice Bulletin No.102 ObstetGynecol 2009 113(3):748-761.
- Lawn JE, Blencowe H, Pattison R, et al. Stillbirths: where? When? Why? how to make the data count? Lancet 2011;377(9775):1448-1463.
- Reddy UM, Ko CW, Willinger M. Maternal age and the risk of stillbirth throughout pregnancy in the United States. Am J ObstetGynecol 2006; 195:764-770.
- Sharma PP, Salihu HM, Oyelese Y, et al. Is race a determinant of stillbirth recurrence? ObstetGynecol 2006; 107:391-397.
- Oron T, Sheiner E, Shorham-Vardi I, et al. Risk factors for antepartum fetal death. J Reprod Med 2001; 46(9):825-830.
- Gardosi J, Kady SM, McGeown P, et al. Classification of stillbirth by relevant condition at death (ReCoDe): population based cohort study. BMJ 2005; 331:1113-1117.
- Bhutta ZA, Yakoob MY, Lawn JE, et al. Stillbirths: what difference can we make and at what cost? Lancet 2011; 377:1523-1538.
- ACOG. Evaluation of stillbirths and neonatal deaths. ACOG Committee Opinion No. 383. ObstetGynecol 2007; 110(4):963-966
- Incerpi MH, Miller DA, Samandi R, et al. Stillbirth evaluation: what tests are needed? Am J ObstetGynecol 1998; 178:1121-1125.
- Silver RM, Varner MW Reddy U, et al. Work-up of stillbirth: a review of the evidence. Am J ObstetGynecol 2007;196(5):433-444.
- Goldstein DP, Reid DE. Circulating fibrinolytic activity-a precursor of hypofibrinogenemia following fetal death in utero. ObstetGynecol 1963; 22:174-180.
- Maslow AD, Breen TW. Sarna MC, et al. Prevalance of coagulation abnormalities associated with intrauterine fetal death. Can J Anaesth 1996; 43(12):1237-1243.
- Autry AM, Hayes EC, Jacobson GF, et al. A comparison of medical induction and dilation and evacuation for second-trimester abortion. Am J ObstetGynecol 2002; 187(2):393-397.
- Toaff R Ayalon D, Gogol G. Clinical use of high concentration dripObstetGynecol 1971; 37:112.