Neural tube defect (NTD)
พญ. ปานวาด หาญอมร
อาจารย์ที่ปรึกษา : รศ. พญ. เกษมศรี ศรีสุพรรณดิฐ
Neural tube defect (NTDs) หรือ ภาวะหลอดประสาทไม่ปิด เป็นความผิดปกติตั้งแต่กำเนิดของระบบประสาทส่วนกลางและไขสันหลัง พบได้บ่อยเป็นอันดับสองรองจากโรคหัวใจพิการแต่กำเนิด(1) เกิดจากการที่ท่อระบบประสาท (neural tube) ปิดตัวไม่สมบูรณ์ในช่วง 3-4 สัปดาห์หลังปฏิสนธิ(อายุครรภ์ 5-6 สัปดาห์) ทำให้เกิดความผิดปกติกับกระดูกสันหลัง ไขประสาท สมอง รวมทั้งกล้ามเนื้อและผิวหนังที่อยู่เหนือบริเวณดังกล่าว
ประเภทของภาวะหลอดประสาทไม่ปิด (Type of neural tube defect)
แบ่งเป็น open และ closed NTDs โดยหากเป็น open NTDs จะพบว่า defect นั้นไม่มีผิวหนังมาปกคลุม อาจมี membrane คลุมอยู่หรือไม่ก็ได้ พบได้ร้อยละ 80 ของ NTDs ทั้งหมด ส่วน closed NTDs จะมีผิวหนังคลุมอยู่โดยอาจมีกระจุกขนปกคลุม บางครั้งพบเป็น birth mark หรือ dimple (2)
โดย NTDs ที่พบบ่อยที่สุดคือ Myelomeningocele หรือ spina bifida
ตารางที่ 1 แสดงชนิดของ Open NTDs
| NTDs | Malformation | Abnormality |
| Cranial | ||
| Anencephaly | Failure of fusion of cephalic portion of neural tube | Absence of all or part of brain, skull, and skin |
| Exencephaly | Failure of scalp and skull formation | Exteriorization of abnormallyformed brain |
| Encephalocele | Failure of complete skull formation | Extrusion of brain tissue into membranous sac |
| Iniencephaly | Defect of cervical and upper thoracic vertebrae | Abnormally formed brain tissue and extreme retroflexion of upper spine |
| Spinal | ||
| Meningocele | Failure of fusion of caudal portion of neural tube | Meninges exposed |
| Myelomeningocele | Failure of fusion of caudal portion of neural tube | Meninges and neural tissueexposed |
| Myeloschisis | Failure of fusion of caudal portion of neural tube | Flattened mass of neural issue exposed |
| Holorachischisis | Failure of fusion of vertebral arches | Entire spinal cord exposed |
| Craniorachischisis | Coexisting anencephaly and open neural tube defect, often in the cervical–thoracic region | Absence of all or part of brain, skull, and skin with spinal abnormality |
ที่มา : ดัดแปลงจาก ACOG Practice bulletin No.187, Dec 2017(3)
จุดกำเนิดของระบบประสาท (Origin of nervous system)
เมื่อตัวอ่อนเข้าสู่สัปดาห์ที่ 3 Notochord เป็นแกนกลางลำตัว (ต่อมาพัฒนาเป็นกระดูกสันหลัง) จะกระตุ้นให้ ectoderm ที่อยู่เหนือขึ้นไปหนาตัว เรียกว่า neural plate จากนั้นขอบด้านข้างของ neural plate จะยกตัวกลายเป็น neural folds แล้วมาชนกันตรงกลาง เป็น neural tube การเชื่อมกันของ neural folds จะเริ่มที่บริเวณ cervical region ก่อน แล้วค่อยๆ เชื่อมกันไปทางด้านหัว(cephalad) และด้านหลัง (caudal)
Anterior neuropore จะปิดเมื่อตัวอ่อนอายุ 25 วัน หลังจากนั้น posterior neuropore จะปิดประมาณ 2 วันหลังจากนั้น กระบวนการทั้งหมดนี้เรียกว่า “Neurulation” (4)
Neural tube จะเจริญไปเป็นสมองและไขสันหลัง ความผิดปกติของการปิดของ neural tube ในขั้นตอนใดก็ตาม จะทำให้เกิด NTDs
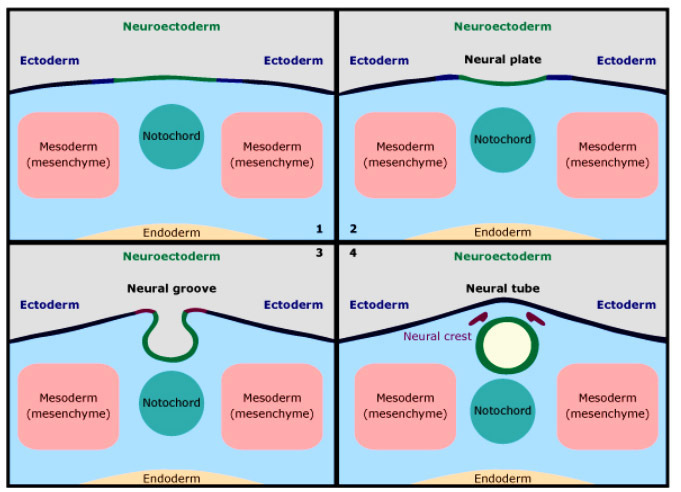
รูปที่ 1 : แสดงการพัฒนาของแรกเริ่มของระบบประสาท (5)
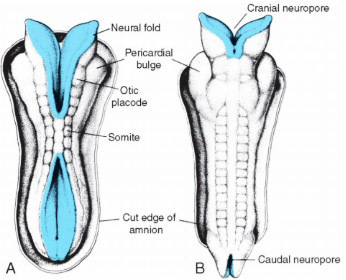
รูปที่ 2 : แสดง dorsal view ของตัวอ่อน 22 วัน(A) และ 23 วัน (B) (4)
อุบัติการณ์ (Prevalence)
ในแต่ละปีมีทารกที่เป็น NTDs ประมาณ 3 แสนคน อุบัติการณ์สูงสุดใน Middle East คือ 20.9 ต่อ 10,000 การคลอด, Southeast Asia พบ 15.8 ต่อ 10,000 การคลอด และต่ำสุดใน Western pacific 6.9 ต่อ 10,000 การคลอด(6)
อาการและความผิดปกติ (Clinical consequence)
ตำแหน่งของความผิดปกติส่วนใหญ่เกิดที่บริเวณ lumbar และ sacrum ซึ่งพบได้ถึงร้อยละ 80 ของ spina bifida ทั้งหมด เนื่องจากเป็นตำแหน่งสุดท้ายที่ neural tube จะปิด(5) พยากรณ์ของโรคและระดับความฉลาดของทารกที่เป็นโรคจะขึ้นอยู่กับขนาด ตำแหน่งของความผิดปกติและการเกิด hydrocephalus ซึ่งหากทารกได้รับการรักษา(ผ่าตัดและยา) พบว่าร้อยละ 75 ของทารกสามารถมีชีวิตอยู่ได้ถึงในช่วงต้นของวัยผู้ใหญ่(7)
ส่วนใหญ่ของทารกจะมี ventriculomegaly ซึ่งต้องได้รับการทำ ventriculoperitoneal shunt ภายในปีแรก และส่วนใหญ่ต้องกลับมาผ่าตัดเพื่อเปลี่ยน shunt อยู่เสมอ(7) ความผิดปกติของระบบประสาทจะพบได้ตั้งแต่แรกเกิด และจะรุนแรงขึ้นหากมีภาวะแทรกซ้อน เช่น hydrocephalus หรือ tethered cord เป็นต้น
Arnold-Chiari malformation เป็นความผิดปกติที่พบร่วมด้วยใน spina bifida โดยจะมี posterior fossa ขนาดเล็ก ทำให้สมองส่วน cerebellar tonsil และ medulla เลื่อนต่ำลงมาใน foramen magnum ทำให้เกิดความผิดปกติของระบบประสาทที่รุนแรงและอาจถึงแก่ชีวิตได้
ปัญหาเรื่องการเคลื่อนไหวเป็นอีกปัญหาที่สำคัญ โดยพบว่าหากตำแหน่งความผิดปกติอยู่เท่ากับหรือต่ำกว่า L4 จะสามารถเคลื่อนไหวและเดินได้ดีกว่าความผิดปกติที่สูงกว่านี้(8) และพบหลังคดได้ร้อยละ 50
ทารกจะมีปัญหาการทำงานของกระเพาะปัสสาวะและลำไส้ที่ผิดปกติ เช่น fecal incontinence(9), neurogenic bladder ซึ่งทำให้เกิด chronic renal disease (10)
สาเหตุและปัจจัยเสี่ยง (Etiology and risk factor)
1. ภาวะขาดโฟเลต (Folate deficiency)
NTDs ที่ไม่มีความผิดปกติอื่นร่วมด้วยมักเกิดจากการขาดโฟเลตร่วมกับปัจจัยทางพันธุกรรมและสภาวะแวดล้อม(11) การขาดโฟเลตอาจเกิดจากการรับประทานอาหารที่มีโฟเลตเป็นส่วนประกอบไม่เพียงพอ ปัญหาการดูดซึมที่ลำไส้ การใช้ยาที่ออกฤทธิ์ต้านการทำงานของโฟเลต เช่น valproic acid (เพิ่มความเสี่ยง NTDs 10-20 เท่า)(12), carbamazepine และโรคทางพันธุกรรมที่มีผลต่อการสร้างโฟเลต
หลักฐานจากการศึกษาแบบ RCT พบว่าการให้กรดโฟลิกเสริมในช่วงตั้งครรภ์สามารถลดการเกิด NTDs ได้(13) และพบว่าหญิงตั้งครรภ์ที่มี บุตรเป็น NTDs จะมีปริมาณโฟเลตในเลือดต่ำกว่าหญิงทั่วไป(14)
2. ปัจจัยทางพันธุกรรม (Genetic factor)
หลายยีนที่พบว่าเกี่ยวข้องกับการเกิด NTDs ยกตัวอย่างเช่น Methylenetetrahydrofolate reductase (MTHFR) เป็นยีนหนึ่งที่ควบคุมการสร้างโฟเลตเพื่อสังเคราะห์ DNA การเกิดโพลีมอร์ฟิซึมของยีนนี้ โฟเลตจะถูกสร้างลดลง และเพิ่มความเสี่ยงต่อการเกิด NTDs (15)
อุบัติการณ์ของ NTDs สูงขึ้นในแฝดไข่ใบเดียวกัน(16) และมีความเสี่ยงสูงขึ้นหากเคยมีบุตรเป็น NTDs มาก่อน โดยความเสี่ยงร้อยละ 3-5 หากมีบุตรเป็นโรคมาก่อน 1 คน และความเสี่ยงจะเพิ่มเป็นร้อยละ 10 หากมีบุตรเป็นโรคมาก่อน 2 คน กรณีที่มี second-degree relative เป็นโรค จะมีความเสี่ยงร้อยละ 0.5 หากเป็น third-degree relative เป็นโรคความเสี่ยงจะอยู่ที่ร้อยละ 0.17(17, 18)
3. กลุ่มโรค (Syndromes)
กลุ่มโรคบางกลุ่มสัมพันธ์กับ NTDs ได้แก่ Meckel-Gruber, HARD, Limb-body wall complex, cloacal exstrophy, OEIS complex, trisomy 13, 18 หรือ triploidy
4. ไข้ (Fever/hyperthermia)
อุณหภูมิของร่างกายที่สูงขึ้น เช่น มีไข้หรือการแช่ในอ่างน้ำร้อน ในไตรมาสแรกของการตั้งครรภ์เพิ่มความเสี่ยงต่อการเกิด NTDs 3 เท่า(19)
5. เบาหวานก่อนตั้งครรภ์ (Pregestational diabetes)
โรคเบาหวานที่คุมน้ำตาลไม่ดีมีความสัมพันธ์กับการเกิด NTDs ดังนั้นการคุมน้ำตาลให้ปกติก่อนตั้งครรภ์จะช่วยป้องกันการเกิด NTDs ได้
6. ภาวะอ้วน (Obesity)
ความเสี่ยงของการเกิด NTDs เพิ่มขึ้นตามน้ำหนักที่มากขึ้น จากการศึกษาความเสี่ยงเพิ่มเป็น 3.1 เท่าในผู้หญิงที่อ้วนรุนแรง (BMI ≥ 38)(20)
7. เชื้อชาติและภูมิลำเนา (Racial,ethnic and geographic location)
หลายการศึกษาในอเมริกาพบว่า เชื้อชาติที่มีความเสี่ยงต่อการเกิด NTDs มากที่สุดคือ Hispanic population(21) ส่วนชาว African American มีความเสี่ยงต่ำ(22) พื้นที่ที่เกิด NTDs มากที่สุดคือจังหวัด Shanxi ในจีน(23) โดยสรุปแล้วปัจจัยเสี่ยงต่าง ๆ น่าจะเป็นผลมาจากความแตกต่างทางพันธุกรรม การรับประทานอาหารและสิ่งแวดล้อม
การวินิจฉัยก่อนตั้งครรภ์ (Prenatal screening and diagnosis)
NTDs แต่ละชนิดก็มีพยากรณ์โรคที่แตกต่างกัน การวินิจฉัย NTDsได้จึงเป็นสิ่งสำคัญ เช่น หากเป็น anencephaly ก็สามารถให้ทางเลือกในการยุติการตั้งครรภ์ได้ หรือในทารกที่เป็น spina bifida และมีพยากรณ์โรคที่ดีก็สามารถเตรียมพร้อมสำหรับการคลอดและรักษาต่อ
หญิงตั้งครรภ์ทุกคนควรได้รับการคัดกรองหาทารกที่มีภาวะ NTDs เนื่องจาก 90-95% ของ NTDs เกิดในหญิงตั้งครรภ์ที่ไม่มีความเสี่ยงใด
วิธีการคัดกรอง (Screening test)
1. การตรวจคลื่นความถี่สูง (Ultrasound examination)
คลื่นความถี่สูงแบบ 2 มิติ เป็นวิธีที่ได้รับความนิยมมากที่สุด พบว่าในช่วงอายุครรภ์ 12-14 สัปดาห์ สามารถวินิจฉัยภาวะ anencephaly, encephalocele และ spina bifida ได้มากกว่าร้อยละ 90, 80 และ 44 ตามลำดับ แต่ความสามารถในการวินิจฉัยจะสูงขึ้นเมื่อทำการตรวจในช่วงไตรมาสที่สอง(อายุครรภ์ 18-22 สัปดาห์) ซึ่งพบว่าวินิจฉัยภาวะ anencephaly และ spina bifida ได้ร้อยละ 100 และ 92-95 ตามลำดับ (24)
ความผิดปกติที่พบจากการตรวจคลื่นความถี่สูงได้แก่ กระดูกศีรษะส่วนหน้าผิดรูป(lemon sign) ความผิดปกติของ cerebellum และ posterior fossa (banana sign) และ ventriculomegaly
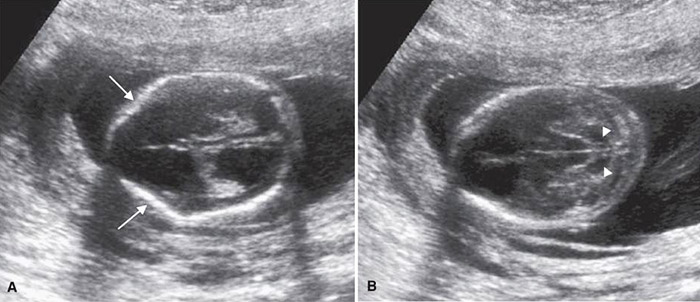
รูปที่ 3 : A. ลูกศรชี้ ให้เห็นการยุบตัวของ frontal bone (lemon sign) ร่วมกับมี ventriculomegaly B. ลูกศรชี้การบางตัวของ cisterna magna (banana sign)(25)
2. การตรวจ Alpha-fetoprotein (AFP)
เป็น glycoprotein ที่สร้างจาก yolk sac ระบบทางเดินอาหาร และตับของทารก เชื่อว่าเกี่ยวของกับระบบภูมิคุ้มกัน และใช้ขนส่งสารต่าง ๆ ในเลือด
AFP สามารถตรวจพบได้ในเลือดของแม่ (maternal serum alpha-fetoprotein: MSAFP) น้ำคร่ำ และในเลือดของทารกในครรภ์
การตรวจ MSAFP นิยมทำในช่วงอายุครรภ์ 15-20 สัปดาห์ โดยจะรายงานผลเป็น multiples of median (MoM) สำหรับแต่ละช่วงอายุครรภ์ ค่าที่ ≥ 2.0 หรือ 2.5 MoM ถือว่าผิดปกติ โดยจะสามารถวินิจฉัยภาวะ anencephaly และ spina bifida ได้มากกว่าร้อยละ 95 และ 65-80 ตามลำดับ(26)
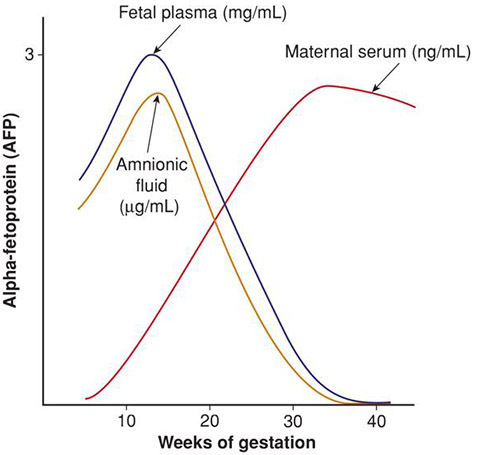
รูปที่ 4 : แสดงระดับ AFP ใน fetal plasma, amnionic fluid และ maternal serum ณ อายุครรภ์ต่าง ๆ
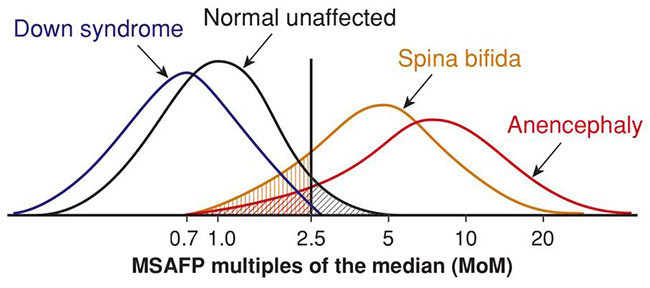
รูปที่ 5 : แสดงค่า MSAFP ที่ 2.5 MoM ณ อายุครรภ์ 15-20 สัปดาห์ ในการวินิจฉัยโรคต่างๆ(25)
ปัจจัยที่มีผลต่อค่า MSAFP ได้แก่
- อายุครรภ์ : ค่า MSAFP จะค่อยๆ เพิ่มขึ้นและสูงสุดในช่วงอายุครรภ์ 28-32 สัปดาห์ แล้วหลังจากนั้นจะเริ่มลดลง
- น้ำหนักแม่ : แม่ที่น้ำหนักตัวมากจะมีระดับ MSAFP ต่ำกว่า เนื่องจากประมาณเลือดที่มากกว่าทำให้ระดับความเข้มข้นของ AFP ลดลง
- โรคเบาหวาน : พบทารกเป็น NTDs มากขึ้นในหญิงตั้งครรภ์ที่เป็นเบาหวาน อีกทั้งระดับ MSAFP ในหญิงที่เป็นเบาหวานชนิดที่ 1 จะมีระดับต่ำกว่าหญิงทั่วไปประมาณร้อยละ 15 ดังนั้นจึงควรใช้ค่า cut point ที่ต่ำลงมา เช่น 1.5 MoM ส่วนในหญิงตั้งครรภ์ที่เป็นเบาหวานชนิดที่ 2 ก็มีค่า MSAFP ต่ำกว่าเช่นกัน แต่ข้อมูลยังจำกัด
- ความพิการของทารก : ความผิดปกติอื่นๆ สามารถทำให้ค่า MSAFP สูงขึ้นได้ เช่น abdominal wall defect, teratomas, fetal congenital nephrosis, benign obstructive uropathy หรือ fetal anemia เป็นต้น
- ครรภ์แฝด : ระดับของ AFP แปรผันตรงกับจำนวนทารกในครรภ์ ดังนั้นค่า cut point ของ MSAFP จึงสูงขึ้นเป็น 4-5 MoM
- เชื้อชาติ : ระดับ MSAFP ในผู้หญิงผิวสี สูงกว่าผู้หญิงทั่วไปร้อยละ 10-20 แต่ความเสี่ยงของการเกิด NTDs ในทารกกลับน้อยกว่าผู้หญิงยุโรปถึงร้อยละ 50 บางสถาบันจึงแนะนำให้ใช้ค่า cut point ที่สูงขึ้น เช่นใช้ 2.5 MoM ในผู้หญิงผิวสี และใช้ 2.0 MoM ในผู้หญิงยุโรป เป็นต้น การใช้ค่า cut point เช่นนี้ จะลดผลบวกลวงได้แต่ก็จะลดความสามารถในการวินิจฉัย NTDs เช่นกัน
- การมีชีวิตของทารกในครรภ์ (Fetal viability) : หากทารกในครรภ์เสียชีวิต ค่า ASAFP จะสูงขึ้น
หากตรวจพบระดับ MSAFP สูง ควรส่งตรวจคลื่นความถี่สูงเพื่อดูความผิดปกติของทารกในครรภ์ หากพบว่ามีความผิดปกติก็ไม่จำเป็นต้องตรวจด้วยวิธีอื่น ๆ เพิ่มเติม แต่หากการตรวจด้วยคลื่นความถี่สูงไม่ชัดเจนหรือไม่พบความผิดปกติใด ควรให้คำแนะนำกับมารดาเรื่องจากตรวจทางพันธุกรรม (genetic counseling) และการเจาะถุงน้ำคร่ำเพื่อส่งตรวจระดับ AFP ในน้ำคร่ำและ amniotic fluid acetylcholinesterase (AChE) โดยหากค่าทั้งสองสูงจะมีความแม่นยำในการวินิจฉัย NTD ถึงร้อยละ 96 โดยมีผลบวกลวงอยู่ที่ร้อยละ 0.08-0.14 (27) โดยร้อยละ 50 ของสาเหตุที่ทำให้ตรวจพบระดับ AChE สูงขึ้น เกิดจากการปนเปื้อนของเลือดในน้ำคร่ำ
ระดับที่สูงขึ้นของ MSAFP ที่หาสาเหตุไม่พบ อาจจะสัมพันธ์กับผลลัพธ์การตั้งครรภ์ที่ไม่ดี เช่น ทารกเสียชีวิตในครรภ์ ทารกโตช้าในครรภ์ หรือภาวะครรภ์เป็นพิษ อย่างไรก็ตาม MSAFP ยังไม่ใช่เครื่องมือที่ดีในการทำนายภาวะเหล่านี้ ดังนั้นจึงไม่มีความจำเป็นต้องตรวจติดตามเป็นพิเศษหากยังไม่พบความผิดปกติใดๆ
การประเมินเด็กทารกในครรภ์ (Fetal evaluation)
- ค้นหาความผิดปกติอื่นๆ (Screening for associated anomaly)
การศึกษาพบว่าเด็กทารกที่เป็น NTDs จะมีความผิดปกติอื่นๆ ร้อยละ 20.4 ที่พบบ่อยได้แก่ ปากแหว่งเพดานโหว่ ความผิดปกติของระบบกล้ามเนื้อและโครงกระดูก ไต และหัวใจ - ส่งตรวจวินิจฉัยทางพันธุกรรม (Chromosome study)
ทารกที่มีภาวะ NTDs จะเพิ่มความเสี่ยงต่อการมีโครโมโซมที่ผิดปกติโดยเฉพาะอย่างยิ่งในกรณีที่พบความผิดปกติอื่นๆ จากรายงานหนึ่งพบว่า เด็กทารกที่มีภาวะ NTD โดยไม่พบความผิดปกติอื่นๆ จะมีโครโมโซมผิดปกติได้ร้อยละ 2.4 แต่หากมีความผิดปกติอื่นๆร่วมด้วยจะตรวจพบความผิดปกติของโครโมโซมได้ถึงร้อยละ 27 - ส่งตรวจคลื่นแม่เหล็กไฟฟ้า (Fetal MRI)
สำหรับยืนยันการวินิจฉัยในกรณีที่การตรวจคลื่นความถี่สูงแล้วผลไม่ชัดเจน สามารถบอกระดับหรือตำแหน่งความผิดปกติได้แน่นอน
การวางแผนการรักษา (Pregnancy management)
1. การรักษาด้วยการผ่าตัด
การผ่าตัดในกรณีที่เป็น myelomeningocele จะหยุดการไหลของน้ำหล่อเลี้ยงสมองและไขสันหลังออกมาจากจุดที่เป็นรอยโรค ช่วยป้องกันหรือแก้ไขการยื่นลงมาของสมองส่วนหลังและภาวะน้ำคั่งในสมอง การผ่าตัดชนิดนี้จะเลือกทำให้กรณีที่มี myelomeningocele เพียงอย่างเดียว เป็นครรภ์เดี่ยวที่ไม่มีภาวะแทรกซ้อนอื่นๆ และผลโครโมโซมปกติ(28)
การผ่าตัดเพิ่มความเสี่ยงต่อการเกิดการคลอดก่อนกำหนด การแยกชั้นกันระหว่าง chorion และ amnion ภาวะน้ำเดินก่อนกำหนด น้ำคร่ำน้อย รกลอกตัวก่อนกำหนด ปอดบวมน้ำในมารดา และเนื่องจากการผ่าตัดนี้ต้องเปิดแผลผ่านมดลูก ทำให้ผนังมดลูกบางและแยกได้ ในครรภ์ต่อไปจึงจำเป็นต้องคลอดด้วยการผ่าตัดคลอด
2. การตรวจติดตามเด็กทารกในครรภ์
แนะนำให้ทำ NSTหรือ BPP ในช่วงไตรมาสที่สามของการตั้งครรภ์ นอกจากนั้นควรตรวจด้วยภาพถ่ายคลื่นความถี่สูงเป็นระยะเพื่อติดตามขนาดของ NTDs หรือขนาดของศีรษะเพื่อวางแผนการคลอด
3. การวางแผนการคลอด
- Myelomeningocele
ควรให้คลอดเมื่อครรภ์ครบกำหนดเพื่อลดปัญหาจากการคลอดก่อนกำหนด แต่หากทารกได้รับการผ่าตัดขณะอยู่ในครรภ์มารดา (Transfundal surgery) ควรให้คลอดด้วยการผ่าตัดคลอดในช่วง late preterm หรือ early term เพื่อหลีกเลี่ยงการเกิด uterine rupture ในช่วงเจ็บครรภ์คลอด
ควรเลือกการผ่าตัดคลอดหากทารกเป็นท่าก้น แต่ในทารกท่าศีรษะยังไม่มีงานวิจัยรองรับที่ชัดเจน หากพิจารณาแล้วว่าศีรษะของทารกมีขนาดปกติ และ NTDs ไม่น่าจะทำให้เกิด dystocia ก็สามารถให้คลอดทางช่องคลอดได้ อย่างไรก็ตามหาก HC > 40 cm หรือ BPD ≥ 12 cm เห็นสมควรให้ผ่าตัดคลอด
สิ่งที่ต้องระวังอย่างหนึ่งคือ ทารกที่เป็น NTDs มีความเสี่ยงที่จะแพ้ latex ได้ และมีโอกาสแพ้รุนแรงถึงชีวิตได้เมื่อโตขึ้น ดังนั้นจึงไม่ควรใช้ถุงมือที่มี latex เป็นองค์ประกอบ(29) - Anencephaly
ร้อยละ 75 ของเด็กทารกที่เป็น anecephaly จะตายคลอด และที่เหลือจะมีชีวิตอยู่ได้ไม่นานหลังจากคลอด จึงแนะนำให้ยุติการตั้งครรภ์ หากท้องต่อไปอาจคลอดก่อนกำหนดเนื่องจาก uterine overdistension จาก polyhydramnios หรืออาจกลายเป็นครรภ์เกินกำหนด เนื่องจากทารกไม่มีสมองที่เป็นส่วนสั่งการให้เกิดการเจ็บครรภ์คลอด ส่วนการผ่าตัดคลอดจะทำเมื่อมีข้อบ่งชี้ของมารดาเท่านั้น - Encephalocele
ยังไม่มีการศึกษาเปรียบเทียบผลลัพธ์ระหว่างการคลอดทางช่องคลอดและการผ่าตัดคลอด โดยการตัดสินใจเลือกช่องทางการคลอดขึ้นอยู่กับพยากรณ์ของโรคหลังคลอดและขนาดของ NTDs หากความผิดปกติมีขนาดใหญ่และมีโอกาสได้รับบาดเจ็บจากการคลอดทางช่องคลอด ก็แนะนำให้ผ่าตัดคลอด
Folic acid supplement
ตั้งแต่ปี คศ.1992 U.S. Public Health Service ได้แนะนำให้หญิงวัยเจริญพันธุ์ที่วางแผนจะมีบุตรรับประทาน folic acid 400 mcg ต่อวันตั้งแต่ก่อนตั้งครรภ์อย่างน้อย 1 เดือน ไปจนกระทั่งอายุครรภ์ครบ 12 สัปดาห์ เนื่องจากเมื่อทราบว่าท้องแล้วค่อยรับประทาน folic acid เสริมจะไม่ทันสำหรับการป้องกันการเกิด NTDs เนื่องจากขณะนั้น neural tube ได้เริ่มสร้างแล้ว(30)
หญิงที่มีความเสี่ยงสูงต่อการเกิด NTDs เช่น ตนเองหรือคู่สมรสเป็น NTDs หรือเคยมีบุตรเป็น NTDs ควรรับประทาน folic acid เสริม 4 mg ต่อวัน เริ่มรับประทาน 3 เดือนก่อนตั้งครรภ์ไปจนกระทั่งอายุครรภ์ครบ 12 สัปดาห์ จะสามารถลด NTDs ได้ถึงร้อยละ 70 (31)
อย่างไรก็ตามมีกลุ่มที่ถือเป็น folate-resistant NTDs ได้แก่ DM ที่คุมน้ำตาลไม่ดี ภาวะอ้วน มีไข้หรืออยู่ในที่อุณหภูมิสูง ความผิดปกติของโครโมโซมและโรคทางพันธุกรรม folic acid ไม่สามารถป้องกันการเกิด NTDs ในกลุ่มนี้ได้ทั้งหมด รวมทั้งในหญิงที่ได้รับยากันชัก เช่น valproic acid ประโยชน์จากการให้ high dose folic acid เสริมก็ยังไม่ชัดเจน(32)
โดยรวมแล้ว folic acid เป็นยาที่ปลอดภัย เนื่องจากละลายน้ำ สามารถขับออกทางปัสสาวะ จึงไม่สะสมในร่างกาย รวมทั้งยังไม่มีข้อมูลถึงผลข้างเคียงจากยาที่รุนแรง อย่างไรก็ตามอาจบดบังอาการของ pernicious anemia ได้
เอกสารอ้างอิง
- Wallingford JB, Niswander LA, Shaw GM, Finnell RH. The continuing challenge of understanding, preventing, and treating neural tube defects. Science. 2013;339(6123):1222002.
- Chaouki Khoury M. Closed spinal dysraphism: Pathogenesis and types. 2017.
- Practice Bulletin No. 187: Neural Tube Defects. Obstetrics and gynecology. 2017;130(6):e279-e90.
- เหล่าวัฒนพงศ์ ศ. Development of nervous system. 2014:28.
- David G McLone PMB. Pathophysiology and clinical manifestations of myelomeningocele (spina bifida). 2018.
- Zaganjor I, Sekkarie A, Tsang BL, Williams J, Razzaghi H, Mulinare J, et al. Describing the Prevalence of Neural Tube Defects Worldwide: A Systematic Literature Review. PloS one. 2016;11(4):e0151586.
- Bowman RM, McLone DG, Grant JA, Tomita T, Ito JA. Spina bifida outcome: a 25-year prospective. Pediatric neurosurgery. 2001;34(3):114-20.
- Sibinski M, Synder M, Higgs ZC, Kujawa J, Grzegorzewski A. Quality of life and functional disability in skeletally mature patients with myelomeningocele-related spinal deformity. Journal of pediatric orthopedics Part B. 2013;22(2):106-9.
- Burke R, Liptak GS. Providing a primary care medical home for children and youth with spina bifida. Pediatrics. 2011;128(6):e1645-57.
- Muller T, Arbeiter K, Aufricht C. Renal function in meningomyelocele: risk factors, chronic renal failure, renal replacement therapy and transplantation. Current opinion in urology. 2002;12(6):479-84.
- Copp AJ, Stanier P, Greene ND. Neural tube defects: recent advances, unsolved questions, and controversies. The Lancet Neurology. 2013;12(8):799-810.
- Wlodarczyk BJ, Palacios AM, George TM, Finnell RH. Antiepileptic drugs and pregnancy outcomes. American journal of medical genetics Part A. 2012;158a(8):2071-90.
- Prevention of neural tube defects: results of the Medical Research Council Vitamin Study. MRC Vitamin Study Research Group. Lancet (London, England). 1991;338(8760):131-7.
- Smithells RW, Sheppard S, Schorah CJ. Vitamin deficiencies and neural tube defects. Archives of disease in childhood. 1976;51(12):944-50.
- Greene ND, Stanier P, Copp AJ. Genetics of human neural tube defects. Human molecular genetics. 2009;18(R2):R113-29.
- Windham GC, Bjerkedal T, Sever LE. The association of twinning and neural tube defects: studies in Los Angeles, California, and Norway. Acta geneticae medicae et gemellologiae. 1982;31(3-4):165-72.
- Bonaiti-Pellie C, Smith C. Risk tables for genetic counselling in some common congenital malformations. Journal of medical genetics. 1974;11(4):374-7.
- Toriello HV, Higgins JV. Occurrence of neural tube defects among first-, second-, and third-degree relatives of probands: results of a United States study. American journal of medical genetics. 1983;15(4):601-6.
- Dreier JW, Andersen AM, Berg-Beckhoff G. Systematic review and meta-analyses: fever in pregnancy and health impacts in the offspring. Pediatrics. 2014;133(3):e674-88.
- Rasmussen SA, Chu SY, Kim SY, Schmid CH, Lau J. Maternal obesity and risk of neural tube defects: a metaanalysis. American journal of obstetrics and gynecology. 2008;198(6):611-9.
- Hendricks KA, Simpson JS, Larsen RD. Neural tube defects along the Texas-Mexico border, 1993-1995. American journal of epidemiology. 1999;149(12):1119-27.
- Egbe AC. Birth defects in the newborn population: race and ethnicity. Pediatrics and neonatology. 2015;56(3):183-8.
- Liao Y, Zhang Y, He L, Wang J, Liu X, Zhang N, et al. Temporal and Spatial Analysis of Neural Tube Defects and Detection of Geographical Factors in Shanxi Province, China. PloS one. 2016;11(4):e0150332.
- Cameron M, Moran P. Prenatal screening and diagnosis of neural tube defects. Prenatal diagnosis. 2009;29(4):402-11.
- Cunningham FG LK, Bloom SL, Spong CY, Dashe JS, Hoffman BL, et al. Williams obstetrics 2014:283-8.
- Bradley LA, Palomaki GE, McDowell GA. Technical standards and guidelines: prenatal screening for open neural tube defects. Genetics in medicine : official journal of the American College of Medical Genetics. 2005;7(5):355-69.
- Wald N, Cuckle H, Nanchahal K. Amniotic fluid acetylcholinesterase measurement in the prenatal diagnosis of open neural tube defects. Second report of the Collaborative Acetylcholinesterase Study. Prenatal diagnosis. 1989;9(12):813-29.
- Committee Opinion No. 720: Maternal-Fetal Surgery for Myelomeningocele. Obstetrics and gynecology. 2017;130(3):e164-e7.
- Rendeli C, Nucera E, Ausili E, Tabacco F, Roncallo C, Pollastrini E, et al. Latex sensitisation and allergy in children with myelomeningocele. Child’s nervous system : ChNS : official journal of the International Society for Pediatric Neurosurgery. 2006;22(1):28-32.
- Bibbins-Domingo K, Grossman DC, Curry SJ, Davidson KW, Epling JW, Jr., Garcia FA, et al. Folic Acid Supplementation for the Prevention of Neural Tube Defects: US Preventive Services Task Force Recommendation Statement. Jama. 2017;317(2):183-9.
- De-Regil LM, Pena-Rosas JP, Fernandez-Gaxiola AC, Rayco-Solon P. Effects and safety of periconceptional oral folate supplementation for preventing birth defects. The Cochrane database of systematic reviews. 2015(12):Cd007950.
- Ban L, Fleming KM, Doyle P, Smeeth L, Hubbard RB, Fiaschi L, et al. Congenital Anomalies in Children of Mothers Taking Antiepileptic Drugs with and without Periconceptional High Dose Folic Acid Use: A Population-Based Cohort Study. PloS one. 2015;10(7):e0131130.


