Rhesus-D Negative in Pregnancy
นพ. วิศิษฎ์ จันทร์คุณาภาส
ศ.นพ. ธีระ ทองสง
หมู่เลือด Rhesus เป็นหมู่เลือดหนึ่งที่ได้รับการตรวจในการฝากครรภ์ครั้งแรกนอกเหนือจากหมู่เลือด ABO ซึ่งเป็นหมู่เลือดที่มีความสำคัญโดยเฉพาะอย่างยิ่งหากผลหมู่เลือดเป็น Rh-D negative สามารถสร้างแอนติบอดีต่อเม็ดเลือดแดงที่มีแอนติเจนของหมู่เลือด Rh-D positive ได้ หรือ เรียกภาวะนี้ว่า Anti-D Alloimunization หากสตรีตั้งครรภ์มีแอนติบอดีดังกล่าวปริมาณมาก จะทำให้ทารกที่หมู่เลือด Rh-D positive เกิดภาวะซีดจากเม็ดเลือดแดงแตก (Hemolytic anemia) หรือ Hemolytic disease of fetus or newborn(HDFN) เกิดภาวะทารกบวมน้ำ(Hydrops fetalis) และหากรุนแรงอาจเสียชีวิตได้ ซึ่งการเกิด HDFN จาก Anti-D immunization ประมาณ 1% และเป็นสาเหตุการตายทุกๆการเกิดของทารก 2,200 คน(1) หลังจากมีการนำ RhIG มาใช้เพื่อป้องกันภาวะดังกล่าวทำให้ HDFNจาก Anti-D Alloimmunization เหลือเพียง 0.04%(3) ดังนั้น การป้องกันเกิด Anti-D alloimmunization ในสตรีตั้งครรภ์ จึงมีความสำคัญเป็นอย่างมาก
สาเหตุที่เกิด Anti-D Alloimunization แม้ว่าจะได้รับการป้องกันโดย RhIG(4)
- ไม่ได้รับการป้องกันการเกิด Anti-D Alloimunization โดย RhIG
- การให้ RhIG ปริมาณไม่เพียงพอในการป้องกัน
- ความผิดพลาดของการทดสอบหมู่เลือด
- ความผิดพลาดจากการเติมเลือดต่างหมู่
หมู่เลือด (Blood groups)
การจำแนกหมู่เลือดแบบ ABO และ Rh เป็นหมู่เลือดที่ได้รับการตรวจตั้งแต่ฝากครรภ์ครั้งแรก
สำหรับ หมู่เลือด ABO มักเกิดภาวะซีดจากเม็ดเลือดแดงแตกหลังคลอด โอกาสเกิดขณะในครรภ์ค่อนข้างน้อยและไม่รุนแรง(5) เนื่องจากเม็ดเลือดแดงของทารกมีปริมาณแอนติเจนสำหรับหมู่เลือด A หรือ B น้อย และแอนติบอดีต่อแอนติเจน A และ B เป็นชนิดที่ผ่านรกได้น้อยและมักถูกดูดซึมบริเวณรกก่อนจะเข้าสู่ตัวทารก
สำหรับ หมู่เลือด Rh อุบัติการณ์มีความแตกต่างกันตามเชื้อชาติ(6) พบว่าหมู่เลือด Rh-negative พบในอเมริกันผิวขาว 17.3% ละติอเมริกา 7.3% อเมริกันผิวดำ 7.1% และเอเชีย 1.7% หากสตรีตั้งครรภ์มีแอนติบอดีต่อแอนติเจน Rh มีโอกาสเกิด Hemolytic disease of the fetus and newborn ได้
หมู่เลือดRh ชนิดย่อยจะแบ่งตามชนิดแอนติเจนผลผิวเม็ดเลือดแดง ได้แก่ C, c, D, E, e หากตรวจพบแอนติเจน D จะแปลผลว่า “RhD positive” และหากไม่พบแอนติเจน D จะแปลผลว่า “RhD negative” มีการถ่ายทอดทางพันธุกรรมแบบเมนเดล ลักษณะ Genotype จะเป็น “DD” หรือ “Dd” และ “dd” ตามลำดับ แต่ในปัจจุบันสาเหตุของ HDFN ที่พบบ่อยมากที่สุดคือ Anti-E Alloimmunization(7) อันดับถัดมาคือ Anti-D Alloimmunization ซึ่งจำนวนลดลงมากเนื่องจากมีแนวทางการให้ RhIG เพื่อป้องกันอย่างแพร่หลาย ส่วนหมู่เลือดอื่นไม่มีอิมมูโนโกลบูลินเพื่อป้องกันการเกิดภาวะ Alloimmunization
นอกจากนี้ มีหมู่เลือดอื่นอีก เช่น Lewis, Duffy และ Kell เป็นต้น
การสร้างแอนติบอดีต่อเม็ดเลือดแดงหรือ “Anti-D Alloimmunization”
สาเหตุเกิดจาก(8)
- การได้รับเลือดต่างกลุ่ม เช่น ผู้ป่วยหมู่เลือด RhD-negative ได้รับเลือดผู้บริจาคหมู่เลือด RhD-positive
- การได้รับการปนเปื้อนเลือดทารกหมู่เลือด RhD-positive ระหว่างตั้งครรภ์หรือขณะคลอดในสตรีตั้งครรภ์หมู่เลือด RhD-negative
การตอบสนองต่อภูมิคุ้มกันในการสร้างแอนติบอดีขึ้นกับปริมาณและจำนวนครั้งที่เลือดที่ปนเปื้อน และความสามารถในการตอบสนองของภูมิคุ้มกันในแต่ละคน
กลไกการเกิด Rh-D alloimmunization ในสตรีตั้งครรภ์ จะเกิดในกรณีสตรีตั้งครรภ์มีหมู่เลือด RhD-negative และทารกในครรภ์มีหมู่เลือด RhD-positive ในแต่ละการตั้งครรภ์นั้น หญิงตั้งครรภ์ไม่สามารถหลีกเลี่ยงการปนเปื้อนเลือดทารกจะมากหรือน้อยขึ้นอยู่กับเหตุการณ์ที่ส่งเสริม
สำหรับครรภ์แรก หรือ กรณีที่สตรีตั้งครรภ์ที่ยังไม่เกิดภาวะ Alloimmunization เมื่อเลือดทารกที่มีแอนติเจน RhD ปนเปื้อนสู่เลือดสตรีตั้งครรภ์ที่ยังไม่มีการสร้างแอนติบอดีต่อ RhD ซึ่งถือว่าเป็นสิ่งแปลกปลอม จึงกระตุ้นให้ระบบภูมิคุ้มกันสร้างแอนติบอดีต่อแอนติเจน RhD ในครั้งแรกจะสร้าง IgM อายุสั้นและไม่สามารถผ่านรกได้ และมีการสร้าง IgG แต่ปริมาณเล็กน้อย จึงไม่ส่งผลต่อทารกในครรภ์ หลังจากนั้น ระบบภูมิคุ้มกันจะจดจำแอนติเจนดังกล่าว หากมีการกระตุ้นในครั้งต่อไป จะสร้างแอนติบอดีชนิด IgG ปริมาณมาก สามารถผ่านรกได้และอยู่ในร่างกายได้นาน ดังนั้น จึงส่งผลต่อทารกทำให้เกิดเม็ดเลือดแดงทารกแตกและเกิดภาวะซีดตามมา หากรุนแรงมากจะเกิดภาวะทารกบวมน้ำและอาจเสียชีวิตได้(9) ซึ่งมักเกิดในครรภ์หลัง อธิบายกลไกการเกิดตามภาพประกอบที่ 1(10)
แนวทางในการดูแลรักษาสตรีตั้งครรภ์ที่สัมพันธ์กับภาวการณ์สร้างแอนติบอดีต่อเม็ดเลือดแดง (Alloimmunization) แสดงตามแผนภูมิที่ 1
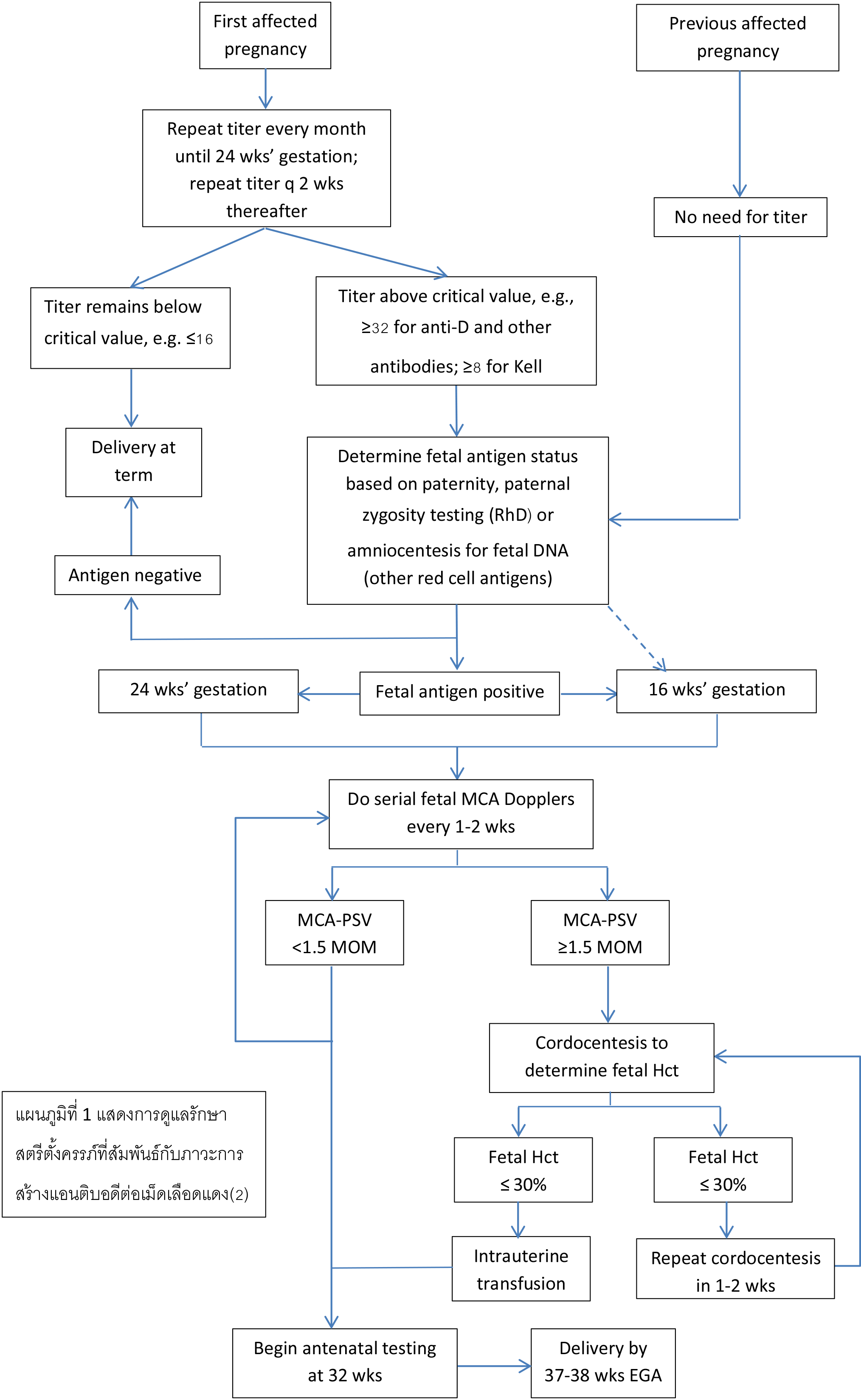
แผนภูมิที่ 1 แสดงการดูแลรักษาสตรีตั้งครรภ์ที่สัมพันธ์กับภาวะการสร้างแอนติบอดีต่อเม็ดเลือดแดง(2)
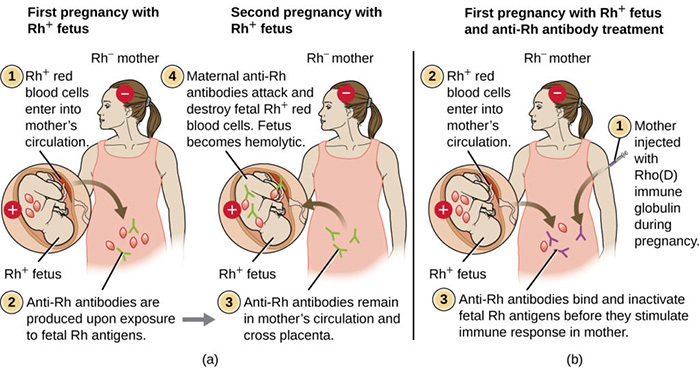
ภาพประกอบที่ 1 (a) แสดงการเกิด Rh-Alloimmunization ในครรภ์แรกและครรภ์ที่สอง (b) แสดงการการป้องกัน Rh-Alloimmunization ในครรภ์แรกโดยใช้ RhIG(10)
การตรวจแอนติบอดีต่อ RhD ในสตรีตั้งครรภ์(2)
หากตรวจไม่พบ ให้พิจารณาให้ RhIG เพื่อป้องกันภาวะ RhD Alloimmunization
หากตรวจพบ ให้ทำการตรวจหาระดับแอนติบอดี เพื่อประเมินระดับของ RhD Alloimmunization หากระดับแอนติบอดีถึงระดับวิกฤต แสดงว่า มีโอกาสมากที่จะเกิดภาวะทารกบวมน้ำ จำเป็นต้องประเมินทารกด้วยวิธีการอื่นเพิ่มเติม เช่น การประเมินภาวะซีดของทารกจาก Peak systolic velocity in the fetal middle cerebral artery (MCA-PSV) หากระดับแอนติบอดีต่ำกว่าค่าวิกฤต ให้ตรวจทุก 1เดือน จนกระทั่งอายุครรภ์ 24 สัปดาห์ หลังจากนั้นตรวจทุก 2 สัปดาห์ และให้คลอดเมื่ออายุครรภ์ครบกำหนดหรือตามข้อบ่งชี้ทางสูติศาสตร์อื่น
สำหรับ ระดับวิกฤตของแอนติบอดีต่อ RhD (Anti-D)หรือกลุ่มอื่น ส่วนมากใช้ค่าระดับวิกฤต มากกว่าหรือเท่ากับ 32 ยกเว้นแอนติบอดีต่อ Kell (Anti-Kell) ใช้ค่ามากกว่าหรือเท่ากับ 8 ขึ้นอยู่กับสถาบันและวิธีการในการทดสอบทางห้องปฏิบัติการ หากระดับต่ำกว่า
กรณีที่ครรภ์ก่อนมีภาวะ RhD Alloimmunization หรือเกิดภาวะ HDFN ไม่จำเป็นตรวจตรวจหาแอนติบอดีต่อ RhD เนื่องจากไม่ช่วยในการบอกความเสี่ยงในการเกิดภาวะทารกบวมน้ำได้ ให้พิจารณาประเมิน MCA-PSVเป็นระยะได้ตั้งแต่อายุครรภ์ 16 สัปดาห์ หากทารกมีหมู่เลือด RhD-positive
การตรวจความเหมือนกันของของยีนในบิดา(Paternal zygosity)(2)
หากสามีหมู่เลือด RhD-negative ทารกจะมีหมู่เลือด RhD-negative ทุกคน ไม่จำเป็นต้องตรวจเพิ่มเติม ดังนั้น Paternal zygosity จะทำการตรวจเมื่อสามีหมู่เลือด RhD-positive
หากยีนประกอบด้วยแอลลีลที่เหมือนกัน “DD” (Homozygous genotype) หรือพันธุ์แท้ โอกาสที่ทารกเกิดมาเป็น RhD-positive 100%
หากยีนประกอบด้วยแอลลีลที่ต่างกัน “Dd” (Heterogenous genotype) หรือ พันธุ์ทาง โอกาสที่ทารกเกิดมามีหมู่เลือดเป็น RhD-negative หรือ positive อย่างละ 50% อาจจะเป็นต้องส่งตรวจทางห้องปฏิบัติการเพิ่มเติมเพื่อประเมินหมู่เลือดในทารก
การตรวจหมู่เลือดในทารก(2)
จะทำในกรณีที่เป็น Heterozygous paternal genotype หรือไม่ทราบข้อมูลของหมู่เลือดสามี โดยการตรวจมีสองวิธี คือ
- การตรวจ Polymerase chain reaction (PCR) จากการเจาะน้ำคร่ำ การเจาะตรวจชิ้นเนื้อรกหรือการเจาะเลือดจากสายสะดือ วิธีนี้จะเสี่ยงต่อการแท้งและเพิ่มโอกาสเกิด Alloimmunization ในสตรีตั้งครรภ์
- การตรวจ Cell free fetal DNA เป็นวิธีที่น่าเชื่อถือและตรวจได้เร็วกว่า(11) เนื่องจากสามารถตรวจได้ตั้งแต่อายุครรภ์ 38 วัน และเป็นอันตรายต่อทารกน้อยกว่าเนื่องจากใช้เลือดสตรีตั้งครรภ์ในการตรวจ DNA ของทารก
หากทารกมีหมู่เลือด RhD-positive จำเป็นต้องอัลตราซาวนด์ดอพเลอร์ MCA-PSV ในทารกเป็นระยะ เพื่อประเมินภาวะซีดจากเม็ดเลือดแดงแตก
Peak systolic floe velocity in the fetal middle cerebral artery
เพื่อประเมินภาวะซีดของทารกที่เป็นมาตรฐาน เป็นวิธีที่ไม่เป็นอันตรายต่อทารก(12) ไม่เสี่ยงต่อการแท้งลดการเกิดภาวะ Alloimmunization เมื่อเทียบกับการตรวจวิธีเดิมที่ใช้การเจาะน้ำคร่ำไปวิเคราะห์ระดับบิลลิรูบินโดยใช้ Queenan และ Liley curves
หากค่า MCA-PSV น้อยกว่า 1.5 multiples of median(MoM)ในอายุครรภ์นั้น ให้ทำการตรวจซ้ำทุก 1-2 สัปดาห์
หากค่า MCA-PSV มากกว่าหรือเท่ากับ 1.5 multiples of median(MoM) ในอายุครรภ์นั้น แสดงว่าทารกน่าจะมีภาวะซีดระดับปานกลางถึงรุนแรง จำเป็นต้องเจาะสายสะดือลูกเพื่อตรวจหาความเข้มข้นของเลือดทารก(Fetal hematocrit)
- ความเข้มข้นของเลือดทารก มีค่าน้อยกว่าหรือเท่ากับ 30% เป็นข้อบ่งชี้ในการเติมเลือดทารกในครรภ์
- ความเข้มข้นของเลือดทารก มีค่ามากกว่า 30% ทำการประเมินซ้ำทุก 1-2 สัปดาห์
การเติมเลือดทารกในครรภ์(Intrauterine blood transfusion)
ข้อบ่งชี้ คือ ทารกมีภาวะซีดรุนแรง ความเข้มข้นของเลือดทารก มีค่าน้อยกว่าหรือเท่ากับ 30% หรือมีภาวะทารกบวมน้ำ หลังการเติมเลือดจะประเมินภาวะซีดเป็นระยะโดยใช้ MCA-PSA หากมากกว่า 1.32 MoM(13) จะถือว่าทารกน่าจะมีภาวะซีดในระดับปานกลางถึงรุนแรง และควรหาระดับความเข้มเลือดทารกต่อไป
สามารถเติมเลือดทารกไปจนถึงอายุครรภ์ 36 สัปดาห์ และชักนำการคลอดในช่วงอายุครรภ์ 37-38 สัปดาห์
พิจารณาให้สตรีตั้งครรภ์รับประทานยา Phenobarbital ก่อนคลอด 7-10 วัน เพื่อกระตุ้นให้ตับสามารถคอนจูเกตบิลลิรูบิลได้ดีมากขึ้น ทำให้ลดจำนวนการเปลี่ยนถ่ายเลือดในทารกแรกเกิด(Neonatal exchange transfusion )ที่มีภาวะเหลืองได้(14)
เริ่มประเมินสุขภาพทารกในครรภ์โดยใช้ Non-stress test(NST) หรือ Biophysical profile(BPP) ตั้งแต่อายุครรภ์ 32 สัปดาห์
Rhesus Immunoglobulin products(RhIG) หรือ Anti-D immunoglobulin(15)
เป็น Anti-D immunoglulin มีชื่อทางการค้าหลายชื่อ เช่น RhoGAM, HyperRHO S/D, Rhophalc และ WinRho-SDF เป็นต้น สกัดมาจากมนุษย์ซึ่งผ่านการกำจัดเชื้อไวรัสที่สามารถติดต่อทางเลือด เช่น เชื้อไวรัสตับอักเสบบีและซี เชื้อไวรัสไซโตเมกะโลไวรัส และเชื้อพาโวไวรัส เป็นต้น จัดอยู่ในกลุ่ม Category C ในหญิงตั้งครรภ์ สามารถให้ได้ในสตรีที่ให้นมบุตรเนื่องจากไม่ขับออกทางน้ำนม ค่าครึ่งชีวิต (T1/2; Half life) 24-30 วัน
โดยทั่วไป 1 vial ประกอบด้วย 1,500 IU of Rhesus immunoglobulin หรือ 300 มคก.
ผลข้างเคียง อาจจะเกิดอาการแพ้แต่เกิดค่อนข้างน้อย และค่าบิลลิรูบินสูงขึ้นจากการทำลายเม็ดเลือดแดงเกิดขึ้นน้อยมาก
ข้อบ่งห้ามในการใช้ ได้แก่ กรุ๊ปเลือด RhD positive กรุ๊ปเลือด RhD negativeที่เกิดภาวะ Alloimmunization และผู้ที่แพ้ต่อ RhIG
สามารถให้ทางกล้ามเนื้อหรือทางเส้นเลือดดำ(2) ส่วนมากจะฉีดเข้าทางกล้ามเนื้อแต่ไม่ควรเกิน 1,500 มคก.หากเกินกว่านี้แนะนำให้ฉีดทางเส้นเลือดดำ และแบ่งให้แต่ละครั้งไม่เกิน 600 มคก. ทุก 8 ชั่วโมง
ปัจจุบัน กำลังมีการศึกษา Rozrolimupab(16) เป็น recombinant monoclonal antibodies ที่ถูกสังเคราะห์ขึ้นจากบริษัทในประเทศสวีเดน ใช้ในการรักษา Idiopathic thrombocytopenic purpura และ ใช้เพื่อป้องกัน Hemolytic disease of the fetus and newborn โดยใช้ปริมาณเท่ากับ RhIG ในการศึกษา phase 1 ไม่พบผลข้างเคียงที่น่ากังวล ตอนนี้กำลังศึกษาอยู่ใน phase 2
การใช้ RhIG เพื่อป้องกัน Anti-D alloimunization ในสตรีตั้งครรภ์หมู่เลือด Rh-D negative
ปริมาณของ RhIG ขึ้นอยู่กับ ช่วงเวลาและเหตุการณ์ที่เกิดขึ้นระหว่างตั้งครรภ์
First Affected Pregnancy
ในสตรีตั้งครรภ์ที่ไม่มีเหตุการณ์ที่อาจจะทำให้เลือดทารกหมู่เลือด Rh-D positive ปนเปื้อนเข้าสู่กระแสเลือดมารดาหมู่เลือด Rh-D negative จะมีการประเมินแอนติบอดีในเลือดมารดาอย่างน้อย 2 ครั้ง ตั้งแต่ฝากครรภ์ครั้งแรก ขณะอายุครรภ์ 28 สัปดาห์(17) และอายุครรภ์ 40 สัปดาห์หากยังไม่คลอด เพื่อประเมินว่ามีการเกิดภาวะ Anti-D alloimmunization หรือไม่ หากมีการสร้างแอนติบอดีแล้ว การให้ RhIG จะไม่เกิดประโยชน์ การให้ RhIG ในการป้องกันภาวะดังกล่าวจะให้ปริมาณ 300 มคก. ขณะอายุครรภ์ 28 สัปดาห์(18) หากไม่คลอดภายหลังจากได้ครั้งแรก 12 สัปดาห์ ควรได้รับ RhIG อีกครั้ง เป็นครั้งที่สอง โดยทั่วไปหลังได้รับ RhIG ปริมาณ titer จะขึ้นได้เล็กน้อย ประมาณ 1:2-1:4 ซึ่งไม่ทำให้เกิดอันตรายต่อทารกในครรภ์
หลังคลอด การให้ RhIG แนะนำให้คำนวณปริมาณการให้ RhIG ทุกครั้ง ซึ่งขึ้นอยู่กับปริมาณเลือดทารกที่เข้ากระแสเลือดมารดา ตามสูตรใน รูปภาพที่ 1 เพื่อป้องกันการเกิด Anti-D Alloimmunization ได้อย่างมีประสิทธิภาพ เวลาที่เหมาะสม คือ ภายใน 72 ชั่วโมงหลังคลอด(18) ถ้าหากให้ภายใน 13 วัน(19) สามารถป้องกันได้บางส่วน ระยะเวลาช้าที่สุดที่คิดว่ายังมีประโยชน์คือ 28 วันหลังคลอด(20)
หากได้รับการป้องกันด้วยวิธีดังกล่าวข้างต้นแล้ว สำหรับในครรภ์ถัดไปหากตรวจไม่พบแอนติบอดีในการฝากครรภ์ครั้งแรกให้ดูแลเหมือนกรณี First Affected Pregnancy
นอกจากนี้ พิจารณาการให้ RhIG ในกรณีที่มีเหตุการณ์ดังต่อไปนี้
- ช่วงแรกของการฝากตั้งครรภ์ เช่น Spontaneous abortion, Threatened abortion, Therapeutic abortion และ Ectopic pregnancy เป็นต้น เนื่องจากแอนติเจนบนผิวเม็ดเลือดแดงของทารก เริ่มสร้างตั้งแต่อายุครรภ์ 38 วัน ดังนั้น หากเกิดภาวะดังกล่าวหลังจากนี้ มีโอกาสที่จะเกิดภาวะ Alloimmunization 2-3% (21) นอกจากนี้
- ได้รับการทำหัตถการ เช่น การทำเจาะน้ำคร่ำ การตัดชิ้นเนื้อรก การเจาะเลือดจากสายสะดือทารก เป็นต้น
- ทารกตายในครรภ์ที่ไตรมาสที่สองหรือสาม
- Partial hydatidiform mole สำหรับกรณีที่พิสูจน์แล้วว่าเป็น Complete hydatidiform mole ไม่จำเป็นต้องได้รับเนื่องจากไม่มีการปรากฏแอนติเจนเซลล์รก
- ภาวะตกเลือดก่อนคลอด
- ได้รับบาดเจ็บถูกกระแทกบริเวณท้อง
- ทำ External cephalic version
ปริมาณของ RhIG ที่เหมาะสม คือ 50 มคก. และ 300 มคก. หากอายุครรภ์น้อยกว่า 12 สัปดาห์ และมากกว่า 12 สัปดาห์ ตามลำดับ แม้ว่าจะได้รับ RhIG ในช่วงไตรมาสที่หนึ่งหรือสองแล้ว ควรที่จะได้รับ RhIG ที่อายุครรภ์ 28 สัปดาห์เช่นเดิม
ในกรณีที่ทำหมันหลังคลอดหรือหลังแท้งนั้น การฉีด RhIG ป้องกัน Anti-D alloimmunization ขึ้นอยู่กับความต้องการของผู้ป่วย ซึ่งอาจเป็นประโยชน์ในกรณีที่รับเลือดไม่ตรงกลุ่มในกรณีฉุกเฉิน(22)
การคำนวณปริมาณ Anti-D immunoglobulinที่ใช้ป้องกันภาวะ Alloimmunization(23)
ปริมาณการใช้ anti-D immunoglobulin นั้น จะขึ้นอยู่กับปริมาณเลือดลูกที่มี่แอนติเจนผิวเม็ดเลือดแดงไปกระตุ้นระบบภูมิคุ้มกันในสตรีตั้งครรภ์ที่ไม่มีแอนติเจนดังกล่าวเนื่องจากเป็นสิ่งแปลกปลอม ให้สร้างแอนติบอดี
Rosette screen ใช้เป็นการตรวจคัดกรองโอกาสที่มารดาจะถูกกระตุ้นให้สร้างแอนติบอดีต่อเลือดทารกซึ่งสามารถตรวจพบได้เมื่อมีปริมาณเม็ดเลือดลูก 10 มล. หรือ 0.2%เม็ดเลือดแดงทารกต่อเม็ดเลือดแดงมารดา หากให้ผลบวก จำเป็นต้องคำนวณปริมาณของเลือดทารกที่เข้าสู่กระแสเลือดมารดาโดยใช้ Kleihauer-Betke acid-elusion test หรือ Flow cytometry เพื่อคำนวณปริมาณ Anti-D immunoglobulinที่ต้องใช้ในการป้องภาวะ Alloimmunization ผลที่ได้จะเป็น %เม็ดเลือดทารกต่อเม็ดเลือดแดงมารดา
Kleihauer-Betke acid-elusion test(24) ใช้ความสามารถในการทนต่อกรดของเม็ดเลือด ฮีโมโกลบินทารก(Hemoglobin F: HbF) ทนต่อความเป็นกรดได้ดีกว่าเมื่อเทียบกับมารดา ตรวจโดยใช้ Blood smear จากเลือดมารดาที่ผ่านเหตุการณ์ที่คิดว่าจะเกิด Fetomaternal hemorrhage หรือหลังจากเด็กคลอดอย่างน้อย 30-60 นาที มาผ่านสารละลายที่เป็นกรด จะพบว่าเม็ดเลือดแดงของทารกจะติดสีชมพูเข้ม ส่วนเม็ดเลือดแดงมารดาจะถูกทำลาย ลักษณะจะซีดและขอบเขตไม่ชัดเจน หรือเรียกว่า Ghost (ผี) คำนวณเปอร์เซ็นต์ของเม็ดเลือดแดงลูกต่อเม็ดเลือดแดงจากการนับเซลล์ทั้งหมด 2,000 เซลล์ (%fetal RBC)
Flow cytometry(25) เป็นการนับจำนวนเม็ดเลือดแดงทารกต่อเม็ดเลือดแดงมารดาโดยใช้เครื่องอัตโนมัติ ซึ่งเป็นวิธีการตรวจที่แม่นยำและรวดเร็วกว่า แต่ราคาแพงกว่า
Fetal blood volume = ( Maternal blood volume x Maternal Hct x %Fetal blood) / Newborn Hct
สูตรในการคำนวณปริมาณเลือดทารกที่เข้าสู่กระแสเลือดมารดา หน่วยเป็น มล.
โดยทั่วไปปริมาณเลือดในสตรีตั้งครรภ์ทั่วไปที่มีความดันโลหิตปกติประมาณ 5,000 มล.
ปริมาณ Anti-D immunoglobulin 1 มคก. สามารถป้องกันการเกิดการกระตุ้นภูมิคุ้มกันจากเลือดทารกได้ 1 มล. หรือ เม็ดเลือดแดงลูก 0.5 มล. ทางทฤษฎี
ในทางปฏิบัติ จะคำนวณเป็นจำนวน Vial ของ Anti-D immunoglobulin (1 vial : 300 mcg. of Anti-D immunoglobulin) หากคำนวณได้เป็นจุดทศนิยมที่มากกว่าหรือเท่ากับ 5 ให้ปัดขึ้นแล้วเพิ่มอีก 1 vial หากคำนวณได้เป็นจุดทศนิยมที่น้อยกว่า5 ให้ปัดลงแล้วเพิ่มอีก 1 vial
ตัวอย่างเช่น คำนวณได้ปริมาณ Anti-D immunoglobulin 1.7 vials จะใช้จริง 2+1= 3 vials
คำนวณได้ปริมาณ Anti-D immunoglobulin 1.3 vials จะใช้จริง 1+1= 2 vials
เอกสารอ้างอิง
- Moise KJ, Jr. Management of rhesus alloimmunization in pregnancy. Obstetrics and gynecology. 2008;112(1):164-76.
- Creasy RK. Creasy and Resnik’s Maternal-Fetal Medicine: Principles and Practice. In: Resnik R, editor. 7 ed: Elsevier Health sciences; 2014. p. 558-68.
- Baskett TF, Parsons ML, Peddle LJ. The experience and effectiveness of the Nova Scotia Rh program, 1964-84. CMAJ : Canadian Medical Association journal = journal de l’Association medicale canadienne. 1986;134(11):1259-61.
- Bennardello F, Coluzzi S, Curciarello G, Todros T, Villa S. Recommendations for the prevention and treatment of haemolytic disease of the foetus and newborn. Blood Transfusion. 2015;13(1):109-34.
- Basu S, Kaur R, Kaur G. Hemolytic disease of the fetus and newborn: Current trends and perspectives. Asian Journal of Transfusion Science. 2011;5(1):3-7.
- Garratty G, Glynn SA, McEntire R. ABO and Rh(D) phenotype frequencies of different racial/ethnic groups in the United States. Transfusion. 2004;44(5):703-6.
- Koelewijn JM, Vrijkotte TG, van der Schoot CE, Bonsel GJ, de Haas M. Effect of screening for red cell antibodies, other than anti-D, to detect hemolytic disease of the fetus and newborn: a population study in the Netherlands. Transfusion. 2008;48(5):941-52.
- ACOG Practice Bulletin No. 75: Management of alloimmunization during pregnancy. Obstetrics and gynecology. 2006;108(2):457-64.
- Cunningham FG. Williams obstetrics. New York: McGraw-Hill Education; 2014. p. 306-20.
- Hypersensitivities [Internet]. 2017 [cited 27 July 2017]. Available from: https://courses.lumenlearning.com/microbiology/chapter/hypersensitivities/.
- Sbarsi I, Isernia P, Montanari L, Badulli C, Martinetti M, Salvaneschi L. Implementing non-invasive RHD genotyping on cell-free foetal DNA from maternal plasma: the Pavia experience. Blood Transfusion. 2012;10(1):34-8.
- Mari G, Deter RL, Carpenter RL, Rahman F, Zimmerman R, Moise KJ, Jr., et al. Noninvasive diagnosis by Doppler ultrasonography of fetal anemia due to maternal red-cell alloimmunization. Collaborative Group for Doppler Assessment of the Blood Velocity in Anemic Fetuses. The New England journal of medicine. 2000;342(1):9-14.
- Detti L, Oz U, Guney I, Ferguson JE, Bahado-Singh RO, Mari G. Doppler ultrasound velocimetry for timing the second intrauterine transfusion in fetuses with anemia from red cell alloimmunization. American journal of obstetrics and gynecology. 2001;185(5):1048-51.
- Trevett TN, Jr., Dorman K, Lamvu G, Moise KJ, Jr. Antenatal maternal administration of phenobarbital for the prevention of exchange transfusion in neonates with hemolytic disease of the fetus and newborn. American journal of obstetrics and gynecology. 2005;192(2):478-82.
- Medscape. Rho(D) immune globulin(Rx). 2017.
- Stasi R. Rozrolimupab, symphobodies against rhesus D, for the potential prevention of hemolytic disease of the newborn and the treatment of idiopathic thrombocytopenic purpura. Current opinion in molecular therapeutics. 2010;12(6):734-40.
- American Association of Blood Banks: Standards for blood banks and transfusion services,ed29. Bethesda,MD,2014.
- ACOG practice bulletin. Prevention of Rh D alloimmunization. Number 4, May 1999 (replaces educational bulletin Number 147, October 1990). Clinical management guidelines for obstetrician-gynecologists. American College of Obstetrics and Gynecology. International journal of gynaecology and obstetrics: the official organ of the International Federation of Gynaecology and Obstetrics. 1999;66(1):63-70.
- Samson D, Mollison PL. Effect on primary Rh immunization of delayed administration of anti-Rh. Immunology. 1975;28(2):349-57.
- Bowman JM. Controversies in Rh prophylaxis. Who needs Rh immune globulin and when should it be given? American journal of obstetrics and gynecology. 1985;151(3):289-94.
- Jabara S, Barnhart KT. Is Rh immune globulin needed in early first-trimester abortion? A review. American journal of obstetrics and gynecology. 2003;188(3):623-7.
- Gorman JG, Freda VJ. Rh immune globulin is indicated for Rh-negative mothers undergoing sterilization. American journal of obstetrics and gynecology. 1972;112(6):868-9.
- Kim YA, Makar RS. Detection of fetomaternal hemorrhage. American journal of hematology. 2012;87(4):417-23.
- Kleihauer E, Braun H, Betke K. [Demonstration of fetal hemoglobin in erythrocytes of a blood smear]. Klinische Wochenschrift. 1957;35(12):637-8.
- Davis BH, Olsen S, Bigelow NC, Chen JC. Detection of fetal red cells in fetomaternal hemorrhage using a fetal hemoglobin monoclonal antibody by flow cytometry. Transfusion. 1998;38(8):749-56.


