หูดอวัยวะเพศ (Anogenital wart)
พญ. ปวีณา พังสุวรรณ
อาจารย์ที่ปรึกษา อ. นพ. เศรษฐวัฒก์ เศรษฐเสถียร
หูดอวัยวะเพศ หรือหูดหงอนไก่ (Anogenital wart, Condyloma acuminata) เป็นโรคติดต่อทางเพศสัมพันธ์ ที่พบบ่อย ทั้งในเพศชายและหญิง เกิดจากการติดเชื้อไวรัส HPV ทำให้เกิดการเจริญผิดปกติของผิวหนังบริเวณอวัยวะสืบพันธุ์และทวารหนัก เห็นลักษณะเป็นตุ่มหรือแผ่นนูนยื่นออกมาบริเวณอวัยวะเพศภายนอก ผิวหนังรอบทวาร ฝีเย็บ หรือขาหนีบ อาจมีอาการปวด คัน หรือไม่มีอาการก็ได้(1) หูดอวัยวะเพศมักมีสีเหมือนสีผิวปกติ หากพบว่ามีสีเข้มกว่าปกติ ควรพิจารณาตัดชิ้นเนื้อเพื่อตรวจหาภาวะผิดปกติอื่นหรือมะเร็งผิวหนัง(2)
สาเหตุของโรค (Etiology)
เกิดจากเชื้อ HPV (Human papillomavirus) ซึ่งเป็นเชื้อไวรัสในกลุ่มดีเอ็นเอสายคู่ที่ไม่มีเปลือกชั้นนอกหุ้ม ในจีนัส Papillomavirus และวงศ์ Papillomaviridae(3) โดยไวรัสชนิดนี้ถูกค้นพบมากกว่า 200 สายพันธุ์ กว่า 40 สายพันธุ์ติดต่อทางเพศสัมพันธ์ สามารถติดเชื้อที่บริเวณอวัยวะเพศและทวารหนัก(4)
เชื้อเอชพีวีแบ่งตามความสามารถในการก่อมะเร็งออกเป็น
- สายพันธุ์ที่เสี่ยงสูงต่อการเกิดมะเร็ง (Oncogenic หรือ high risk HPV types) ได้แก่ สายพันธุ์ 16, 18, 31, 33, 35, 39, 41-45, 51, 52, 56, 59(5,6)
- สายพันธุ์ที่ไม่เพิ่มความเสี่ยงต่อมะเร็ง (Nononcogenic หรือ low risk HPV types) ได้แก่ สายพันธุ์ 6, 11, 42, 43, 44(5,6)
หูดอวัยวะเพศและทวารหนัก ร้อยละ 90 เกิดจากเชื้อ HPV สายพันธุ์ 6 และ 11(7) ซึ่งเป็นสายพันธุ์ที่ไม่เพิ่มความเสี่ยงต่อมะเร็ง มักติดเชื้อบริเวณเยื่อบุผิวชนิด squamous สามารถติดเชื้อได้กับทุกส่วนของอวัยวะเพศที่ปกคลุมด้วยเยื่อบุชนิดนี้ ได้แก่ ปากช่องคลอด แคม คลิตอริส ผนังช่องคลอด รวมถึงบริเวณลึกๆ เช่น ปากมดลูก ภายในช่องคลอด ทวารหนัก ในท่อปัสสาวะ นอกจากนี้ยังทำให้เกิดหูดที่บริเวณเยื่อบุตา โพรงจมูก ช่องปาก และกล่องเสียงในทารกแรกคลอดที่ได้รับเชื้อจากช่องทางคลอดขณะคลอด อย่างไรก็ตามสามารถพบการติดเชื้อร่วมกันของ low risk และ high risk HPV ที่ทำให้เกิดหูดอวัยวะเพศได้บ่อยได้แก่ HPV สายพันธุ์ 16, 18, 31, 33 และ 35 ซึ่งมักพบร่วมกับ HPV 6 และ 11 และยังสัมพันธ์กับการเกิด high-grade squamous intraepithelial lesions (HSIL) ได้ โดยเฉพาะในผู้ติดเชื้อเอชไอวี
การแพร่เชื้อ (Transmission)
เชื้อ HPV ติดต่อผ่านทางการสัมผัสโดยตรงกับผิวหนังหรือเยื่อบุที่ติดเชื้อ โดยเชื้อไวรัสจะบุกรุกเข้าไปในเซลล์ของชั้น epidermal basal layer ผ่านทางรอยถลอกขนาดเล็ก (microabrasion) ดังนั้น การติดเชื้อ HPV ที่บริเวณอวัยวะเพศและทวารหนักจึงมักเกิดผ่านการมีเพศสัมพันธ์ โดยผู้ที่แพร่เชื้อไม่จำเป็นต้องมีรอยโรค แต่ในคนที่มีรอยโรคจะมีโอกาสแพร่เชื้อได้มากกว่าเนื่องจากมีปริมาณไวรัสสูงกว่า
เมื่อได้รับเชื้อ HPV เข้าสู่ร่างกาย จะทำให้เกิดการติดเชื้อในระยะแฝง (latent phase) โดยอาจมีหรือไม่มีอาการก็ได้ ระยะฟักตัวของเชื้อประมาณ 3 สัปดาห์ถึง 8 เดือน (เฉลี่ย 2.9 เดือน) หากมีการติดเชื้อ HPV สายพันธุ์ 6 และ 11 มักจะมีโอกาสเกิดหูดอวัยวะเพศได้สูง
ปัจจัยเสี่ยง (Risk factor)
- การมีเพศสัมพันธ์ (sexual activity) เป็นปัจจัยเสี่ยงพื้นฐานของการติดเชื้อ HPV(8) ไม่ว่าจะเป็นเพศสัมพันธ์ทางช่องคลอดหรือทางทวารหนัก และยังสามารถติดต่อได้โดยไม่ต้องมีการสอดใส่ (non-penetrating sexual intercourse) แต่พบได้น้อย
- การมีเพศสัมพันธ์ทางทวารหนักเป็นปัจจัยเสี่ยงหลักในการติดเชื้อ HPV ในทวารหนัก อย่างไรก็ตามอาจเกิดจากการสัมผัสอื่นๆ เช่น นิ้ว สิ่งของ หรือติดจากอวัยวะเพศอื่นที่ติดเชื้อ HPVได้ (autoinoculation)
- ความเสี่ยงของการติดเชื้อ HPV แปรผันตามจำนวนคู่นอน การเปลี่ยนคู่นอนบ่อยๆ มีโอกาสเสี่ยงติดเชื้อมากกว่าการมีคู่นอนเพียงคนเดียว การศึกษาแบบไปข้างหน้าของ Moscicki AB และคณะ พบว่า ความเสี่ยงสัมพัทธ์ของการติดเชื้อ HPV คิดเป็น 10.1 เท่าต่อการมีคู่นอนใหม่ต่อเดือน(9)
- ภาวะภูมิคุ้มกันต่ำ เช่น ติดเชื้อเอชไอวี เป็นเบาหวานที่ควบคุมไม่ดี หรือได้รับยากดภูมิคุ้มกัน หูดมักมีขนาดใหญ่ ดื้อต่อการรักษา มีอัตราการกลับเป็นซ้ำสูง และมีโอกาสเกิดเป็นรอยโรคมะเร็งมากขึ้น
- การสูบบุหรี่ เพิ่มความเสี่ยงตามจำนวนบุหรี่ที่สูบต่อปี(10)
- การขลิบอวัยวะเพศชาย (Male circumcision) ลดความเสี่ยงในการติดเชื้อ HPV และลดการแพร่เชื้อไปยังผู้หญิง(11)
ระบาดวิทยาของโรค (Epidemiology)
การติดเชื้อ HPV พบได้บ่อยทั่วโลก ความชุกโดยประมาณของการติดเชื้อ HPV บริเวณอวัยวะเพศและทวารหนักในสหรัฐอเมริกา คิดเป็นร้อยละ 10-20 ในคนที่ไม่ได้รับวัคซีน อย่างไรก็ตาม ความชุกของโรคมีแนวโน้มลดลงหลังมีการใช้วัคซีนป้องกันอย่างแพร่หลายมากขึ้น อัตราอุบัติการณ์ของโรค คิดเป็น 160-289 คนต่อประชากร 100,000 คนต่อปี อัตราความชุกแตกต่างกันตามรายงานตั้งแต่ 0.13-5.1% โดยมากพบในวัยหนุ่มสาว โดยเฉพาะกลุ่มอายุน้อยกว่า 24 ปีในเพศหญิง และกลุ่มอายุ 25-29 ปีในเพศชาย(12)
อาการและอาการแสดง (Clinical manifestations)
ลักษณะจำเพาะของหูดอวัยวะเพศ มักเป็นติ่งเนื้อยื่นออกมาจากผิว สีชมพู กระจายออกทางด้านบนคล้ายหงอนไก่หรือดอกกะหล่ำ เกิดจากเยื่อบุที่ติดเชื้อระหว่างการมีเพศสัมพันธ์ (microtrauma) ทำให้เกิดรอยโรคที่เป็นรอยนูนหรือมีก้านยื่นขึ้นบริเวณผิว (granular papillations) เป็นตะปุ่มตะป่ำเหมือนดอกกะหล่ำ (verrucous or cauli-flower appearance)
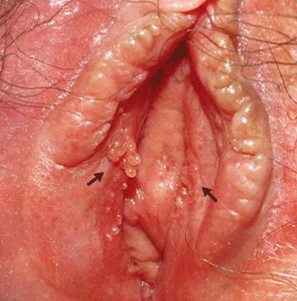
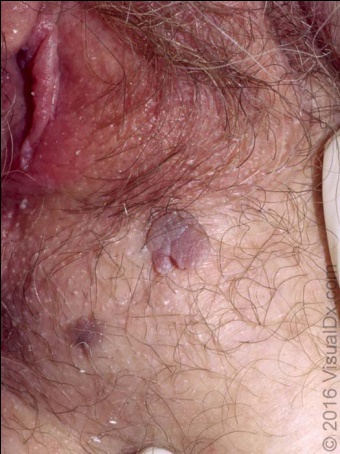
ภาพที่ 1 และ 2 รอยโรคจำเพาะของหูดอวัยวะเพศ ลักษณะเป็นตะปุ่มตะป่ำเหมือนดอกกะหล่ำ
(https://usmlegalaxy.files.wordpress.com/2010/08/picture10.png, https://www.uptodate.com/contents/images/DERM/108140/Condyloma_acuminatum_vulva.jpg)
อย่างไรก็ตามสามารถพบรอยโรคได้หลายลักษณะ อาจเป็นรอยโรคเดี่ยวหรือกลุ่ม มีลักษณะแบนเรียบ นูน ลักษณะโค้งเป็นโดม เป็นปื้น เป็นหยักๆ เหมือนดอกกะหล่ำ หรือเป็นชนิดมีก้านยื่นออกมาจากเยื่อบุผิวก็ได้ มักมีสีเหมือนผิวหนัง คือสีชมพู บางรายอาจมีสีขาว แดง หรือน้ำตาล ส่วนมากจะนุ่ม มีขนาดหลากหลายตั้งแต่ 1 มิลลิเมตรถึงหลายเซนติเมตร
ตำแหน่งที่พบบ่อยได้แก่ รอบปากช่องคลอด ใต้หนังหุ้มปลายองคชาติ และบริเวณลำองคชาติที่ขลิบแล้ว อาจพบได้หลายตำแหน่งพร้อมๆ กัน รวมทั้งในตำแหน่งอื่นๆ เช่น ปากมดลูก ช่องคลอด ท่อปัสสาวะ ฝีเย็บ รอบทวารหนัก รูทวารหนัก และอัณฑะ โดยหูดบริเวณด้านในทวารหนัก มักพบในผู้ที่มีเพศสัมพันธ์ทางทวารหนักโดยเป็นผู้รับ อาจเป็นเพศชายหรือหญิงก็ได้(13)
ผู้ป่วยส่วนมากมักไม่มีอาการ ขึ้นกับตำแหน่งและขนาดของรอยโรค อาจมีอาการคันได้บ้าง ในรายที่เกิดแผลจากการบาดเจ็บหรือติดเชื้อซ้ำซ้อนอาจมีอาการคัน หรือมีน้ำหนองกลิ่นเหม็นได้
ผลต่อสภาวะจิตใจ (Psychologic effect) ผู้ป่วยที่มีหูดบริเวณอวัยวะเพศควรได้รับการตรวจประเมินสภาวะทางจิตใจด้วย เนื่องจากผู้ป่วยเหล่านี้ มักมีความเครียด วิตกกังวล ซึมเศร้า กลัว อับอาย และอาจมีความกังวลต่อภาวะเจริญพันธุ์ การเกิดมะเร็งในอนาคต และอาจส่งผลต่อความสัมพันธ์กับคู่สมรสได้
การดำเนินโรค (Clinical course)
รอยโรคประมาณ 1 ใน 3 จะหายไปได้เองโดยไม่ต้องรับการรักษา ภายในระยะเวลา 1 ปี แต่อย่างไรก็ตาม การติดเชื้อ HPV ยังคงมีอยู่ จึงมีโอกาสเป็นรอยโรคซ้ำขึ้นมาได้อีก (14) โอกาสกลับเป็นซ้ำ คิดเป็น 20-30% ของผู้ป่วยทั้งหมด แม้ว่าจะได้รับการรักษาอย่างเหมาะสมแล้วก็ตาม โดยขึ้นกับสภาวะภูมิคุ้มกันของผู้ป่วยและการลุกลามของรอยโรค โดยมักกลับเป็นซ้ำใน 2-3 เดือน เนื่องจากการรักษาไม่ว่าจะเป็นการใช้ยาหรือการผ่าตัด จะกำจัดเฉพาะรอยโรคออกไป แต่ไม่สามารถกำจัดเซลล์ที่ติดเชื้อ HPV ออกไปได้หมด เพราะมีการติดเชื้อ HPV แบบแฝง (latent infection) ซึ่งไม่มีรอยโรคให้เห็นในขณะนั้น ทำให้ผู้ป่วยเหล่านี้ยังมีความสามารถในการแพร่เชื้อไปสู่คู่นอน และมีโอกาสติดเชื้อในตนเองซ้ำ ที่บริเวณใกล้เคียง (autoinoculation) เชื่อว่าการเสียดสี บาดแผล การถูกกดภูมิคุ้มกัน และการอักเสบ เป็นปัจจัยที่กระตุ้นให้เกิดการแบ่งตัวของไวรัสเพิ่มขึ้นในเซลล์ที่มีการติดเชื้อแบบแฝง ทำให้เกิดรอยโรคขึ้นมาได้(15)
ความสัมพันธ์กับการเกิดมะเร็ง
แม้ว่าเชื้อสาเหตุของหูดอวัยวะเพศกว่า 90% จะเป็นเชื้อ HPV 6 และ 11 ซึ่งไม่สัมพันธ์กับการเกิดมะเร็ง แต่อย่างไรก็ตาม สามารถพบการติดเชื้อร่วมของเชื้อ HPV ชนิดที่มีความเสี่ยงสูงต่อการเกิดมะเร็งได้บ่อย
จากการศึกษาแบบ cohort ในเดนมาร์กของ Blomberg M และคณะ พบอุบัติการณ์เกิดโรคมะเร็งเหล่านี้ในผู้ป่วยที่มีหูดอวัยวะเพศสูงขึ้น ได้แก่ มะเร็งทวารหนัก (Anal cancer, SIR ชาย 21.5 เท่า, หญิง 7.8 เท่า) มะเร็งปากช่องคลอด (Vulvar cancer, SIR 14.8 เท่า), มะเร็งช่องคลอด (Vaginal cancer, SIR 5.9 เท่า), มะเร็งปากมดลูก (Cervical cancer SIR 1.5 เท่า), มะเร็งองคชาติ (Penile cancer, SIR 8.2 เท่า), มะเร็งศีรษะและคอ (Head and neck cancers, SIR 2.8 เท่า)(16)
การที่รอยโรคหูดอวัยวะเพศจะกลายเป็นมะเร็งโดยตรง พบได้น้อย แต่จะพบมากขึ้นในผู้ป่วยที่มีภาวะภูมิคุ้มกันต่ำ
การวินิจฉัยและการวินิจฉัยแยกโรค (Diagnosis and Differential diagnosis)
อาศัยลักษณะทางคลินิกเป็นสำคัญ การตรวจยืนยันโดยการตัดชิ้นเนื้อส่งตรวจทางพยาธิวิทยาจะพิจารณาทำในรายที่รอยโรคมีลักษณะที่ไม่จำเพาะต่อหูดเช่น มีสีเข้ม แข็ง ติดแน่นกับเนื้อเยื่อด้านล่าง การวินิจฉัยไม่แน่นอน ไม่ตอบสนองต่อการรักษาตามมาตรฐาน ต้องการแยกจากแผลมะเร็ง แผลจากการติดเชื้อโรคติดต่อทางเพศสัมพันธ์อื่นๆ เช่น Molluscum contagious, Papulosquamous lichen planus, Bowenoid papulosis เป็นต้น
การติดเชื้อสามารถเกิดร่วมกันได้หลายตำแหน่งบริเวณอวัยวะเพศและรอบทวารหนัก จึงควรตรวจร่างกายทุกตำแหน่งที่อาจเกิดหูดอวัยวะเพศได้ นอกจากนั้น ควรตรวจหารอยโรคหรืออาการแสดงของโรคติดเชื้อทางเพศสัมพันธ์อื่นๆ ที่อาจพบร่วม ได้แก่ แผล ต่อมน้ำเหลืองโต ตุ่มน้ำใส หรือสารคัดหลั่งผิดปกติต่างๆ
ผู้ป่วยกลุ่มนี้อาจมีการติดเชื้อ HPV ที่มีความเสี่ยงสูงร่วมอยู่ ควรตรวจคัดกรองมะเร็งปากมดลูกทุกราย ตรวจร่างกายคู่นอน และตรวจคัดกรองโรคติดต่อทางเพศสัมพันธ์คู่นอนที่มีพฤติกรรมเสี่ยง เช่น เปลี่ยนคู่นอนบ่อย
การตัดชิ้นเนื้อตรวจทางพยาธิวิทยา (Biopsy)
มีวัตถุประสงค์เพื่อยืนยันการวินิจฉัยในรายที่ไม่แน่ใจการวินิจฉัย ผู้ป่วยภูมิคุ้มกันต่ำ ไม่ตอบสนองต่อการรักษา และในรายที่รอยโรคสงสัยมะเร็ง ได้แก่ มีลักษณะแข็ง ยึดติดกับเนื้อเยื่อบริเวณข้างเคียง มีเลือดออก มีสีผิดปกติ หรือมีแผล ตำแหน่งที่ควรตัดชิ้นเนื้อ คือ บริเวณที่มีลักษณะผิดปกติมากที่สุด โดยตัดให้รวมขอบของฐานรอยโรคและเนื้อเยื่อข้างเคียงที่ปกติด้วย
การตรวจหาเชื้อ HPV (HPV testing) ไม่จำเป็นต้องทำในทุกราย เนื่องจากไม่ใช่การยืนยันการวินิจฉัยและไม่มีผลต่อการรักษา
ลักษณะทางพยาธิวิทยา (Histopathology)
เมื่อย้อม hematoxylin-eosin (H&E) จะพบลักษณะ papillomatosis, koilocytosis (multiple vacuolated cells with enlarged, irregular nuclei), coarse keratohyaline granules, flat anogenital warts show acanthosis in the epidermal spinous layer
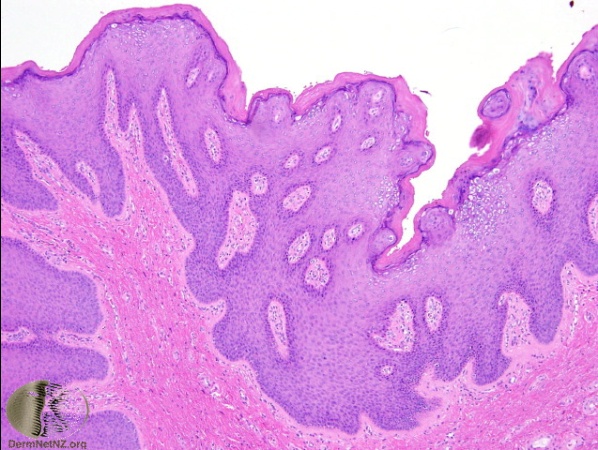
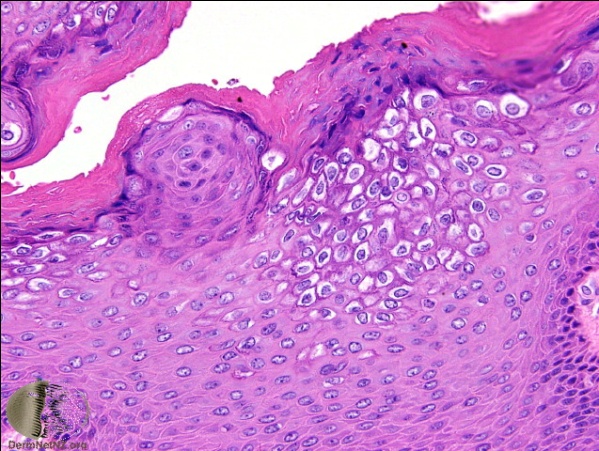
ภาพที่ 3 Papillomatosis ภาพที่ 4 Koilocytosis
(http://www.dermnetnz.org/topics/condyloma-acuminatum-pathology/)
การย้อม MIB1(17) ซึ่งเป็น antibody ต่อ cell proliferation protein Ki-67 ซึ่งจะติดเซลล์ที่มีการติดเชื้อ HPV โดยการติดสี Ki67 ที่เยื่อบุอย่างน้อย 2 ใน 3 ของความหนาแสดงถึงการติดเชื้อ HPV
การรักษา (Treatment)
เนื่องจากหูดอวัยวะเพศส่วนหนึ่งสามารถหายได้เองภายในระยะเวลา 1 ปี ในรายที่มีรอยโรคขนาดเล็กหรือไม่มีอาการ อาจพิจารณาตรวจติดตาม หากยังไม่หายภายใน 1 ปี จึงเริ่มการรักษา
การรักษามีทั้งการรักษาด้วยยาและการรักษาด้วยการผ่าตัด มีอัตราการหายของหูด 35-100% ภายใน 3-15 สัปดาห์ การรักษาหูดอวัยวะเพศ ช่วยลดการติดเชื้อ HPV แต่ไม่สามารถกำจัดเชื้อได้เซลล์ที่มีการติดเชื้อ HPV แบบแฝงเป็นสาเหตุของการกลับเป็นซ้ำ และการแพร่เชื้อให้แก่คู่นอน อัตราการกลับเป็นซ้ำขึ้นกับสภาวะภูมิคุ้มกันของผู้ป่วยและการลุกลามของรอยโรค ผู้ป่วยประมาณ 20-30% จะกลับเป็นซ้ำ (ในตำแหน่งเดิมหรือตำแหน่งใหม่) ภายใน 2-3 สัปดาห์ นอกจากนี้การรักษาหูดอวัยวะเพศไม่ช่วยลดความเสี่ยงของการเกิดมะเร็งในอนาคต ผู้ป่วยจำเป็นต้องมีความเข้าใจเกี่ยวกับกระบวนการรักษาและการตรวจติดตามว่าจะต้องใช้เวลานาน รวมถึงมีโอกาสเกิดการกลับเป็นซ้ำของโรคได้
การเลือกวิธีการรักษา ขึ้นกับขนาด จำนวน ตำแหน่งของรอยโรค ความต้องการของผู้ป่วยค่าใช้จ่าย ความสะดวกสบาย ผลข้างเคียงของการรักษา และประสบการณ์ของผู้รักษาไม่มีข้อมูลที่ชัดเจนว่าการรักษาใดดีกว่า และไม่มีการรักษาใดที่ดีที่สุดเพียงอย่างเดียวสำหรับผู้ป่วยทุกคน ควรพิจารณาในผู้ป่วยแต่ละราย โดยควรให้การรักษาด้วยยาก่อนหากไม่ตอบสนองต่อการรักษาใน 3 สัปดาห์ หรือไม่หายขาดภายใน 6-12 สัปดาห์ให้เปลี่ยนไปใช้การรักษาวิธีอื่น ส่วนการผ่าตัดหูดออกจะเลือกในรายที่มีรอยโรคขนาดใหญ่ หรือล้มเหลวต่อการรักษาด้วยยา การผ่ามีอัตราการหายของรอยโรคในครั้งแรก 90-100% แต่อย่างไรก็ตาม มีโอกาสกลับเป็นซ้ำเท่ากับการรักษาด้วยยา
ภาวะแทรกซ้อนของการรักษา
- ความไม่สุขสบายเฉพาะที่ ได้แก่ อาการคัน แสบร้อน แผลถลอก ปวดบริเวณรอยโรคที่ถูกรักษา
- สีผิวเข้มขึ้นหรือจางลงอย่างถาวร มักเกิดจากการถูกจี้ และการใช้ imiquimod
- แผลเป็นยุบหรือนูน มักเกิดจากการผ่าตัดที่ตัดเนื้อเยื่อใต้ชั้นผิวหนังไปด้วย
- อาการปวดเรื้อรังบริเวณอวัยวะเพศ แต่พบได้ไม่บ่อย
การรักษาแบ่งเป็น
- ผู้ป่วยใช้ยาเอง (Patient-applied therapy) เป็นการรักษาที่บ้าน มีข้อดี คือ มีความเป็นส่วนตัว ผู้ป่วยสามารถนำยากลับไปทาเองที่บ้าน และกลับมาตรวจติดตามหลังการรักษา 2-3 สัปดาห์ โดยผู้ป่วยควรจะทราบวิธีการใช้ยา และผลข้างเคียงของยาก่อน ประกอบด้วย imiquimod, podofilox และ sinecatechins
- แพทย์เป็นผู้รักษา (Provider-administered therapy) ได้แก่ การจี้ Trichloroacetic acid (TCA) หรือ bichloroacetic acid (BCA) การจี้เย็น และการผ่าตัดออก
การรักษาโดยใช้ยา
|
ยา |
กลไก |
รูปแบบยา |
วิธีใช้ |
อาการข้างเคียง |
หญิงตั้งครรภ์ (18) |
|
Imiquimod |
กระตุ้นสร้าง interferone และ cytokines |
– Imiquimod 5% cream
– Imiquimod 3.75% cream
|
วันละ 1 ครั้ง ก่อนนอน 3 ครั้ง/สัปดาห์
วันละ 1 ครั้งก่อนนอน ทุกวัน
นาน 16 wk หลังทา 6 ชั่วโมง ล้างออกด้วยสบู่ |
ผิวแดง ระคายเคือง แผล มีตุ่มน้ำ ผิวหนังสีจางลง
ทำให้โรคผิวหนังชนิด inflammatory แย่ลง เช่น สะเก็ดเงิน ด่างขาว |
ไม่แนะนำ |
|
Podofilox, podophyllotoxin
|
ยับยั้งการแบ่งตัว |
– Podofilox solution – Podofilox gel 0.5%
|
วันละ 2 ครั้ง ติดต่อการ 3 วัน จากนั้นเว้นการรักษา 4 วัน ทำซ้ำจนครบ 4 รอบ
ไม่ควรทารอยโรค > 10 cm2 ปริมาณยา ไม่เกิน 0.5 ml/วัน |
ปวด ระคายเคือง |
ห้ามใช้ |
|
Sinecatechins
|
สกัดจากใบชาเขียว active product คือ catechins |
Sinecatechins 15% ointment |
ทาวันละ 3 ครั้ง ไม่ต้องล้างออก ทาไม่เกิน 0.5 cm ต่อหนึ่งรอยโรค ไม่ให้ใช้ติดต่อกันนานเกิน 16 wk
|
แดง คัน แสบ ปวด แผล บวม ผื่นตุ่มน้ำ |
ไม่แนะนำ
ไม่แนะนำให้ใช้ใน HIV, ภูมิคุ้มกันบกพร่อง หรือเริม |
|
Trichloroacetic acid (TCA) Bichloroacetic acid (BCA)
|
สารเคมีกัดกร่อน ทำให้เกิด coagulation ของโปรตีน ทำลายเนื้อเยื่อ |
80-90% TCA, BCA |
ทาผิวหนังปกติบริเวณรอบๆ ด้วย petroleum jelly ก่อน
ทายาปริมาณน้อยๆ ทิ้งให้แห้ง (เป็นสีขาว) ก่อนลุก
ทาซ้ำทุกสัปดาห์จนกว่าจะหาย นาน 4-6 สัปดาห์ จนกว่ารอยโรคจะหาย |
หากปวดมาก ให้สะเทินกรดด้วย sodium bicarbonate หรือล้างด้วยสบู่
ทาปริมาณมากจะเกิด chemical burn |
ใช้ได้ |
การรักษาโดยการผ่าตัด
1. การจี้เย็น (Cryotherapy)
อาศัยการใช้ความเย็นทำให้เซลล์แตก โดยใช้ไนโตรเจนเหลว หรือ cryoprobe
อาการข้างเคียง : อาการปวด เกิดเนื้อตาย ตุ่มน้ำพอง
ควรฉีดหรือทายาชาก่อนการรักษา โดยเฉพาะในรายที่รอยโรคขนาดใหญ่
2. การผ่าตัดออก (Surgical therapy)
มีหลายวิธี ได้แก่การใช้จี้ไฟฟ้า กรรไกร เลเซอร์คาร์บอนไดออกไซด์ หรือการขูดออก
ควรฉีดยาชาก่อนตัดโดยใช้ tangential excision ด้วยกรรไกรหรือใบมีด, เลเซอร์คาร์บอนไดออกไซด์ หรือการขูดอาจไม่จำเป็นต้องเย็บแผลทุกรายถ้าไม่มีเลือดออกหรือแผลไม่กว้างในรายที่รอยโรคมีขนาดใหญ่ การผ่าตัดออกเป็นการรักษาที่เหมาะสม โดยเฉพาะการใช้เลเซอร์ และควรทำในสถานที่ที่มีการระบายอากาศตามมาตรฐานและมีเครื่องดูดควัน
การรักษาทางเลือก (Alternative regimens)
- Podophyllin resin 10%–25% ใน tincture benzoin
ปัจจุบันไม่แนะนำ เนื่องจากมีผลข้างเคียงมาก มีพิษต่อร่างกาย
วิธีการ : จี้รอยโรคบางๆ ทีละรอยโรค ทิ้งให้แห้งก่อนสวมเสื้อผ้า เสื้อผ้า สามารถจี้ซ้ำได้ทุก 1 สัปดาห์ นาน 4-6 สัปดาห์หรือจนกว่ารอยโรคจะหาย
ข้อควรระวัง : ทาครั้งละน้อยๆ ไม่เกิน 0.5 ml หรือ ไม่เกิน 10 cm2 และบริเวณที่ทายาต้องไม่มีแผลเปิดหรือเป็นผิวหนังอ่อน ทิ้งไว้ 1-4 ชั่วโมงแล้วล้างออก
อาการข้างเคียง : ระคายเคืองผิว ปวด systemic toxicity
ไม่แนะนำให้ใช้ในหญิงตั้งครรภ์ - Intralesional interferon
- Photodynamic therapy
- Topical cidofovir
การตรวจติดตาม (Follow-Up)
หูดอวัยวะเพศส่วนใหญ่ตอบสนองต่อการรักษาภายใน 3 เดือน นอกจากการตอบสนองของโรค แพทย์ควรตรวจหาภาวะแทรกซ้อนของการรักษาที่อาจเกิดขึ้นได้ ได้แก่ การเปลี่ยนแปลงของสีผิวบริเวณนั้นอย่างถาวร เกิดแผลเป็นยุบหรือนูน เกิดอาการปวดเรื้อรังหรือชา หากเป็นหูดบริเวณทวารหนักอาจเกิดภาวะปวดเวลาถ่ายหรือ เกิด fistula ได้
การดูแลรักษาคู่นอน (Management of Sex Partners)
คู่นอนคนปัจจุบันควรได้รับข้อมูลว่าตนเองอาจติดเชื้อ HPV ไปแล้วแม้จะไม่มีอาการหรือรอยโรค อย่างไรก็ตามไม่แนะนำให้ทำการตรวจหาเชื้อ HPV ควรตรวจร่างกายเพื่อหารอยโรค และตรวจคัดกรองหาโรคติดต่อทางเพศสัมพันธ์อื่นๆ ที่อาจพบร่วม
การป้องกัน (Prevention)
การตรวจคัดกรองโรคติดต่อทางเพศสัมพันธ์
ผู้ป่วยทุกคนที่เคยมีประวัติโรคติดต่อทางเพศสัมพันธ์ หรือมีความเสี่ยง (เช่น เปลี่ยนคู่นอนบ่อย ใช้สารเสพติด ใช้บริการทางเพศ) ควรได้รับการตรวจหาเชื้อเอชไอวีและโรคติดต่อทางเพศสัมพันธ์อื่นๆ เป็นระยะ กลุ่มเสี่ยงที่ควรได้รับการตรวจคัดกรองโรคติดต่อทางเพศสัมพันธ์เป็นประจำทุกปี ได้แก่
- วัยรุ่นที่มีอายุ 15-24 ปีที่มีเพศสัมพันธ์และมีพฤติกรรมเสี่ยง(19)
- ผู้ชายที่มีเพศสัมพันธ์กับผู้ชาย (MSM; Men who have sex with men)
- ผู้ติดเชื้อ HIV
วัคซีนป้องกันการติดเชื้อ HPV (HPV vaccine)
ปัจจุบันมีวัคซีนที่สามารถป้องกันมะเร็งปากมดลูกที่มีสาเหตุมาจากเชื้อหูดบางสายพันธุ์ได้ ในประเทศไทยมี วัคซีน 2 ชนิด ได้แก่
- วัคซีนชนิด 2 สายพันธุ์ (Cervarix) ประกอบด้วยสายพันธุ์ที่ 16 และ 18
- วัคซีนชนิด 4 สายพันธุ์ (Gardasil) ประกอบด้วยสายพันธุ์ที่ 6, 11, 16 และ 18
วัคซีนทั้ง 2 ชนิด สามารถป้องกันการติดเชื้อ HPV สายพันธุ์ที่ 16 และ 18 ซึ่งเป็นสาเหตุของมะเร็งปากมดลูกได้ประมาณ 70% สำหรับวัคซีนชนิด 4 สายพันธุ์ สามารถป้องกันเชื้อ HPV สายพันธุ์ที่ 6 และ 11 ที่เป็นสาเหตุของโรคหูดอวัยวะเพศประมาณ 90% ได้ด้วย การฉีดวัคซีนจะต้องฉีด 3 เข็ม และควรฉีดก่อนเริ่มมีเพศสัมพันธ์ สามารถฉีดได้ตั้งแต่อายุ 9-26 ปี(20)และห้ามฉีดวัคซีนในหญิงตั้งครรภ์
การใส่ถุงยางอนามัย (Condom use)
การใส่ถุงยางอนามัยขณะมีเพศสัมพันธ์ช่วยลดการติดเชื้อ HPV และช่วยให้สามารถกำจัดเชื้อได้มากขึ้น นอกจากนั้นยังช่วยลดการติดโรคติดต่อทางเพศสัมพันธ์อื่นๆ ได้แก่ เชื้อ HIV หนองในแท้ หนองในเทียม และโรคเริม ได้อีกด้วย
การขลิบอวัยวะเพศชาย (Male circumcision)
ช่วยลดการติดเชื้อ HPV และโรคติดต่อทางเพศสัมพันธ์อื่น ได้แก่ HIV และ เริม
หูดอวัยวะเพศในผู้ป่วยที่ตั้งครรภ์
ควรรักษาโดยการจี้ TCA ห้ามใช้ podofilox, podophyllin และ sinecatechins หลีกเลี่ยงการใช้ Imiquimod เนื่องจากไม่มีหลักฐานเพียงพอ ส่วนการผ่าตัดก้อนออกขณะตั้งครรภ์สามารถทำได้ แต่อย่างไรก็ตามผลการรักษาในขณะตั้งครรภ์มักได้ผลไม่ค่อยดี
เชื้อ HPV สายพันธุ์ 6 และ 11 ทำให้เกิด respiratory papillomatosis ในเด็กทารกแรกเกิดได้น้อย สาเหตุของการถ่ายทอดเชื้อไม่ทราบแน่ชัด ไม่มีหลักฐานเพียงพอว่าการผ่าตัดคลอดจะช่วยป้องกันภาวะนี้ได้ ดังนั้นจึงจะพิจารณาผ่าตัดคลอดในรายที่รอยโรคกีดขวางช่องทางคลอด หรือการคลอดทางช่องคลอดจะทำให้มีเลือดออกมาก อย่างไรก็ตาม สตรีตั้งครรภ์ควรได้ทราบข้อมูลว่า ทารกมีความเสี่ยงอยู่บ้างในการเกิดภาวะ recurrent respiratory papillomatosis
เอกสารอ้างอิง
- “Warts: Overview”. U.S. National Library of Medicine. 30 July 2014.
- W. Buck H Jr. Warts (genital). BMJ Clin Evid. 2010 Aug 13;2010.
- Bonnez W, Reichman RC. Papillomaviruses. In: Principles and Practice of Infectious Diseases, Fifth Edition, Mandell GL, Bennett JE, Dolin R (Eds), Churchill Livingston, Philadelphia 2000. p.1630.
- de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H. Classification of papillomaviruses. Virology. 2004;324(1):17.
- World Health Organization. IARC Monograph on the Evaluation of Carcinogenic Risks to Humans: Human Papillomaviruses. Vol 64. Lyons, France: IARC; 1995
- Franco EL, Duarte-Franco E, Ferenczy A. Cervical cancer: epidemiology, prevention and the role of human papilloma virus infection. CMAJ. 2001 Apr 3;164(7):1017-25.
- Garland SM, Steben M, Sings HL, et al. Natural history of genital warts: analysis of the placebo arm of 2 randomized phase III trials of a quadrivalent human papillomavirus (types 6, 11, 16, and 18) vaccine. J Infect Dis 2009;199:805-14.
- American College of Obstetricians and Gynecologists. ACOG Practice Bulletin. Clinical Management Guidelines for Obstetrician-Gynecologists. Number 61, April 2005. Human papillomavirus. Obstet Gynecol. 2005;105(4):905.
- Moscicki AB, Hills N, Shiboski S, Powell K, Jay N, Hanson E, Miller S, Clayton L, Farhat S, Broering J, Darragh T, Palefsky J. Risks for incident human papillomavirus infection and low-grade squamous intraepithelial lesion development in young females. JAMA. 2001;285(23):2995.
- Kaderli R, Schnüriger B, Brügger LE. The impact of smoking on HPV infection and the development of anogenital warts. Int J Colorectal Dis. 2014 Aug;29(8):899-908.
- Tobian AA, Serwadda D, Quinn TC, Kigozi G, Gravitt PE, Laeyendecker O, Charvat B, Ssempijja V, Riedesel M, Oliver AE, Nowak RG, Moulton LH, Chen MZ, Reynolds SJ, Wawer MJ, Gray RH. Male circumcision for the prevention of HSV-2 and HPV infections and syphilis. N Engl J Med. 2009;360(13):1298.
- Patel H, Wagner M, Signal P, Kothari S. Systematic review of the incidence and prevalence of genital warts. BMC Infect Dis. 2013 Jan 25;13:39.
- CDC. 2015. 2015 Sexually Transmitted Diseases Treatment Guidelines; Anogenital Warts. Available: https://www.cdc.gov/std/tg2015/warts.htm [Accessed on 06.02.2017]
- Handsfield HH. Clinical presentation and natural course of anogenital warts. Am J Med. 1997 May;102(5A):16-20.
- Doorbar J. Latent papillomavirus infections and their regulation. Curr Opin Virol. 2013 Aug;3(4):416-21.
- Blomberg M, Friis S, Munk C, Bautz A, Kjaer SK . Genital warts and risk of cancer: a Danish study of nearly 50 000 patients with genital warts. J Infect Dis. 2012 May;205(10):1544-53.
- Pirog EC, Chen YT, Isacson C. MIB-1 immunostaining is a beneficial adjunct test for accurate diagnosis of vulvar condyloma acuminatum. Am J Surg Pathol. 2000 Oct;24(10):1393-9.
- Briggs GC, Freeman RK, Yaffe SJ. Drugs in Pregnancy and Lactation, 9th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2011.
- COMMITTEE ON PRACTICE AND AMBULATORY MEDICINE and, BRIGHT FUTURES PERIODICITY SCHEDULE WORKGROUP. 2016 Recommendations for Preventive Pediatric Health Care. Pediatrics. 2016;137(1):1.
- Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines, 2010. MMWR Recomm Rep 2010; 59(RR-12):1-109.
- Scheinfeld, N. 2017. Condylomata acuminata (anogenital warts) in adults: Epidemiology, pathogenesis, clinical features, and diagnosis. UptoDate. Available: https://www.uptodate.com/contents/condylomata-acuminata-anogenital-warts-in-adults-epidemiology-pathogenesis-clinical-features-and-diagnosis [Accessed on 06.02.2017]
- Carusi, A. D. 2015. Treatment of vulvar and vaginal warts. Uptodate. Available: https://www.uptodate.com/contents/treatment-of-vulvar-and-vaginal-warts [Accessed on 06.02.2017]


