เยื่อบุโพรงมดลูกเจริญผิดที่ (Endometriosis)
พ.ญ.จงปีติ วุฒิสรรพ์
อาจารย์ที่ปรึกษา นพ.โอภาส เศรษฐบุตร
เยื่อบุโพรงมดลูกเจริญผิดที่คืออะไร
หมายถึง เยื่อบุโพรงมดลูกที่ไปเจริญเติบโตอยู่ผิดที่นอกโพรงมดลูก โดยอาจแทรกตัวอยู่ในผนังหรือกล้ามเนื้อมดลูก หรืออาจเล็ดลอดเข้าไปในช่องท้องจนไปเจริญเติบโตอยู่ตามอวัยวะต่างๆในอุ้งชิงกราน เช่น เยื่อบุช่องท้อง รังไข่ ผนังลำไส้ และผนังกระเพาะปัสสาวะ และบางครั้งอาจกระจายไปสู่อวัยวะที่อยู่ไกลออกไป เช่น กระบังลม ปอด และ ช่องเยื่อหุ้มปอด
เยื่อบุโพรงมดลูกที่เจริญผิดที่นี้ ถือเป็นปฏิกิริยาการอักเสบที่ขึ้นกับฮอร์โมนเอสโตรเจน (Estrogen-dependent, benign, inflammatory disease) เมื่อไปเจริญเติบโตอยู่ผิดที่ก็จะยังคงทำหน้าที่เช่นเดิม คือ สร้างประจำเดือน จึงทำให้มีเลือดสีแดงคล้ำหรือสีดำข้นคล้ายช็อกโกแลตขังอยู่ตามอวัยวะต่างๆ ซึ่งเป็นสาเหตุสำคัญของอาการผิดปกติต่างๆที่พบได้ในผู้ป่วยโรคนี้ เช่น ปวดท้องประจำเดือน ปวดท้องน้อยเรื้อรัง มีบุตรยาก
เยื่อบุโพรงมดลูกเจริญผิดที่ไม่ใช่เนื้อร้าย(benign) แต่เป็นโรคเรื้อรัง และต้องการ การวางแผนการรักษาอย่างเป็นระบบ โดยขึ้นกับ ความต้องการมีบุตร และ ความพึงพอใจของผู้ป่วยเป็นสำคัญ
เยื่อบุโพรงมดลูกเจริญผิดที่พบได้บ่อยแค่ไหน
ความชุกของการเกิดภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ค่อนข้างหลากหลาย เนื่องจากส่วนใหญ่ไม่มีอาการ หรือ อาจมีอาการได้หลากหลาย และไม่เฉพาะเจาะจง ซึ่งการวินิจฉัยที่ชัดเจนต้องอาศัยการผ่าตัด ได้มีงานวิจัยรายงานความชุกของภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ไว้ 1-7%(1-3) โดยส่วนใหญ่ภาวะนี้ จะพบมากในสตรีอายุ 25-35 ปี(4) แต่ก็มีบางส่วนที่พบได้ในวัยก่อนเป็นประจำเดือน(5) และวัยหลังหมดประจำเดือน (2-5%)(6)
ปัจจัยที่เพิ่มความเสี่ยงในการเกิดภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ ได้แก่ ภาวะไม่มีบุตร มีประวัติได้รับเอสโตรเจนเป็นระยะเวลานาน (ประจำเดือนมาครั้งแรกตอนอายุน้อย, หมดประจำเดือนตอนอายุมาก), รอบประจำเดือนสั้น (น้อยกว่า 27 วัน), ประจำเดือนมามาก, มีการอุดกั้นทางออกของประจำเดือน,(7) ได้รับสาร DES (diethylstilbestrol)ขณะตั้งครรภ์(8) ส่วนสูงมากกว่า68นิ้ว(9), ดัชนีมวลกายต่ำ,(9) รับประทานอาหารที่มีไขมันไม่อิ่มตัวเป็นประจำ(10)
ส่วนปัจจัยที่ช่วยลดความเสี่ยงในการเกิดภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ ได้แก่ การคลอดบุตรหลายคน, ให้นมบุตรเป็นระยะเวลานาน,(11) ประจำเดือนมาครั้งแรกตอนอายุมากกว่า14ปี, รับประทานอาหารที่มี Omega-3 ปริมาณมาก(10) และเชื้อชาติ black, Hispanic(11)
อะไรคือสาเหตุที่ทำให้เกิดเยื่อบุโพรงมดลูกเจริญผิดที่
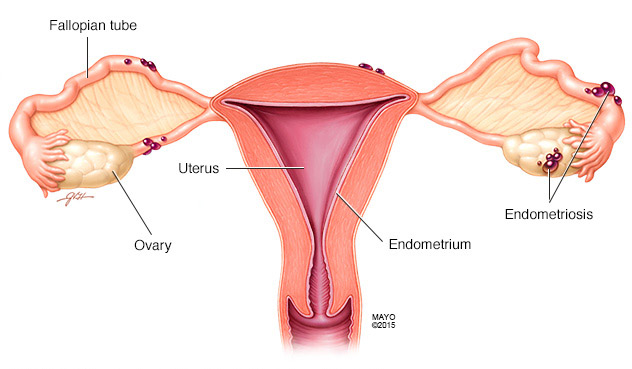
รูปที่ 1 แสดงการฝังตัวของภาวะเยื่อบุโพรงมดลูกเจริญผิดที่
ทฤษฎีการก่อกำเนิดของเยื่อบุโพรงมดลูกเจริญผิดที่นั้นมีหลากหลาย แต่ส่วนใหญ่เชื่อว่าเกิดจากการไหลย้อนทางของ ประจำเดือนผ่านท่อนำไข่เข้าไปฝังตัวอยู่ตามอวัยวะต่างๆภายในช่องท้อง(12) (Sampson’s theory) โดยมักจะตกไปอยู่ในอุ้งเชิงกราน ซึ่งเป็นส่วนที่อยู่ต่ำสุดของร่างกาย จะเห็นได้จาก สตรีที่มีการอุดกั้นของทางระบายเลือดประจำเดือน มีอุบัติการณ์เกิดภาวะนี้สูงขึ้น นอกจากนี้ ยังเชื่อว่าเซลล์เยื่อบุโพรงมดลูกอาจกระจายไปยังอวัยวะ รูปที่1 แสดงการฝังตัวของภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ ส่วนอื่นๆที่อยู่ไกลออกไป ได้โดยผ่านทางหลอดเลือดและ ท่อน้ำเหลือง(13, 14) ซึ่งการไหลย้อนทางของประจำเดือนก็ไม่ได้ทำให้เกิดโรคนี้ในผู้ป่วยทุกราย(15) (>90%ของสตรีที่มีการไหลย้อนทางของประจำเดือน ไม่ได้มีภาวะเยื่อบุโพรงมดลูกเจริญผิดที่(14) เนื่องจาก ระบบภูมิคุ้มกันของร่างกายสามารถกำจัดเซลล์เยื่อบุโพรงมดลูกเหล่านี้ได้ ยกเว้นในบางรายที่การทำหน้าที่ของระบบภูมิคุ้มกันไม่สมบูรณ์(16) ก็จะมีความเสี่ยงต่อการเกิดโรคนี้เพิ่มขึ้น
มีบางทฤษฎี ได้อธิบายถึงสาเหตุของการเกิดเยื่อบุโพรงมดลูกเจริญผิดที่ในกลุ่มสตรีก่อนเป็นประจำเดือนไว้ว่า เกิดจากการมี Mullerian embryonic rest หลงเหลืออยู่(5) ซึ่งอาจมีเลือดออกทางช่องคลอดได้ตั้งแต่ยังเป็นทารก หรืออาจเกิดจากการได้รับฮอร์โมนขณะตั้งครรภ์(17)
อาการและอาการแสดงของเยื่อบุโพรงมดลูกเจริญผิดที่
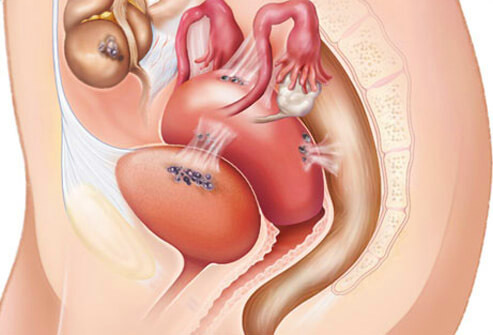
รูปที่2 แสดงการเกิดพังผืด บริเวณอุ้งเชิงกราน
อาการแสดงที่สำคัญของโรคนี้ ได้แก่ อาการปวดบริเวณท้องน้อย(80%)(16, 18, 19) โดยเฉพาะอาการปวดประจำเดือนที่มากผิดปกติความรุนแรงของอาการปวดจะเพิ่มมากขึ้นเรื่อยๆ ตามเวลาที่ผ่านไป (progressive dysmenorrhea) ลักษณะอาการปวดจะปวดแบบตื้อๆ หรือปวดแบบบีบๆ เป็นตั้งแต่ 1-2 วัน ก่อนเป็นประจำเดือน(18) ซึ่งอาการปวดท้องเกิดจาก มีการเพิ่มการสร้างสารที่ก่อให้เกิดการอักเสบ, ความเจ็บปวดเพิ่มมากขึ้น และมีการเพิ่มกระแสประสาทของความเจ็บปวดมากขึ้น(20) บางรายที่รอยโรคอยู่ค่อนไปทางด้านหลังของมดลูก ซึ่งเป็นตำแหน่งที่ใกล้กับลำไส้ตรง ก็จะมีอาการปวดหน่วงลงทวารหนักได้ในช่วงที่มีประจำเดือน(21) ส่วนอาการอื่นๆที่พบได้บ่อย ได้แก่ เจ็บในอุ้งเชิงกรานขณะมีเพศสัมพันธ์ (dyspareunia) ปวดท้องน้อยเรื้อรัง และภาวะมีบุตรยาก(25%)(18) ซึ่งสัมพันธ์กับการอักเสบและการเกิดพังผืดในอุ้งเชิงกราน(22) นอกจากนี้ผู้ป่วยบางรายอาจมีเลือดออกกะปริดกะปรอยระหว่างรอบเดือน (intermenstrual bleeding) ท้องอืด คลื่นไส้ อาเจียน และในกรณีที่รอยโรคอยู่ที่
รูปที่2 แสดงการเกิดพังผืด บริเวณอุ้งเชิงกราน ลำไส้หรือกระเพาะปัสสาวะ ก็อาจพบเลือดออกทางทวารหนัก(23) หรือปัสสาวะเป็นเลือดได้ ในช่วงที่มีประจำเดือน(24) ผู้ป่วยบางรายอาจมีอาการปวดบริเวณต้นคอ,สะบัก แน่นหน้าอก หรือไอเป็นเลือด(25) หากรอยโรคอยู่บริเวณช่องอก อย่างไรก็ตาม พบว่ามีผู้ป่วยจำนวนไม่น้อยที่ถึงแม้จะมีรอยโรคชัดเจน แต่ก็กลับไม่มีอาการผิดปกติแต่อย่างใด ผู้ป่วยบางราย อาจมาด้วยคลำพบก้อนบริเวณท้องน้อย(20%)(18) หรืออาจตรวจเจอโดยบังเอิญ จากการทำultrasound
พยาธิวิทยาของภาวะเยื่อบุโพรงมดลูกเจริญผิดที่
ภาวะนี้จะมีลักษณะที่มองเห็นด้วยตาเปล่าค่อนข้างจำเพาะ ได้แก่ จะเห็นจุดสีน้ำตาลหรือม่วงคล้ำ บริเวณผิวของรังไข่, มดลูก, กระเพาะปัสสาวะ, ลำไส้ และเยื่อบุช่องท้อง ซึ่งจะมีขนาดแตกต่างกันออกไป หรืออาจพบเป็นก้อนบริเวณรังไข่ ภายในมีของเหลวข้นสีช็อกโกแลต
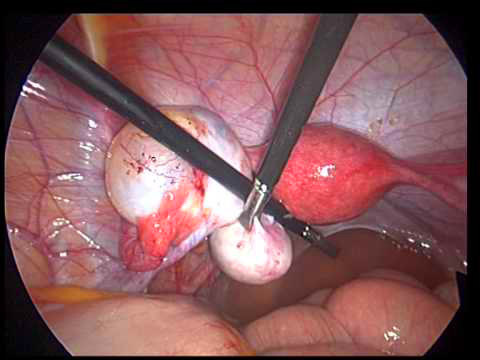
รูปที่3 แสดง right endometrioma
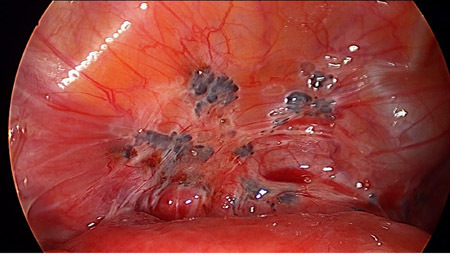
รูปที่4 แสดง endometriotic spot
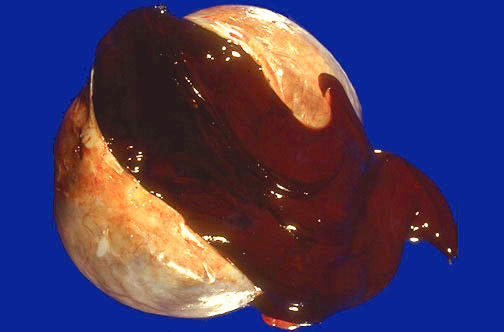
รูปที่5 แสดง chocolate content ใน endometrioma
Deep infiltrative endometriosis
หมายถึง ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ ที่กินลึกอย่างน้อย 5 มม. ใต้ต่อเยื่อบุช่องท้อง
ลักษณะที่เห็นจากกล้องจุลทรรศน์ จะพบ gland และ stroma ของเยื่อบุโพรงมดลูก อาจพบตำแหน่งเลือดออกในรอยโรค, พบ hemosiderin-laden macrophage และมักพบเซลล์อักเสบอยู่โดยรอบ
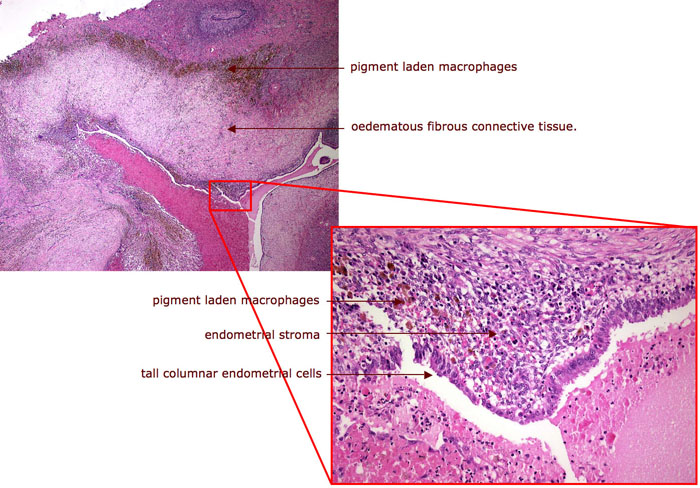
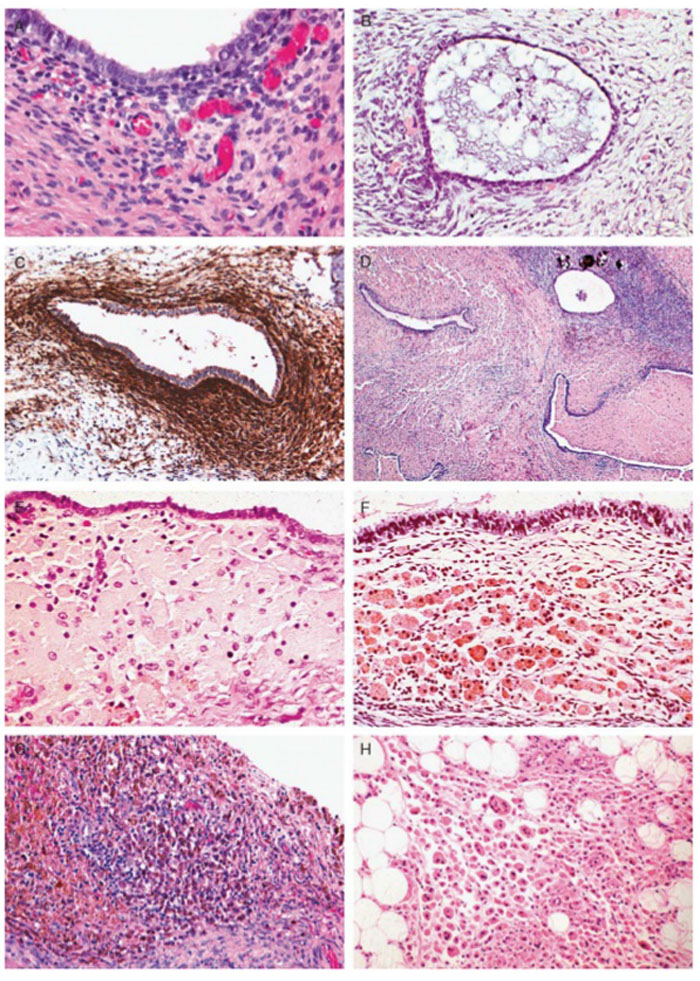
รูปที่ 6-7 แสดง ลักษณะทางพยาธิวิทยา ของภาวะเยื่อบุโพรงมดลูกเจริญผิดที่
แนวทางการตรวจวินิจฉัยโรคเยื่อบุโพรงมดลูกเจริญผิดที่
สิ่งที่ตรวจพบจากการตรวจร่างกายค่อนข้างหลากหลาย ขึ้นกับตำแหน่ง และขนาดของเยื่อบุโพรงมดลูกที่มาฝังตัว(26) โดยส่วนใหญ่ จะตรวจภายในพบมดลูกโต อาจคลำได้ nodule บริเวณด้านหลังมดลูก (Posterior fornix) หรือตรวจพบมดลูกเอียงหรือคว่ำจากการมีพังผืดดึงรั้ง ซึ่งหากตรวจร่างกายไม่พบความผิดปกติ ก็ไม่สามารถตัดภาวะภาวะนี้ออกไปได้(27) แต่หากผลการตรวจร่างกายยังไม่ชัดเจนอาจทำการตรวจultrasound ทางช่องคลอดหรือทางทวารหนัก โดยจะพบ ovarian cyst (endometrioma) , nodules บริเวณ rectovaginal septum และกระเพาะปัสสาวะ แต่การตรวจ ultrasound จะไม่สามารถวินิจฉัยรอยโรคตามเยื่อบุช่องท้องได้ การส่องกล้องตรวจภายในช่องท้อง (laparoscopy) ช่วยให้การวินิจฉัยแม่นยำขึ้น ส่วนการตรวจทางพยาธิวิทยา (Pathology) จะให้การวินิจฉัยที่แน่นอนที่สุด
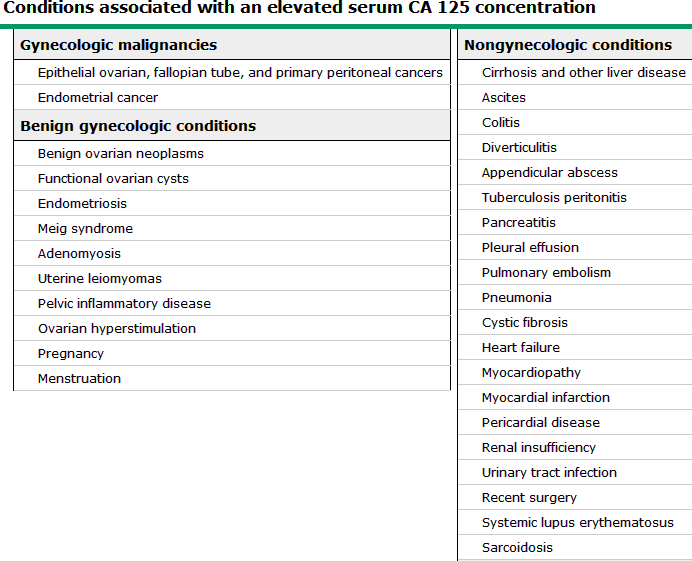
ยังไม่มีการส่งตรวจทางห้องปฎิบัติการ ที่จำเพาะสำหรับภาวะนี้ แต่อาจตรวจพบ CA125 เพิ่มขึ้นได้ (>35u/ml)(28) แต่ไม่เฉพาะเจาะจง เนื่องจากการเพิ่มขึ้นของ CA125 สามารถพบได้หลายภาวะ ดังตาราง1 โดยส่วนใหญ่มักใช้ ค่า CA125 ในการทำนายการกลับเป็นซ้ำของภาวะนี้ ภายหลังการรักษา
ตารางที่1 แสดง ภาวะที่ทำให้ค่า CA125 เพิ่มสูงขึ้น

การวินิจฉัยแยกโรค
ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ บางครั้ง อาจแยกยากจากภาวะ Primary dysmenorrhea, การอักเสบในอุ้งเชิงกราน, การตั้งครรภ์นอกมดลูก, เนื้องอกรังไข่, มะเร็งของเยื่อบุโพรงมดลูก
เราจะผ่าตัดเมื่อไร
โดยปกติภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ ไม่จำเป็นต้องผ่าตัด แต่อาจพิจารณาผ่าตัดในกรณี ไม่ตอบสนองต่อการรักษาด้วยยา, มีอาการที่รุนแรง ส่งผลต่อการใช้ชีวิตประจำวัน, มีanatomic abnormality ซึ่งนิยมการผ่าตัดโดยวิธีการส่องกล้อง
เยื่อบุโพรงมดลูกเจริญผิดที่ มีกี่ระยะ
American Society for reproductive Medicine (ASRM) ได้แบ่งภาวะนี้แบ่งออกเป็น 4 ระยะ ตามขนาด, ตำแหน่งของพยาธิสภาพ และตามความมากน้อยของพังผืด ซึ่งการกำหนดระยะความรุนแรงอาศัยการตรวจโดยการส่องกล้องเป็นหลัก (Laparoscopy) ดังรูปที่ 8
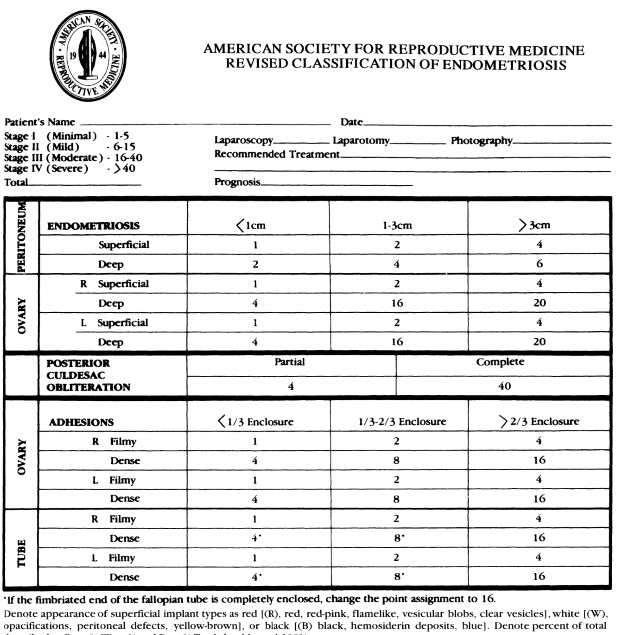
รูปที่ 8 แสดงการกำหนดระยะ ความรุนแรง ของภาวะเยื่บุโพรงมดลูกเจริญผิดที่
เยื่อบุโพรงมดลูกเจริญผิดที่ มีแนวทางการรักษาอย่างไร
หลักการเลือกวิธีการรักษาในภาวะนี้ ต้องพิจารณาถึง อาการและอาการแสดงของผู้ป่วย ตลอดจนความรุนแรงของอาการ, อายุ, ความต้องการมีบุตรในอนาคต, ผลข้างเคียงจากการใช้ยา, ภาวะแทรกซ้อนจากการผ่าตัด และราคา(16)
แนวทางการรักษาโรคเยื่อบุโพรงมดลูกเจริญผิดที่ แบ่งเป็น
การรักษาเรื่องอาการปวด โดยทั่วไป นิยมใช้ยาเป็นหลัก โดยมีหลักการ ดังนี้
– อาการรุนแรงน้อยถึงรุนแรงปานกลางและจากการU/S ไม่พบ endometrioma: นิยมให้การรักษาโดยการให้ NSAIDS ร่วมกับ Continuous hormonal contraceptive เป็น first line of treatment เนื่องจากการรักษาวิธีนี้ ผลข้างเคียง และสามารถลดอาการปวดท้องได้เป็นอย่างดี
– อาการรุนแรงมาก,ไม่ตอบสนองต่อ first line treatment, กลับเป็นซ้ำ นิยมให้ยากลุ่ม GnRH agonist ร่วมกับ add-back hormonal therapy ร่วมกับการส่องกล้อง เพื่อยืนยันการวินิจฉัยและเพื่อการรักษา หากผู้ป่วยไม่สามารถทนผลข้างเคียงจากการใช้ยากลุ่ม GnRH agonist ได้ จะเปลี่ยนเป็นยากลุ่ม Aromatase inhibitor แต่ข้อมูลเกี่ยวกับการใช้ยายังมีจำกัด ดังจะกล่าวลงรายละเอียดต่อไป
การใช้ยา มีข้อดีและข้อเสียแตกต่างกัน ดัง ตาราง2
– ยาแก้ปวดกลุ่มที่มีฤทธิ์ต้านการอักเสบ (NSAIDS) เพื่อช่วยลดอาการปวดประจำเดือนและอาการปวดท้องน้อย ซึ่งมีขนาดและวิธีการบริหารยา ตาม ตาราง3 แต่หากผู้ป่วยยังต้องการมีบุตร การใช้ยา NSAIDS ควรหลีกเลี่ยงกลุ่ม COX-2 inhibitor เนื่องจากมีรายงานพบว่า จะยับยั้งการตกไข่ (29)
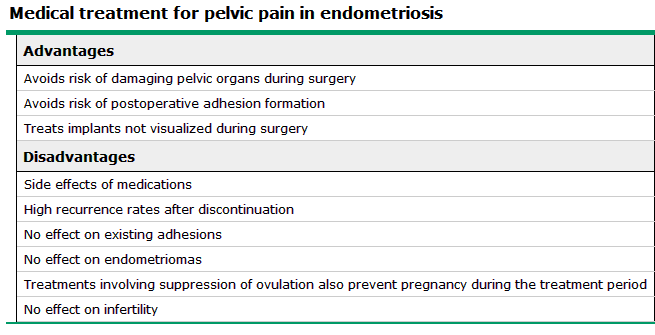
ตารางที่ 2 แสดงข้อดีและข้อเสียจากการใช้ยา ในการรักษาอาการปวดท้องน้อยที่เกิดจากภาวะเยื่อบุโพรงมดลูกเจริญผิดที่
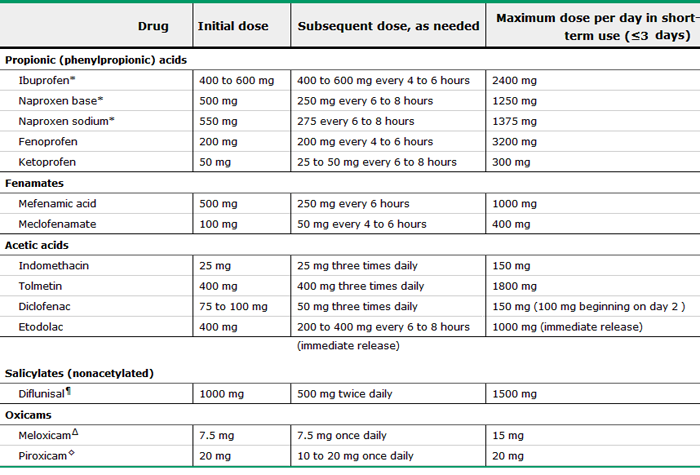
ตารางที่ 3 แสดง ชนิดของยาแก้ปวดที่มีฤทธิ์ต้านการอักเสบ และขนาดของยาที่ใช้
– Estrogen-Progestin contraceptive มีกลไก ช่วยลดการทำงานของรังไข่ และทำให้เยื่อบุโพรงมดลูกฝ่อ จึงนิยมใช้ เนื่องจาก สามารถใช้ได้เป็นระยะเวลานาน ผู้ป่วยทนผลข้างเคียงได้ ใช้ได้ง่าย และมีราคาถูก นอกจากนี้ยังช่วยลดความเสี่ยงในการเกิด มะเร็งรังไข่และมะเร็งเยื่อบุโพรงมดลูก ซึ่งยาที่นิยมใช้ ได้แก่ ยาเม็ดคุมกำเนิด, แผ่นฮอร์โมนแปะ, vaginal ring มีการศึกษาได้กล่าวไว้ว่า การให้ผู้ป่วยรับประทานยาคุมแบบ continuous ได้ผลในการลดอาการปวดท้องน้อยได้ดีกว่า รับประทานแบบ Cyclic (30) ซึ่งประสิทธิภาพในการลดอาการปวดท้องน้อยในผู้ป่วยที่รับประทานยาเม็ดคุมกำเนิด ให้ผลใกล้เคียงกับผู้ป่วยที่รักษาโดยใช้ GnRH agonist (31)
– Progestins ช่วยยับยั้งการเจริญของเยื่อบุโพรงมดลูก โดยทำให้เกิด decidualization และการฝ่อ(16) นอกจากนี้ยังกดการสร้าง metalloproteinase enzyme ซึ่งทำให้เกิดการกดเจริญเติบโต และการฝังตัวของเยื่อบุโพรงมดลูก (32) ยากลุ่มนี้ได้แก่
- Medroxyprogesterone acetate (MPA)
- DMPA 150 mg IM ทุก 3 เดือน
- Norethindrone acetate 5 mg oral (2.5-15mg/day)
- Dienogest 2 mg oral
ยากลุ่มนี้เหมาะในผู้ป่วยที่มีข้อห้ามในการใช้ estrogen แต่ก็มีผลข้างเคียงที่พบบ่อยคือ มีเลือดออกกระปริดกระปรอย, ไม่เป็นประจำเดือน, น้ำหนักเพิ่มขึ้น, ซึมเศร้า, มวลกระดูกลดลง ซึ่งหากใช้ Norethindrone acetate เป็นระยะเวลานาน อาจลด HDL, เพิ่ม LDL, TG
– Alternative progestin treatment option ได้แก่
- Ethylnorgestrienone(gestrinone)
- Etonogestrel implant: ผลการรักษาใกล้เคียงกับการใช้ DMPA
- Levonorgestrel intrauterine device (LNG-IUD)
– GnRH agonist ทำหน้าที่จับกับ receptor ที่ ต่อมใต้สมอง ส่งผลให้เกิด down regulate ทำให้ estrogenลดลง
- Intranasal nafarelin acetate 200 mcg วันละ2 ครั้ง
- leuprolide acetate 3.75 mg IM monthly, 11.25 mg IM ทุก3 เดือน
- buserelin, goserelin, triptorelin
ยากลุ่มนี้อาจทำให้เกิด hypoestrogenic effect เช่น ร้อนวูบวาบ, ช่องคลอดแห้ง, อารมณ์แปรปรวน, มวลกระดูกลดลง และ ความต้องการทางเพศลดลง จึงนิยมให้ Add back therapy ด้วย Norethindrone acetate 5 mg oral หรือ ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวมทุกวัน (16)
– Danazol เป็นยากลุ่ม 17alpha ethinylestosterone ออกฤทธิ์ยับยั้งการเกิด LH surge, ยับยั้งการสร้าง steroid และเพิ่มระดับ testosterone ในกระแสเลือด นอกจากนี้ยังออกฤทธิ์ยับยั้งการสร้างฮอร์โมนของรังไข่ ทำให้เกิดการยับยั้งการฝังตัวของเยื่อบุโพรงมดลูก ไม่นิยมใช้เพื่อรักษาอาการปวดท้องน้อย เนื่องจาก ผลข้างเคียงค่อนข้างมาก (Androgenic side effect)เช่น สิว,น้ำหนักเพิ่มขึ้น,ขนขึ้น,เสียงแหบขึ้น,มีเลือดออกกระปริดกระปรอย(33) ขนาดที่แนะนำ คือ 400-800 mg 6 เดือน
– Aromatase inhibitors ออกฤทธิ์ยับยั้งการสร้างฮอร์โมนestrogen จาก รังไข่,สมอง และเนื้อเยื่อไขมัน นิยมใช้ในผู้ป่วยที่มีอาการปวดท้องรุนแรง ที่ไม่ตอบสนองต่อยาตัวอื่น (34) โดยยาที่นิยมให้คือ anastrozole 1 mg วันละ 1 ครั้ง หรือ letrozole 2.5 mg วันละครั้ง มักให้ร่วมกับ norethindrone acetate มีการศึกษาว่า ให้ผลดีในการรักษาอาการปวดท้อง และอาการปวดจากการมีเพศสัมพันธ์ แต่ก็มีผลข้างเคียงค่อนข้างมาก และมีราคาสูง (35) โดยผลข้างเคียงที่สำคัญในยากลุ่มนี้คือ ลดมวลกระดูก และอาจทำให้เกิด ovarian cyst ได้ จึงนิยมให้คู่กับ ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวม หรือ norethindrone acetate
2. การผ่าตัด
จุดมุ่งหมาย คือ การตัดเอารอยโรคของเยื่อบุโพรงมดลูกเจริญผิดที่ออกให้หมดหรือตัดออกให้มากที่สุด และทำให้กายวิภาคของอวัยวะต่างๆในอุ้งเชิงกรานกลับมาเป็นปกติ
ข้อบ่งชี้ในการผ่าตัด มีดังนี้ ยังคงมีอาการปวดท้องอยู่หลังจากได้รักษาโดยการให้ยาแก้ปวดแล้ว มีข้อห้ามในการใช้ยา, ต้องการชิ้นเนื้อในการช่วยยืนยันการวินิจฉัย, ยังไม่สามารถตัดโรคมะเร็งของรังไข่ออกได้, มีการอุดตันของลำไส้ และระบบทางเดินปัสสาวะ (16)
การผ่าตัด แบ่งเป็น
- การผ่าตัดเชิงอนุรักษ์(Conservative surgery) เช่น การจี้, การเลาะพังผืดออก หรือการเลาะก้อนบริเวณรังไข่ออก การผ่าตัดเชิง อนุรักษ์นี้ ถือเป็น first line treatment เนื่องจาก มีภาวะแทรกซ้อนน้อยกว่า แต่ก็มีโอกาสกลับเป็นซ้ำ และต้องมาผ่าตัดซ้ำสูงกว่า(16) ซึ่งวิธีมาตรฐาน คือ การผ่าตัดผ่านทางหน้าท้องโดยใช้กล้อง เนื่องจากแผลผ่าตัดมีขนาดเล็ก ผู้ป่วยสามารถฟื้นตัวจากการผ่าตัดได้เร็ว และที่สำคัญคือมีโอกาสเกิดพังผืดภายหลังการผ่าตัดน้อยกว่าวิธีการผ่าตัดแบบเปิดหน้าท้อง(36) ซึ่งถือว่ามีความสำคัญมากโดยเฉพาะในรายที่ยังต้องการมีบุตร ส่วนการผ่าตัดแบบเปิดหน้าท้องนั้นควรใช้เฉพาะกรณีที่รอยโรคเป็นรุนแรงจนไม่สามารถรักษาได้ด้วยวิธีการใช้กล้อง และผู้ป่วยไม่มีความต้องการมีบุตรแล้ว . ปัจจุบันมีการผ่าตัด โดยการตัดเส้นประสาทที่รับกระแสประสาทจากอวัยวะในอุ้งเชิงกราน (Presacral neurectomy) พบว่าช่วยลดอาการปวดท้องบริเวณแนวกึ่งกลางลำตัวได้เป็นอย่างดี แต่ก็มีผลข้างเคียง คือ ท้องผูก และการทำงานของระบบทางเดินปัสสาวะเสียไป
- การผ่าตัดให้หายขาด (Definitive surgery) เหมาะในผู้ป่วยที่มีอาการรุนแรง ไม่ตอบสนองต่อยา และไม่ต้องการมีบุตรแล้ว การรักษาส่วนใหญ่จะนิยม ผ่าตัดมดลูก
บทบาทในการตัดรังไข่
การตัดรังไข่จะช่วยลดอาการปวดท้องได้จาก การลดระดับ estrogen ซึ่งอาจต้องพิจารณาทั้งผลดีและผลเสีย จากการเกิดวัยทองเร็วกว่ากำหนด โดยปัจจุบันยังไม่มีตัวเลขกำหนดแน่นอน แต่นิยมตัดรังไข่ในผู้ป่วยที่อายุมากกว่า40 ปี (37)
จากการศึกษาวิจัยพบว่า ในผู้ป่วยที่รับการรักษาอาการปวดท้องด้วยวิธีการผ่าตัด จะมีอาการปวดท้องทุเลาลง 3 เท่า ในช่วงเวลา 12 เดือน(38) และพบว่ามีผู้ป่วย 20% ที่ต้องได้รับการผ่าตัดซ้ำ ในระยะเวลา2 ปี (37)
อย่างไรก็ตาม หากรอยโรคของเยื่อบุโพรงมดลูกเจริญผิดที่ไม่รุนแรงและผู้ป่วยมีภาวะมีบุตรยากร่วมด้วย การรักษาด้วยวิธีการผ่าตัดอาจไม่ช่วยเพิ่มโอกาสการตั้งครรภ์ ในกรณีนี้ผู้ป่วยควรได้รับการรักษาด้วยเทคนิคช่วยการเจริญพันธุ์ เช่น การกระตุ้นการตกไข่และฉีดน้ำเชื้อ การทำเด็กหลอดแก้ว เป็นต้น
การดูแลผู้ป่วยหลังผ่าตัด โดยทั่วไปมักให้ยาฮอร์โมนต่อ18-24 เดือน เพื่อกดการเจริญของเยื่อบุโพรงมดลูก ในส่วนที่คาดว่า น่าจะผ่าตัดเอาออกไม่หมด เพื่อลดอัตราการเป็นซ้ำ และการผ่าตัดซ้ำ(39) โดยยาที่นิยมให้ คือ OCP, oral progestin, GnRH agonist, LNG- IUD
การรักษาเรื่องภาวะมีบุตรยาก หลักการเลือกวิธีการรักษา ขึ้นอยู่กับ ระยะของตัวโรค แบ่งเป็น
1. ระยะที่ 1,2 ระยะนี้ สาเหตุของภาวะมีบุตรยาก ส่วนใหญ่มักเกิดจาก inflammatory response ส่งผลให้มีการหลั่งสาร Prostaglandin, metalloproteinase, cytokine, chemokine ทำให้เกิดกระบวนการอักเสบ และรบกวนการทำงานของรังไข่, การโบกของท่อนำไข่, และการทำงานของเยื่อบุโพรงมดลูก(40) ส่งผลให้เกิดการรบกวนการปฏิสนธิและการฝังตัวของตัวอ่อน
การรักษาภาวะมีบุตรยากในระยะนี้ แบ่งตามกลุ่มอายุ
- หากผู้ป่วยมีอายุน้อยกว่า 35 ปี: นิยมรักษาด้วยการเฝ้าสังเกต (Expectant) ซึ่งเป็นการเฝ้าติดตามอาการ โดยไม่มีการให้ยา หรือการผ่าตัด มีแต่การกำหนดวันมีเพศสัมพันธ์ในช่วงวันไข่ตก โดยจะใช้เวลา 6 เดือน หากภายใน 6 เดือน ยังไม่ตั้งครรภ์ จะเพิ่มวิธี ให้ยาเพื่อกระตุ้นการตกไข่ร่วมกับ การฉีดอสุจิเข้าในโพรงมดลูก (Ovulation induction + Intrauterine insemination) ยาที่ใช้ในการกระตุ้นการตกไข่ คือ Clomiphene อาจใช้ยากลุ่ม aromatase inhibitor (Letrozole) แต่ไม่นิยมกระตุ้นการตกไข่โดยใช้ยากลุ่ม GnRH agonist เนื่องจากจะเพิ่มความเสี่ยงในการเกิดครรภ์แฝด >20% (41) โดยจะทำทั้งหมดประมาณ 3 -5 ครั้ง อัตราการตั้งครรภ์โดยวิธีนี้ 40% (42) แต่หากยังไม่ตั้งครรภ์ อาจต้องใช้เทคโนโลยีช่วยเจริญพันธุ์
- หากผู้ป่วยอายุมากกว่า 35ปี , ต้องการมีบุตรในระยะเวลาอันรวดเร็ว จะแนะนำให้ใช้เทคโนโลยีช่วยเจริญพันธุ์ อาจแนะนำให้เก็บตัวอ่อนแช่แข็งไว้ เผื่อใช้ในอนาคต (43) แต่ให้พึงระลึกอยู่เสมอว่า อัตราการตั้งครรภ์จากการทำIVF ในผู้ป่วยเยื่อบุโพรงมดลูกเจริญผิดที่ระยะที่1-2 ไม่แตกต่างกับคนปกติ (44)
2. ระยะที่3,4 สาเหตุมักเกิดจาก ระบบกายวิภาคในอุ้งเชิงกรานเปลี่ยนแปลงไป จากการมีพังผืด จึงไม่นิยมให้ยาเพื่อกระตุ้นการตกไข่ แต่จะแนะนำเรื่องการใช้เทคโนโลยีช่วยเจริญพันธุ์ไปเลย ซึ่งมีการศึกษาพบว่าการใช้เทคโนโลยีช่วยเจริญพันธุ์ ไม่เพิ่มความเสี่ยงในการเกิดภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ซ้ำ (39) และไม่เพิ่มความเสี่ยงในการเกิดภาวะแทรกซ้อนขณะตั้งครรภ์ เช่น การคลอดก่อนกำหนด (45)
การรักษา Endometrioma มีเป้าหมายการรักษา ดังนี้
- บรรเทาอาการ
- ป้องกันภาวะแทรกซ้อนจากตัวก้อน เช่น บิดขั้ว,รั่ว,แตก
- แยกให้ได้จากภาวะมะเร็งรังไข่
- รักษาภาวะมีบุตรยาก
- รักษาการทำงานของรังไข่ที่เหลืออยู่ให้ได้มากที่สุด เนื่องจาก endometrioma จะลดปริมาณ follicle
การรักษา endometrioma แบ่งเป็น
1. การเฝ้าสังเกต (Expectant) นิยมทำในกรณีที่ก้อนขนาดน้อยกว่า 5 เซนติเมตร(46) และผู้ป่วยไม่มีอาการ โดยจะนัดตรวจร่างกาย และ Ultrasound ดูขนาดก้อน ทุก 6 เดือนเป็นเวลา 1-2 ปี หากก้อนมีขนาดพอๆเดิม และไม่มีอาการเพิ่มขึ้น จะนัดห่างเป็นทุก 1 ปี แต่หากก้อนมีขนาดใหญ่ขึ้น, ลักษณะของก้อนสงสัยว่าเป็นมะเร็ง หรือผู้ป่วยมีอาการมากขึ้น จะแนะนำให้ผ่าตัด
2. การผ่าตัด โดยทั่วไป นิยมรักษาด้วยวิธีการผ่าตัดส่องกล้องเป็นอันดับแรก
- การผ่าตัดเชิงอนุรักษ์(Conservative surgery) ไม่นิยมการรักษาโดยวิธีเจาะดูดน้ำในก้อนเพียงอย่างเดียว เนื่องจากอัตราการกลับเป็นซ้ำสูงถึง 80-100% (47) นอกจากนี้การเปิดเลาะและการจี้ตัวก้อน ยังพบว่าไม่ช่วยเพิ่มอัตราการตั้งครรภ์ได้เทียบเท่ากับการผ่าตัดเอาก้อนออก (48) ดังนั้นจึงนิยมผ่าตัดเอาก้อนออก (cystectomy) เนื่องจากช่วยเพิ่มอัตราการตั้งครรภ์ถึง 3 เท่า (48)
- การผ่าตัดให้หายขาด (Definitive surgery) ได้แก่ การผ่าตัดเอารังไข่ข้างที่มีก้อนออก (Oophorectomy) เหมาะสมในผู้ป่วย ที่มีอาการกลับเป็นซ้ำ, สงสัยมะเร็งรังไข่ การผ่าตัดมดลูกร่วมกับการผ่าตัดรังไข่2ข้างออก (Hysterectomy with bilateral salpingo-oohorectomy) เหมาะในผู้ป่วยที่ล้มเหลวกับการรักษาวิธีอื่น, ไม่ต้องการมีบุตรแล้ว
มีโอกาสมากน้อยแค่ไหนที่จะกลับมาเป็นโรคนี้ซ้ำภายหลังการผ่าตัด
ในการผ่าตัดเอารอยโรคของเยื่อบุโพรงมดลูกเจริญผิดที่ออกนั้นทำได้เฉพาะกับรอยโรคที่มองเห็นได้ด้วยตาเปล่า ดังนั้นจึงมีความเป็นไปได้สูงที่จะเอาออกไม่หมด เนื่องจากยังเหลือรอยโรคบางส่วนอยู่ (retained retroperitoneal ovarian ramnant) ซึ่งหากไม่ได้รับการรักษาต่อภายหลังการผ่าตัดพบว่ามีโอกาสที่โรคจะกลับเป็นซ้ำได้ 24-29%(45) ดังนั้นผู้ป่วยที่ยังไม่ต้องการมีบุตรในทันทีจึงควรได้รับการรักษาต่อเนื่องด้วยการใช้ยาฮอร์โมนเป็นระยะเวลาประมาณ 6 เดือน (49) ส่วนในรายที่ต้องการมีบุตรนั้น ช่วงเวลาดีที่สุดที่จะมีโอกาสตั้งครรภ์อยู่ในช่วง 1 ปีแรกภายหลังการผ่าตัด ซึ่งหากยังไม่ประสบผลสำเร็จก็ควรได้รับการรักษาด้วยเทคนิคช่วยการเจริญพันธุ์ต่อไป ส่วนในกรณีที่รอยโรคค่อนข้างรุนแรงและผู้ป่วยไม่ต้องการมีบุตรแล้ว การผ่าตัดเอามดลูกและรังไข่ออกทั้งหมดจะช่วยให้หายขาดจากโรคได้ แต่ก็มีข้อเสีย คือ ทำให้ผู้ป่วยเข้าสู่ภาวะวัยทองก่อนเวลาอันควร ในกรณีนี้จึงอาจจำเป็นต้องให้ฮอร์โมนทดแทนเพื่อช่วยลดอาการต่างๆของภาวะวัยทอง ซึ่งฮอร์โมนที่ให้เสริมในวัยทองนี้มีปริมาณฮอร์โมนน้อยเมื่อเทียบกับฮอร์โมนจากรังไข่จึงแทบไม่มีผลกระตุ้นให้โรคกลับเป็นซ้ำในระหว่างที่ใช้ยา
การพยากรณ์โรค
จากการศึกษาวิจัยพบว่า หากไม่ได้รับการรักษา มีโอกาสที่ภาวะนี้จะเป็นมากขึ้น 29-45%, ทุเลาลง22-29% และอาการคงเดิม 33-42%(50)ซึ่งปัจจุบันยังไม่ทราบปัจจัยที่มีผลต่อการดำเนินโรคดังกล่าว(51)
การตั้งครรภ์มีผลอย่างไรต่อภาวะเยื่อบุโพรงมดลูกเจริญผิดที่
โดยส่วนใหญ่ การตั้งครรภ์ มักทำให้ภาวะนี้ทุเลาลง หรือหายขาด เนื่องจากการเปลี่ยนแปลงของฮอร์โมนขณะตั้งครรภ์ ทำให้เกิดการ decidualization ของรอยโรค (52)แต่ก็ได้มีการศึกษาวิจัยที่กล่าวถึงภาวะแทรกซ้อนที่อาจพบได้มากขึ้น เช่น ลำไส้ทะลุ, มีเลือดคั่งในช่องท้อง, ไส้ติ่งอักเสบ, ก้อนในรังไข่แตกหรือติดเชื้อ(53-55)ซึ่งกลไกที่สามารถอธิบายภาวะดังกล่าวได้ คือ การที่มดลูกขยายขนาดขึ้นบริเวณที่มีพังผืด หรืออาจเกิดจากเส้นเลือดมาเลี้ยงบริเวณอุ้งเชิงกรานมากขึ้น (55)
ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่มีผลต่อการตั้งครรภ์อย่างไร
ภาวะนี้ อาจเพิ่มความเสี่ยงต่อการเกิด การแท้งบุตร,ตั้งครรภ์นอกมดลูก, รกเกาะต่ำ, ตกเลือดหลังคลอด, คลอดก่อนกำหนด(56)
ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่มีโอกาสพัฒนาเป็นมะเร็งได้หรือไม่
ได้มีการศึกษาพบว่าภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ เพิ่มโอกาสในการเกิดมะเร็งรังไข่ชนิดเยื่อบุผิว(Epithelial ovarian cancer)มากขึ้น (Clear cell 3 เท่า, Endometrioid and low grade serous type 2 เท่า)(57)โดยหากแยกตามกลุ่มอายุ โอกาสในการเกิดมะเร็งในผู้ป่วยก่อนหมดประจำเดือน 1% , ในผู้ป่วยหลังหมดประจำเดือน เป็น 1-2.5%(58)จะเห็นได้ว่า ความเสี่ยงค่อนข้างต่ำ จึงไม่มีความจำเป็นต้องตรวจคัดกรอง และยังไม่มีหลักฐานว่าการตัดรังไข่จะช่วยลดความเสี่ยงดังกล่าว
นอกจากนี้ยังได้มีการกล่าวถึง การเพิ่มความเสี่ยงในการเกิดโรคไขมันอุดตัน และโรคหลอดเลือดหัวใจในผู้ป่วยที่มีภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ โดยเชื่อว่าเกิดจาก การเพิ่มปฏิกิริยาการอักเสบของร่างกาย ร่วมกับมีการเพิ่ม oxidative stress(59)
สรุป
ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ คือ ภาวะที่เยื่อบุโพรงมดลูกเจริญเติบโตผิดที่นอกโพรงมดลูก บางครั้งอาจกระจายไปสู่อาจกระจายไปสู่อวัยวะที่อยู่ไกลออกไป เช่น กระบังลม ปอด และ ช่องเยื่อหุ้มปอด ผู้ป่วยส่วนใหญ่จะมาด้วยอาการ ปวดท้องน้อยเรื้อรัง โดยเฉพาะช่วงเป็นประจำเดือน มีภาวะมีบุตรยาก และมีอาการเจ็บตอนที่เพศสัมพันธ์ การวินิจฉัยโดยส่วนใหญ่ จะพิจารณาจากอาการเป็นสำคัญ ร่วมกับการตรวจร่างกาย และการผ่าตัดส่องกล้อง ภาวะนี้ไม่ใช่เนื้อร้าย แต่เป็นโรคเรื้อรัง และต้องการ การวางแผนการรักษาอย่างเป็นระบบ โดยขึ้นกับความต้องการมีบุตร และ ความพึงพอใจของผู้ป่วยเป็นสำคัญ
เอกสารอ้างอิง
- Sangi-Haghpeykar H, Poindexter AN, 3rd. Epidemiology of endometriosis among parous women. Obstetrics and gynecology. 1995;85(6):983-92.
- Strathy JH, Molgaard CA, Coulam CB, Melton LJ, 3rd. Endometriosis and infertility: a laparoscopic study of endometriosis among fertile and infertile women. Fertility and sterility. 1982;38(6):667-72.
- Kirshon B, Poindexter AN, 3rd. Contraception: a risk factor for endometriosis. Obstetrics and gynecology. 1988;71(6 Pt 1):829-31.
- Boothroyd CV, Lepre F. Permanent voice change resulting from Danazol therapy. The Australian & New Zealand journal of obstetrics & gynaecology. 1990;30(3):275-6.
- Marsh EE, Laufer MR. Endometriosis in premenarcheal girls who do not have an associated obstructive anomaly. Fertility and sterility. 2005;83(3):758-60.
- Nezhat F, Datta MS, Hanson V, Pejovic T, Nezhat C, Nezhat C. The relationship of endometriosis and ovarian malignancy: a review. Fertility and sterility. 2008;90(5):1559-70.
- Ballard KD, Seaman HE, de Vries CS, Wright JT. Can symptomatology help in the diagnosis of endometriosis? Findings from a national case-control study–Part 1. BJOG : an international journal of obstetrics and gynaecology. 2008;115(11):1382-91.
- Missmer SA, Hankinson SE, Spiegelman D, Barbieri RL, Michels KB, Hunter DJ. In utero exposures and the incidence of endometriosis. Fertility and sterility. 2004;82(6):1501-8.
- Hediger ML, Hartnett HJ, Louis GM. Association of endometriosis with body size and figure. Fertility and sterility. 2005;84(5):1366-74.
- Missmer SA, Chavarro JE, Malspeis S, Bertone-Johnson ER, Hornstein MD, Spiegelman D, et al. A prospective study of dietary fat consumption and endometriosis risk. Human reproduction (Oxford, England). 2010;25(6):1528-35.
- Missmer SA, Hankinson SE, Spiegelman D, Barbieri RL, Marshall LM, Hunter DJ. Incidence of laparoscopically confirmed endometriosis by demographic, anthropometric, and lifestyle factors. American journal of epidemiology. 2004;160(8):784-96.
- Mousa NA, Bedaiwy MA, Casper RF. Aromatase inhibitors in the treatment of severe endometriosis. Obstetrics and gynecology. 2007;109(6):1421-3.
- Bulun SE, Zeitoun K, Takayama K, Noble L, Michael D, Simpson E, et al. Estrogen production in endometriosis and use of aromatase inhibitors to treat endometriosis. Endocrine-related cancer. 1999;6(2):293-301.
- Vercellini P, Bracco B, Mosconi P, Roberto A, Alberico D, Dhouha D, et al. Norethindrone acetate or dienogest for the treatment of symptomatic endometriosis: a before and after study. Fertility and sterility. 2016;105(3):734-43.e3.
- Chapron C, Vercellini P, Barakat H, Vieira M, Dubuisson JB. Management of ovarian endometriomas. Human reproduction update. 2002;8(6):591-7.
- Treatment of pelvic pain associated with endometriosis: a committee opinion. Fertility and sterility. 2014;101(4):927-35.
- Oliveira FR, Dela Cruz C, Del Puerto HL, Vilamil QT, Reis FM, Camargos AF. Stem cells: are they the answer to the puzzling etiology of endometriosis? Histology and histopathology. 2012;27(1):23-9.
- Sinaii N, Plumb K, Cotton L, Lambert A, Kennedy S, Zondervan K, et al. Differences in characteristics among 1,000 women with endometriosis based on extent of disease. Fertility and sterility. 2008;89(3):538-45.
- Givens V, Mitchell GE, Harraway-Smith C, Reddy A, Maness DL. Diagnosis and management of adnexal masses. American family physician. 2009;80(8):815-20.
- Arnold J, Barcena de Arellano ML, Ruster C, Vercellino GF, Chiantera V, Schneider A, et al. Imbalance between sympathetic and sensory innervation in peritoneal endometriosis. Brain, behavior, and immunity. 2012;26(1):132-41.
- Vercellini P, Fedele L, Aimi G, Pietropaolo G, Consonni D, Crosignani PG. Association between endometriosis stage, lesion type, patient characteristics and severity of pelvic pain symptoms: a multivariate analysis of over 1000 patients. Human reproduction (Oxford, England). 2007;22(1):266-71.
- Alkatout I, Mettler L, Beteta C, Hedderich J, Jonat W, Schollmeyer T, et al. Combined surgical and hormone therapy for endometriosis is the most effective treatment: prospective, randomized, controlled trial. Journal of minimally invasive gynecology. 2013;20(4):473-81.
- Ballard K, Lane H, Hudelist G, Banerjee S, Wright J. Can specific pain symptoms help in the diagnosis of endometriosis? A cohort study of women with chronic pelvic pain. Fertility and sterility. 2010;94(1):20-7.
- Berlanda N, Vercellini P, Carmignani L, Aimi G, Amicarelli F, Fedele L. Ureteral and vesical endometriosis. Two different clinical entities sharing the same pathogenesis. Obstetrical & gynecological survey. 2009;64(12):830-42.
- Hwang SM, Lee CW, Lee BS, Park JH. Clinical features of thoracic endometriosis: A single center analysis. Obstetrics & gynecology science. 2015;58(3):223-31.
- Vercellini P, Trespidi L, De Giorgi O, Cortesi I, Parazzini F, Crosignani PG. Endometriosis and pelvic pain: relation to disease stage and localization. Fertility and sterility. 1996;65(2):299-304.
- Hickey M, Ballard K, Farquhar C. Endometriosis. BMJ (Clinical research ed). 2014;348:g1752.
- Cheng YM, Wang ST, Chou CY. Serum CA-125 in preoperative patients at high risk for endometriosis. Obstetrics and gynecology. 2002;99(3):375-80.
- Duffy DM, VandeVoort CA. Maturation and fertilization of nonhuman primate oocytes are compromised by oral administration of a cyclooxygenase-2 inhibitor. Fertility and sterility. 2011;95(4):1256-60.
- Muzii L, Di Tucci C, Achilli C, Di Donato V, Musella A, Palaia I, et al. Continuous versus cyclic oral contraceptives after laparoscopic excision of ovarian endometriomas: a systematic review and metaanalysis. American journal of obstetrics and gynecology. 2016;214(2):203-11.
- Davis L, Kennedy SS, Moore J, Prentice A. Oral contraceptives for pain associated with endometriosis. The Cochrane database of systematic reviews. 2007(3):Cd001019.
- Olive DL. Medical therapy of endometriosis. Seminars in reproductive medicine. 2003;21(2):209-22.
- Brown J, Pan A, Hart RJ. Gonadotrophin-releasing hormone analogues for pain associated with endometriosis. The Cochrane database of systematic reviews. 2010(12):Cd008475.
- Attar E, Bulun SE. Aromatase inhibitors: the next generation of therapeutics for endometriosis? Fertility and sterility. 2006;85(5):1307-18.
- Ferrero S, Camerini G, Seracchioli R, Ragni N, Venturini PL, Remorgida V. Letrozole combined with norethisterone acetate compared with norethisterone acetate alone in the treatment of pain symptoms caused by endometriosis. Human reproduction (Oxford, England). 2009;24(12):3033-41.
- Vercellini P, Crosignani PG, Abbiati A, Somigliana E, Vigano P, Fedele L. The effect of surgery for symptomatic endometriosis: the other side of the story. Human reproduction update. 2009;15(2):177-88.
- Shakiba K, Bena JF, McGill KM, Minger J, Falcone T. Surgical treatment of endometriosis: a 7-year follow-up on the requirement for further surgery. Obstetrics and gynecology. 2008;111(6):1285-92.
- Duffy JM, Arambage K, Correa FJ, Olive D, Farquhar C, Garry R, et al. Laparoscopic surgery for endometriosis. The Cochrane database of systematic reviews. 2014(4):Cd011031.
- Dunselman GA, Vermeulen N, Becker C, Calhaz-Jorge C, D’Hooghe T, De Bie B, et al. ESHRE guideline: management of women with endometriosis. Human reproduction (Oxford, England). 2014;29(3):400-12.
- Gupta S, Goldberg JM, Aziz N, Goldberg E, Krajcir N, Agarwal A. Pathogenic mechanisms in endometriosis-associated infertility. Fertility and sterility. 2008;90(2):247-57.
- Guzick DS, Carson SA, Coutifaris C, Overstreet JW, Factor-Litvak P, Steinkampf MP, et al. Efficacy of superovulation and intrauterine insemination in the treatment of infertility. National Cooperative Reproductive Medicine Network. The New England journal of medicine. 1999;340(3):177-83.
- Schenken RS, Asch RH, Williams RF, Hodgen GD. Etiology of infertility in monkeys with endometriosis: luteinized unruptured follicles, luteal phase defects, pelvic adhesions, and spontaneous abortions. Fertility and sterility. 1984;41(1):122-30.
- Reindollar RH, Regan MM, Neumann PJ, Levine BS, Thornton KL, Alper MM, et al. A randomized clinical trial to evaluate optimal treatment for unexplained infertility: the fast track and standard treatment (FASTT) trial. Fertility and sterility. 2010;94(3):888-99.
- Hamdan M, Omar SZ, Dunselman G, Cheong Y. Influence of endometriosis on assisted reproductive technology outcomes: a systematic review and meta-analysis. Obstetrics and gynecology. 2015;125(1):79-88.
- Benaglia L, Candotti G, Papaleo E, Pagliardini L, Leonardi M, Reschini M, et al. Pregnancy outcome in women with endometriosis achieving pregnancy with IVF. Human reproduction (Oxford, England). 2016;31(12):2730-6.
- Smith S, Pfeifer SM, Collins JA. Diagnosis and management of female infertility. Jama. 2003;290(13):1767-70.
- Keyhan S, Hughes C, Price T, Muasher S. An Update on Surgical versus Expectant Management of Ovarian Endometriomas in Infertile Women. BioMed research international. 2015;2015:204792.
- Holoch KJ, Lessey BA. Endometriosis and infertility. Clinical obstetrics and gynecology. 2010;53(2):429-38.
- Bianchi PH, Pereira RM, Zanatta A, Alegretti JR, Motta EL, Serafini PC. Extensive excision of deep infiltrative endometriosis before in vitro fertilization significantly improves pregnancy rates. Journal of minimally invasive gynecology. 2009;16(2):174-80.
- Sutton CJ, Ewen SP, Whitelaw N, Haines P. Prospective, randomized, double-blind, controlled trial of laser laparoscopy in the treatment of pelvic pain associated with minimal, mild, and moderate endometriosis. Fertility and sterility. 1994;62(4):696-700.
- Sutton CJ, Pooley AS, Ewen SP, Haines P. Follow-up report on a randomized controlled trial of laser laparoscopy in the treatment of pelvic pain associated with minimal to moderate endometriosis. Fertility and sterility. 1997;68(6):1070-4.
- Moen MH, Muus KM. Endometriosis in pregnant and non-pregnant women at tubal sterilization. Human reproduction (Oxford, England). 1991;6(5):699-702.
- Pisanu A, Deplano D, Angioni S, Ambu R, Uccheddu A. Rectal perforation from endometriosis in pregnancy: case report and literature review. World journal of gastroenterology. 2010;16(5):648-51.
- Brosens IA, Lier MC, Mijatovic V, Habiba M, Benagiano G. Severe spontaneous hemoperitoneum in pregnancy may be linked to in vitro fertilization in patients with endometriosis: a systematic review. Fertility and sterility. 2016;106(3):692-703.
- Leone Roberti Maggiore U, Remorgida V, Sala P, Vellone VG, Biscaldi E, Ferrero S. Spontaneous Uroperitoneum and Preterm Delivery in a Patient With Bladder Endometriosis. Journal of minimally invasive gynecology. 2015;22(6):923-4.
- Saraswat L, Ayansina DT, Cooper KG, Bhattacharya S, Miligkos D, Horne AW, et al. Pregnancy outcomes in women with endometriosis: a national record linkage study. BJOG : an international journal of obstetrics and gynaecology. 2016.
- Pearce CL, Templeman C, Rossing MA, Lee A, Near AM, Webb PM, et al. Association between endometriosis and risk of histological subtypes of ovarian cancer: a pooled analysis of case-control studies. The Lancet Oncology. 2012;13(4):385-94.
- Van Gorp T, Amant F, Neven P, Vergote I, Moerman P. Endometriosis and the development of malignant tumours of the pelvis. A review of literature. Best practice & research Clinical obstetrics & gynaecology. 2004;18(2):349-71.
- Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. The New England journal of medicine. 2005;352(16):1685-95.


