Opportunistic salpingectomy
พญ. อลิน เพชโรภาส
อาจารย์ที่ปรึกษา ผศ.นพ. ชัยเลิศ พงษ์นริศร
มะเร็งรังไข่เป็นมะเร็งที่พบได้อันดับสองในกลุ่มโรคมะเร็งนรีเวช และเป็นสาเหตุการเสียชีวิตอันดับหนึ่งของกลุ่มโรคมะเร็งนรีเวช ในประเทศสหรัฐอเมริกาและแคนาดาพบว่ามีประชากรที่ได้รับการวินิจฉัยว่าเป็นมะเร็งรังไข่ปีละ 25,000 คน (1) และเสียชีวิตจากมะเร็งรังไข่ปีละ 16,000 คน ข้อมูลของประเทศไทยใน พ.ศ. 2553 รวบรวมโดยกรมการแพทย์ กระทรวงสาธารณสุข พบว่าในระหว่าง พ.ศ. 2544-2546 มะเร็งรังไข่พบเป็นอันดับที่ 6 ของมะเร็งที่พบในสตรีไทย โดยมีอุบัติการณ์เท่ากับ 5.1 ต่อประชากรสตรี 100,000 คนต่อปี (2) โดยความเสี่ยงของมะเร็งรังไข่ตลอดชั่วชีวิต (lifetime risk) ของสตรีคนหนึ่งๆในกลุ่มประชากรทั่วไปอยู่ที่ 1.4 เปอร์เซ็นต์ ในขณะที่สตรีที่มีความเสี่ยงสูง กล่าวคือคนที่มียีน BRCA1 และ BRCA2 ความเสี่ยงของมะเร็งรังไข่อยู่ที่ร้อยละ 40 – 75 และ 8 -34 ตามลำดับ (3)
มะเร็งรังไข่โดยทั่วไปมักจะไม่แสดงอาการในเบื้องต้น แต่มักจะแสดงอาการเมื่อโรคดำเนินไปในขั้นสูงแล้วและจะมีพยากรณ์โรคที่แย่ พบว่าอัตราการมีชีวิตรอดใน 5 ปี (five-year overall survival rate) ต่ำกว่าร้อยละ 50 (4) อีกทั้งในปัจจุบันข้อมูลเกี่ยวกับการตรวจคัดกรองมะเร็งรังไข่พบว่ายังไม่มีการตรวจคัดกรองใดที่ให้ประโยชน์ในการช่วยคัดกรองในแง่ของการช่วยลดอัตราการเสียชีวิต ดังนั้นการตรวจคัดกรองจึงยังไม่เป็นที่แนะนำในขณะนี้ (5)
ความรู้ความเข้าใจเกี่ยวกับมะเร็งรังไข่ในปัจจุบันได้พัฒนาขึ้นมาก และเป็นที่เข้าใจแล้วว่ามะเร็งรังไข่เป็นกลุ่มโรคที่มีความแตกต่างทางโมเลกุลและพฤติกรรมทางชีวภาพที่แตกต่างกันไปในแต่ละชนิดของมะเร็งรังไข่ และแต่ละชนิดจะมีเซลล์ต้นกำเนิดต่างๆกัน (6,7) โดยมีการตั้งสมมุติฐานว่ามะเร็งรังไข่สามารถเกิดได้ทั้งจากเซลล์เยื่อบุผิวของรังไข่ เยื่อบุผิวของท่อนำไข่ หรือแม้กระทั่งเยื่อบุโพรงมดลูกที่มาเจริญอยู่ผิดที่ เป็นต้น ยิ่งทำให้การตรวจคัดกรองมะเร็งรังไข่เป็นไปได้ยากเนื่องมาจากความหลากหลายของพยาธิวิทยาและการกำเนิดของเซลล์ชนิดนั้นๆ
มะเร็งรังไข่ที่จะกล่าวในที่นี้จะขอกล่าวถึงเฉพาะกลุ่มมะเร็งรังไข่ชนิดเยื่อบุผิว (Epithelial ovarian cancer) โดยปัจจุบันได้แบ่งกลุ่มของมะเร็งรังไข่ชนิดนี้ตามพยาธิวิทยาได้ 5 กลุ่มหลัก คือ high-grade serous carcinoma (HGSC), low-grade serous carcinoma (LGSC), endometrioid carcinoma (ENOC), clear cell carcinoma (CCOC) และ mucinous carcinoma (8) โดยจะพบกลุ่มของ high-grade serous carcinoma มากที่สุดถึงร้อยละ 70 (9) และมักจะพบอาการแสดงเมื่อตัวโรคดำเนินอยู่ในระยะที่ 3 หรือ 4 แล้ว ถึงแม้ว่ามะเร็งรังไข่กลุ่มนี้จะตอบสนองต่อยาเคมีบำบัดได้ดี แต่มีจะมีการกลับเป็นซ้ำ และพบภาวะดื้อต่อยาเคมีบำบัดได้บ่อย
และเนื่องจากการคัดกรองมะเร็งรังไข่ทำได้ยากและไม่ค่อยมีประสิทธิภาพนัก ปัจจุบันการป้องกันแบบปฐมภูมิ (Primary prevention) จึงได้ถูกนำเสนอขึ้นมา เช่นในกลุ่มสตรีที่มีความเสี่ยงสูงต่อมะเร็งรังไข่ดังที่กล่าวไปข้างต้น คือสตรีที่มียีน BRCA mutation หรือกลุ่ม Lynch syndrome จะแนะนำให้ทำ risk-reduction salpingo-oophorectomy (rrBSO) (10) และสำหรับสตรีที่มีความเสี่ยงทั่วไปในปัจจุบันได้มีการกล่าวถึง opportunistic salpingectomy เพื่อลดความเสี่ยงของมะเร็งรังไข่ในอนาคต
บทบาทของท่อนำไข่กับมะเร็งรังไข่
รังไข่เป็นแหล่งที่พบก้อนมะเร็งมากที่สุดเมื่อมีการวินิจฉัยมะเร็งรังไข่เกิดขึ้นในสตรีรายหนึ่งๆ โดยแต่เดิมมีทฤษฎีเกี่ยวกับการตกไข่อย่างต่อเนื่อง (incessant ovulation hypothesis) ว่า ในสตรีที่มีประวัติการตั้งครรภ์หลายครั้งจะลดความเสี่ยงของมะเร็งรังไข่ (11) และคิดว่า Mullerian-type cortical inclusion cysts (Mullerain-CICs) ที่อยู่ในรังไข่ซึ่งเปลี่ยนมาจาก ovarian surface epithelium หลังจากการตกไข่อาจจะเป็นเซลล์ต้นกำเนิดของมะเร็งรังไข่
ต่อมาความคิดเกี่ยวกับเซลล์ต้นกำเนิดของมะเร็งรังไข่ว่ามีเซลล์ต้นกำเนิดจากท่อนำไข่ได้เกิดขึ้นในปีพ.ศ. 2439 เนื่องจากพบรายงานผู้ป่วยมะเร็งท่อนำไข่ปฐมภูมิว่ามีลักษณะพยาธิวิทยาคล้ายกับที่พบในมะเร็งรังไข่ (12) นอกจากนี้ได้ทำการศึกษาในสตรีที่มียีน BRCA1 และ BRCA2 ที่ได้ทำการผ่าตัดรังไข่และท่อนำไข่แบบ rrBSO พบว่าร้อยละ 5 – 15 ของสตรีในกลุ่มนี้มีเซลล์มะเร็งแอบแฝงอยู่บริเวณท่อนำไข่ส่วนปลาย (fimbriae) (13) และพบเซลล์ก่อนเป็นมะเร็ง (preinvasive lesion) คือกลุ่มของ serous tubal intraepithelial cancers (STICs) ที่ท่อนำไข่ส่วนปลายประมาณร้อยละ 1 – 6 (14) ทำให้เกิด The Sectioning and Extensive Examination of the Fimbria (SEE-FIM) protocol เพื่อเพิ่มการตรวจพบรอยโรคก่อนเป็นมะเร็งและมะเร็งในระยะเริ่มแรกโดยการตรวจทางพยาธิวิทยาของท่อนำไข่ โดย protocol นี้ทำให้พบว่ามีรอยโรคที่ท่อนำไข่ถึงร้อยละ 70 ในสตรีที่วินิจฉัย high-grade serous carcinoma ทั้งที่เป็นมะเร็งรังไข่และมะเร็งเยื่อบุช่องท้อง (primary peritoneal) ทั้งในรายที่มีและไม่มี BRCA mutation (15) และพบ STICs ที่บริเวณปลายท่อนำไข่ร้อยละ 40 – 60 (16) และที่สำคัญที่สุดคือในสตรีรายที่ผ่าตัดโดยรอยโรคไม่ใช่มะเร็ง (benign conditions) ไม่พบรอยโรคของ STICs เลย จากการศึกษาทั้งหมดจึงสามารถสรุปได้ว่าท่อนำไข่เป็นเซลล์ต้นกำเนิดของมะเร็งรังไข่ในกลุ่ม high-grade serous carcinomas แล้วถึงมีการกระจายของรอยโรคไปบริเวณรังไข่และเยื่อบุช่องท้อง (17) นอกจากนี้ยังมีการศึกษาที่สนับสนุนทฤษฎีที่ว่า STICs เป็นรอยโรคก่อน HGSC คือการค้นพบยีน TP53 mutation ใน STICs เช่นเดียวกับที่พบในมะเร็งรังไข่หรือมะเร็งเยื่อบุช่องท้อง (15) จากข้อสรุปของ SEE-FIM protocol ท่อนำไข่จึงเป็นเป้าหมายหลักในการป้องกันมะเร็งรังไข่
ความสัมพันธ์ของการทำหมันและความเสี่ยงของมะเร็งรังไข่ (Tubal ligation and ovarian cancer risk)
จากที่กล่าวมาข้างต้นท่อนำไข่ถือเป็นหนึ่งในเซลล์ต้นกำเนิดของมะเร็งรังไข่ มีการศึกษาว่าการทำหมันโดยการตัดท่อนำไข่สามารถช่วยลดความเสี่ยงของมะเร็งรังไข่ได้ (18) จากการศึกษาของ Nurses’ Health Study ทำการศึกษาในสตรี 230,000 ราย โดยมี 29,340 รายที่ได้รับการทำหมันพบว่าในสตรีที่ได้รับการทำหมันมีความสัมพันธ์ในการลดความเสี่ยงของมะเร็งรังไข่ (Hazard ratio 0.76, 95% CI 0.64-0.90) และผลการศึกษานี้มีอิทธิพลมากในรายที่เป็น non-serous type และมีนัยสำคัญทางสถิติในสตรีที่มีอายุน้อยกว่า 35 ปีผลการลดความเสี่ยงนี้ใน non-serous type โดยเฉพาะกลุ่ม endometrioid carcinomas และ clear cell carcinomas เชื่อว่าเซลล์มะเร็งในสองกลุ่มนี้เกิดจากการเปลี่ยนแปลงของเซลล์เยื่อบุโพรงมดลูกเจริญผิดที่ (19) และท่อนำไข่ถึงว่าเป็นท่อสะสมของระดูที่ไหลย้อนขึ้นมาจากโพรงมดลูกและทำให้เยื่อบุโพรงมดลูกไปเจริญที่รังไข่และเยื่อบุช่องท้อง ดังนั้นการขัดขวางท่อนำไข่อาจจะป้องกันขั้นตอนเหล่านี้ได้
การทำหมันด้วยเทคนิคต่าง ๆ ทั้งการใช้คลิป การใช้ห่วงรัด การจี้ไฟฟ้าเพื่อทำลายเนื้อเยื่อ หรือการตัดท่อนำไข่ออกบางส่วนโดยไม่รวมถึงการใช้ hysteroscope ในปัจจุบันยังไม่มีการศึกษาที่บ่งชี้แน่ชัดว่าวิธีการใดดีกว่ากันในการลดความเสี่ยงของมะเร็งรังไข่
Opportunistic salpingectomy
Opportunistic salpingectomy ถูกแนะนำให้ใช้ในการผ่าตัดทางนรีเวชโดย the Ovarian Cancer Research team (OVCARE) ในเดือนกันยายน พ.ศ.2553 เพื่อใช้ลดความเสี่ยงของมะเร็งรังไข่ในสตรีที่มีความเสี่ยงทั่วไป และถูกแนะนำให้ทำโดย The Society of Gynecologic Oncology of Canada ในปีพ.ศ. 2554 แต่ opportunistic salpingectomy ไม่แนะนำให้ใช้แทนการทำ risk-reduction bilateral salpingo-oophorectomy ในสตรีที่ความเสี่ยงสูงต่อมะเร็งรังไข่
Opportunistic salpingectomy โดยนิยามคือการผ่าตัดนำท่อนำไข่ออกในสตรีที่เข้ารับการผ่าตัดทางนรีเวชด้วยเหตุผลอื่น ๆ โดยสตรีนั้น ๆจะต้องไม่ต้องการมีบุตรแล้วและไม่ต้องการใช้ท่อนำไข่เพื่อเหตุผลในแง่ของการสืบพันธุ์อีกต่อไป และหากไม่มีเหตุที่จะต้องนำรังไข่ออกด้วยการผ่าตัดนั้นจะยังเก็บรังไข่ไว้โดยนำเฉพาะท่อนำไข่ออกเพียงอย่างเดียว โดยทั่วไปการผ่าตัดที่แนะนำให้ทำ opportunistic salpingectomy คือ
- การผ่าตัดมดลูกด้วยเนื้องอกชนิดไม่เป็นเนื้อร้าย (Hysterectomy for benign conditions)
- การทำหมัน
เป้าหมายของการทำ opportunistic salpingectomy คือการตัดเอาส่วนปลายหนึ่งในสามส่วนของท่อนำไข่ออก คือส่วนของ fimbria, infundibulum และส่วนหนึ่งของ ampulla (ดังส่วนของท่อนำไข่ที่แสดงในรูปที่ 1) แต่ในส่วนของ interstitial part ไม่จำเป็นต้องตัดออก นอกจากนี้ส่วนของ fimbria อื่น ๆ ที่ติดอยู่กับรังไข่ควรจะจี้ทำลายหรือตัดออกจนหมด ดังเหตุผลที่กล่าวไปข้างต้นว่ามักพบรอยโรคก่อนเป็นมะเร็งและเซลล์มะเร็งแอบแฝงอยู่บริเวณท่อนำไข่ส่วนปลาย และการตัดท่อนำไข่ออกควรทำด้วยความระมัดระวังไม่ให้ตัดโดนเส้นเลือดในส่วนของ infundibulopelvic ligament ที่มาเลี้ยงรังไข่เนื่องจากเส้นเลือด collateral อื่น ๆ ที่มาเลี้ยงรังไข่จะถูกทำลายไประหว่างการตัดท่อนำไข่ออก
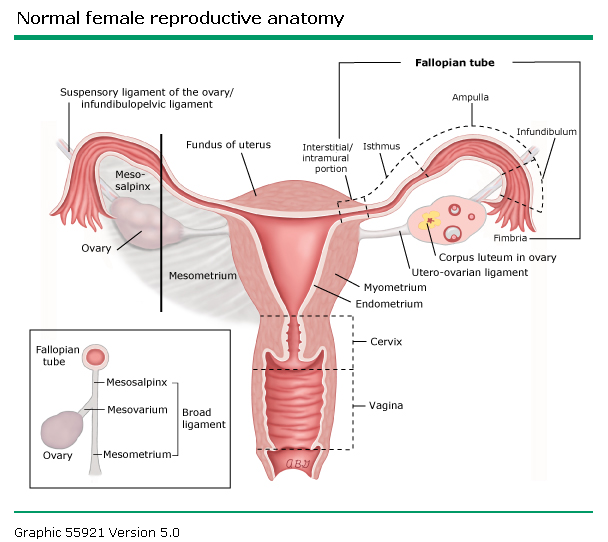
รูปที่ 1 แสดงส่วนต่างของระบบสืบพันธุ์เพศหญิง
Complete salpingectomy หมายถึงการนำส่วนของท่อนำไข่ออกทั้งหมด แต่หากทำไม่ได้สามารถทำ partial salpingectomy แทนได้นั่นคือการตัดท่อนำไข่ไปจนถึงส่วนของ isthmic portion ประมาณ 0.5 – 1 เซนติเมตรห่างจาก cornu
ก่อนทำควรมีการ informed consent กับผู้ป่วยก่อนสำหรับผู้ป่วยที่วางแผนจะตัดมดลูกหรือทำหมัน อธิบายถึงทางเลือกในการทำ opportunistic salpingectomy และอธิบายถึงข้อได้และข้อเสียของการทำ และที่สำคัญที่สุดจำเป็นต้องแจ้งผู้ป่วยเสมอว่าในปัจจุบันยังไม่มีข้อมูลเกี่ยวกับผลกระทบของหัตการนี้กับการเกิดมะเร็งรังไข่ มะเร็งท่อนำไข่ และมะเร็งเยื่อบุช่องท้อง
ขั้นตอนการทำ opportunistic salpingectomy
1. หลังจากพบส่วนของท่อนำไข่ ให้แยกระหว่างส่วนของท่อนำไข่และรังไข่ให้ชัดเจน โดยสองอวัยวะนี้จะมี mesosalpinx ขั้นอยู่ตรงกลาง ใช้ Kelly clamp จับบริเวณส่วนของ cornual portion ของท่อนำไข่ และจับท่อนำไข่ส่วนที่เหลือด้วย Babcock และยกส่วนของท่อนำไข่ขึ้นมาและทำการเจาะรูบริเวณของ mesosalpinx ด้วย straight Halsted clamp ดังรูปที่ 2
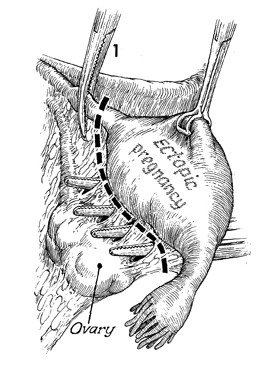
รูปที่ 2 แสดการยกท่อนำไข่และการเจาะรูบริเวณ mesosalpinx
2. หลังจาก clamp บริเวณ mesosalpinx แล้วให้ทำการตัดและผูกแต่ละ stump ด้วย interrupted absorbable suture 3-0 ไปจนถึงบริเวณ cornual portion แล้วผูกส่วนนี้ด้วย interrupted absorbable suture ไว้ที่บริเวณ broad ligament กับด้านหลังของมดลูก ดังรูปที่ 3
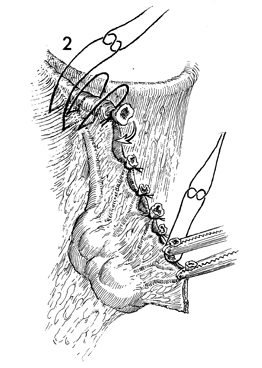
รูปที่ 3 แสดงการตัดและผูกบริเวณ mesosalpinx
3. เย็บไหมเป็น continuous suture ด้วย absorbable suture 3-0 เพื่อ reperitonealize บริเวณ mesosalpinx ดังรูปที่ 4 และรูปที่ 5
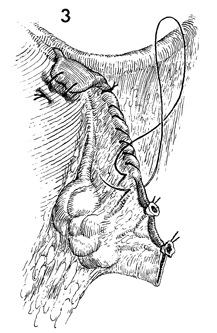

รูปที่ 4 และ 5 แสดงการเย็บเพื่อ reperitonealize บริเวณ mesosalpinx
ผลการรักษา (Outcome and effectiveness)
จากที่ได้กล่าวไปในข้างต้น ในปัจจุบันมีหลักฐานหลายอย่างที่สนับสนุนเกี่ยวกับความสัมพันธ์ของท่อนำไข่กับการเกิดมะเร็งรังไข่ นอกจากนี้จากการศึกษาเกี่ยวกับการทำหมันที่สามารถช่วยลดความเสี่ยงของมะเร็งรังไข่ จึงทำให้เริ่มมีการศึกษาเกี่ยวกับผลของการทำ opportunistic salpingectomy ต่อการลดความเสี่ยงมะเร็งรังไข่
การศึกษาจากนักวิจัยในประเทศเดนมาร์กซึ่งทำ retrospective cohort study (20) พบว่าการตัดท่อนำไข่ออกทั้งสองข้างช่วยลดความเสี่ยงของมะเร็งรังไข่ได้ร้อยละ 42 (OR = 0.58, 95% CI 0.36-0.95) แต่ในงานวิจัยนี้พบว่าพยาธิวิทยาของมะเร็งรังไข่ที่ได้นำมาทำการศึกษาต่างจากกลุ่มประชากรทั่วไปเล็กน้อย คือพบพยาธิวิทยากลุ่ม high-grade serous carcinomas ในการศึกษานี้เพียงร้อยละ 46 (ในกลุ่มประชากรทั่วไปพบพยาธิวิทยากลุ่ม high-grade serous carcinomas ประมาณร้อยละ 70 )
นอกจากนี้ยังมีการศึกษาล่าสุดทำในประเทศสวีเดนในสตรีมากกว่า 5.5 ล้านคนและมีผู้ป่วยที่เป็นมะเร็งรังไข่ในสตรีกลุ่มนี้ 30,000 คน เป็นงานวิจัยแบบ retrospective (21) โดยใช้ข้อมูลทางสุขภาพที่มีการบันทึกไว้ของประเทศศึกษาเปรียบเทียบสตรีที่เข้ารับการผ่าตัดทางนรีเวช 4 กลุ่ม คือ กลุ่มผ่าตัดมดลูกอย่างเดียว กลุ่มผ่าตัดมดลูกและท่อนำไข่รวมถึงรังไข่ท้องสองข้าง กลุ่มตัดเฉพาะท่อนำไข่ และกลุ่มทำหมัน พบว่ากลุ่มที่ผ่าตัดมดลูกและท่อนำไข่รวมถึงรังไข่ทั้งสองข้างเป็นกลุ่มที่ลดความเสี่ยงต่อมะเร็งรังไข่ได้เกือบทั้งหมด นอกจากนี้ยังได้มีการศึกษาในกลุ่มที่ตัดท่อนำไข่พบว่า การตัดท่อนำไข่ 1 ข้างสามารถลดความเสี่ยงของมะเร็งรังไข่ได้ร้อยละ 29 และกลุ่มที่ตัดท่อนำไข่ทั้งสองข้างสามารถลดความเสี่ยงของมะเร็งรังไข่ได้ถึง ร้อยละ 65 และในรายงานการวิจัยนี้ยังพบว่าแม้กระทั่งการผ่าตัดเฉพาะมดลูกอย่างเดียวยังสามารถลดความเสี่ยงของมะเร็งรังไข่ได้ด้วย
แต่เนื่องจากการทำ opportunistic salpingectomy ได้เริ่มแนะนำและทำในปีพ.ศ. 2553 ดังนั้นผลข้างเคียงในระยะยาวหรือการศึกษาแบบ prospective เพื่อหาความสัมพันธ์ของการทำ opportunistic salpingectomy กับอัตราการเกิดมะเร็งรังไข่ มะเร็งท่อนำไข่ และมะเร็งเยื่อบุช่องท้อง อาจจะต้องรอข้อมูลอย่างน้อย 10 ปีเพื่อดูผลของการทำหัตถการนี้
Cost-effectiveness
ในสหรัฐอเมริกาและแคนาดาพบว่ามีสตรีที่เข้ารับการผ่าตัดมดลูกเพียงอย่างเดียวโดยไม่ได้ตัดท่อนำไข่ รวมถึงสตรีที่ผ่าตัดทำหมัน จำนวน 590,000 คนต่อปี (22) หลังจากมีการแนะนำให้ทำ opportunistic salpingectomy ได้มีการศึกษาเกี่ยวกับค่าใช้จ่ายเพิ่มเติมจากการทำหัตถการนี้และความสัมพันธ์ของประสิทธิภาพที่จะได้จากการทำหัตถการนี้ โดยข้อมูลเกี่ยวกับค่าใช้จ่ายในการทำ opportunistic salpingectomy ในระบบสุขภาพทั่วไปต้องเก็บข้อมูลเพิ่มเติมต่อไป จึงต้องใช้ decision-analytic model ในการประเมินหา cost-effectiveness ของหัตถการนี้ (23) เพื่อดูความคุ้มค่าในการทำ โดยใช้สมมติฐานที่ว่า opportunistic salpingectomy ช่วยลดความเสี่ยงของมะเร็งรังไข่ได้ร้อยละ 50 เปรียบเทียบกับการทำ bilateral salpingo-oophorectomy, การผ่าตัดมดลูกอย่างเดียว และการทำหมัน ซึ่งช่วยลดความเสี่ยงของมะเร็งรังไข่ได้ ร้อยละ 90, 20 และ 30 ตามลำดับ พบว่าการทำ opportunistic salpingectomy นั้นคุ้มค่าที่จะทำ จากรายงานการศึกษาพบว่าการผ่าตัดมดลูกร่วมกับการทำ opportunistic salpingectomy มีค่าใช้จ่ายน้อยกว่าแต่มีประสิทธิภาพมากกว่าการทำผ่าตัดเฉพาะมดลูกเพียงอย่างเดียวหรือการทำ bilateral salpingo-oophorectomy โดยพบว่า life expectancy ของการผ่าตัดมดลูกร่วมกับการทำ opportunistic salpingectomy มากกว่าการทำผ่าตัดเฉพาะมดลูกเพียงอย่างเดียว 1 สัปดาห์ และมากกว่าการทำ bilateral salpingo-oophorectomy ถึง 2 เดือน (โดยที่ไม่มีการใช้ฮอร์โมนทดแทนในรายที่ได้รับการทำ bilateral salpingo-oophorectomy)
พบว่าจำนวนการทำ opportunistic salpingectomy ในการผ่าตัดมดลูกเพื่อป้องกันการเกิดมะเร็งรังไข่ 1 ราย (Number needed to treat; NNT) คือ 273 และ NNT ของ opportunistic salpingectomy ในการทำหมันคือ 366 ซึ่งใกล้เคียงกับ NNT ของการฉีดวัคซีน human papilloma เพื่อป้องกันมะเร็งปากมดลูก (24)
ความปลอดภัย
การศึกษาเกี่ยวกับภาวะแทรกซ้อนระหว่างการผ่าตัดและหลังผ่าตัดของการทำ opportunistic salpingectomy พบว่า การทำ opportunistic salpingectomy ร่วมกับการผ่าตัดมดลูก เพิ่มระยะเวลาการผ่าตัด 16 นาที และการทำ opportunistic salpingectomy แทนการทำหมันเพิ่มระยะเวลาการผ่าตัด 10 นาที แต่ไม่พบว่าการทำ opportunistic salpingectomy ในแง่ของการเพิ่มระยะเวลาการนอนโรงพยาบาล การกลับมานอนโรงพยาบาลซ้ำ (25) และการเติมเลือดซึ่งเป็นเรื่องสำคัญมากสำหรับสูตินรีแพทย์ทุกคน
การศึกษาเปรียบเทียบระหว่างการผ่าตัดแบบเปิดหน้าท้อง (open approach) การผ่าตัดแบบส่องกล้อง (laparoscopic approach) และการผ่าตัดทางช่องคลอด (vaginal approach) พบว่าการผ่าตัดทางช่องคลอดมีระยะเวลานอนโรงพยาบาลสั้นที่สุดและช่วยลดอัตราการกลับมานอนโรงพยาบาลซ้ำ (26) ดังนั้นการผ่าตัดมดลูกร่วมกับการทำ opportunistic salpingectomy ผ่านทางช่องคลอดจึงเป็นช่องทางที่ปลอดภัยและเหมาะสมที่สุด
การทำ opportunistic salpingectomy ยังช่วยลดความเสี่ยงต่อการเกิด hydrosalpinx และ ectopic pregnancy เนื่องจาก hydrosalpinx เป็นภาวะแทรกซ้อนที่พบได้บ่อยหลังจากการผ่าตัดมดลูกโดยไม่ตัดท่อนำไข่ โดยพบมากถึงร้อยละ 35.5 และจะต้องกลับมาผ่าตัดซ้ำถึงร้อยละ 7.8 นอกจากนี้ภาวะแทรกซ้อนอื่น ๆที่ลดลงหลังจากการทำ opportunistic salpingectomy คือลดโอกาสการเกิดภาวะการติดเชื้อในอุ้งเชิงกราน, ท่อนำไข่อักเสบ, เนื้องอกท่อนำไข่ และภาวะท่อนำไข่หย่อน
การทำ opportunistic salpingectomy ที่ถูกต้องจะต้องไม่ทำให้หลอดเลือดที่ไปเลี้ยงรังไข่เสียหายเพราะจะส่งผลต่อการทำงานของรังไข่ในอนาคตได้ ซึ่งในการศึกษาก่อนหน้านี้พบว่าแม้การผ่าตัดมดลูกเพียงอย่างเดียวโดยเก็บรังไข่ไว้มีความสัมพันธ์กับการทำงานของรังไข่ที่ลดลง และทำให้เกิดภาวะหมดประจำเดือนก่อนวัย นอกจากนี้ยังมีการศึกษา retrospective (27) ในสตรีจำนวน 160 คนที่เข้ารับการผ่าตัดผ่านกล้องเพื่อผ่าตัดมดลูกเพียงอย่างเดียว เทียบกับการผ่าตัดมดลูกและท่อนำไข่ทั้งสองข้าง พบว่ามีการเปลี่ยนแปลงของภาพอัลตราซาวน์ของรังไข่และระดับฮอร์โมนเพียงเพียงเล็กน้อยหากเทียบกับก่อนผ่าตัด แต่เทียบระหว่างสองกลุ่มแล้วไม่พบความแตกต่าง โดยพบว่า anti-Mullerian hormone (AMH) หลังการผ่าตัดลดลงเพียงเล็กน้อยในสองกลุ่ม นอกจากนี้มีการศึกษา pilot randomized controlled trial ศึกษาผลกระทบระยะสั้นระหว่างการผ่าตัดผ่านกล้องเพื่อตัดมดลูกและท่อนำไข่เพื่อดูการทำงานของรังไข่พบว่าการศึกษาให้ผลแบบเดียวกัน ดังนั้นการศึกษาเปรียบเทียบการทำงานของรังไข่เปรียบเทียบกันหลังการผ่าตัดมดลูกเพียงอย่างเดียวเทียบกับการผ่าตัดมดลูกร่วมกับการทำ opportunistic salpingectomy ยังคงต้องการการศึกษาเพิ่มเติมในอนาคตถึงการทำงานของังไข่ในระยะยาว
ประเด็นสำคัญที่ต้องนำมาคำนึงถึงก่อนการตัดสินใจทำ opportunistic salpingectomy เสมอคือภาวะการเป็นหมันถาวรและไม่สามารถกลับมาต่อหมันได้อีกเหมือนในรายที่ทำหมันทั่วไป เนื่องจากท่อนำไข่โดยตัดออกไปเกือบทั้งหมด ดังนั้นหากผู้ป่วยมีภาวะจิตใจที่ยังไม่แน่นอนว่าต้องการกลับมามีบุตรอีกหรือไม่จึงยังไม่ควรแนะนำให้ทำ opportunistic salpingectomy แต่ในรายที่ตัดสินใจทำ opportunistic salpingectomy ไปแล้วและตัดสินใจต้องการกลับมาตั้งครรภ์ในภายหลังแนะนำให้ทำการปฏิสนธิในหลอดทดลอง (in vitro fertilization; IVF)
Recommendations ในปัจจุบัน
ปัจจุบันการแนะนำให้ทำ risk-reduction salpingo-oophorectomy (rrBSO) ในสตรีที่มีความเสี่ยงสูงพบว่าช่วยป้องกันและลดความเสี่ยงของมะเร็งรังไข่ได้ถึงร้อยละ 80 ในขณะเดียวกันที่ความเข้าใจในเรื่องเซลล์ต้นกำเนิดของมะเร็งรังไข่ที่มีมากขึ้นว่ามาจากเซลล์ท่อนำไข่ทำให้เกิด recommendation ในการทำ opportunistic salpingectomy เพื่อช่วยลดความเสี่ยงของมะเร็งรังไข่ในสตรีที่มีความเสี่ยงทั่วไปขึ้น โดยเริ่มแนะนำครั้งแรกโดย Ovarian Cancer Research team (OVCARE) เดือนกันยายน พ.ศ. 2553
ในปัจจุบันหลายองค์กรเกี่ยวกับมะเร็งนรีเวชได้เห็นด้วยและได้มี recommendation ในการทำ opportunistic salpingectomy ขึ้นมา คือ The Society of Gynecologic Oncology of Canada, US Society for Gynecologic Oncology และล่าสุดคือ the American College of Obstetricians and Gynecologists ซึ่ง recommendation กล่าวว่า “ศัลยแพทย์และผู้ป่วยควรปรึกษากันเกี่ยวกับประโยชน์ของการตัดท่อนำไข่ออกระหว่างการผ่าตัดมดลูกในสตรีที่มีความเสี่ยงทั่วไปของมะเร็งรังไข่ที่เข้ารับการผ่าตัดทางนรีเวชและไม่ได้จำเป็นจะต้องผ่าตัดรังไข่ออก และในสตรีที่จะเข้ารับการผ่าตัดส่องกล้องเพื่อทำหมันควรได้รับคำแนะนำเกี่ยวกับการผ่าตัดท่อนำไข่ทั้งสองข้างเสมอและถือว่าเป็นการทำหมันที่มีประสิทธิภาพวิธีหนึ่ง” (28)
สรุป
มะเร็งรังไข่ชนิดเยื่อบุผิว (Epithelial ovarian cancer) ถือว่าเป็นเหตุสำคัญของการเสียชีวิตจากมะเร็งในสตรีและในปัจจุบันยังไม่มีการตรวจคัดกรองที่แม่นยำ โดยปัจจุบันได้มีความเข้าใจเกี่ยวกับเซลล์ต้นกำเนิดของมะเร็งรังไข่ชนิดเยื่อบุผิวว่ามาจากเซลล์ของท่อนำไข่ ดังนั้นในสตรีที่เข้ารับการผ่าตัดทางนรีเวชด้วยเหตุอื่น ๆ ควรแนะนำให้มีการตัดท่อนำไข่ออกไปด้วย เรียกว่า opportunistic salpingectomy เพื่อลดความเสี่ยงต่อการเกิดมะเร็งรังไข่ในอนาคตสำหรับสตรีที่มีความเสี่ยงทั่วไปต่อมะเร็งรังไข่
เอกสารอ้างอิง
- Canadian Cancer Society. Canadian cancer statistics 2014. Toronto: 2014
- Attasara P, Srivatanakul P, Sriplung H. Cancer incidence in Thailand. In: Khuhaprema T, Srivatanakul P, Attasara P, Sriplung H, Wiangnon S, Sumitsawan Y, editors. Cancer in Thailand Volume V, 2001-2003. Bangkok 2010. 3-76.
- Mavaddat N, Peock S, Frost D, Ellis S, Platte R, Fineberg E, et al. Cancer risks for BRCA1 and BRCA2 mutation carriers: results from prospective analysis of EMBRACE. J Natl Cancer Inst. 2013;105(11):812–22.
- Surveillance Epidemiology and End Results Program. Ovary Cancer Survival Statistics [cited 2014 August 25]. Available from: http://seer.cancer.gov/ statfacts/html/ovary.html.
- Rosenthal AN, Fraser L, Manchanda R, Badman P, Philpott S, Mozersky J, et al. Results of annual screening in phase I of the United Kingdom familial ovarian cancer screening study highlight the need for strict adherence to screening schedule. J Clin Oncol. 2013;31(1):49–57.
- Kindelberger DW, Lee Y, Miron A, Hirsch MS, Feltmate C, Medeiros F, et al. Intraepithelial carcinoma of the fimbria and pelvic serous carcinoma: Evidence for a causal relationship. Am J Surg Pathol. 2007;31(2):161–9.
- Kobel M, Kalloger SE, Boyd N, McKinney S, Mehl E, Palmer C, et al. Ovarian carcinoma subtypes are different diseases: implications for biomarker studies. PLoS Med. 2008;5(12):e232.
- Gilks CB. Molecular abnormalities in ovarian cancer subtypes other than high-grade serous carcinoma. J Oncol. 2010;2010:740968.
- Kobel M, Kalloger SE, Huntsman DG, Santos JL, Swenerton KD, Seidman JD, et al. Differences in tumor type in low-stage versus high-stage ovarian carcinomas. Int J Gynecol Pathol. 2010;29(3):203–11.
- Olivier RI, Lubsen-Brandsma MA, Verhoef S, van Beurden M. CA125 and transvaginal ultrasound monitoring in high-risk women cannot prevent the diagnosis of advanced ovarian cancer. Gynecol Oncol 2006; 100:20
- Fathalla MF. Incessant ovulation–a factor in ovarian neoplasia? Lancet. 1971;2(7716):163.
- Doran A. An unreported case of primary cancer in the fallopian tubes in 1847, with notes on primary tubal cancers. Trans Obstet Soc Lond. 1896;38:322–6.
- Lamb JD, Garcia RL, Goff BA, Paley PJ, Swisher EM. Predictors of occult neoplasia in women undergoing risk-reducing salpingo-oophorectomy. Am J Obstet Gynecol. 2006;194(6):1702–9.
- Powell CB, Chen LM, McLennan J, Crawford B, Zaloudek C, Rabban JT, et al. Risk-reducing salpingo-oophorectomy (RRSO) in BRCA mutation carriers: experience with a consecutive series of 111 patients using a standardized surgical-pathological protocol. Int J Gynecol Cancer. 2011;21(5):846–51.
- Carlson JW, Miron A, Jarboe EA, Parast MM, Hirsch MS, Lee Y, et al. Serous tubal intraepithelial carcinoma: its potential role in primary peritoneal serous carcinoma and serous cancer prevention. J Clin Oncol. 2008;26(25):4160–5.
- Tang S, Onuma K, Deb P, Wang E, Lytwyn A, Sur M, et al. Frequency of serous tubal intraepithelial carcinoma in various gynecologic malignancies: a study of 300 consecutive cases. Int J Gynecol Pathol. 2012;31(2):103–10.
- Gao FF, Bhargava R, Yang H, Li Z, Zhao C. Clinicopathologic study of serous tubal intraepithelial carcinoma with invasive carcinoma: is serous tubal intraepithelial carcinoma a reliable feature for determining the organ of origin? Hum Pathol. 2013;44(8):1534–43.
- McLaughlin JR, Risch HA, Lubinski J, et al. Reproductive risk factors for ovarian cancer in carriers of BRCA1 or BRCA2 mutations: a case-control study. Lancet Oncol 2007; 8:26.
- Garrett LA, Growdon WB, Goodman A, et al. Endometriosis-associated ovarian malignancy: a retrospective analysis of presentation, treatment, and outcome. J Reprod Med 2013; 58:469.
- Madsen C, Baandrup L, Dehlendorff C, Kjaer SK. Tubal ligation and salpingectomy and the risk of epithelial ovarian cancer and borderline ovarian tumors: a nationwide case–control study. Acta Obstet Gynecol Scand. 2015;94(1):86–94.
- Falconer H, Yin L, Gronberg H, Altman D. Ovarian cancer risk after salpingectomy: a nationwide population-based study. J Natl Cancer Inst. 2015;107(2).
- Herzog TJ, Dinkelspiel HE. Fallopian tube removal: “stic-ing” it to ovarian cancer: what is the utility of prophylactic tubal removal? Curr Oncol. 2013;20(3):148–51.
- Kwon JS, McAlpine JN, Hanley GE, Finlayson S, Cohen T, Miller D, et al. Costs and benefits of opportunistic salpingectomy as an ovarian cancer prevention strategy. Obstet Gynecol. 2014;In Press.
- Brisson M, Van de Velde N, De Wals P, Boily MC. Estimating the number needed to vaccinate to prevent diseases and death related to human papillomavirus infection. CMAJ. 2007;177(5):464–8.
- Reade CJ, Finlayson S, McAlpine J, Tone AA, Fung-Kee-Fung M, Ferguson SE. Risk-reducing salpingectomy in Canada: a survey of obstetrician-gynaecologists. J Obstet Gynaecol Can. 2013;35(7):627–34.
- McAlpine JN, Hanley GE, Woo MM, Tone AA, Rozenberg N, Swenerton KD, et al. Opportunistic salpingectomy: uptake, risks, and complications of a regional initiative for ovarian cancer prevention. Am J Obstet Gynecol. 2014;210(5):471 e1–11.
- Morelli M, Venturella R, Mocciaro R, Di Cello A, Rania E, Lico D, et al. Prophylactic salpingectomy in premenopausal low-risk women for ovarian cancer: primum non nocere. Gynecol Oncol. 2013;129(3):448–51.
- American College of Obstetrics & Gynecology. Committee opinion no. 620: salpingectomy for ovarian cancer prevention. Obstet Gynecol. 2015;125(1):279–81.


