Basic Chemotherapy in Gynecologic Oncology
พญ.สุจิณันฐ์ นันทาภิวัธน์
ผศ.นพ.ฉลอง ชีวเกรียงไกร
Chemotherapy คือการใช้ยาอะไรก็ตามเพื่อการรักษาโรค ส่วนใหญ่มีความเข้าใจว่าใช้ในการรักษาโรคมะเร็ง ทั้งนี้ มีchemotherapy มากกว่า 100 ชนิด โดยใช้เป็นยาชนิดเดียวหรือร่วมกันมากกว่า 2 ชนิด
Cell Cycle (วงจรเซลล์)
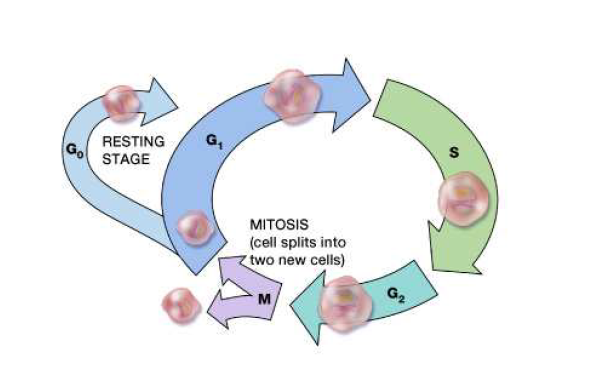
- G0 phase (resting stage): เป็นระยะพัก เซลล์ยังไม่มีการแบ่งตัว เซลล์ใช้เวลาส่วนมากอยู่ในระยะนี้ ซึ่งเซลล์แต่ละชนิดใช้เวลาไม่เท่ากัน อาจใช้ระยะเวลาเพียงไม่กี่ชั่วโมงถึงหลายปีได้ จนกระทั่งเซลล์เหล่านี้ได้รับสัญญาณจึงเข้าสู่ระยะ G1
- G1 phase (post mitotic phase): เซลล์เริ่มมีการสังเคราะห์โปรตีน RNA และเพิ่มขนาดของเซลล์ เพื่อทำให้เซลล์ใหม่มีขนาดเท่าเดิม ใช้เวลาประมาณ 18-30 ชั่วโมง
- S phase (DNA synthetic phase): มีการเพิ่มจำนวน DNA เป็น 2 เท่า ที่มีลักษณะเหมือนกัน เพื่อแบ่งให้เซลล์ 2 เซลล์ที่เกิดใหม่ ใช้เวลาประมาณ 18-20 ชั่วโมง
- G2 phase (post synthetic phase): เป็นช่วงที่ตรวจเช็คความผิดปกติของ DNA เพื่อเตรียมความพร้อมในการแบ่งเป็น 2 เซลล์ ใช้เวลาประมาณ 2-10 ชั่วโมง
- M phase (mitotic phase): เป็นระยะที่เซลล์มีการแบ่งตัว ซึ่งแบ่งตัวออกเป็น 2 เซลล์ ใช้เวลา 30-60 นาที
การเข้าใจหลักการของ cell cycle มีความสำคัญ เพื่อช่วยทำให้เข้าใจการทำงานของ chemotherapy มากขึ้น เนื่องจาก chemotherapy จะทำงานเฉพาะกับเซลล์ที่กำลังอยู่ในช่วงแบ่งตัว (reproducing) ไม่ใช่เซลล์ที่อยู่ในระยะ resting phase (G0) โดยที่การทำงานของยามีหลายแบบ ไม่ว่าจะเป็นบางระยะของ cycle เช่น M หรือ S phase ดังนั้นการเข้าใจการทำงานของยา จะช่วยให้แพทย์สามารถเลือกยามาใช้ร่วมกันได้อย่างเหมาะสม
Chemotherapy ไม่สามารถแยกแยะความแตกต่างของเซลล์ปกติที่กำลังอยู่ในช่วงแบ่งตัว ออกจากเซลล์มะเร็งได้ หมายความว่า ขณะที่ chemotherapy ทำลายเซลล์มะเร็ง เซลล์ปกติจะถูกทำลายไปด้วย ซึ่งทำให้เกิดผลข้างเคียงต่างๆเกิดขึ้น ดังนั้นทุกครั้งที่มีการใช้ chemotherapy ต้องพิจารณาให้สมดุลระหว่างการทำลายเซลล์มะเร็งเพื่อการรักษา และทำร้ายเซลล์ปกติให้น้อยที่สุด เพื่อไม่ทำให้เกิดผลข้างเคียงที่มากเกินไป
สิ่งที่แพทย์ควรรู้ในการพิจารณาเลือกใช้ chemotherapy คือ tumor biology, cellular kinetics, pharmacodynamics, kinetics และ drug resistance
Tumor growth & cell kinetics
รูปแบบการเจริญเติบโตของเซลล์ปกติ
- Static population: เซลล์ที่ไม่การแบ่งตัวแล้ว ยกเว้นขณะที่เป็นตัวอ่อน เช่น กล้ามเนื้อลาย กระดูก กระดูกอ่อน และเส้นประสาท
- Expanding population (slow proliferation): เป็นกลุ่มเซลล์ที่สามารถแบ่งตัวได้ ซึ่งปกติจะยังไม่แบ่งตัว แต่ถ้ามีภาวะเครียด เช่น การบาดเจ็บ จะมีการแบ่งตัวเพื่อซ่อมแซม หลังจากการซ่อมแซมเสร็จสิ้นก็จะหยุดการแบ่งตัว เช่น ปอด ตับ ไต ต่อมไร้ท่อ และเยื่อบุผนังหลอดเลือด
- Renewing cell population (rapid proliferation): กลุ่มเซลล์ที่ยังมีการแบ่งตัวอยู่เสมอ เมื่อมีการตายเกิดขึ้นจะมีการแบ่งตัวขึ้นมาทดแทน เช่น ไขกระดูก เยื่อบุทางเดินอาหาร รังไข่ อัณฑะ และรากผม
จากความรู้เรื่องการแบ่งตัวของเซลล์ chemotherapy จะมีผลยับยั้งการแบ่งตัวของเซลล์ ดังนั้นกลุ่มเซลล์ที่ไม่ค่อยมีการแบ่งตัว จึงมักไม่ค่อยมีอันตราย
การเจริญเติบโตของเซลล์มะเร็ง (Cancer cell growth)
เกิดจากการควบคุมการแบ่งตัวของเซลล์เสียไป ทำให้เกิดการแบ่งตัวของเซลล์เพิ่มขึ้นอย่างต่อเนื่อง ทั้งนี้ความไวในการแบ่งตัวของเซลล์มะเร็งก็ไม่แตกต่างไปจากการแบ่งตัวของเซลล์ปกติ เพียงแค่กลไกการควบคุมความสมดุลเสียไป เกิดการสร้างมากกว่าการทำลาย โดยที่กลไกควบคุมการตายของเซลล์ เรียกว่า apoptosis คือกลไกสำคัญ ซึ่งจากการศึกษา พบว่า oncogene ชื่อ c-myc และ bcl-2 ร่วมกับ anti-oncogene ชื่อ Rb และ p53 มีบทบาทสำคัญต่อกระบวนการ apoptosis อีกทั้งยังมีผลต่อการตอบสนองในการรักษาด้วย chemotherapy เชื่อว่าการที่มียีน bcl-2 และ p53 มาก จะทำให้ดื้อต่อการรักษา
การเจริญเติบโตแบบกอมเพอร์เซียน (Gompertzian growth)
การที่ก้อนมะเร็งที่มีขนาดเล็ก จะมีการเพิ่มจำนวนแบบเลขยกกำลัง (exponential pattern) เมื่อมีขนาดโตมากขึ้น จะมีอัตราการเพิ่มจำนวนช้าลง ซึ่งเรียกว่า gompertzian growth หรือกล่าวได้ว่าการที่ก้อนมะเร็งมีขนาดใหญ่มากขึ้น ระยะเวลาที่ใช้ในการเพิ่มขนาดเป็น 2 เท่าจะนานขึ้น
Doubling time
ระยะเวลาที่ใช้ในการเพิ่มขนาดของมะเร็งเป็น 2 เท่า ซึ่งมะเร็งแต่ละชนิดจะมี doubling time ที่ไม่เหมือนกัน โดยทั่วไปว่า embryonal tumor มี doubling time ที่สั้นกว่า (20-40 วัน) เมื่อเทียบกับ adenocarcinoma หรือ squamous cell carcinoma ที่มีอัตรา doubling time ที่ช้ากว่า (50-150 วัน) ทั้งนี้บริเวณที่มะเร็งมีการแพร่กระจาย (metastasis) จะมี doubling time ที่เร็วกว่ามะเร็งปฐมภูมิ
จลน์ศาสตร์ของเซลล์ (Cell kinetics)
ระยะเวลาของวงจรเซลล์ (cell cycle) เฉลี่ยประมาณ 1 วัน โดยพบว่ามีเพียงส่วนน้อยที่มีการแบ่งตัว โดยขึ้นอยู่กับปัจจัย 2 ประการที่มีผลต่อการแบ่งตัว คือ สัดส่วนการเจริญเติบโต (growth fraction) ซึ่งแต่ละเซลล์มะเร็งมีสัดส่วนที่แตกต่างกันตั้งแต่ 25%-95% และ จำนวนเซลล์ที่ตาย (cell death)
Log kill hypothesis
จากการทดลองในสัตว์ทดลอง พบว่า อัตราการอยู่รอดของสัตว์ที่เป็นมะเร็ง จะเป็นสัดส่วนผกผันกับขนาดของเซลล์มะเร็งขณะให้ยารักษา กล่าวคือ ถ้าให้ยา chemotherapy ตั้งแต่มะเร็งมีขนาดเล็ก จะให้ผลการรักษาที่ดีกว่า อีกทั้ง chemotherapy สามารถทำลายมะเร็งในสัดส่วนที่คงที่ (constant fraction) ไม่ได้ทำลายในจำนวนที่คงที่ (specific number) ดังนั้นจึงต้องให้ยาเป็นระยะๆ เพื่อให้สามารถทำลายเซลล์มะเร็งให้ได้มากที่สุด และระดับของยา chemotherapy ที่ใช้สำหรับรายที่มีจำนวนเซลล์มะเร็งน้อย ก็ไม่มีความจำเป็นที่ต้องลดระดับยา
Types of Chemotherapy drugs
ยา chemotherapy อาจแบ่งเป็น 2 กลุ่มใหญ่ ตามกลไกในการทำลายเซลล์
- cell cycle-nonspecific: สามารถทำลายเซลล์ได้ทุกระยะ มักไม่ขึ้นกับความสามารถในการเพิ่มจำนวนของเซลล์
- cell cycle-specific: สามารถทำลายเซลล์ได้บางระยะของวงจรเซลล์เท่านั้น
|
กลุ่ม
|
ตัวอย่าง
|
|
Cell cycle-specific, proliferative dependent
|
Hydroxyurea, Cytosine arabinoside
|
|
Cell cycle-specific, less proliferative dependent
|
5-fluorouracil, Methotrexate
|
|
Cell-cycle-nonspecific, proliferative dependent
|
Cyclophosphamide, actinomycin D, Cisplatin
|
|
Cell cycle-nonspecific, less proliferative dependent
|
Nitrogen mustard
|
|
ตำแหน่งที่ยาออกฤทธิ์
|
ตัวอย่างยา
|
|
G1
|
Actinomycin D
|
|
Early S
|
Hydroxyurea, Cytosine arabinoside, 5-fluorouracil, Methotrexate
|
|
Late S
|
Doxorubicin
|
|
G2
|
Bleomycin, Etoposide, Teniposide, Carboplatin, Cisplatin, Topotecan
|
|
M
|
Paclitaxel, Vincristine, Vinblastine
|
Alkylating agents ทำลาย DNA โดยตรง ทำให้ไม่สามารถเพิ่มจำนวนได้ ทำงานในทุกระยะของ cell cycle จากการที่ทำลาย DNA ทำให้เกิดผลช้างเคียงระยะยาวได้กับ ไขกระดูก (bone marrow) มีรายงานที่ทำให้เกิด มะเร็งเม็ดเลือดขาว (Acute leukemia) ซึ่งสัมพันธ์กับขนาดยาที่ใช้ในการรักษา (dose dependent) โดยที่ความเสี่ยงในการเกิดเพิ่มขึ้นสูงสุด 5-10 ปีภายหลังการรักษา ยาในกลุ่มนี้มีหลาย class ที่ใช้มากทางมะเร็งนรีเวช เช่น Nitrogen mustards: cyclophosphamide, ifosfamide
ในกลุ่มยา platinum drugs(1) เช่น cisplatin, carboplatin, oxalaplatin บางครั้งถูกจัดรวมอยู่ใน alkylating agents เนื่องจากมีหลักการทำงานที่เหมือนกัน ทั้งนี้ platinum drugs มีความเสี่ยงในการเกิดมะเร็งตามมาในอนาคตต่ำกว่า
Antimetabolites รบกวนการเจริญเติบโตของ DNA และ RNA โดยที่ยาจะเข้าไปทำลายในระยะ S phase ของ cell cycle เช่น 5-Fluorouracil (5-FU), Gemcitibine, Hydroxyurea, Methotrexate
Anti-tumor antibiotics แตกต่างจากยา antibiotics ที่ในการรักษาโรคติดเชื้อ แต่ทำงานโดยการเปลี่ยนแปลง DNA ภายในเซลล์มะเร็งทำให้ลดการเจริญเติบโตและลดการเพิ่มจำนวน
Anthracyclines คือ anti-tumor antibiotics ซึ่งมีผลต่อเอนไซม์ในกระบวนการ DNA replication โดยที่ตัวยาทำงานในทุกระยะของ cell cycle เช่น Daunorubicin, Doxorubicin (Adriamycin) การใช้ยากลุ่มนี้ต้องระวัง เนื่องจากยามีผลในการทำงานของหัวใจถาวร (permanently damage)
Other anti-tumor antibiotics
Actinomycin-D, Bleomycin, Mitomycin-C, Mitoxantrone (topoisomerase II inhibitor)
Topoisomerase inhibitors ยามีผลต่อเอนไซม์ topoisomerases ซึ่งมีบทบาทในการคลายสายเกลียวของ DNA เพื่อให้มีการทำสำเนาในระยะ S phase
Topoisomerase I inhibitors: Topotecan, Irinotecan
Topoisomerase II inhibitors: Etoposide, Teniposide, Mitoxantrone
ทั้งนี้ Topoisomerase II inhibitors เพิ่มโอกาสในการเกิด second cancer คือ acute myelogenous leukemia (AML) ซึ่งสามารถเกิดได้ภายหลังการรักษาไปแล้ว 2-3 ปี
Mitotic inhibitors มีส่วนประกอบจาก plant alkaloids และสารจากธรรมชาติ ทำงานโดยการหยุดการแบ่งตัว (mitosis) ในระยะ M phase ของ cell cycle ร่วมกับการทำลายในทุกระยะจากการที่ยับยั้งการทำงานของเอนไซม์ที่จำเป็นสำหรับการสร้างโปรตีนที่ใช้ในการเพิ่มจำนวนเซลล์ เช่น
-Taxanes: paclitaxel (Taxol), docetaxel (Taxotere)
-Vinca alkaloids: vinblastine, vincristine
-Estramustine
Corticosteroids สามารถใช้รักษามะเร็งได้ รวมไปถึงเป็นส่วนหนึ่งของการรักษามะเร็ง ในการลดอาการคลื่นไส้อาเจียน หรือป้องกันภาวะแพ้อย่างรุนแรง (severe allergic reaction) เช่น prednisolone, methylprednisolone, dexamethasone
Deciding which chemotherapy drug to use(2)
1. Tumor characteristics
- การวินิจฉัย primary malignant ควรทราบชนิดของมะเร็ง และระยะของมะเร็ง
- การวินิจฉัย recurrent disease ควรพยายามให้ได้ชนิดของเซลล์ cytology หรือ histology อย่างไรก็ตาม บางครั้งก็อาจทำได้ยาก เช่น มะเร็งรังไข่ ที่วินิจฉัย recurrent จากการตรวจร่างกาย tumor marker หรือ ภาพถ่ายทางรังสี
- extent of disease
- การตอบสนองของมะเร็ง (ชนิดของมะเร็ง, rate of disease progression, ระยะเวลาที่ห่างจากการรักษาที่เคยได้รับมาก่อนหน้า)
- tumor marker
2. Patient characteristics
- อายุของผู้ป่วย
- สุขภาพโดยรวม (performance status)
- โรคประจำตัว เช่น โรคไต โรคหัวใจ โรคตับ
- การรักษามะเร็งที่เคยได้รับมาก่อน มีการตอบสนองหรือผลข้างเคียงเป็นอย่างไร
3. Goals of treatment
- tumor control to prolong survival
- palliative of symptoms
การตัดสินใจเลือก chemotherapy ในการรักษาขึ้นอยู่กับปัจจัยเหล่านี้ ร่วมกับข้อมูลจากรายงานการวิจัย เพื่อประเมินผลลัพธ์ในการรักษาในผู้ป่วยที่มีลักษณะตัวโรคใกล้เคียงกับที่มีงานวิจัยรายงาน โดยที่ก่อนเริ่มการรักษาจะต้องทราบชนิดของมะเร็งที่เป็น primary แน่นอน ไม่ว่าจะเป็นจาก cytology หรือ histology ยกเว้น gestational trophoblastic disease อีกทั้ง ควรตั้ง goal of treatment ก่อนการเริ่มให้การรักษา ถ้าเป็นการใช้ยา chemotherapy เพื่อหวังผล curative เช่น ovarian germ cell tumor หรือ choriocarcinoma ถึงแม้ว่าจะมีผลข้างเคียงที่ค่อนข้างรุนแรง ก็อาจเพียงพอในการพิจารณาใช้ยาต่อถ้ายังหวังผลในการรักษา ทั้งนี้ถ้าเป็นการรักษาเพื่อ prolong survival ต้องพิจารณาระหว่างประโยชน์ที่จะได้รับจากการรักษาเทียบกับผลข้างเคียงที่ได้รับ ยิ่งถ้าเป็นการรักษาเพื่อ palliative ในการลดจำนวนเซลล์มะเร็งเพื่อบรรเทาอาการ ควรเลือกใช้ chemotherapy ที่มีผลข้างเคียงจากการรักษาน้อยที่สุด ซึ่งผลข้างเคียงจากการใช้ chemotherapy ไม่ควรแย่กว่าตัวโรคของผู้ป่วย
ทั้งนี้การรักษาอาจเลือกใช้ยาตัวเดียว หรือหลายชนิดร่วมกัน ส่วนมากผู้ป่วยโรคมะเร็งมักรักษาโดยใช้ยาหลายชนิด ซึ่งเชื่อว่าเพิ่มประสิทธิภาพในการรักษา เพราะตัวเซลล์มะเร็งถูกทำลายจากหลายวิธี อย่างไรก็ตามเมื่อใช้ยาในการรักษาหลายชนิด แพทย์ต้องพิจารณาถึงผลข้างเคียงและการออกฤทธิ์ของยาแต่ละตัว นอกจากนี้ อาจใช้ยา chemotherapy ร่วมกับ การใช้ radiotherapy หรือ targeted therapy
การออกฤทธิ์ของยา chemotherapy มีหลายรูปแบบดังกล่าวข้างต้น จากธรรมชาติของมะเร็งที่มีความ activeผ่านทาง cell cycle ตลอดเวลา จะมีการตอบสนองต่อการรักษาโดยใช้ยา chemotherapy เป็นอย่างดี (highly chemosensitive) เมื่อเทียบกับเซลล์ที่อยู่ในระยะ resting state (G0) ซึ่งจัดว่า insensitive ต่อ chemotherapy กล่าวได้อีกอย่างว่า การที่ผู้ป่วยวินิจฉัยว่าเป็นมะเร็งที่มีการดำเนินโรคที่ค่อนข้างช้า อาจมีชีวิตต่อได้นาน แต่มะเร็งชนิดนั้นจะตอบสนองต่อ chemotherapy น้อย เนื่องจากเซลล์ส่วนมากอยู่ใน resting phase
Minimum requirement
Administration of chemotherapy
การให้ยา chemotherapy จำเป็นต้องอาศัยผู้ที่มีความเชี่ยวชาญ ทั้งความรู้ในการเลือกยา รวมไปถึงความสามารถในการดูแลผลข้างเคียง และภาวะแทรกซ้อนที่อาจเกิดขึ้นได้ เนื่องจาก chemotherapy มีความสามารถทั้งทางด้าน mutagenic, teratogenic และ carcinogenic นอกจากนั้นยังสามารถเกิดการระคายเคืองโดยตรงต่อบริเวณผิวหนังได้ ดังนั้นในขั้นตอนการเตรียมยา ก็มีความจำเป็นต้องอาศัย onco-pharmacists ที่เชี่ยวชาญ อีกทั้งยังต้องมีการแต่งกายด้วยเครื่องป้องกันที่เหมาะสม ไม่ว่าจะเป็นเสื้อคลุม หน้ากากปิดหน้า ถุงมือ สำหรับสารละลายที่ใช้ในการผสมยา chemotherapy ก็ต้องเลือกสารละลายที่เหมาะสม และแนวทางในการให้ยา (route of administration) ที่เหมาะสม เช่น ทางหลอดเลือดดำแบบฉีด (intravenous push) หรือ การให้ทางหลอดเลือดดำแบบช้าๆ (intravenous drip) อีกทั้งระยะเวลาในการเดินยาก็ต้องเป็นสิ่งที่นำมาพิจารณาด้วย
ปัญหาเรื่อง extravasation ของ therapeutic agent จะให้เกิดการระคายเคือง เช่น anthracyclines จะทำให้เกิดชิ้นเนื้อบริเวณผิวหนังตายอย่างรุนแรง (severe tissue necrosis) ที่อาจจำเป็นต้องใช้การผ่าตัดแก้ไข
การประเมินผลข้างเคียงที่เกิดขึ้น สามารถใช้ employing toxicity scales เช่น จากสถาบัน National Cancer Institute Common Terminology Criteria for Adverse Events (NCI CTCAE) (2)หรือการเพิ่ม patient-reported outcome measures (PROM)(3) จะช่วยเพิ่มความแม่นยำ ในการวิเคราะห์ นอกจากนี้ควรให้ความรู้ผู้ป่วยเกี่ยวกับผลข้างเคียงที่อาจเกิดขึ้นได้ ทั้งนี้ American Society of Clinical Oncology (ASCO)/Nursing Society ได้นำเสนอรายละเอียดเกี่ยวกับ Chemotherapy administration safety standard(4)
Minimum laboratory back-up requirement
การประเมินผลเลือดอย่างน้อยที่ต้องการ เพื่อพิจารณาการให้ยา chemotherapy แต่ละครั้ง คือ cbc, minimal liver function test (alkaline phosphatase, alanine transaminase, aspartate transaminase), creatinine
การพิจารณาผลข้างเคียง
ยาแต่ละตัวมีผลข้างเคียงที่แตกต่างกัน โดยผลข้างเคียงที่เกิดขึ้น เกิดจากการที่ตัวยา chemotherapy มีผลต่อเซลล์ปกติที่กำลังมีการแบ่งตัวอยู่ เช่น ไขกระดูก เซลล์เยื่อบุระบบทางเดินอาหารหรือระบบสืบพันธุ์ และเส้นผม ซึ่งยาทุกตัวมีผลต่อเซลล์เหล่านี้เกือบทั้งหมด เพียงแค่มีผลมากหรือน้อย ขึ้นอยู่กับ ระดับยาที่ใช้, แนวทางในการให้ยา และลักษณะของผู้ป่วย ส่วนมากการเลือกใช้ยาคือ ระดับยาปานกลาง ของยา 2 ชนิด เพื่อให้ผู้ป่วยสามารถทนต่อผลข้างเคียงของยาได้ แทนที่จะเลือกใช้ยาในระดับสูง 1 ชนิด ซึ่งอาจส่งผลให้เกิดผลข้างเคียงหรือการทำลายอวัยวะอย่างรุนแรงถาวร อย่างไรก็ตาม มีข้อยกเว้นบางอย่าง ในมะเร็งบางชนิดที่มีการเลือกใช้ chemotherapy เพียงชนิดเดียว
แพทย์มักมีหลักการในการใช้ chemotherapy คือ ใช้ระดับยาที่เพียงพอในการรักษาและควบคุมอาการของโรค โดยที่มีผลข้างเคียงน้อยที่สุด อีกทั้งการหลีกเลี่ยงการใช้ยาหลายตัวที่มีผลข้างเคียงเหมือนกัน
-hypersensitivity reactions
ยาส่วนมากมี mild reactions มักเกิดขณะที่มีการให้ยา เช่น hot flush, rash และ back pain ซึ่งถ้าเป็น allergic reactions ที่แท้จริงจะมีอาการที่รุนแรง ไม่ว่าจะเป็น หายใจลำบาก ความดันโลหิตเปลี่ยนแปลง ซึ่งอาจร้ายแรงถึงแก่ชีวิต ทั้งนี้ยา chemotherapy ที่พบปัญหานี้ได้บ่อย คือ platinum, liposomal doxorubicin, taxanes โดยที่ปัญหามักเกิดขึ้นขณะที่กำลังให้ยากลุ่ม taxanes โดยเฉพาะอย่างยิ่งใน first cycle ซึ่งสามารถแก้ไขได้โดยการหยุดการให้ยา และกลับมาให้ยาอีกครั้งในอัตราที่ช้าลง อย่างไรก็ตามปัญหานี้ยิ่งเกิดมากขึ้นในผู้ป่วยที่ได้รับยากลุ่ม taxanes ในรอบถัดๆมา และยิ่งเคยได้รับมาก่อน อาการยิ่งเพิ่มความรุนแรงมากขึ้น นอกจากนี้การปรึกษาแพทย์ผู้เชี่ยวชาญเรื่องโรคภูมิแพ้ อาจเป็นอีกหนึ่งทางเพื่อช่วยในการรักษา เพื่อ desensitization ยา ก่อนการกลับมาใช้ยาชนิดนี้อีกครั้ง ถ้าอาการแพ้ไม่รุนแรงถึงชีวิต
-bone marrow/ blood cells
ไขกระดูก เป็นตำแหน่งที่ได้รับผลข้างเคียงจาก chemotherapy มากที่สุด เม็ดเลือดขาวต่ำ (neutropenia) มักเกิดขึ้นภายหลังการได้รับยา 7-10 วัน ซึ่งเพิ่มความเสี่ยงในการติดเชื้อมากขึ้น อย่างไรก็ตามการเกิด febrile neutropenia จากการใช้ระดับยา chemotherapy ตามมาตรฐานในการรักษา ถือว่าเกิดขึ้นไม่บ่อย ดังนั้นยังไม่มีคำแนะนำในการให้ prophylactic granulocyte colony-stimulating factor (G-CSFs) แต่ในรายที่ผู้ป่วยต้องเลื่อนการรักษา (delay cycle) เนื่องจากมีปัญหา neutropenia ดังนั้นเพื่อที่จะทำให้เป็นไปตาม goal ต้องมีการรักษา interval ในการให้ยา ควรละระดับยา chemotherapy ที่ใช้ และ/หรือ ร่วมกับการให้ prophylactic G-CSFs(5, 6)
การใช้ erythropoiesis-stimulating agents (ESAs) ในการรักษา chemotherapy-induced anemia ยังเป็นข้อถกเถียงกันอยู่ เนื่องจากเพิ่มการเกิด thromboembolic events ร่วมกับ ทำให้ survival rate ลดลง แต่ยังไม่สามารถอธิบายกลไกที่ทำให้ลด survival rate ได้ชัดเจน ASCO guidelines ได้แนะนำการใช้ ESAs ในกรณีที่ผู้ป่วยได้รับ myelosuppressive chemotherapy ที่มี hemoglobin น้อยกว่า 10 g/dL(7) อย่างไรก็ตามการตัดสินใจควรให้ผู้ป่วยมีส่วนร่วมในการวิเคราะห์ถึงประโยชน์ เช่น ลดอัตราการเติมเลือด และผลเสียที่อาจเกิดขึ้น เช่น การติดเชื้อ หรือ immune-mediated adverse reactions
การลดลงของเกล็ดเลือด (thrombocytopenia) และการกลับมาสู่ระดับปกติ ใช้เวลาที่นานกว่า neutropenia การให้ยา chemotherapy เช่น combination ระหว่าง carboplatin และ paclitaxel ทำให้ส่งเสริมการเกิด thrombocytopenia ทั้งนี้เกล็ดเลือดที่ต่ำ เพิ่มโอกาสเสี่ยงในการเกิดภาวะแทรกซ้อนจากเลือดออก ถ้าระดับเกล็ดเลือดต่ำกว่า 50,000 /mm3 และความเสี่ยงจะเพิ่มสูงขึ้น ถ้าระดับต่ำกว่า 10,000 /mm3 การเติมเกล็ดเลือดอาจช่วยได้เพียงการประคับประคองชั่วคราว ดังนั้นการที่ภาวะนี้เกิดบ่อยๆ อาจจะต้องลดระดับยา chemotherapy ลง หรือ delay treatment
เกล็ดเลือด มีหน้าที่ในการช่วยแข็งตัวของเลือดและหยุดเลือด ทั้งนี้ยา chemotherapy ชะลอไขกระดูกในการผลิตเกล็ดเลือด ดังนั้น การรับประทานยาเช่น aspirin หรือยาชนิดอื่นที่มีผลลดการทำงานของเกล็ดเลือด สำหรับคนทั่วไปที่ร่างกายแข็งแรงอาจไม่ส่งผลกระทบมากนัก แต่สำหรับผู้ป่วยที่ได้รับยา chemotherapy ที่มีเกล็ดเลือดต่ำอยู่แล้ว อาจทำให้เกิดภาวะเลือดออกที่อันตรายได้
-nausea and vomiting
ผู้ป่วยต่างลงความเห็นว่า ผลข้างเคียงที่ส่งผลกระทบมากที่สุด คือ คลื่นไส้และอาเจียน ทั้งนี้ปัจจัยที่ทำให้เกิดอาการเหล่านี้ มีหลายอย่าง ไม่ว่าจะเป็น chemotherapeutic agents, dosage, schedule หรือ route of administration ทั้งนี้ ความเสี่ยงเพิ่มขึ้นในผู้หญิงอายุต่ำกว่า 50 ปี, มีประวัติเคยเมารถ หรือ แพ้ท้องขณะตั้งครรภ์, การอาเจียนหลังได้รับยา chemotherapy หรือ ภาวะวิตกกังวล (anxiety) อย่างไรก็ตาม ภาวะติดสุรา (alcoholism) ลดปัญหาเรื่องการคลื่นไส้อาเจียนได้ ทั้งนี้ภาวะ chemotherapy-induced nausea/vomiting แบ่งได้เป็น 2 ชนิด คือ acute กับ delayed โดยที่ acute-onset เกิดได้ภายในไม่กี่นาทีหลังได้รับยา ไปจนถึงในช่วง 24 ชั่วโมงแรก ส่วน delayed-onset เกิดภายหลัง 24 ชั่วโมงแรก จนถึง 7 วัน ซึ่งพบว่ามีอาการบ่อยสุดในช่วง 48-72 ชั่วโมง
เป้าหมายในการรักษาอาการนี้ คือ ป้องกันไม่ให้เกิดอาการนี้ตั้งแต่แรก โดยการให้ยากลุ่ม antiemetic therapy ควรให้ตั้งแต่ก่อนเริ่มยา chemotherapy ซึ่งการเลือกชนิดยาที่ใช้ขึ้นอยู่กับ emetogenic potential ของยา chemotherapy แต่ละชนิด หรือ ยาแก้อาเจียนที่เคยได้รับมาก่อน รวมไปถึงปัจจัยเสี่ยงของผู้ป่วยแต่ละราย ทั้งนี้ emetogenicity ของ chemotherapy แบ่งออกเป็น 4 ชนิด(8) คือ
- Highly emetogenic agents (>/= 90% risk of acute emesis): แนะนำให้ใช้ 3-drug combination คือ neurokinin 1 (NK1) antagonist, serotonin5-HT3 receptor antagonist และ dexamethasone
- Moderately emetogenic agents (30%-90% risk): แนะนำให้ใช้ 2-drug combination ของ palonosetron และ corticosteroid ทั้งนี้ ถ้า palonosetron ไม่มี สามารถใช้เป็น first generation 5-HT3 antagonist
- Low emetogenic agents (10%-30% risk): แนะนำเป็น single 8 mg dexamethasone ก่อนการให้ยา
- Minimal emetogenic agents (<10% risk): no routine prophylaxis
ในผู้ป่วยที่ใช้ยา chemotherapy หลายชนิดในการรักษา ให้ยึดตามตัวที่มีโอกาสในการเกิดผลข้างเคียงอาการอาเจียนสูงที่สุด มาเป็นหลักพิจารณาในการให้ยาต้านการอาเจียน ทั้งนี้การใช้ยา 5-HT3 antagonists ไม่ว่าจะเป็นในรูปแบบยากิน หรือยาฉีด ต่างให้ประสิทธิภาพที่เท่ากัน ถ้าใช้ในระดับยาที่เหมาะสม สำหรับผู้ป่วยรายที่ไม่สามารถรับประทานยาเม็ดได้ อาจเลือกเป็นชนิดแผ่นแปะเพื่อบรรเทาอาการ ส่วนผู้ป่วยที่มีอาการ anticipatory emesis คือมีอาการคลื่นไส้อาเจียนตั้งแต่ก่อนรับยา chemotherapy พบได้ 18%-57% ซึ่งมีอาการคลื่นไส้เด่นกว่าอาการอาเจียน มีวิธีในการแก้ไข ด้วยการปรับพฤติกรรม
การฝังเข็ม พบว่าอาจได้ประโยชน์ โดยเฉพาะอย่างยิ่งในกรณีที่ไม่สามารถหายาแก้อาการอาเจียนได้(9) นอกจากนี้การปรับพฤติกรรมการรับประทานอาหาร ให้รับประทานทีละน้อย แต่ทานหลายๆครั้ง อาจสามารถช่วยบรรเทาอาการได้ ทั้งนี้ต้องเฝ้าระวังการเกิดอาการที่ร้ายแรง เช่น bowel obstruction, dyspepsia, brain metastasis, electrolyte imbalance และ uremia
ผู้ป่วยที่รับการรักษาด้วย chemotherapy ส่วนมากมีปัญหาเรื่องน้ำหนักตัวลด จากการที่ความอยากอาหารลดลง ท้องเสีย ท้องผูก ดังนั้นก่อนการเริ่มยา chemotherapy ในแต่ละรอบ ควรชั่งน้ำหนักทุกครั้ง เนื่องจากการที่น้ำหนักลดลงมากกว่า 10% หมายความว่า ต้องหาสาเหตุอื่นที่อาจทำให้น้ำหนักลดลง รวมไปถึงอาจต้องปรึกษานักโภชนากรเพื่อช่วยวางแผนเรื่องโภชนากรที่เหมาะสม
-alopecia
ผู้ป่วยส่วนมากมักกังวลกับปัญหาเกี่ยวกับผมร่วงมากที่สุด โดยที่ chemotherapy ส่วนมากมักไม่ทำให้ผมร่วงทั้งหมด (complete hair loss) แต่ทำให้ผมมีลักษณะบาง อ่อนแอ และแตกหักง่าย ซึ่งผมร่วงมักเกิดหลังจากการได้รับยาครั้งแรก ประมาณ 2-3 สัปดาห์ แต่สำหรับยากลุ่ม taxane ซึ่งมักทำให้เกิด complete alopecia มักเกิดปัญหาเรื่องผมร่วงได้เร็วมากกว่ายาชนิดอื่น อย่างไรก็ตามเส้นผมจะกลับมางอกจนเป็นปกติ ใช้เวลา 3-6 เดือน ทั้งนี้ลักษณะเส้นผมที่งอกใหม่อาจมีสีหรือรูปร่างที่เปลี่ยนไปจากเดิม ดังนั้นการให้คำแนะนำแก่ผู้ป่วยเรื่องการเตรียมพร้อม ไม่ว่าจะเป็นการเตรียมผมปลอม การเตรียมคิ้ว หรือหมวก จะช่วยบรรเทาอาการความวิตกกังวลของผู้ป่วยได้ มีบางรายงานกล่าวถึงการทำ scalp cooling(10) จะช่วยลดปัญหาเรื่องผมร่วงได้ อย่างไรก็ตาม ถ้าในรายที่ผู้ป่วยมีความเสี่ยงสูงที่จะมีเซลล์มะเร็งในเส้นเลือดที่มาเลี้ยงบริเวณหนังศีรษะ เช่น hematologic malignancy ก็อาจไม่ควรใช้การรักษาด้วยการทำ scalp cooling
-peripheral neuropathy
ยา chemotherapy-induced peripheral neuropathy เป็น major dose limiting ที่สามารถพบได้จากการใช้ยา platinum และ taxane พบได้ประมาณ 30%-40% ซึ่งพบได้ในทุกช่วงของการรักษา อาการที่พบคือ pain, numbness/tingling, sensory loss และ functional impairment โดยที่อาการเหล่านี้สามารถกลับมาเป็นปกติได้เพียงบางส่วน (partially reversible) แต่อาการผิดปกติทางระบบประสาทจะเป็นถาวร (neuronal permanent damage) ความเสี่ยงเพิ่มขึ้นจากการใช้ระดับยาที่สูงติดต่อกัน (cumulative dose) หรือการใช้ร่วมกันกับยาที่สามารถทำลายระบบประสาทได้ ความเสี่ยงจะเพิ่มมากขึ้นในรายที่มี pre-existing neuropathy เช่น ดื่มสุรา, เบาหวาน, ขาดวิตามิน B12 และ ภาวะไทรอยด์ต่ำ ซึ่งในปัจจุบันยังไม่มียาที่สามารถป้องกันอาการเหล่านี้ได้(11) ทางที่ดีที่สุดในขณะนี้ คือ การเฝ้าระวัง และ early detection ก่อนที่อาการจะรุนแรงจนมีผลต่อการทำงานของระบบประสาทอย่างรุนแรง ทางเลือกอื่น เช่นการปรับระดับยาที่ใช้ หรือการเปลี่ยนยาจาก paclitaxel มาเป็น docetaxel หรือการหยุดใช้ยา taxanes ในการรักษาโดยการใช้ platinum-taxanes combination ทั้งนี้ผู้ป่วยควรเปลี่ยนลักษณะของรองเท้าที่ใช้ เนื่องจากมี neurosensitivity ที่ลดลง
-sexual dysfunction, reproduction and pregnancy
ความรู้สึกทางเพศที่ลดลงเกิดได้จากหลายปัจจัย ไม่ว่าจะเป็น dyspareunia และ vaginal dryness หรือผลลัพธ์จากการผ่าตัด รังสีรักษา หรือเคมีบำบัดที่เคยได้รับมาก่อน รวมไปถึงเพิ่มโอกาสเสี่ยงมากขึ้นจากการติดเชื้อ เช่น เชื้อรา เริม การบรรเทาอาการสามารถใช้สารหล่อลื่น ฮอร์โมนทดแทน เครื่องถ่างขยายช่องคลอด และการปรึกษาเกี่ยวกับเรื่องเพศ อีกทั้งการเน้นย้ำว่าการรักษาด้วย chemotherapy สามารถมีเพศสัมพันธ์ระหว่างการรักษาได้ การใช้ chemotherapy อาจทำให้เกิด ovarian insufficiency อย่างถาวร และ infertility โดยความเสี่ยงเพิ่มสูงขึ้นจากอายุ 30 ปี และพบมากในรายที่มากกว่า 40 ปี ยิ่งในรายที่รักษาด้วยการใช้ alkylating agents สำหรับผู้ป่วยที่อายุต่ำกว่า 30 ปี ที่ได้รับ platinum-based chemotherapy มักมีปัญหาเรื่องประจำเดือนหายไปชั่วคราว แต่ว่ารังไข่ยังสามารถกลับมาทำงานได้อย่างปกติ ดังนั้นจึงมีความจำเป็นที่ผู้ป่วยควรได้รับการคุมกำเนิด ในระหว่างการรักษา ไปจนถึง 1 ปีแรกหลังการรักษาเสร็จสิ้น ถ้าผู้ป่วยยังไม่เคยมีบุตร และมีความเสี่ยงที่อาจจะเกิดภาวะ infertility ได้ภายหลังจากการรักษา อาจต้องมีการร่วมกันตัดสินใจเรื่องของการทำ germ cell preservation ซึ่งต้องไม่ทำให้เกิดการล้าช้าในการเริ่มต้นการรักษา
ทั้งนี้ chemotherapy มีผลในการเป็น mutagenic, teratogenic และ carcinogenic ต่อตัวอ่อน (embryo) ซึ่งขึ้นกับอายุครรภ์ และระดับยาที่ได้รับด้วย มะเร็งทางนรีเวชที่วินิจฉัยขณะที่ผู้ป่วยกำลังตั้งครรภ์ ต้องอาศัยแพทย์สหสาขาวิชาชีพในการร่วมวางแผนในการรักษา เนื่องจากต้องคำนึงถึงโอกาสรอดชีวิต และพยากรณ์โรคของมารดา ร่วมกับความเสี่ยงของเด็กที่อาจได้รับผลกระทบจากการใช้ยา chemotherapy ทั้งนี้ช่วงอายุครรภ์ในไตรมาสแรกถือว่าเป็นช่วงที่ไม่เหมาะสมในการรักษาด้วย chemotherapy แต่การเลือกยาที่เหมาะสมบางชนิดก็สามารถนำมาใช้ในการรักษาช่วงไตรมาสที่ 2 และ 3 ของการตั้งครรภ์ได้ โดยที่ไม่ทำให้เด็กมีความเสี่ยงที่เพิ่มขึ้น(12, 13) อย่างไรก็ตาม 3 สัปดาห์ หลังการรักษา chemotherapy ครั้งสุดท้าย ไม่ควรเป็นช่วงเวลาของการคลอด ถ้าสามารถทำได้ควรเลื่อนกำหนดคลอดออกไป ซึ่งสามารถคลอดได้ตั้งแต่อายุครรภ์มากกว่า 37 สัปดาห์ขึ้นไป ส่วนระหว่างการให้ chemotherapy ควรงดการให้นมบุตรก่อน
การหลีกเลี่ยงการออกฤทธิ์ของยาที่ต้านกัน
การพิจารณาเลือกใช้ chemotherapy มากกว่า 2 ชนิดขึ้นไปในการรักษา ต้องคำนึงถึงการออกฤทธิ์ของยาแต่ละตัวว่ามีผลต่อกันอย่างไร รวมไปถึงยาประจำตัวที่ผู้ป่วยใช้อยู่ด้วย รวมไปถึงวิตามิน และยาที่นอกเหนือจากที่แพทย์สั่ง ที่ผู้ป่วยซื้อมารับประทานเอง
เอกสารอ้างอิง
- Armstrong DK, Bundy B, Wenzel L, Huang HQ, Baergen R, Lele S, et al. Intraperitoneal cisplatin and paclitaxel in ovarian cancer. New England Journal of Medicine. 2006;354(1):34-43.
- Lundqvist EÅ. Principles of chemotherapy. International Journal of Gynecology & Obstetrics. 2012;119:S151-S4.
- Basch E, Bennett A, Pietanza MC. Use of patient-reported outcomes to improve the predictive accuracy of clinician-reported adverse events. Journal of the National Cancer Institute. 2011;103(24):1808-10.
- Jacobson JO, Polovich M, McNiff KK, LeFebvre KB, Cummings C, Galioto M, et al. American society of clinical oncology/oncology nursing society chemotherapy administration safety standards. Journal of Clinical Oncology. 2009;27(32):5469-75.
- Aapro MS, Cameron DA, Pettengell R, Bohlius J, Crawford J, Ellis M, et al. EORTC guidelines for the use of granulocyte-colony stimulating factor to reduce the incidence of chemotherapy-induced febrile neutropenia in adult patients with lymphomas and solid tumours. European journal of cancer. 2006;42(15):2433-53.
- Smith TJ, Khatcheressian J, Lyman GH, Ozer H, Armitage JO, Balducci L, et al. 2006 update of recommendations for the use of white blood cell growth factors: an evidence-based clinical practice guideline. Journal of Clinical Oncology. 2006;24(19):3187-205.
- Rizzo JD, Brouwers M, Hurley P, Seidenfeld J, Arcasoy MO, Spivak JL, et al. American Society of Clinical Oncology/American Society of Hematology clinical practice guideline update on the use of epoetin and darbepoetin in adult patients with cancer. Journal of Clinical Oncology. 2010;28(33):4996-5010.
- Burstein HJ, Prestrud AA, Seidenfeld J, Anderson H, Buchholz TA, Davidson NE, et al. American Society of Clinical Oncology clinical practice guideline: Update on adjuvant endocrine therapy for women with hormone receptor–positive breast cancer. Journal of Clinical Oncology. 2010:JCO. 2009.26. 3756.
- Ezzo J, Richardson MA, Vickers A, Allen C, Dibble S, Issell BF, et al. Acupuncture-point stimulation for chemotherapy-induced nausea or vomiting. Cochrane Database Syst Rev. 2006;2.
- Grevelman E, Breed W. Prevention of chemotherapy-induced hair loss by scalp cooling. Annals of Oncology. 2005;16(3):352-8.
- Pachman D, Barton D, Watson J, Loprinzi C. Chemotherapy‐Induced Peripheral Neuropathy: Prevention and Treatment. Clinical Pharmacology & Therapeutics. 2011;90(3):377-87.
- Amant F, Van Calsteren K, Halaska MJ, Beijnen J, Lagae L, Hanssens M, et al. Gynecologic cancers in pregnancy: guidelines of an international consensus meeting. Rare and Uncommon Gynecological Cancers: Springer; 2011. p. 209-27.
- Pentheroudakis G, Orecchia R, Hoekstra H, Pavlidis N, Group EGW. Cancer, fertility and pregnancy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. 2010;21(suppl 5):v266-v73.


