Management of Gonadotropin-dependent precocious puberty (GDPP)
พญ.อลิน เพชโรภาส
อาจารย์ที่ปรึกษา อ.พญ. อุบล แสงอนันต์
Precocious puberty หรือ ภาวะเข้าสู่วัยหนุ่มสาวก่อนวัยอันควร หมายความถึงภาวะเด็กผู้หญิงที่มีพัฒนาการทางเพศขั้นที่สองก่อนอายุ 8 ปี หรือก่อนอายุ 9 ปีในเด็กผู้ชาย (โดยเทียบจากเกณฑ์อายุเฉลี่ย -2.5 ถึง -3 SD ของอายุที่เข้าสู่วัยหนุ่มสาว) [1] โดยทั่วไปอายุเฉลี่ยของเด็กผู้หญิงปกติที่ถือว่าเข้าสู่วัยสาวคือที่ประมาณ 10 ปี [2]โดยเด็กผู้หญิงที่มีพัฒนาการทางเพศเป็นแบบผู้หญิงเรียกว่า isosexual feminization แต่หากมีการพัฒนาค่อนไปทางเพศชายเรียกว่า contrasexualvirilizationหรือ heterosexual precocity[3]
ในบางรายอาจจะมีประวัติคนครอบครัวเป็นแบบเดียวกันนี้ แต่ส่วนใหญ่จะไม่มีประวัติครอบครัวและไม่มีประวัติโรคทางกายอื่นๆที่ก่อให้เกิดภาวะนี้ โดยภาวะเข้าสู่หนุ่มสาวก่อนวัยอันควรนี้สามารถแบ่งได้เป็น 3 ชนิด[2]ได้แก่
1. Gonadotropin-dependent precocious puberty (GDPP)
หรือ central precocious puberty หรือ true precocious puberty เป็นความผิดปกติที่เกิดจาก hypothalamus-pituitary-gonadal axis เริ่มทำงานเร็วกว่าปกติ โดยจะเริ่มมีพัฒนาการเข้าสู่วัยหนุ่มสาวที่อายุน้อยดังที่กล่าวไปในนิยามข้างต้น แต่การพัฒนาของหนุ่มสาวจะเรียงลำดับตามปกติ คือในเด็กผู้หญิงจะมีการพัฒนาของ เต้านม ขนบริเวณหัวเหน่า ความสูง และการมีประจำเดือน ตามลำดับ ซึ่งการพัฒนาเข้าสู่วัยหนุ่มสาวในกลุ่มนี้จะพัฒนาแบบ isosexualพบว่า GDPP จะพบในเด็กผู้หญิงมากกว่าเด็กผู้ชายถึง 20 เท่า [4]
2. Gonadotropin-independent precocious puberty (GIDP)
หรือ peripheral precocious puberty หรือ pseudo-precocious puberty เกิดจากภาวะที่มีการหลั่งฮอร์โมนเพศมากเกินไป (ทั้ง estrogen และ androgen) โดยฮอร์โมนเพศที่มากเกินไปนี้อาจได้มาจากต่อมหมวกไต อวัยวะสืบพันธุ์ หรือมาจากแหล่งอื่นภายนอกร่างกาย รวมถึงเนื้องอกอื่นที่สามารถผลิตฮอร์โมนเพศได้ เช่นกลุ่ม germ cell tumor เป็นต้น ซึ่งการพัฒนาเข้าสู่วัยหนุ่มสาวในกลุ่มนี้อาจจะพัฒนาเป็นแบบ isosexualหรือ contrasexualก็ได้ ในกลุ่มนี้หากมีพัฒนาการทางเพศและอายุกระดูกมาถึงระดับหนึ่งจากการกระตุ้นของฮอร์โมนเพศอย่างต่อเนื่อง จะสามารถกระตุ้นให้เกิด secondary GDPP ตามมาได้ด้วยดังนั้นจึงต้องมีการตรวจติดตามอย่างใกล้ชิด[5]
3. Incomplete precocious puberty
หมายถึงภาวะเข้าสู่วัยหนุ่มสาวก่อนวัยอันควรซึ่งพบเพียงการพัฒนาทางเพศขั้นที่สองอย่างใดอย่างหนึ่ง เช่น พบการพัฒนาของเต้านมเพียงอย่างเดียวในเด็กผู้หญิง (Premature thelarche) หรือมีการพัฒนาเฉพาะส่วนที่เกี่ยวข้องกับฮอร์โมน androgen ทั้งในเด็กผู้หญิงและเด็กผู้ชาย (Premature adrenarche) ในกลุ่มนี้ควรได้รับการติดตามอย่างใกล้ชิดเพราะมีโอกาสจะพัฒนาไปเป็น precocious puberty ชนิดใดชนิดหนึ่งได้ในอนาคต
การวินิจฉัยภาวะ precocious puberty (เน้นภาวะวัยหนุ่มสาวก่อนกำหนดเฉพาะในเด็กผู้หญิงเป็นสำคัญ)
หลักในการวินิจฉัยภาวะคือแยกภาวะที่อาจเป็นอันตรายถึงชีวิต เช่นเนื้องอกหรือมะเร็งต่างๆ รวมทั้งความผิดปกติของต่อมหมวกไตออกไปก่อน และต้องวินิจฉัยให้ได้ว่าการเข้าสู่วัยสาวนี้เกิดในอัตราเร็วช้าหรือเร็วหรือคงที่ เพื่อการตัดสินใจในการรักษา ซึ่งต้องอาศัยข้อมูลดังต่อไปนี้
1.การซักประวัติ: เน้นในเรื่องของการเปลี่ยนแปลงลักษณะทางกายภาพที่ชัดเจนเรียงตามลำดับที่เกิดขึ้นทั้งของเด็กเองและคนในครอบครัว นอกจากนี้ต้องให้ความสำคัญเกี่ยวกับประวัติการเจริญเติบโตทั้งนำหนักและส่วนสูง รวมทั้งอาการที่สงสัยว่าจะเกี่ยวข้องกับโรคทางระบบประสาทต่างๆ และการได้รับฮอร์โมนจากภายนอกร่างกายด้วย[2]
2.การตรวจร่างกาย: ตรวจร่างกายทั่วไปและอาการแสดงทางระบบประสาทอย่างละเอียด เน้นในเรื่องของน้ำหนัก ส่วนสูง และคำนวณอัตราการเจริญเติบโตโดยเฉพาะความสูงเป็นเซนติเมตรต่อปี (growth velocity) [6]นอกจากนี้ต้องให้ความสำคัญในการตรวจเต้านมและขนบริเวณอวัยวะเพศตาม Tanner staging ด้วยเสมอดังแสดงในภาพที่ 1 และ 2 ตามลำดับ
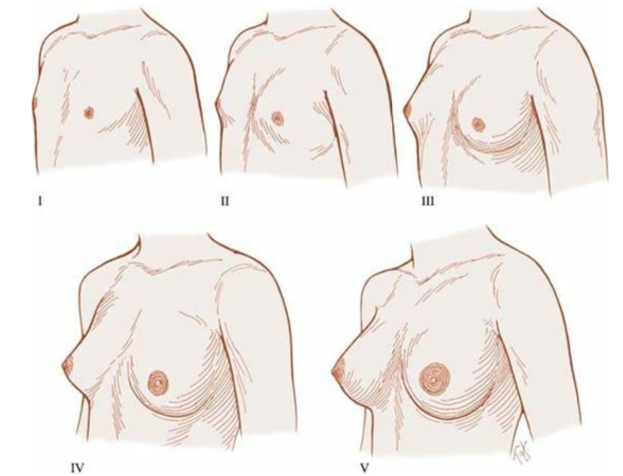
ภาพที่ 1 แสดง Tanner staging ของเต้านม
อ้างอิงจาก Ross GT, Van de Wiele RL, Frantz AG. The ovaries and the breasts. In: Williams RH, ed. Textbook of endocrinology. 6th ed. Philadelphia, PA: WB Saunders, 1981:355
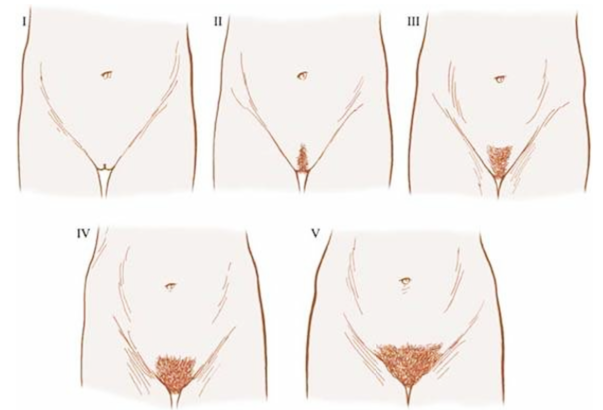
ภาพที่ 2 แสดง Tanner staging ของขนบริเวณหัวเหน่า
อ้างอิงจาก Ross GT, VandeWiele RL, Frantz AG. The ovaries and the breasts. In: Williams RH, ed. Textbook of endocrinology. 6th ed. Philadelphia, PA: WB Saunders, 1981:355
3. การตรวจเพิ่มเติมทางห้องปฏิบัติการ [7]
a. Bone age การวัดอายุกระดูกควรได้รับการตรวจในทุกกรณี โดยอ้างอิงเกณฑ์ของ Greulich and Pyle ในกลุ่มที่มี advanced bone age หรือกลุ่ม normal bone age แต่มีพัฒนาการทางเพศและการเจริญเติบโตอย่างรวดเร็วควรได้รับการตรวจวินิจฉัยแยกโรคเพิ่มเติมโดยเฉพาะการตรวจวัดระดับฮอร์โมนและการตรวจทางรังสีวิทยา[2]
b.การตรวจวัดระดับ thyroid function test เพื่อแยกภาวะพร่องไทรอยด์ฮอร์โมน
c.การตรวจวัดระดับ basal gonadotropins ดังแสดงในภาพที่ 3
กรณีที่พบว่ามีระดับของ Luteinizing hormone (LH) สูง (ซึ่งอาจจะมีการ cross-reactivity กับ human chorionic gonadotropin ได้) ให้สงสัยไปทาง gonadotropin-producing neoplasm ที่พบบ่อยที่สุดคือ pinealoma
กรณีที่วัดระดับของ gonadotropins ได้ในระดับปกติหรือต่ำ ให้พิจารณาว่าการพัฒนาทางเพศเป็นไปในแบบ isosexualหรือ contrasexualโดยพิจารณาดังนี้
พัฒนาการไปทาง isosexualในเด็กผู้หญิง ให้พิจารณาตรวจระดับ estradiol เพิ่มเติม หากพบว่า estradiol มีค่าสูง สาเหตุเกิดจาก estrogen-secreting neoplasm ซึ่งน่าจะมาจากรังไข่ แต่หากพบว่า estradiol อยู่ในค่าปกติ ให้พิจารณาหาสาเหตุจากระบบประสาทต่อไปโดยการทำ brain MRI
พัฒนาการไปทาง contrasexualในเด็กผู้หญิงให้พิจารณาตรวจระดับ androgen (testosterone, 17OHP, DHEAS) หากพบว่า testosterone มีค่าสูงสาเหตุน่าจะมาจาก androgen-producing neoplasm จากรังไข่หรือต่อมหมวกไตซึ่งคงต้องส่งตรวจทางรังสีวิทยาไม่ว่าจะเป็นอัลตราซาวนด์หรือ CT scan ต่อไป แต่หากพบว่า 17OHP หรือ DHEAS มีระดับสูงน่าจะเกิดจากภาวะ congenital adrenal hyperplasia
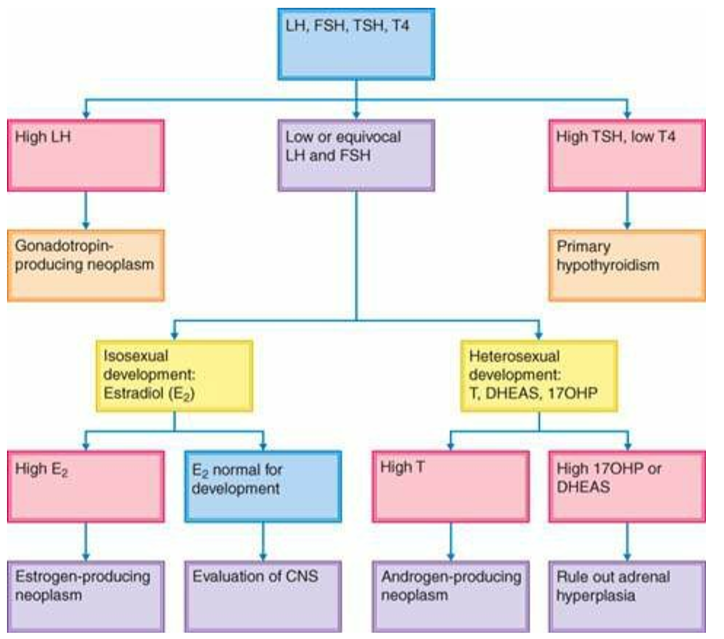
ภาพที่ 3 แสดงการตรวจวัดระดับ basal gonadotropins
อ้างอิงจาก Rebar RW. Normal and abnormal sexual differentiation and pubertal development. In: Moore TR, Reiter RC, Rebar RW, et al., eds. Gynecology and obstetrics: a longitudinal approach. New York, NY: Churchill Livingstone, 1993:97-133
d.การตรวจเพื่อยืนยันภาวะ GDPP ให้ทำ GnRH stimulation test โดยหลังจากได้รับการฉีด 100 microgram GnRHแล้วพบว่า LH ในระดับเลือดหลังได้รับ GnRHนาน 30-40 นามีมีค่ามากกว่า 15 mIU/ml [8]หรืออาจใช้ GnRH agonist ได้แก่ leuprolide acetate (20 microgram/kg) ฉีดเข้าใต้ผิวหนังแล้ววัดระดับ LH ที่ 30-60 นาทีหลังการให้ยา หากพบว่าเพิ่มขึ้นมากกว่า 5-8 IU/L ก็สามารถช่วยยืนยันการวินิจฉัยนี้ได้เช่นกัน[9]
e.แนะนำให้ตรวจอัลตราซาวด์ดูอวัยวะในช่องท้องและในอุ้งเชิงกราน ในเด็กผู้หญิงที่มาด้วยเรื่อง precocious puberty ทุกรายเนื่องจาก GDPP นั้นก็สามารถเป็น secondary GDPP ที่มีสาเหตุมาจาก GIPP ได้เช่นเดียวกันตามที่กล่าวไว้ข้างต้น[2]นอกจากนี้การวัดขนาดมดลูกและความหนาของเยื่อบุโพรงมดลูกสามารถช่วยเป็นข้อมูลประกอบในการวินิจฉัยภาวะ progressive GDPP เพื่อพิจารณาให้การรักษา ดังแสดงในตารางที่ 1[10]
Table 1. Criteria for Differentiating Progressive from Nonprogressive Forms of Precocious Puberty in Girls
{tabulizer:style[gr.alterora.elemental_1_blue.css]}
|
Criterion |
Progressive Central Precocious Puberty |
Nonprogressive Precocious Puberty |
|
Clinical Progression through pubertal stages Growth velocity Bone age
Predicted adult height
|
Progression from one stage to the next in 3–6 mo Accelerated (> about 6 cm per yr) Usually advanced by at least 1 yr Below target height range or declining on serial determinations
|
Stabilization or regression of pubertal signs Usually normal for age Usually within 1 yr of chronologic age Within target height range
|
|
Uterine development Pelvic ultrasound scan |
Uterine volume >2.0 ml or length >34 mm, pearshaped uterus, endometrial thickening (endometrial echo) |
Uterine volume ≤2.0 ml or length ≤34 mm; prepubertal, tubularshaped uterus |
|
Hormone levels Estradiol LH peak after GnRH or GnRH agonist |
Usually measurable estradiol level with advancing pubertal development In the pubertal range |
Estradiol not detectable or close to the detection limit In the prepubertal range |
ตารางที่ 1 แสดงการแยกภาวะ progressive GDPP จาก nonprogressive GDPP อ้างอิงจาก Carel JC, Leger J. Precocious puberty (clinical practice). N Engl J Med. 2008; 358:2366-2377
ในที่นี้จะขอกล่าวเน้นในเรื่องของ GDPP เป็นหลัก โดยสาเหตุของ GDPP ที่พบมีดังนี้
- ไม่ทราบสาเหตุ (Idiopathic) ประมาณ 80-90 เปอร์เซ็นต์ของเด็กผู้หญิงที่มีภาวะ Gonadotropin-dependent precocious puberty นั้นไม่ทราบสาเหตุของภาวะนี้ และมักเป็นการวินิจฉัยที่ได้จากการแยกโรคอื่นๆออกไปก่อน [4][11]
- มีพยาธิสภาพในระบบประสาทส่วนกลาง (CNS lesions) ซึ่งพยาธิสภาพในระบบประสาทส่วนกลางที่เป็นสาเหตุของ GDPP ส่วนใหญ่เกิดจากเนื้องอกสมอง ได้แก่ คือ hamartoma (พบได้บ่อยที่สุด), astrocytoma, ependymoma, pinealomaและ optic/hypothalamic gliomaนอกจากนี้อาจเกิดได้จากการได้รับการกระทบกระเทือน การฉายรังสีบริเวณระบบประสาทหรือภาวะการอักเสบติดเชื้อก็อาจเป็นอีกสาเหตุหนึ่งของภาวะนี้ได้เช่นกัน [11, 12] แนะนำให้ตรวจ magnetic resonance imaging (MRI) แม้ว่าจะไม่มีอาการแสดงทางระบบประสาทก็ตาม[13]
- พันธุกรรม (Genetics) พบว่ามียีนบางตัวที่เกี่ยวข้องกับการเกิดภาวะนี้ เช่น การมิวเตชั่นของยีน Kisspeptin1(KISS1) KISS1 receptor (GPR54) และ MKRN3 (Prader-Willi syndrome)[14]
- เคยได้รับฮอร์โมนเพศในระดับสูงมาก่อน (Previous excess sex steroid exposure) กลุ่มที่เป็น GIPP ก็สามารถทำให้เกิดภาวะนี้ได้เช่นกันดังที่กล่าวไปแล้วข้างต้น
- ภาวะไทรอยด์ต่ำแบบปฐมภูมิ (Primary hypothyroidism) การที่มีไทรอยด์ฮอร์โมนต่ำเป็นเวลานานจะทำให้ negative feedback ต่อ thyroid releasing hormone ลดลง ทำให้ thyroid releasing hormone มีปริมาณเพิ่มขึ้นสามารถไปกระตุ้นต่อมใต้สมองให้มีขนาดโตขึ้นและทำให้ GnRHกระตุ้นต่อมใต้สมองได้มากขึ้น เลยทำให้เกิดภาวะ GDPP ได้เช่นเดียวกัน แต่มักจะมีลักษณะทางกายภาพที่บ่งบอกถึงภาวะพร่องไทรอยด์ฮอร์โมนที่ชัดเจน[15]
การรักษาภาวะ GDPP
หลักในการดูแลรักษาภาวะ GDPP
- ให้การดูแลรักษาด้านจิตใจ ผู้ป่วยที่เข้าสู่วัยหนุ่มสาวก่อนวัยอันควรจะมีสภาพจิตใจแบบเด็กตามอายุจริง ยังไม่มีความสนใจในเพศตรงข้าม แม้ว่าการเปลี่ยนแปลงทางด้านร่างกายจะรุดหน้าไปกว่าอายุจริงมาก ดังนั้นควรมีการทำความเข้าใจและอธิบายรายละเอียดของโรคกับผู้ปกครองให้เข้าใจ ร่วมกับอาจแนะนำให้ผู้ป่วยคบหากับเพื่อนผู้หญิงที่มีอายุมากกว่าเพื่อช่วยให้คำแนะนำในการปรับตัวสู่วัยสาว ผู้ป่วยกลุ่มนี้ในระยะแรกมีแนวโน้มที่จะแยกตัวจากเพื่อนเนื่องจากไม่เหมือนคนอื่น และในระยะต่อมามักมีปัญหาเรื่องมีคู่รักและมีเพศสัมพันธ์เร็ว ควรมีการแนะนำผู้ปกครองและผู้ป่วยให้เตรียมตัวไว้ก่อน[16]
- การรักษาจำเพาะตามสาเหตุที่ตรวจพบ ในภาวะGDPP ที่เกิดจากพยาธิสภาพในสมอง การรักษาจะขึ้นอยู่กับพยาธิสภาพนั้นๆโดยส่วนมากจะเป็นการกำจัดพยาธิสภาพนั้นให้หมดสิ้น ยกเว้นภาวะ hypothalamic hamartomaที่การรักษาจะเป็นการเฝ้าระวังและตรวจติดตามอาการและอาการแสดงทางระบบประสาทเป็นระยะ[17]
แต่จากที่กล่าวไว้ข้างต้นภาวะ GDPP ในเด็กผู้หญิงส่วนใหญ่ไม่ทราบสาเหตุ ดังนั้นยาที่ใช้เป็นอันดับแรกคือ gonadotropin-releasing hormone (GnRH) agonist ซึ่งถือว่าเป็นวิธีการรักษาที่ปลอดภัยและมีประสิทธิภาพมาก ในส่วนนี้จึงจะขอกล่าวละเอียดเกี่ยวกับการรักษาภาวะ GDPP โดยการใช้ gonadotropin-releasing hormone (GnRH) agonist เป็นหลัก
การออกฤทธิ์ของ gonadotropin-releasing hormone (GnRH) agonist
Gonadotropin-releasing hormone (GnRH) เป็นฮอร์โมนที่หลั่งจาก arcuate nucleus ของไฮโพทาลามัสเพื่อมากระตุ้นการหลั่ง gonadotropins คือ FSH และ LH จากต่อมใต้สมองส่วนหน้า โดยการกระตุ้นเพื่อให้ gonadotropins หลั่งนั้น GnRHต้องมากระตุ้นแบบ pulsatile ซึ่งมีการทดลองในสัตว์ทดลองแล้วว่าหากให้ GnRHกระตุ้นแบบต่อเนื่องจะไม่ทำให้เกิดการหลั่งของ gonadotropins และยังทำให้เกิดปรากฏการณ์ Down-regulation คือทำให้ GnRH receptor บนเซลล์ gonadotrophของ pituitary ลดลง
GnRH agonists เป็นสารที่ผลิตขึ้นเพื่อเลียนแบบ GnRHแต่มีการปรับแต่งให้มีประสิทธิภาพในการจับกับ GnRH receptor ได้ดีกว่าและมีการถูกทำให้เสื่อมสภาพช้ากว่า GnRHโดยกลไกการออกฤทธิ์คือเมื่อ GnRH agonists จับกับ GnRH receptor จะมีการกระตุ้น GnRH receptor แบบต่อเนื่อง ทำให้เหมือนมีการหลั่งของ GnRHแบบต่อเนื่องเช่นกัน ผลคือทำให้มีการกดการหลั่งของ gonadotropins และยังทำให้เกิด down-regulation ดังนั้นระดับของ gonadotropins จะถูกกำจัดไปในท้ายที่สุด[18]
การตัดสินใจในการเลือกการรักษา
เป้าหมายหลักของการรักษาภาวะ GDPP คือ สามารถทำให้ผู้ป่วยที่มีภาวะนี้สามารถเจริญเติบโตและมีความสูงเป็นปกติ โดยการตัดสินใจในการเลือกการรักษาด้วย GnRH agonist ขึ้นอยู่กับ อายุที่เริ่มรักษา อัตราความเร็วในการเปลี่ยนแปลงเข้าสู่ภาวะวัยรุ่น อัตราการเพิ่มของความสูง และ ความสูงที่ประมาณไว้เมื่อเข้าสู่วัยผู้ใหญ่ (estimated adult height) ซึ่งคำนวณได้จากอายุกระดูก (bone age) [9]
1.อายุที่เริ่มรักษา (Child’s age)
พบว่าผู้ป่วยที่มีภาวะ GDPP ที่ปรากฏอาการและอาการแสดงขณะที่มีอายุน้อยร่วมกับการมีอัตราการเจริญเติบโตเข้าสู่วัยรุ่นที่เร็วนั้นจะมีการปิดของ epiphyseal plate ของกระดูกที่เร็ว ทำให้ความสูงสุดท้ายแล้วจะต่ำเมื่อเข้าสู่วัยผู้ใหญ่ ดังนั้นผู้ป่วยกลุ่มนี้จึงเป็นกลุ่มที่เหมาะสมกับการได้รับ GnRH agonist [9]
ในทางกลับกันผู้ป่วยที่ปรากฏอาการของโรคนี้ในช่วงอายุที่เข้าใกล้กับช่วงวัยรุ่นหรือมีอัตราการเปลี่ยนแปลงเข้าสู่วัยรุ่นที่ช้าไม่จำเป็นจะต้องได้รับการรักษาด้วย GnRH agonist [19]
สำหรับเด็กผู้หญิงพบว่าหลังจากรักษาด้วย GnRH agonist แล้วความสูงเฉลี่ยเพิ่มขึ้น 9–10 เซนติเมตรหากเริ่มรักษาก่อนอายุ 6 ปี และความสูงเฉลี่ยจะเพิ่มขึ้น 4-7 เซนติเมตรหากเริ่มรักษาในช่วงอายุ 6-8 ปี แต่ทั้งนี้ความสูงเฉลี่ยที่เพิ่มขึ้นนั้นต้องดูตามอายุกระดูกก่อนการเริ่มรักษาด้วย [9]
2.อัตราความเร็วในการเปลี่ยนแปลงเข้าสู่ภาวะวัยรุ่น (Rate of pubertal progression)
อัตราการเปลี่ยนแปลงเข้าสู่วัยรุ่นช้า คือ ไม่พบการเปลี่ยนแปลงของเต้านม ขนบริเวณหัว เหน่า และอวัยวะเพศ เป็นระยะเวลา 6 เดือนหรือมากกกว่านั้น หรือ อาจหมายถึงมีการใช้ระยะเวลาในการเปลี่ยนแปลงจาก tanner stage 2 เป็น stage 3 มากกว่า 18 เดือน ซึ่งพบว่าในกลุ่มที่มีอัตราความเร็วในการเปลี่ยนแปลงเข้าสู่วัยรุ่นช้านี้ไม่มีความจำเป็นที่จะต้องรักษาด้วย GnRH agonist [20]
3.อัตราการเพิ่มของความสูง (Height velocity)
โดยอัตราการเพิ่มขึ้นของความสูงจะถือว่ารวดเร็วเมื่อมีความสูงเพิ่มขึ้นมากกว่า 6 เซนติเมตรต่อ 1 ปี โดยจะนำมาพิจารณาร่วมกับอายุกระดูกเพื่อให้ได้ความสูงที่ประมาณไว้เมื่อเข้าสู่วัยผู้ใหญ่ดังที่กล่าวในข้อถัดไป
4.ความสูงที่ประมาณไว้เมื่อเข้าสู่วัยผู้ใหญ่ (Estimated adult height)
ซึ่งคำนวณได้จากอายุกระดูก (bone age) และอัตราการเพิ่มของความสูง (height velocity) โดยพบว่าถ้าความสูงที่ประมาณไว้มากกว่ากว่า 150 เซนติเมตรในเด็กผู้หญิง และมากกว่า 160 เซนติเมตรในเด็กผู้ชาย ไม่จำเป็นต้องได้รับการรักษา[19]
โดยสรุปหากผู้ป่วยมีอาการปรากฏก่อนอายุ 6 ปี โดยมีพัฒนาการของเต้านมและขนบริเวณหัวเหน่า มีอายุกระดูกมาก และมีอัตราการเพิ่มความสูงที่รวดเร็ว จะเป็นกลุ่มที่ได้ประโยชน์จากการรักษาด้วย GnRH agonist
ผลของ GnRH agonist ต่อความสูง
ประสิทธิภาพของการรักษาด้วย GnRH agonist ต่อความสูงพบว่าความสูงสุดท้ายของเด็กผู้หญิงที่ได้รับการรักษาด้วย GnRH agonist เฉลี่ยอยู่ที่ 159 +/- 7.6 เซนติเมตรซึ่งเป็นความสูงที่มากกว่าความสูงที่คาดประมาณก่อนการรักษา แต่จะน้อยกว่าความสูงเฉลี่ยจากบิดามารดา (midparental height)[21]
ความปลอดภัยในการรักษาด้วย GnRH agonist
พบว่าการรักษาด้วย GnRH agonist ไม่มีผลข้างเคียงในระยะยาวต่อ pituitary-gonadal axis เนื่องจากพบว่าฤทธิ์การกด axis นั้นจะหายไปเมื่อหยุดการรักษา และไม่มีผลต่อระบบสืบพันธุ์เมื่อเข้าสู่วัยหนุ่มสาวอย่างแท้จริง นอกจากนี้พบว่าการเปลี่ยนแปลงเข้สู่วัยหนุ่มสาวจะเป็นไปตามปกติภายใน 1 ปีหลังจากหยุดการรักษาด้วย GnRH agonist และจะมีประจำเดือนหลังจากหยุดการรักษาประมาณ 11.2 เดือนโดยเฉลี่ย
อย่างไรก็ตามพบว่ามวลกระดูกจะลดลงในช่วงที่รักษาด้วย GnRH agonist แต่มวลกระดูกจะกลับมาเป็นปกติหลังจากหยุดการรักษาแล้ว จึงมีการแนะนำให้ทานอาหารี่มีแคลเซียมและวิตามินดีอย่างเพียงพอระหว่างและหลังหยุดการรักษา [22]
สูตรการรักษาและ dose ที่ใช้
ขณะนี้มีการใช้สูตรการรักษาและ dose ของ GnRH agonist ที่ใช้หลากหลายดังแสดงในตารางที่ 2 อาจเป็นสูตรสำหรับการใช้ทุกเดือน หรือทุกสามเดือน โดยการเลือกสูตรการรักษานั้นขึ้นอยู่กับหลายปัจจัยทั้งจากแพทย์และผู้ป่วย รวมถึงการรับรองสูตรการรักษาของประเทศนั้นๆด้วย [9] ซึ่งแต่ละสูตรการรักษาไม่ได้มีการทำวิจัยแบบ randomized trial เพื่อเปรียบเทียบกันโดยตรง
โดยทั่วไปที่มีใช้คือ Leuprolide (Lupron Depot PED) ให้ฉีดเข้ากล้ามเนื้อทุกเดือน โดยเริ่มปริมาณที่ 7.5 มิลลิกรัม 11.25 มิลลิกรัม หรือ 15 มิลลิกรัมขึ้นอยู่กับน้ำหนักของผู้ป่วย (0.3 mg/kg/dose) และหากผู้ป่วยที่อายุน้อยกว่า 8 ปีในเด็กผู้หญิง และน้อยกว่า 9 ปีในเด็กผู้ชาย ปริมาณยาที่ใช้จะเพิ่มขึ้นกว่าผู้ป่วยที่อายุมาก แต่หากผู้ป่วยและครอบครัวไม่สะดวกในการมารับการรักษาทุกเดือนสามารถเปลี่ยนสูตรยาเป็นทุก 3 เดือนได้โดยเริ่มปริมาณยาที่ 11.25 มิลลิกรัมและปรับปริมาณยาขึ้นจนสามารถกดการเข้าสู่วัยหนุ่มสาวได้
Table 2. Medications Used for the Treatment of Precocious Puberty
{tabulizer:style[gr.alterora.elemental_1_blue.css]}
|
For treatment of central or gonadotropin-dependent precocious puberty |
||
|
Drugs |
Formulation and Usually Recommended Dose |
Side Effects and Cautions |
|
Depot GnRH agonists Overview |
|
Local side effects include pain, erythema, inflammatory reaction, sterile abscess, implant-site reaction; other side effects include headaches and menopausal-like symptoms (hot flushes, asthenia); decreased bone density during treatment but no long-term impairment documented after treatment is discontinued |
|
Leuprorelin leuprolide (Enantone [Takeda], Lupron Depot [TAP], Lupron Depot-PED [TAP])
|
4-wk and 12-wk preparations (subcutaneous or intramuscular); United States — 0.3 mg/kg of body weight every 4 wk (1-mo depot); Europe — 3.75 mg every 4 wk (4-wk depot) or 11.25 mg every 12 wk (12-wk depot) |
|
|
Triptorelin (Decapeptyl [Ipsen, Ferring], Gonapeptyl [Ferring])
|
4-wk and 12-wk preparations (intramuscular); Europe — 3.00–3.75 mg every 4 wk (1-mo depot) or 11.25 mg every 12 wk (3-mo depot) |
|
|
Goserelin (Zoladex [AstraZeneca], 3.6 mg or 10.8 mg)
|
4-wk and 12-wk implants
|
|
|
Histrelin (Supprelin LA [Indevus])
|
12-mo implants United States — 50-mg implant every 12 mo
|
|
|
Rapid-acting GnRH agonists — buserelin, deslorelin, histrelin, leuprorelin, leuprolide, nafarelin, triptorelin
|
Nasal spray or subcutaneous injections 1–3 times daily |
Difficulties with compliance; use usually limited to patients with sterile abscesses from depot injections |
|
For treatment of peripheral or gonadotropin-independent precocious puberty |
||
|
Aromatase inhibitors Testolactone (Teslac [Bristol-Myers Squibb]) |
40 mg/kg of body weight/day orally, 4–6 times daily |
Data from small, uncontrolled trials in McCune– Albright syndrome; also used in association with spironolactone for familial male-limited precocious puberty |
|
Letrozole (Femara [Novartis])
|
2.5 mg orally once daily
|
Menopause-like symptoms; data from small, uncontrolled trial in McCune–Albright syndrome
|
|
Anastrozole (Arimidex [AstraZeneca])
|
1 mg orally once daily
|
Data from case reports
|
|
SERM — Tamoxifen (Nolvadex [AstraZeneca])
|
20 mg orally once daily
|
Data from small, uncontrolled trials in McCune– Albright syndrome
|
|
Androgen-synthesis inhibitor — ketoconazole (Nizoral [Janssen-Cilag])
|
20 mg/kg of body weight/day orally |
Side effects include liver toxicity and adrenal deficiency; data from small, uncontrolled trials in familial male-limited precocious puberty |
ตารางที่ 2 แสดงยาที่ใช้ในการรักษาภาวะ precocious puberty
อ้างอิงจาก Carel JC, Leger J. Precocious puberty (clinical practice). N Engl J Med. 2008; 358:2366-2377
การตรวจติดตามหลังเริ่มการรักษา
หลังจากเริ่มรักษาด้วย GnRH agonist ต้องมีการตรวจติดตามผลของการรักษาเป็นระยะโดยจะตรวจติดตามพัฒนาการการเข้าสู่วัยหนุ่มสาวทุก 3-6 เดือน และตรวจอายุกระดูกทุก 6-12 เดือน เพื่อให้แน่ใจว่าการรักษาได้ผล คือสามารถกด pituitary-gonadal axis ได้และสามารถชะลอระยะเวลาในการเปลี่ยนเข้าสู่วัยหนุ่มสาว รวมถึงชะลอการเปลี่ยนแปลงของอายุกระดูก [9][23]
หากการรักษาได้ผลจะเห็นว่าการเปลี่ยนแปลงของเต้านมจะหยุดลง อัตราเร็วของการเพิ่มขึ้นของความสูง และอายุกระดูกจะลดลง แต่ขนบริเวณหัวเหน่าอาจจะมีการเปลี่ยนแปลงต่อไปได้เรื่อยๆ เนื่องจากผลของฮอร์โมน androgen ที่สร้างจากต่อมหมวกไต
วิธีการที่ใช้ในการตรวจติดตามผลของการรักษาอีกวิธีหนึ่งคือ การเจาะตรวจดูระดับ LH และฮอร์โมนเพศในเลือดโดยจะต้องเจาะเลือดก่อนการได้รับ GnRH agonist ในวันนั้นๆ โดยทั่วไปจะเจาะเลือดดูระดับฮอร์โมนนี้หลังจากการรักษาหรือหลังจากการปรับปริมาณ ของ GnRH agonist ไปแล้ว 1-2 เดือน หากการรักษาด้วย GnRH agonist ในปริมาณนั้นๆได้ผล ระดับ LH และฮอร์โมนเพศจะต้องอยู่ในระดับ prepubertal
หากหลังจากการรักษาไปแล้ว พบว่ายังมีอาการแสดงถึงการเปลี่ยนแปลงเข้าสู่วัยหนุ่มสาวอยู่ ให้ทำการทดสอบดูประสิทธิภาพของการรักษาด้วย GnRH agonist ด้วยวิธีการดังต่อไปนี้
1. GnRH (or GnRH agonist) stimulation test
การทดสอบโดยการใช้ GnRHหรือ GnRH agonist เพื่อกระตุ้นดูระดับการกด pituitary-gonadal axisระหว่างการรักษาด้วย GnRH agonist หากมีการกด axis อย่างสมบูรณ์จะไม่มีการตอบสนองของ LH ออกมาแม้ว่าจะได้รับการกระตุ้น แต่หากการกด axis ยังไม่สมบูรณ์จะพบว่าระดับ LH จะเพิ่มสูงขึ้นภายใจ 2 ชั่วโมงหลังจากถูกกระตุ้น
2. การเจาะระดับ LH หลังจากการฉีด GnRH agonist ที่ใช้รักษา (Therapeutic GnRH agonist dose
เป็นการเจาะดูระดับ LH หลังจากการฉีด GnRH agonist ที่ใช้รักษาอยู่แล้ว ที่ 30 และ 90 นาที หากระดับ LH ที่วัดได้นั้นน้อยกว่า 2.5 mIU/mL หมายความว่าการรักษาด้วย GnRH agonist ปริมาณนั้นเพียงพอแล้วต่อการรักษา แต่หากวัดค่าได้มากกว่านี้ควรเพิ่มปริมาณ GnRH agonist ที่ใช้รักษาให้มากขึ้น[24]
หลังจากที่ได้ปริมาณ GnRH agonist ที่เหมาะสมต่อการรักษาแล้ว เราจะให้การรักษาต่อเนื่องไปจนถึงอายุ 11 ปีในเด็กผู้หญิงและ 12 ปีในเด็กผู้ชาย ทั้งนี้การตัดสินใจในการหยุดการรักษานั้นขึ้นกับอายุของผู้ป่วย อายุกระดูก และส่วนสูงที่คาดคะเนไว้
ภาวะเข้าสู่วัยหนุ่มสาวก่อนวัยอันควร เป็นภาวะการพัฒนาการทางเพศที่ผิดปกติที่สำคัญ และควรได้รับการวินิจฉัยและการรักษาอย่างถูกต้องเหมาะสม จึงจะทำให้การเจริญเติบโตของผู้ป่วยในภาวะนี้เป็นไปตามปกติได้
เอกสารอ้างอิง
- Boepple PA, Crowley WF Jr, Precocious puberty.In: Reproductive Endocrinology, Surgery, and Technology, Adashi EY, Rock JA, Rosenwaks Z (Eds). Lippincott-Raven, Philadelphia 1996: p. 989.
- Fritz MA, Speroff L., Clinical gynecologic endocrinology and infertility (precocious puberty). 8th ed. . Philadelphia. Lippincott Williams & Wilkins, 2011: p. 408-419.
- Speroff L, Glass RH, Kase NG, Clinical gynecologic endocrinology and Infertility (Abnormal puberty and growth problems). 6th ed. Lippincott Williams & Wilkins, 1999: p. 382-419.
- Bridges NA, Christopher JA, Hindmarsh PC, et al., Sexual precocity: sex incidence and aetiology. Arch Dis Child, 1994. 70(2): p. 116-8.
- Meyer-Seifer CH, Seifer DB., Disorders of puberty. In:Cowan BD, Seifer DB, editors. Clinical reproductive medicine. . Philadelphia: Lippincott-Raven, 1997: p. 49-59.
- Papadimitriou A, Beri D, Tsialla A, et al., Early growth acceleration in girls with idiopathic precocious puberty. J Pediatr, 2006. 149(1): p. 43-6.
- Rebar RW, V.Paupeo AA, Berek & Novak’s Gynecology (puberty: precocious puberty). 14th ed. Philadelphia. Lippincott Williams & Wilkins, 2012: p. 1017-1032.
- White PC, Speiser PW, Congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Endorc Rev, 2012;21: p. 245-291.
- Carel JC, Eugster EA, Rogol A, et al., Consensus statement on the use of gonadotropin-releasing hormone analogs in children. Pediatrics, 2009. 123(4): p. e752-62.
- Carel JC, Leger J, Precocious puberty (clinical practice). N Engl J Med, 2008: p. 358:2366-2377
- Chemaitilly W, Trivin C, Adan L, et al., Central precocious puberty: clinical and laboratory features. Clin Endocrinol (Oxf), 2001. 54(3): p. 289-94.
- Chalumeau M, Chemaitilly W, Trivin C, et al., Central precocious puberty in girls: an evidence-based diagnosis tree to predict central nervous system abnormalities. Pediatrics, 2002. 109(1): p. 61-7.
- Ng SM, Kumar Y, Cody D, et al., Cranial MRI scans are indicated in all girls with central precocious puberty. Arch Dis Child, 2003. 88(5): p. 414-8; discussion 414-8.
- Silveira LG, Noel SD, Silveira-Neto AP, et al., Mutations of the KISS1 gene in disorders of puberty. J Clin Endocrinol Metab, 2010. 95(5): p. 2276-80.
- Cabrera SM, DiMeglio LA, Eugster EA, Incidence and characteristics of pseudoprecocious puberty because of severe primary hypothyroidism. J Pediatr, 2013. 162(3): p. 637-9.
- ธีระพร วุฒยวนิช, พัฒนาการทางเพศก่อนวัยอันควร: Precocious puberty.เอนโดรไครน์นรีเวช, 2005: p. 355-371.
- Mahachoklertwattana P, Kaplan SL, Grumbach MM, The luteinizing hormone-releasing hormone-secreting hypothalamic hamartoma is a congenital malformation: natural history. J Clin Endocrinol Metab, 1993. 77(1): p. 118-24.
- David L. Olive, Steven F. Palter, Reproductive physiology. Berek&Novak’s Gynecology, 2007: p. 165-168.
- Bar A, Linder B, Sobel EH, et al., Bayley-Pinneau method of height prediction in girls with central precocious puberty: correlation with adult height. J Pediatr, 1995. 126(6): p. 955-8.
- Lazar L, Pertzelan A, Weintrob N, et al., Sexual precocity in boys: accelerated versus slowly progressive puberty gonadotropin-suppressive therapy and final height. J Clin Endocrinol Metab, 2001. 86(9): p. 4127-32.
- Klein KO, Barnes KM, Jones JV, et al., Increased final height in precocious puberty after long-term treatment with LHRH agonists: the National Institutes of Health experience. J Clin Endocrinol Metab, 2001. 86(10): p. 4711-6.
- Park HK, Lee HS, Ko JH, et al., The effect of gonadotrophin-releasing hormone agonist treatment over 3 years on bone mineral density and body composition in girls with central precocious puberty. Clin Endocrinol (Oxf), 2012. 77(5): p. 743-8.
- Boepple PA, Mansfield MJ,Wierman ME,et al., Use of a potent, long acting agonist of gonadotropin-releasing hormone in the treatment of precocious puberty. Endocr Rev, 1986. 7(1): p. 24-33.
- Demirbilek H, Alikasifoglu A,Gonc NE, et al., Assessment of gonadotrophin suppression in girls treated with GnRH analogue for central precocious puberty; validity of single luteinizing hormone measurement after leuprolide acetate injection. Clin Endocrinol (Oxf), 2012. 76(1): p. 126-30.


