ASHERMAN SYNDROME
นพ.ชาญฤทธิ์ พงศ์พัฒนาวุฒิ
อาจารย์ที่ปรึกษา : รศ.นพ.โอภาส เศรษฐบุตร
ภาวะพังผืดในโพรงมดลูก (Asherman syndrome) ซึ่งเป็นสาเหตุหนึ่งของ 2nd amenorrhea ได้ถูกค้นพบและกล่าวถึงมาตั้งแต่ปลายศตวรรษที่ 19 โดย Heinrich Fritsch ซึ่งได้รายงานการเกิด posttraumatic intrauterine adhesion (IUA) ในปีค.ศ.1927 โดยศึกษาในกลุ่มประชากรที่เคยผ่านการทำแท้งจำนวน 1,000 คน พบว่า 20 คน เกิด cervical obstruction ต่อมาในปีค.ศ.1948 Joseph G. Asherman(1)ได้เผยแพร่ผลการศึกษาที่อธิบายภาวะ IUA หลังจากนั้น Asherman syndrome จึงถูกใช้มาจนถึงปัจจุบัน
Asherman syndrome เป็นภาวะที่ตามมาหลังจากเกิดบาดแผลต่อ endometrium ทำให้เกิดพังผืดในโพรงมดลูกขึ้นรวมถึงใน cervical canal เป็นผลให้เกิดอาการต่างๆตามมา เช่น ความผิดปกติของประจำเดือน, infertility, recurrent pregnancy loss เป็นต้นซึ่ง asherman syndrome จะใช้เรียกในกรณีที่มี IUA ร่วมกับอาการที่กล่าวข้างต้น แต่หากไม่มีอาการจะเรียกว่า asymptomatic IUA(2)
แม้ว่าช่วงแรก asherman syndrome จะหมายถึง IUA ที่เกิดหลังจากการทำ dilatation & curettage(D&C)แต่ปัจจุบันพบว่ายังมีสาเหตุอื่นๆที่ทำให้เกิด IUA ดังนั้นปัจจุบัน asherman syndrome จึงไม่ได้หมายถึงเฉพาะกรณีที่เกิด IUA ตามหลังการทำ D&C เท่านั้นนอกจากนี้ปัจจุบันมีการทำ endometrial ablation เพื่อรักษา dysfunctional uterine bleeding เพิ่มขึ้น เพื่อต้องการให้เกิด IUA ตามมาหลังการรักษาจะมีอาการและ hysteroscopic finding เหมือน asherman syndrome แต่ไม่ต้องการการรักษาเพิ่มเติม
EPIDEMIOLOGY
อัตราการเกิด IUA ที่แท้จริงยังไม่ทราบแน่ชัด เนื่องจากผู้ป่วยส่วนใหญ่ที่ถูกวินิจฉัย IUA ไม่มีอาการ Schenker&Margalioth(3)ได้รายงานการเกิด asherman syndromeในกลุ่มตัวอย่าง 2,981 คน ในหลายๆประเทศ พบว่ามีอัตราการเกิดสูงใน Israel (770 คนจาก 2,981 คน) Greece (456คนจาก 2,981 คน) และ South Africa (445คนจาก 2,981 คน) ความชุกมีความแตกต่างกันขึ้นกับลักษณะภูมิประเทศ, ประชากรที่ศึกษารวมถึงวิธีการที่ใช้วินิจฉัย ซึ่งความแตกต่างที่เกิดขึ้นอธิบายได้จาก ความตระหนักของแพทย์, นโยบายการทำแท้งของแต่ละประเทศ, วิธีการทำแท้ง เช่น sharp – blunt หรือsuctional curettage, อัตราการเกิด genital TB หรือ puerperal infection ที่แตกต่างกัน และเกณฑ์ที่ใช้ในการวินิจฉัย
ในประเทศไทยพบว่า มีข้อมูลเกี่ยวกับสาเหตุและการป้องกันภาวะพังผืดในโพรงมดลูกน้อยมาก ทำให้ไม่ทราบถึงจำนวนผู้ป่วยที่แท้จริง สาเหตุของการเกิดโรคและผลลัพธ์หลังจากให้การรักษา การศึกษาในประเทศไทยของโรงพยาบาลรามาธิบดี(4)เรื่องผลลัพธ์ของการสลายพังผืดในโพรงมดลูกโดยวิธีการส่องกล้องเมื่อ ค.ศ.2000 ก็มิได้แจกแจงถึงสาเหตุของพังผืดในโพรงมดลูก
CLASSIFICATION
การแบ่งกลุ่มของ IUA มีความสำคัญในด้านการประเมินความรุนแรงของการเกิดพังผืด การวางแผนการรักษาและทำนายผลการรักษาในปีค.ศ.1988 American Fertility Society ได้พัฒนาวิธีการแบ่งกลุ่มของ IUA ขึ้น โดยดูความสัมพันธ์จาก ประวัติประจำเดือนร่วมกับการตรวจ hysteroscopicและ hysterosalpingographic(Table 1)(5)ในทางตรงกันข้าม European Society of Hysteroscopy และ European Society of Gynecological Endoscopy ได้เลือกใช้วิธีแบ่งประเภทของ IUA โดยยึดตาม Hysteroscopy Training Center ของ Wamsteker(Table 2)(6)ซึ่งทั้งสองวิธีก็ยังคงซับซ้อนและยากที่จะนำไปใช้ ในปัจจุบันจึงมีการปรับปรุงวิธีการประเมินใหม่โดยดูจาก อาการ, hysteroscopic finding และผลลัพธ์ของการรักษา(7) ซึ่งพบว่าเป็นวิธีที่น่าสนใจเนื่องจากสามารถใช้ทำนาย reproductive outcome ได้
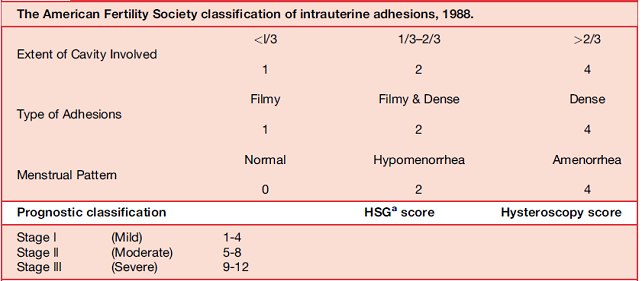
Table 1: The American Fertility Society classification of intrauterine adhesions,1988.(5)

Table 2 : European Society of Gynecological Endoscopy (ESGE) classification of IUAs (1995 version)(6)
ETIOLOGY
Trauma to a Gravid Uterine Cavity
แผลบาดเจ็บต่อโพรงมดลูกขณะตั้งครรภ์นับเป็นสาเหตุหลักของการเกิดพังผืดในโพรงมดลูก ซึ่งแผลดังกล่าวมักเกิดจากการขูดมดลูกจากสาเหตุต่างกัน เช่น รักษาภาวะตกเลือดหลังคลอดจากรกค้าง, ยุติการตั้งครรภ์, ผ่าคลอด เป็นต้น การศึกษาของ Schenker and Margalioth(3)ซึ่งศึกษาในหญิง1856 คน ที่ได้รับการวินิจฉัยว่าเป็นพังผืดในโพรงมดลูก พบว่า 66.7 %เกิดตามหลังการขูดมดลูกหลังแท้ง 21.5 %เกิดตามหลังการขูดมดลูกหลังคลอด 2 %เกิดตามหลังการผ่าคลอด และ 0.6 %เกิดตามหลังการ evacuation ครรภ์ไข่ปลาอุก
สมมติฐานที่เป็นไปได้ที่ใช้อธิบายถึงมดลูกที่ตั้งครรภ์ถึงง่ายต่อการเกิดพังผืดในโพรงมดลูกคือ การเจริญของเยื่อบุโพรงมดลูกขึ้นกับระดับฮอร์โมน estrogen ซึ่งระดับฮอร์โมน estrogen จะต่ำลงหลังการทำหัตถการเพื่อยุติการตั้งครรภ์ อีกสมมติฐานกล่าวว่ามดลูกบาดเจ็บได้ง่ายขึ้นจากการตั้งครรภ์ ทำให้ basal layer ของเยื่อบุโพรงมดลูกเกิดแผลได้ง่ายขึ้น โดยเฉพาะแผลจากการขูดมดลูก(8)
Trauma to Nongravid Endometrium
Schenker and Margalioth(3)รายงานผลการศึกษาในหญิง1856 คน ที่ได้รับการวินิจฉัยว่าเป็นพังผืดในโพรงมดลูกที่แผลบาดเจ็บต่อโพรงมดลูกเกิดขึ้นขณะไม่ได้ตั้งครรภ์ พบว่า เกิดตามหลัง diagnostic curettage 1.6 %, abdominal myomectomy 1.3 %, cervical biopsy หรือ polypectomy 0.5 %, insertion of intrauterine device 3 %นอกจากนี้ยังมีรายงานว่าสามารถเกิดตามหลังการทำ hysteroscopic surgeryหรือ uterine artery embolization ได้
การทำ endometrium ablation มักจะตามมาด้วยการเกิดพังผืดในโพรงมดลูก เนื่องจาก basal layer ของเยื่อบุโพรงมดลูกถูกทำลายทำให้เกิดพังผืดตามมามีรายงานว่าการทำด้วยวิธีthermal balloon ablation สามารถเกิดพังผืดในโพรงมดลูกได้ถึง 36.4%(9)
Infection
Endometrial tuberculosis ถูกรายงานเป็นครั้งแรกในปีค.ศ.1956 ว่าเป็นสาเหตุของ severe intrauterine adhesions พยาธิสภาพที่เกิดขึ้นเป็นผลให้เกิด amenorrhea และ infertility ตามมา(10)
ส่วนภาวะ endometritisยังไม่มีข้อสรุปที่แน่ชัดว่าสามารถทำให้เกิดพังผืดในโพรงมดลูกได้หรือไม่ Polishuk et al.(11)ได้ศึกษาในหญิงที่ผ่าคลอด 171 คน พบว่า 28 คนได้รับการวินิจฉัยเป็น endometritisหลังทำ hysterosalpingographyพบว่าการเกิดพังผืดในโพรงมดลูกไม่แตกต่างกับกลุ่มควบคุม แต่บางการศึกษาสรุปว่า endometritisทำให้เกิดการอักเสบในโพรงมดลูกซึ่งจะเพิ่มความเสี่ยงต่อการเกิดพังผืดในโพรงมดลูกมากกว่ากลุ่มควบคุม
Congenital Anomaly of the Uterus
ปีค.ศ.1985 Stillmanและ Asarkof(12)พบว่ามีความสัมพันธ์กันระหว่างภาวะพังผืดในโพรงมดลูกกับ Mullerian duct malformations โดยเฉพาะ septate uterus ซึ่งเป็นไปได้ว่าความผิดปกติของมดลูกแต่กำเนิดเพิ่มความเสี่ยงของการเกิด recurrent pregnancy loss ตามมาด้วยการยุติการตั้งครรภ์ด้วยการขูดมดลูกหรือ evacuation ตามมา ทำให้ความเสี่ยงต่อการเกิดพังผืดในโพรงมดลูกเพิ่มขึ้น
Genetic Predisposition
นอกจากสาเหตุดังกล่าวข้างต้นแล้ว ความแตกต่างของความรุนแรงของการเกิดพังผืดในโพรงมดลูกยังขึ้นกับความแตกต่างเฉพาะของแต่ละบุคคลซึ่งทำนายได้ยาก(13)
PATHOLOGY
Asherman syndrome เป็นสภาวะที่เยื่อบุโพรงมดลูกกลายเป็นพังผืด ซึ่ง endometrial stromaถูกแทนที่ด้วย fibrous tissue และ endometrial glands ถูกเปลี่ยนเป็น inactive cubo-columnar epithelium ระยะห่างระหว่าง functional layer และ basal layer ของเยื่อบุโพรงมดลูกถูกทำลาย นอกจากนี้ functional layer ถูกแทนที่ด้วย epithelial monolayer ที่ไม่ตอบสนองต่อการกระตุ้นด้วยฮอร์โมนและเกิดการสร้างพังผืดมาเชื่อมกันในผนังโพรงมดลูก
ลักษณะทาง histology ของ asherman syndrome จะพบ fibrosis ส่วนการเปลี่ยนแปลงอื่นที่อาจพบได้แก่ epitheloidหรือ foreign body granuloma, hemosiderin, black-brown carbon และ metallic pigmentหรือ necrotizing granulomatous inflammation ซึ่งพบได้น้อย(14)
SYMPTOMATOLOGY
Menstrual Abnormality
ความผิดปกติของระดูได้แก่ amenorrhea และ hypomenorrheaเป็นอาการที่พบได้บ่อยที่สุด (1339 คนจาก 1973 คน, 68%)(3)สาเหตุเช่น เกิด cervical adhesion ทำให้ปากมดลูกตีบตันทางระบายออกของระดูหรือมีพังผืดที่ชั้น basal layer ของเยื่อบุโพรงมดลูกทำให้ผู้ป่วยมาด้วยอาการขาดระดู ในรายที่มีพังผืดเพียงเล็กน้อยผู้ป่วยอาจมีระดูตามปกติหรือปริมาณระดูที่ลดลง นอกจากนี้ยังพบอาการปวดท้องน้อยที่สัมพันธ์กับรอบระดู, hematometraและ hematosalpinxในผู้ที่มีพังผืดตีบตันทางระบายออกของระดูได้
Infertility
ภาวะมีบุตรยากพบได้ 43% สาเหตุของการมีบุตรยากเกิดจากมีพังผืดไปอุดกั้นบริเวณท่อนำไข่, โพรงมดลูกหรือปากมดลูก พังผืดที่เกิดขึ้นป้องกันอสุจิไปปฏิสนธิกับไข่หรือทำให้เยื่อบุโพรงมดลูกไม่เหมาะสมกับการฝังตัวของตัวอ่อน
Recurrent Pregnancy Loss
ภาวะพังผืดในโพรงมดลูกที่ไม่รุนแรงพบว่ามีความสัมพันธ์กับการแท้งซ้ำ ซึ่งอธิบายการเกิดจากมีการหดตัวเล็กลงของโพรงมดลูกจากพังผืด, เยื่อบุโพรงมดลูกไม่เหมาะสมต่อการฝังตัวและการพัฒนาของรกและการเกิด vascularization ของเยื่อบุโพรงมดลูกมีข้อบกพร่องจากพังผืด(15)
Other Pregnancy Complications
มีรายงานสตรีที่เป็น asherman syndrome สามารถตั้งครรภ์ได้ตามปกติ 45.5% ในกลุ่มสตรีตั้งครรภ์ที่มีภาวะพังผืดในโพรงมดลูกพบว่าเกิด การแท้ง 40% คลอดก่อนกำหนด 23% คลอดครบกำหนด 30% placenta adherens 13% และท้องนอกมดลูก 12%
Endometrial Malignancy
พบการเกิดมะเร็งเยื่อบุโพรงมดลูกตามหลังการวินิจฉัย severe IUA ได้เนื่องจากยังคงมีเยื่อบุโพรงมดลูกที่สามารถทำงานได้ปกติเหลืออยู่ การส่องกล้องตรวจทางโพรงมดลูกจะเห็นลักษณะของเนื้อเยื่อที่มีการเจริญผิดปกติติดกับพังผืด ซึ่งถ้าสงสัยควรตัดชิ้นเนื้อบริเวณดังกล่าวเพื่อส่งตรวจทางพยาธิวิทยาต่อไป
Clinical-Pathological Correlation
อาการแสดงทางคลินิกมีความสัมพันธ์กับตำแหน่งของการเกิดพังผืดในโพรงมดลูก (Figure 1)(2)อาการอุดตันของระดูมักเกิดตามหลังพังผืดที่เกิดในปากมดลูก ทำให้ผู้ป่วยมาด้วยอาการขาดระดูร่วมกับปวดท้องน้อยที่สัมพันธ์กับรอบระดู โพรงมดลูกมักจะปกติ กลุ่มนี้มีพยากรณ์โรคที่ดีภายหลังการรักษา
พังผืดที่เกิดในโพรงมดลูกพบได้บ่อยกว่าและแบ่งย่อยได้อีกตามตำแหน่งของพังผืด พังผืดที่เกิดขึ้นตรงกลางของโพรงมดลูกพยากรณ์โรคหลังการรักษามักจะดี ตรงข้ามกับพังผืดที่เกิดรอบโพรงมดลูกหรือเกิดทั่วโพรงมดลูกผู้ป่วยมักมีอาการขาดระดูและมีบุตรยาก พยากรณ์โรคหลังการรักษาไม่ดีนัก บางกรณีพังผืดอาจเกิดได้ทั้งในโพรงมดลูกและปากมดลูกทำให้อาการแสดงหลากหลาย พยากรณ์โรคยากขึ้นกับขอบเขตและความรุนแรงของการเกิดพังผืด
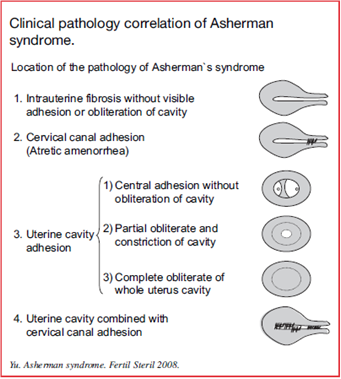
Figure 1: Clinical pathology correlation of Asherman syndrome.(2)
INVESTIGATIONS
Hysteroscopy
การส่องกล้องตรวจภายในโพรงมดลูกเป็นวิธีสืบค้นมาตรฐานสำหรับการวินิจฉัย IUA ใช้ตรวจติดตามภายหลังการรักษา สามารถเห็นขอบเขตตำแหน่งและความรุนแรงของการเกิดพังผืด เยื่อบุโพรงมดลูกปกติที่เหลืออยู่ร่วมกับผ่าตัดเลาะพังผืดไปพร้อมกับการส่องตรวจได้ (Figure 2)(2)วิธีตรวจแบบนี้มีข้อดีคือ เจ็บตัวน้อย, ใช้เวลาไม่นาน, ค่าใช้จ่ายต่ำและสามารถตรวจแบบผู้ป่วยนอกได้
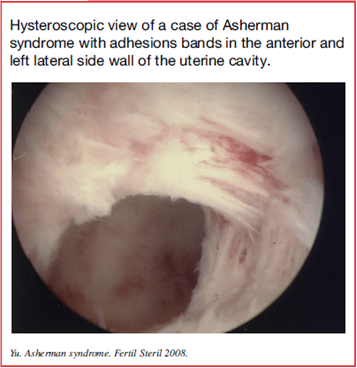
Figure 2 :Hysteroscopic view of a case of Asherman syndrome with adhesions bands in the anterior and left lateral side wall of the uterine cavity(2)
Hysterosalpingography (HSG)
การฉีดสารทึบรังสีในโพรงมดลูกเป็นวิธีที่ใช้ในการวินิจฉัย IUA ก่อนหน้าที่จะมีการใช้ hysteroscopy มีข้อดีคือไม่ต้องใช้ยาสลบ สามารถทำได้ในห้องตรวจทั่วไปที่มีเครื่องเอกซเรย์ ลักษณะความผิดปกติที่พบหลังการฉีดสารทึบรังสีจะพบ filling defect คือสารทึบรังสีไม่สามารถเข้าไปฉาบเยื่อบุโพรงมดลูกเพราะโดนพังผืดขวาง ทำให้เห็นขอบเขตและมุมที่ผิดปกติขึ้น กรณีที่พังผืดอุดตันทั่วโพรงมดลูกหรือปากมดลูกจะไม่เห็นสารทึบรังสีในโพรงมดลูก
HSG มี sensitivity 75-81%, specificity 80%, positive predictive value 50% ในการวินิจฉัย IUA เมื่อเทียบกับ hysteroscopy แต่มี false positive (38%) ที่สูงถือเป็นข้อจำกัดของ HSG(16)
Transvaginal Ultrasound (TVS)
การตรวจด้วยอัลตราซาวด์ทางช่องคลอด เป็นวิธีที่ทำง่าย, ราคาถูกและมีความปลอดภัย จะเห็นลักษณะของพังผืดในโพรงมดลูกเป็น hyperechoic area แต่ถ้าพังผืดกระจายทั่วไปในโพรงมดลูกจะทำให้การแปลผลจากอัลตราซาวด์ทำได้ยากขึ้น การเห็น echolucent area แสดงว่ายังมีบริเวณที่มีเยื่อบุโพรงมดลูกที่ปกติจึงเห็นระดู
การสืบค้นด้วยอัลตราซาวด์ทางช่องคลอดเพียงอย่างเดียวเป็นการประเมินที่ไม่ดีนักเนื่องจาก sensitivity 52%(17)และ specificity 11% ซึ่งค่อนข้างต่ำเมื่อเทียบกับ hysteroscopy แต่มีประโยชน์ในแง่ของการติดตามผลการรักษาโดยการเปรียบเทียบ endometrial thickness ก่อนและหลังการรักษา
Sonohysterography (SHG)
การทำอัลตราซาวด์ทางช่องคลอดร่วมกับการฉีด isotonic saline 20-30 มล.เข้าในโพรงมดลูก อัลตราซาวด์จะเห็น echogenic area ตั้งแต่ 1 ตำแหน่งขึ้นไประหว่างผนังด้านหน้าและด้านหลังของโพรงมดลูกที่ถูกแทนที่ด้วยสารละลาย หรือเห็นมีการขยายตัวของโพรงมดลูกจากการขวางกั้นโดยพังผืด
การวินิจฉัยด้วย SHG มี sensitivity 75%, specificity 43% ประสิทธิภาพเทียบเท่ากับ HSG ในการวินิจฉัย IUA(16)เช่นเดียวกับ HSG ที่มี false positive สูงจึงควรนำมาใช้ในการตรวจคัดกรองมากกว่าการใช้วินิจฉัย
Magnetic Resonance Imaging (MRI)
มีการใช้ MRI ในการวินิจฉัย cervical adhesion รวมถึงประเมิน endometrial remnant แต่มีข้อเสียคือค่าใช้จ่ายในการตรวจสูง, เครื่องมือมีน้อยและไม่ทราบ sensitivity จึงมีการใช้แค่ในงานวิจัยเท่านั้น
TREATMENT
การรักษา asherman syndrome มีวัตถุประสงค์เพื่อ
- ทำให้โพรงมดลูกกลับมามีขนาดและรูปร่างที่ปกติ
- ป้องกันการกลับมาเกิดพังผืดซ้ำหลังการรักษา
- กระตุ้นให้เกิดการซ่อมแซมและมีการสร้างเยื่อบุโพรงมดลูกที่เสียหายขึ้นใหม่
- ทำให้กลับมาตั้งครรภ์ได้
ซึ่งวิธีการรักษามีหลายวิธีดังนี้
Expectant Management
มีรายงานการรักษาโดยการเฝ้าสังเกตในสตรี 23 คน ที่วินิจฉัย asherman syndrome และมีอาการขาดระดูพบว่า 18 คน (78%) กลับมามีประจำเดือนปกติหลังจากติดตามไป 1-7 ปี ในกลุ่มตัวอย่าง 292 พบว่าสามารถกลับมาตั้งครรภ์ได้ 133 คน (45%) เมื่อรักษาโดยการเฝ้าสังเกต(3)
Cervical Probing
เป็นวิธีการรักษาแบบดั้งเดิมสำหรับ cervical stenosis ที่ไม่มีพยาธิสภาพในโพรงมดลูก(1)ซึ่งได้ผลดีในกรณีที่มีพังผืดไม่มาก พบว่าหลังการรักษาสามารถกลับมามีระดูได้ภายใน 1 เดือน แต่ในปัจจุบันวิธีนี้มีการใช้น้อยลงเนื่องจากเสี่ยงต่อการเกิดมดลูกทะลุ จากเทคนิคที่ไม่เห็นตำแหน่งของเครื่องมือและรอยโรคขณะทำหัตถการ
Blind Dilatation and Curettage (D&C)
ก่อนที่จะมีการใช้ hysteroscopy อย่างแพร่หลายในปัจจุบัน การรักษา asherman syndrome ทำโดยวิธี D&C ซึ่งผลสำเร็จของการรักษาต่ำ โอกาสกลับมาเป็นซ้ำที่รุนแรงกว่าเดิมสูงและเกิดมดลูกทะลุได้ง่าย ปัจจุบันจึงไม่แนะนำให้ใช้วิธีนี้
Hysterotomy
การผ่าตัดเลาะพังผืดในโพรงมดลูกผ่านทาง fundus วิธีนี้เหมาะสำหรับกรณีที่มีพังผืดรุนแรงคลุมหมดทั้งโพรงมดลูก มีรายงานพบว่า 52% กลับมาตั้งครรภ์ได้และ 26% คลอดบุตรครบกำหนด ก่อนตัดสินใจให้การรักษาด้วยวิธีนี้ผู้ป่วยต้องได้ข้อมูลความเสี่ยงของการเสียเลือดจากการผ่าตัดจนอาจต้องตัดมดลูก รวมถึงความเสี่ยงของการเกิดมดลูกแตกจากการตั้งครรภ์ซึ่งสามารถเกิดขึ้นได้
HysteroscopicAdhesiolysis
การผ่าตัดส่องกล้องผ่านโพรงมดลูกในปัจจุบันเป็นวิธีการรักษาหลักสำหรับ asherman syndrome เนื่องจากเจ็บตัวน้อย เห็นบริเวณที่ผ่าตัด วิธีการผ่าตัดเลาะพังผืดทำได้โดยใช้ hysteroscopic scissors, laser หรือ diathermy โดยทั่วไปพังผืดที่เกิดบริเวณตรงกลางของโพรงมดลูกสามารถผ่าตัดเลาะแยกได้ง่าย ตรงข้ามกับพังผืดที่ติดกับขอบโพรงมดลูกที่แยกความแตกต่างกับเยื่อบุโพรงมดลูกที่ปกติและผ่าตัดแยกออกได้ยากกว่า รวมถึงเกิดมดลูกทะลุง่าย
การใช้ scissors(Figure 3)(18)หรือ biopsy forceps ในการผ่าตัดมีข้อดีคือ มีการทำลายเยื่อบุโพรงมดลูกน้อยเมื่อเทียบกับการใช้ จี้ไฟฟ้าหรือเลเซอร์ ซึ่งทางทฤษฎีจะมีการทำลายเยื่อบุโพรงมดลูกมากกว่าจากแหล่งพลังงานที่ใช้ แต่ข้อดีของวิธีหลังคือสามารถเลาะพังผืดได้ดีกว่าร่วมกับการห้ามเลือดไปพร้อมกัน(19)
การผ่าตัดพังผืดในโพรงมดลูกผ่านการส่องกล้องจะทำได้ยากขึ้นในกรณีที่พังผืดหนา ทำให้เพิ่มความเสี่ยงต่อการเกิดมดลูกทะลุได้ง่ายขึ้น โดยเฉพาะอย่างยิ่งถ้าต้องมีการถ่างขยายปากมดลูกเพื่อใส่เครื่องมือต่างๆ ดังนั้นจึงมีการใช้ laparoscopy, fluoroscopic control, transabdominal ultrasound guidance ฯ เพื่อช่วยให้สามารถเห็นบริเวณที่ต้องการผ่าตัดให้ดีขึ้นป้องกันการเกิดมดลูกทะลุจากการทำหัตถการ
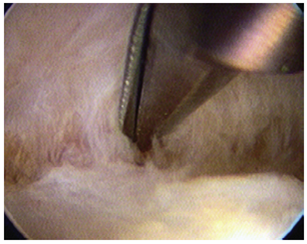
Figure 3 :Hysteroscopic scissors are used to mechanically divide dense adhesions in the uterus.(18)
Transcervicaladhesiolysis after the use of laminaria tent
Laminaria tent เป็นสาหร่ายทะเลจะดูดซับสารคัดหลั่งบริเวณปากมดลูกแล้วขยายตัวขึ้นใช้เพื่อถ่างขยายปากมดลูกเพื่อช่วยให้การผ่าตัดเลาะพังผืดทำได้ง่ายขึ้นเห็นบริเวณที่ต้องการเลาะพังผืดชัดขึ้น โดยเริ่มแรกจะใส่ tent 1-2 อันบริเวณปากมดลูกทิ้งไว้ 24 ชั่วโมง จากนั้นแทนที่ด้วย tent ใหม่อีก 3-4 อันทิ้งไว้อีก 24 ชั่วโมง แล้วนำออกก่อนทำหัตถการ(20)
Pressure lavage under guidance (PLUG)
เป็นเทคนิคที่พัฒนาต่อจากการทำ SHG โดยการฉีด isotonic saline อย่างต่อเนื่องเข้าโพรงมดลูกเพื่อให้เกิดแรงดันจากสารละลายไปถ่างขยายทำให้พังผืดในโพรงมดลูกฉีกขาด ซึ่งเป็นวิธีรักษาที่เหมาะสมในรายที่มีพังผืดไม่มากนัก(21)
Genital Tuberculosis
การรักษาภาวะ IUA ที่มีสาเหตุเกิดจากการติดเชื้อวัณโรคในโพรงมดลูก โดยวิธีส่องกล้องผ่านโพรงมดลูกเพื่อเลาะพังผืดผลการรักษาด้วยวิธีนี้ให้ผลไม่ดีนักแตกต่างจาก IUA ที่เกิดจากสาเหตุอื่นๆ การอุ้มบุญ (Surrogacy) อาจเป็นทางเลือกสำหรับผู้ที่ต้องการมีบุตรในกรณีที่การรักษาโดยการผ่าตัดล้มเหลว
Prevention of Recurrence of Adhesion
การเกิด IUA ซ้ำภายหลังการรักษาพบว่ามีอัตราการเกิดซ้ำสูง (3%-23.5%) โดยเฉพาะ severe adhesion (20%-62.5%) ดังนั้นการป้องกันการกลับมาเกิดพังผืดซ้ำภายหลังการผ่าตัดจึงมีความสำคัญต่อการรักษา วิธีการป้องกันมีหลายวิธีดังนี้
Intrauterine contraceptive devices (IUD)
หลายการศึกษาสนับสนุนการใส่ IUD ถึงประสิทธิภาพในการป้องกันการเกิดพังผืดในโพรงมดลูกซ้ำ โดยหลังจากผ่าตัดเลาะพังผืดใส่ IUD ในโพรงมดลูกเพื่อกั้นแยกผนังของโพรงมดลูกแต่ละด้านป้องกันการเกิดพังผืดและผนังมดลูกมาติดกันซ้ำ(22)
Foley balloon catheter
หลังการผ่าตัดเลาะพังผืดในโพรงมดลูกมีการใช้ foley balloon catheter เพื่อถ่างขยายผนังโพรงมดลูกแต่ละด้านไม่ให้ติดกัน ข้อเสียของวิธีนี้อาจเพิ่มความเสี่ยงต่อการติดเชื้อผ่านทางสายสวนปัสสาวะ การถ่างขยายของบอลลูนที่มากเกินไปทำให้เลือดมาเลี้ยงผนังมดลูกลดลงซึ่งอาจมีผลต่อการเจริญของเยื่อบุโพรงมดลูก และความรู้สึกไม่สะดวกจากการคาสายสวน
Hyaluronic acid (HA)
Hyaluronic acid เป็นส่วนประกอบของ vitreous humor และ synovial fluid ก่อนหน้านี้มีการใช้เพื่อป้องกันการเกิด adhesion จากการผ่าตัดในช่องท้องและอุ้งเชิงกราน ต่อมามีการนำมาประยุกต์ใช้ในการลดการเกิด IUA หลังการผ่าตัดเลาะพังผืด ชื่อการคือ Seprafilmและ auto-cross-linked HA (ACP) ซึ่งมีงานวิจัยสนับสนุนว่าสามารถป้องกันการเกิด IUA ได้ทั้งสองชนิด
Hormone treatment
มีการใช้ estrogen ภายหลังการผ่าตัดรักษา IUA โดยเชื่อ estrogen สามารถกระตุ้นการสร้างเยื่อบุโพรงมดลูกขึ้นมาใหม่แทนที่พังผืดที่ถูกเลาะออกไป(23)แต่ปัจจุบันยังไม่มีงานวิจัยมายืนยันถึงประสิทธิภาพของการใช้ estrogen ในเรื่องของการลดการเกิดพังผืดซ้ำ รวมถึงขนาดของยา, ระยะเวลาในการให้และการใช้ร่วมกับ progestin
Prevention of Asherman Syndrome
การเกิด IUA มีการตอบสนองต่อการเกิดที่แตกต่างกันในสตรีแต่ละคน อย่างไรก็ตามการป้องกันการเกิดพังผืดย่อมต้องให้ความสำคัญกว่าการรักษา โดยมีแนวทางดังนี้
1.ควรหลีกเลี่ยงการขูดมดลูกหลังคลอดหรือหลังแท้งหากเลี่ยงไม่ได้ลองใช้วิธี evacuation หรือ MVA เพื่อลดการเกิดแผลในโพรงมดลูก
2.ใช้ hysteroscopy ในการวินิจฉัยและรักษาโดยการหนีบชิ้นเนื้อออกกรณีมีการแท้งค้างหรือมีรกค้างหลังคลอด(24)
3.เลือกวิธียุติการตั้งครรภ์โดยการใช้ยาหรือเฝ้าสังเกตอาการอย่างใกล้ชิด
Outcomes of Treatment
ความสำเร็จในการรักษาโดยการผ่าตัดประเมินจากโพรงมดลูกกลับมามีลักษณะที่ปกติ ซึ่งอัตราการรักษาสำเร็จมีรายงานอยู่ที่ 57.8% – 97.5% หลังจากนั้นพังผืดที่เหลืออยู่จะใช้พยากรณ์ความสามารถในการตั้งครรภ์ต่อไป ภายหลังการรักษามีรายงานว่าสามารถกลับมามีระดูได้ปกติ 52.4% – 88.2% ความสามารถในการตั้งครรภ์จาก 28.7% ก่อนผ่าตัดเพิ่มเป็น 53.6% หลังการผ่าตัด(25)
PROGNOSIS
ก่อนที่จะมีการรักษาด้วย hysteroscopy อัตราการตั้งครรภ์หลังการรักษาอยู่ที่ 51% ดีกว่ากลุ่มที่ไม่ได้รับการรักษาที่อยู่ที่ 46% เล็กน้อย แต่หลังจากมีการรักษาด้วย hysteroscopy ทำให้อัตราการตั้งครรภ์หลังการรักษาเพิ่มสูงขึ้นเป็น 74%(3)
สตรีที่ตั้งครรภ์หลังการรักษาภาวะพังผืดในโพรงมดลูกพบว่าเป็นการตั้งครรภ์ความเสี่ยงสูง สามารถเกิด spontaneous abortion, premature delivery, abnormal placentation, intrauterine growth restriction (IUGR) และ uterine rupture ได้มากกว่าการตั้งครรภ์ปกติ จึงควรได้รับการดูแลแบบครรภ์ความเสี่ยงสูงในช่วงฝากครรภ์จนถึงระยะเจ็บครรภ์คลอด
CONCLUSION
Asherman syndrome เป็นโรคที่ส่งผลต่อสุขภาวะทางด้านการเจริญพันธุ์ของสตรี ควรสงสัยภาวะนี้มากขึ้นหากมีประวัติเคยขูดมดลูกหลังคลอดหรือแท้งมาก่อน ซึ่งมักมาด้วยอาการระดูผิดปกติ, มีบุตรยาก หากสงสัยภาวะนี้สามารถตรวจคัดกรองได้ด้วย sonohysterographyหรือ hysterosalpingographyและให้การวินิจฉัยและรักษาด้วย hysteroscopy นอกจากนี้ภาวะพังผืดในโพรงมดลูกกลับมาเป็นซ้ำได้ง่ายดังนั้นจึงมีโอกาสต้องผ่าตัดรักษาซ้ำมากกว่า 1 ครั้ง ภาวะระดูผิดปกติมักจะดีขึ้นหลังการรักษา ส่วนความสามารถในการตั้งครรภ์ขึ้นอยู่กับความรุนแรงของพังผืดรวมถึงปัจจัยอื่นๆ เช่น อายุ, โรคประจำตัว ฯ ทำให้ทำนายได้ยาก ในสตรีที่สามารถตั้งครรภ์สำเร็จหลังการรักษาควรดูแลแบบครรภ์ความเสี่ยงสูงและเฝ้าระวังภาวะแทรกซ้อนต่างๆ ที่มีโอกาสเกิดขึ้น
References
- Asherman JG. Amenorrhoea traumatica (atretica). J Obstet Gynaecol Br Emp. 1948 Feb;55(1):23-30.
- Yu D, Wong YM, Cheong Y, Xia E, Li TC. Asherman syndrome–one century later. Fertil Steril. 2008 Apr;89:759-79.
- Schenker JG, Margalioth EJ. Intrauterine adhesions: an updated appraisal. Fertil Steril. 1982 May;37(5):593-610.
- Preutthipan S, Linasmita V. Reproductive outcome following hysteroscopic lysis of intrauterine adhesions: a result of 65 cases at Ramathibodi Hospital. J Med Assoc Thai. 2000 Jan;83(1):42-6.
- The American Fertility Society classifications of adnexal adhesions, distal tubal occlusion, tubal occlusion secondary to tubal ligation, tubal pregnancies, mullerian anomalies and intrauterine adhesions. Fertil Steril. 1988 Jun;49(6):944-55.
- Wamsteker K, de Blok S, de Wit W. [Diagnostic and therapeutic applications of hysteroscopy]. Ned Tijdschr Geneeskd. 1988 Nov 5;132(45):2041-4.
- Nasr AL, Al-Inany HG, Thabet SM, Aboulghar M. A clinicohysteroscopic scoring system of intrauterine adhesions. Gynecol Obstet Invest. 2000;50(3):178-81.
- Westendorp IC, Ankum WM, Mol BW, Vonk J. Prevalence of Asherman’s syndrome after secondary removal of placental remnants or a repeat curettage for incomplete abortion. Hum Reprod. 1998 Dec;13(12):3347-50.
- Leung PL, Tam WH, Yuen PM. Hysteroscopic appearance of the endometrial cavity following thermal balloon endometrial ablation. Fertil Steril. 2003 May;79(5):1226-8.
- Netter AP, Musset R, Lambert A, Salomon Y. Traumatic uterine synechiae: a common cause of menstrual insufficiency, sterility, and abortion. Am J Obstet Gynecol. 1956 Feb;71(2):368-75.
- Polishuk WZ, Anteby SO, Weinstein D. Puerperal endometritis and intrauterine adhesions. Int Surg. 1975 Aug;60(8):418-20.
- Stillman RJ, Asarkof N. Association between mullerian duct malformations and Asherman syndrome in infertile women. Obstet Gynecol. 1985 May;65(5):673-7.
- Klein SM, Garcia CR. Asherman’s syndrome: a critique and current review. Fertil Steril. 1973 Sep;24(9):722-35.
- Foix A, Bruno RO, Davison T, Lema B. The pathology of postcurettage intrauterine adhesions. Am J Obstet Gynecol. 1966 Dec 1;96(7):1027-33.
- Polishuk WZ, Sadovsky E. A syndrome of recurrent intrauterine adhesions. Am J Obstet Gynecol. 1975 Sep 15;123(2):151-8.
- Soares SR, Barbosa dos Reis MM, Camargos AF. Diagnostic accuracy of sonohysterography, transvaginal sonography, and hysterosalpingography in patients with uterine cavity diseases. Fertil Steril. 2000 Feb;73(2):406-11.
- Salle B, Gaucherand P, de Saint Hilaire P, Rudigoz RC. Transvaginal sonohysterographic evaluation of intrauterine adhesions. J Clin Ultrasound. 1999 Mar-Apr;27(3):131-4.
- Deans R, Abbott J. Review of intrauterine adhesions. J Minim Invasive Gynecol. Sep-Oct;17(5):555-69.
- Fedele L, Vercellini P, Viezzoli T, Ricciardiello O, Zamberletti D. Intrauterine adhesions: current diagnostic and therapeutic trends. Acta Eur Fertil. 1986 Jan-Feb;17(1):31-7.
- Chen FP, Soong YK, Hui YL. Successful treatment of severe uterine synechiae with transcervical resectoscopy combined with laminaria tent. Hum Reprod. 1997 May;12(5):943-7.
- Coccia ME, Becattini C, Bracco GL, Pampaloni F, Bargelli G, Scarselli G. Pressure lavage under ultrasound guidance: a new approach for outpatient treatment of intrauterine adhesions. Fertil Steril. 2001 Mar;75(3):601-6.
- March CM. Intrauterine adhesions. Obstet Gynecol Clin North Am. 1995 Sep;22(3):491-505.
- Farhi J, Bar-Hava I, Homburg R, Dicker D, Ben-Rafael Z. Induced regeneration of endometrium following curettage for abortion: a comparative study. Hum Reprod. 1993 Jul;8(7):1143-4.
- Goldenberg M, Schiff E, Achiron R, Lipitz S, Mashiach S. Managing residual trophoblastic tissue. Hysteroscopy for directing curettage. J Reprod Med. 1997 Jan;42(1):26-8.
- Katz Z, Ben-Arie A, Lurie S, Manor M, Insler V. Reproductive outcome following hysteroscopic adhesiolysis in Asherman’s syndrome. Int J Fertil Menopausal Stud. 1996 Sep-Oct;41(5):462-5.


