Targeted therapy in gynecologic malignancy
พ.ญ. ดังชีวัน ตินนังวัฒนะ
อ.ที่ปรึกษา อ.ฉลอง ชีวเกรียงไกร
การเกิดขึ้นของเซลล์มะเร็งเกิดจากการเปลี่ยนแปลงที่ผิดปกติของเซลล์นั้นๆ เช่น การเพิ่มจำนวนของ gene product จำพวก receptor หรือโปรตีนต่างๆที่มากผิดปกติ (overexpression), การเพิ่มจำนวนของ gene copy หรือ gene coating ของเซลล์ (amplification), การเปลี่ยนแปลงรูปแบบของสารพันธุกรรม (gene mutation) ซึ่งส่วนใหญ่มักจะเป็นการขาดหายไปของ tumor suppressor gene และสุดท้าย คือการเกิดความไม่สมดุลกันของ growth factors และreceptors(1)จากการเปลี่ยนแปลงของเซลล์ต่างๆดังที่กล่าวมานั้น ส่งผลให้เกิดการสร้างเส้นเลือดใหม่ (angiogenesis) รวมถึงทำให้เซลล์ปกติขาด immune response ที่เหมาะสมต่อเซลล์มะเร็ง ส่งเสริมให้เซลล์มะเร็งสามารถเติบโตขึ้น การศึกษาถึงกลไกการเกิดและเติบโตของเซลล์มะเร็งดังที่กล่าวมานั้น ทำให้สามารถพัฒนาการรักษามะเร็งแบบใหม่ที่เรียกว่า Targeted therapy
การเติบโตขึ้นของเซลล์มะเร็งอาศัยการส่งสัญญาณระหว่างเซลล์ (signal transduction pathway) โดยเป็นผลจากการทำงานของ tyrosine kinase receptor ซึ่งประกอบด้วยองค์ประกอบหลัก 3 ส่วน(2)ได้แก่
- Extracellular domain คือส่วนที่ยื่นออกไปนอกเซลล์เพื่อจับกับ ligand แล้วทำให้เกิดการรวมตัวเป็นคู่ของ receptor (dimerization)
- Transmembrane domain อยู่บริเวณ cell membrane
- Tyrosine kinase domain ซึ่งอยู่ภายในเซลล์และควบคุมทำงานโดยเอนไซม์ tyrosine kinase โดยเมื่อเกิดการรวมตัวกับกลุ่มฟอสเฟต (phosphorylation) จะทำให้มีการกระตุ้นสารหรือโมเลกุลอื่นทั้งภายนอกและภายใน nucleus และเกิดการส่งต่อสัญญาณหรือ signal transduction ซึ่งส่งผลควบคุมการเกิดและเติบโตของเซลล์มะเร็งต่อไป
ยาในกลุ่ม molecular targeted therapy ที่ออกฤทธิ์ยับยั้ง signal transduction ของ tyrosine kinase receptor ที่ได้รับการอนุมัติใช้ในการรักษาผู้ป่วยมะเร็ง solid tumor ในปัจจุบันมี 2 ประเภทได้แก่ monoclonal antibody และ small molecule tyrosine kinase inhibitor
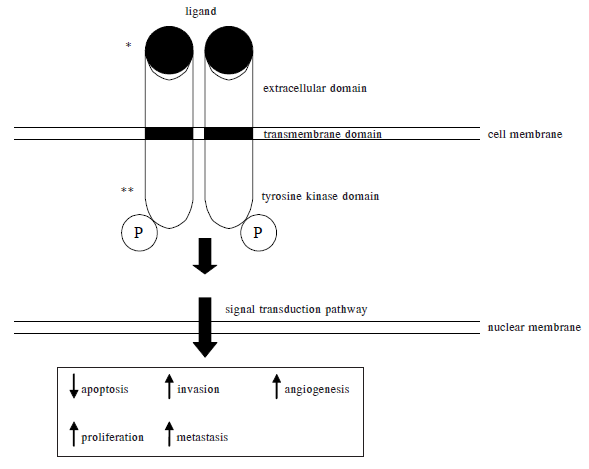
*ตำแหน่งออกฤทธิ์ของ monoclonal antibody
**ตำแหน่งออกฤทธิ์ของ small molecule tyrosine kinase inhibitor
Monoclonal antibody(2)ยับยั้งการเติบโตของเซลล์มะเร็งได้โดยผ่านทางกลไกภูมิคุ้มกันประเภทcomplement-dependent และ antibodydependent cell-mediated toxicity antibody ประกอบด้วย 2 แขนที่แตกต่างกันคือแขนจับกับเซลล์มะเร็งและแขนจับกับ immune-effector cell ของ host ได้แก่ T cell, natural-killer cell และmacrophage เมื่อ monoclonal antibody ไปจับกับ growth factor receptor ซึ่งเป็นโปรตีนบนผิวของเซลล์มะเร็งจะสามารถยับยั้งกระบวนการ phosphorylation ของเอนไซม์ tyrosine kinase ซึ่งนำไปสู่การยับยั้ง signal transduction ที่มีผลต่อการเกิดและเติบโตของเซลล์มะเร็งได้
Small molecule tyrosine kinase inhibitor(2)ได้แก่สารโมเลกุลขนาดเล็กที่ออกฤทธิ์ยับยั้ง signal transduction ภายในเซลล์มะเร็งโดยรวมตัวกับ tyrosine kinase domain ของ tyrosinekinase receptor ทำให้ไม่เกิดกระบวนการ phosphorylation จึงไม่เกิดการกระตุ้นส่วนสำคัญต่อการเกิดและเติบโตของเซลล์มะเร็ง
กระบวนการเหล่านี้จะยับยั้งการสร้างเซลล์มะเร็งใหม่ (inhibit proliferation), กระตุ้นการตายของเซลล์ (induce apoptosis), และช่วยลดการแพร่กระจายของมะเร็ง (block metastasis)ลงได้
ตามธรรมชาติของเซลล์มะเร็งนั้น จะสร้างสารต่างๆในกลไกการสื่อสารของเซลล์ที่แตกต่างจากเซลล์ปกติ และมีความจำเพาะต่อเซลล์มะเร็ง ซึ่ง targeted therapy จะเข้ายับยั้งกระบวนการต่างๆเหล่านี้ จึงมีข้อดีคือยาในกลุ่มนี้ยับยั้งกระบวนการในระดับโมเลกุลที่พบว่าจำเพาะต่อเซลล์มะเร็งแต่ละชนิดทำให้ผลของการต้านเซลล์มะเร็งสูงในขณะที่ผลไม่พึงประสงค์ต่อเซลล์ปกติน้อยซึ่งต่างจากการ ให้ยาเคมีบำบัดที่ไม่สามารถเลือกออกฤทธิ์เฉพาะต่อเซลล์มะเร็งและป้องกันเซลล์ปกติของร่างกายไม่ให้ถูกทำลายได้ โดย Molecular target ที่ดีในการรักษาผู้ป่วยโรคมะเร็งควรจะมีคุณสมบัติดังนี้(2)
- มีความจำเพาะต่อเซลล์มะเร็งและไม่พบหรือพบน้อยในเซลล์อื่นที่สำคัญของร่างกาย
- สามารถตรวจพบจากตัวอย่างชิ้นเนื้อหรือสิ่งส่งตรวจอื่นจากผู้ป่วยได้ด้วยวิธีการทางห้องปฏิบัติการที่ไม่ยุ่งยากและเชื่อถือได้
- มีความสัมพันธ์กับผลการตอบสนองต่อการรักษาของผู้ป่วย
- เมื่อถูกยับยั้งสามารถทำให้ผู้ป่วยที่ express molecular target นั้นตอบสนองต่อการรักษาได้ดีแต่ไม่เกิดผลการตอบสนองในผู้ป่วยที่ไม่ express molecular target
โดยการรักษาสามารถแบ่งตามกลไกการยับยั้งเซลล์มะเร็งได้ดังนี้
Angiogenesis
การสร้างเส้นเลือดใหม่ เป็นกระบวนการพื้นฐานของการเจริญเติบโตของเซลล์มะเร็ง โดยอาศัยการหลั่ง angiogenicfactor ต่างๆ เช่น Vascular endothelial growth factor (VEGF), Interleukin 8, Platelet-derived endothelial cell growth factor (PEGF) และ Angiopoitins โดยเซลล์มะเร็งจะมีการหลั่งสารต่างๆเหล่านี้ที่มากกว่าเซลล์ปกติทั่วไป ทำให้เกิดการสร้างเส้นเลือดใหม่มาเลี้ยงเซลล์มะเร็งมากขึ้น ซึ่งมีผลต่อการนำสารอาหารและออกซิเจนมาเลี้ยงเซลล์มะเร็งที่มากขึ้นด้วย
ในกระบวนการยับยั้งเซลล์มะเร็งในกระบวนการสร้างเส้นเลือดใหม่นั้นมี 3 แบบคือ
- ยับยั้งการทำงานของ VEGF เช่น Bevacizumab, VEGF-Trap
- ยับยั้งการจับกันของ VEGF และ VEGF receptor
- ยับยั้งการทำงานของ tyrosine kinase และยับยั้งการส่งสัญญาณการสร้างเส้นเลือดใหม่
Vascular endothelial growth factor
VEGF ทำหน้าที่เป็นpotent angiogenic cytokines(3)ซึ่งสารในกลุ่มนี้มีหลายชนิด เช่น VEGFA, VEGFB, VEGFC, VEGFD, PIGF-1, PIGF-2 มีความสำคัญต่อเซลล์มะเร็งคือนอกจากจะช่วยเพิ่มจำนวนของเซลล์มะเร็งดังที่กล่าวไปข้างต้นแล้ว ยังช่วยเพิ่มvascular permeability และ vasodilatationส่งผลให้เกิดการรั่วไหลออกของสารในเส้นเลือด ทำให้การลำเลียงยาต่างๆไปสู่เซลล์มะเร็งได้น้อยลง(4) มีการศึกษาว่าการมี VEGFA ที่มากขึ้นนั้น สัมพันธ์กับการมีภาวะน้ำในช่องท้อง (ascites), carcinomatosisและ การพยากรณ์โรคที่ไม่ดีในผู้ป่วยมะเร็งรังไข่(3)ในกลุ่มผู้ป่วยมะเร็งปากมดลูกนั้น สัมพันธ์กับระยะของโรคที่มากขึ้น, การกระจายไปยังต่อมน้ำเหลือง(5), และการมี disease-free survival และ overall survival ที่ต่ำ (6-8) โดยยาในกลุ่มนี้ที่ใช้กันอย่างแพร่หลายคือ Bevacizumabเป็นยาที่ให้ทางเส้นเลือดดำ ออกฤทธิ์เป็น monoclonal antibody มีกลไกคือยับยั้ง VEGFA
มีการศึกษาในผู้ป่วยมะเร็งรังไข่ โดยใช้ Bevacizumabในการยับยั้งการโตของเซลล์มะเร็งและยับยั้งการสร้างน้ำในช่องท้อง โดยมีการศึกษาจาก GOG เปรียบเทียบการให้ standard chemotherapy (carboplatin 6 AUC – paclitaxel 175 mg/m2) กับการให้ standard chemotherapy ร่วมกับ Bevacizumabพบว่าในกลุ่มที่ใช้ Bevacizumabร่วมด้วยนั้นมีผลเพิ่ม progression free survival ประมาณ 6 เดือน (13.1 เดือนเทียบกับ 19.1 เดือน)(9)
OCEAN study ศึกษาการใช้bevacizumabร่วมกับ carboplatin และ gemcitabine ในผู้ป่วยมะเร็งรังไข่ชนิด platinum-sensitiveที่มีการกลับเป็นซ้ำ พบว่ามีการ progression free survival เพิ่มขึ้น 4 เดือน เมื่อเทียบกับกลุ่มที่ไม่ได้ยาbevacizumab (8.4 เดือนเทียบกับ 12.4 เดือน) และ European Medicine Agency (EMA) ยอมรับให้มีการใช้bevacizumabร่วมกับ carboplatin และ paclitaxel เป็น First-line therapy ในผู้ป่วย platinum-sensitive ที่มีการกลับเป็นซ้ำหลังจากได้ carboplatin ร่วมกับ gemcitabine แต่อย่างไรก็ตามการรักษาด้วย Bevacizumabในรูปแบบนี้ยังไม่ได้รับการยอมรับจาก FDA เนื่องจากยังไม่มีการศึกษาถึง overall survival อย่างชัดเจน(10)
มีการศึกษาจาก GOG ในกลุ่มผู้ป่วยมะเร็งปากมดลูกที่มีการกลับเป็นซ้ำหรือมีการแพร่กระจาย เปรียบเทียบการใช้ standard chemotherapy (paclitaxel ร่วมกับ cisplatinหรือ paclitaxel ร่วมกับ topotecan) กับการให้ standard chemotherapy ร่วมกับ bevacizumab พบว่า สามารถเพิ่ม overall survival จาก 13.3 เดือน เป็น 17 เดือน และเพิ่ม progression free survival จาก 5.9 เดือน เป็น 8.2 เดือน (11)
ผลข้างเคียงจากยาในกลุ่มนี้ที่พบได้คือ การเกิดลิ่มเลือดอุดตันในเส้นเลือดทั้งเส้นเลือดแดงและเส้นเลือดดำ (venous and arterial thrombosis), เกิดเลือดออก (hemorrhage), ไตอักเสบและโปรตีนรั่ว (nephritic syndrome with proteinuria), ความดันโลหิตสูง (hypertension) และลำไส้แตก (bowel perforation)(1)โดยโอกาสการเกิด bowel perforation จะมากขึ้นในกลุ่มที่มะเร็งลุกลามเข้าลำไส้ โดยมีอุบัติการณ์ประมาณ 11%(3)
ยาในกลุ่ม Small molecule tyrosine kinase inhibitor ที่มีผลยับยั้ง VEGF pathway ตัวอย่างเช่น Pazopanibมีผลยับยั้ง VEGFR1, VEGFR2, VEGFR3, platelet-derived growth factor receptor (PDGFR) และ c-kit
นอกจากนี้ยังมียา afliberceptซึ่งเป็นยาในกลุ่ม VEGF-Trap เป็นโปรตีนที่มีส่วนประกอบของ extracellular domain ของ VEGF receptor (VEGFR1 และ VEGFR2) เชื่อมกับ FC portion ของ immunoglobulin G1 โดย VEGF-Trap จะเข้าไปจับกับ VEGF และทำลายทิ้งไป(1)จากการศึกษาพบว่าประสิทธิภาพเท่าเทียมกับ bevacizumabแต่มีอุบัติการณ์การเกิดลำไส้แตกน้อยกว่า คือประมาณ 1%(3)
Epidermal growth factor receptor inhibitors
Epidermal growth factor receptor pathway มีส่วนสำคัญในกระบวนการ cell growth and differentiation ซึ่งส่งผลต่อ cell division, migration, adhesion, differentiation และ apoptosis สารในกลุ่ม epidermal growth factor receptor มี 4 ตัว คือ EGFR (HER1), HER2, HER3 และ HER4 พบว่ามีการสร้าง EGFR ที่มากขึ้นประมาณ 35-70% ในกลุ่ม epithelial ovarian cancer และ 43-67% ในกลุ่ม endometrial cancer ซึ่งสัมพันธ์กับความรุนแรงของโรคที่มากขึ้น การมี disease-free survival และ overall survival ที่ลดลง รวมถึงการไม่ตอบสนองต่อยาเคมีบำบัด(12) การพบ HER2 receptor ใน nonendometrial cancer ก็มักจะพบในกลุ่มมะเร็งที่มีความรุนแรง (aggressive) เช่นใน uterine serous papillary carcinoma พบได้ประมาณ 42%
ยาที่ใช้ในกลุ่มนี้ เช่น Trastuzumabและ Pertuzumabเป็น monoclonal antibody โดย trastuzumabออกฤทธิ์ที่ extracellular domain ของ HER2 ส่งผลให้ยับยั้งการเพิ่มจำนวนเซลล์ส่วน pertuzumabจะออกฤทธิ์ที่ HER2 receptor ทำให้ receptor นั้นไม่ทำงาน
Cetuximab เป็น monoclonal antibody มักใช้ในผู้ป่วยมะเร็งรังไข่และมะเร็งเยื่อบุโพรงช่องท้องที่มีการตรวจแล้วว่าเป็น EGFR-positive tumors โดยมีการใช้ร่วมกับ paclitaxel และ carboplatin เป็น first line treatment ในผู้ป่วยมะเร็งรังไข่ระยะที่ 3 ซึ่งการศึกษาพบว่าไม่ช่วยเพิ่ม progression-free survival แต่อย่างใดและมีการศึกษาในผู้ป่วยมะเร็งปากมดลูกระยะลุกลามโดย GINECO trial เทียบการให้cetuzimabร่วมกับ topotecanและ cisplatinแต่การศึกษานี้ต้องหยุดไปเนื่องจากมีผู้ป่วยเสียชีวิต 28% ซึ่งมี 3 คนที่เสียชีวิตจากผลข้างเคียงของยา เช่น การติดเชื้อ, febrile neutropenia, ลิ่มเลือดอุดตันปอด(13)
Erlotinib เป็น small-molecule inhibitors โดยยับยั้งการเกิด autophosphorylation มีการใช้เป็น first line treatment หลังการผ่าตัดในผู้ป่วยมะเร็งรังไข่, มะเร็งท่อนำไข่ และมะเร็งเยื่อบุช่องท้อง มีการศึกษาในผู้ป่วยมะเร็งปากมดลูกในระยะลุกลามเฉพาะที่ โดยให้ ertolinibร่วมกับ cisplatinและ radiotherapy ในผู้ป่วย 36 คน พบว่าไม่มีผู้ป่วยใดที่มีการลุกลามของโรคมากขึ้นเลย โดยมี 94.4% ที่ตอบสนองเป็น complete response(14)ซึ่งถือว่าเป็นการรักษาที่ได้ผลดีผลข้างเคียงจากยานี้ที่สำคัญคือ skin rashes (68%) และ diarrhea (38%)(3)
Gefitinib เป็น oral-form small-molecule inhibitors(5)ออกฤทธิ์เป็น competitive receptor inhibitor ออกฤทธิ์โดยไปจับกับ ATP-binding domain ของ receptor แล้วป้องกันไม่ให้เกิด phosphorylationโดยมีการใช้ร่วมกับยา tamoxifenในการรักษามะเร็งรังไข่และมะเร็งท่อนำไข่ โดยมีการศึกษาการใช้ในรูปแบบนี้ในผู้ป่วย 56 คน พบว่าการตอบสนองของเซลล์ยังไม่ชัดเจนนัก แต่มี 16 คน ที่ไม่มีการลุกลามของโรค (disease stable)(15)ผลข้างเคียงที่สำคัญของ gefitinibคือ diarrhea (25%), leucopenia (22%), neutropenia (9%), anemia (13%) และ skin rashes (13%) แต่มีการรายงานว่าพบ myelodysplastic syndrome และ acute leukemia ด้วยเช่นกัน (15)
Lapatinibเป็น small molecules inhibitor ของทั้ง HER2 และ EGFR receptor
HER-2/neu receptor inhibitor
HER-2/neu receptor เป็น transmembrane tyrosine kinase inhibitor(13)ถูกกระตุ้นด้วยกระบวนการ homo-heterodimerizationทำให้เกิด tyrosine phosphorylation และเกิดการสื่อสารต่างๆภายในเซลล์ ทำให้เกิดการสร้างเซลล์ใหม่, การย้ายที่ และการบุกรุกของเซลล์
Trastuzumabเป็น IgG1 monoclonal antibody ที่จำเพาะต่อ domain ของ HER-2/neu receptor ส่วนที่อยู่ภายนอกเซลล์ เมื่อยานี้ไปจับกับ receptor จะกระตุ้นให้เซลล์ตาย, สูญเสียการซ่อมแซม DNA และยับยั้งการสร้างเส้นเลือดใหม่
HER-2/neu oncogene พบได้ในผู้ป่วยมะเร็งรังไข่ 20-30% ใน GOG มีการศึกษาถึงการใช้ trastuzumabในผู้ป่วยที่ตรวจพบว่ามี receptor นี้ (ตรวจพบ 95 คนใน 837 คน) พบว่าการใช้ trastuzumabเพียงตัวเดียวมีอัตราการตอบสนองที่ต่ำ (complete response 2.4% และ partial response 4.9%)(16)
HER-2/neu overexpression พบในผู้ป่วยมะเร็งปากมดลูกเพียง 2.9% โดยพบมากในกลุ่ม adenocarcinoma มากกว่า squamous cell carcinoma(13, 17)และพบในผู้ป่วยมะเร็งมดลูกชนิด papillary serous carcinoma 18% ซึ่งบ่งบอกถึงการมีพยากรณ์โรคที่ไม่ดี(8)ใน GOG ศึกษาการตอบสนองของเซลล์มะเร็งต่อยา trastuzumabในผู้ป่วยมะเร็งเยื่อบุโพรงมดลูกระยะลุกลามหรือมีการกลับเป็นซ้ำ พบว่ามีการตอบสนองต่อยาน้อย ถึงแม้จะเป็นเซลล์มะเร็งที่มีการสร้าง HER-2/neureceptor ก็ตาม(18)
Mitogen-activated protein (MAP) kinase pathway inhibitor
กระบวนการนี้ถูกกระตุ้นได้จากหลายสาเหตุ เช่น สาร cofactor, inflammatory cytokines หรือภาวะเครียด โดยสารสื่อสัญญาณในกระบวนการนี้มีหลายชนิด เช่น RAS, MEK1/2, ERK1/2, p38 MAPK โดยการยับยั้งสารสื่อสัญญาณเหล่านี้ส่วนใหญ่ยังอยู่ในระหว่างการศึกษา
Sorafenibเป็นยาตัวแรกในกลุ่มนี้ที่ได้มีการศึกษาถึงประสิทธิภาพของยา โดยใช้กระบวนการการยับยั้งสารที่ชื่อ rafโดยได้มีการศึกษาแล้วว่าประสิทธิภาพในการรักษา renal cell carcinoma และ hepatocellular carcinoma นอกจากการยับยั้ง rafแล้ว sorafenibยังเป็นสารยับยั้ง VEGFR2, VEGFR3, FT3, c-kit และ PDGFR-β(1)
The PI3-kinase/Akt/mTOR pathway inhibitor
PI3-kinase/Akt/mTOR pathwayเป็นกระบวนการสื่อสารหลักของเซลล์มะเร็งทางนรีเวช โดยสามารถพบในมะเร็งเยื่อบุโพรงมดลูกได้ 80%, ในมะเร็งรังไข่ชนิดเยื่อบุผิว 50-70% และในมะเร็งปากมดลูกประมาณ 50%
กระบวนการนี้จะเริ่มต้นจากการมี growth factors ต่างๆ เช่น PDGF หรือ IGF ไปกระตุ้นการเกิด phosphorylation ของ PI3-kinaseซึ่งจะไปกระตุ้นให้ปล่อย Akt protein จากเยื่อหุ้มเซลล์ Akt protein นี้ จะทำให้เกิดกระบวนการ phosphorylation ของสารสื่อประสาทต่างๆ เช่น BAD, FKHR, Caspase 9 และ mammalian target of rapamycin (mTOR) กระบวนการทั้งหมดที่กล่าวมานี้ทำให้เกิดการเพิ่มจำนวนของเซลล์, การรุกล้ำของเซลล์มะเร็ง, การดื้อต่อยา และการสร้างเส้นเลือดใหม่(1)
กระบวนการยับยั้ง PI3-kinase/Akt/mTOR pathway ยังไม่มีการศึกษาชัดเจนถึงประโยชน์ในการรักษามะเร็งทางนรีเวช (5) แต่มีการศึกษาแล้วว่ามีประโยชน์ในการรักษามะเร็งเนื้อไต และมะเร็งเนื้อสมองชนิด glioblastoma
PDGFR-KIT inhibition
Platelet-derived growth factor, Platelet-derived growth factorreceptor และ c-KIT มีส่วนช่วยในการเจริญเติบโต และการสร้างเส้นเลือดของเซลล์มะเร็ง พบว่ามีการสร้างสารนี้มากใน 70% ของกลุ่มผู้ป่วยมะเร็งรังไข่ ซึ่งพบว่ามีความสัมพันธ์กับการมี overall survival ที่น้อยกว่าเมื่อเปรียบเทียบกับผู้ป่วยมะเร็งรังไข่ที่ไม่มีการสร้างสารนี้ ยาที่อยู่ในกลุ่มนี้ เช่น imatinibจากการศึกษาใน phase I และ II ยังพบว่ายังไม่มีประโยชน์ชัดเจน(19, 20)
ขณะนี้มียาในกลุ่ม molecular targeted therapy ที่กำลังทำการศึกษาทั้งในปัจจุบัน รวมถึงในอนาคตอีกมาก โดยมีข้อดี ข้อเสีย แตกต่างกัน โดยประโยชน์ทางคลินิกนั้น ยังคงต้องติดตามกันต่อไป แต่ในประเทศไทยนั้นยังมีการเข้าถึงยาในกลุ่มนี้น้อย เนื่องจากการไม่นำเข้ายาจากต่างประเทศ หรือปัญหาด้านเศรษฐกิจจากราคายา ทำให้คนไทยที่มีโอกาสเข้าถึงการรักษาด้วยยากลุ่มนี้ยังมีจำกัด ซึ่งเป็นปัญหาที่ควรได้รับการแก้ไขต่อไป
เอกสารอ้างอิง
- Berek JS. Gynecologic oncology. fifth ed. philadelphia: Lippincott williams & wilkins; 2010.
- สรรพวีรวงศ์ ภ. สารยับยั้งการทำงานของ Tyrosine kinase receptor: เป้าหมายระดับอณูของการรักษามะเร็งชนิด solid tumor. สงขลานครินทร์เวชสาร. 2006;Sect. 10.
- Pliarchopoulou K, Pectasides D. Epithelial ovarian cancer: focus on targeted therapy. Crit Rev Oncol Hematol. 2011 Jul;79(1):17-23.
- Banerjee S, Kaye S. The role of targeted therapy in ovarian cancer. Eur J Cancer. 2011 Sep;47 Suppl 3:S116-30.
- Vici P, Mariani L, Pizzuti L, Sergi D, Di Lauro L, Vizza E, et al. Emerging Biological Treatments for Uterine Cervical Carcinoma. J Cancer. 2014;5(2):86-97.
- Guidi AJ, Abu-Jawdeh G, Berse B, Jackman RW, Tognazzi K, Dvorak HF, et al. Vascular permeability factor (vascular endothelial growth factor) expression and angiogenesis in cervical neoplasia. J Natl Cancer Inst. 1995 Aug 16;87(16):1237-45.
- Loncaster JA, Cooper RA, Logue JP, Davidson SE, Hunter RD, West CM. Vascular endothelial growth factor (VEGF) expression is a prognostic factor for radiotherapy outcome in advanced carcinoma of the cervix. Br J Cancer. 2000 Sep;83(5):620-5.
- Pectasides D, Pectasides E, Economopoulos T. Systemic therapy in metastatic or recurrent endometrial cancer. Cancer Treat Rev. 2007 Apr;33(2):177-90.
- Burger RA, Brady MF, Rhee J, Sovak MA, Kong G, Nguyen HP, et al. Independent radiologic review of the Gynecologic Oncology Group Study 0218, a phase III trial of bevacizumab in the primary treatment of advanced epithelial ovarian, primary peritoneal, or fallopian tube cancer. Gynecol Oncol. 2013 Oct;131(1):21-6.
- Benerjee S. Targeted therapies for the management of ovarian cancer. Royal collage of obstetricians and gynecologist. 2013.
- Tewari KS, Sill MW, Long HJ, 3rd, Penson RT, Huang H, Ramondetta LM, et al. Improved survival with bevacizumab in advanced cervical cancer. N Engl J Med. 2014 Feb 20;370(8):734-43.
- Bartlett JM, Langdon SP, Simpson BJ, Stewart M, Katsaros D, Sismondi P, et al. The prognostic value of epidermal growth factor receptor mRNA expression in primary ovarian cancer. Br J Cancer. 1996 Feb;73(3):301-6.
- Zagouri F, Sergentanis TN, Chrysikos D, Filipits M, Bartsch R. Molecularly targeted therapies in cervical cancer. A systematic review. Gynecol Oncol. 2012 Aug;126(2):291-303.
- Nogueira-Rodrigues A, Moralez G, Grazziotin R, Carmo CC, Small IA, Alves FV, et al. Phase 2 trial of erlotinib combined with cisplatin and radiotherapy in patients with locally advanced cervical cancer. Cancer. 2014 Apr 15;120(8):1187-93.
- Wagner U, du Bois A, Pfisterer J, Huober J, Loibl S, Luck HJ, et al. Gefitinib in combination with tamoxifen in patients with ovarian cancer refractory or resistant to platinum-taxane based therapy–a phase II trial of the AGO Ovarian Cancer Study Group (AGO-OVAR 2.6). Gynecol Oncol. 2007 Apr;105(1):132-7.
- Bookman MA, Darcy KM, Clarke-Pearson D, Boothby RA, Horowitz IR. Evaluation of monoclonal humanized anti-HER2 antibody, trastuzumab, in patients with recurrent or refractory ovarian or primary peritoneal carcinoma with overexpression of HER2: a phase II trial of the Gynecologic Oncology Group. J Clin Oncol. 2003 Jan 15;21(2):283-90.
- Fadare O, Zheng W. HER2 protein (p185(HER2)) is only rarely overexpressed in cervical cancer. Int J Gynecol Pathol. 2004 Oct;23(4):410-1; author reply 1-2.
- Bansal N, Yendluri V, Wenham RM. The molecular biology of endometrial cancers and the implications for pathogenesis, classification, and targeted therapies. Cancer Control. 2009 Jan;16(1):8-13.
- Coleman RL, Broaddus RR, Bodurka DC, Wolf JK, Burke TW, Kavanagh JJ, et al. Phase II trial of imatinib mesylate in patients with recurrent platinum- and taxane-resistant epithelial ovarian and primary peritoneal cancers. Gynecol Oncol. 2006 Apr;101(1):126-31.
- Noguera IR, Sun CC, Broaddus RR, Branham D, Levenback CF, Ramirez PT, et al. Phase II trial of imatinib mesylate in patients with recurrent platinum- and taxane-resistant low-grade serous carcinoma of the ovary, peritoneum, or fallopian tube. Gynecol Oncol. 2012 Jun;125(3):640-5.


