ภาวะถุงรังไข่หลายใบ (Polycystic ovary syndrome)
พ.ญ. ภัทรามาส เลิศชีวกานต์
อ.ที่ปรึกษา: ร.ศ. น.พ. อภิชาติ โอฬารรัตนชัย
บทนำ
ภาวะถุงน้ำรังไข่หลายใบหรือ Polycystic ovary syndrome (PCOS) เป็นความผิดปกติของระบบต่อมไร้ท่อที่พบบ่อยที่สุดในทางนรีเวช โดยพบภาวะนี้ในสตรีวัยเจริญพันธุ์ร้อยละ 5-10(1) ซึ่งภาวะนี้เป็นกลุ่มอาการที่ประกอบด้วยภาวะที่มีฮอร์โมนแอนโดรเจนสูงร่วมกับภาวะไม่ตกไข่เรื้อรัง ภาวะแอนโดรเจนสูงทำให้เกิดภาวะขนดก มีบุตรยาก ผิวหน้ามัน มีสิวมาก บางรายอาจพบมีภาวะผมบางจากแอนโดรเจน (Androgen-dependent alopecia) และภาวะไข่ไม่ตกเรื้องรังจะทำให้ระยะระหว่างรอบระดูห่างมากขึ้น บางรายมีภาวะขาดระดูตามมา ร่วมกับมีการตรวจพบถุงน้ำขนาดเล็กจำนวนมากที่รังไข่ (Polycystic ovary)
พยาธิสรีรวิทยา
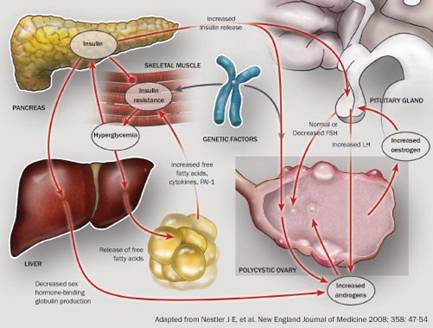
กลไกการเกิดของ PCOS ยังไม่เป็นที่ทราบแน่ชัดในปัจจุบันพบว่ามีความผิดปกติอยู่หลายตำแหน่งทั้งที่ รังไข่, ต่อมหมวกไต, ผิวหนังและไขมันรอบนอกของร่างกาย (peripheral compartment) และที่ต่อมใต้สมองกับต่อมพิทูอิทารี่ ความผิดปกติในตำแหน่งต่างๆเหล่านี้ทำให้เกิดผลสืบเนื่องเกี่ยวพันซึ่งกันและกันเป็นวงจร แต่ไม่สามารถสรุปได้ว่าความผิดปกติใดเป็นจุดเริ่มต้นของวงจรนี้
ในปัจจุบันกลไกที่ทำให้เกิด PCOS ที่ได้รับการยอมรับประกอบด้วยวงจรความผิดปกติของระบบต่อมไร้ท่อ (endocrine disorder) 2 วงจร คือ วงจรของ Hypothalamic-pituitary-ovarian (HPO) axis และวงจรของภาวะดื้อต่ออินซูลิน (insulin resistance) ดังแสดงในรูปที่ 1
รูปที่ 1: วงจรการเกิดความผิดปกติของ polycystic ovary syndrome
ที่มา: Nestler J E, et al. New England journal of medicine 2008; 358: 47-54
จากกลไกที่กล่าวมาทำให้เกิดผล 3 ประการคือ
- เอสโตรเจนมีระดับสูงร่วมกับไม่มีไข่ตกทำให้ผู้ป่วยตกอยู่ในสภาวะ Unopposed estrogen เสี่ยงต่อโรคเยื่อบุโพรงมดลูกหนาตัว (Endometrial hyperplasia) และมะเร็งเยื่อบุโพรงมดลูก (Endometrial cancer)
- แอนโดรเจนอิสระมีระดับสูงขึ้น ทำให้มีอาการแสดงอันเกิดจากฤทธิ์ของฮอร์โมนเพศชาย เช่น เป็นสิว หน้ามัน ขนดก เป็นต้น
- ภาวะดื้อต่ออินซูลินทำให้เสี่ยงต่อภาวะ Metabolic syndrome และมะเร็งเยื่อบุโพรงมดลูก
ลักษณะอาการทางคลินิก
ผู้ป่วยส่วนใหญ่เริ่มมีอาการผิดปกติมาตั้งแต่เริ่มมีระดู (Menarche) แต่บางรายเริ่มมีอาการผิดปกติ เมื่ออายุมากขึ้น ผู้ป่วยแต่ละรายอาจจะมีชนิดและความรุนแรงของอาการที่แตกต่างกัน
ลักษณะทางคลินิกที่พบในผู้ป่วย PCOS มีดังต่อไปนี้
1. ระดูผิดปกติ
ผู้ป่วยส่วนใหญ่จะมีระดูผิดปกติซึ่งพบได้ทุกรูปแบบแต่ที่พบบ่อยคือ รอบระดูห่าง (Oligomenorrhea) หรือขาดระดู (Amenorrhea) พบร้อยละ 45-95(2) มีรอบระดูไม่สม่ำเสมอและ/หรือมีเลือดออกผิดปกติจากโพรงมดลูก (Menometrorrhagia) ร้อยละ 30 ซึ่งมักจะพบตามหลังภาวะขาดระดูและมี breakthrough bleeding จาก Unopposed estrogen(3)
2. ภาวะขนดก (Hirsutism)
เป็นอาการที่บ่งบอกถึงการมีระดับแอนโดรเจนสูงที่พบได้บ่อยที่สุดใน PCOS โดยพบภาวะขนดกประมาณร้อยละ 70 แต่อาจมีอุบัติการณ์แตกต่างกันไปในแต่ละชนชาติ ส่วนภาวะสิวมากพบร้อยละ 50 โดยจะพบที่บริเวณใบหน้า, หน้าอกและหลังส่วนบน
3. ภาวะอ้วน (Obesity)
ผู้ป่วย PCOS มักพบร่วมกับภาวะอ้วน โดยพบได้ร้อยละ 35-76 ลักษณะเป็นอ้วนแบบลงพุงหรือ Android obesity และเพิ่มความเสี่ยงต่อภาวะดื้ออินซูลิน นอกจากนี้ยังมีรายงานการศึกษาพบว่าการเพิ่มขึ้นของ Body mass index (BMI) และการที่มีการสะสมของไขมัน (Visceral adiposity) สัมพันธ์กับการเพิ่มขึ้นของอุบัติการณ์ระดูมาผิดปกติ, ภาวะแอนโดรเจนเกินและภาวะขนดก
4. ภาวะมีบุตรยาก (Infertility)
เนื่องจากภาวะไม่มีไข่ตกเรื้อรังจึงทำให้ผู้ป่วย PCOS มีบุตรยาก นอกจากนี้ผู้ป่วยกลุ่มนี้ยังมีระดับ insulin และ plasminogen activator inhibitor-1 (PAI-1) สูงกว่าปกติพบว่ามีความสัมพันธ์กับการแท้งบุตรและการแท้งซ้ำซากที่อายุครรภ์น้อยๆ นอกจากนี้ยังพบว่าอาจเพิ่มภาวะแทรกซ้อนจากการตั้งครรภ์ เช่น เบาหวานแฝงขณะตั้งครรภ์และภาวะครรภ์เป็นพิษ ซึ่งยังไม่ทราบแน่ชัดว่าเกี่ยวข้องโดยตรงหรือเป็นผลจากภาวะอ้วนที่มักพบในผู้ป่วย PCOS(4)
5. ภาวะเสี่ยงในระยะยาวของผู้ป่วยที่เป็น PCOS ได้แก่
- เบาหวาน
- ความผิดปกติของเมตาบอลิก
- โรคระบบหลอดเลือดหัวใจและความดันโลหิตสูง
การซักประวัติ
- ซักประวัติส่วนตัว ประวัติครอบครัวทั่วไป ประวัติโรคประจำตัว
- ประวัติระดูและประวัติการตั้งครรภ์
- ประวัติลักษณะของแอนโดรเจนเกิน เช่น สิว ผิวมัน ขนดก และศีรษะล้าน
- ประวัติการใช้ยา
การตรวจร่างกาย
- การตรวจร่างกายทั่วไปทุกระบบ วัดความดันโลหิต วัดส่วนสูงและน้ำหนัก คำนวณ Body Mass Index (BMI) ดูว่ามีภาวะอ้วนหรือไม่ วัด Waist-Hip ratio เพื่อดูลักษณะการกระจายของไขมัน
- ตรวจพัฒนาการทางเพศขั้นที่สอง ลักษณะการกระจายของขน สิว ผิวมัน ศีรษะล้านและลักษณะบุรุษเพศ
- ตรวจภายในเพื่อประเมินขนาดของรังไข่ ดูขนาดของ clitoris ว่ามี clitoromegaly
- ตรวจหาอาการแสดงของภาวะการดื้อต่ออินซูลิน อาทิเช่น obesity, centripetal fat distribution, Acantosis nigrican
- ตรวจร่างกายหาลักษณะของ Cushing’s syndrome เพื่อใช้ในการวินิจฉัยแยกโรค เช่น ลักษณะ Moon face, Buffalo hump, Abdominal striae
การวินิจฉัย
ในปัจจุบันใช้เกณฑ์การวินิจฉัยตาม Rotterdam criteria ปี ค.ศ. 2003 (5) กำหนดให้ผู้ป่วยที่ได้รับการวินิจฉัยว่าเป็น PCOS ต้องมีลักษณะทางคลินิกหรือผลการตรวจทางห้องปฏิบัติการเข้าได้ตามเกณฑ์ 2 ใน 3 ข้อและต้องวินิจฉัยแยกโรคอื่นที่อาจทำให้มีลักษณะทางคลินิกเช่นเดียวกับ PCOS
เกณฑ์ในแต่ละข้อมีแนวทางการวินิจฉัยดังต่อไปนี้
1. Oligoovulation หรือ Anovulation ใช้ลักษณะทางคลินิกคือมีรอบระดูห่างหรือขาดไป
2. Hyperandrogenemia หรือ hyperandrogenism มีลักษณะทางคลินิกอันเกิดจากฤทธิ์ของฮอร์โมนแอนโดรเจนมากกว่าปกติ คือ หน้ามัน มีสิวมาก ขนดกมากกว่าปกติ หรือการตรวจสารชีวเคมีในเลือดพบระดับฮอร์โมนแอนโดรเจนสูงกว่าปกติ
3. Polycystic ovary การวินิจฉัย polycystic ovary ได้จากการอัลตราซาวน์ โดยต้องตรวจพบว่ามีรังไข่อย่างน้อย 1 ข้างมีถุงไข่ไม่ต่ำกว่า 12 follicles ที่มีขนาดเส้นผ่านศูนย์กลาง 2-9 มิลลิเมตร และรังไข่มีปริมาตรมากกว่า 10 มิลลิลิตร
การวินิจฉัย PCOS นอกจากเกณฑ์ดังกล่าวแล้วจะต้องวินิจฉัยแยกจากโรคอื่นที่ทำให้มีอาการและอาการแสดงคล้าย PCOS ดังแสดงในตารางที่ 1 จึงต้องซักประวัติตรวจร่างกาย รวมทั้งทำการสืบค้นเพิ่มเติมเพื่อแยกโรคดังกล่าวออกก่อนที่จะวินิจฉัย PCOS
ตารางที่ 1 ภาวะที่ต้องวินิจฉัยแยกโรคก่อนที่จะให้การวินิจฉัยภาวะถุงน้ำรังไข่หลายใบ
|
Androgen secreting tumor |
|
Exogenous androgen |
|
Cushing’s syndrome |
|
Nonclassical congenital adrenal hyperplasia |
|
Acromegaly |
|
Genetic defect in insulin action |
|
Primary hypothalamic amenorrhea |
|
Primary ovarian failure |
|
Thyroid disease |
|
Prolactin disorder |
ที่มา : ดัดแปลงจาก ACOG Practice Bulletin , Number 41 December 2002
การตรวจทางห้องปฏิบัติการ
ในปัจจุบันยังไม่มีการตรวจทางห้องปฏิบัติการอันใดอันหนึ่งที่จะสามารถวินิจฉัย PCOS ได้ จุดมุ่งหมายหลักของการตรวจทางห้องปฏิบัติการก็เพื่อวินิจฉัยแยกภาวะอื่นๆ ออกไปเท่านั้น
การตรวจวัดระดับฮอร์โมน
1. การตรวจเพื่อยืนยันภาวะแอนโดรเจนเกิน
- Total Testosterone/ Free testosterone
- ในผู้ป่วย PCOS จะมีระดับ Testosterone อยู่ในช่วง 50-150 ng/dL แต่ผู้ป่วยที่เป็นเนื้องอกของรังไข่ที่สร้างฮอร์โมนแอนโดรเจนมักจะมีค่าสูงเกิน 200 ng/dL
2. การส่งตรวจเพื่อวินิจฉัยแยกโรคอื่นออกไป
- DHEAS เพื่อวินิจฉัยแยกโรคเนื้องอกของต่อมหมวกไตที่สร้างแอนโดรเจน ซึ่งระดับของ DHEAS มักสูงเกิน 7,000 ng/dl ในขณะที่ PCOS จะต่ำกว่า 500 ng/dl
- 17-OHP เพื่อวินิจฉัยแยกโรค Congenital adrenal hyperplasia ที่เกิดจากการขาดเอนไซม์ 21- hydroxylase ในรายที่ 17-OHP สูงกว่า 200 ng/dl ควรทำACTH stimulation test ต่อ
- Prolactin ในกรณีที่ผู้ป่วยมาด้วยเรื่องขาดระดูเพื่อวินิจฉัยภาวะ hyperprolactinemia แต่ก็มีผู้ป่วย PCOS ประมาณร้อยละ 15-20 ที่มีระดับ prolactin สูงกว่าปกติอยู่ในช่วง 20-40 ng/dl
- Thyroid stimulating hormone (TSH) เพื่อวินิจฉัยภาวะ thyroid dysfunction
- LH : FSH ratio ปกติ LH: FSH ratio 1:1 ซึ่งในผู้ป่วย PCOS จะมีค่าสูงกว่าปกติราว 2:1 หรือมากกว่า 3:1 แต่ไม่ค่อยช่วยในการวินิจฉัยเพราะมีผู้ป่วยร้อยละ 40 ที่มีอัตราส่วนของ LH : FSH ปกติ แต่การวัดระดับ FSH อาจช่วยในการวินิจฉัยแยกภาวะหมดระดูก่อนวัยอันควรในรายที่ปัญหาขาดระดู
- 24 hr urine test for urinary free cortisol เพื่อใช้ในการวินิจฉัยแยกภาวะ Cushing syndrome
3. การตรวจเพื่อประเมินความผิดปกติของ metabolic
- 2-hour oral glucose tolerance test (75 grams)
- การตรวจวัดระดับไขมันในเลือด
4. การตรวจอัลตราซาวน์ เพื่อประเมินลักษณะของรังไข่เพื่อประกอบการวินิจฉัยและช่วยในการวินิจฉัยแยกโรค
การรักษา
เนื่องจากโรคนี้ยังไม่ทราบสาเหตุที่แน่ชัด การรักษาจึงเป็นการรักษาตามอาการหรือภาวะผิดปกติที่พบ และพยายามขจัดสาเหตุหรือปัจจัยเสี่ยงที่ทำให้เกิดโรคเป็นวงจรที่แย่ลงเรื่อยๆ การให้การดูแลรักษา PCOS อาจแบ่งกลุ่มตามปัญหาที่นำผู้ป่วยมาพบแพทย์ โดยแบ่งเป็น 2 กลุ่มคือ
1. กลุ่มผู้ป่วยที่มีอาการแสดงและยังไม่ต้องการมีบุตรขณะที่มาพบแพทย์
แนวทางการรักษาจะมุ่งเน้นการดูแลรักษาตามอาการสำคัญที่นำผู้ป่วยมาพบแพทย์ รวมถึงการดูแลผู้ป่วยเพื่อป้องกันปัญหาที่อาจจะเกิดขึ้นในระยะยาว โดยมีวัตถุประสงค์เพื่อ
- ลดอาการอันเกิดจากภาวะแอนโดรเจนเกิน
- ป้องกันเยื่อบุโพรงมดลูกจากโรคเยื่อบุโพรงมดลูกหนาตัวผิดปกติและมะเร็งเยื่อบุโพรงมดลูก
- ส่งเสริมการปรับเปลี่ยนวิถีชีวิตให้มีน้ำหนักอยู่ในเกณฑ์ปกติ
- ลดปัจจัยเสี่ยงต่อโรคเบาหวาน โรคหัวใจและหลอดเลือด
2. กลุ่มที่ต้องต้องการมีบุตรขณะที่มาพบแพทย์
แนวทางการรักษาจะมุ่งเน้นเพื่อทำให้เกิดการตกไข่และเกิดการตั้งครรภ์ ตลอดจนการดูแลเพื่อไม่ให้เกิดภาวะแทรกซ้อนในขณะตั้งครรภ์
แนวทางการดูแลผู้ป่วยกลุ่มที่มีอาการและยังไม่ต้องการบุตร
1. การดูแลสตรีที่มีประจำเดือนผิดปกติและป้องกันภาวะเยื่อบุโพรงมดลูกหนาตัวผิดปกติ
การรักษาผู้ป่วยกลุ่มนี้จะเน้นไปที่การชักนำให้เกิดเลือดออกจากการหลุดลอกของเยื่อบุโพรงมดลูก เพื่อป้องกันเยื่อบุโพรงมดลูกหนาตัวมากเกินไป
1. ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวม (Combine oral contraception)
การใช้ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวม ถือเป็นหัวใจหลักในการดูแลผู้ป่วย PCOS ในระยะยาว โดยมีกลไกการออกฤทธิ์หลายกลไก อันได้แก่ โปรเจสตินจะกดการหลั่งฮอร์โมน LH (lutinizing hormone) จากต่อมใต้สมองและกดการหลั่งฮอร์โมนแอนโดรเจนจากรังไข่ เอสโตรเจนจะกระตุ้นให้ตับผลิต SHBG (Sex hormone binding globulin) ทำให้แอนโดรเจนในรูปของฮอร์โมนอิสระมีระดับลดลง การใช้ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวมสามารถนำมาใช้ในการรักษาภาวะเลือดออกผิดปกติและป้องกันภาวะเยื่อบุโพรงมดลูกหนาตัวผิดปกติ
ข้อมูลการศึกษาเกี่ยวกับการใช้ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวมแบบ case-control เปรียบเทียบระหว่างกลุ่มผู้ป่วยที่เป็นมะเร็งเยื่อบุโพรงมดลูกกับกลุ่มควบคุมพบว่า ผู้ป่วยที่เคยใช้ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวมจะมีโอกาสเกิดมะเร็งเยื่อบุโพรงมดลูกต่ำกว่า (6-9)แต่ควรหลีกเลี่ยงยาคุมกำเนิดที่มีโปรเจสตินชนิด Norethindrone, Norgestrel และ Levonorgestrel ซึ่งมีฤทธิ์ของแอนโดรเจนสูง ควรเลือกใช้เป็นกลุ่ม Desogestrel, Norgestimate หรือ Gestodene ซึ่งมีฤทธิ์แอนโดรเจนต่ำกว่า หรืออาจเลือกใช้โปรเจสตินในกลุ่มที่มีฤทธิ์ Antiandrogen ซึ่งชนิดที่มีการศึกษาในกลุ่มผู้ป่วย PCOS คือ Cyproterone acetate ในขณะที่โปรเจสตินตัวอื่นๆ ยังมีรายงานการศึกษาน้อย
2. โปรเจสติน
การใช้ยาชนิดฮอร์โมนโปรเจสตินสามารถใช้ในการรักษาภาวะเลือดออกผิดปกติในกลุ่มผู้ป่วย PCOS และป้องกันการเกิดเยื่อบุโพรงมดลูกหนาตัวผิดปกติได้ โดยการให้โปรเจสโตรเจนเป็นรอบๆ ทุก 1-3 เดือนช่วยให้ระดูมาสม่ำเสมอและสามารถปกป้องเยื่อบุโพรงมดลูกได้ โดยการให้ยาทุกเดือนจะมีประสิทธิภาพดีกว่าการให้ยาทุก 3 เดือน การให้การรักษาด้วยโปรเจสโตรเจนเป็นรอบๆ เช่นนี้ไม่สามารถรักษาภาวะขนดก สิว และภาวะดื้อต่ออินซูลินให้ดีขึ้น แต่เหมาะสำหรับผู้ป่วยที่มีข้อห้ามในการใช้ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวม เช่นการให้ Medroxy progesterone acetate (MPA) ให้รับประทานวันละ 5 – 10 มิลลิกรัมเป็นเวลาอย่างน้อย 10 วันทุกเดือน ในกรณีที่รักษาด้วยโปรเจสเทอโรนอย่างเดียวไม่ได้ผลควรให้ทั้งเอสโตรเจนและโปรเจสทินร่วมกันเป็นเวลา 2 – 3 เดือน
3. ยาลดการต้านอินซูลิน (Insulin-sensitizing Agents)
ยาลดการต้านอินซูลินสามารถนำมาใช้ในการรักษาภาวะเลือดออกผิดปกติในกลุ่มผู้ป่วย PCOS แต่ยังไม่มีข้อมูลสนับสนุนเพียงพอถึงการนำยาลดการต้านอินซูลินมาใช้ในการป้องกันเยื่อบุโพรงมดลูกหนาตัวผิดปกติได้ ยารักษาเบาหวานในกลุ่ม insulin-sensitizers ออกฤทธิ์ยับยั้ง hepatic gluconeogenesis ส่งเสริมการนำกลูโคสเข้าสู่เซลล์ โดยแนะนำให้ใช้ยา Metformin (dimenthylbiguanide) ขนาด 500 – 850 มิลลิกรัม รับประทานวันละ 3 เวลาหรือขนาด 1000 มิลลิกรัมรับประทานวันละ 2 เวลา ส่วนยาในกลุ่มอื่นเช่น Troglitazone (Thiazolidinedione) เคยมีการศึกษาในกลุ่มผู้ป่วย PCOS พบว่าทำให้ระดับฮอร์โมนเทสโทสเตอโรนลดลง แต่มีพิษต่อตับจึงถูกถอนออกจากตลาดและพัฒนายาตัวใหม่ขึ้นมาแทนคือ pioglitazone และ rosiglitazone ซึ่งไม่มีผลต่อตับแต่คงต้องรอผลการศึกษาเพิ่มเติม นอกจากนี้ยังมีในกลุ่ม D-chino-inositol ซึ่งเป็นยากลุ่มใหม่มีการศึกษาในกลุ่มผู้ป่วย PCOS พบว่าช่วยให้การควบคุมระดับน้ำตาลดีขึ้น ผู้ป่วยหลายรายมีการตกไข่กลับมาเป็นปกติ(10) ในขณะนี้ยาตัวนี้กำลังอยู่ในระหว่างการศึกษาเพิ่มเติม
4. การใช้ห่วงอนามัยคุมกำเนิดชนิด levonorgestrel (Levonorgestrel IUD)
ห่วงอนามัยคุมกำเนิดชนิด levonorgestrel สามารถนำมาใช้เพื่อป้องกันภาวะเยื่อบุโพรงมดลูกหนาตัวผิดปกติร่วมกับการคุมกำเนิดในสตรีที่มีปัญหาภาวะถุงน้ำรังไข่หลายใบเท่านั้นแต่ไม่สามารถแก้ไขปัญหาเรื่องเลือดออกผิดปกติจากมดลูกได้ ถึงแม้ว่ายังจะไม่มีรายงานการใช้ห่วงอนามัยคุมกำเนิดชนิด levonorgestrel ในการป้องกันเยื่อบุโพรงมดลูกหนาตัวผิดปกติที่เฉพาะเจาะจงในรายที่มีปัญหาภาวะถุงน้ำรังไข่หลายใบก็ตาม แต่จากข้อมูลที่รายงานในปัจจุบันแสดงให้เห็นว่าการใช้ห่วงอนามัยคุมกำเนิดชนิด levonorgestrel สามารถใช้รักษาภาวะเยื่อบุโพรงมดลูกหนาตัวผิดปกติได้(11, 12)
5. การเปลี่ยนแปลงพฤติกรรม; การควบคุมอาหารและการลดน้ำหนัก
การเปลี่ยนแปลงพฤติกรรมการรับประทานอาหารและการออกกำลังกายแบบแอโรบิคในสตรีที่มีภาวะถุงน้ำรังไข่หลายใบและมีโรคอ้วนเพื่อลดน้ำหนักจะสามารถช่วยให้ภาวะประจำเดือนมาไม่ปกติดีขึ้นได้ รวมถึงยังช่วยให้สามารถมีการตกไข่ได้มากขึ้นอีกด้วย การศึกษาทดลองแบบไปข้างหน้าทั้งหมดในสตรีที่มีภาวะถุงน้ำรังไข่หลายใบและมีปัญหาโรคอ้วน พบว่าการลดน้ำหนักทำให้ประจำเดือนมาสม่ำเสมอมากขึ้น และมีการตกไข่สูงขึ้นด้วย(13-17) แต่ในปัจจุบันยังไม่มีข้อมูลในระยะยาวที่บ่งบอกถึงผลการลดน้ำหนักต่อการป้องกันการเกิดเยื่อบุโพรงมดลูกหนาตัวผิดปกติได้ ในปี ค.ศ. 2009 องค์กร Androgen Excess and Polycystic Ovary Syndrome Society (AE-PCOS) ได้ออกแนวทางในการเปลี่ยนแปลงพฤติกรรมผู้ป่วย PCOS ที่มีภาวะอ้วนร่วมด้วยดังมีรายละเอียดในตารางที่ 2
6. การผ่าตัดจี้รังไข่ (Ovarian drilling)
ในปัจจุบันยังไม่มีข้อมูลการศึกษาถึงผลการผ่าตัดจี้รังไข่เพื่อรักษาภาวะประจำเดือนผิดปกติและป้องกันการเกิดเยื่อบุโพรงมดลูกหนาตัวผิดปกติ
ตารางที่ 2: แนวทางในการเปลี่ยนแปลงพฤติกรรมผู้ป่วย PCOS ที่มีภาวะอ้วนร่วมด้วย

ที่มา: Moran. Obesity treatment in PCOS. Fertil Steril 2009; 92:1996-1982
2. การดูแลสตรีที่มีโรคอ้วนและป้องกันการเกิดภาวะเมตาโบลิก (Metabolic syndrome)
การดูแลรักษาสตรีที่มีภาวะถุงน้ำรังไข่หลายใบและโรคอ้วนไม่ควรมุ่งเน้นที่จะดูแลรักษาเพียงอาการที่นำผู้ป่วยมาพบแพทย์ สูติแพทย์ ควรจะดูแลป้องกันสุขภาพของผู้ป่วยในระยะยาวร่วมด้วย เพื่อป้องกันการเกิดภาวะเมตาโบลิกซึ่งเป็นปัจจัยเสี่ยงของการเกิดโรคเบาหวานและการเกิดโรคหัวใจและหลอดเลือด ในปี ค.ศ. 2010 องค์กร AE-PCOS ได้เสนอแนวทางในการประเมินเพื่อหาความเสี่ยงและการป้องกันโรคหัวใจและหลอดเลือดไว้ดังนี้ (18)
- วัดรอบเอวและคำนวณ BMI ทุกครั้งที่มารับการตรวจติดตาม
- เจาะเลือดวัดระดับไขมันในเลือด ถ้าผลปกติให้ตรวจติดตามทุกๆ 2 ปีหรือตรวจซ้ำเมื่อน้ำหนักเพิ่มขึ้น
- ตรวจวัดระดับน้ำตาลโดยใช้วิธี 2-Hour glucose tolerance test (75 กรัม) ในกลุ่มประชากร ดังต่อไปนี้
- BMI มากกว่า 30 kg/m2
- อายุมากกว่า 40 ปี
- มีประวัติเคยเป็นโรคเบาหวานในขณะตั้งครรภ์
- มีประวัติครอบครัวเป็นเบาหวานชนิดที่ 2
- วัดความดันโลหิตทุกครั้งที่มาตรวจ โดยที่ความดันโลหิตควรจะอยู่ในระดับต่ำกว่า 120/80 mmHg
- ประเมินภาวะซึมเศร้า, วิตกกังวลและคุณภาพชีวิตของผู้ป่วยอย่างสม่ำเสมอ
การดูแลสตรีที่มีโรคอ้วนและป้องกันการเกิดภาวะเมตาโบลิกมีแนวทางดังต่อไปนี้
1. การเปลี่ยนแปลงพฤติกรรม, การควบคุมอาหารและลดน้ำหนัก
การลดน้ำหนักร้อยละ 5 – 10 จากน้ำหนักเดิมโดยการควบคุมอาหารและออกกำลังกายจะทำให้ภาวะดื้อต่ออินซูลินดีขึ้น ทำให้ระดับน้ำตาลในเลือดและไขมันในเลือดลดลง ทำให้ไข่ตกมากขึ้น ทำให้ระดูกลับมาปกติและทำให้ภาวะขนดกดีขึ้น
การปรับเปลี่ยนพฤติกรรมการใช้ชีวิตเพื่อให้เกิดการใช้พลังงานในกิจวัตรประจำวันหรือออกกำลังกายให้มากขึ้นจะมีผลต่อระบบการเผาผลาญพลังงาน(19) ส่งผลให้อาการของโรคดีขึ้นทั้งในระยะสั้นและระยะยาว และอาจจะช่วยป้องกันโรคเบาหวานและโรคหลอดเลือดหัวใจในอนาคต
2. ยารับประทานคุมกำเนิดชนิดฮอร์โมนรวม
ยารับประทานคุมกำเนิดชนิดฮอร์โมนรวมนับว่าเป็นยาที่ใช้ในการักษาสตรีที่มีภาวะถุงน้ำรังไข่หลายใบที่บ่อยที่สุดและต้องใช้ระยะเวลายาวนาน แต่มีการศึกษาถึงผลกระทบต่อเมตาโบลิกค่อนข้างน้อยและการศึกษาส่วนใหญ่เป็นการศึกษาในกลุ่มประชากรไม่มากนักและมีระยะเวลาในการตรวจติดตามสั้น ระยะหลังมีการศึกษาเกี่ยวกับการใช้ยารับประทานคุมกำเนิดชนิดฮอร์โมนรวมในการรักษาสตรีที่มีภาวะถุงน้ำรังไข่หลายใบหลายการศึกษาให้ผลไปในทางเดียวกันคือการรับประทานยาคุมกำเนิดชนิดฮอร์โมนรวมไม่ได้ทำให้ภาวะต้านอินซูลินดีขึ้น(20-22) อีกทั้งการใช้ยารับประทานคุมกำเนิดชนิดฮอร์โมนรวมที่มีปริมาณฮอร์โมนเอสโตรเจนในขนาดสูงยังทำให้ภาวะต้านอินซูลินรุนแรงมากขึ้น ดังนั้นการใช้ยารับประทานคุมกำเนิดชนิดฮอร์โมนรวมในการรักษาสตรีที่มีภาวะถุงน้ำรังไข่หลายใบไม่ได้มีผลช่วยให้ภาวะต้านอินซูลินดีขึ้นจึงไม่สามารถใช้ป้องกันหรือลดโอกาสเกิดโรคเบาหวาน ดังนั้นการใช้ยากลุ่มนี้ในผู้ป่วยโรคเบาหวานต้องมีความระมัดระวังและติดตามอย่างใกล้ชิด สำหรับผลในการป้องกันหรือลดโอกาสการเกิดโรคหัวใจและหลอดเลือดยังไม่แน่ชัด แม้จะพบว่าสตรีที่มีภาวะถุงน้ำรังไข่หลายใบมีปัจจัยเสี่ยงของการเกิดโรคหัวใจและหลอดเลือดหลายประการ แต่ยังไม่พบว่าผู้ป่วยกลุ่มนี้จะมีอัตราการเจ็บป่วยหรืออัตราการเสียชีวิตจากโรคหัวใจและหลอดเลือดสูงกว่าประชากรทั่วไป อย่างไรก็ตามผู้ป่วยกลุ่มนี้ควรได้รับการตรวจประเมินหาปัจจัยเสี่ยงของภาวะเมตาโบลิกและโรคหัวใจและหลอดเลือด
3. กลุ่มยาลดภาวะต้านอินซูลิน
แม้ว่าจะมีการศึกษาถึงประสิทธิภาพของยาลดการต้านอินซูลินทำให้ภาวะการต้านอินซูลินดีขึ้นหรือมีความไวต่ออินซูลินเพิ่มขึ้นก็ตาม แต่ข้อมูลการศึกษาที่มีอยู่ในปัจจุบันยังไม่เพียงพอที่จะสรุปการนำยาลดการต้านอินซูลินไปใช้เพื่อป้องกันการเกิดโรคเบาหวานในระยะยาว
3. การดูแลสตรีที่มีภาวะขนดกและสิวมาก
สำหรับสตรีที่เป็น PCOS มีภาวะขนดกและเป็นสิวจากภาวะ Hyperandrogenism ดังนั้นการรักษาตามพยาธิสรีรวิทยาคือ การกดการสร้างแอนโดรเจน แต่การกดการสร้างแอนโดรเจนเพียงอย่างเดียวจะเห็นผลการรักษาช้า โดยใช้เวลาประมาณ 3-6 เดือน ผู้ป่วยจะรู้สึกได้ว่าขนขึ้นช้าลง ไม่ต้องโกนบ่อยแต่ขนจะกลับมาขึ้นเร็วเหมือนเดิมถ้าหยุดใช้ยา นอกจากนี้ผู้ป่วยก็ต้องการเห็นผลการรักษาที่รวดเร็ว ดังนั้นการรักษาภาวะขนดกให้ได้ผลดีและผู้ป่วยมีความพึงพอใจ ต้องใช้วิธีการรักษาหลายอย่างร่วมกันดังนี้
- ยากดการสร้างแอนโดรเจนเพื่อลดปริมาณแอนโดรเจนในกระแสเลือด ได้แก่ ยาเม็ดคุมกำเนิดชนิดฮอร์โมนรวมและยาในกลุ่ม insulin sensitizer
- ยากดการต้านฤทธิ์ของแอนโดรเจน เพื่อกดการออกฤทธิ์ของแอนโดรจนที่ Hair follicle ได้แก่ Spironolactone (Aldosterone antagonist), Flutamidine (An androgen receptor antagonist), Finasteride (5α-reductase inhibitor)
- ครีมทาลดอัตราการเจริญของขน เช่น 13.9% eflornitine hydrochloride ซึ่งสามารถใช้ทาบริเวณใบหน้าได้
- การกำจัดขน (Mechanical hair removal) ได้แก่ การโกน การถอน การทำ แวกซ์ขน แต่วิธีเหล่านี้ไม่ถาวรเนื่องจากขนจะงอกขึ้นมาใหม่ได้อีก การกำจัดขนถาวรทำได้ด้วยการใช้ไฟฟ้า (electrolysis) หรือการใช้จี้ทำลาย hair follicle แต่มีค่าใช้จ่ายสูงและมีผลข้างเคียงคือการเกิดแผลเป็นและรอยดำ จึงควรหลีกเลี่ยงการรักษาด้วยวิธีนี้ในผู้ป่วยที่มีประวัติเกิดแผลเป็นได้ง่าย(23)
สำหรับผู้ป่วย PCOS ที่เป็นสิวนั้นเกิดจากการที่แอนโดรเจนไปเพิ่มการสร้าง sebum จาก pilosebaceous unit ทำให้มีโอกาสเกิดสิวมากขึ้น โดยส่วนใหญ่จะเป็นสิวบริเวณใบหน้า แต่ก็มีผู้ป่วยอีกร้อยละ 50 ที่เป็นสิวบริเวณลำคอ, หน้าอก และหลังส่วนบน ในกรณีที่เป็นสิวรุนแรง การใช้ Isotretinoin จะมีประโยชน์แต่การตองสนองในผู้ป่วยแต่ละรายนั้นไม่เหมือนกัน
แนวทางการดูแลรักษาผู้ป่วย PCOS ในกลุ่มที่ต้องการมีบุตรขณะที่มาพบแพทย์
การรักษาจะมุ่งเน้นที่จะทำให้เกิดการตกไข่และตั้งครรภ์ ตลอดจนการเกิดมีชีพของทารก
การชักนำให้ไข่ตกมีหลายวิธี แบ่งเป็นขั้นตอนทั้งหมด 4 ขั้นตอน
1.การปรับเปลี่ยนพฤติกรรมการรับประทานอาหารและการออกกำลังกาย
การรักษาด้วยวิธีนี้พบว่าการลดน้ำหนักเพียงร้อยละ 5-10 สามารถทำให้มีการตกไข่ร้อยละ 50-60 และพบการตั้งครรภ์ร้อยละ 30-40 การปรับเปลี่ยนพฤติกรรมประกอบด้วย
– การจำกัดอาหาร
โดยองค์กร AE-PCOS แนะนำให้ผู้ป่วย PCOS ที่มีภาวะอ้วนรับประทานอาหารที่มีแคลอรีต่ำกว่าปกติ 500-1000 kcal/day โดยต้องมีสารอาหารครบและจำกัดปริมาณพลังงานที่ได้รับจากไขมันให้น้อยกว่าร้อยละ 30 และจากไขมันอิสระให้น้อยกว่าร้อยละ10 และเพิ่มการรับประทานอาหารที่มีกากใยให้มากขึ้น(24)
– การออกกำลังกาย
การศึกษาส่วนใหญ่จะแนะนำให้ออกกำลังกายควบคู่ไปกับการจำกัดอาหาร ส่วนมากแนะนำให้ออกกำลังกายสม่ำเสมออย่างน้อย 120-150 นาทีต่อสัปดาห์ โดยต้องออกกำลังกายแบบ weight bearing exercise เพื่อที่จะจำกัดน้ำหนักให้คงที่ในระยะยาว ทั้งนี้ต้องคำนึงถึงข้อจำกัดในแง่ของหัวใจและกระดูกไขข้อเนื่องจากผู้ป่วยกลุ่มนี้มักจะมีภาวะอ้วนร่วมด้วย (25-27)
– การใช้ยาและการผ่าตัดเพื่อลดน้ำหนัก
ไม่แนะนำให้ใช้เป็นลำดับแรกเพื่อลดน้ำหนักเพราะมีข้อมูลเกี่ยวกับเรื่องนี้ค่อนข้างน้อย แนะนำให้ใช้ในกรณีที่เป็น morbid obesity (BMI > 40 mg/m2) เพื่อจำกัดน้ำหนักให้คงที่ในระยะยาว ข้อมูลในปัจจุบันสนับสนุนให้ใช้การปรับเปลี่ยนพฤติกรรมการรับประทานอาหารร่วมกับการออกกำลังกายแบบแอโรบิคเป็นทางเลือกแรกในการชักนำให้ไข่ตกในสตรีที่มีภาวะถุงน้ำรังไข่หลายใบ
2. การให้ยาเพื่อชักนำการตกไข่
ยาที่ใช้ในการกระตุ้นไข่ ได้แก่
- Estrogen antagonist เช่น clomiphene citrate
- Gonadotropins โดยใช้ยาในกลุ่ม Recombinant-FSH แล้วตามด้วย hCG หรือ Recombinanat-LH
- Aromatase inhibitor เช่น Letrozole
การกระตุ้นการตกไข่ในผู้ป่วย PCOS จะเริ่มจากการใช้ clomiphene citrate ก่อนเป็นอันดับแรก(24, 28) โดยเริ่มให้ที่ขนาด 50 มิลลิกรัมต่อวันและเริ่มภายในวันที่ 2-5 ของรอบเดือนแล้วค่อยๆ เพิ่มขนาดยาขึ้นจนผู้ป่วยมีไข่ตกหรือไม่เกินวันละ 150 มิลลิกรัม โดยจะพบการตกไข่ร้อยละ 40-50 ซึ่งจะให้ได้ไม่เกิน 6 รอบ ส่วนการใช้ยา Metformin เป็นยาตัวแรกสำหรับชักนำให้เกิดการตกไข่ในผู้ป่วย PCOS นั้นข้อมูลยังคงขัดแย้งกันอยู่แต่พบว่าอัตราการตกไข่จะสูงขึ้นถ้าใช้ยานานขึ้น โดยเริ่มจากการให้ในขนาดต่ำๆ ก่อนและค่อยๆ ปรับเพิ่มขนาดของยาตามดัชนีมวลกาย ในกรณีที่ผู้ป่วยไม่ตอบสนองต่อการใช้ clomiphene citrate เพียงอย่างเดียวบางรายยังอาจตอบสนองต่อการใช้ควบคู่กับ metformin จากการศึกษาแบบ Meta-analysis พบว่าสามารถทำให้อัตราการตกไข่เพิ่มขึ้น 4 เท่าและอัตราการตั้งครรภ์เพิ่มขึ้น 3.6 เท่า(29) แต่การใช้ยา metformin ร่วมกับ clomiphene citrate ในการชักนำการตกไข่ตั้งแต่แรกนั้นไม่ได้ให้ผลดีไปกว่าการใช้ clomiphene citrate เพียงตัวเดียว(30) สำหรับ insulin sensitizing agents ในกลุ่ม Thiazolidinediones นั้นในปัจจุบันยังไม่มีข้อมูลเพียงพอที่จะนำมาใช้ในผู้ป่วย PCOS
เมื่อไม่ตอบสนองต่อยารับประทานก็เปลี่ยนเป็นยาฉีดในกลุ่ม Recombinant-FSH ซึ่งอาจพิจารณาทำ Intrauterine insemination (IUI) ร่วมด้วย แต่ผู้ป่วย PCOS มีความเสี่ยงที่จะเกิดภาวะ Ovarian hyperstimulation syndrome (OHSS) ได้สูง ทางองค์กร American Society of Medicine (ASRM) จึงแนะนำให้ใช้ Low-dose gonadotropin protocol
สำหรับการใช้ยาในกลุ่ม Aromatase inhibitors มีการศึกษาในกลุ่มที่ไม่ตอบสนองต่อ clomiphene citrate และกลุ่มที่ใช้ยา Aromatase inhibitors เป็นยาตัวแรกในกลุ่ม PCOS พบว่ามีประสิทธิภาพดีทั้งสองกลุ่มและอัตราการตกไข่และการตั้งตรรภ์ไม่ต่างกัน (31-33) อย่างไรก็ตามควรพิจารณาความเหมาะสมในด้านราคาและความสะดวกในการใช้ รวมถึงอาการข้างเคียง นอกจากนี้ข้อมูลด้านความปลอดภัยของยาต่อทารกยังมีค่อนข้างน้อย ในกรณีที่การใช้ยาพื่อกระตุ้นการตกไข่ไม่ประสบความสำเร็จอาจพิจารณาใช้วิธีการผ่าตัดเป็นลำดับต่อไป
3. การผ่าตัดเพื่อแก้ไขภาวะฮอร์โมนเพศชายเกินและทำให้เกิดการตกไข่
- Wedge resection คือการผ่าตัดเพื่อตัดบางส่วนของรังไข่ออก การผ่าตัดจะช่วยลดปริมาณแอนโดรเจนเฉพาะที่ลง ทำให้วงจรผิดปกติของ PCOS ถูกทำลายลงได้และมีการตกไข่ตามมา สามารถทำให้ตั้งครรภ์ได้ถึงร้อยละ 80 แต่อย่างไรก็ตามในทางปฏิบัติมักจะเลือกใช้วิธีนี้เฉพาะเมื่อล้มเหลวจากการใช้ยาเท่านั้น
- Laparoscopic ovarian drilling คือการผ่าตัดผ่านกล้องส่องในช่องท้องแล้วเจาะรังไข่ด้วยไฟฟ้าหรือเลเซอร์ มีวัตถุประสงค์เพื่อให้มีการตกไข่เกิดขึ้นเอง จากการศึกษาพบว่าผู้ป่วยมีไข่ตกดีขึ้นร้อยละ 80 และมีอัตราการตั้งครรภ์เพิ่มขึ้นร้อยละ 50 (34) แนะนำให้ใช้วิธีนี้เฉพาะในรายที่ให้ยากระตุ้นไข่ชนิดรับประทานแล้วไม่ได้ผล นอกจากนี้อาจใช้ในกรณีที่ผู้ป่วยต้องการประเมินพยาธิสภาพในอุ้งเชิงกรานร่วมด้วยหรือบ้านอยู่ห่างไกลไม่สามารถมาตรวจติดตามภายหลังการกระตุ้นไข่ได้
สำหรับการรักษาด้วยวิธีการผ่าตัดทั้งสองวิธีนั้นต้องคำนึงถึงผลเสียในระยะยาว ได้แก่การเกิดพังผืดในช่องท้องและอาจทำให้เกิดภาวะ Ovarian failure ได้
4. การใช้เทคโนโลยีการช่วยการเจริญพันธุ์
เนื่องจากการกระตุ้นไข่โดยใช้ Gonadotropin เพิ่มความเสี่ยงในการเกิดการตั้งครรภ์แฝดในผู้ป่วย PCOS บางรายงานมีอุบัติการณ์สูงถึงร้อยละ 10 การทำ Invitro fertilization with single ovum transfer จึงเป็นอีกทางเลือกหนึ่งในการลดความเสี่ยงดังกล่าว อาจพิจารณาทำในรายที่ใช้วิธีการอื่นแล้วไม่ได้ผล, มีพยาธิสภาพในอุ้งเชิงกรานหรือมีความผิดปกติทางฝ่ายชายร่วมด้วย(35) ซึ่งมีรายงานการศึกษาถึงวิธีการกระตุ้นไข่ก่อนทำ IVF หลายวิธี ในปัจจุบันยังไม่มีการศึกษาเปรียบเทียบว่าวิธีการไหนดีที่สุดและมีความเสี่ยงน้อยที่สุด แต่จากการประชุมขององค์กร ASRM ในปี ค.ศ. 2008 มีวิธีที่ได้รับความนิยมมากที่สุดคือวิธี Long FSH desensitization protocol associated with FSH (24)ซึ่งจากการศึกษาแบบ Meta-analysis พบว่าการทำ IVF ในผู้ป่วย PCOS สามารถเก็บ Cumulus-oocyte complex ได้มากกว่าแต่มี Fertilization rate และอัตราการตั้งครรภ์พอๆ กับสตรีที่ไม่ได้มีภาวะ PCOS ร่วมด้วย
สรุป
ภาวะถุงน้ำรังไข่หลายใบหรือ PCOS เป็นโรคที่ยังไม่ทราบสาเหตุที่ชัดเจน แต่เป็นโรคที่พบบ่อยและส่งผลกระทบกับสตรีตั้งแต่ช่วงเข้าสู่วัยรุ่น วัยเจริญพันธุ์และส่งผลกระทบในระยะยาวแก่ผู้ป่วย วิธีการรักษายังเป็นวิธีการรักษาตามอาการและอาการแสดงของผู้ป่วย ยังไม่ทราบวิธีการรักษาที่ดีที่สุด การพิจาณาการให้รักษาจึงต้องเลือกให้เหมาะสมกับผู้ป่วยแต่ละราย และยังต้องมีการตรวจติดตามเฝ้าระวังถึงผลกระทบในระยะยาว นอกจากนี้ยังคงต้องรอข้อมูลการศึกษาวิจัยเพิ่มเติมในอีกหลายประเด็น
เอกสารอ้างอิง
- Ehrmann DA. Polycystic ovary syndrome. N Engl J Med. 2005 Mar 24;352(12):1223-36.
- Vutyavanich T, Khaniyao V, Wongtra-Ngan S, Sreshthaputra O, Sreshthaputra R, Piromlertamorn W. Clinical, endocrine and ultrasonographic features of polycystic ovary syndrome in Thai women. J Obstet Gynaecol Res. 2007 Oct;33(5):677-80.
- Balen AH, Conway GS, Kaltsas G, Techatrasak K, Manning PJ, West C, et al. Polycystic ovary syndrome: the spectrum of the disorder in 1741 patients. Hum Reprod. 1995 Aug;10(8):2107-11.
- Solomon CG. The epidemiology of polycystic ovary syndrome. Prevalence and associated disease risks. Endocrinol Metab Clin North Am. 1999 Jun;28(2):247-63.
- Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome. Fertil Steril. 2004 Jan;81(1):19-25.
- Stanford JL, Brinton LA, Berman ML, Mortel R, Twiggs LB, Barrett RJ, et al. Oral contraceptives and endometrial cancer: do other risk factors modify the association? Int J Cancer. 1993 May 8;54(2):243-8.
- Maxwell GL, Schildkraut JM, Calingaert B, Risinger JI, Dainty L, Marchbanks PA, et al. Progestin and estrogen potency of combination oral contraceptives and endometrial cancer risk. Gynecol Oncol. 2006 Nov;103(2):535-40.
- Tao MH, Xu WH, Zheng W, Zhang ZF, Gao YT, Ruan ZX, et al. Oral contraceptive and IUD use and endometrial cancer: a population-based case-control study in Shanghai, China. Int J Cancer. 2006 Nov 1;119(9):2142-7.
- Weiderpass E, Adami HO, Baron JA, Magnusson C, Lindgren A, Persson I. Use of oral contraceptives and endometrial cancer risk (Sweden). Cancer Causes Control. 1999 Aug;10(4):277-84.
- Pfeifer SM, Dayal M. Treatment of the adolescent patient with polycystic ovary syndrome. Obstet Gynecol Clin North Am. 2003 Jun;30(2):337-52.
- Varma R, Soneja H, Bhatia K, Ganesan R, Rollason T, Clark TJ, et al. The effectiveness of a levonorgestrel-releasing intrauterine system (LNG-IUS) in the treatment of endometrial hyperplasia–a long-term follow-up study. Eur J Obstet Gynecol Reprod Biol. 2008 Aug;139(2):169-75.
- Wildemeersch D, Janssens D, Pylyser K, De Wever N, Verbeeck G, Dhont M, et al. Management of patients with non-atypical and atypical endometrial hyperplasia with a levonorgestrel-releasing intrauterine system: long-term follow-up. Maturitas. 2007 Jun 20;57(2):210-3.
- Crosignani PG, Colombo M, Vegetti W, Somigliana E, Gessati A, Ragni G. Overweight and obese anovulatory patients with polycystic ovaries: parallel improvements in anthropometric indices, ovarian physiology and fertility rate induced by diet. Hum Reprod. 2003 Sep;18(9):1928-32.
- Huber-Buchholz MM, Carey DG, Norman RJ. Restoration of reproductive potential by lifestyle modification in obese polycystic ovary syndrome: role of insulin sensitivity and luteinizing hormone. J Clin Endocrinol Metab. 1999 Apr;84(4):1470-4.
- Palomba S, Giallauria F, Falbo A, Russo T, Oppedisano R, Tolino A, et al. Structured exercise training programme versus hypocaloric hyperproteic diet in obese polycystic ovary syndrome patients with anovulatory infertility: a 24-week pilot study. Hum Reprod. 2008 Mar;23(3):642-50.
- Thomson RL, Buckley JD, Moran LJ, Noakes M, Clifton PM, Norman RJ, et al. The effect of weight loss on anti-Mullerian hormone levels in overweight and obese women with polycystic ovary syndrome and reproductive impairment. Hum Reprod. 2009 Aug;24(8):1976-81.
- Tolino A, Gambardella V, Caccavale C, D’Ettore A, Giannotti F, D’Anto V, et al. Evaluation of ovarian functionality after a dietary treatment in obese women with polycystic ovary syndrome. Eur J Obstet Gynecol Reprod Biol. 2005 Mar 1;119(1):87-93.
- Wild RA, Carmina E, Diamanti-Kandarakis E, Dokras A, Escobar-Morreale HF, Futterweit W, et al. Assessment of cardiovascular risk and prevention of cardiovascular disease in women with the polycystic ovary syndrome: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome (AE-PCOS) Society. J Clin Endocrinol Metab. 2010 May;95(5):2038-49.
- Moran LJ, Pasquali R, Teede HJ, Hoeger KM, Norman RJ. Treatment of obesity in polycystic ovary syndrome: a position statement of the Androgen Excess and Polycystic Ovary Syndrome Society. Fertil Steril. 2009 Dec;92(6):1966-82.
- Armstrong VL, Wiggam MI, Ennis CN, Sheridan B, Traub AI, Atkinson AB, et al. Insulin action and insulin secretion in polycystic ovary syndrome treated with ethinyl oestradiol/cyproterone acetate. QJM. 2001 Jan;94(1):31-7.
- Cibula D, Sindelka G, Hill M, Fanta M, Skrha J, Zivny J. Insulin sensitivity in non-obese women with polycystic ovary syndrome during treatment with oral contraceptives containing low-androgenic progestin. Hum Reprod. 2002 Jan;17(1):76-82.
- Vrbikova J, Stanicka S, Dvorakova K, Hill M, Vondra K, Bendlova B, et al. Metabolic and endocrine effects of treatment with peroral or transdermal oestrogens in conjunction with peroral cyproterone acetate in women with polycystic ovary syndrome. Eur J Endocrinol. 2004 Feb;150(2):215-23.
- Hobbs L, Ort R, Dover J. Synopsis of laser assisted hair removal systems. Skin Therapy Lett. 2000;5(3):1-5.
- Consensus on infertility treatment related to polycystic ovary syndrome. Hum Reprod. 2008 Mar;23(3):462-77.
- Thomson RL, Buckley JD, Noakes M, Clifton PM, Norman RJ, Brinkworth GD. The effect of a hypocaloric diet with and without exercise training on body composition, cardiometabolic risk profile, and reproductive function in overweight and obese women with polycystic ovary syndrome. J Clin Endocrinol Metab. 2008 Sep;93(9):3373-80.
- Norman RJ, Davies MJ, Lord J, Moran LJ. The role of lifestyle modification in polycystic ovary syndrome. Trends Endocrinol Metab. 2002 Aug;13(6):251-7.
- Humphreys L, Costarelli V. Implementation of dietary and general lifestyle advice among women with polycystic ovarian syndrome. J R Soc Promot Health. 2008 Jul;128(4):190-5.
- Palomba S, Orio F, Jr., Falbo A, Russo T, Tolino A, Zullo F. Clomiphene citrate versus metformin as first-line approach for the treatment of anovulation in infertile patients with polycystic ovary syndrome. J Clin Endocrinol Metab. 2007 Sep;92(9):3498-503.
- Ng EH, Wat NM, Ho PC. Effects of metformin on ovulation rate, hormonal and metabolic profiles in women with clomiphene-resistant polycystic ovaries: a randomized, double-blinded placebo-controlled trial. Hum Reprod. 2001 Aug;16(8):1625-31.
- Zain MM, Jamaluddin R, Ibrahim A, Norman RJ. Comparison of clomiphene citrate, metformin, or the combination of both for first-line ovulation induction, achievement of pregnancy, and live birth in Asian women with polycystic ovary syndrome: a randomized controlled trial. Fertil Steril. 2009 Feb;91(2):514-21.
- Baruah J, Roy KK, Rahman SM, Kumar S, Sharma JB, Karmakar D. Endometrial effects of letrozole and clomiphene citrate in women with polycystic ovary syndrome using spiral artery Doppler. Arch Gynecol Obstet. 2009 Mar;279(3):311-4.
- Atay V, Cam C, Muhcu M, Cam M, Karateke A. Comparison of letrozole and clomiphene citrate in women with polycystic ovaries undergoing ovarian stimulation. J Int Med Res. 2006 Jan-Feb;34(1):73-6.
- Badawy A, Abdel Aal I, Abulatta M. Clomiphene citrate or letrozole for ovulation induction in women with polycystic ovarian syndrome: a prospective randomized trial. Fertil Steril. 2009 Sep;92(3):849-52.
- ACOG Practice Bulletin. Clinical management guidelines for obstetrician-gynecologists number 34, February 2002. Management of infertility caused by ovulatory dysfunction. American College of Obstetricians and Gynecologists. Obstet Gynecol. 2002 Feb;99(2):347-58.
- van Santbrink EJ, Fauser BC. Is there a future for ovulation induction in the current era of assisted reproduction? Hum Reprod. 2003 Dec;18(12):2499-502.