Induction of labor : การชักนำการคลอด
Induction of labor : การชักนำการคลอด
นพ. เจษฎา ใจพรหม
ศ.นพ. ธีระ ทองสง
บทนำ
การชักนำการคลอดหรืออาจเรียกง่ายๆ ให้บุคคลทั่วไปเข้าใจว่า การเร่งคลอด หรือ การกระตุ้นคลอด ซึ่งหมายถึงการทำให้เกิดการเจ็บครรภ์คลอดโดยอาศัยเทคนิควิธีต่างๆ ในขณะที่ยังไม่มีการเจ็บครรภ์คลอดเกิดขึ้นเองตามธรรมชาติ ส่วนใหญ่แล้วทำไปโดยต้องมีข้อบ่งชี้ทางการแพทย์ ซึ่งการคลอดหรือยุติการตั้งครรภ์นั้นมีผลดีมากกว่าให้ดำเนินการตั้งครรภ์ต่อ อาจมีบ้างที่แพทย์นัดหญิงตั้งครรภ์เพื่อชักนำการคลอดด้วยเหตุผลในความสะดวกของแพทย์เองหรือหญิงตั้งครรภ์ แต่ไม่เป็นที่แนะนำให้ปฏิบัติกันทั่วไป
ในปัจจุบันมีสถิติการชักนำการคลอดเพิ่มมากขึ้นอาจด้วยมาจากหลายๆ ปัจจัย เช่น ปัญหาสุขภาพของหญิงตั้งครรภ์ หรือ ภาวะแทรกซ้อนทางสูติศาสตร์ จากข้อมูลของประเทศสหรัฐอเมริกา มีการชักนำการคลอดเพิ่มขึ้น 2 เท่า (1) ( 9.5% ในปี 1991 เพิ่มเป็น 23.2% ในปี 2011 ) อย่างไรก็ตามแม้การชักนำการคลอดจะทำเมื่อมีข้อบ่งชี้ โดยที่คำนึงถึงประโยชน์ของมารดาและทารกเป็นหลัก แต่เทคนิคต่างๆ ที่นำมาใช้ ล้วนมีผลข้างเคียงและภาวะแทรกซ้อนเกิดขึ้นได้ ดังนั้นแพทย์ต้องพิจารณาถึงข้อดี ข้อเสีย ของเทคนิคต่างๆ ก่อนตัดสินใจนำมาใช้ และดำเนินการชักนำการคลอดด้วยความระมัดระวัง
นิยามความหมาย
Induction of labor คือ การกระตุ้นให้เจ็บครรภ์คลอด โดยทำให้มดลูกเกิดการหดรัดตัวและหรือทำให้ปากมดลูกนุ่ม ซึ่งในขณะนั้นยังไม่มีการเจ็บครรภ์คลอดตามธรรมชาติเกิดขึ้น
Augmentation of labor คือ การส่งเสริมการเจ็บครรภ์คลอดที่มีอยู่ก่อนแล้วให้มีการหดรัดตัวของมดลูกที่ดีขึ้น
Uterine tachysystole คือ มีการหดรัดตัวของมดลูกมากกว่า 5 ครั้ง ในเวลา 10 นาที เฉลี่ยในช่วงระยะเวลา 30 นาที
Uterine hypertonus คือ การที่มดลูกมีการหดรัดตัวนานกว่า 2 นาที ต่อ 1 ครั้ง
Uterine hyperstimulation คือ การเกิด tachysytole หรือ hypertonus ร่วมกับมี nonreassuring fetal heart rate pattern เกิดขึ้น
Indication (2)
ข้อบ่งชี้สำหรับชักนำการคลอดพิจารณาจากภาวะของมารดาและทารกเป็นสำคัญ ซึ่งได้แก่
- Postterm pregnancy
- Premature rupture of membrane
- Preeclampsia, eclampsia
- Gestational hypertension
- Chorioamnionitis
- Fetal demise
- Abruption placentae
- Maternal medical conditions : eg. Diabetes mellitus, renal disease, chronic pulmonary disease, chronic hypertension, antiphospholipid syndrome
- Fetal compromise : eg. Severe fetal growth restriction, isoimunization, oligohydramnios
Contraindication (2)
ข้อบ่งห้ามสำหรับชักนำการคลอดคล้ายกับข้อห้ามของการคลอดทางช่องคลอด
- Vasa previa
- Placenta previa
- Transverse fetal lie
- Umbilical cord prolapse
- Previous classical cesarean delivery
- Previous myomectomy entering the endometrial cavity
- Active genital herpes infection
การประเมินก่อนทำการชักนำการคลอด
ก่อนชักนำการคลอดควรมีการพิจารณาถึงข้อบ่งชี้ ข้อห้าม โอกาสประสบความสำเร็จของการชักนำคลอด ความเป็นไปได้ของการผ่าตัดคลอด เลือกเทคนิควิธีการชักนำคลอดที่เหมาะสม แล้วมีการให้คำแนะนำและอธิบายแก่หญิงตั้งครรภ์ฟังให้เข้าใจก่อนจะทำการเซ็นต์ยินยอมรับการรักษา นอกจากนี้ การยืนยันอายุครรภ์ที่ถูกต้องก็เป็นสิ่งสำคัญ และที่ขาดไม่ได้คือการตรวจภายในประเมินความพร้อมของปากมดลูก การตรวจสุขภาพของทารกในครรภ์ พึงระลึกไว้ว่าการชักนำคลอดจะต้องทำในที่ที่สามารถตรวจประเมินสุขภาพทารกและการหดรัดตัวของมดลูกได้ตลอดเวลา สามารถผ่าตัดคลอดฉุกเฉินได้กรณีมีข้อบ่งชี้
การประเมินความพร้อมของปากมดลูก
ก่อนชักนำคลอดต้องมีการตรวจภายในประเมินความพร้อมของปากมดลูกเพราะสามารถนำมาใช้ในการทำนายความสำเร็จของการชักนำคลอดได้ โดยประเมินจาก 5 ข้อ ได้แก่ ความนุ่ม ตำแน่งของปากมดลูก การเปิดขยาย การบางตัว และตำแหน่งของส่วนนำทารก (รายละเอียดตามตารางที่ 1) คะแนนเต็มทั้งหมด 13 คะแนน คะแนนยิ่งมากโอกาสชักนำคลอดสำเร็จก็มากขึ้น โดยเฉพาะรายที่มีคะแนนตั้งแต่ 9 เป็นต้นไป ส่วนรายที่คะแนน 4 หรือน้อยกว่า ถือว่าปากมดมดลูกไม่พร้อมสำหรับชักนำคลอด (unfavorable cervix) (2) ซึ่งจำเป็นต้องทำให้ปากมดลูกมีความพร้อมก่อนที่จะเริ่มชักนำคลอด
ตารางที่ 1 (3) Modified Bishop scoring system
{tabulizer:style[gr.alterora.elemental_1_green.css]}
| 1 | 2 | 3 | ||
| Dilation (cm) | Closed | 1-2 | 3-4 | 5-6 |
| Effacement (%) | 0-30 | 40-50 | 60-70 | ≥80 |
| Station* | -3 | -2 | -1, 0 | +1, +2 |
| Cervical consistency | Firm | Medium | Soft | |
| Position of the cervix | Posterior | Midposition | Anterior | |
Pre-induction cervical ripening
1. Prostaglandins
ถือเป็นตัวยาที่ถูกนำมาใช้อย่างแพร่หลายในการทำให้ปากมดลูกพร้อมและชักนำการคลอดเพราะมีฤทธิ์ทำให้ปากมดลูกนุ่มและเปิดขยาย รวมทั้งกระตุ้นให้มีการหดรัดตัวของมดลูก ซึ่งสามารถใช้ได้อย่างปลอดภัยและมีประสิทธิภาพที่ดี โดยที่มีใช้กันแพร่หลายได้แก่
1.1 Prostaglandin E2 : dinoprostone เป็นยาที่มีหลายรูปแบบดังต่อไปนี้
Cervidil : เป็นเม็ดยาขนาด 10 mg ที่อยู่ในชุดอุปกรณ์โดยมีเม็ดยาอยู่ส่วนปลายใช้สอดช่องคลอดแล้วมีส่วนปลายต่อออกมาสำหรับใช้ดึงเมื่อถึงเวลาต้องเอาออกหรือชักนำคลอดสำเร็จ ชุดอุปกรณ์นี้จะค่อยๆปล่อยตัวยาออกมาช้าๆ ในอัตรา 0.3 mg/hr บริหารยาแบบ single dose โดยให้นอนราบอย่างน้อย 30 นาทีถึง 2 ชั่วโมงหลังสอดยา เมื่อครบ 12 ชั่วโมงหรือเจ็บครรภ์คลอดจึงดึงปลายสายออกจากช่องคลอด
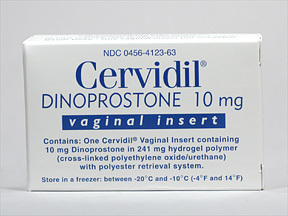

Prepidil : เป็นยารูปแบบเจล บรรจุในหลอดปริมาตร 2.5 ml มีตัวยาอยู่ 0.5 mg ใช้สอดเข้าไปฉีดเจลเข้าในรูปากมดลูก หลังจากฉีดเจลแล้วให้นอนราบ 30 นาที ให้ยาซ้ำได้ทุก 6 ชั่วโมง โดยสามารถให้ซ้ำได้ 3 ครั้งในระยะเวลา 24 ชั่วโมง
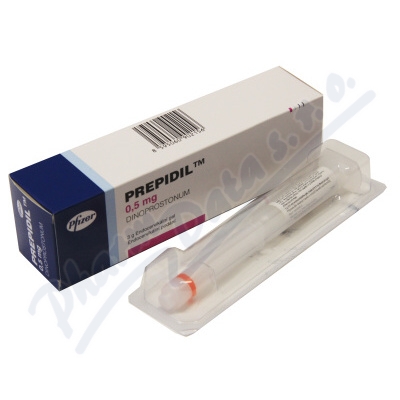
1.2 Prostaglandin E1 : misoprostol
ชื่อการค้าคือ Cytotec เป็นยาที่ถูกคิดค้นมาเพื่อรักษาป้องกันแผลในกระเพราะอาหารและลำไส้ แต่ต่อมาพบว่าทำให้มดลูกหดรัดตัวในหญิงตั้งครรภ์ จนกระทั่งมีการศึกษาและนำมาใช้ประโยชน์ในการชักนำคลอดกันอย่างแพร่หลายในเวลาต่อมา ขนาดเม็ดยา มี 100 และ 200 mcg ในประเทศไทยมีใช้ขนาด 200 mcg เท่านั้น
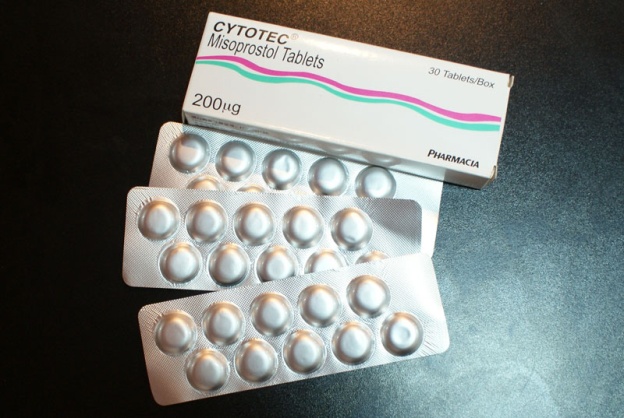
การบริหารยาทำได้ทั้งแบบรับประทานและสอดทางช่องคลอดโดยมีการศึกษาถึงประสิทธิภาพและขนาดของยาที่ใช้ มากมาหลายการศึกษาด้วยกัน สรุปได้ดังนี้
การบริหารยาแบบสอดช่องคลอด
ACOG แนะนำให้เริ่มต้นโดยใช้ยา 25 mcg สอดไปที่ posterior fornix ให้ยาซ้ำได้ทุก 4-6 ชั่วโมง จนกระทั่งได้การหดรัดตัวที่เหมาะสมหรือปากมดลูกพร้อมสำหรับการชักนำคลอดด้วยวิธีอื่นต่อไป การใช้ยาในขนาด 50 mcg สามารถทำได้เช่นกันโดยสามารถลดระยะเวลาตั้งแต่เริ่มชักนำคลอดจนกระทั่งคลอดได้แต่จะเพิ่มโอกาสเกิด tachysyslole และภาวะแทรกซ้อนต่างๆ ต่อทั้งมารดาและทารก
การบริหารยาแบบรับประทาน
จากข้อมูลที่ได้จากการศึกษาพบว่าขนาดยาที่ได้ผลเทียบเท่ากับการสอดยาทางช่องคลอด 25 mcg เพื่อชักนำคลอดคือ รับประทานครั้งละ 100 mcg ให้ยาซ้ำได้ทุก 3-6 ชั่วโมง
2. Balloon catheter
การถ่างขยายปากมดลูกด้วยอุปกรณ์ที่มีปลายเป็นลูกบอลลูน สามารถทำให้ปากมดลูกเปลี่ยนแปลงจนมีความพร้อมในการชักนำคลอดและอาจมีการหดรัดตัวของมดลูกเกิดขึ้น ซึ่งที่นิยมใช้กันก็คือ สายสวนปัสสาวะ (foley catheter) ทำได้โดยสอดปลายสายผ่านรูปากมดลูกเข้าไปจนบอลลูนพ้น internal os แล้วใส่ NSS 30-80 ml เข้าไปในบอลลูน จากนั้นดึงปลายด้านนอกลงเล็กน้อยเพื่อให้เกิดแรงดึงบริเวณปากมดลูกเล็กน้อย เมื่อปากมดลูกมีการเปลี่ยนแปลงและเปิดขยายสายสวนปัสสาวะก็จะหลุดออกมาเอง ต่อมามีการดัดแปลงเพิ่มเติมเทคนิคเรียกว่า Extra-amniotic saline infusion : EASI โดยการปล่อยน้ำให้ผ่านสายสวนปัสสาวะเข้าไป ในอัตรา 30-40 ml/hr เพื่อเพิ่มประสิทธิภาพในการชักนำคลอด
จากการศึกษาพบว่า การใช้เทคนิคนี้ทำให้ Bishop scores ดีขึ้นชัดเจน การใส่น้ำเข้าบอลลูน 80 ml ได้ผลดีมากขึ้น และเทคนิค EASI สามารถชักนำคลอดได้ผลดีขึ้นโดยเฉพาะอย่างยิ่งร่วมกับการให้ oxytocin
3. Hygroscopic dilator
วิธีนี้เป็นอุปกรณ์ถ่างขยายปากมดลูกที่ทำจากสาหร่ายทะเลหรือสารสังเคราะห์ที่มีคุณสมบัติดูดซับน้ำมาจากปากมดลูกทำให้แท่ง dilator มีขนาดใหญ่ขึ้นจนสามารถถ่างขยายปากมดลูกได้เมื่อเวลาผ่านไป และทำให้ปากมดลูกมีความพร้อมในการชักนำคลอดในที่สุด เทคนิควิธีนี้มักใช้ในการยุติการตั้งครรภ์ช่วงไตรมาสที่ 2 สำหรับประโยชน์ในการชักนำคลอด จากการศึกษาไม่พบประโยชน์ที่ชัดเจนมากเท่ากับเทคนิควิธีอื่นๆ (20)
Techniques for induction
1. Oxytocin
การให้ฮอร์โมน oxytocin ทางหลอดเลือดดำถือเป็นวิธีที่นิยมและใช้กันอย่างแพร่หลายในการชักนำคลอด ก่อนที่จะเริ่มใช้วิธีนี้ในรายที่ปากมดลูกไม่พร้อมควรทำให้ปากมดลูกมีความพร้อมเสียก่อน การกระตุ้นให้เจ็บครรภ์คลอดด้วยวิธีนี้เริ่มใช้ได้ผลในรายที่อายุครรภ์ตั้งแต่ 20 สัปดาห์เป็นต้นไปและจะตอบสนองมากขึ้นตามอายุครรภ์ที่เพิ่มขึ้น ยิ่งในรายที่มีการเจ็บครรภ์คลอดมาเองตามธรรมชาติอยู่ก่อนแล้ว จะมีการตอบสนองต่อ oxytocin มากเป็นพิเศษ (4) การที่มดลูกตอบสนองต่อยามากขึ้นตามอายุครรภ์นั้นอธิบายได้จากการที่มี receptor บริเวณกล้ามเนื้อมดลูกเพิ่มจำนวนมากขึ้น (5)
การบริหารยา oxytocin นิยมให้ผ่านทางหลอดเลือดดำ เพราะการรับประทานยาจะถูกย่อยสลายโดยเอนไซม์ในทางเดินอาหาร โดยทั่วไปมักจะผสมยา 10 units ในสารน้ำชนิด isotonic solution ปริมาณ 1,000 ml ผ่านทาง automatic infusion pump เพื่อความถูกต้องแม่นยำในการบริหารยา
การบริหารยามีหลากหลายรูปแบบดังตารางที่ 2 โดยควรปรับยาให้มีการหดรัดตัวของมดลูก 3-5 ครั้งใน 10 นาทีและหดรัดตัวแต่ละครั้ง นาน 40-60 วินาที
ตารางที่ 2 Examples of oxytocin infusion protocols
{tabulizer:style[gr.alterora.elemental_1_green.css]}
| Regimen | Starting dose, milliunits/minute | Incremental increase, milliunits/minute | Dosage interval, minutes |
| Low-dose | 0.5 to 1 | 1 | 30 to 40 |
| Alternative low-dose | 1 to 2 | 2 | 15 to 30 |
| High-dose | 6 | 6 | 15 to 40 |
| The incremental increase should be reduced to 3 milliunits/minute if hyperstimulation is present, and reduced to 1 milliunit/minute if recurrent hyperstimulation. | |||
| Some clinicians limit to a maximum cumulative dose of 10 units and a maximum duration of 6 hours. | |||
| Alternative high-dose | 4 | 4 | 15 |
Oxytocin should be administered by trained personnel who are familiar with its effects. It should be administered using an infusion pump that provides precise flow rate to ensure accurate minute to minute control. Most clinicians will not administer more than 40 milliunits/minute as the maximum dose.
ไม่ว่าจะบริหารยาแบบใดความสำเร็จในการชักนำคลอดนั้นใกล้เคียงกัน แต่ข้อมูลที่มีการศึกษานั้นบ่งชี้ว่า การให้ยาปริมาณสูงและปรับเพิ่มยาบ่อยๆ นั้น ช่วยลดระยะเวลาตั้งแต่เริ่มให้ยาจนกระทั่งคลอดลงได้ เกิด chorioamnionitis น้อยลง การผ่าตัดคลอดจากการคลอดยากน้อยลง แต่เกิด tachysystole บ่อยขึ้นและ เพิ่มการผ่าตัดคลอดจากการเกิด nonreassuring fetal heart rate pattern (6,7)
ข้อถกเถียงระหว่างการให้ oxytocin ต่อเนื่องจนกระทั่งคลอดหรือหยุดให้ยาเมื่อเข้าสู่ระยะเร่งของการคลอดนั้น ยังไม่เป็นที่ตกลงกันแน่ชัดเพราะผลการศึกษาที่ขัดแย้งกัน นั่นคือ การหยุดให้ oxytocin จะทำให้การดำเนินการคลอดยาวนานขึ้น แต่บางการศึกษาก็พบว่าการให้ยาแบบต่อเนื่องจนคลอดนั้นไม่ได้เพิ่มประสิทธิภาพในการชักนำคลอดแต่กลับเพิ่มอัตราการผ่าตัดคลอด (11-14)
2. Amniotomy
การเจาะถุงน้ำคร่ำก็เป็นการชักนำคลอดและส่งเสริมการคลอดที่นิยมใช้กันแพร่หลายอีกวิธีหนึ่ง สามารถทำได้ง่าย ไม่ซับซ้อน เพียงต้องระวังเป็นอย่างมากว่าก่อนจะทำการเจาะถุงน้ำคร่ำ ไม่มีภาวะรกเกาะต่ำ ไม่มีเส้นเลือดทอดผ่านบริเวณที่จะทำหัตถการ ไม่มีสายสะดือลงมาต่ำกว่าส่วนนำของทารก ทั้งก่อนและหลังเจาะถุงน้ำคร่ำต้องทำการฟังเสียงหัวใจทารก ตรวจให้แน่ใจหลังเจาะว่าไม่มีสายสะดือย้อย
จากการศึกษาพบว่า การเจาะถุงน้ำคร่ำร่วมกับการให้ oxytocin สามารถชักนำคลอดได้ผลดีกว่าการเจาะถุงน้ำคร่ำแต่เพียงอย่างเดียว(8) และได้ผลดีกว่าการให้ oxytocin เพียงอย่างเดียว การเจาะถุงน้ำคร่ำควรจะตามด้วยการให้ oxytocin ทันทีโดยไม่ต้องรอ(9) นอกจากนี้การเจาะถุงน้ำคร่ำตั้งแต่ปากมดลูกเปิดช่วงแรกๆ คือ 1-2 cm แต่ไม่เกิน 4 cm สามารถลดระยะเวลาการการคลอดลงได้ 2-4 ชั่วโมง(10)
3. Membrane stripping/sweeping
การเซาะแยกถุงน้ำคร่ำถือเป็นการชักนำคลอดอีกวิธีที่ทำได้ง่าย สามารถทำแบบ OPD case ได้
มีความปลอดภัยและได้ผลดี หลังทำการเซาะแยกถุงน้ำคร่ำจะเป็นการกระตุ้นให้มีการหลั่งเอนไซม์ phospholipase A2 จาก endocervix และ ระดับ prostaglandin F2α จะสูงขึ้น(15) ซึ่งจะกระตุ้นให้มดลูกหดรัดตัวตามมา
วิธีนี้ช่วยลดการตั้งครรภ์เกินกำหนด ลดการใช้ยากระตุ้นคลอด โดยไม่เพิ่มการติดเชื้อในทั้งมารดาและทารก ไม่เพิ่ม PROM ไม่เพิ่มการผ่าตัดคลอด แต่อย่างใด จากข้อมูลการศึกษาในหญิงที่อายุครรภ์มากกว่า 40 สัปดาห์ พบว่า 2/3 เกิดการเจ็บครรภ์คลอดตามมาใน 72 ชั่วโมง ทั้งนี้จะต้องทำการเซาะแยกถุงน้ำคร่ำ 8 ราย เพื่อลดการใช้ยากระตุ้นคลอด 1 ราย(16)
4. Breast stimulation
การกระตุ้นบริเวณเต้านมรวมทั้งหัวนม โดยการนวดคลึงหรือดูด จะกระตุ้นให้ร่างกายมีการหลั่ง oxytocin ข้อมูลการศึกษาที่มีพบว่าสามารถกระตุ้นให้เกิดการเจ็บครรภ์ได้และปากมดลูกมีความพร้อมมากขึ้น(17) ช่วยให้เกิดการเจ็บครรภ์คลอดใน 72 ชั่วโมงกรณีที่ปากมดลูกมีความพร้อม ในขณะที่รายที่ปากมดลูกยังไม่พร้อมการกระตุ้นเต้านมไม่มีประโยชน์ใดๆ ในการชักนำคลอด(18)
Complications
Oxytocin และ Prostaglandins
1. Tachysystole
เป็นภาวะแทรกซ้อนที่ต้องเฝ้าระวังอย่างมากในช่วงที่ชักนำการคลอดเนื่องจากสามารถทำให้ทารกในครรภ์เกิดภาวะฉุกเฉินจากการขาดออกซิเจนจนมีการเต้นของหัวใจที่ผิดปกติไปจนเป็นอันตรายถึงชีวิตได้ในที่สุด
แนวทางการดูรักษา
ให้มารดานอนตะแคงซ้าย ให้สูดดมออกซิเจน
กรณีใช้ prostaglandin ให้นำเม็ดยาออก ส่วนถ้าเป็นแบบเจลอาจทำการสวนล้างเอาตัวเจลออกแต่มักไม่ช่วยให้การหดรัดตัวของมดลูกห่างออกไป
กรณีใช้ oxytocin ให้หยุดการให้ยาหรือลดปริมาณลง ขึ้นกับว่ามีหัวใจทารกเต้นผิดปกติหรือไม่ หาก tachysystole หายไปโดยที่หัวใจทารกเต้นปกติ สามารถเริ่มให้ยาใหม่ได้
หลังจากหยุดยาหรือเอาเม็ดยาออกแล้วยังมี tachysystole อยู่ แนะนำให้ แก้ไขด้วย tocolytic drugs เช่น terbutaline(Bricanyl) 0.25 mg ฉีดใต้ผิวหนังหรือทางหลอดเลือดดำ
หลังจากแก้ไขด้วยวิธีข้างต้นแล้วยังไม่สามารถแก้ไข tachysystole ที่เกิดร่วมกับ nonreassuring fetal heart rate ได้ ก็แนะนำให้ผ่าตัดคลอด
2. Uterine rupture
โอกาสเกิดมดลูกแตกนั้นค่อนข้างน้อย พบได้ในรายที่ใช้ prostaglandin หรือ oxytocin โดยส่วนใหญ่เกิดในรายที่เคยผ่าผ่าตัดบริเวณมดลูกมาก่อนโดยเฉพาะอย่างยิ่งเคยผ่าตัดคลอด
Side effects
1. Oxytocin
Hyponatremia : เนื่องจาก oxytocin มีโครงสร้างคล้ายคลึงกับ vasopressin ซึ่งเป็น antidiuretic hormone จึงสามารถออกฤทธิ์ได้เช่นเดียวกับ vasopressin ก่อให้เกิด severe hyponatremia จากการที่มี excessive water retension หากใช้ในขนาดที่สูง และ ผสมในสารน้ำชนิด hypotonic solution รวมถึงการให้ยาในปริมานรวมที่มากและระยะเวลานาน อาการก็คือ ปวดศรีษะ คลื่นไส้ อาเจียน เบื่ออาหาร ง่วงซึม การรู้ตัวลดลง หากเป็นรุนแรงมากจะมีอาการชักเกร็ง หรือ ระบบประสาทเสียหายรุนแรงได้ หากเกิดภาวะนี้ขึ้น ต้องหยุดยาทันทีรวมถึงหยุดสารน้ำชนิด hypotonic จำกัดการรับประทานน้ำ และแก้ไขภาวะ hyponatremia ด้วย hypertonic salline
Hypotension : เกิดในกรณีให้ยาทางหลอดเลือดดำในอัตราที่เร็วเกินไป แต่เป็นข้อมูลที่ได้จากการศึกษาใน ผู้ชาย หญิงที่ไม่ตั้งครรภ์ และ หญิงตั้งครรภ์ในไตรมาสแรก อย่างไรก็ตามการใช้ยา oxytocin ก็ต้องให้ด้วยความระมัดระวังผ่าน infusion pump แบบช้าๆ เพื่อหลีกเลี่ยงการเกิด tachysystole และ hypotension ที่อาจเกิดขึ้นได้
2. Prostaglandins : ไข้ หนาวสั่น อาเจียน และ ถ่ายเหลว โดยความถี่ของการเกิดอาการข้างเคียง ขึ้นกับชนิดของยาที่ใช้ ขนาดยา และช่องทางการบริหารยา
Failed induction
การล้มเหลวของการชักนำคลอดมักจะสิ้นสุดที่การผ่าตัดคลอด คำนิยามที่ชัดเจนยังไม่เป็นที่ตกลงกัน ปัจจัยที่สำคัญก่อนจะตัดสินว่าการชักนำคลอดนั้นล้มเหลวคือการให้เวลาที่เหมาะสมสำหรับการทำให้ปากมดลูกพร้อมและรอให้การดำเนินการคลอดเข้าสู่ระยะเร่งอย่างแท้จริง
ในการทำ workshop ของ NICHD, SMFM และ ACOG ในปี 2012 ได้นิยามการล้มเหลวของการชักนำคลอดไว้ว่า การที่ไม่สามารถชักนำให้เกิดมดลูกหดรัดตัวอย่างสม่ำเสมอทุก 3 นาที และไม่มีการเปลี่ยนแปลงของปากมดลูกหลังจากให้ oxytocin ไปแล้วอย่างน้อย 24 ชั่วโมง ในกรณีที่ถุงน้ำคร่ำยังไม่แตก หากถุงน้ำคร่ำแตกแล้วให้ถือว่าการชักนำคลอดล้มเหลวเมื่อให้ยา oxytocin ไปแล้ว 12 ชั่วโมง ทั้งนี้เวลาดังกล่าวไม่นับรวมช่วงการเตรียมปากมดลูกก่อนเริ่มชักนำคลอด(18)
เอกสารอ้างอิง
- Martin JA, Hamilton BE, Ventura SJ, et al. Births: Final data for 2011. Natl Vital Stat Rep 2013; 62.
- ACOG Committee on Practice Bulletins — Obstetrics. ACOG Practice Bulletin No. 107: Induction of labor. Obstet Gynecol 2009; 114:386.
- BISHOP EH. PELVIC SCORING FOR ELECTIVE INDUCTION. Obstet Gynecol 1964; 24:266.
- Calderyro-Barcia, R, Sereno, JA. The response of human uterus to oxytocin throughout pregnancy. Oxytocin. Calderyro-Barcia, R, Heller, H (Eds), Pergamon Press, London 1959.
- Fuchs AR, Fuchs F, Husslein P, Soloff MS. Oxytocin receptors in the human uterus during pregnancy and parturition. Am J Obstet Gynecol 1984; 150:734.
- Patka JH, Lodolce AE, Johnston AK. High- versus low-dose oxytocin for augmentation or induction of labor. Ann Pharmacother 2005; 39:95.
- Merrill DC, Zlatnik FJ. Randomized, double-masked comparison of oxytocin dosage in induction and augmentation of labor. Obstet Gynecol 1999; 94:455.
- Howarth GR, Botha DJ. Amniotomy plus intravenous oxytocin for induction of labour. Cochrane Database Syst Rev 2001; :CD003250.
- Selo-Ojeme DO, Pisal P, Lawal O, et al. A randomised controlled trial of amniotomy and immediate oxytocin infusion versus amniotomy and delayed oxytocin infusion for induction of labour at term. Arch Gynecol Obstet 2009; 279:813.
- Macones GA, Cahill A, Stamilio DM, Odibo AO. The efficacy of early amniotomy in nulliparous labor induction: a randomized controlled trial. Am J Obstet Gynecol 2012; 207:403.e1.
- Girard B, Vardon D, Creveuil C, et al. Discontinuation of oxytocin in the active phase of labor. Acta Obstet Gynecol Scand 2009; 88:172.
- Diven LC, Rochon ML, Gogle J, et al. Oxytocin discontinuation during active labor in women who undergo labor induction. Am J Obstet Gynecol 2012; 207:471.e1.
- Daniel-Spiegel E, Weiner Z, Ben-Shlomo I, Shalev E. For how long should oxytocin be continued during induction of labour? BJOG 2004; 111:331.
- Ustunyurt E, Ugur M, Ustunyurt BO, et al. Prospective randomized study of oxytocin discontinuation after the active stage of labor is established. J Obstet Gynaecol Res 2007; 33:799.
- McColgin SW, Bennett WA, Roach H, Cowan BD, Martin JN, Jr., Morrison JC. Parturitional factors associated with membrane stripping. Am J Obstet Gynecol 1993 Jul;169(1):71-7.
- Boulvain M, Stan C, Irion O. Membrane sweeping for induction of labour. Cochrane Database Syst Rev 2005;(1):CD000451.
- Elliott JP, Flaherty JF. The use of breast stimulation to ripen the cervix in term pregnancies. Am J Obstet Gynecol 1983 Mar 1;145(5):553-6.
- Kavanagh J, Kelly AJ, Thomas J. Breast stimulation for cervical ripening and induction of labour. Cochrane Database Syst Rev 2001;(4):CD003392.
- Spong CY, Berghella V, Wenstrom KD, et al. Preventing the first cesarean delivery: summary of a joint Eunice Kennedy Shriver National Institute of Child Health and Human Development, Society for Maternal-Fetal Medicine, and American College of Obstetricians and Gynecologists Workshop. Obstet Gynecol 2012; 120:1181.
- Boulvain M, Kelly A, Lohse C, Stan C, Irion O. Mechanical methods for induction of labour. Cochrane Database Syst Rev 2001;(4):CD001233.