Do we know about Radical hysterectomy?
Do we know about Radical hysterectomy?
พ.ญ. ศรันยา ชิตตระกูล
อาจารย์ที่ปรึกษา ร.ศ. นพ. กิตติภัต เจริญขวัญ
Introduction
Radical hysterectomy คือการผ่าตัดมดลูกแบบกว้างหรือผ่าตัดแบบถอดรากโคน เป็นที่คุ้นเคยกันดีในการรักษา ผู้ป่วยมะเร็งปากมดลูกระยะเริ่มแรก (Early-stage disease) การผ่าตัดมดลูกแบบกว้างได้เริ่มเกิดขึ้นตั้งแต่ปี ค.ศ.1895 โดย Clark ที่ John Hopkins Hospital จากนั้นก็มีคนพัฒนาการผ่าตัดมดลูกแบบกว้างต่อมาเรื่อยๆ ซึ่งคนแรกที่ได้ทำการศึกษาและเก็บรวบรวมเคสรายงานตีพิมพ์คนแรกคือ Werthiemแพทย์ชาวเวียดนามได้ทำการศึกษาที่ประเทศออสเตรีย ถัดจากนั้นก็มีการศึกษาของ Okabayashiที่ประเทศญี่ปุ่น และโดย Meigsที่ประเทศสหรัฐอเมริกา
Radical hysterectomy หมายความว่า การตัดในส่วนของมดลูกรวมทั้งเนื้อเยื่อข้างๆมดลูก (Parametriumie, round, broad, cardinal and uterosacral ligaments)และ ช่องคลอดส่วนบนหนึ่งส่วนสามถึงหนึ่งส่วนสองของความยาว ซึ่งมักจะทำร่วมกับการเลาะต่อมน้ำเหลืองในเชิงกราน (Pelvic lymphadenectomy) อาจจะทำการผ่าตัดผ่านทางหน้าท้อง (Laparotomy) ผ่านกล้องส่องตรวจช่องท้อง (Laparoscopy)หรือผ่านหุ่นยนต์ผ่าตัด (Robotic assist) ในบางรายอาจมีการพิจารณาให้ยาเคมีบำบัดก่อนการผ่าตัด RHPL ( Neoadjuvant chemotherapy , NACT)การผ่าตัดแบบนี้ต้องอาศัยความชำนาญและประสบการณ์ค่อนข้างมาก เพราะต้องตัดให้กว้างเพื่อเอาส่วนที่มักจะมีการกระจายของมะเร็งได้บ่อยออกให้พอ ซึ่งก็จะต้องระมัดระวังกับอวัยวะข้างเคียงที่มักได้รับการบาดเจ็บ เช่น ท่อไต, กระเพาะปัสสาวะ, ลำไส้ใหญ่, เส้นเลือดในอุ้งเชิงกราน และมักมีโอกาสเกิดภาวะแทรกซ้อนหลังผ่าตัดได้มากกว่าการผ่าตัดมดลูกธรรมดา(1)
Indications(1)
Non-malignancy
- Pelvic endometriosis
- Pelvic tuberculosis
Malignancy
- Stage IB or IIA of cervical cancer
- Selected stage II adenocarcinoma of endometrium
- Upper vaginal carcinoma, uterine or cervical sarcomas
- Salvage therapy in irradiation cervical cancer with develop small central pelvic recurrence or central area persistent disease.
Indications
{tabulizer:style[gr.alterora.elemental_1_red.css]}
| Tissue | Cervical conization | Total abdominal/vaginal hysterectomy | Modified radical hysterectomy | Radical abdominal hysterectomy | Radical vaginal trachelectomy | Radical vaginal hysterectomy |
| Cervix uteri | Partially removed | Completely removed | Completely removed | Completely removed | Majority removed | Completely removed |
| Corpus uteri | Preserved | Completely removed | Completely removed | Completely removed | Preserved removed | Completely removed |
| Ovaries and tubes | Preserved | Preserved | Preserved | Preserved | Preserved | Preserved |
| Parametria and paracolpos | Preserved | Preserved | Removed at level of ureter | Removed lateral to ureter | Partially removed | Removed at level of ureter |
| Uterine vessels | Preserved | Ligated at level of cervical internal os | Ligated at level of ureter | Ligated at origin from hypogastric vessels | Descending cervicovaginal branch ligated | Ligated at level of ureter |
| Uterosacral ligaments | Preserved | Ligated at uterus | Divided midway to rectum | Divided near rectum | Partially removed | Partially removed |
| Vaginal cuff | Preserved | None removed | 1-2 cm removed | >2 cm removed | 1-2 cm removed | >2 cm removed |
Ref.TeLinde’s Operative Gynecology 10th edition (2).
{tabulizer:style[gr.alterora.elemental_1_red.css]}
| Indication | Extent of disease |
| Invasive cervical cancer | Stage IA1 with lymphvascular invasion |
| Stage IA2 | |
| Stage IB1 | |
| Stage IB2 (selected) | |
| Stage IIA (selected) | |
| Invasive vaginal cancer | Stage I-II (limited to upper one third of vagina, usually involving posterior vaginal fornix) |
| Endometrial carcinoma | Clinical stage IIB (gross cervical invasion) |
| Persistent or recurrent cervical cancer after radiotherapy | Clinically limited to cervix or proximal vaginal fornix |
Ref.TeLinde’s Operative Gynecology 10th edition (2).
Patient selection(1)
ผู้ป่วยที่เหมาะกับการผ่าตัด RH ในอุดมคติเลยจะเป็นผู้ป่วยอายุน้อย รูปร่างผอม ไม่มีโรคประจำตัว มีความพร้อมที่จะทำกิจกรรมหลังการผ่าตัดได้เร็ว อย่างไรก็ตามก็ยังสามารถให้ทางเลือกนี้ในรายที่อายุมากและไม่มีโรคประจำตัว และประเมินดูแล้วมีความพร้อมต่อการผ่าตัด และรับมือกับภาวะแทรกซ้อนได้ ในคนอ้วนเป็นเพียง Relative contraindication
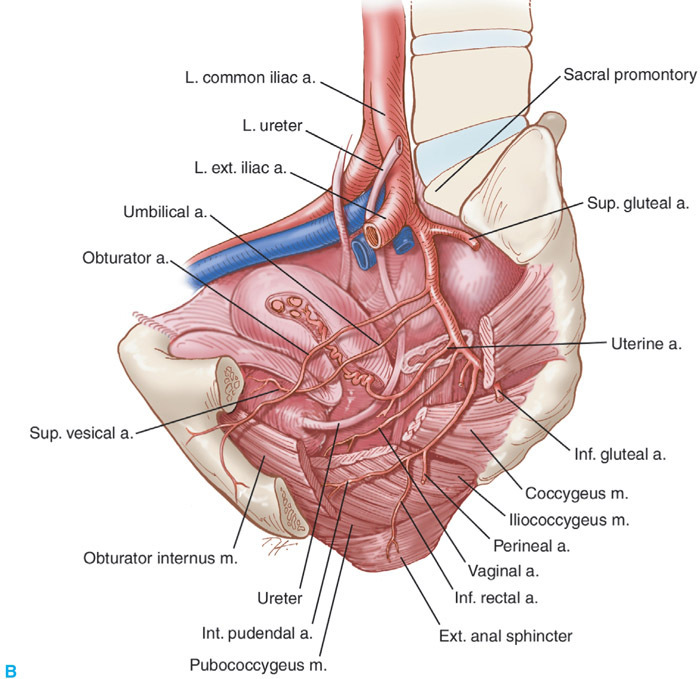
Anatomy review(3)
ความสำคัญที่จะทำให้แพทย์ผู้ผ่าตัดลดอัตราการเกิดภาวะแทรกซ้อนในการทำ Radical Hysterectomy คือการมีความรู้ด้านกายวิภาคของอวัยวะในอุ้งเชิงกราน และโดยเฉพาะอย่างยิ่งในส่วนของบริเวณที่อยู่นอกเยื่อบุช่องท้อง (Retroperitomeumspace) เส้นเลือดสำคัญที่มีบทบาทในการเลาะต่อมน้ำเหลืองในอุ้งเชิงกราน เส้นประสาทและกลุ่มของแขนงประสาทที่มักถูกทำลายระหว่างการผ่าตัด และท่อไตทั้งสองข้าง
การใช้ International Anatomical Nomenclature มีบทบาทสำคัญในการสรุปการแบ่ง Radical Hysterectomy Classification ที่จะกล่าวต่อไป หมายถึงว่าการใช้ศัพท์เกี่ยวกับการบอกถึงกายวิภาคให้เป็นสากล ใช้เหมือนกันทั่วโลก โดยการระบุตำแหน่งที่เปลี่ยนไปคือ ให้เลิกใช้คำว่า Anterior-Posterior, Deep-Superficial , Internal-Externalและเปลี่ยนเป็น Ventral-Dorsal, Cranial-Caudal, Medial-Lateral.และคำศัพท์อื่นๆ คือ
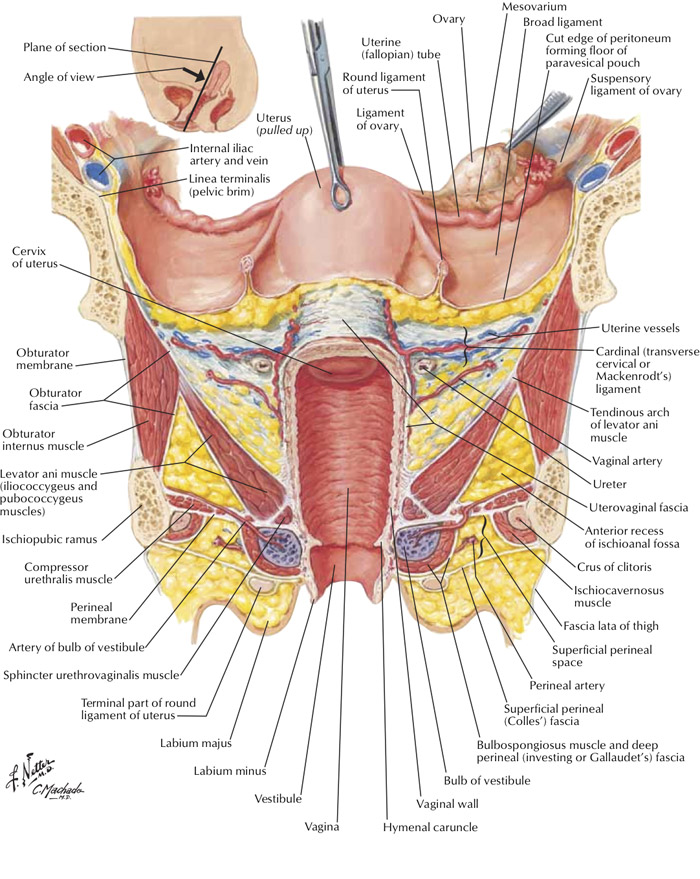
–Paracervix : Tissue that dorsolateral attachment of cervix, Replace Cardinal or Mackenrodt’s ligament .
-Parametrium :refers to tissuesthat surround the uterine artery between the uterinecorpus and pelvic sidewall cranial to the ureter,correspondingto the superficial uterine pedicle (uterineartery and superficial uterine vein) and related connectivetissue and lymph channels.
-Paracolpos/Paracolpium : is included in the paracervix
-Lateral ligament of bladder and rectum : lateral attachment of bladder and rectum
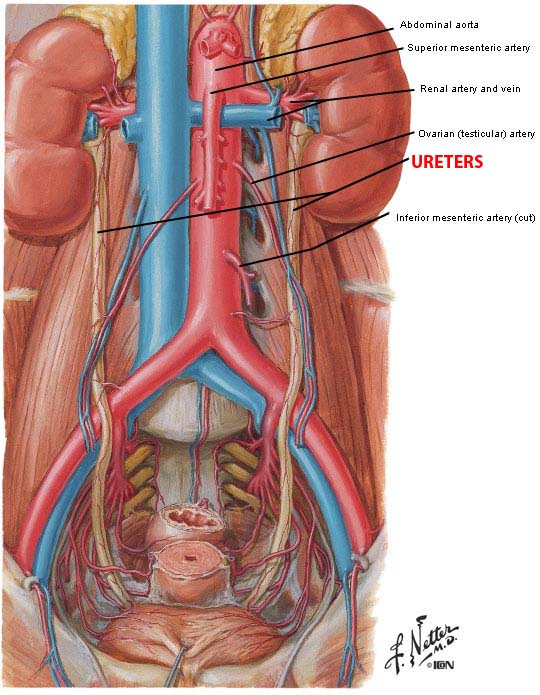
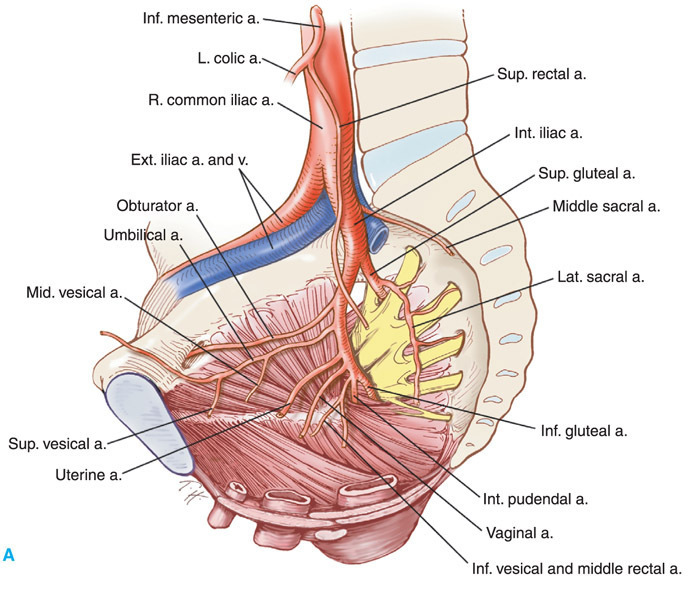
Classification(3)
Querleu and Morrow Classification of Radical Hysterectomy
{tabulizer:style[gr.alterora.elemental_1_red.css]}
| Extent of resection | Ureter | Comment | |
| A-minimum resection of paracervix | Paracervix is transected medial to ureter, but lateral to the cervix; uterosacral and vesicouterine ligaments are not transected at a distance from the uterus; vaginal resection-generally at a minimum, without removal of the paracolpos | Palpation or direct visualisation without freeing from bed | .. |
| B-transection of paracervix at the ureter | Paracervix is transected at the level of the ureteral tunnel; partial resection of uterosacral and vesicouterine ligaments; no resection of caudal (deep) neural component of the paracervix (caudal to the deep uterine vein); vaginal resection-at least 10 mm of the vagina from the cervix or tumour | Unroofing and rolled laterally | The border between paracervical and iliac (parietal) lymph-nodes is the obturator nerve (the combination of paracervical and parietal lymph-node dissections is a comprehensive pelvic-node dissectionand can be equivalent to that of a type C1 resection) |
| B1 | As described above | .. | |
| B2 | As described above and with additional removal of the lateral lymph nodes | .. | |
| C-transection of paracervix at junction with internal iliac vascular system | Transection of the uterosacral ligaments at the rectum; transection of the vesicouterine ligaments at the bladder; resection 15-20 mm of the vagina from the tumour or cervix and corresponding paracolpos | Completely mobilised | .. |
| C1 | With autonomic nerve sparing/preservation | .. | |
| C2 | Without autonomic nerve sparing/preservation | .. | |
| D-laterally extended resection | |||
| D1 | Resection of the paracervix at the pelvic side, with vessels arising from internal iliac system, exposing the roots of the sciatic nerve | Completely mobilised | .. |
| D2 | Resection of the paracervix at the pelvic side, with hypogastric vessels plus adjacent fascial or muscular structures (laterally extended endopelvic resection) | .. | |
Querleu D, Morrow CP. Classification of radical hysterectomy. Lancet Oncol 2008; 9: 297–303
ข้อดีของการรักษามะเร็งปากมดลูกด้วยการผ่าตัด(4)
- การทราบระยะที่แน่นอนของมะเร็งสามารถตรวจการแพร่กระจายและการลุกลามของมะเร็งได้โดยเฉพาะการแพร่กระจายไปที่ต่อมน้ำเหลืองและการลุกลามparametrium
- การอนุรักษ์รังไข่สามารถเก็บรังไข่ไว้สร้างฮอร์โมนได้
- การอนุรักษ์ผนังช่องคลอดหลังผ่าตัดผนังช่องคลอดยังคงมีความยืดหยุ่นไม่แห้งหรือตีบแข็ง
- ก้อนมะเร็งบางชนิดที่อาจดื้อต่อรังสีรักษาการผ่าตัดเอาก้อนมะเร็งออกสามารถลดปัญหาการคงอยู่และการคืบหน้าของมะเร็งปากมดลูกที่รักษาไม่หายด้วยรังสีได้
- ระยะเวลาที่ใช้ในการรักษาสั้นกว่าการผ่าตัดใช้เวลาในการรักษาและอยู่ในโรงพยาบาลประมาณ10-14 วันในขณะที่การรักษาด้วยรังสีจะใช้ระยะเวลาประมาณ6-8 สัปดาห์
- การรักษาโรคทางนรีเวชที่เป็นร่วมด้วยถ้ามีโรคทางนรีเวชที่ต้องรักษาด้วยการผ่าตัดอยู่แล้วเช่นเนื้องอกมดลูกหรือเนื้องอกรังไข่ก็สามารถรักษาไปพร้อมกันในการผ่าตัดรักษามะเร็งปากมดลูก
- ภาวะแทรกซ้อนที่เกิดขึ้นจากการผ่าตัดมักเกิดในระยะแรกหลังการผ่าตัดและสามารถรักษาแก้ไขได้เช่นการติดเชื้อและการตกเลือดเป็นต้นในขณะที่ภาวะแทรกซ้อนของรังสีรักษามักเกิดขึ้นในระยะหลังและรักษาไม่ค่อยหายขาดเช่นการถ่ายปัสสาวะเป็นเลือดจากการอักเสบของกระเพาะปัสสาวะ (radiation cystitis) และการถ่ายอุจจาระเป็นเลือดจากการอักเสบของลำไส้ตรง (radiation proctitis) เป็นต้น
- ความพึงพอใจผู้ป่วยบางคนรู้สึกพึงพอใจที่ก้อนมะเร็งได้ถูกผ่าตัดออกไปจากร่างกายในขณะที่การรักษาด้วยรังสีปากมดลูกและมดลูกยังคงอยู่ที่เดิม
ข้อเสียหรือข้อด้อยของการรักษามะเร็งปากมดลูกด้วยการผ่าตัด(4)
- ระยะของมะเร็งไม่สามารถรักษามะเร็งปากมดลูกได้ทุกระยะสามารถใช้รักษาได้ในระยะที่I ถึงระยะIIA บางรายเท่านั้น
- ความพร้อมของการผ่าตัดสามารถใช้รักษาได้เฉพาะในสถาบันที่มีความพร้อมในการผ่าตัดมะเร็งเท่านั้นเช่นมีแพทย์ผู้เชี่ยวชาญทางมะเร็งวิทยานรีเวชวิสัญญีแพทย์อุปกรณ์ผ่าตัดและคลังเลือด
Operative technique(1)
- ผู้ป่วยอยู่ในท่า Modified dorsal lithotomy
- แพทย์ผ่าตัดที่ถนัดมือขวาให้ยืนด้านซ้ายมือของผู้ป่วยและมีตำแหน่งบริเวณระหว่างขาของผู้ป่วยที่จะมีประโยชน์สำหรับแพทย์ผ่าตัดเวลาเลาะต่อมน้ำเหลืองในอุ้งเชิงกรานและการเลาะแยกกระเพาะปัสสาวะ
- การลงแผลที่หน้าท้องอาจลงแบบแนวขวางหรือแนวยาวตรงกลางก็ได้ แผลแนวขวางก็สามารถทำผ่าตัดได้ในรายที่รูปร่างผอม แต่โดยทั่วไปแผลแนวกลางจะสามารถทำผ่าตัดได้ดีที่สุด แต่จะมีปัญหาด้านความสวยงามมากกว่าในบางรายที่ลงแผลแนวขวางอาจใช้วิธีตัดหรือเลาะแยกกล้ามเนื้อหน้าท้องเพื่อช่วยให้ทำการผ่าตัดได้ง่ายขึ้น (Transverse muscle-splitting)
- เมื่อเปิดเข้าในช่องท้องได้แล้ว ควรสำรวจอวัยวะในช่องท้องทั้งหมด ว่ามีการกระจายของมะเร็งหรือไม่ เท่าที่ทำได้ การผ่าตัดควรหยุดเมื่อตรวจพบมีการกระจายไปที่ต่อมน้ำเหลือง จากการสำรวจหรือจากการส่งชิ้นเนื้อให้พยาธิแพทย์ขณะผ่าตัด (Frozen section)หรือตรวจพบที่อวัยวะในช่องท้อง
ภาวะแทรกซ้อนของการผ่าตัด
ภาวะแทรกซ้อนของการผ่าตัดแบ่งออกเป็น(4-6)
1. ภาวะแทรกซ้อนในขณะผ่าตัดได้แก่
- การตกเลือดจากการฉีกขาดหรือการบาดเจ็บของเส้นเลือด
- การบาดเจ็บต่ออวัยวะในเชิงกรานเช่นท่อไตและกระเพาะปัสสาวะเป็นต้น
2. ภาวะแทรกซ้อนหลังผ่าตัดได้แก่
2.1 ภาวะแทรกซ้อนของกระเพาะปัสสาวะ
- การทำหน้าที่ผิดปกติของกระเพาะปัสสาวะ (bladder dysfunction)
- รูรั่วระหว่างกระเพาะปัสสาวะกับช่องคลอด
2.2 ภาวะแทรกซ้อนของท่อไตอาจเกิด
- รูรั่วระหว่างท่อไตกับช่องคลอดผู้ป่วยจะมีปัสสาวะไหลออกทางช่องคลอดประมาณ1-2 สัปดาห์หลังผ่าตัด
- การตีบแคบของท่อไต(ureteric stricture) ทำให้ท่อไตและไตบวมน้ำจนไตทำงานบกพร่องได้
2.3 ถุงน้ำเหลือง (lymphocyst) เกิดจากการสะสมของสารน้ำในช่องว่างหลังเยื่อบุช่องท้อง
2.4 ภาวะแทรกซ้อนจากการติดเชื้อ(febrile morbidity) พบได้ประมาณร้อยละ25-30 สาเหตุส่วนใหญ่เกิดจากการติดเชื้อของทางเดินปัสสาวะการติดเชื้อในเชิงกรานการติดเชื้อของแผลผ่าตัดและภาวะปอดแฟบ (atelectasis)
2.5 ภาวะหลอดเลือดดำมีลิ่มเลือด (venous thrombosis)
2.6 ภาวะลิ่มเลือดหลุดอุดในปอด (pulmonary embolism) พบในผู้ป่วยที่มีภาวะvenous thrombosis มีประวัติembolism และมีvaricose vein
2.7 การตกเลือดหลังผ่าตัดพบได้น้อย
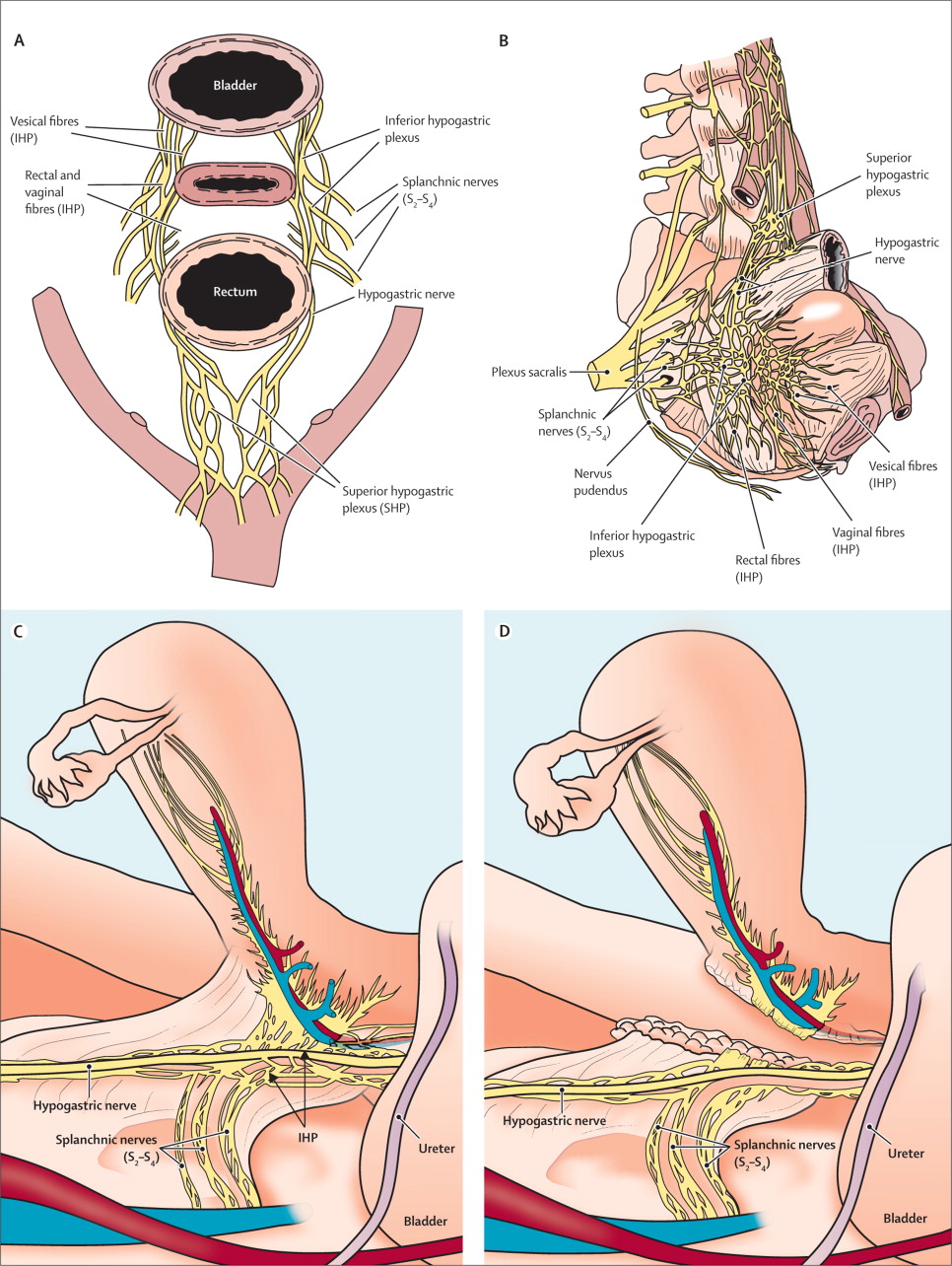
What is nerve-sparing surgery
ภาวะแทรกซ้อนของการผ่าตัดมดลูกแบบกว้างที่ทำให้ผู้ป่วยมักต้องประสบปัญหาที่เกิดตามภายหลังการผ่าตัด ปัญหาที่สำคัญก็คือการปัสสาวะ ภาวะช่องคลอดแห้งหรือความยาวช่องคลอดสั้นลง และบางรายอาจมีปัญหาเกี่ยวกับระบบขับถ่าย เนื่องจากการทำงานของกระเพาะปัสสาวะ, การคั่งของเส้นเลือดที่ผนังช่องคลอด และการทำงานของลำไส้ใหญ่อาจเสียไป จากการที่เส้นประสาทถูกทำลายระหว่างการผ่าตัด จึงได้มีการศึกษาวิธีการเพื่อช่วยให้ลดการทำลายต่อเส้นประสาทกลุ่มนี้ ก็คือการผ่าตัดแบบอนุรักษ์เส้นประสาท โดยแพทย์ที่ทำผ่าตัดต้องมีความรู้และประสบการณ์ในการที่จะระบุตำแหน่งที่เส้นประสาทเหล่านั้นทอดผ่านในอุ้งเชิงกราน และสามารถที่จะตัดเฉพาะเนื้อเยื่อเกี่ยวพันข้างเคียงโดยเลี่ยงไม่ตัดกลุ่มเส้นประสาทสำคัญที่มาเลี้ยงกระเพาะปัสสาวะ, ช่องคลอด และลำไส้ใหญ่(7,8)
{tabulizer:style[gr.alterora.elemental_1_green.css]}
| Procedures and types of nerves which can be injured |
| Presacral lymphadenectomy |
| Superior hypogastric plexus |
| Resection of dorsal paracervix (uterasacral ligaments and rectovaginal ligaments) |
| Hypogastric nerves bilaterally |
| Resection of dorsal paracervix or wasteful preparation of pararectal space |
| Proximal part of the inferior hypogastric plexus and splanchnic nerves |
| Resection of lateral part of the paracervix in space of deep uterine vein |
| Inferior hypogastric plexus and splanchnic nerves |
| Resection of deep vesicouterine ligaments |
| Distal part of the inferior hypogastric plexus |
จากตารางแสดงชนิดของการผ่าตัดที่สัมพันธ์กับตำแหน่งเส้นประสาทที่มักได้รับบาดเจ็บ(7) ผลจากการทำลายหรือบาดเจ็บต่อกลุ่มเส้นประสาทในอุ้งเชิงกรานทำให้เกิดปัญหาหลังการผ่าตัด แบ่งเป็น
1. Bladder dysfunction ภาวะแทรกซ้อนที่พบบ่อยที่สุดของการผ่าตัดมดลูกแบบกว้างคือ ระบบทางเดินปัสสาวะส่วนล่าง (Function disorder of lower urinary tract) พบประมาณ 5-76% (7) pathogenesis ของbladder dysfunction เกิดจาก Multifactorial แต่ก็ไม่มีการสรุปที่ชัดเจน อาการผิดปกติแบ่งเป็นสองระยะ ระยะที่1.Hypertonic phase: เกิดจากระบบพาราซิมพาเทติกที่ทำงานเด่นขึ้นมา ทำให้มีลักษณะของ transient spastic bladder มักเกิดในช่วงหลังผ่าตัดใหม่ๆ 2.Hypotonic phase: ในระยะนี้จะเกิดภาวะ overdistended bladder ทำให้ผู้ป่วยมีปัญหาปัสสาวะไม่ออก หรือออกได้ไม่สุด มักต้องสิ้นสุดด้วยการสวนปัสสาวะเป็นครั้งๆไป
2. Sexual dysfunction ผู้ป่วยมักมีปัญหาทั้งทางกายภาพและการทำงานของช่องคลอด ซึ่งถือเป็นภาวะแทรกซ้อนหลังการผ่าตัดที่สำคัญและมีผลกับคุณภาพชีวิตของผู้ป่วย เนื่องจากกว่า 50% ผู้ป่วยมะเร็งปากมดลูกอายุน้อยกว่า 50 ปี และมากกว่า 90% ของผู้ป่วยไม่มีการกระจายไปที่ต่อมน้ำเหลือง และมีระยะเวลาปลอดโรคที่ยืนยาว การบาดเจ็บหรือทำลายเส้นประสาท Inferior hypogastric plexus ทำให้เกิดผลกระทบกับการควบคุมหลอดเลือดที่มาเลี้ยงผนังช่องคลอด ซึ่งเป็นตัวตอบสนองให้ช่องคลอดมีเลือดมาคั่งและสร้างสารคัดหลั่งเวลามีสิ่งกระตุ้น(9,10)
3. Anorectal dysfunction ข้อมูลศึกษาเกี่ยวกับผลกระทบต่อการทำงานของลำไส้ยังมีอยู่น้อยการศึกษาที่มีอธิบายว่าเกิดจากการที่เลาะตัด paracervix ด้าน Dorsal และ Lateral และเกิดจากการกันให้ลำไส้พ้นจากบริเวณที่ต้องการผ่าตัดได้ไม่เพียงพอ จึงเกิดการบาดเจ็บต่อเส้นประสาทที่มาเลี้ยงลำไส้ อาการที่พบได้ เช่น ปวดเบ่ง ท้องผูก ถ่ายไม่สุด ท้องเสีย แต่ก็มีบางรายงานบอกว่าการผ่าตัดไม่มีผลให้การทำงานของลำไส้ผิดปกติ จะเห็นว่าการแบ่ง classification ล่าสุดของการผ่าตัดมดลูกแบบกว้าง ก็มีการพูดถึงการอนุรักษ์เส้นประสาท ใน class C1 เพราะหากมีการอนุรักษ์เส้นประสาทก็ช่วยลดภาวะแทรกซ้อนหลังการผ่าตัดได้อย่างมีนัยสำคัญ แต่ทั้งนี้การทำผ่าตัดก็ต้องเป็นแพทย์ที่เชี่ยวชาญและมีประสบการณ์การทำมาก่อนเพราะการระบุตำแหน่งของเส้นประสาทถ้าไม่คุ้นเคยก็อาจจะทำให้ได้รับบาดเจ็บต่อเส้นประสาทได้.
เอกสารอ้างอิง
- Up to date
- Te Linde’s Operative Gynecology 10th edition.
- Querleu D, Morrow CP. Classification of radical hysterectomy. Lancet Oncol 2008; 9: 297–303.
- จตุพล ศรีสมบูรณ์. มะเร็งปากมดลูก การวินิจฉัยและการรักษา. กรุงเทพฯ : พี.บี.ฟอเรนบุ๊คส์เซนเตอร์, 2547 : 1-227.
- Randall ME, Michael H, Long HIII, Tedjarati S. Uterine cervix. In: Barakat RR, Markman ME, Randall ME, editors.Principles and practice of gynecologic oncology. Philadelphia: Lippincott Williams & Wilkins; 2009:623-81.
- Hacker NF, Friedlander ML. Cervical cancer. In : Berek JS, Hacker NF, editors. Berek & Hacker’s gynecologic oncology. 5th ed. Philadelphia : Lippincott Williams & Wilkins; 2010 : 341-95.
- Lukas R, Michael H, Helena R. Nerve-sparing and individually tailored surgery for cervical cancer. Lancet Oncol 2010; 11: 292-301.
- Ngan HYS. FIGO Cancer Committee guidelines for early cervical cancer management. In: Global guidance for cervical cancer prevention and control. FIGO 2009: 69-70.
- Pieterse QD, Kuile CP, Deruiter MC, Trimbos JB. Vaginal blood flow after radical hysterectomy with and without nerve sparing.A preliminary report. Int J Gynecol Cancer 2008; 18: 576–83.
- Benedetti-Panici PL, Zullo MA, Muzii L, et al. The role of neoadjuvant chemotherapy followed by radical surgery in the treatment of locally advanced cervical cancer. Eur J Gynaecol Oncol 2003; 24:467–70.