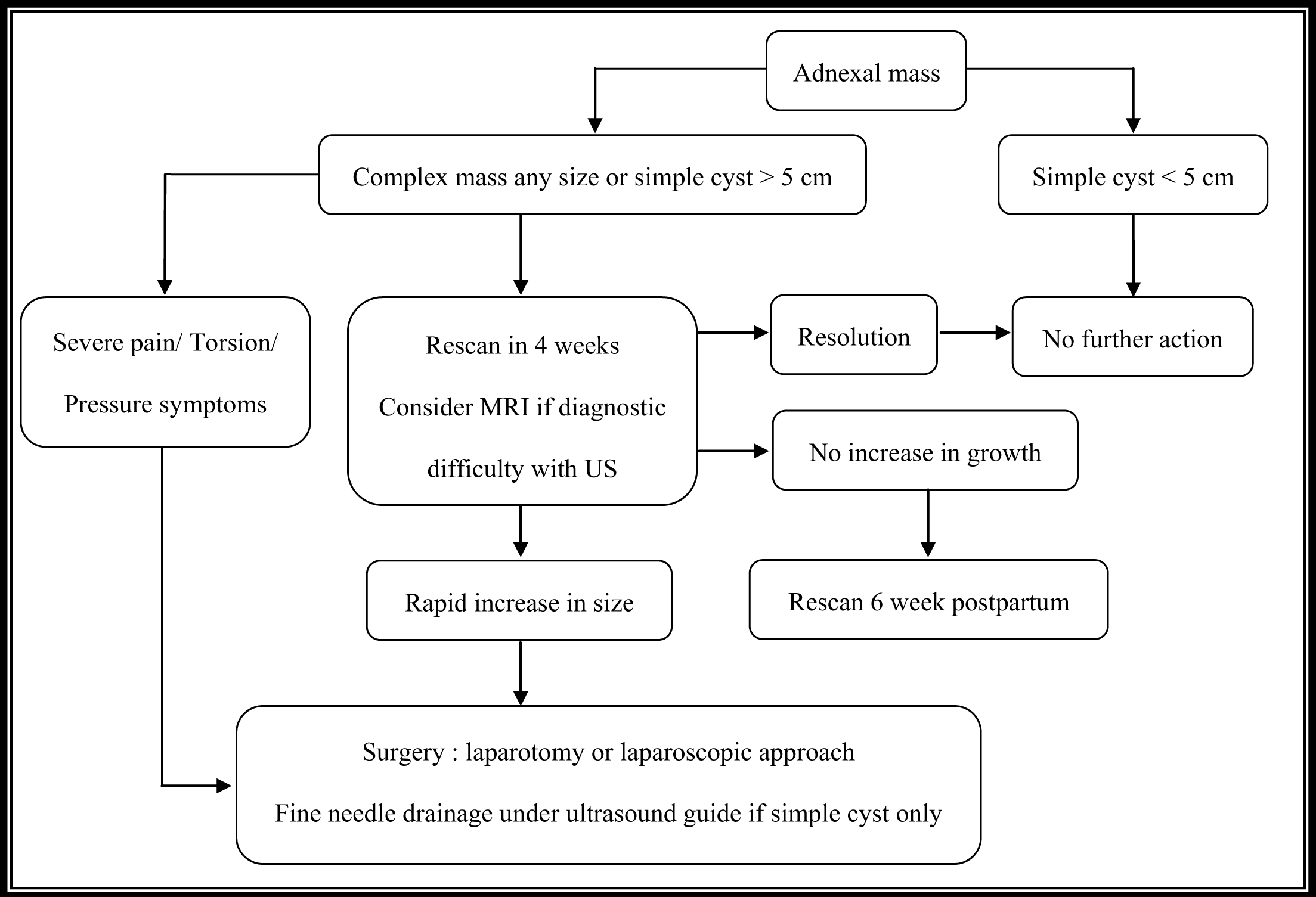
Ovarian reserve for general gynecologist
Ovarian reserve for general gynecologist
นพ.รัตน์พล อ่ำอำไพ
รศ.พญ.สุปรียา วงศ์ตระหง่าน
บทนำ
Reproductive aging เป็นกระบวนการของการที่มีการลดจำนวนลงของ oocytes ทั้งปริมาณและคุณภาพ และจะไม่สามารถสร้างเพิ่มเติมมาใหม่ได้อีก ซึ่งเป็นทฤษฎีที่ได้รับการยอมรับในปัจจุบัน
ปัจจัยต่างได้แก่ พันธุกรรม, ลักษณะการใช้ชีวิต, สภาพแวดล้อม, และภาวะและการรักษาต่างๆ เช่น ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่, การผ่าตัดบริเวณรังไข่หรือปีกมดลูก, เคมีบำบัดและการฉายรังสีในการรักษามะเร็ง ปัจจัยต่างๆเหล่านี้มีผลต่อคุณภาพและปริมาณของ oocytes หรือที่เราเรียกว่า “ovarian reserve” แม้ว่าการลดลง ovarian reserve นี้จะสัมพันธ์กับอายุที่เพิ่มขึ้น ทั้งนี้เมื่อเปรียบเทียบในกลุ่มคนในอายุเดียวกันอาจจะมีความหลากหลายกันไปที่ไม่สามารถคาดการณ์ได้ขึ้นอยู่กับกระบวนการ reproductive aging ของแต่ละคน
Concept of reproductive aging
ปัจจุบันเชื่อว่า Reproductive aging ของผู้หญิงมีความสัมพันธ์กับอายุ เมื่ออายุที่มากขึ้นปริมาณของเซลล์เพศที่ลดลง ในทารกแรกคลอด จำนวนเซลล์เพศจะเหลือประมาณ 1 – 2 ล้าน เมื่อเริ่มเข้าสู่วัยสาว ปริมาณ Oocyte จะลดลงเหลือ 300,000 จากทั้งหมด 6 -7 ล้านฟองที่สามารถตกไข่ได้ ในระหว่าง 35 ถึง 40 ปี ของวัยเจริญพันธุ์ follicles จะถูกคัดเลือกให้ตกไข่จำนวน 400 – 500ฟอง โดยเฉพาะช่วงอายุ 45-46 ปี จะมีจำนวนลดลงเป็นจำนวนมาก ซึ่งช่วงนี้ทำให้เกิดประจำเดือนที่ไม่สม่ำเสมอ และเข้าสู่ช่วงใกล้หมดประจำเดือน และเมื่อถึงจุดวัยหมดประจำเดือนจะมี primary follicles เหลือเพียงไม่กี่ร้อยเท่านั้น [1]
อีกทฤษฎีได้อธิบายเกี่ยวกับ reproductive aging “Neuro-endocrine concept” [2] ซึ่งอธิบายว่า reproductive aging เกิดจากทำงานที่ลดลงของ GnRH pulse generator ใน hypothalamus โดยเกิดจากการลดลงของ neurochemical control ในสมองส่วนอื่นๆ เมื่อเกิดการเปลี่ยนแปลงนี้จะทำให้ปริมาณ FSH เพิ่มขึ้นมากจนเกิด follicle depletion ทำให้ผู้หญิงเขาสู่วัยหมดประจำเดือนในที่สุด
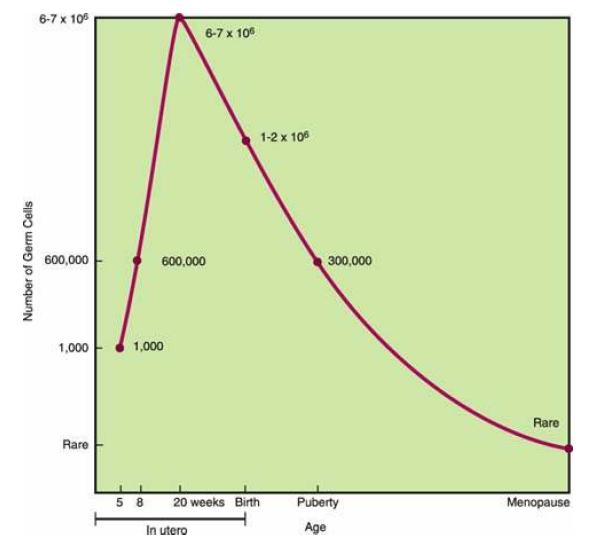
รูปภาพที่ 1 – แสดงจำนวนของ oocyte ในรังไข่ตั้งแต่ก่อนและหลังเกิดไปจนถึงช่วงหมดประจำเดือน [1]
Oocyte/follicle growth and development [3]
ช่วงแรกของ embryonic development germ cell จะมีการแยกตัวจาก somatic cell มีบางส่วนจะเคลื่อนไปอยู่บริเวณ gonadal ridge และเริ่มมีการแบ่งตัวต่อเนื่องแบบ mitotic ขณะที่ fetus มีอายุครรภ์มีอายุ 16-20 สัปดาห์ จะมี oogonia ประมาณ 7 x 106 และเปลี่ยนแปลงไปสู่ primary oocytes ซึ่งช่วงนี้จะมี granulosa cell มาล้อมรอบเรียกว่า Primodial follicle ซึ่งส่วนใหญ่หยุดอยู่ในช่วง Resting phase มีเพียงบางส่วนที่จะมีการแบ่งตัวแบบ meiosis ต่อ และเจริญเติบโตต่อจนถึง ovulation [รูปภาพที่ 2] ซึ่งปัจจุบันยังไม่มีข้อสรุปที่ชัดเจนว่าเหตุใดจึงมี oocyte เพียงบางส่วนที่สามารถเจริญเติบโตต่อไปได้
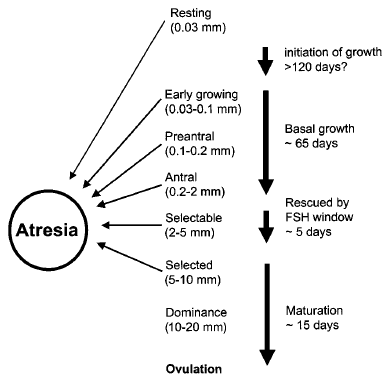
รูปภาพที่ 2 – แสดง phase ต่างๆของ follicle growth และมีการฝ่อลงเหลือเพียงบางส่วนที่จะ ovulation [3]
มีการศึกษาถึงปัจจัยต่างๆที่อาจเป็นทั้งตัวกระตุ้นและตัวยับยั้งของการเจริญเติบโตของ follicle เช่น Follicle stimulating hormone (FSH), Anti – mullerian hormone (AMH), BAX1 and BCL2 และ Wilm’s tumor gene ซึ่งยังไม่ทราบแน่ชัดเกี่ยวกับผลโดยตรงของปัจจัยเหล่านี้ โดยตัวที่มีบทบาทมากที่สุดคือ FSH ซึ่งมีบทบาทสำคัญในการคัดเลือก dominant follicle และบทบาทเกี่ยวกับการเจริญเติบโตของ follicle ด้วย แต่ทั้งนี้ยังมีบางการทดลองที่บอกว่า follicle สามารถเจริญเติบโต ได้โดยไม่ต้องอาศัย gonadotropins ตัวอย่างเช่นใน fetus มีการโตของ follicle ได้ขณะที่ยังไม่มี gonadotropins เป็นต้น
Ovarian reserve testing
ในอดีตมีการใช้ ovarian reserve test ในการตรวจก่อนทำ in vitro fertilization (IVF) และให้การรักษาเฉพาะผู้ที่มีผลการตรวจผิดไปจากค่าปกติ ส่วนในปัจจุบันมักจะใช้ในงานวิจัยการตรวจและการประเมินผลอาจแตกต่างกันไปในแต่ละแห่ง ใช้ในการดูความสามารถในการตั้งครรภ์ การตอบสนองของไข่ต่อการกระตุ้นด้วย gonadotropin โดยการประเมินการตอบสนอง ไม่ว่าจะเป็นนับจำนวน follicles, จำนวนของ oocytes, จำนวน embryo การรายงานผลก็แตกต่างกันไปขึ้นกับการตรวจ [4]
ความรู้ความเข้าใจเกี่ยวกับ ovarian reserve ในปัจจุบันนั้นเกี่ยวกับศักยภาพในการดำรงอยู่ซึ่งภาวะในการสืบพันธุ์โดยคำนึงถึงทั้งจำนวนและคุณภาพของ oocytes ที่ยังคงเหลืออยู่ โดยวัตถุประสงค์ของการตรวจ ovarian reserve คือเพื่อใช้ในการพยากรณ์ศักยภาพภาวะสืบพันธุ์ของเพศหญิงนั่นเอง ซึ่ง ideal screening test ควรจะมีความจำเพาะสูงและมีผลบวกลวงต่ำ
เป้าหมายหลักของการตรวจ ovarian reserve คือสามารถตรวจหาผู้ที่มีปัจจัยเสี่ยงต่อการลดลงของ ovarian reserve (diminished ovarian reserve, DOR) ซึ่งปัจจุบันยังไม่มีนิยามที่ชัดเจนเกี่ยวกับภาวะนี้ อย่างไรก็ตามมีการเปรียบเทียบกับผู้หญิงปกติที่อายุเดียวกันพบว่า DOR มักจะมีประจำเดือนที่ปกติ เพียงแต่มี ovarian follicle ที่ลดลงเท่านั้น จึงส่งผลให้เกิดภาวะมีบุตรยากเพิ่มขึ้น [5]
Biomarker of ovarian response
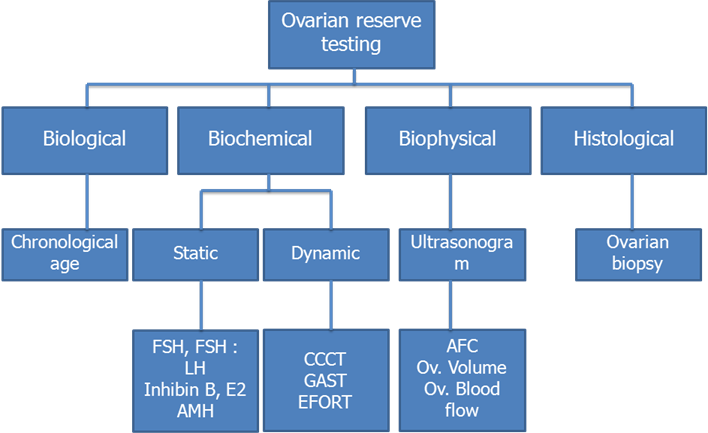
แผนภาพที่ 1 – แสดงการตรวจ ovarian reserve ชนิดต่างๆ (ดัดแปลงจาก [6])
• Basal follicle stimulating hormone
การวัดระดับ basal follicle stimulating hormone (FSH) จะตรวจในช่วงวันที่ 3 ของรอบเดือน ซึ่งมักใช้เป็น ovarian reserve testing เนื่องจาก การเพิ่มขึ้นของระดับ FSH นั้นมีผลต่อ follicle ที่ลดลง โดยเป็นการตรวจวัดที่ทำได้ง่ายและไม่แพง ในปัจจุบันยังไม่มีค่า cut-off ที่แน่ชัด แต่หากผลตรวจที่มีค่ามากกว่า 25 IU/L อาจจะบ่งบอกว่าผลผิดปกติ เนื่องจากหลายงานวิจัยก่อนหน้านี้เกี่ยวกับ FSH พบว่ามีความไวและความจำเพาะค่อนข้างต่ำ จึงอาจจะใช้ในการ screening เพื่อทำการ counseling และมักใช้ตรวจร่วมกับ marker ตัวอื่นๆ
• Estradiol
การวัดระดับ basal estradiol จะตรวจในช่วงวันที่ 2, 3 หรือ 4 ของรอบเดือน เป็นการตรวจ ovarian reserve testing อีกรูปแบบหนึ่ง แต่จากหลายๆงานวิจัยพบว่าไม่มีผลที่แตกต่างกันระหว่าผู้หญิงที่ปกติกับผู้หญิงที่มี DOR จึงไม่นิยมใช้ estradiol เพียงอย่างเดียวในการทำ screening test มักจะใช้ร่วมกับ marker ตัวอื่นเช่น basal FSH ซึ่งโดยปกติแล้วหาก FSH อยู่ในช่วงปกติ แต่ estradiol มีค่าสูง (มากกว่า 60 – 80 pg/mL) ในช่วง early follicular phase อาจบ่งบอกว่าผู้ป่วยมีภาวะมีบุตรยาก
• Anti-Mullerian hormone
Anti-Mullerian hormone (AMH) ที่สร้างจาก granulosa cell ของ preantral และ small antral follicle (AFs) ในรังไข่ กระบวนการสร้างเริ่มต้นตั้งแต่ follicle มีการเปลี่ยนแปลงจาก primodial stage ไปเป็น primary stage และดำเนินไปเรื่อยๆ จนถึง Antral stage (ขนาดของ follicle 2 – 6 มิลลิเมตร) ปริมาณของ AFs ขึ้นอยู่กับขนาดของ primodial follicle pool ซึ่งโดยทั่วไป AFs จะลดลงตามอายุที่เพิ่มขึ้น จนกระทั่งหยุดสร้างเมื่อเข้าสู่วัยหมดประจำเดือน นอกจากนี้ระดับของ AMH ยังมีความสัมพันธ์กับ basal antral follicle count (AFC) ที่วัดได้จากการทำ transvaginal ultrasound
การตรวจหาระดับ AMH สามารถตรวจได้ตลอดซึ่งไม่เหมือนกับ biomarkers ตัวอื่นๆที่ตรวจได้เพียงเฉพาะบางวันของรอบเดือน มีความไวในการตรวจสูงถึงร้อยละ 80 – 87 และมีความจำเพาะร้อยละ 64 – 93 ซึ่งค่าระดับปกติของ AMH อยู่ที่ 0.2 – 1.26 ng/mL ซึ่งหากอยู่ในช่วงค่าปกติจะบ่งชี้ว่า ovarian reserve ยังคงมีเหลือเพียงพอและโอกาสในการใช้เทคโนโลยีการเจริญพันธุ์มีโอกาสสำเร็จมาก แต่ทั้งนี้การตรวจ AMH ยังค่อนข้างจำกัดในแต่ละที่
• Inhibin B
Inhibin B ไม่ได้มีผลต่อ ovarian reserve โดยตรง แต่ระดับของ inhibin B จะสูงขึ้นเมื่อถูกกระตุ้นจาก GnRH และ FSH และพบว่าระดับของ inhibin B จะต่ำในกลุ่มที่ poor ovarian response มีค่า cut-off อยู่ในช่วง 40 – 45 pg/mL มีความไวในการตรวจที่ร้อยละ 40 – 80 และมีความจำเพาะที่ร้อยละ 64 – 90 แต่จากการศึกษาพบว่าในผู้หญิงปกติกับกลุ่ม DOR ได้ค่าที่ไม่แตกต่างกัน จึงไม่ได้แนะนำให้ใช้ inhibin B เป็น Ovarian reserve testing
• Clomiphene citrate challenge test
ใช้ Clomiphene citrate 100 mg เริ่มให้วันที่ 5 ของรอบเดือนไปประมาณ 5 วัน ควรตรวจวัดระดับ basal FSH ในวันที่ 3 ของรอบเดือนก่อนเป็นครั้งแรก แล้วตรวจซ้ำอีกครั้งหลังการกระตุ้นด้วย Clomiphene citrate เพื่อดูระดับของ FSH ในวันที่ 10 ของรอบเดือน หากพบว่าผลผิดปกติอย่างใดอย่างหนึ่ง (หรือทั้งคู่) ก็น่าจะสรุปได้ว่าเป็น poor ovarian response อย่างไรก็ตามผลที่ได้อาจไม่ต่างกับการตรวจเฉพาะ basal FSH ค่าใช้จ่ายสูงกว่าและใช้เวลานานกว่า อีกทั้งผู้ป่วยต้องเสี่ยงต่อผลข้างเคียงของ clomiphene citrate จึงยังไม่เป็นที่นิยมใช้ในปัจจุบัน
|
Test |
Cutpoint |
Poor response |
Nonpregnancy |
Reliability |
Advantages |
Limitations |
||
|
Sensitivity (%) |
Specificity (%) |
Sensitivity (%) |
Specificity (%) |
|||||
|
FSH (IU/L) |
10–20
|
10–80 |
83–100 |
7–58 |
43–100 |
Limited |
Widespread use |
– Reliability – Low sensitivity |
|
AMH (ng/mL) |
0.2–0.7 |
40–97 |
78–92 |
Insufficient evidence |
Insufficient evidence |
Good |
Reliability |
– Limit of detectability – Two commercial assays – Does not predict nonpregnancy
|
|
AFC (n)
|
3–10 |
9–73 |
73–100 |
8–33 |
64–100 |
Good |
– Reliability – Widespread use |
Low sensitivity
|
|
Inhibin B (pg/mL) |
40–45 |
40–80 |
64–90 |
Insufficient evidence |
– |
Limited |
– |
– Reliability – Does not predict nonpregnancy |
|
CCCT, day 10 FSH (IU/L)
|
10–22 |
35–98 |
68–98 |
23–61 |
67–100 |
Limited |
Higher sensitivity than basal FSH
|
– Reliability – Limited additional value to basal FSH – Requires drug administration |
ตารางที่ 1 – สรุปการตรวจ biomarker ชนิดต่างๆ ในการประเมิน ovarian reserve (ดัดแปลงจาก [4])
Ultrasound parameters
• Antral follicle count (AFC)
สามารถตรวจได้โดยการทำ transvaginal ultrasound ในช่วง early follicular phase โดยการนับจากรังไข่ทั้งสองข้างแล้วนำผลมารวมกัน หากพบว่ามี 8 – 10 ฟอง ถือว่าปกติ ส่วนขนาดมีความแตกต่างกันไปในแต่ละการศึกษา (2 – 10 มิลลิเมตร) ปัจจุบันยังไม่มีตัวเลขที่แน่ชัด แต่พบว่าหากวัดขนาดได้ 2 – 6มม. เมื่อตรวจร่วมกับ markers อื่นๆ เช่น อายุ, FSH, CCCT ให้ผลไปในทางเดียวกันคือแนวโน้มต่ำลง ส่วนขนาด 7 – 10 มม. มักพบว่าเป็นปกติ ดังนั้นจึงเป็นการตรวจที่น่าเชื่อถือสำหรับการประเมิน ovarian reserve และเป็นการตรวจที่ดีที่สุดเมื่อเทียบกับการตรวจอื่นๆ เช่น total ovarian volume, basal FSH, estradiol, inhibin B แต่ทั้งนี้หากใช้ AFC ในการพยากรณ์โอกาสในการตั้งครรภ์พบว่ามีความไวและความจำเพาะในการตรวจต่ำ และหากตรวจพบ AFs ที่มากกว่า 14 ฟองขึ้นไปจะเป็นตัวพยากรณ์โอกาสในการเกิด hyper-response ได้ การใช้ 3D ultrasound ในการตรวจ AFC เพื่อใช้ประเมิน ovarian reserve นั้นไม่ได้ดีไปกว่าการใช้ 2D ultrasound
• Ovarian volume
ตรวจได้โดยการทำ transvaginal ultrasound และคำนวณโดยรวม volume ของรังไข่ทั้งสองข้าง ซึ่งโดยปกติขนาดของรังไข่จะไม่เปลี่ยนแปลง จนกว่าเข้าสู่ระยะใกล้หมดประจำเดือน และขนาดของ ovarian volumeที่ลดลงมักจะเกิดขึ้นในผู้หญิงที่มีอายุ 40 ปีขึ้นไป แต่ไม่สามารถนำมาพยากรณ์ AFC ได้ ดังนั้นจึงไม่นิยมนำมาใช้
Ovarian biopsy
ทำได้โดยการผ่าตัดส่องกล้อง (laparoscopy) หรือทำโดยการผ่าตัดเปิดหน้าท้อง (laparotomy) ซึ่งสามารถดู follicular density โดยจะลดลงเมื่ออายุ 35 ปีขึ้นไป และพบว่า ovarian volume ก็ลดลงด้วย อย่างไรก็ตามการกระจายตัวของ follicle ในรังไข่ไม่ได้เป็นแบบสม่ำเสมอ ดังนั้นการทำ ovarian biopsy จึงไม่ได้เป็นตัวบอก follicle density ได้ นอกจากนี้ยังเป็นวิธีที่ invasive จึงไม่ใช้ในการตรวจ ORT
Combined ovarian reserve test
เนื่องจากไม่มีการตรวจใดที่ให้ผลความไวและความจำเพาะในการตรวจได้ 100% ดังนั้นจึงมีการใช้ biomarker ร่วมกับ imaging เสมอ แต่ในปัจจุบันก็ยังมีปัญหาเรื่องการแปลผล เนื่องจากมีค่า cut-off ที่หลากหลาย และมีรายงานว่า การตรวจแบบ combined test โดยตรวจ AMH, inhibin B และวัด AFC ไม่ได้ให้ผลดีไปกว่าการตรวจแต่ละตัวเพียงอย่างเดียว และไม่มีการตรวจใดที่จะสามารถพยากรณ์โอกาสในการตั้งครรภ์ได้ กล่าวโดยสรุป ในปัจจุบันการตรวจแบบ combined test ไม่มีหลักฐานบอกว่าให้ผลดีกว่า single test ซึ่ง combined test อาจจะมีประโยชน์ในทางปฏิบัติแต่ก็มีข้อจำกัดในการตรวจในแต่ละที่
Diminished ovarian reserve (DOR)
ภาวะต่างๆที่ทำให้เพิ่มความเสี่ยงต่อ ovarian reserve ลดลงที่ทราบกันในปัจจุบัน ได้แก่ การรักษาด้วยยาเคมีบำบัดซึ่งมีผลเป็น gonadotoxic agent, การฉายแสงบริเวณรังไข่, การผ่าตัดต่างๆบริเวณรังไข่หรือปีกมดลูก, การติดเชื้อในอุ้งเชิงกราน, ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ (endometriosis) โดยเฉพาะที่เกิดบริเวณรังไข่ และเงื่อนไขทางพันธุกรรมบางอย่างเช่น Turner syndrome (45, X mosaicism). FMR1 (Fragile X) ซึ่งสัมพันธ์กับ ovarian reserve ที่ลดลงและในกรณีที่มีมีการลดลงของ ovarian reserve ก่อนวัยอันควรหรือหาสาเหตุไม่ได้ มีการแนะนำให้ตรวจคัดกรองพันธุกรรมหา FMR1 carrier gene
สาเหตุอื่นๆที่ทำให้ ovarian reserve ลดลง ได้แก่ การสูบบุหรี่ และประวัติทางครอบครัวเกี่ยวกับการหมดประจำเดือนก่อนวัยอันควร [7]
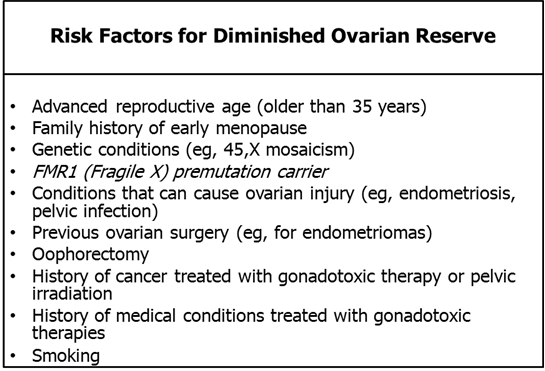
ตารางที่ 2 – สรุปปัจจัยเสี่ยงการเกิด DOR (ดัดแปลงจาก [5])
• อายุ
ข้อมูลในอดีตพบว่าอายุมีความสัมพันธ์กับภาวะมีบุตรยาก โดยแปรผันโดยตรงกับอายุที่เพิ่มขึ้น นั่นอาจเป็นเพราะว่าเมื่ออายุเพิ่มขึ้นทำให้มี sexual activity ที่ลดลง นอกจากนี้แล้วเมื่ออายุเพิ่มมากขึ้นก็ทำให้มีความเสี่ยงต่อโรคอื่นๆที่ผลต่อภาวะมีบุตรยากร่วมด้วย เช่น เนื้องอกมดลูก, โรคของท่อนำไข่, เยื่อบุโพรงมดลูกเจริญผิดที่ นอกจากนี้อายุที่เพิ่มมากขึ้นยังมีความเสี่ยงของการเกิด spontaneous abortion, การเกิด aneuploidy โดยเฉพาะกลุ่ม autosomal trisomy กล่าวโดยสรุปคือโอกาสในการตั้งครรภ์นั้นจะลดลงตามอายุที่เพิ่มมากขึ้น เนื่องจากมี oocyte atresia โดยเฉพาะอย่างยิ่งในช่วงวัยใกล้หมดประจำเดือน ซึ่งจะมีประจำเดือนมาไม่สม่ำเสมอ
ดังนั้น American College of Obstetricians and Gynecologists and the American Society for Reproductive Medicine [8] จึงมีคำแนะนำดังนี้
- ให้ความรู้และให้ตระหนักถึงเรื่องอายุที่เพิ่มมากขึ้นส่งผลต่อการตั้งครรภ์
- ในผู้หญิงที่มีอายุมากกว่า 35 ปีขึ้นไป ควรได้รับการตรวจเพิ่มเติมและใช้เทคโนโลยีในการช่วยเจริญพันธุ์หากไม่สามารถตั้งครรภ์ได้หลังจากรักษามามากกว่า 6 เดือน หรือเร็วกว่านั้นหากมีข้อบ่งชี้
- ในผู้หญิงที่มีอายุมากกว่า 40 ปีขึ้นไป ควรได้รับการตรวจเพิ่มเติมในทันทีและใช้เทคโนโลยีในการช่วยเจริญพันธุ์ด้วยวิธีที่สมควร
• ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่
ภาวะเยื่อบุโพรงมดลูกเจริญผิดที่มีความสัมพันธ์กับภาวะมีบุตรยาก โดยเกิดจากหลายกลไกโดยเฉพาะอย่างยิ่งการอุดตันท่อนำไข่จากพังผืดในอุ้งเชิงกราน ส่งผลต่อการเคลื่อนตัวและฝังตัวของ embryo การติดเชื้อและการอักเสบภายในอุ้งเชิงกรานทำให้มีการหลั่ง cytokine เพิ่มขึ้น และลดจำนวนของ follicle ลง, การตั้งครรภ์ลดลง, ความสำเร็จในการใช้เทคโนโลยีการเจริญพันธุ์ลดลง รวมถึงเพิ่มความเสี่ยงของ primary ovarian failure
ในปัจจุบันปัญหาการมีบุตรยากเกิดจาก การลดลงของ ovarian reserve ซึ่งภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ เป็นปัญหาที่สำคัญหนึ่งในนั้น มีรายงานว่าการผ่าตัด cystectomy ในภาวะนี้ ก่อให้เกิดความเสียหายต่อเซลล์ไข่และ follicle ส่งผลให้มีระยะเวลาที่สามารถสืบพันธ์ได้ลดลง รวมถึงอาจมีโอกาสเกิด primary ovarian failure ด้วย แต่จะช่วยในเรื่องการลดการกลับเป็นซ้ำและ เพิ่มโอกาสในการตั้งครรภ์เองได้ แต่ไม่สามารถเพิ่มอากาสในการสำเร็จของ IVF [9]
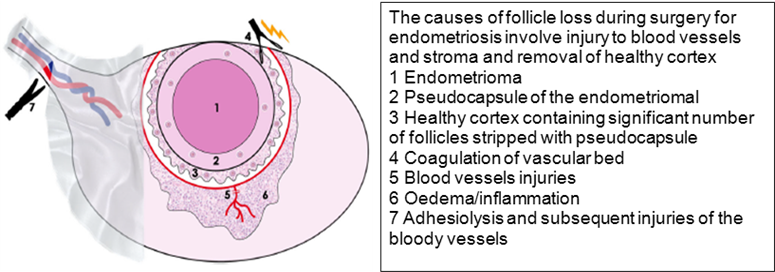
รูปภาพที่ 3 – แสดงภาพและสรุปกลไกลการเกิด follicle loss จากการผ่าตัด [10]
การผ่าตัด bilateral endometriomas ก่อให้เกิดความเสียหายเป็นวงกว้าง โดยเฉพาะอย่างยิ่งการผ่าตัดโดยใช้จี้ไฟฟ้า เนื่องจากผนังของ endometrioma จะประกอบด้วย follicle ซึ่งจะถูกตัดออกไปด้วย ในการตรวจทางพยาธิวิทยาพบว่าปริมาณของ follicle cell ที่ติดไปกับ cyst wall มีความสัมพันธ์กับอายุ ยิ่งอายุน้อยปริมาณเซลล์ก็ยิ่งมาก ซึ่งกลุ่มผู้หญิงอายุน้อยมีโอกาสเกิดโรคซ้ำประมาณร้อยละ 30-50 ดังนั้นจึงมีความเสี่ยงในการผ่าตัดซ้ำด้วย นอกจากนี้การผ่าตัดยังทำให้เกิดความเสียหายต่อ ovarian blood supply อีกด้วย ซึ่งเมื่อเทียบกับการผ่าตัดในรายที่เป็น endometrioma เพียงข้างเดียว พบว่า ค่า AMH และ FSH หลังผ่าตัดในรายที่ผ่าตัดสองข้างลดต่ำลงกว่าในรายที่ผ่าตัดข้างเดียวอย่างชัดเจนและวิธีการหยุดเลือดหลังการผ่าตัดก็เป็นอีกปัจจัยที่ทำให้ ovarian reserve ลดลงได้อีกด้วย [11]
เนื้อเยื่อรอบๆ endometriomas มักจะผิดปกติและแตกต่างกับรังไข่ข้างที่ปกติ เช่น พบ cortical stroma ลดลง มี fibrosis มากขึ้น และมี follicular density ที่ลดลง จึงส่งผลต่อการลดลงของ ovarian reserve นอกจากนี้ยังพบว่าภาวะเยื่อบุโพรงมดลูกที่พบในอวัยวะอื่นๆ นอกรังไข่ยังทำให้เกิด early menopause อีกด้วย เช่น peritoneal endometriosis ซึ่งภาพทางพยาธิวิทยาพบ fibrosis และ vascular deficiency รวมถึงพบว่าสัดส่วนของ primodial follicle ลดลงเมื่อเทียบกับ non-resting growing follicles นั่นหมายถึงว่าตัวโรคกระตุ้นให้เกิด follicle activation และลดปริมาณของ follicular reserve โดยเหมือนกับการการสัมผัสเคมีบำบัด [10]

ตารางที่ 3 – แสดง Parameters ของการผ่าตัดที่มีผลต่อ ovarian reserve [10]
ดังนั้นภาวะเยื่อบุโพรงมดลูกเจริญผิดที่นี้สามารถทำให้เกิดภาวะมีบุตรยากตามมาได้ค่อนข้างสูงซึ่งวิธีที่จะช่วยให้ preserve female fertility ได้จึงจำเป็นต้องใช้หลายวิธีร่วมๆกัน [12] ดังนี้คือ เมื่อจำเป็นต้องรักษาด้วยการผ่าตัดให้เลือกวิธีการผ่าตัดที่ดีที่สุด, หลีกเลี่ยงการผ่าตัดที่ไม่จำเป็น, ประเมิน ovarian function ก่อนทำการผ่าตัดทุกครั้ง และใช้ยาหรือเทคโนโลยีช่วยเจริญพันธุ์ เช่น GnRH analog, IVF หรือ cryopreservation techniques เป็นต้น
• การผ่าตัดต่างๆ บริเวณอุ้งเชิงกราน
การผ่าตัดบริเวณอุ้งเชิงกรานอาจมีผลทำให้มีการลดลงของ ovarian reserve ได้ โดยเฉพาะ การผ่าตัดเพื่อทำการรักษาภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ดังที่ได้กล่าวไปข้างต้นแล้ว นอกจากนี้ยังมีการผ่าตัดอื่นๆที่สามารถลด ovarian reserve
Salpingectomy : มีการศึกษาแบบ retrospective [13] เมื่อตรวจ AMH และ FSH ในผู้ป่วยที่มาทำ IVF และเคยมีประวัติผ่าตัด salpingectomy พบว่า มีค่า AMH ที่ต่ำลง และ FSH สูงขึ้น แต่ก็มีหลายรายงานที่ขัดแย้งกับการศึกษานี้ เช่นการศึกษาของ Venturella [14] ซึ่งศึกษาเกี่ยวกับการทำผ่าตัดแบบวงกว้างบริเวณใกล้ๆรังไข่และท่อนำไข่ในผู้ป่วยที่มาผ่าตัด bilateral salpingectomy พบว่าการผ่าตัดเพื่อนำ mesosalpinx ออกหรือการผ่าตัด salpingectomy ไม่ส่งผลกระทบต่อ ovarian reserve ล่าสุดมีการศึกษา meta-analysis [15] ได้สรุปว่าการผ่าตัด salpingectomy ไม่ทำให้เกิดผลกระทบต่อ ovarian function หรือ การตอบสนองเมื่อกระตุ้นด้วย gonadotropins หรือผลลัพธ์ในการทำ IVF ในระยะสั้นๆ แต่อาจจะเกิดผลการทบต่อการสูญเสีย ovarian reserve ในระยะยาวได้
Tubal sterilization : มีการศึกษาทดลองในหนู [16] เปรียบเทียบการทำหมันแบบวิธีใช้ไฟฟ้าจี้ (Bipolar electrocauterization) และวิธี Pomeroy พบว่า มีการลดลงของ AFC และ AMH ในกลุ่มที่ใช้ไฟฟ้าจี้ มากกว่ากลุ่ม Pomeroy และกลุ่ม control อย่างมีนัยสำคัญทางสถิติ จึงสรุปว่า การใช้ Bipolar electrocauterization อาจทำให้เกิด negative effect ต่อ ovarian structure และ ovarian reserve ได้ แต่อย่างไรก็ตามยังเป็นแค่การศึกษาทดลองในหนู
• การรักษามะเร็ง
การรักษามะเร็งทำให้ ovarian reserve ลดลงได้จากหลายทาง [17]
1. ยาเคมีบำบัดบางชนิดมีผลทำลายเซลล์ไข่ซึ่งนำมาซึ่งภาวะมีบุตรยากภายหลังการรักษา ซึ่งความเสี่ยงขึ้นอยู่กับชนิดยาเคมีบำบัดที่ใช้, ขนาดยาที่ได้รับ รวมถึงอายุของผู้ที่ได้รับการรักษาขณะนั้น อายุที่เพิ่มมากขึ้นส่งผลให้จำนวนไข่ขณะเริ่มทำการรักษามีน้อยอยู่เดิมภายหลังการรักษาจึงมีโอกาสสูงกว่าที่จะเกิดภาวะมีบุตรยาก หรือในบางคนอาจมีประจำเดือนที่ปกติหลังจากการรักษาได้แต่จะเกิดภาวะมีบุตรยากและเข้าสู่วัยทองตั้งแต่อายุน้อยตามมาภายหลังได้
2. การฉายรังสีบริเวณอุ้งเชิงกราน นอกเหนือสามารถทำลายเซลล์ไข่ได้เหมือนกับการได้รับการรักษาด้วยเคมีบำบัดแล้ว การฉายรังสียังอาจจะมีผลต่อมดลูกทำให้เกิดพังผืดและแผลเป็นต่อเนื้อเยื่อบริเวณนั้นได้ซึ่งส่งผลต่อภาวะมีบุตรยากตามมา
Menopausal transition
มีการอธิบายเรื่องของ biomarker ต่างๆเมื่อเข้าสู่ menopausal transition [18] พบว่า FSH จะเริ่มสูงขึ้นในช่วงวัยนี้ และเริ่มมีการลดลงของ estradiol เมื่อใกล้ถึง FMP ในขณะที่ถ้าตรวจ inhibin B ในช่วง early follicular phase จะพบว่ามีระดับต่ำลงเรื่อยๆ แต่ไม่สามารถนำมาพยากรณ์ Final menstrual period (FMP) ได้ดีกว่า FSH การที่ FSH มีระดับสูงขึ้นเรื่อยๆในขณะที่ inhibin B ในช่วง early follicular phase มีระดับต่ำลงทำให้เกิดการมีรอบเดือนที่ไม่สม่ำเสมอได้ สำหรับฮอร์โมนตัวอื่นๆ เช่น adrenal androgen จะมีระดับลดลงตามอายุ ส่วน Ovarian androgens, testosterone และ androstenedione จะลดลงเรื่อยๆตามอายุและลดอย่างชัดเจนก่อนถึง FMP
สำหรับ biomarker ที่ใช้ในการประเมิน ovarian reserve นั้น งานวิจัยก่อนหน้านี้พบว่า AMH เป็น endocrine marker ที่แสดงถึงการลดจำนวนลงของ follicle เป็นสัญญานที่แสดงว่าเข้าสู่ late stage ของ menopausal transition แล้ว [19] และจาก STRAW +10 [20] ระดับ biomarker ที่ใช้ในการประเมิน ovarian reserve เช่น inhibin B และ AFC ก็เริ่มมีค่าต่ำลงในช่วง late reproductive age ซึ่งเป็นระยะก่อนถึง menopausal transition ซึ่งเป็นไปได้ว่าหากผู้หญิงที่อยู่ในกลุ่มเสี่ยงต่อการเกิด DOR ที่มี ovarian reserve ต่ำกว่าคนปกติจะมีโอกาสเข้าสู่ช่วง menopausal transition และมีความเสี่ยงการเกิดภาวะต่างๆของ menopause ได้มากกว่าหรือเร็วกว่าคนปกติทั่วไป เช่น ความดันโลหิตสูงหรือกลุ่มโรคหลอดเลือดและหัวใจ เป็นต้น [21][22] แต่ก็ยังไม่เป็นที่สรุปชัดเจนในเรื่องนี้
Ovarian response biomarkers in the future [23]
ในอนาคตการนำ biomarker มาใช้ใน health care provider จะมีมากขึ้นไม่เพียงแต่การใช้ใน IVF clinic ซึ่ง biomarker ที่เป็นการตรวจทางเลือกในปัจจุบันคือ AMH ซึ่งอยู่ในระหว่างการพัฒนาการตรวจ, มีราคาแพง, ตรวจได้เฉพาะบางที่ แต่คาดว่าจะใช้อย่างแพร่หลายมากขึ้นในอนาคต โดยเฉพาะการพยากรณ์ reproductive life span ที่แม่นยำ ซึ่งในกรณีที่เราพยากรณ์ผู้หญิงคนที่มีความเป็นไปได้ว่าในอนาคตจะมี reproductive life span ต่ำ ควรจะได้รับการวางแผนครอบครัวและการมีบุตร หรือการใช้ AMH มาประเมิน ovarian reserve หลังการผ่าตัดโดยเฉพาะหลังการผ่าตัด endometrioma จะทำให้มีovarian reserve ลดลง ตามที่กล่าวไปข้างต้นแล้ว และยังสามารถนำมาพยากรณ์ภาวะมีบุตรยากภายหลังการรักษาเคมีบำบัดในผู้หญิงอายุน้อยที่เป็นมะเร็งอีกด้วย
AMH อาจจะสามารถช่วยวินิจฉัยภาวะประจำเดือนมาผิดปกติ เช่น PCOS มักจะพบว่าระดับ AMH สูงมากกว่า 35 pmol/L หรือหากตรวจพบระดับ AMH ต่ำอาจจะบ่งบอกถึงภาวะ POI ดังนั้นจะเห็นได้ว่าในอนาคตอันใกล้ อาจมีการนำ biomarker เหล่านี้ มาใช้ให้เกิดประโยชน์ในอีกหลายทาง
สรุป
จุดมุ่งหมายหลักของการตรวจ ovarian reserve คือการพยายามหากลุ่มเสี่ยงต่อการเกิด DOR ซึ่งจากหลักฐานทางการศึกษาปัจจุบันพบว่าการตรวจที่ให้ผลแม่นยำและหน้าเชื่อถือได้แก่ AMH และ AFC สำหรับในทางปฏิบัตินั้น ทาง general gynecologist อาจต้องตระหนักถึงภาวะ DOR ให้มากและพยายามทำให้ผู้ป่วยมีการ loss of ovarian function ไปให้น้อยที่สุด โดยเฉพาะกลุ่มผู้ป่วยเยื่อบุโพรงมดลูกเจริญผิดที่ ที่เข้ารับการผ่าตัด ส่วนจุดมุ่งหมายรองของการตรวจหา ovarian reserve จะเป็นเรื่องของการรักษาภาวะมีบุตรยากซึ่งเป็นเฉพาะแล้วแต่บุคคลว่าเหมาะสมกับการรักษาแบบไหน ทั้งนี้ต้องพยายามให้ข้อมูลผู้ป่วยเสมอว่า การตรวจ ovarian reserve นี้ใช้พยากรณ์การตอบสนองของรังไข่ต่อการรักษาเท่านั้น แต่ไม่สามารถพยากรณ์ผลลัพธ์ของการรักษาหรือความสำเร็จของเทคโนโลยีการเจริญพันธุ์ในอนาคตได้
เอกสารอ้างอิง
- Olive DL, Palter SF. Reproductive Physiology. Berek and Novak’s Gynecology 15th Edition,Lippincott Williams and Wilkins. 2012;138-58.
- Wise PM, Kashon ML. Aging of the female reproductive system: a window into brain aging. Recent Prog Horm Res. 1997; 52:279–305.
- te Velde ER, Pearson PL. The variability of female reproductive ageing. Hum Reprod Update. 2002;8:141–54.
- Testing and interpreting measures of ovarian reserve: a committee opinion. Practice Committee of the American Society for Reproductive Medicine. Fertil Steril. 2012;98:1407–15.
- Ovarian reserve testing. Committee Opinion No. 618. American College of Obstetricians and Gynecologists. Obstet Gynecol. 2015;125:268–73.
- Jirge PR. Ovarian reserve tests. J Hum Reprod Sci. 2011;4:108-13.
- Gurtcheff SE, Klein NA. Diminished ovarian reserve and infertility. Clin Obstet Gynecol. 2011;54:666–74.
- Female age-related fertility decline. Committee Opinion No.589. American College of Obstetricians and Gynecologists. Obstet Gynecol. 2014;123:719–21.
- Carnahan M,Fedor J.Ovarian endometrioma:guidelines for selection of cases for surgical treatment or expectant management. Expert Rev. Obstet. Gynecol. 2013;8(1): 29–55.
- Carrillo L, Seidman DS.The role of fertility preservation in patients with endometriosis. J Assist Reprod Genet. 2016;33:317–323.
- Shao MJ, Hu M. AMH trend after laparoscopic cystectomy and ovarian suturing in patients with endometriomas. Arch Gynecol Obstet. 2016;293:1049–52.
- Carvalho L, Nataraj N. Seven ways to preserve female fertility in patients with endometriosis, Expert Review of Obstetrics & Gynecology.2012;7:3, 227-240.
- Ye X, Yang Y, Sun X. A retrospective analysis of the effect of salpingectomy on serum antiMullerian hormone level and ovarian reserve. Am J Obstet Gynecol. 2015;212:53.e1-10.
- Venturella R, Morelli M. Wide excision of soft tissues adjacent to the ovary and fallopian tube does not impair the ovarian reserve in women undergoing prophylactic bilateral salpingectomy: results from a randomized, controlled trial. Fertil Steril. 2015 Nov;104(5):1332-9.
- Qin F, Du DF, Li XL.The Effect of Salpingectomy on Ovarian Reserve and Ovarian Function.Obstet Gynecol Surv. 2016 Jun;71(6):369-76.
- Kaya C, Turgut H. The effect of tubal sterilization with the Pomeroy technique and bipolar electrocauterization on the ovarian reserve and serum anti-Müllerian hormone levels in a rat model. Eur J Obstet Gynecol Reprod Biol. 2015 Feb;185:108-13.
- Memorial Sloan Kettering Cancer Center. Fertility Preservation: Options for Women Who Are Starting Cancer Treatment. 2016.Available from: https://www.mskcc.org/pdf/cancer-care/patient-education/cancer-and-fertility-information-women/
- Santoro N. The menopause transition: an update. Hum Reprod Update. 2002 Mar-Apr;8(2):155-60.
- Sowers MR, Eyvazzadeh AD. Anti-mullerian hormone and inhibin B in the definition of ovarian aging and the menopause transition. J Clin Endocrinol Metab. 2008 Sep;93(9):3478-83.
- Harlow SD, Gass M. Executive summary of the Stages of Reproductive Aging Workshop + 10: addressing the unfinished agenda of staging reproductive aging. Menopause. 2012 Apr;19(4):387-95.
- Kallen AN, Pal L. Cardiovascular disease and ovarian function. Curr Opin Obstet Gynecol. 2011 Aug;23(4):258-67.
- Maric-Bilkan C, Gilbert EL, Ryan MJ. Impact of ovarian function on cardiovascular health in women: focus on hypertension. Int J Womens Health. 2014 Jan 24;6:131-9.
- Nelson SM. Biomarkers of ovarian response: current and future applications. Fertil Steril. 2013 Mar 15;99(4):963-9.