ภาวะมดลูกเจริญผิดปกติแต่กำเนิด : Congenital uterine anomalies
ภาวะมดลูกเจริญผิดปกติแต่กำเนิด : Congenital uterine anomalies
นพ.รังสรรค์ เดชนันทพิพัฒน์
ผ.ศ.นพ.โอภาส เศรษฐบุตร
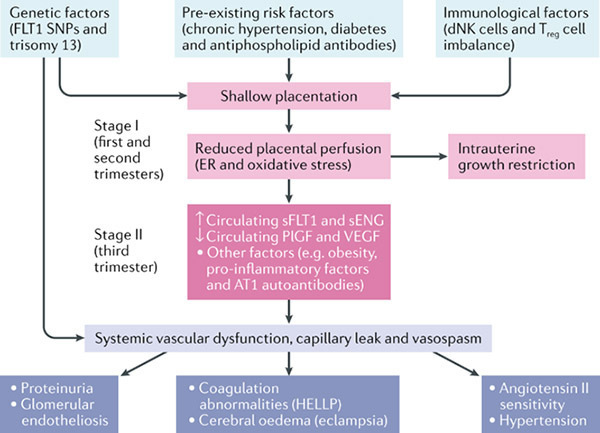
ภาวะมดลูกเจริญผิดปกติแต่กำเนิด (Congenital uterine anomalies : CUAs) เป็นสาเหตุของอาการปวดในอุ้งเชิงกราน, เลือดออกผิดปกติทางช่องคลอด, ภาวะแท้งเป็นอาจิณ, ภาวะเจ็บครรภ์คลอดก่อนกำหนด หรือตรวจพบในผู้ป่วยที่มาหาแพทย์ด้วยอาการผิดปกติทางนรีเวชวิทยาอื่นๆ ผู้ป่วยที่ตรวจร่างกายพบความผิดบางอย่าง เช่น มีผนังกั้นแบ่งในช่องคลอด (longitudinal vaginal septum) มีความสัมพันธ์กับภาวะมดลูกเจริญผิดปกติ (1)
การแบ่งประเภทของภาวะมดลูกเจริญผิดปกติแต่กำเนิด (Classification)
การแบ่งประเภทของภาวะมดลูกเจริญผิดปกติแต่กำเนิดนั้น ไม่มีระบบการแบ่งประเภทที่เป็นที่ยอมรับโดยทั่วไป เนื่องจากระบบการแบ่งที่มีอยู่ ยังไม่สามารถใช้เปรียบเทียบอาการ, วิธีการรักษา และผลลัพธ์จากโรคและการรักษากับประชากรทั้งหมดได้
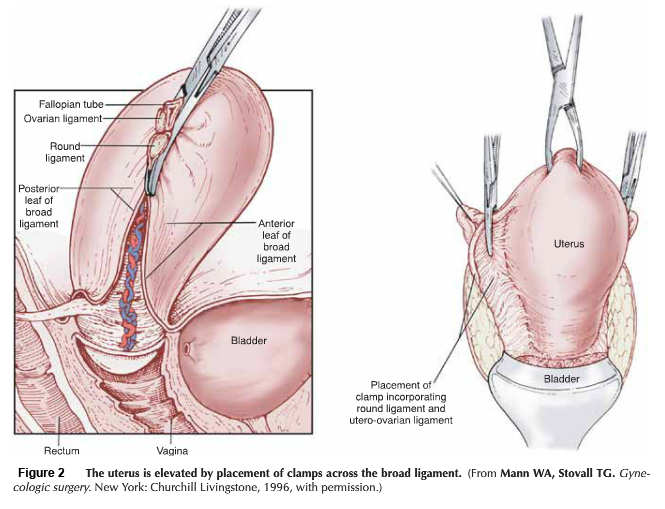
● The American Society for Reproductive Medicine’s (ASRM) classification system for Müllerian defects (2) ใช้เป็นมาตรฐานในประเทศสหรัฐอเมริกา การตรวจพบมดลูกเจริญผิดปกติแต่กำเนิด ควรที่จะตรวจเพิ่มเติมหาความผิดปกติของช่องคลอด, ปากมดลูก, ท่อนำไข่และไต แม้จะไม่ได้เป็นส่วนหนึ่งของระบบการแบ่งประเภท
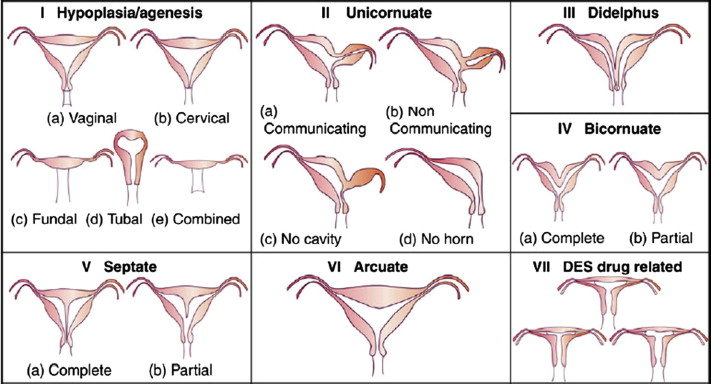
ภาพที่ 1 ASRM classification system for Müllerian defects
● The European Society of Human Reproduction and Embryology (ESHRE) and the European Society for Gynaecological Endoscopy (ESGE) (3)
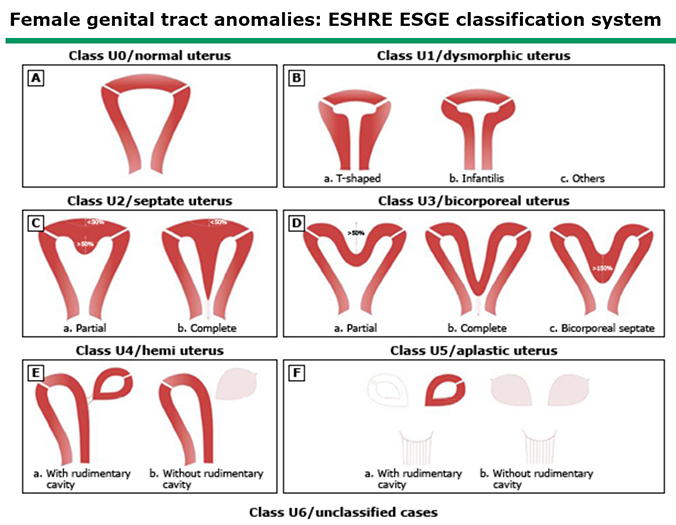
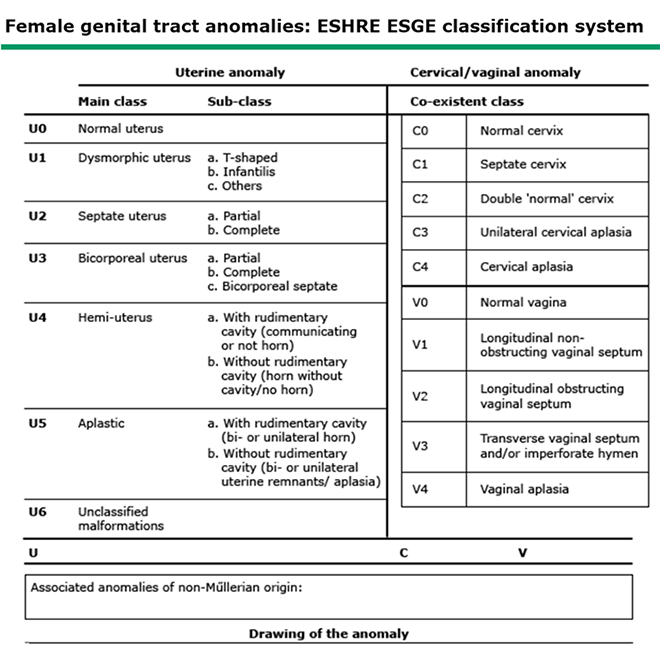
ภาพที่ 2 ESHRE and ESGE classification system for Müllerian defects
● ระบบการแบ่งประเภทอื่นๆ อาจเน้นที่การอธิบายความผิดปกติที่ซับซ้อนเพิ่มเติม เช่น Acien’s classification, ASRM Practice Committee guideline on the uterine septum, หรือ ระบบการแบ่งประเภทโดยผู้เชี่ยวชาญต่างๆ
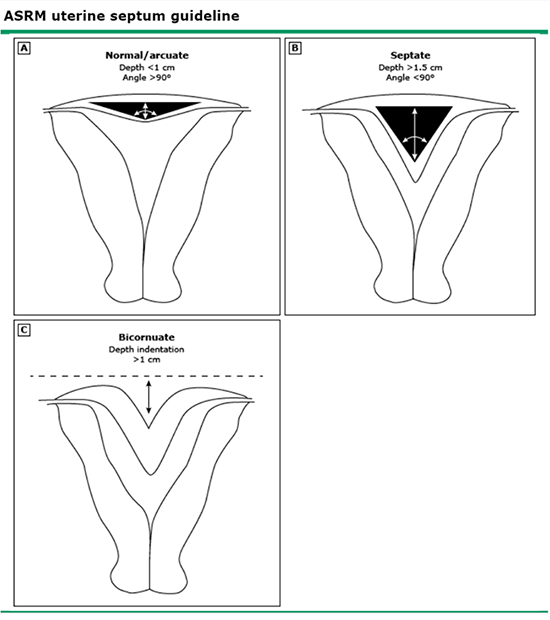
ภาพที่ 3 ASRM Practice Committee guideline on the uterine septum
ความสัมพันธ์ของภาวะมดลูกเจริญผิดปกติแต่กำเนิดกับระบบอวัยวะอื่นๆ (Associated anomalies in other organ systems)
ผู้ป่วยมดลูกเจริญผิดปกติแต่กำเนิดมีความเสี่ยงที่จะมีไต, กระดูกและผนังหน้าท้องผิดปกติร่วมด้วย หรือสัมพันธ์กับการเกิด inguinal hernia ความผิดปกติของไต พบร้อยละ 20 – 30 ของผู้ป่วยที่มี Müllerian defects (4) ความผิดปกติที่พบ เช่น Duplex collecting system, horseshoe kidney, pelvic kidney, และ unilateral renal agenesis สัมพันธ์กับ obstructed hemiuterus, obstructed hemivagina, และ transverse vaginal septa ของข้างเดียวกัน
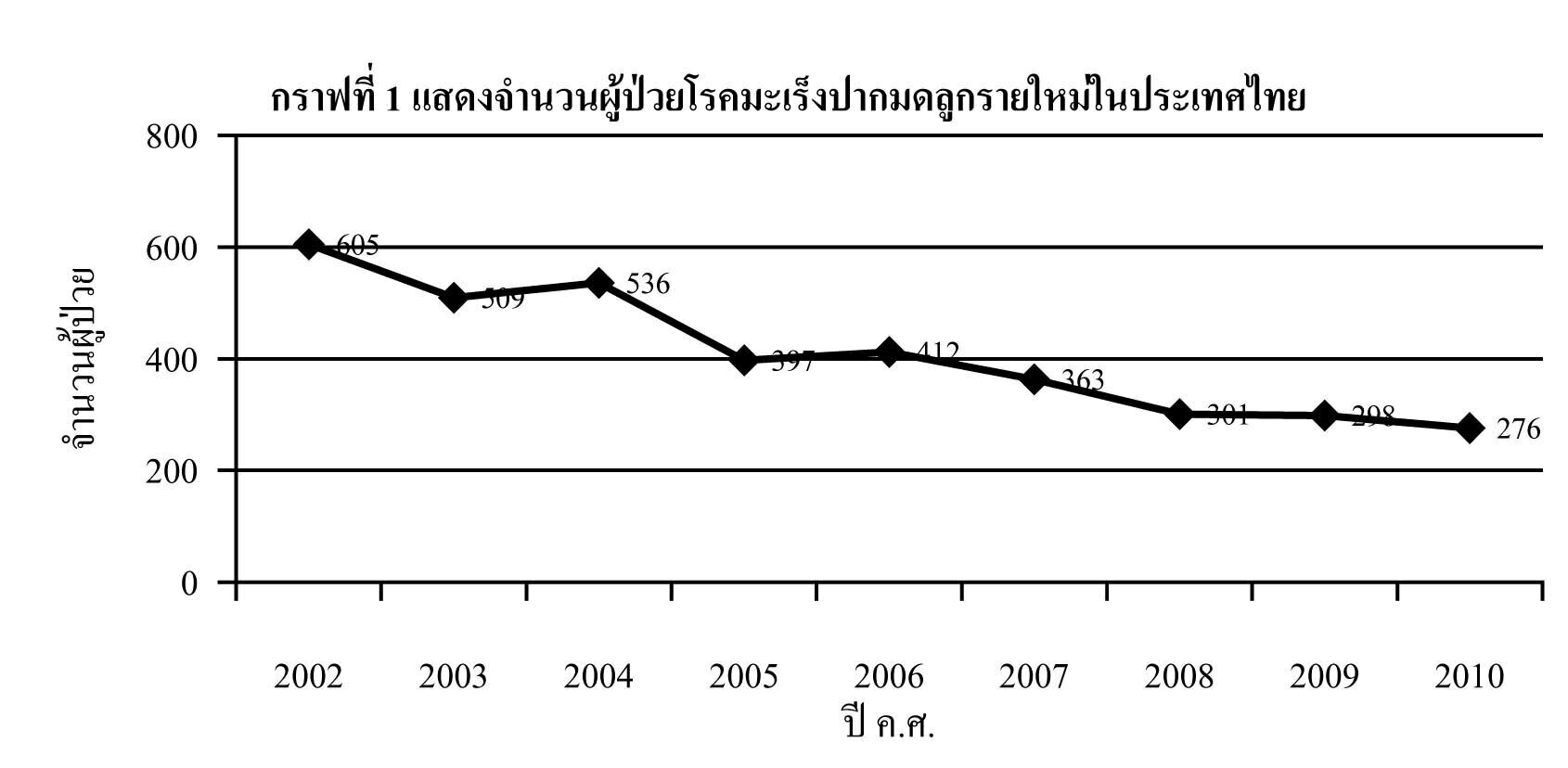
ความชุกของโรค (Prevalence)
ความชุกของภาวะมดลูกเจริญผิดปกติแต่กำเนิด ไม่สามารถระบุได้อย่างแม่นยำ เนื่องจากผู้ป่วยส่วนหนึ่งไม่แสดงอาการ รายงานความชุกในแต่ละการศึกษา จึงแตกต่างกัน (1)
- จาก systematic review ความชุกของภาวะมดลูกเจริญผิดปกติแต่กำเนิด พบร้อยละ 5.5 ของเพศหญิง, พบร้อยละ 8.0 ของเพศหญิงที่มีภาวะมีบุตรยาก, พบร้อยละ 12.3 ของผู้หญิงที่มีประวัติแท้งบุตร และพบร้อยละ 24.5 ของเพศหญิงที่มีประวัติแท้งบุตรร่วมกับภาวะมีบุตรยาก (5)
- จากการศึกษาในเพศหญิง 700 คน ที่มีภาวะเจริญพันธุ์ปกติที่ได้รับการทำหมัน (tubal ligation) ทั้งจากการผ่าตัดส่องกล้อง (laparoscopy) และ การผ่าตัดทางหน้าท้อง (laparotomy) ที่ได้รับการตรวจด้วย hysterosalpingogram 5 เดือน หลังการทำหมัน พบความชุกของภาวะมดลูกเจริญผิดปกติแต่กำเนิดร้อยละ 3.2 (6)
- ในการศึกษาอื่นๆ รายงานความชุกของภาวะมดลูกเจริญผิดปกติแต่กำเนิด ประมาณร้อยละ 5 – 10 ในเพศหญิงที่เคยมีประวัติแท้งบุตรในช่วงไตรมาสแรกของการตั้งครรภ์ และมากกว่าร้อยละ 25 ของเพศหญิงที่เคยมีประวัติแท้งบุตรหรือคลอดก่อนกำหนดในช่วงท้ายของไตรมาสแรกถึงไตรมาสที่สองของการตั้งครรภ์ (7)
จากการศึกษาในผู้ป่วยภาวะมดลูกเจริญผิดปกติแต่กำเนิดที่มีภาวะมีบุตรยากและภาวะเจริญพันธุ์ปกติ ความชุกของภาวะมดลูกเจริญผิดปกติแต่กำเนิดแยกตามประเภทพบดังนี้ septate (ร้อยละ 35), bicornuate (ร้อยละ 26), arcuate (ร้อยละ 18), unicornuate (ร้อยละ 10), didelphys (ร้อยละ 8), และ agenesis (ร้อยละ 3) (8) สำหรับเพศหญิงที่มีภาวะเจริญพันธุ์ปกติ พบ septate (ร้อยละ 90), bicornuate (ร้อยละ 5), และ didelphys (ร้อยละ 5) (6) อย่างไรก็ตามรายงานความชุกแตกต่างกันขึ้นกับประชากรที่ศึกษาและวิธีการที่ใช้ในการตรวจ
พยาธิกำเนิด (Pathogenesis)
พัฒนาการของระบบท่อสืบพันธุ์เพศหญิงที่ปกติ
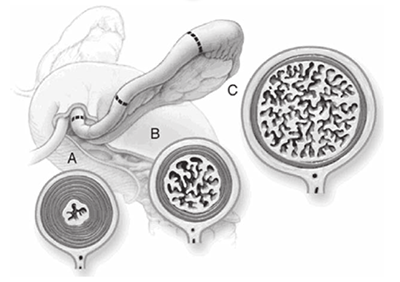
Müllerian ducts เริ่มพัฒนาประมาณอายุครรภ์ 6 สัปดาห์ เริ่มยืดยาวออกไปทางก้นและทอดข้าม metanephric ducts เข้าสู่แนวกลางลำตัว สัปดาห์ที่ 7 Urorectal septum พัฒนา แยก rectum จาก urogenital sinus ประมาณสัปดาห์ที่ 12 Müllerian ducts ส่วนปลายทั้งสองข้างจะมารวมกันเป็น uterovaginal canal และปลายสุดจะไปบรรจบที่ผนังของ urogenital sinus ทางด้านหลัง ที่ตำแหน่ง Müller’s tubercle ที่ 20 สัปดาห์ Müllerian ducts ทั้งสองข้าง เกิด canalization ท่อส่วนต้นเป็นปลายเปิดเข้าช่องท้องพัฒนาเป็น fimbria และ fallopian tubes ท่อส่วนปลายที่มาเชื่อมกันพัฒนาเป็น uterus และ upper vagina (1)
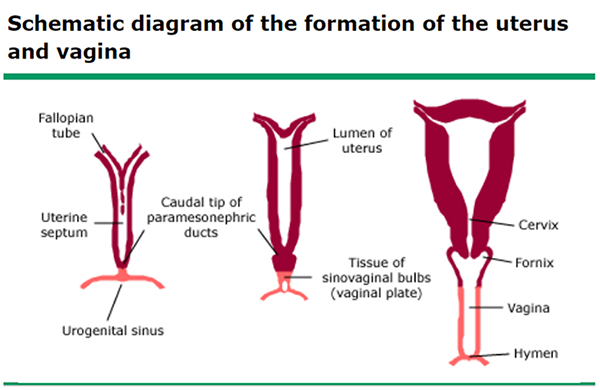
ภาพที่ 4 Formation of the uterus and vagina
พัฒนาการของระบบท่อสืบพันธุ์เพศหญิงที่ผิดปกติ
สาเหตุของความผิดปกติในการพัฒนาระบบสืบพันธุ์เพศหญิงไม่สามารถระบุได้แน่ชัด เกิดจากความผิดปกติทางพันธุกรรมและหลายปัจจัยร่วมกัน (polygenic and multifactorial causes) karyotype ของผู้ป่วยส่วนใหญ่ปกติ (46,XX ร้อยละ 92) (1)
● Agenesis or hypoplasia – Müllerian agenesis หรือ hypoplasia ทำให้ไม่เกิดการพัฒนาของ uterus และ upper vagina เรียกอีกชื่อว่า Mayer-Rokitansky-Küster-Hauser (MRKH) syndrome ความรุนแรงมีหลากหลาย อาจพบ unicornuate uterus หรือ midline uterus without cervix ได้ แต่ที่พบมากที่สุด คือ ทั้ง uterus และ cervix ไม่พัฒนา
● Lateral fusion defect – ความผิดปกติในการเชื่อมต่อกันของ Müllerian ducts ทางด้านข้าง (lateral) แบ่งเป็น symmetric หรือ asymmetric และ nonobstructed หรือ obstructed เช่น bicornuate uterus, uterus didelphys สาเหตุของ lateral fusion defect ได้แก่
- ความผิดปกติในการสลาย (resorption) ของผนังกั้น ทำให้เกิด uterine หรือ longitudinal vaginal septum
- ความผิดปกติในการเจริญของ Müllerian duct ข้างใดข้างหนึ่ง
- ความผิดปกติในการเคลื่อนของ Müllerian duct (duct migration) จากในช่องท้องไปยังอุ้งเชิงกราน
- ความผิดปกติในการเชื่อมกันของ Müllerian duct
● Vertical fusion defect – ความผิดปกติในการเชื่อมต่อในแนวบนล่าง (vertical) ทำให้เกิด transverse vaginal septum, segmental vaginal agenesis, และ/หรือ cervical agenesis หรือ dysgenesis อาจทำให้เกิด vagina และ/หรือ cervix ผิดปกติในแบบ obstructed หรือ nonobstructed ก็ได้ สาเหตุเกิดจากความผิดปกติของการ fusion ระหว่าง caudal end ของ Müllerian duct กับ urogenital sinus หรือเกิดจากความผิดปกติในพัฒนาโครงสร้างท่อของ vagina (vaginal canalization)
ทารกเพศหญิงในครรภ์ ที่ระหว่างตั้งครรภ์มารดาได้รับสาร diethylstilbestrol (DES) ซึ่งเป็น synthetic estrogen ที่ใช้ในการป้องกันการแท้ง (มีใช้ในช่วงปี ค.ศ. 1949 – 1971) ทำให้เกิดความผิดปกติของระบบท่อสืบพันธุ์เพศหญิง มีลักษณะดังนี้
- Uterine anomalies (T-shaped uterine cavity, hypoplastic uterus, midfundal constrictions, filling defects, and endometrial cavity adhesions)
- Vaginal adenosis, vaginal ridges, transverse septa
- Cervical anomalies (hypoplasia, hoods, collars, or pseudopolyps)
ผลกระทบที่อาจเกิดขึ้น (Potential consequences)
ในเพศหญิงที่ไม่ได้ตั้งครรภ์ ภาวะมดลูกเจริญผิดปกติสามารถทำให้เกิดอุดตันการไหลออกของระดูบางส่วนหรือทั้งหมดได้ เช่น noncommunicating functioning uterine horn, uterine duplication with an obstructed hemivagina, uterine septum with an obstructed hemivagina ภาวะอื่นๆ ที่ทำให้เกิดได้ ได้แก่
- Hematometra : มีเลือดอุดตันสะสมในมดลูก
- Hematocolpos : มีเลือดอุดตันสะสมในช่องคลอด
- Retromenstruation and development of endometriosis : เกิดการไหลย้อนกลับของระดู กลับเข้ามาในช่องท้องและเกิดภาวะเยื่อบุมดลูกเจริญผิดที่
- Pelvic pain : มีอาการปวดท้องน้อยทั้งแบบที่ปวดตามรอบเดือนและไม่ตามรอบเดือน (cyclic or noncyclic)
- Abnormal uterine bleeding or discharge : มีเลือดออกผิดปกติทางช่องคลอด หรือตกขาวผิดปกติ
- Genital tract infection : ภาวะติดเชื้อในระบบสืบพันธุ์
ภาวะมดลูกเจริญผิดปกติ โดยทั่วไปไม่ได้มีผลยับยั้งการตั้งครรภ์หรือการฝังตัวของตัวอ่อน ทั้งการตั้งครรภ์ที่เกิดขึ้นเองและการย้ายตัวอ่อนที่ผสมแล้วมาฝังตัวในมดลูก (9) ภาวะมดลูกเจริญผิดปกติมีผลต่อการตั้งครรภ์ดังนี้ (8)
- Spontaneous abortion : แท้งบุตร
- Recurrent miscarriage : ภาวะแท้งเป็นอาจิณ
- Preterm delivery : คลอดก่อนกำหนด
- Intrauterine growth restriction : ภาวะทารกเจริญเติบโตช้าในครรภ์
- Antepartum and postpartum bleeding : การตกเลือดก่อนและหลังคลอด
- Placental attachment abnormalities : รกเกาะแน่นผิดปกติ
- Cervical insufficiency : ปากมดลูกหลวม
- Fetal malpresentation : ส่วนนำของทารกไม่ใช้ศีรษะ
- Pregnancy-associated hypertension : ความดันโลหิตสูงขณะตั้งครรภ์
- Cesarean delivery : การผ่าตัดคลอดทางหน้าท้อง
- Rupture of a rudimentary horn
มีหลายทฤษฎีที่พยายามอธิบายความผิดปกติต่างๆ ที่เกิดกับการตั้งครรภ์ในภาวะมดลูกเจริญผิดปกติแต่กำเนิด เช่นmalpresentation : อาจเกิดจากการตั้งครรภ์ในมดลูกที่มีขนาดเล็ก จำกัดการเคลื่อนไหวและการเกิด cephalic presentation, cesarean delivery : การมี Vaginal septa อาจเป็นสาเหตุที่ทำให้ไม่สามารถคลอดทางช่องคลอดได้ (10), Growth restriction : อาจเกิดจากมดลูกมีหลอดเลือดที่มาเลี้ยงผิดปกติ (abnormal uterine vasculature), Postpartum hemorrhage : อาจเกิดจากรกบางส่วนไปเกาะใน accessory horn หรือเกาะแน่นผิดปกติ, Pregnancy-associated hypertension : อธิบายจากการที่หญิงตั้งครรภ์อาจมีการพัฒนาของไตผิดปกติร่วมด้วย (11), Pregnancy loss : อาจเกิดจากการฝังตัวของทารกในตำแหน่งที่ไม่เหาะสม เช่น septum
จาก systematic review ในปัจจุบัน รายงานผลกระทบของการตั้งครรภ์ในผู้ป่วยภาวะมดลูกเจริญผิดปกติแต่กำเนิดเทียบกับคนปกติ ดังนี้ (9)
- First trimester spontaneous abortion – septate (Relative risk : RR 2.65), bicornuate (RR 2.32)
- Second trimester spontaneous abortion – septate (RR 2.95), bicornuate (RR 2.90)
- Preterm delivery – didelphys (RR 3.39), unicornuate (RR 3.14), bicornuate (RR 2.16), septate (RR 2.11)
- Fetal growth restriction – didelphys (RR 4.94), bicornuate (RR 2.80), septate (RR 2.54)
- Malpresentation at delivery – bicornuate (RR 4.65), septate (RR 4.35), unicornuate (RR 3.12), didelphys (RR 2.62)
- Reduction in spontaneous pregnancy – septate (RR 0.86)
อาการและอาการแสดง (Signs and symptoms)
ผู้ป่วยภาวะมดลูกเจริญผิดปกติแต่กำเนิดส่วนใหญ่ไม่มีอาการ ในบางรายตรวจพบจากการความผิดปกติจากการตรวจสุขภาพ นำไปสู่การตรวจเพิ่มเติมและการวินิจฉัย การตรวจภายในพบ Longitudinal vaginal septa และ double cervixes มักสัมพันธ์กับ uterine anomaly เช่น uterus didelphys และ septate uterus (12) cervix จะมีขนาดเล็กกว่าปกติและอาจคลำพบในแต่ละข้างของ vaginal septum ในตำแหน่งที่แตกต่างกันได้
ผู้ป่วยที่มี hematocolpos หรือ hematometra อาจคลำได้ก้อนที่ท้องน้อยจากการตรวจภายใน
สำหรับรายที่มีอาการ อาจมาด้วยอาการปวดท้องน้อย, มีเลือดออกผิดปกติทางช่องคลอด และ/หรือ ติดเชื้อในระบบสืบพันธุ์ อาการและอาการแสดงมีได้หลากหลาย ขึ้นกับลักษณะความผิดปกติที่เกิดขึ้น
- ผู้ป่วยที่มีการเจริญของ Müllerian duct ผิดปกติที่ทำให้เกิดการอุดตันของท่อ อาจแสดงอาการปวดท้องน้อย ทั้งที่ปวดตามรอบเดือนและไม่ตามรอบเดือน ตั้งแต่เริ่มมีประจำเดือน
- ผู้ป่วยที่มีการเจริญของ Müllerian duct ผิดปกติที่ทำให้ระดูไม่สามารถระบายออกมาได้ อาจมาด้วยอาการขาดประจำเดือนหรือประจำเดือนมาน้อย
- ผู้ป่วย transverse vaginal septum ร่วมกับมีรูเปิดเล็กๆ (small fenestration) อาจมาด้วยอาการประจำเดือนมานาน (prolonged menstrual bleeding)
- ผู้ป่วย transverse vaginal septum หรือ obstructed hemivagina อาจมีรูเปิดเล็กๆที่เชื้อโรคสามารถเจริญขึ้นไปทำให้เกิดการติดเชื้อได้ (infected hematocolpos) ผู้ป่วยอาจมาด้วยอาการตกขาวมีกลิ่นเหม็น ในบางรายการติดเชื้อลุกลามไปถึงมดลูกและท่อนำไข่ เป็นสาเหตุให้เกิด cyclic pelvic inflammatory disease ได้
ผู้ป่วยภาวะมดลูกเจริญผิดปกติบางส่วนวินิจฉัยจากการตรวจภาพรังสีในอุ้งเชิงกรานที่ส่งตรวจเพิ่มเติมในการหาสาเหตุของอาการทางนรีเวชอื่นๆ หรือปัญหาเกี่ยวกับการตั้งครรภ์ เช่น ภาวะมีบุตรยาก, ก้อนในอุ้งเชิงกราน, ปวดท้องน้อย หรือภาวะแท้งเป็นอาจิณ เป็นต้น การส่งตรวจภาพรังสีในอุ้งเชิงกรานถือเป็นส่วนหนึ่งในการสืบค้นเพิ่มเติมในผู้ป่วยเพศหญิงที่มีความผิดปกติแต่กำเนิดของไต, กระดูกหรือผนังหน้าท้อง หรือมีประวัติเป็นไส้เลื่อน (inguinal hernia) (13)
การวินิจฉัยโรค (Diagnosis)
เมื่อสงสัยภาวะมดลูกเจริญผิดปกติแต่กำเนิด การสืบค้นเพิ่มเติมและการวินิจฉัยจะอาศัยการตรวจภาพรังสี การส่งตรวจภาพรังสีที่ควรส่งเป็นลำดับแรก คือ Two-dimensional (2D) ultrasound เนื่องจากเป็นวิธีการตรวจที่มีใช้โดยทั่วไป, ไม่อันตราย, ราคาถูก, สามารถใช้ตรวจอวัยวะอื่นนอกจากมดลูกได้ เช่น ท่อนำไข่, รังไข่และไต ข้อมูลที่ได้จาก 2D ultrasound ช่วยในการพิจารณาการส่งตรวจภาพรังสีวิธีอื่นที่เฉพาะเจาะจงเพื่อการวินิจฉัยได้ Three-dimensional (3D) ultrasound จะช่วยให้รายละเอียดที่มากขึ้น แต่ก็อาจต้องส่งตรวจภาพรังสีวิธีอื่นเพิ่มเติม (14)
Magnetic resonance imaging (MRI) เป็นการตรวจวินิจฉัย (gold standard) ภาวะมดลูกเจริญผิดปกติแต่กำเนิด จะส่งตรวจในรายที่ ultrasound ไม่สามารถใช้วินิจฉัยได้และในรายที่ต้องการการวินิจฉัยที่แม่นยำในการดูแลรักษา
การตรวจอื่นๆ ที่อาจพิจารณาทำ เมื่อผู้ป่วยมีอาการหรือข้อบ่งชี้ เช่น การใช้ยาสลบเพื่อการตรวจภายใน, vaginoscopy, laparoscopy,และ hysteroscopy (15)
Ultrasonography — เป็นวิธีการตรวจที่สามารถใช้แยก septate uterus กับ bicornuate uterus ได้ และใช้ประเมินความผิดปกติของไต ที่มักพบร่วมกับภาวะมดลูกเจริญผิดปกติแต่กำเนิด
- 2D ultrasound สามารถให้รายละเอียดของมดลูกทั้งภายในและภายนอก การตรวจในระยะ secretory phase จะช่วยให้มองเห็นชั้น endometrium ได้อย่างชัดเจน การตรวจภาพในแนว longitudinal และเห็น endometrium แยกออกจากกันบ่งบอกถึงภาวะ duplication of uterus การตรวจ ultrasound สามารถใช้ตรวจภาวะ hematometra หรือ hematocolpos ได้
- 3D ultrasound จะแสดงภาพทั้ง uterine cavity, myometrium และรูปร่างภายนอกของมดลูก ซึ่งสามารถใช้แยก septate และ bicornuate uterus ได้
- Saline infusion sonohysterography หรือ hysterosalpingography (HSG) เป็นวิธีการตรวจที่ให้ข้อมูลเกี่ยวกับลักษณะภายในโพรงมดลูกได้เป็นอย่างดี ช่วยในการประเมินความยาวและความกว้างของ uterine septum ในกรณีที่วางแผนจะรักษาด้วยการผ่าตัด (16)
Hysterosalpingography — ใช้สำหรับตรวจลักษณะภายในโพรงมดลูก ให้รายละเอียดได้เป็นอย่างดี แต่ไม่สามารถให้รายละเอียดภายนอกมดลูกได้ ไม่สามารถใช้แยกระหว่าง septate และ bicornuate uterus ในผู้ป่วย unicornuate uterus การตรวจ HSG สามารถใช้ประเมินการเชื่อมต่อกับของ uterine horn และ uterus กับ vagina ได้ สำหรับ uterine didelphys การตรวจ HSG จะต้องฉีดสารทึบรังสีเข้าไปใน cervix ทั้งสองข้าง เพื่อประเมินทั้ง 2 hemiuterus
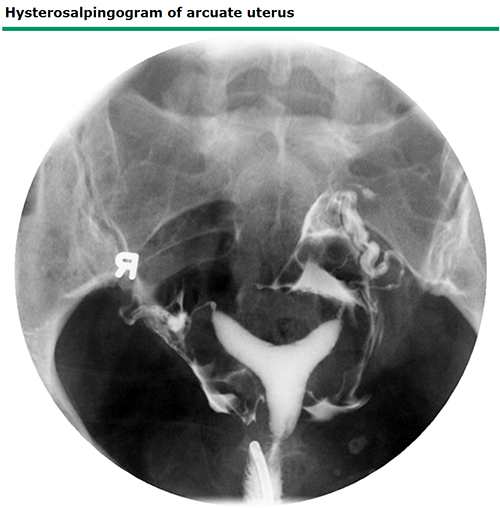
ภาพที่ 5 Hysterosalpingogram of arcuate uterus
Magnetic resonance imaging — ให้รายละเอียดได้ดีทั้งลักษณะภายในและภายนอกของมดลูก ใช้แยก septate กับ bicornuate uterus ได้ ใช้ระบุการมีหรือไม่มีของ cervix ในผู้ป่วยที่มีความผิดปกติที่ซับซ้อน ใช้ประเมินการทำงานของ endometrium ใน noncommunicating obstructed rudimentary uterine horn มดลูกก่อนวัยเจริญพันธุ์จะมีขนาดเล็ก ซึ่งแยกยากกับภาวะ uterine agenesis ถึงแม้การตรวจโดยใช้ MRI ก็มีโอกาสไม่สามารถให้การวินิจฉัยแยกโรคได้
ภาวะมดลูกเจริญผิดปกติแต่กำเนิดที่พบบ่อย (Common congenital uterine anomalies)
Arcuate uterus
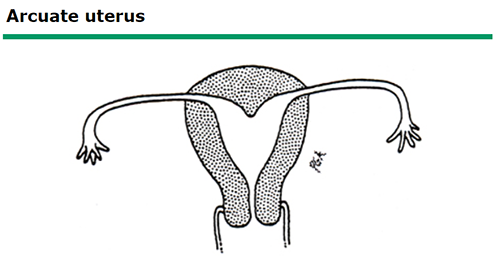
ภาพที่ 6 Arcuate uterus
arcuate uterus คือ มดลูกที่โพรงมดลูกมีรอยคอดที่ fundus บริเวณแนวกลางเล็กน้อย โดยทั่วไปจัดเป็นความหลากหลายทางรูปร่างของมดลูกที่ปกติ ไม่มีอาการและไม่ส่งผลต่อการตั้งครรภ์
การวินิจฉัย
Arcuate uterus มักถูกตรวจพบจาก ultrasound ที่พบรอยคอดของ endometrial cavity บริเวณ fundus ที่รอยคอดนั้นยาวน้อยกว่า 1 ซม. และมุมของรอยคอด (angle of indentation) มากกว่า 90 องศา (17) ภาพ 3D ultrasound สามารถช่วยยืนยันการวินิจฉัยได้
ความสำคัญ
ปัจจุบัน arcuate uterus ถือเป็น normal variant ไม่มีความสำคัญทางคลินิก (4) ผู้ป่วยไม่มีอาการ ไม่มีผลต่อการเจริญพันธุ์และการตั้งครรภ์
Septate uterus
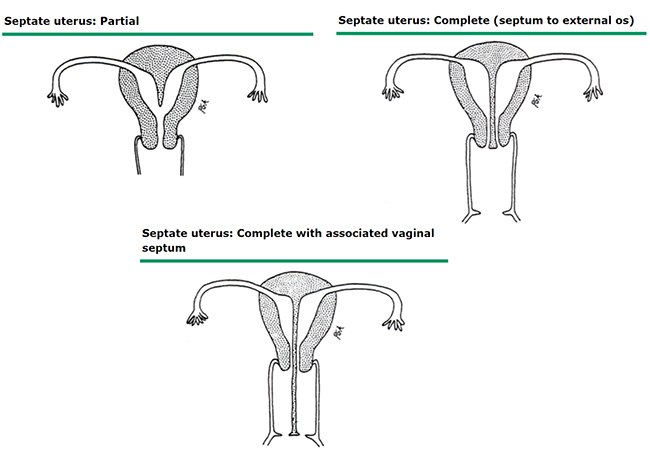
ภาพที่ 7 Septate uterus
septate uterus เป็นความผิดปกติแต่กำเนิดของมดลูกที่พบได้บ่อยที่สุด พบประมาณร้อยละ 35 – 90 ของผู้ป่วยภาวะมดลูกเจริญผิดปกติแต่กำเนิด ผนังกั้น (septum) ประกอบด้วยชั้น myometrium และ endometrium มักมีหลอดเลือดมาเลี้ยง ในบางการศึกษาพบว่า endometrium ที่บริเวณ septum มีลักษณะทาง histology และการแสดงออกของยีนแตกต่างจาก endometrium ที่บริเวณผนังมดลูกปกติ สาเหตุของ septate uterus ไม่ทราบแน่ชัด แต่มีทฤษฎีที่เชื่อว่าเกิดจากความผิดปกติในการ canalization ของ Müllerian ducts ที่มาเชื่อมกัน หรือเกิดจากความผิดปกติในการ resorption ของผนังกั้นระหว่าง Müllerian ducts ความรุนแรงของ septate uterus มีหลากหลาย ตั้งแต่ partial septum (subseptate uterus) ที่มี cervix อันเดียว ไปจนถึง complete septum ที่มีผนังกั้นตั้งแต่ fundus ไปจนถึง vagina
Septate หรือ supseptate uterus (complete or incomplete) แยกกันที่ septate uterus จะมี septum จาก fundus ไปจนถึง internal os (18) ความหนา, สัดส่วนของ muscular tissue กับ fibrous tissue และปริมาณของหลอดเลือดที่มาเลี้ยงมีความหลากหลายมาก ปัจจุบันยังไม่มีระบบที่เป็นมาตรฐานในจำแนกความหลากหลายนี้
การวินิจฉัย
การวินิจฉัยอาศัยการตรวจ ultrasound พบ endometrial cavity 2 cavities แยกจากกันและบริเวณ fundus ด้านนอก ไม่มีรอยคอด (external fundal indentation depth <1 cm) ด้านในมดลูกวัดความยาวของ septum ได้มากกว่าเท่ากับ 1.5 ซม. และมี angle of indentation น้อยกว่า 90 องศา septum โดยมากมักบาง ความยาวมีได้หลากหลาย สามารถยาวได้ถึง cervix และอาจพบร่วมกับ longitudinal vaginal septum (19)
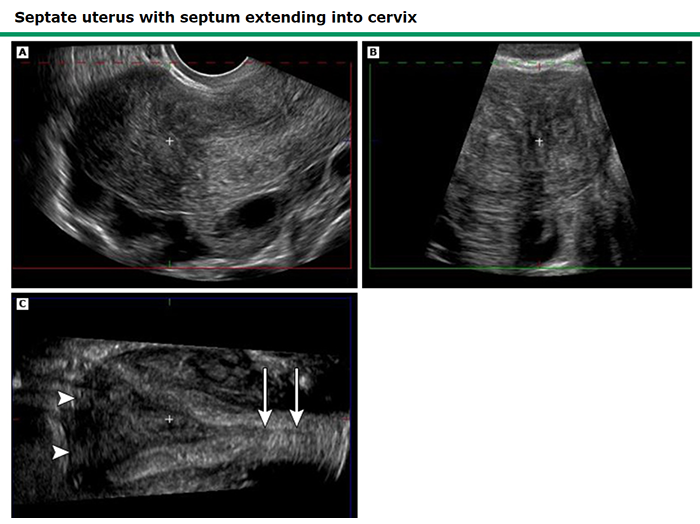
ภาพที่ 8 Ultrasound image of septate uterus
ทั้ง sensitivity และ specificity ของ MRI ในการใช้วินิจฉัย septate uterus เท่ากับร้อยละ 100 สามารถแยกรูปร่างของมดลูกทางด้านนอกว่า เรียบ (septate uterus) หรือ มีรอยคอด (bicornuate uterus) ได้ MRI มีบทบาทในรายที่ 2D ultrasound ไม่สามารถให้การวินิจฉัยได้แน่ชัด หรือ 3D ultrasound ไม่สามารถทำได้ MRI ยังมีส่วนช่วยในการวางแผนการรักษาด้วยการผ่าตัดในรายที่ septum มีขนาดใหญ่, กว้าง และยาวมาก
ความสำคัญ
septate uterus มีผลเพิ่มผลการตั้งครรภ์ไม่พึงประสงค์ (adverse pregnancy outcome) เมื่อเทียบกับมดลูกปกติ septate uterus เพิ่มความเสี่ยงต่อการแท้งบุตร (ร้อยละ 21 – 44), การคลอดก่อนกำหนด (ร้อยละ 12 – 33) ส่วนการเกิดมีชีพพบร้อยละ 50 – 72 ความยาวของ septum ที่เพิ่มขึ้นสัมพันธ์กับอัตราการแท้งบุตรที่เพิ่มขึ้น แต่ยังไม่สามารถยืนยันได้แน่ชัด เนื่องจากผู้ป่วยที่ไม่ได้รับการรักษา ก็สามารถมีการตั้งครรภ์ที่ปกติได้ การแท้งบุตรมักเกิดในช่วงไตรมาสที่สองของการตั้งครรภ์ ต้องแยกโรคจากภาวะปากมดลูกหลวม (cervical insufficiency) นอกจากนี้ septate uterus ยังเพิ่มความเสี่ยงต่อทารกท่าก้นและรกลอกตัวก่อนกำหนด (9)
Septum ที่ยาวไปจนถึง vagina สามารถทำให้เกิด obstructed hemivagina ได้ เป็นสาเหตุของอาการปวดท้องน้อยตามรอบเดือน ตรวจร่ายกายพบก้อนที่บริเวณด้านข้างของช่องคลอด หาก obstructed hemivagina เกิดรูรั่ว อาจเกิดการติดเชื้อ ผู้ป่วยจะมีอาการเลือดออกผิดปกติทางช่องคลอด ตกขาวมีกลิ่นเหม็น มีรายงานพบผู้ป่วยมีอาการติดเชื้อในกระแสเลือด
การรักษาด้วยการผ่าตัด septum ออก (hysteroscopic metroplasty) ช่วยลดการเกิดการตั้งครรภ์ไม่พึงประสงค์ได้ (improve pregnancy outcome)
Bicornuate uterus
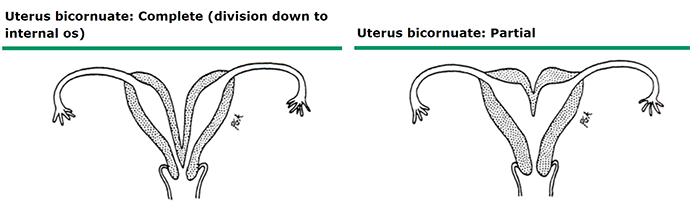
ภาพที่ 9 Bicornuate uterus
bicornuate uterus มีรอยคอดที่บริเวณ fundus ≥ 1 ซม. (17) Vagina และ cervix มักปกติ bicornuate uterus เกิดจาก partial fusion ของ Müllerian ducts แบ่งเป็น complete, partial และ minimal bicornuate uterus
การวินิจฉัย
การวินิจฉัยอาศัยการตรวจ ultrasound พบ endometrial cavities แยกจากกัน ร่วมกับ fundus ด้านนอกมีรอยคอด 3D ultrasound จะให้รายละเอียดของมดลูกทั้งด้านในและด้านนอก ช่วยในการแยก septate และ bicornuate uterus ได้ MRI โดยทั่วไปไม่จำเป็นในการวินิจฉัย อาจพิจารณาทำในรายที่ไม่สามารถทำ 3D ultrasound ได้, ผล ultrasound ไม่สามารถให้การวินิจฉัยได้และมีความผิดปกติที่ซับซ้อนหรือสงสัยความผิดปกติในระบบอื่นๆร่วมด้วย
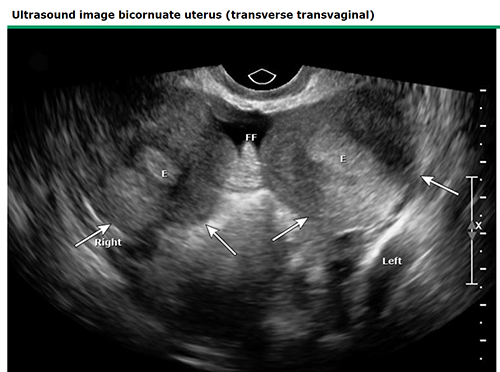
ภาพที่ 10 Ultrasound image of bicornuate uterus
ความสำคัญ
จากการทบทวนการศึกษาที่เกี่ยวข้อง พบ bicornuate uterus สัมพันธ์กับการแท้งบุตร ร้อยละ 36, การคลอดก่อนกำหนด ร้อยละ 21 – 23 และการเกิดมีชีพ ร้อยละ 50 – 60 นอกจากนี้ยังพบทารกเจริญเติบโตช้าในครรภ์ (Fetal growth restriction) และ ทารกท่าก้นเพิ่มขึ้น (9)
ในผู้ป่วยที่มีผลการตั้งครรภ์ไม่พึงประสงค์ที่สัมพันธ์กับ bicornuate uterus สามารถผ่าตัดแก้ไข (laparotomy uterine reunification) เพื่อลดความเสี่ยงได้ ผู้ป่วย bicornuate uterus ที่ตั้งครรภ์ สัมพันธ์กับการเกิด cervical insufficiency ควรที่จะมีการตรวจประเมินความยาวของ cervix (cervical length) ในระหว่างการตั้งครรภ์
Uterine didelphys
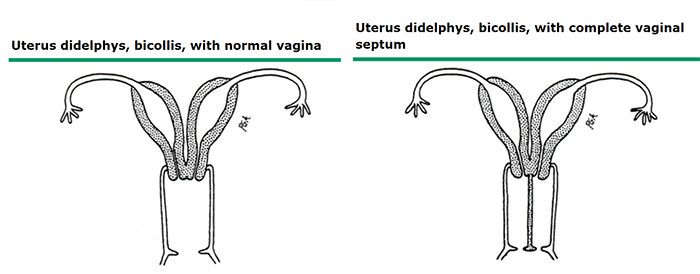
ภาพที่ 11 Uterine didelphys
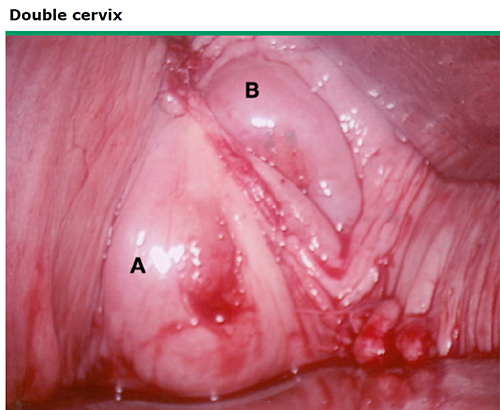
ภาพที่ 12 Double cervixes in uterine didelphys
Uterine didelphys หรือ double uterus เกิดจาก Müllerian ducts ทั้งสองข้างไม่มี fusion กัน ทำให้มี 2 uterus และ 2 cervix แต่ละข้างของ hemiuterus จะมี 1 fallopian tube การเกิด duplication นี้ โดยมากจะเกิดเฉพาะกับ uterus และ cervix แต่มีโอกาสเกิด duplication ของ vagina, vulva, bladder, และ anus ร่วมด้วยได้ ร้อยละ 15 – 20 ของ uterine didelphys จะมีความผิดปกติของอวัยวะข้างเคียงข้างใดข้างหนึ่งร่วมด้วย เช่น obstructed hemivagina และ ipsilateral renal agenesis (ร้อยละ 65 จะเกิดกับข้างขวา) (20)
การวินิจฉัย
การวินิจฉัยอาศัยการ ultrasound พบ 2 uterus ร่วมกับการตรวจภายในพบ 2 cervix การทำ MRI มีบทบาทน้อยในการวินิจฉัยภาวะนี้
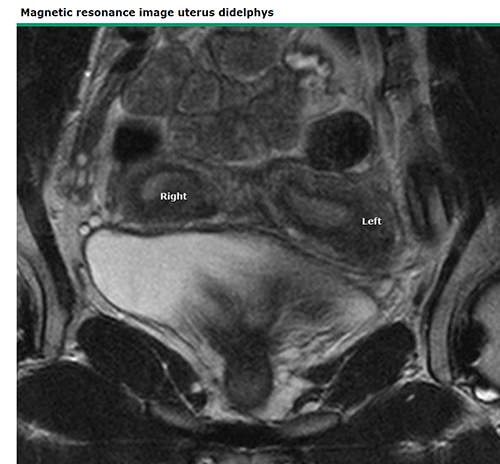
ภาพที่ 13 MRI image of uterine didelphys
ความสำคัญ
สัมพันธ์กับการแท้ง ร้อยละ 32, คลอดก่อนกำหนด ร้อยละ 28 และเพิ่มการเกิด fetal growth restriction, uterine didelphys (9) พบร่วมกับ septate vagina ร้อยละ 75 ทำให้เกิดปัญหาในการมีเพศสัมพันธ์และการคลอดทางช่องคลอดได้ การผ่าตัดแก้ไข (resection of the vaginal septum) มีข้อบ่งชี้ในผู้ป่วยกลุ่มนี้ การผ่าตัด Metroplasty จะพิจารณาทำในผู้ป่วยที่มีอาการปวดท้องน้อย, ภาวะแท้งเป็นอาจิณและมีประวัติคลอดก่อนกำหนด
ผู้ป่วยที่มี obstructed hemivagina และ ipsilateral renal agenesis/anomaly(Herlyn Werner-Wunderlich Syndrome) จะมีประจำเดือนปกติจาก hemiuterus อีกข้างที่ไม่มีการอุดตัน ผู้ป่วยส่วนมากจะเกิดอาการปวดท้องตามรอบเดือนจากการสะสมเลือดประจำเดือนเกิดเป็น hematocolpos ซึ่งอาจมี microcommunication กับ vagina และเกิดการติดเชื้อได้ การอุดตันของ vagina ทั้งสองข้างอาจเกิดขึ้นได้ ผู้ป่วยจะมาด้วยอาการไม่มีประจำเดือน (primary amenorrhea)
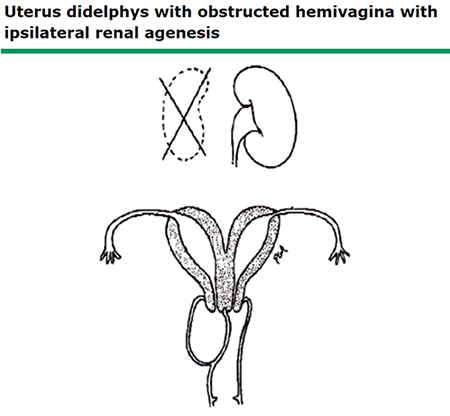
ภาพที่ 14 Uterine didelphys with obstructed hemivagina with ipsilateral renal agenesis
การรักษาได้แก่การผ่าตัด vaginal septum ออก ทำให้เกิด single vagina การผ่าตัดแก้ไข uterine didelphys เพื่อ improve pregnancy outcome ยังขาดหลักฐานที่เพียงพอว่ามีประโยชน์
Unicornuate uterus
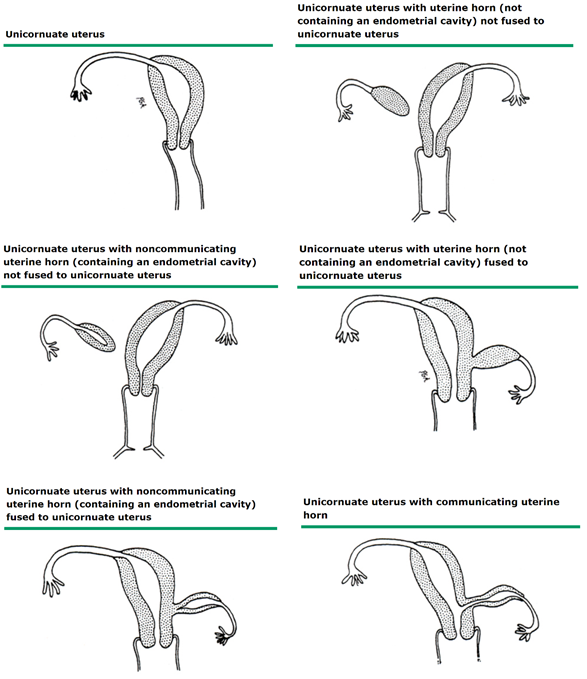
ภาพที่ 15 Unicornuate uterus
unicornuate uterus คือ มดลูกที่มี 1 uterine horn ที่ปกติ ร่วมกับ 1 fallopian tube และ cervix ส่วน Müllerian duct อีกข้างมีความผิดปกติในพัฒนาการ ซึ่งมีความหลากหลายมาก อาจจะไม่พัฒนาเลยหรือพัฒนาเพียงบางส่วน (rudimentary horn) rudimentary horn นี้อาจมีหรือไม่มี endometrial cavity และเชื่อมต่อหรือไม่เชื่อมต่อกับ uterus ก็ได้
การวินิจฉัย
โดยมากวินิจฉัยจาก ultrasound ที่พบ uterus อยู่เพียงด้านในด้านหนึ่งในอุ้งเชิงกราน 3D ultrasound มีส่วนช่วยในการวินิจฉัยได้ การรักษา ควรที่จะประเมิน rudimentary horn ว่าเป็นชนิดใด MRI มีส่วนช่วยในการวางแผนการผ่าตัด
ความสำคัญ
การมี rudimentary horn ส่วนใหญ่ไม่มีอาการ non-communicating endometrial containing rudimentary horn สามารถเกิดการลอกของ endometrium ตามรอบเดือนได้ ทำให้เกิดอาการปวดท้องน้อยตามรอบเดือนหรือปวดท้องน้อยเรื้อรังได้ อายุเฉลี่ยที่เริ่มแสดงอาการ คือ 23 – 26 ปี อาจต้องรักษาด้วยการผ่าตัด rudimentary horn ออก
ผู้ป่วย unicornuate uterus สัมพันธ์กับการเกิด endometriosis, preterm labor และ breech presentation จากการศึกษาการเกิด adverse pregnancy outcome ในหญิงตั้งครรภ์ที่มี unicornuate uterus พบ ectopic pregnancy ร้อยละ 2.7, first-trimester abortion ร้อยละ 24.3, second-trimester abortion ร้อยละ 9.7, preterm delivery ร้อยละ 20.1, fetal demise ร้อยละ 3.8, และ live births ร้อยละ 58.5 (21)
การตั้งครรภ์ใน obstructed หรือ rudimentary uterine horn สามารถเกิดได้ มีโอกาสสูงมากในการเกิดมดลูกแตก (uterine rupture) และ placental accreta จากการศึกษา rudimentary horn pregnancy พบเพียงร้อยละ 1 เท่านั้น ที่สามารถคลอดทารกครบกำหนดมีชีพได้ ร้อยละ 89 เกิด uterine rupture ทั้งแบบที่มดลูกแตกเองและมดลูกแตกในระหว่างเจ็บครรภ์คลอดหรือชักนำการคลอด หากวินิจฉัย rudimentary horn pregnancy ควรที่จะยุติการตั้งครรภ์โดยเร็ว
Unicornuate uterus สัมพันธ์กับการเกิด ectopic ovary มีความสำคัญในผู้ป่วยที่จะทำการกระตุ้นไข่ในกระบวนการทำเด็กหลอดแก้ว หรือมีโอกาสเกิดมะเร็งได้ ectopic ovary สามารถวินิจฉัยได้ด้วย MRI
Unicornuate uterus สัมพันธ์กับการมีความผิดปกติแต่กำเนิดของไตร่วมด้วย พบร้อยละ 40 (22)
ผู้ป่วย unicornuate uterus ไม่เป็นข้อบ่งชี้ในการผ่าตัดแก้ไข เพื่อ improve pregnancy outcome โดยทั่วไปสามารถตั้งครรภ์ได้ อย่างไรก็ตามสามารถเกิด rudimentary horn pregnancy ได้ ซึ่งถือเป็น ectopic pregnancy ประเภทหนึ่ง
เอกสารอ้างอิง
- Marc R Laufer M, Alan H DeCherney, MD. Congenital uterine anomalies: Clinical manifestations and diagnosis2019 2/2/2020. Available from: https://www.uptodate.com/contents/congenital-uterine-anomalies-clinical-manifestations-and-diagnosis?source=history_widget.
- The American Fertility Society classifications of adnexal adhesions, distal tubal occlusion, tubal occlusion secondary to tubal ligation, tubal pregnancies, mullerian anomalies and intrauterine adhesions. Fertil Steril. 1988;49(6):944-55.
- Grimbizis GF, Gordts S, Di Spiezio Sardo A, Brucker S, De Angelis C, Gergolet M, et al. The ESHRE/ESGE consensus on the classification of female genital tract congenital anomalies. Hum Reprod. 2013;28(8):2032-44.
- Lin PC, Bhatnagar KP, Nettleton GS, Nakajima ST. Female genital anomalies affecting reproduction. Fertil Steril. 2002;78(5):899-915.
- Chan YY, Jayaprakasan K, Zamora J, Thornton JG, Raine-Fenning N, Coomarasamy A. The prevalence of congenital uterine anomalies in unselected and high-risk populations: a systematic review. Hum Reprod Update. 2011;17(6):761-71.
- Simon C, Martinez L, Pardo F, Tortajada M, Pellicer A. Mullerian defects in women with normal reproductive outcome. Fertil Steril. 1991;56(6):1192-3.
- Acien P. Incidence of Mullerian defects in fertile and infertile women. Hum Reprod. 1997;12(7):1372-6.
- Grimbizis GF, Camus M, Tarlatzis BC, Bontis JN, Devroey P. Clinical implications of uterine malformations and hysteroscopic treatment results. Hum Reprod Update. 2001;7(2):161-74.
- Venetis CA, Papadopoulos SP, Campo R, Gordts S, Tarlatzis BC, Grimbizis GF. Clinical implications of congenital uterine anomalies: a meta-analysis of comparative studies. Reprod Biomed Online. 2014;29(6):665-83.
- Green LK, Harris RE. Uterine anomalies. Frequency of diagnosis and associated obstetric complications. Obstet Gynecol. 1976;47(4):427-9.
- Heinonen PK. Gestational hypertension and preeclampsia associated with unilateral renal agenesis in women with uterine malformations. Eur J Obstet Gynecol Reprod Biol. 2004;114(1):39-43.
- Haddad B, Louis-Sylvestre C, Poitout P, Paniel BJ. Longitudinal vaginal septum: a retrospective study of 202 cases. Eur J Obstet Gynecol Reprod Biol. 1997;74(2):197-9.
- Thompson DP, Lynn HB. Genital anomalies associated with solitary kidney. Mayo Clin Proc. 1966;41(8):538-48.
- Shatzkes DR, Haller JO, Velcek FT. Imaging of uterovaginal anomalies in the pediatric patient. Urologic radiology. 1991;13(1):58-66.
- Pellerito JS, McCarthy SM, Doyle MB, Glickman MG, DeCherney AH. Diagnosis of uterine anomalies: relative accuracy of MR imaging, endovaginal sonography, and hysterosalpingography. Radiology. 1992;183(3):795-800.
- Soares SR, Barbosa dos Reis MM, Camargos AF. Diagnostic accuracy of sonohysterography, transvaginal sonography, and hysterosalpingography in patients with uterine cavity diseases. Fertil Steril. 2000;73(2):406-11.
- Uterine septum: a guideline. Fertil Steril. 2016;106(3):530-40.
- Heinonen PK. Complete septate uterus with longitudinal vaginal septum. Fertil Steril. 2006;85(3):700-5.
- Ludwin A, Ludwin I, Coelho Neto MA, Nastri CO, Bhagavath B, Lindheim SR, et al. Septate uterus according to ESHRE/ESGE, ASRM and CUME definitions: association with infertility and miscarriage, cost and warnings for women and healthcare systems. Ultrasound Obstet Gynecol. 2019;54(6):800-14.
- Vercellini P, Daguati R, Somigliana E, Vigano P, Lanzani A, Fedele L. Asymmetric lateral distribution of obstructed hemivagina and renal agenesis in women with uterus didelphys: institutional case series and a systematic literature review. Fertil Steril. 2007;87(4):719-24.
- Reichman D, Laufer MR, Robinson BK. Pregnancy outcomes in unicornuate uteri: a review. Fertil Steril. 2009;91(5):1886-94.
- Fedele L, Bianchi S, Agnoli B, Tozzi L, Vignali M. Urinary tract anomalies associated with unicornuate uterus. J Urol. 1996;155(3):847-8.