Menopause and cardiovascular risk
Menopause and cardiovascular risk
พ.ญ.มัลลิกา วงศ์ชนะ
อาจารย์ที่ปรึกษา ศาสตราจารย์แพทย์หญิง สายพิณ พงษธา
วัยหมดระดู (Postmenopause) คือ วัยที่มีการหยุดของรอบประจำเดือน โดยจะต้องมีประวัติว่าประจำเดือนขาดหายเป็นเวลาอย่างน้อย 12 เดือน โดยที่ไม่ได้มีสาเหตุจากความผิดปกติอื่นๆ วัยหมดระดูเป็นช่วงเวลาที่การทำงานของรังไข่ลดลง จนภาวะเจริญพันธุ์สิ้นสุดลง เป็นผลให้เกิดภาวะ hypoestrogenemia มีการเพิ่มขึ้นของ FSH (follicle-stimulating hormone) โดยอายุเฉลี่ย 51.4 ปี [1]
ได้มีการแบ่งระยะของภาวะเจริญพันธุ์ (The Stage Of Reproductive Aging Workshop, STRAW) ดังรูป
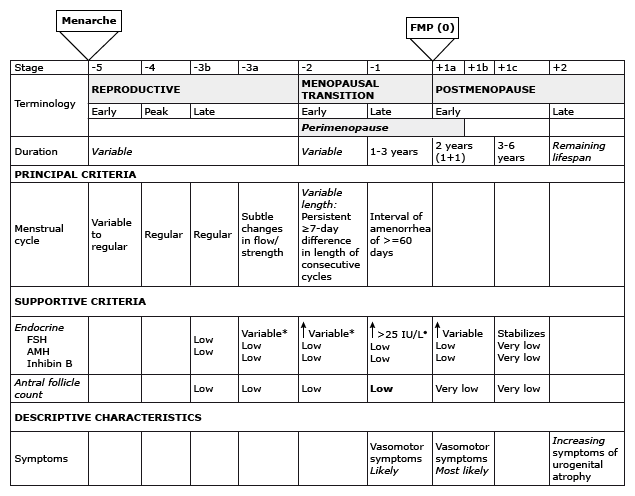
* Blood draw on cycle days 2 to 5.
• Approximate expected level based on assays using current international pituitary standard.
รูปที่ 1: ระยะ (staging) ของภาวะเจริญพันธุ์(reproductive aging) ที่มา Harlow SD, Gass M, Hall JE, et al. Executive Summary of the Stages of Reproductive Aging Workshop + 10. J Clin Endocrinol Metab 2012.[2]
อาการแสดงอันเนื่องมาจากการเปลี่ยนแปลงของระดับฮอร์โมน เริ่มพบได้ตั้งแต่ในช่วง menopausal transition หรือ perimenopause ไปจนถึงช่วง post menopause อาการแสดงที่พบได้ มีดังนี้
- Hot flashes เป็นอาการที่พบบ่อยที่สุดในช่วง menopausal transition และ menopause โดยพบได้ถึง 80% ของสตรี แต่มีเพียง 20-30 % เท่านั้นที่มาพบแพทย์เพื่อต้องการการรักษา พบว่าบางคนจะเริ่มจากมีอาการในช่วงมีประจำเดือนของระยะ late reproductive และอาการเป็นมากขึ้นเมื่อเข้าสู่ระยะ early menopausal transition (40%), late menopausal transition และ early postmenopause (60-80%)
โดยอาการเริ่มด้วยมีความรู้สึกร้อนบริเวณหน้าอกส่วนบน,ใบหน้า และค่อยๆไปทั่วลำตัว เป็นอยู่ 2-4 นาที มักมีเหงื่อและใจสั่นร่วมด้วย บางครั้งมี anxiety ตามมา อาการ hot flashes มักเป็นหลายครั้งต่อวัน โดยมักจะเกิดตอนกลางคืน(night sweats) นอกจากนี้อาการดังกล่าวจะหายได้เองใน 4-5 ปี แต่มีรายงานพบว่ามีได้ไปจนถึงหลังอายุ 70 ปี(9%) - Sleep disturbance มักเกี่ยวข้องกับอาการ hot flashes อาการดังกล่าวพบได้ 32-40% ในช่วง early menopausal transition, 38-46% ในช่วง late menopausal transition การให้การรักษา vasomotor symptoms อาจช่วยให้อาการ sleep disturbance ดีขึ้น
- Depression มักวินิจฉัยได้ในช่วง menopausal transition
- Vaginal drynessเนื่องจาก vagina และ urethra เป็น estrogen-dependent tissue การขาดเอสโตรเจน ทำให้เกิดการบางตัวของชั้น epithelium เป็นผลทำให้เกิด atrophic vaginitis ซึ่งจะมีอาการ vaginal dryness, itching และ dyspareunia อาการดังกล่าวพบได้ 3,4,21,และ 47% ของระยะ reproductive, early menopausal transition, late menopausal transition และ three years postmenopausal stage ตามลำดับ โดยอาการจะเป็นรุนแรงขึ้นตามระยะเวลาที่ขาดเอสโตรเจน สำหรับอาการอื่นๆที่พบร่วมได้
- Pale vagina with lack of the normal rugae
- The external genitalia : scarce pubic hair, diminished elasticity and turgor of the vulvar skin, introital narrowing and fusion or resorption of the labia minora
- Sexual dysfunction เกิดเนื่องจากมีการลดลงของ blood flow ที่ไปยัง vagina และvulva เป็นผลเนื่องจากการขาดเอสโตรเจน ซึ่งเป็นสาเหตุทำให้มีการลดลงของ vaginal lubrication และเกิด sexual dysfunction มีความยืดหยุ่นของช่องคลอดลดลง ทำให้เกิดช่องคลอดสั้นและแคบลง การมีเพศสัมพันธุ์ต่อเนื่องพบว่าสามารถป้องกันการเปลี่ยนแปลงขนาดของช่องคลอดได้แม้ไม่ได้รับการรักษาด้วยฮอร์โมน[3]
- Cognitive changes จะมีปัญหา memory loss และการ concentrate เกิดในช่วง menopausal transition, menopause
- Joint pain พบว่าการให้ combined estrogen-progesterone therapy หรือ unopposed estrogen สามารถลดอาการได้
- Breast pain พบบ่อยในช่วง early menopausal transition และจะหายไปในช่วง late menopausal transition ซึ่งเกิดจากการ fluctuation ของเอสโตรเจน
Long term consequence of estrogen deficiency
- Bone loss เริ่มเกิดในช่วงของ menopausal transition โดยอัตราการสูญเสียสูงสุดในช่วง 1ปีก่อนและ2ปี หลังfinal menstrual period(FMP)
- Cardiovascular disease ความเสี่ยงในการเกิดเพิ่มขึ้นหลังจากmenopause เป็นผลจาก estrogen deficiency และจากปัจจัยเสี่ยงของการเกิดโรคเอง เช่น lipid profile (LDL เพิ่มขึ้นในช่วง menopausal transition, HDL เท่าเดิมในช่วง early post menopause)
- Dementia The Women’s Health Initiative (WHI) รายงานว่า การให้ unopposed estrogen หรือ combined estrogen-progestin therapy ไม่ได้มีประโยชน์ในเรื่องglobal cognitive ในกลุ่มnon-demented postmenopausal women
- Body composition การได้ hormone replacement therapy ช่วยลด central fat distribution
- Skin change เกิดจาก collagen ลดลง แต่ปัจจุบันยังไม่มีข้อมูลที่พบว่าเอสโตรเจน ทำให้มีการเปลี่ยนแปลงลดลง
General approach
– กลุ่มอายุมากกว่า 45 ปี
Menopausal transition เกิดในช่วงอายุเฉลี่ย 47 ปี ดังนั้นในการประเมินว่าหญิงที่อายุมากกว่า 45 ปี เข้าสู่ menopausal transitionแล้วหรือยังนั้นจะใช้อาการของวัยหมดประจำเดือนร่วมกับการมีรอบประจำเดือนผิดปกติ สำหรับผล FSH พบว่ายังมีความแปรปรวน ทำให้แปลผลผิดพลาดได้ จึงไม่แนะนำให้ใช้ผลเลือดในการประเมิน
แต่หากไม่มีอาการของวัยหมดประจำเดือนแต่มีลักษณะของรอบประจำเดือนผิดปกติ การใช้ผล FSH (>25 IU/L) จะช่วยในการวินิจฉัยได้
นอกจากนี้หากสงสัยว่ามีภาวะอื่นที่ทำให้มีอาการของรอบประจำเดือนผิดปกติได้ ควรได้รับการตรวจหาสาเหตุเพิ่มเติมด้วย เช่น thyroid disease, hyperprolactinemia
-กลุ่มอายุ 40-45 ปี
หญิงที่มาด้วยอาการรอบประจำเดือนไม่สม่ำเสมอร่วมกับมีหรือไม่มีอาการของ menopause ในช่วงอายุ 40-45 ปี ควรตรวจหาสาเหตุอื่นก่อนเสมอ เช่น pregnancy,hyperprolactinemia, hyperthyroidism
-กลุ่มอายุน้อยกว่า 40 ปี
ควรตรวจหาสาเหตุอื่นที่ทำให้รอบประจำเดือนผิดปกติ สาเหตุที่สำคัญคือ primary ovarian insufficiency
-กลุ่มที่มีปัญหารอบประจำเดือนผิดปกติมาก่อน
พบในกลุ่ม polycystic ovary syndrome(PCOS), hypothalamic amenorrhea ควรใช้ค่า FSH ช่วยในการวินิจฉัย
-กลุ่มที่กินยาคุมกำเนิด
การกินยาคุมกำเนิดมีผลให้ไม่มีความผิดปกติของรอบประจำเดือนและไม่มีอาการของmenopause เนื่องจากมีการกด hypothalamic-pituitary axis ทำให้ค่า FSH แปลผลไม่ได้หากเจาะขณะกินยา จึงควรเจาะหลังหยุดยาคุมกำเนิด 2-4 สัปดาห์ หากมีค่า≥ 25 IU/L แสดงว่าน่าจะเข้าสู่ช่วง menopausal transition
-กลุ่มที่ได้รับการผ่าตัดhysterectomy หรือ endometrial ablation
ให้ใช้อาการและผล FSH
Late postmenopausal transition : FSH > 25 IU/L
Postmenopause :FSH 70-100 IU/L
Hormone replacement therapy
เป้าหมายในการใช้ฮอร์โมนก็เพื่อรักษา vasomotor symptom เป็นหลัก ซึ่งให้ผลตอบสนองดีต่อการใช้เอสโตรเจน พบว่าในหญิงสุขภาพดี การได้รับการรักษาด้วยฮอร์โมนในช่วงปลายอายุ40หรือ50ปี เมื่อใช้เป็นเวลา5ปี ยังไม่พบภาวะแทรกซ้อนใดๆ
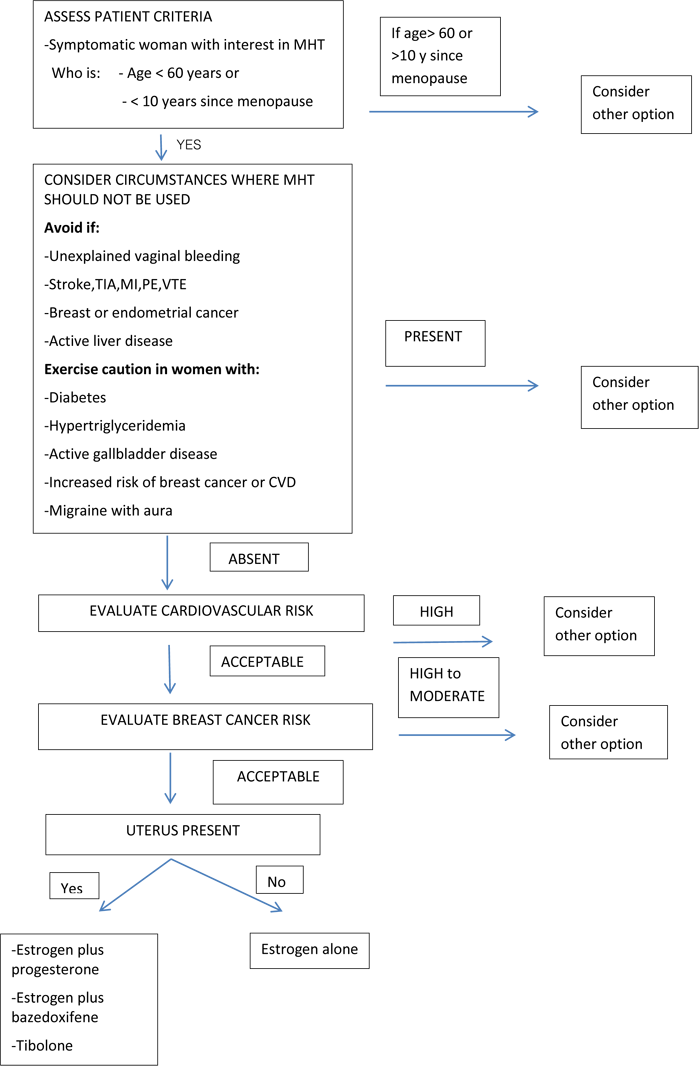
รูปที่ 2: Approach to the patient with VMS contemplating MHT. TIA,transien t ischemic attack [3]
ชนิดของฮอร์โมนทดแทน
ฮอร์โมนทดแทนมีทั้งชนิดรับประทานและแบบแผ่นแปะผิวหนัง(transdermal) พบว่า
- เอสโตรเจนทุกรูปแบบมีประสิทธิภาพในการรักษาอาการ vasomotor symptom เท่ากัน แต่ชนิดแผ่นแปะผิวหนัง มีความเสี่ยงในการเกิด venous thromboembolism, stroke น้อยกว่า
- แนะนำว่าควรเลือกใช้ชนิดแผ่นแปะที่มีเอสโตรเจน 17-beta estrial (Grade 2C)
- ในสตรีที่ยังมีมดลูก ต้องให้โปรเจสเตอโรนร่วมด้วยเพื่อป้องกันภาวะ Endometrial hyperplasia, carcinoma
- แนะนำว่าควรเลือกใช้โปรเจสเตอโรนชนิด micronized progesterone พบว่าไม่เพิ่มความเสี่ยงของทั้ง breast cancer,CHD แม้ว่ายังมีข้อมูลจำกัด(Grade 2C)
- ไม่แนะนำให้ใช้ฮอร์โมนทดแทนเพื่อการป้องกันโรคเรื้อรัง ได้แก่ osteoporosis, CHD, dementia (Grade 2B)
Menopause and cardiovascular risk
มีการศึกษาในระยะแรกพบว่า หญิงในกลุ่ม Early natural menopause (อายุ≤44ปี ) จะเพิ่มความเสี่ยงของการเกิดโรคหลอดเลือดหัวใจ ศึกษาทั้งในกลุ่มที่สูบและไม่สูบบุหรี่[4, 5]
ผลของเอสโตรเจนต่อระบบหลอดเลือดและหัวใจ
ข้อดี
- Lipid profile ดีขึ้น (เอสโตรเจนชนิดรับประทาน)
- เพิ่ม endothelial function (แต่ไม่พบในคนที่ประจำเดือนหมดเป็นเวลานานและมีโรคหลอดเลือดหัวใจ)
- Improve insulin sensitivity แต่ข้อมูลยังไม่ชัดเจน
ข้อเสีย
- Triglyceride เพิ่มขี้น (เอสโตรเจนชนิดรับประทาน)
- Serum fibrinogen, factor VII และ antithrombin III ลดลง (เอสโตรเจนชนิดรับประทาน) แต่มีผลน้อยหากเป็นชนิดแผ่นแปะผิวหนัง
- มีการเพิ่มการสร้าง vascular inflammatory marker ของตับ ได้แก่ C-reactive protein(CRP) โดยเฉพาะเอสโตรเจนชนิดรับประทาน[6]
ผลของโปรเจสตินต่อระบบหลอดเลือดและหัวใจ
พบว่า Synthetic progestin ได้แก่ medroxyprogesterone acetate มีผลต้านกับเอสโตรเจนในเรื่องของไขมันและหลอดเลือด สำหรับ natural progesterone นั้น มีการศึกษาน้อย แต่ก็ไม่พบว่ามีผลต้านกับเอสโตรเจนในเรื่องของไขมัน
นอกจากนี้ทั้ง unopposed conjugated estrogen และ combined conjugated estrogen-progestin therapy มีผลเพิ่ม C-reactive protein
Primary prevention
ในการศึกษาช่วงแรกพบว่าการให้ estrogen therapy แบบระยะยาว(มากกว่า 5 ปี) มีผลป้องกันการเกิดcoronary heart disease (CHD) เป็นผลจากของเอสโตรเจน
หลังจากนั้นทาง Women’s Health initiative (WHI) trial พบว่าการให้ hormone replacement therapy ไม่ช่วยในเรื่อง primary prevention ของโรคหลอดเลือดหัวใจ[7, 8] ซึ่งศึกษาในหญิงวัยหมดประจำเดือน อายุ 50-79 ปี
จากการศึกษาหนึ่งของ WHI ได้ศึกษาการให้ combined continuous estrogen-progesterone เทียบกับยาหลอก ได้ยุติไปเนื่องจากพบว่าเพิ่มความเสี่ยงของการเกิด breast cancer, stroke, CHD, venous thromboembolism(VTE) หลังจากติดตามไปเฉลี่ย 5.2 ปี ถึงแม้จะพบว่ามีประโยชน์ในเรื่องลดความเสี่ยงของการเกิดfracture และ colon cancer[9]
ได้มีการศึกษาของ WHI ในการให้ unopposed estrogen (conjugated estrogen 0.625 mg) เทียบกับยาหลอกในผู้หญิงที่ทำ hysterectomy พบว่าเมื่อติดตามไป1ปี ได้ยุติลงเนื่องจากพบความเสี่ยงของการเกิด stroke และไม่พบว่ามีข้อดีอื่นๆ[8]
Combined estrogen-progestin
จากรายงานในระยะแรกของ WHI พบความเสี่ยงของcoronary heart disease(hazard ratio = 1.24) แต่อย่างไรก็ตาม การศึกษาต่อๆมาพบว่า ความเสี่ยงที่เพิ่มขึ้นน่าจะเป็นผลจากอายุเยอะ นอกจากนี้ปัจจัยเสี่ยงอื่นๆ ได้แก่ body mass index(BMI), vasomotor symptom, coronary risk factor, aspirin, statin พบว่าไม่มีผลต่อการ CHD risk ในคนที่ได้รับ hormone replacement therapy[10] นอกจากนี้ยังพบว่าเพิ่มความเสี่ยงของการเกิด stroke, breast cancer และ VTE เล็กน้อยแบบindividual
แต่ได้มีการศึกษาของ Women’s International Study of Long-Duration Oestrogen After Menopause (WISDOM) พบว่า เมื่อติดตามไป 12 เดือน มีผลเพิ่มความเสี่ยงของการเกิด CHD และ VTE แต่ไม่พบเพิ่มความเสี่ยงของ stroke แต่การศึกษาดังกล่าวไม่ได้วิเคราะห์เรื่องอายุและระยะเวลาหลังหมดประจำเดือน[11]
Unopposed estrogen
จากรายงานของ WHI พบว่า hazard ration ต่อ CHD เท่ากับ 0.95 [8]ซึ่งเป็นผลป้องกันการเกิด CHD ในสตรีอายุ 50-59 ปี[12] ดังนั้นจึงสรุปได้ว่า progestin เป็นตัวหลักที่ทำให้เพิ่มความเสี่ยงต่อ CHD
ส่วนผลอื่นๆของ unopposed estrogen ได้แก่ stroke, VTE
Predictors of risk of CHD
- การใช้ statin, diabetic mellitus, ค่า lipid markers, thrombotic markers, imflammatory marker มีผลต่อ CHD event
- Baseline LDL cholesterol สูง พบว่าเพิ่มความเสี่ยงของ CHD ในคนที่ได้ menopausal hormone therapy
- Combined therapy มีผลกับ biomarker : CRP, HDL, triglycerides เพิ่มขึ้น, LDL ลดลง แต่การเปลี่ยนแปลงดังกล่าวไม่มีผลกับความเสี่ยงของ CHD
Timing of exposure
จากหลายการศึกษาสรุปได้ว่าระยะเวลาที่ได้รับฮอร์โมนเป็นปัจจัยสำคัญที่มีผลต่อความเสี่ยงของ CHD โดยหากได้รับหลังหมดประจำเดือนระยะแรกๆ พบว่าไม่ผลต่อความเสี่ยงของ CHD โดยมีความสัมพันธ์กับ subclinical atherosclerosis baseline โดยในคนที่อายุไม่มากจะมีลักษณะของ atherosclerotic plaque ที่ยังคงที่
มีการศึกษาของ WHIได้กล่าวถึงเรื่อง cardioprotective effect ของการให้ hormone therapy และ estrogen therapy ซึ่งเรียกว่า timing hypothesis กล่าวว่า สตรีที่เพิ่งหมดประจำเดือนจะได้รับประโยชน์จากการรักษาด้วยฮอร์โมนมากกว่ากลุ่มที่หมดประจำเดือนไปแล้ว ≥ 10 ปี หรืออายุมากกว่า 60 ปี หลังจากนั้นมีหลายการศึกษาหลัก ๆ ดังนี้
- the HERS trial(1998), the HERS II trial(2002 ): พบว่าในคนที่เป็นโรคหลอดเลือดหัวใจอยู่เดิม การให้ hormone therapy ไม่ช่วยลดความเสี่ยงของการเกิดโรคหลอดเลือดหัวใจ และพบว่าจะเพิ่มความเสี่ยงของการเกิดถึง 52%[13, 14]
- WHI (ปี 2002): พบว่าการให้ hormone therapy ในคนที่สุขภาพดี เมื่อติดตามไป 5.2ปี จะช่วยป้องกันโรคหลอดเลือดหัวใจ แต่การศึกษาก็ได้ยุติลงเนื่องจากพบว่ามีผลเสียต่อระบบหลอดเลือดและหัวใจและในเรื่อง global index (มีความเสี่ยงของการเกิด breast cancer, stroke, pulmonary embolism, endometrial cancer, colorectal cancer, hip fracture) และพบว่าเพิ่มความเสี่ยงของการเกิดอุบัติการณ์ของหลอดเลือดหัวใจ 29% ซึ่งเกิดขึ้นไม่นานหลังจากเริ่มทำการศึกษา[9]
- ET trial (Follow up ต่อของ WHI trial),(2004) : การได้ estrogen therapy อาจจะช่วยลดความเสี่ยงของการเกิดโรคหลอดเลือดหัวใจในกลุ่มที่ใช้เป็นเวลานาน แต่ไม่พบความแตกต่างของอุบัติการณ์การเกิดโรคหลอดเลือดหัวใจเมื่อเทียบกับกลุ่มที่ใช้ยาหลอก[8]
- The WHI Coronary Artery Calcium Study(2007) : ศึกษาในสตรี 1,064 คน อายุ 50-59 ปี ซึ่งเป็นคนที่เข้าร่วมการศึกษาของ WHI ในส่วนที่ได้รับ Estrogen therapy โดยได้ทำ computed tomography ของหัวใจ เพื่อดูระดับของ coronary artery calcium burden โดยพบว่าคนที่ได้รับ Estrogen therapy จะมีระดับดังกล่าวน้อยกว่าเมื่อเทียบกับกลุ่มที่ได้รับยาหลอก และในคนที่ได้รับฮอร์โมนต่อเนื่อง(80% ใช้นาน≥5ปี) ยังช่วยลดเรื่องของ coronary artery calcification [8]
Secondary prevention
ถึงแม้ว่ามีหลายการศึกษาบอกว่าในสตรีที่มี CHD จะได้รับประโยชน์หากได้รับการป้องกันการเกิด coronary event แต่ก็ยังไม่มีการยืนยันของประโยชน์ชัดเจน
จากหลายการศึกษาข้างต้น สรุปได้ว่า
Estrogen therapy
- Estrogen therapy ไม่เพิ่มความเสี่ยงของ coronary heart disease หากเริ่มได้รับตั้งแต่อายุน้อยกว่า 60 ปี และอาจจะลดความเสี่ยงได้ด้วย[15]
- การให้แบบ oral หรือ transdermal ไม่มีความแตกต่างของการเกิด coronary heart disease และขนาดของ estrogen ก็ไม่มีผล[15]
Combined estrogen progesterone therapy
- สตรีที่เป็น early menopause และไม่มีความเสี่ยงของหลอดเลือดหัวใจ และมีอาการของวัย
- หมดประจำเดือน ควรพิจารณาให้ estrogen therapy หรือ conjugated equine estrogenร่วมกับ progestin (medroxyprogesterone acetate or micronized progesterone)[16]
- การให้ estrogen progesterone therapy ไม่พบว่าเพิ่มความเสี่ยงของโรคหลอดเลือดหัวใจหากให้ตอนใกล้เข้าสู่วัยหมดระดู
เอกสารอ้างอิง
- RobertF Casper, M., Clinical manifestations and diagnosis of menopause,UpToDate. 2016.
- Harlow, S., et al. STRAW 10 Collaborative Group. in Executive summary of the Stages of Reproductive Aging Workshop.
- Cutler, W.B., C.R. Garcia, and N. McCoy, Perimenopausal sexuality. Archives of Sexual Behavior, 1987. 16(3): p. 225-234.
- Charalampopoulos, D., et al., Age at menarche and risks of all-cause and cardiovascular death: a systematic review and meta-analysis. American journal of epidemiology, 2014. 180(1): p. 29-40.
- Lakshman, R., et al., Early age at menarche associated with cardiovascular disease and mortality. The Journal of Clinical Endocrinology & Metabolism, 2009. 94(12): p. 4953-4960.
- Brosnan, J.F., B.L. Sheppard, and L.A. Norris, Haemostatic activation in post-menopausal women taking low-dose hormone therapy: less effect with transdermal administration? Thrombosis and haemostasis, 2007. 97(4): p. 558-565.
- Investigators, G.f.t.W.s.H.I., Risk and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. JAMA, 2002. 288(3): p. 321-333.
- Anderson, G., et al., Women’s Health Initiative Steering Committee. Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women’s Health Initiative randomized controlled trial. Jama, 2004. 291(14): p. 1701-1712.
- Investigators, W.G.f.t.W.s.H.I., Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women’s Health Initiative randomized controlled trial. Jama, 2002. 288(3): p. 321-333.
- Manson, J.E., et al., Estrogen plus progestin and the risk of coronary heart disease. New England Journal of Medicine, 2003. 349(6): p. 523-534.
- Vickers, M.R., et al., Main morbidities recorded in the women’s international study of long duration oestrogen after menopause (WISDOM): a randomised controlled trial of hormone replacement therapy in postmenopausal women. Bmj, 2007. 335(7613): p. 239.
- Hsia, J., et al., Conjugated equine estrogens and coronary heart disease: the Women’s Health Initiative. Archives of internal medicine, 2006. 166(3): p. 357-365.
- Hulley, S., et al., Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Jama, 1998. 280(7): p. 605-613.
- Grady, D., et al., Cardiovascular disease outcomes during 6.8 years of hormone therapy: Heart and Estrogen/progestin Replacement Study follow-up (HERS II). Jama, 2002. 288(1): p. 49-57.
- Stuenkel, C.A., et al., Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism, 2015. 100(11): p. 3975-4011.
- Manson, J.E. and S.S. Bassuk, Invited commentary: hormone therapy and risk of coronary heart disease—why renew the focus on the early years of menopause? American Journal of Epidemiology, 2007. 166(5): p. 511-517.