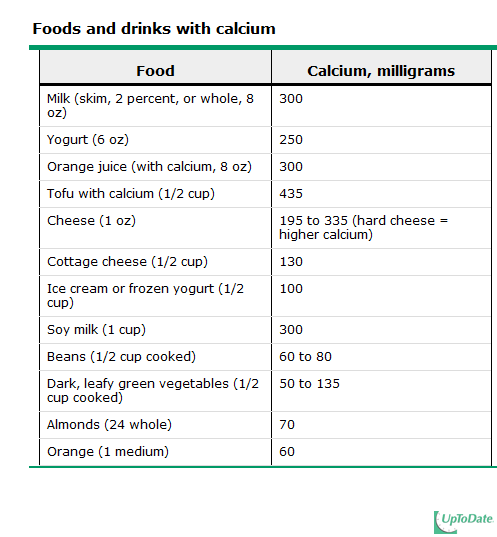
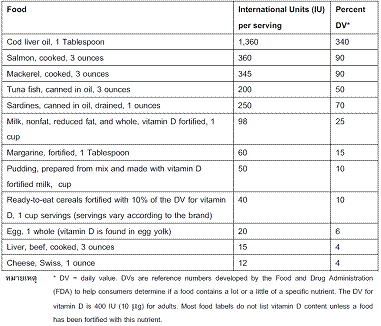
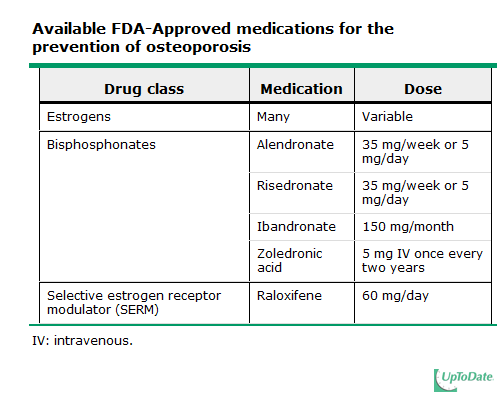
ยาต้านไวรัสที่ใช้ในการรักษาโรคเอดส์สำหรับสตรีตั้งครรภ์
ยาต้านไวรัสที่ใช้ในการรักษาโรคเอดส์สำหรับสตรีตั้งครรภ์
(Antiretroviral medications in pregnant HIV-infected patients)
นพ.ภักดี แก้วแปงจันทร์
รศ.พญ.พรรณี ศิริวรรธนาภา
โรคเอดส์ (AIDS)
โรคเอดส์ (AIDS) หรือโรคภูมิคุ้มกันบกพร่อง (Acquired immune deficiency syndrome) เป็นกลุ่มอาการที่มีสาเหตุมาจากการติดเชื้อไวรัสที่ชื่อว่า Human immunodeficiency virus (HIV) ซึ่งเป็น RNA virus ที่มีคุณสมบัติเฉพาะในการทำลาย T-helper lymphocyte หรือ CD4 cells เป็นผลให้ระบบภูมิคุ้มกันของผู้ป่วยเสื่อมลงอย่างรวดเร็วจนทำหน้าที่ป้องกันอันตรายให้แก่ร่างกายไม่ได้ ในระยะสุดท้ายของโรคผู้ป่วยมักเสียชีวิตเนื่องจากอาการแทรกซ้อนต่าง ๆ เช่น การติดเชื้อฉวยโอกาสบางชนิด เช่น เชื้อรา เชื้อวัณโรค เป็นต้น
การรักษาการติดเชื้อ HIV ในสตรีตั้งครรภ์
การรักษาผู้ที่ติดเชื้อ HIV ในสตรีตั้งครรภ์ได้มีการพัฒนามาอย่างต่อเนื่องถึง 25 ปี โดยได้มีการพัฒนาสูตรยาต้านไวรัสมาใช้ในสตรีตั้งครรภ์ซึ่งเป้าหมายของการให้ยา คือ เพื่อรักษาโรคติดเชื้อในส่วนของแม่ และเพื่อลดการถ่ายถอดเชื้อจากแม่ไปยังลูกในประเทศที่พัฒนาแล้วพบว่าหลังจากมีการให้ยาต้านไวรัสแก่สตรีตั้งครรภ์แล้วโอกาสที่จะถ่ายทอดเชื้อจากแม่ไปยังลูกในครรภ์ได้ลดลงมาก
ความสำเร็จในการลดการถ่ายทอดเชื้อจากแม่สู่ลูกนั้นเกิดจาก การตรวจคัดกรองภาวะการติดเชื้อ HIV ในสตรีตั้งครรภ์ที่มาฝากครรภ์ทุกรายและให้ยาต้านไวรัสตั้งแต่ต้น การผ่าตัดคลอดในรายที่มีข้อบ่งชี้อย่างเหมาะสม และการงดให้นมบุตรในรายที่แม่ติดเชื้อ
โดยการให้ยาต้านไวรัสจะให้กับสตรีตั้งครรภ์ที่ติดเชื้อทุกราย โดยไม่ได้คำนึงถึงระดับCD4 T lymphocyte count และระดับPlasma HIV RNA copy number โดยจะต้องให้ยาต้านไวรัสทั้ง 3 ระยะ คือ ขณะตั้งครรภ์ ขณะเจ็บครรภ์คลอด ขณะคลอด และขณะให้นมบุตรด้วย โดยพบว่าสามารถลดโอกาสการถ่ายถอดเชื้อไปสู่ลูกในครรภ์ให้ลดลงเหลือน้อยกว่า 2 เปอร์เซ็นต์
วงจรชีวิตของเชื้อ HIV
อนุภาคไวรัส HIV เมื่อเข้าสู่ร่างกายจะมีการเกาะติดระหว่าง GP120 ซึ่งเป็นไกลโคโปรตีนที่อยู่บน Envelop ของเชื้อกับ CD4 receptor ที่อยู่บน CD4 cell หลังจากนั้นเชื้อจะแทรกตัวเข้าไปในCytoplasm ของ CD4 cellแล้วทำการแยกส่วนชั้นเปลือกนอกที่เป็นโปรตีนออกจากส่วนแกนกลางที่เป็นสารพันธุกรรม คือ Single stranded RNA หลังจากนั้น เอนไซม์ Reverse transcriptase จะเปลี่ยน RNA ของเชื้อให้เป็น Single stranded DNA ก่อน จากนั้น Single stranded DNA จึงจะถูกเปลี่ยนต่อให้อยู่ในรูป Doluble stranded DNA ก่อนที่จะเข้าไปเชื่อมต่อกับโครโมโซมของ เซลล์เจ้าบ้าน โดยอาศัยการทำงานของเอนไซม์ Integraseโดย Integrated viral DNA จะทำหน้าที่เป็นตัวก่อไวรัส (Provirus) กล่าวคือ Gene ของไวรัสจะสงบนิ่งเพื่อรอโอกาสที่เหมาะสม เช่น เมื่อ เซลล์เจ้าบ้าน อ่อนแอลงเนื่องจากมีการติดเชื้อชนิดอื่น โดย Provirus จะเร่งสร้างทั้ง RNAที่เป็นสารพันธุกรรมของเชื้อ และ mRNA ซึ่งจะไปควบคุมการสร้างโปรตีนของเชื้อ ซึ่งโปรตีนเหล่านี้บางตัวจะถูกสร้างในรูปโปรตีนต้นแบบ (Precursor) ที่มีโมเลกุลค่อนข้างใหญ่ก่อนแล้วจึงจะถูกย่อยด้วยเอนไซม์ Proteaseของเชื้อให้มีขนาดเล็กลงที่พร้อมจะไปใช้งานได้ จากนั้นจึงมีการประกอบตัวกันของส่วนประกอบต่าง ๆ ของไวรัสกลายเป็นอนุภาคไวรัสที่สมบูรณ์แบบ (Mature virus) และถูกปลดปล่อยออกจากเซลล์ไปติดเซลล์อื่น ๆ ต่อไป
กลไกการออกฤทธิ์ของยาต้านไวรัส HIV
นักวิทยาศาสตร์ได้พยายามค้นคว้าวิจัยเพื่อพัฒนายาที่จะใช้ทำลายหรือต้านการเจริญเติบโตของไวรัสชนิดนี้ ซึ่งยาที่พัฒนาขึ้นมาจะมีกลไกการออกฤทธิ์ในขั้นตอนต่าง ๆ ในวงจรชีวิตของเชื้อดังต่อไปนี้
- ป้องกันไม่ให้อนุภาคไวรัสเข้าจับกับตัวรับ CD4 receptor บนCell membrane เช่นใช้สารสะลายRecombinant CD4 ฉีดเข้าไปในกระแสเลือดเพื่อขัดขวางไม่ให้ไวรัสจับกับ CD4
- ยับยั้งการหลอมตัวของไวรัสเข้ากับบนCell membrane (Fusion inhibitor)
- ยับยั้งการแยกส่วน (Uncoating) ของไวรัสที่เข้าสูเซลล์ ปัจจุบันยังไม่มียาตัวใดที่มีประสิทธิภาพเช่นนี้
- ยับยั้งการทำงานของเอนไซม์ Reverse transcriptase ยาหลายตัวที่นิยมใช้ในการรักษาโรคเอดส์ ในปัจจุบันจะออกฤทธิ์ยับยั้งการเจริญของเชื้อโดยอาศัยกลไกนี้
- ยับยั้งการทำงานของเอนไซม์ Integraseขั้นตอนนี้น่าจะเป็นอีกเป้าหมายหนึ่งที่จะสามารถยับยั้งการเจริญเติบโตของเชื้อ HIV แต่ยังไม่มีการศึกษากันมากนัก
- ยับยั้งการทำงานของเอนไซม์ Protease ปัจจุบันมียาที่ออกฤทธิ์ยับยั้งขั้นตอนนี้หลายชนิดที่ได้รับอนุมัติให้ใช้รักษาโรคเอดส์ได้
- รบกวนหรือยับยั้งการประกอบตัวระหว่าง RNA กับโปรตีนเปลือกนอกของไวรัส และการเคลื่อนตัวของไวรัสออกจากเซลล์ ยังไม่มียาที่มีประสิทธิภาพเช่นนี้ในปัจจุบัน
ยาต้านไวรัสที่ใช้ในการรักษาโรคเอดส์ในสตรีตั้งครรภ์ในปัจจุบัน
1.1 ย าที่ออกฤทธิ์ยับยั้งการทำงานของเอนไซม์ Reverse transcriptase ที่เป็นอนุพันธุ์ของสารNucleosides (Nucleoside reverse transcriptase inhibitors; NRTIs)
1.1.1 Zidovudine (Azidothymidine, Retrovi,AZT)
Zidovudineเป็นยาที่จัดอยู่ใน Category : C โดยสามารถผ่านออกทางรกได้เร็วและดี สามารถขับออกทางน้ำนมได้เป็นยาตัวแรกที่พบว่ามีผลยับยั้งเชื้อ HIV ทั้งในห้องปฏิบัติการ
กลไกการออกฤทธิ์ของAZT โดยตัวมันเองจะไม่มีฤทธิ์ แต่เมื่อเข้าสู่ร่างกายแล้วจะถูกเปลี่ยนให้อยู่ในรูป Triphosphate โดยอาศัยเอนไซม์ Kinase ในเซลล์ ซึ่ง AZT triphosphate จะออกฤทธิ์ยับยั้งการทำงานของ Reverse transcriptase ได้อย่างค่อนข้างเฉพาะเจาะจง โดยจะมีผลยับยั้ง Reversetranscriptase ของเชื้อมากกว่า Cellular DNA polymerase ถึง 100 เท่า นอกจากนี้แล้ว AZTtriphosphateซึ่งมีสูตรโครงสร้างคล้ายคลึงกับ Thymidine บางส่วนจะถูกนำเข้าไปในสายของ DNA ของเชื้อแทน Thymidine เป็นผลให้การสร้าง DNA ของเชื้อหยุดชะงักด้วย
เภสัชจลนศาสตร์ยานี้จะถูกดูดซึมจากทางเดินอาหารได้ดี ถูกเปลี่ยนแปลงที่ตับและขับออกทางปัสสาวะในรูป Glucoronide conjugate AZT ในรูป Triphosphaseจะมีค่าครึ่งชีวิตในเลือดประมาณ 1 ชม.
อาการไม่พึงประสงค์ที่พบบ่อยได้แก่ เบื่ออาหาร อ่อนเพลีย ปวดหัว ปวดกล้ามเนื้อ คลื่นไส้นอนไม่หลับ นอกจากนี้ยังอาจทำให้เกิดภาวะโลหิตจาง ซึ่งอาจเนื่องมาจากพิษของยาต่อ Erythoroid stemcell ภาวะซีดที่เกิดจากยานี้อาจแก้ไขได้ด้วยการให้สาร Erythropoietin เพื่อกระตุ้นการสร้างเม็ดเลือดแดง หรือเลี่ยงไปใช้ยาต้านไวรัสตัวอื่น นอกจากนี้แล้วการใช้ AZT ติดต่อกันนานๆ จะทำให้เล็บมีสีเข้มขึ้น กล้ามเนื้อเสื่อม(Myopathy) รวมทั้งเกิดพิษต่อตับ
ประโยชน์ในทางการแพทย์Zidovudineถือเป็นยาที่แนะนำให้ใช้ในผู้ป่วยหญิงที่ตั้งครรภ์มากที่สุดซึ่งจากการศึกษาต่าง ๆ พบว่ามีประสิทธิภาพดีที่สุดสามารถลดการถ่ายทอดเชื้อจากแม่สู่ลูกได้ถึง 70 เปอร์เซ็นต์ และไม่ผลที่เป็นToxicityต่อทารกในครรภ์
การดื้อยา ผู้ป่วยโรคเอดส์ที่ได้รับยา AZT ติดต่อกันเป็นเวลานาน ๆ อาจทำให้เชื้อ HIV เกิดการดื้อยาขึ้นได้ ทั้งนี้เป็นผลเนื่องมาจากการกลายพันธุ์ (Mutation) ของเอนไซม์ Reverse transcriptaseปัจจุบันนิยมใช้ AZT ร่วมกับยาอื่น ๆ เป็นแบบ double หรือ triple combination ในการรักษาโรคเอดส์เพื่อเพิ่มประสิทธิภาพและป้องกันการดื้อยาของเชื้อ
1.1.2 Dianosine(Dideoxyinosine, Videx,ddI)
Didanosineเป็นยาที่จัดอยู่ในกลุ่ม Category : Bพบว่าสามารถผ่านทางรกได้เล็กน้อย แต่ไม่มีข้อมูลเรื่องการผ่านทางน้ำนม
Didanosineเป็น Nucleoside analog อีกตัวหนึ่งที่นิยมใช้ในการรักษาโรคเอดส์ ยานี้เมื่อเข้าสู่ร่างกายแล้วจะถูกเปลี่ยนให้อยู่ในรูป2′,3′-dideoxyadenosine-5′-triphosphate (ddATP) ซึ่งจะมีกลไกการออกฤทธิ์คล้ายคลึงกับ AZT
เภสัชจลนศาสตร์ddIจะไม่ทนต่อกรดในกระเพาะอาหาร ดังนั้นจึงควรให้ร่วมกับยาลดกรด หรือให้มีการผสม Buffer ลงในเม็ดยาเพื่อเพิ่มการดูดซึมของยา ค่าครึ่งชีวิตของ ddIจะประมาณ 0.8-2.8 ชม.ยาที่รับประทานจะถูกขับออกจากร่างกายทางปัสสาวะในรูปเดิมและเภสัชจลนศาสตร์ไม่ถูกเปลี่ยนแปลงโดยภาวะการตั้งครรภ์
อาการไม่พึงประสงค์ที่พบบ่อยได้แก่ ท้องเสีย ซึ่งอาจเนื่องมาจาก Buffer ที่ผสมในเม็ดยาอาการที่รุนแรงได้แก่การอักเสบของเส้นประสาทส่วนปลายและตับอ่อน ซึ่งโอกาสเกิดตับอ่อนอักเสบจะเพิ่มขึ้นในผู้ป่วยที่ติดเหล้า ผู้ที่เคยเป็นตับอ่อนอักเสบมาก่อน หรือผู้ที่ใช้ยาในขนาดสูง อาการอื่น ๆ ได้แก่ ปวดศีรษะ นอนไม่หลับ คลื่นไส้ อาเจียน ท้องเสีย ปวดท้อง มีไข้ ผื่น สับสน
สำหรับผลกระทบของทารกในครรภ์ คือ เพิ่มความเสี่ยงในการเกิดภาวะ Fatal lactic acidosis
ประโยชน์ในทางการแพทย์ใช้ร่วมกับยาอื่น ๆ เป็นแบบ Double หรือ Triple combination ในการรักษาโรคเอดส์เพื่อเพิ่มประสิทธิภาพและป้องกันการดื้อยาของเชื้อ
1.1.3 Zalcitabine (Deoxycytidine, ddC)
Zalcitabineหรือ ddCจะมีกลไกการออกฤทธิ์เช่นเดียวกับ AZT และ ddIปัจจุบันเป็นยาตัวหนึ่งที่ใช้ร่วมกับยาต้านไวรัสตัวอื่น ๆ ในการรักษาโรคเอดส์
เภสัชจลนศาสตร์ddCถูกดูดซึมได้ดีเมื่อให้โดยการ ค่าครึ่งชีวิตของยาในเลือดประมาณ 1-2 ชม. ยานี้จะถูกขับออกจากร่างกายทางไตประมาณ 75% มีเพียงส่วนน้อยที่ขับออกทางอุจจาระ
อาการไม่พึงประสงค์ที่สำคัญจะคล้ายคลึงกับ ddIได้แก่ ทำให้เกิดการอักเสบเส้นประสาทส่วนปลายและตับอ่อนนอกจากนี้ยังมีผลทำให้เกิดแผลในหลอดอาหาร ท้องเสีย ผื่น ไข้ และกล้ามเนื้อหัวใจอ่อนแรง
1.1.4 Stavudine(2′,3′-Didehydro-3′-Deoxythymidine, Zerit, d4T)
Stavudineเป็นยาที่จัดอยู่ใน Category : C โดยสามารถผ่านออกทางรกและขับออกทางน้ำนมได้มีฤทธิ์ยับยั้งการเจริญเติบโตของเชื้อ HIV โดยการยับยั้งการงานของเอนไซม์ Reverse transcriptase
เภสัชจลนศาสตร์ยานี้จะถูกดูดซึมได้ดีจากทางเดินอาหาร และผ่าน Blood brain barrier ได้ดีพอสมควร ค่าครึ่งชีวิตของยาในเลือดประมาณ 1-2 ชม.ประมาณ 25-50% ของขนาดยาที่รับประทานจะถูกขับออกจากร่างกายทางปัสสาวะในรูปเดิม
อาการไม่พึงประสงค์คล้ายคลึงกับ ddCคือ ทำให้ประสาทส่วนปลายอักเสบ
ผลกระทบต่อทารกในครรภ์ คือ เพิ่มโอกาสเกิดภาวะ Fatal lactic acidosisเมื่อใช้ยานี้แบบ Combination ที่มียาDidanosineและ Stavudineร่วมกัน
1.1.5 Abacavir (Ziagen, ABC)
Abacavirเป็นยาที่จัดอยู่ใน Category : C โดยสามารถผ่านออกทางรกและขับออกทางน้ำนมได้
เภสัชจลนศาสตร์ จากการศึกษาต่างๆ พบว่า Abacavir ไม่มีความแตกต่างในภาวะการตั้งครรภ์
อาการไม่พึงประสงค์สามารถทำให้เกิดการแพ้แบบรุนแรง Serious hypersensitivityได้ โดยจะพบอาการแสดงต่าง ๆ เช่น ไข้ ผื่นตามผิวหนัง อ่อนเพลีย อาการทางระบบทางเดินอาหาร คลื่นไส้ อาเจียน ท้องเสียถ่ายเหลว หรือ มีอาการปวดท้อง ดังนั้นคนที่ประวัติสงสัยจะแพ้ยาแนะนำให้ตรวจ Testing for HLA-B*5701 ก่อนการให้ยาเพื่อหลีกเลี่ยงความเสี่ยงต่อภาวะแพ้รุนแรง
1.1.6 Emtricitabine (Emtriva, FTC)
Emtricitabineเป็นยาที่จัดอยู่ใน Category : B โดยสามารถผ่านออกทางรกได้ดีมากและยังสามารถขับออกทางน้ำนมได้ด้วย
เภสัชจลนศาสตร์ พบว่า Emtricitabineมีเภสัชจลนศาสตร์ลดลงประมาณ 25 เปอร์เซ็นต์ในช่วงไตรมาสที่ 3 ของการตั้งครรภ์ แต่ไม่ส่งผลต่อการลดระดับของเชื้อไวรัสและการลดโอกาสการถ่ายทอดเชื้อจากแม่สู่ลูก
1.1.7Lamivudine (Epivir, 3TC)
Lamivudineเป็นยาที่จัดอยู่ใน Category : Cโดยสามารถผ่านออกทางรกได้ดีมาก และยังสามารถขับออกทางน้ำนมได้
Lamivudine เป็น (-) –enantiomer ของ 2′,3′ –dideoxycytidineซึ่งเป็น –dideoxycynucleoside analog ที่สังเคราะห์ขึ้นมีโครงสร้างคล้ายคลึงกับ 2′,3′ –dideoxycytidine (ddCzalcitabine) ต่างกันที่ต่ำแหน่ง 3′- ของน้ำตาล ribose ของ lamivudine เป็น sulfur จากการทดลองพบว่า(-)-enantiomer มีความสามารถในการยับยั้งเชื้อ HIV-1 และ HIV-2 ได้ใกล้เคียงหรือดีกว่า(+)-enantiomer แต่มีดวามเป็นพิษต่อเซลล์น้อย
เภสัชจลนศาสตร์ Lamivudineไม่ถูกเปลี่ยนแปลงด้วยภาวะตั้งครรภ์เมื่อเทียบกับคนปกติ ใช้ในผู้ป่วยที่ติดเชื่อ HIV โดยใช้ร่วมกับ Zidovudineแต่ไม่แนะนำให้ใช้ Lamivudieตัวเดี่ยวเนื่องจากจะเกิดเชื้อดื้อยาได้เร็วมาก
1.2 ยาที่ออกฤทธิ์ยับยั้งการทำงานของเอนไซม์ Reverse transcriptase ที่ไม่ใช่อนุพันธุ์ของสารNucleosides (Non-nucleoside reverse transcriptase inhibitors; NNRTIs)
ยาในกลุ่มนี้มีกลไกการออกฤทธิ์ยับยั้ง reverse transcriptase ที่แตกต่างจากพวกที่เป็นอนุพันธุ์ของNucleoside โดยจับกับเอนไซม์ Reverse transcriptase ที่ตำแหน่งใกล้ ๆ กับตำแหน่งที่อนุพันธุ์ของ Nucleoside จับ ออกฤทธิ์ได้โดยไม่จำเป็นต้องถูกเปลี่ยนให้อยู่ในรูป Triphosphate ก่อน
1.2.1.Efavirenz (Sustiva, EFV)
Efavirenzเป็นยาที่จัดอยู่ใน Category : Dโดยสามารถผ่านออกทางรกและขับออกทางน้ำนมได้
เภสัชจลนศาสตร์ไม่ถูกเปลี่ยนแปลงโดยการตั้งครรภ์ และมี Clearance ค่อนข้างสูง และพบว่าระดับในช่วงไตรมาสที่ 3 ของการตั้งครรภ์จะต่ำกว่าช่วงอื่น ๆ แต่ก็ไม่จำเป็นต้องเพิ่มประมาณยาEfavirenzจะถูกดูดซึมจากทางเดินอาหารได้ดี มีค่าครึ่งชีวิตที่ค่อนข้างนานสามารถให้วันละครั้งได้ จับกับพลาสมาโปรตีนได้ดีทำให้เข้าสู่ CSF ได้น้อย ยานี้จะถูกเปลี่ยนแปลงที่ตับโดยเอนไซม์ CYP3A4 และ CYP2B6
จากการใช้ Efavirenzในช่วงไตรมาสแรกของการตั้งครรภ์ พบว่ามีรายงานการเกิด Teratogenicity คือ Neural tube defect (Meningomyelocele) และ Anophthalmia with severe facial clefts and amniotic banding แต่จากผลการรวบรวมแล้วพบว่าEfavirenz ไม่ได้เพิ่มความผิดปกติของทารกในครรภ์อย่างมีนัยสำคัญที่แตกต่างจากกลุ่มคนทั่วไป
1.2.2 Nevirapine (Viramune, NVP)
Nevirapineเป็นยาที่จัดอยู่ใน Category : Cโดยสามารถผ่านออกทางรกและขับออกทางน้ำนมได้
เภสัชจลนศาสตร์ Nevirapineเป็นยาในกลุ่ม nonnucleoside analog ตัวแรกที่ FDA ของสหรัฐอเมริกายอมรับให้ใช้ในผู้ป่วยโรค AIDS Nevirapineเป็นอนุพันธุ์ของ dipyridoiazepinoneมีโครงสร้างทางเคมีคล้ายคลึงกับยาในกลุ่ม Benzodiazepine nevirapineออกฤทธิ์ยับยั้งเอนไซม์ Reverses transcriptase ซึ่งทำหน้าที่เปลี่ยน RNA ของไวรัสให้เป็น Single-strand DNA หลังจากนั้น DNA ที่สร้างจะถูกแยกออกจาก RNA โดยเอนไซม์ Ribonuclease H นอกจากนี้เอนไซม์ Reverses transcriptase ยังทำให้เกิด Duplication ของ Single-strand DNA ได้เป็น Double-stranded DNA ด้วย Nevirapineยับยั้งการทำงานของอนไซม์ Revesre transcriptase ฃองเชื้อ HIV-1 อย่างเฉพาะเจาะจงโดยจะจับกับเอนไซม์ Nonsubstrate binding site
จากการศึกษาพบว่า Nevirapineจะใช้ได้ผลดีต่อเชื้อ HIV ที่ดื้อต่อ AZT และยังเสริมฤทธิ์ของ AZT ในการต้านเชื้อ HIV ด้วย ยานี้จะถูกดูดซึมได้ดีจากทางเดินอาหารเมื่อให้โดยการรับประทาน ยาส่วนใหญ่จะถูกเปลี่ยนแปลงที่ตับเอนไซม์ Cytochrome P450 3A4 (CYP3A4) ก่อนที่จะขับออกจากร่างกาย
อาการไม่พึงประสงค์คือ การเกิดผื่นมักจะเกิดในช่วง 4-6 สัปดาห์แรกของการรักษาและมีโอกาสเกิดเพิ่มขึ้นถ้าใช้ nevirapineร่วมกับยาต้านไวรัสอื่น ๆ ได้แก่ ผื่นที่ผิวหนังSevere skin rash (Stevens Johnson syndrome) และอันตรายต่อตับ Hepatotoxicityหรือ Liver failureได้ซึ่งเป็นผลอันตรายต่อชีวิต เกิดในผู้หญิงบ่อยกว่าผู้ชาย โดยมักจะเกิดในช่วง 18 สัปดาห์หลังได้รับยา Nevirapine และเกิดขึ้นได้บ่อยในหญิงตั้งครรภ์ที่รับยาอาการอื่นๆ เช่น ท้องเสีย คลื่นไส้ ปวดศีรษะ ง่วง อ่อนล้าเป็นต้น
โดยอาการไม่พึงประสงค์ดังกล่าวจะเกิดได้ในรายที่มีระดับ CD4 counts >250 cells/microLทำให้เกิดผลข้างเคียงที่รุนแรงบ่อยกว่าคนทั่วไปถึง 9.8 เท่า โดยเฉพาะHepatotoxicity
1.2.3 Etravirine (Intelence, ETV)
Etravirineเป็นยาที่จัดอยู่ใน Category : Bโดยสามารถผ่านออกทางรกและขับออกทางน้ำนมได้
ยังไม่มีการศึกษาที่ดีในมนุษย์ แต่จากการศึกษาในสัตว์ทดลองพบว่า Etravirineไม่ได้มีผลเป็น teratogenic effects
1.2.4 Rilpivirine (Edurant, RPV)
Rilpivirineเป็นยาที่จัดอยู่ใน Category : B ยังไม่ทราบเรื่องการขับออกทางรกและขับออกทางน้ำนม
1.2.5 Delavirdine (Rescriptor)
Delavirdineเป็นยาที่จัดอยู่ใน Category : Cยังไม่ทราบเรื่องการขับออกทางรกและขับออกทางน้ำนม
สำหรับ Delavirdineพบว่าเมื่อใช้ร่วมกับ ddIและ AZT ในการรักษาโรคเอดส์จะให้ผลดีกว่าใช้ AZT ตัวเดียว Delavirdineจะถูกดูดซึมจากทางเดินอาหารได้ดีเมื่อให้รับประทาน แต่ถ้าได้รับยาร่วมกับอาหารที่มีไขมันจะลดการดูดซึม ยานี้จะถูกเปลี่ยนแปลงที่ตับเอนไซม์ CYP3A4 ก่อนขับออกจากร่างกาย
อาการไม่พึงประสงค์ คือ ผื่น แผลผุพอง แผลในปาก มีไข้ เยื่อตาอักเสบ ปวดเมื่อยกล้ามเนื้อ ปวดข้อ
ไม่แนะนำให้ใช้ในหญิงตั้งครรภ์ เนื่องจาก Delavirdineมีประสิทธิภาพในการทำงานต่ำใน และจากการทดลองพบว่ามี teratogenic ในสัตว์ทดลองด้วย
1.3 ยาที่ออกฤทธิ์ยับยั้งการทำงานของเอนไซม์ Reverse transcriptase ที่เป็นอนุพันธุ์ของสารNucleotides (Nucleotide inhibitors)
1.3.1Tenofovirdisoproxilfumaratem(Tenofovir DF, Viread)
Tenofovir DF เป็นยาที่จัดอยู่ใน Category : C โดยสามารถผ่านออกทางรกและขับออกทางน้ำนมได้
เภสัชจลนศาสตร์Tenofovirdisoproxilfumaratemเป็น Prodrugที่จะต้องถูกเปลี่ยนแปลงในร่างกายเป็น Tenofovirซึ่งเป็นอนุพันธ์ของ Adenine ยานี้จะออกฤทธิ์ยับยั้งการทำงานของเอนไซม์ Reverse transcriptase และทำให้การต่อสายของ DNA หยุดชะงักTenofovir DF มีภาวะเภสัชจลนศาสตร์ลดลงประมาณ 25 เปอร์เซ็นต์ในช่วงไตรมาสที่ 3 ของการตั้งครรภ์ แต่ก็ไม่ส่งผลต่อการลดระดับของเชื้อไวรัสและการลดการถ่ายทอดเชื้อจากแม่สู่ลูกได้
สำหรับหญิงตั้งครรภ์ที่มีภาวะ chronic hepatitis B infection แนะนำให้ใช้ Tenofovir DF เป็นส่วนประกอบในยาต้านไวรัสซึ่งสามารถให้ร่วมกับ emtricitabineหรือ lamivudine ซึ่ง Tenofovir DF ถือว่าเป็นPreferred NRTI backbone ในผู้ป่วยกลุ่มนี้
Tenofovirจะต้องใช้ร่วมกับยาต้านไวรัสที่ใช้รักษาโรคเอดส์ตัวอื่นๆ จากการศึกษาพบว่ายานี้สามารถยับยั้งเชื้อ HIV-1 ที่รุนแรงในผู้ป่วยที่เคยได้รับการรักษามาก่อน
อาการไม่พึงประสงค์ คือ คลื่นไส้ อาเจียน ท้องเสีย ท้องอืด
2. ยาที่ออกฤทธิ์ยับยั้งการทำงานของเอนไซม์ Protease
Protease เป็นเอนไซม์ที่สำคัญของไวรัสในการแยก Gag-pol polyproteinให้เป็น Reverse transcriptase protease และ Integaseซึ่งเป็นโปรตีนที่สำคัญของไวรัส ปัจจุบันได้มีการพัฒนายาที่ออกฤทธิ์ยับยั้งการทำงานของเอนไซม์นี้เพื่อใช้ในการรักษาโรคเอดส์ เนื่องจากเอนไซม์ Protease ของเชื้อ HIV จะมีคุณสมบัติที่แตกต่างจาก Protease ของคน ดังนั้นยาในกลุ่มนี้จึงน่าจะมีผลต่อ เซลล์เจ้าบ้าน cell น้อยมากจากผลการวิจัยพบว่า เมื่อผู้ป่วยได้รับ Protease inhibitor เพียงตัวเดียวหรือได้รับร่วมกับยาต้านไวรัส HIV ตัวอื่น ๆ จะทำให้เชื้อไวรัสในกระแสเลือดลดลงอย่างมาก ในขณะที่ CD4 cell จะเพิ่มจำนวนอย่างรวดเร็วโดยทั่วไปจะแนะนำให้ใช้ยากลุ่มนี้ร่วมกับยาต้านไวรัส HIV ตัวอื่น ๆ เพราะนอกจากจะเพิ่มประสิทธิภาพในการรักษาแล้วยังช่วยชะลอการดื้อยาอีกด้วย
2.1 Saquinavir
Saquinavirเป็นยาที่จัดอยู่ใน Category : C โดยสามารถผ่านออกทางรกได้ แต่ไม่ทราบการขับออกทางน้ำนม เป็นยาในกลุ่ม Protease inhibitor ตัวแรกที่ได้รับการอนุมัติจากคณะกรรมการอาหารและยาของประเทศสหรัฐอเมริกาให้ใช้ในการรักษาผู้ป่วยโรคเอดส์
เภสัชจลนศาสตร์ยานี้จะถูกดูดซึมจากทางเดินอาหารเข้าสู่กระแสเลือดได้น้อยมากจะถูกเปลี่ยนแปลงที่ตับ โดยเอนไซม์ Cytochrome P4503A4 และขับออกจากร่างกายทางอุจจาระ ค่าครึ่งชีวิตของยาประมาณ 13.2 ชม.
อาการไม่พึงประสงค์พบน้อยได้แก่ ท้องเสีย คลื่นไส้ ไม่สบายในท้อง ปวดหัว อ่อนเพลีย
ข้อควรระวัง เนื่องจากยานี้จะถูกเปลี่ยนแปลงในร่างกายโดยเอนไซม์ CYP3A4 ดังนั้นจึงควรระวังเมื่อใช้ร่วมกับยาหรือสารใด ๆ ที่สามารถเหนี่ยวนำ (เช่น Rifampin carbamazepine dexamethasone phenytoin) หรือยับยั้งการทำงานของเอนไซม์นี้ได้ เช่น Ketoconazoleเพราะจะมีผลทำให้เกิดอันตรกิริยาซึ่งจะมีผลต่อระดับยาSaquinavirในกระแสเลือด และมีผลต่อการรักษาโรคได้
2.2 Ritonavir (Norvir)
Ritonavir เป็นยาที่จัดอยู่ใน Category : C โดยสามารถผ่านออกทางรกได้ แต่ไม่ทราบการขับออกทางน้ำนม
เภสัชจลนศาสตร์ยานี้เมื่อใช้รับประทานจะดูดซึมจากร่างกายได้ดีพอสมควร ค่าครึ่งชีวิตของยาในร่างกายประมาณ 3-5 ชม. ประมาณ 35% ของขนาดยาที่ได้รับจะถูกขับออกจากร่างกายทางอุจจาระในรูปเดิมจากผลการวิจัยเมื่อใช้ยานี้ร่วมกับ AZT และ Lamivudine ปรากฏว่าจะให้ผลในการยับยั้งการเจริญเติบโตของเชื้อ HIV ได้ดีมาก
อาการไม่พึงประสงค์ที่พบบ่อยได้แก่ คลื่นไส้ ท้องเสีย ปวดศีรษะ การรับรสผิดปกติ ระดับไขมันในเลือดสูงขึ้น เอนไซม์ที่แสดงถึงการทำงานของตับสูงขึ้น
ข้อควรระวัง Ritonavir อาจจะเกิดอันตรกิริยาเมื่อใช้กับยาอื่น ๆ ได้ ซึ่งบางครั้งอาจทำให้เกิดอันตรายได้ ดังนั้นจึงควรระมัดระวังเมื่อใช้ยานี้ร่วมกับยาบางตัว เช่น Alprazolam, Astemizole, Amiodarone, Cisapride, Clozapine, Encainide, Midazolam, Quinidine และ Rifabutinเป็นต้น
2.3 Indinavir(Crixivan)
Indinavirเป็นยาที่จัดอยู่ใน Category : C โดยสามารถผ่านออกทางรกได้ แต่ไม่ทราบการขับออกทางน้ำนมได้
Indinavirให้ผลในการลดจำนวนเชื้อ HIV ได้ดีมาก ผู้ป่วยที่ติดเชื้อ HIV ที่ได้รับยานี้ร่วมกับ AZT หรือ Stavudineจะมีการพัฒนาจนเกิดอาการของโรคเอดส์และอัตราการตายน้อยกว่ากลุ่มที่ได้รับ AZT ร่วมกับ Lamivudine
อาการไม่พึงประสงค์ที่สำคัญคือ นิ่วในไตดังนั้นจึงควรดื่มน้ำหรือของเหลวมาก ๆ เพื่อลดความเสี่ยงต่อการเกิดนิ่วในไต นอกจากนี้ยังอาจทำให้เกิดอาการคลื่นไส้ ผื่นที่ผิวหนัง ปวดศีรษะ ท้องเสีย อ่อนเพลีย การรับรสผิดปกติระดับเอนไซม์ที่แสดงถึงการทำงานของตับเปลี่ยนแปลง คือHyperbilirubinemiaแต่อาการเหล่านี้ส่วนใหญ่จะไม่รุนแรง ไม่ถึงกับต้องหยุดยา
ข้อควรระวังเนื่องจาก Indinavirจะถูกเปลี่ยนแปลงในร่างกายโดยอาศัยเอนไซม์ CYP3A4 นอกจากนี้ยังพบว่ายานี้ฤทธิ์ยับยั้งการทำงานของเอนไซม์นี้อีกด้วย ดังนั้นจึงควรระมัดระวังเมื่อใช้ร่วมกับยาบางชนิด ยกตัวอย่างเช่นMidazolam, Astemizoleและ Cisaprideเพราะอาจจะเกิดอันตรกิริยาต่อกันได้
2.4 Nelfinavir (Viracept)
Nelfinavirเป็นยาที่จัดอยู่ใน Category : Bโดยสามารถผ่านออกทางรกได้เล็กน้อย แต่สามารถขับออกทางน้ำนมได้ดี
เภสัชจลนศาสตร์ ยาจะดูดซึมจากทางเดินอาหารได้ช้ามากเมื่อเทียบกับยาที่ออกฤทธ์ยับยั้ง Protease ตัวอื่นๆการดูดซึมจะเพิ่มขึ้น 2-3 เท่าถ้าให้ยาร่วมกับอาหาร ยานี้จะถูกเปลี่ยนแปลงที่ตับโดยเอนไซม์ CYP3A4, CYP2C19 และ CYP2D6 เมทตาบอไลท์ที่ได้จะยังคงมีฤทธิ์ทางเภสัชวิทยา ถูกขับออกจากร่างกายทางอุจจาระ
อาการไม่พึงประสงค์ที่พบบ่อย ได้แก่ ท้องเสีย
2.5 Atazanavir (Reyataz)
Atazanavirเป็นยาที่จัดอยู่ใน Category : B โดยสามารถผ่านออกทางรกและขับออกทางน้ำนมได้
อาการไม่พึงประสงค์ ทำให้ค่าการทำงานของตับผิดปกติ เช่นElevation in indirect (unconjugated) bilirubin
2.6 Darunavir (Prezista)
Darunavirเป็นยาที่จัดอยู่ใน Category : B โดยสามารถผ่านออกทางรกและขับออกทางน้ำนมได้จากการศึกษาพบว่ายานี้ไม่มีผลต่อทารกในครรภ์ในด้าน Congenital or major metabolic anomalies
2.7 Fosamprenavir (Lexiva)
Fosamprenavirเป็นยาที่จัดอยู่ใน Category : Cยังไม่ทราบเรื่องความสามารถขับผ่านออกทางรกและการขับออกทางน้ำนมได้หรือไม่ และยังไม่มีการศึกษาที่ดีพอในหญิงตั้งครรภ์
2.8 Lopinavir-ritonavir (Kaletra)
Lopinavir-ritonavirเป็นยาที่จัดอยู่ใน Category : Cโดยสามารถผ่านทางรกและขับออกทางน้ำนมได้
อาการไม่พึงประสงค์ คือ การทำงานของตับและไตของทารกแรกคลอดจะลดลง เนื่องจากส่วนประกอบของยามีAlcohol 4.2 เปอร์เซ็นต์ และ Propylene glycol 15.3 เปอร์เซ็นต์ และยังอาจจะทำให้เกิดปัญหาต่อระบบหัวใจ ไต การหายใจและระบบเมทตาบอลิซึมได้
2.9 Tipranavir (Aptivus)
Tipranavirเป็นยาที่จัดอยู่ใน Category : C ยังไม่ทราบเรื่องความสามารถผ่านออกทางรกและการขับออกทางน้ำนมได้หรือไม่ และยังไม่มีการศึกษาที่ดีพอในหญิงตั้งครรภ์
3. ยาที่ออกฤทธิ์ยับยั้งการหลอมตัวของไวรัสเข้ากับCell membrane (Fusion inhibitor)
3.1 Enfuvirtide
Enfuvirtideเป็นยาที่จัดอยู่ใน Category : Bโดยสามารถขับผ่านออกทางรกได้เล็กน้อยหรือไม่ผ่านรกเลย แต่ยังไม่มีข้อมูลเกี่ยวกับการขับออกทางน้ำนม
Enfuvirtideเป็นยาต้านไวรัสที่ใช้รักษาโรคเอดส์ตัวใหม่ ที่ออกฤทธิ์โดยยับยั้งการหลอมตัวของเชื้อเข้า
กับCell membrane ของเซลล์เจ้าบ้าน (Fusion) จึงสามารถยับยั้งกระบวนการเข้าเซลล์ (Penetration) ของไวรัสได้ ยานี้เป็นเปปไทด์ของกรดอะมิโนที่ได้จากการสังเคราะห์
เภสัชจลนศาสตร์ ยานี้จะจับกับ gp41 subunit ของเปลือกหุ้มที่เป็นไกลโคโปรตีนของไวรัส ป้องกัน
การเปลี่ยนแปลงรูปร่าง (Conformation change) ที่จำเป็นต่อการหลอมรวมของเชื้อเข้ากับCell membraneยานี้จะจับกับ Plasma protein ได้ประมาณ 92 เปอร์เซ็นถูกเปลี่ยนแปลงในร่างกายโดยกระบวนการ Proteolytic hydrolysis มีค่าครึ่งชีวิตประมาณ 3.8 ชั่วโมง
อาการไม่พึงประสงค์ ได้แก่ การเกิดปฏิกิริยาของบริเวรที่ฉีดยา อาจเกิด Hypersensitivity ได้
4. ยาที่ออกฤทธิ์ยับยั้งการทำงานของเอนไซม์ Integrase
ยากลุ่มนี้จะออกฤทธิ์ยับยั้งการทำงานของเอนไซม์ Integrase ซึ่งเป็นเอนไซน์สำคัญของกระบวนการเพิ่มจำนวนของไวรัส HIVในช่วง Viral replication การยับยั่งเอนไซม์ Integraseจะทำให้วงจรการเพิ่มจำนวนของไวรัสถูกยับยั้งขั้นตอนนี้เป็นอีกเป้าหมายหนึ่งที่จะสามารถยับยั้งการเจริญเติบโตของเชื้อ HIV ได้แต่ยังไม่มีการศึกษากันมากนัก
4.1 Raltegravir
Raltegravirเป็นยาที่จัดอยู่ใน Category : C โดยสามารถผ่านออกทางรกและขับออกทางน้ำนมได้แต่ยังไม่มีผลการศึกษาวิจัยที่เพียงพอในการใช้กับมนุษย์
4.2 Elvitegravir
Elvitegravirเป็นยาที่จัดอยู่ใน Category : B ยังไม่มีข้อมูลเกียวกับการขับผ่านออกทางรกและขับออกทางน้ำนมแต่ยังไม่มีผลการศึกษาวิจัยที่เพียงพอในการใช้กับมนุษย์
เอกสารอ้างอิง
- การป้องกันการถ่ายทอดเชื้อเอชไอวีจากมารดาสู่ทารกด้วยยาต้านไวรัส. ใน: ประพันธ์ ภานุภาค และคณะ, บรรณาธิการ. แนวทางการตรวจวินิจฉัยและการดูแลรักษาผู้ติดเชื้อเอชไอวีและผู้ป่วยเอดส์ระดับชาติ ปี พ.ศ. 2553. กรุงเทพฯ: โรงพิมพ์ชุมนุมสหกรณ์การเกษตรแห่งประเทศไทยจำกัด, 2553: 293-327.
- Cunningham FG, Leveno KJ, Bloom SL, Hauth JC, Rouse, DJ, Spong CY. Sexually transmitted diseases. Williams Obstetrics. 23rd ed. New York: McGraw-Hill, 2010: 1235-1257.
- The use of antiretroviral drug for treating and preventing HIV infection , World Health Organization , June 2013
- ยาต้านไวรัสที่ใช้ในการรักษาโรคเอดส์ (ANTIVIRAL THERAPY IN AIDS) รศ. ดร. วิจิตรา ทัศนียกุลภาควิชาเภสัชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยขอนแก่น
- www.uptodate.com/Use of antiretroviral medications in pregnant HIV-infected patients and their infants in resource-rich settings
- www.uptodate.com/Antiretroviral medications in pregnancy: Entry and integrase inhibitors” and “Antiretroviral medications in pregnancy: Protease inhibitors” and “Antiretroviral medications in pregnancy: Non-nucleoside reverse transcriptase inhibitors” and “Antiretroviral medications in pregnancy: Nucleoside reverse transcriptase inhibitors” and “Prenatal evaluation and intrapartum management of the HIV-infected patient in resource-rich settings