Antiphospholipid syndrome
Antiphospholipid syndrome
นพ.พิชญ์ จันทร์ดียิ่ง
รศ.พญ. สุพัตรา ศิริโชติยะกุล
กลุ่มอาการต้านฟอสโฟลิพิด (antiphospholipid syndrome – APS) เป็นโรคออร์โตอิมมูน (autoimmune disorder) มีความสัมพันธ์กับการเกิดการแท้งซ้ำซาก(Recurrent pregnancy loss ,RPL) หรือ ภาวะแทรกซ้อนทางสูติศาสตร์ ได้แก่ preclampsia, fetal growth restriction, preterm delivery fetal death และ placental insufficiency เป็นต้น (1)นอกจากนี้สัมพันธ์กับการเกิด arterial /venous thrombosis , myocardial infarction และ stroke เป็นต้นภาวะดังกล่าวทำให้เกิดภาวะทุพลภาพ หรือ รุนแรงถึงขั้นเสียชีวิตได้
อุบัติการณ์ของกลุ่มอาการต้านฟอสโฟลิพิด (APS) ไม่ทราบแน่ชัด โดยประมาณการพบราว ร้อยละ 0.5 ของประชากรแบ่งเป็นร้อยละ70 ในผู้หญิงวัยเจริญพันธุ์ (reproductive age) ร้อยละ 12 ในผู้ป่วยอายุมากกว่า 50 ปีแต่แทบไม่พบในเด็ก ขณะที่ร้อยละ50 ของผู้ป่วยกลุ่มนี้เกิดขึ้นใหม่เองโดยปราศจากประวัติลิ่มเลือดอุดตันมาก่อน ส่วนโรครูปแบบรุนแรง (catastrophic form) พบน้อยกว่าร้อยละ 1 (2)
กลุ่มอาการต้านฟอสโฟลิพิด (APS)สามารถจำแนกออกได้เป็น primary APS และ secondary APS (3)
- primary APS คือ ผู้ป่วยผู้มีอาการของ APS โดยปราศจากโรค systemic disease อื่น พบมากที่สุด มากกว่าร้อยละ 50
- secondary APS คือ ผู้ป่วยผู้มีอาการของ APS ร่วมกับ systemic disease ได้แก่ Systemic Lupus Erythematosus (SLE), rhreumatiod arthritis, leukemia, systemic sclerosisเป็นต้น โดยเฉพาะร้อยละ 20 ถึง 50 ของผู้ป่วย SLE เกิด APS ได้
การวินิจฉัย
อาศัยเกณฑ์ของInternational Society on Thrombosis and Haemostasis ปีค.ศ.2006 ประกอบด้วยอาการทางคลินิกอย่างน้อย 1 ข้อ ร่วมกับ ผลการตรวจทางห้องปฏิบัติการอย่างน้อย 1 ข้อ ดังตารางที่ 1
ตารางที่ 1 เกณฑ์วิจัยสำหรับคำจำกัดความ APS ปรับจาก Miyakis et al (2006) ได้รับอนุญาตจาก John Wiley & Sons, Inc 2006 international society on thrombosis and hemostasis(4)
Clinical criteria
1. Vascular thrombosis
One or more clinical episodes of arterial, venous, or small vessel thrombosis§, in any tissue or organ. Thrombosis must be confirmed by objective validated criteria (i.e. unequivocal findings of appropriate imaging studies or histopathology). For histopathologic confirmation, thrombosis should be present without significant evidence of inflammation in the vessel wall.
2. Pregnancy morbidity
(a) One or more unexplained deaths of a morphologically normal fetus at or beyond the 10th week of gestation, with normal fetal morphology documented by ultrasound or by direct examination of the fetus, or
(b) One or more premature births of a morphologically normal neonate before the 34th week of gestation because of: (i) eclampsia or severe pre-eclampsia defined according to standard definitions, or (ii) recognized features of placental insufficiency, or
(c) Three or more unexplained consecutive spontaneous abortions before the 10th week of gestation, with maternal anatomic or hormonal abnormalities and paternal and maternal chromosomal causes excluded.
Laboratory criteria
1. Lupus anticoagulant (LA) present in plasma, on two or more occasions at least 12 weeks apart, detected according to the guidelines of the International Society on Thrombosis and Haemostasis (Scientific Subcommittee on LAs/phospholipid-dependent antibodies)
2. Anticardiolipin (aCL) antibody of IgG and/or IgM isotype in serum or plasma, present in medium or high titer (i.e. >40 GPL or MPL, or >the 99th percentile), on two or more occasions, at least 12 weeks apart, measured by a standardized ELISA
3. Anti-β2 glycoprotein-I antibody of IgG and/or IgM isotype in serum or plasma (in titer >the 99th percentile), present on two or more occasions, at least 12 weeks apart, measured by a standardized ELISA, according to recommended procedures
สารภูมิต้านทานต้านฟอสโฟลิพิด (Antiphospholipidantibodies-aPL)
กลุ่มอาการต้านฟอสโฟลิพิด(APS)เป็นกลุ่มอาการเกิดจากผลของ antiphospholipidantibodies(aPL) ใช้สำหรับการวินิจฉัยโรค APS ได้แก่ Lupus anticoagulant (LAC),anticardiolipin antibody(ACL), Beta-2 glycoprotein I antibody เป็นต้นเนื่องจากผลบวก(positive test) อาจเกิดชั่วคราว (transient) ดังนั้นการวินิจฉัย APS จำเป็นต้องพบผลบวกของ aPLสองครั้งโดยตรวจห่างกันอย่างน้อย 12 สัปดาห์(1)ผู้เชี่ยวชาญส่วนใหญ่รายงานว่าการตรวจ LAC ผ่าน coagulation assay ในเลือดมีความจำเพาะ (specificity) มากกว่าแต่ ความไว(sensitivity) น้อยกว่าเมื่อเปรียบเทียบกับการตรวจอื่นอีก 2 ชนิด(5,6)
สารต้านการเกาะลิ่มเลือดลูปัส(Lupus anticoagulant -LAC)
รูปแบบการตรวจ LAC มีดังนี้
- การยืดเวลาของการทดสอบการจับเป็นลิ่มอาศัยฟอสโฟลิพิด(prolongation of a phospholipid-dependent clotting test)
- การพบตัวยับยั้งโดยการทดสอบผสมรวม(the presence of an inhibitor by mixingtests)
- การตรวจพบ phospholipid dependenceของตัวยั้บยั้ง(phospholipid dependence of the inhibitor)
การทดสอบ 2 รูปแบบด้วยหลักการแตกต่างกัน ควรใช้เพื่อเพิ่มความจำเพาะ(specificity)และ ให้แน่ใจว่าสามารถตรวจพบการทดสอบผลบวกอย่างอ่อน (weakly positive test) แม้มีผลบวกของการทดสอบLAC แล้วก็ตาม
การทดสอบphospholipid-dependent clotting test หรือ screening test ได้แก่ kaolin clot time (KCT), plasma clot time (PCT), lupus anticoagulant-sensitive activated partial thromboplastin time(APTT)และ dilute Russell’s viper venom time(DRVVT) ฯลฯ(1)พบว่าการทดสอบในข้างต้นมีฟอสโฟลิพิด เป็นสารตั้งต้นของเอนไซม์และ เป็นปัจจัยร่วม (co-factor) สำหรับการแข็งตัวของเลือด หากว่ามี LAC ยึดจับจะส่งผลขัดขวางกระบวนการแข็งตัวของเลือดเป็นผลให้ระยะเวลาการจับเป็นลิ่ม (clotting time) ยาวนานขึ้นหลักฐานทางคลินิกสัมพันธ์กับภาวะหลอดเลือดมีลิ่มเลือด(thrombosis) แนะนำว่า การตรวจ DRVVT มีประโยชน์ และควรใช้เป็นการทดสอบหนึ่ง ส่วนอีกการทดสอบใช้ APTT, modified APTT หรือ dilute prothrombin time
ปัจจัยอื่นนอกจาก LAC ส่งผลให้ยืดเวลาการจับเป็นลิ่ม ได้แก่ การดำเนินการตัวอย่างไม่ถูกต้อง(improperly processed specimens), การได้รับยาต้านการเกาะเป็นลิ่ม (anticoagulant medications),การบกพร่องปัจจัยการจับเป็นลิ่ม(clotting factor deficiencies)และตัวยับยั้งปัจจัยจำเพาะ(factor-specific inhibitors) เป็นต้น(1) ตรวจสอบได้โดย
- Additional test (Mixing test) คือ การเติมน้ำเลือดปกติ(normal plasma) หากขาดปัจจัยการจับเป็นลิ่มส่งผลให้การแข็งตัวของเลือดกลับเป็นปกติในทางกลับกัน หากเป็นตัวต้านการเกาะเป็นลิ่มลูปัส(LAC)การแข็งตัวของเลือดคงนานเท่าเดิม
- Confirmatory test ด้วยการเติมหรือเอาออกฟอสโฟลิพิดจากการทดสอบหรือ การนำตัวต้านการเกาะเป็นลิ่มลูปัส(LAC)ออกไป เช่น การ preincubateของพลาสมาด้วยการเติมฟอสโฟลิพิดปริมาณมากเข้าไป เพื่อทำให้เกิดการใช้LAC หมดสิ้นก่อนหากหลังการทดสอบพบระยะเวลาการแข็งตัวของเลือดปกติ แสดงว่ามี LAC ตัวอย่างการตรวจ เช่น ความเข้มข้นฟอสโฟลิพิตสูง(high phospholipid concentration), สารทำให้เกร็ดเลือดเป็นกลาง (platelet neutralizing reagent) หรือ สารไม่ไวตัวต้านการเกาะเป็นลิ่มลูปัส(LA-insensitive reagent) เป็นต้น(4) อย่างไรก็ตามการทดสอบ LAC ไม่สามารถบอกเป็นปริมาณ จะบอกได้เพียงว่า พบ หรือ ไม่พบ LAC เท่านั้น(1)
หากการทดสอบ APTT บ่งชึ้ว่ามี LAC แต่การทดสอบDRVVT ให้ผลลบ การใช้ขั้นตอนการยืนยัน(confirmatory step)ควรใช้เพื่อเติมเต็มสำหรับเกณฑ์การวินิจฉัย LAC(6)โดยทั่วไปในสารภูมิต้านทานต้านฟอสโฟลิพิด(aPL)พบว่า LAC จำเพาะกับภาวะหลอดเลือดมีลิ่มเลือด (thrombosis)มากกว่าACL และ Anti-Beta2-Glycoprotein I Antibodiesและความจำเพาะเพิ่มขึ้นในกลุ่มความเข้มข้นสูง(high titer)ของ aCL เทียบกับกลุ่มความเข้มข้นต่ำ(low titer) มีการศึกษาพบว่าผู้ป่วยผู้มีผลบวกทั้งจากการตรวจ DRVVT และ APTT พบการเกิดลิ่มเลือดอุดตันมากกว่า เมื่อเทียบกับกลุ่มผู้มีผลบวกจากการตรวจวิธีเดียว (Swadzba et al
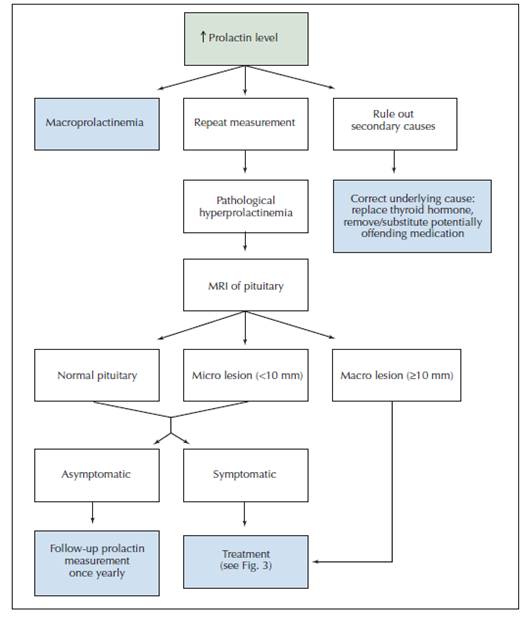
การทำงานของ LAC ไม่ได้จับโดยตรงกับประจุลบฟอสโฟลิพิด(negatively chargedphospholipid) แต่ยับยั้งphospholipid-dependent clotting assay โดยการรบกวนการเกิดการรวมกลุ่มโปรธร็อมบิน(prothrombin complex)(1,7)ความไวและความจำเพาะของแต่ละการตรวจแต่ละห้องปฏิบัติการแตกต่างกันรวมถึงสารใช้ตรวจ สำหรับ phospholipid binding protein ที่เกี่ยวข้องกับกลุ่มอาการต้านฟอสโฟลิพิด(APS)ได้แก่protein C,S และ annexin V(Placental anticoagulant protein I หรือ Lipocortin V) เป็นต้น หากมีสารภูมิต้านทาน(antibodies -Ab) จับกับ Protein C,S ส่งผลให้เกิดลิ่มเลือดในหลอดเลือดแดง เส้นเลือดดำ หรือ เนื้อเยื่อเดซิดวล(decidual) ได้ในขณะที่การจับกับ annexin V ซึ่งปกติ annexin V ปกคลุม syncytiotrophoblastในปริมาณความเข้มข้นสูง ส่งผลให้เกิดการแข็งตัวของเลือดและลิ่มเลือดตามมาใน intervillous space(7)จากงานวิจัยในปี 1997 ของ Rand และ คณะ (8) พบว่าในสตรีตั้งครรภ์ผู้เป็นAPS ร่วมด้วย จะพบระดับ annexin V ในเนื้อเยื่อรกน้อยลงเมื่อเปรียบเทียบกับรกปกตินอกจากนี้ยังพบการลดลงของannexin V ในเยื่อบุผิวหลอดเลือด (endothelial cell) จากการเพาะเลี้ยงที่สัมผัสกับสารภูมิต้านทานต้านฟอสโฟลิพิด(aPL)
โปรตีน ซี (protein C) หลังจากถูกเปลี่ยนรูปเป็น activated protein c ซึ่งทำหน้าที่เป็นตัวป้องกันการแข็งตัวของเลือดโดยธรรมชาติ โดยทำงานร่วมกับ protein s ในยับยั้งการกระตุ้นของปัจจัย Vaและ VIIIa นอกจากนี้ช่วยยับยั้งการสร้าง plasminogen-activator inhibitor 1 ด้วย ดังนั้นการขาดโปรตีนชนิดนี้ (protein c deficiency )ส่งผลให้เพิ่มความเสี่ยงของลิ่มเลือดอุดตัน
โปรตีน เอส (protein S) เป็นโปรตีนในกระแสเลือดทำหน้าที่ป้องกันการแข็งตัวของเลือดโดยธรรมชาติ ทำงานร่วมกับ protein C ส่งผลให้ลดการเกิดเปลี่ยน prothrombinเป็น thrombin (thrombin generation)
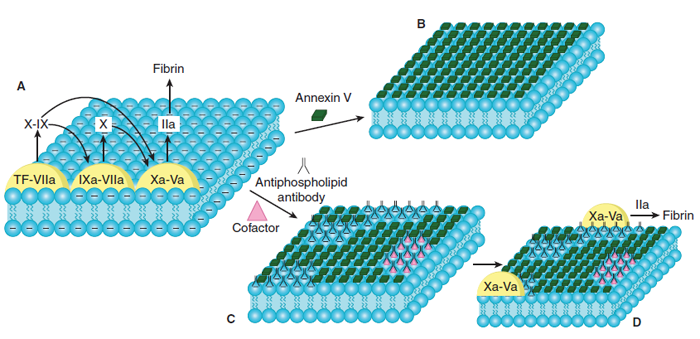
รูปภาพที่ 1 ภาพแสดงกลไกเกิดความผิดปกติในผู้ป่วยกลุ่มอาการต้านฟอสโฟลิพิด(APS)ปรับปรุงจาก Rand and colleagues, 1997a, 2008(7)
สารภูมิต้านทานต้านคาร์ดิโอไลปีน (Anticardiolipinantibodies-ACL)
การวิเคราะห์enzyme-linked immunosorbant assay (ELISA)โดยอาศัยการตรวจวัด IgM ACL และ IgG ACL ส่วนตรวจวัด IgA ACL ยังคง ไม่ชัดเจนการทำให้การทดสอบ ACL)เป็นมาตรฐานเดียวกันทำได้ยาก ส่งผลให้การทดสอบของห้องปฏิบัติการณ์แต่ละที่มีความสอดคล้องกันน้อย(9)และการรายงานผลเป็นผลลบ ต่ำ ปานกลาง หรือ สูง(neagative,low ,medium หรือ high)ปัจจุบันใช้สารอ้างอิง(reference reagent)และรายงานผลด้วยหน่วยมาตรฐานนานาชาติ(international standard unit)ในการตรวจวัด ค่ามาตรฐานใช้ในการอ้างอิงผลบวก คือ ค่ามากกว่า 40 IgG phospholipid units(GPL) ,40 IgM phospholipid units(MPL)หรือ เปอร์เซนต์ไทด์ที่ 99(10)
สารภุมิต้านทานต้านเบต้า2 กลัยโคโปรตีน(Anti-Beta2-Glycoprotein I Antibodies- anti B2 GPI Ab)
การวิเคราะห์enzyme-linked immunosorbant assay(ELISA) ใช้การวัดไอโซโทป(isotope)IgGและ IgM anti-beta 2-glycoprotein I ใช้หน่วยมาตรฐานนานาชาติสำหรับการตรวจวัด โดย standard IgG unit (SGU)สำหรับ IgGและ standard IgM unit (SMU)สำหรับ IgMสำหรับผลบวก อ้างอิงเมื่อค่ามากกว่าเปอร์เซนต์ไทด์ที่ 99(10)
ปกติหน้าที่ของ Beta 2 glycoprotein Iป้องกันการแข็งตัวของเลือด หน้าที่หลักเป็นphospholipid dependent anticoagulant inhibitionสำหรับการทำหน้าที่ของเอนไซม์prothrombinaseของเกร็ดเลือด และการเกาะเป็นกลุ่มก้อนของเกร็ดเลือดเหนี่ยวนำด้วยเอดิโนซายน์ไดฟอสเฟต(ADP- induced platelet aggegration)(11)สาร Beta 2 glycoprotein I แย่งจับกับcoagulation factor โดยเฉพาะปัจจัยที่ 7(factor VII)และการรวมกลุ่มโปรธร็อมบินเนส(prothrombinase complex)บนผิวของฟอสโฟลิพิดช่วยป้องกันการกระตุ้นของcoagulation cascade Beta 2 glycoprotein พบปริมาณมากบริเวณผิวของเซลล์รกsyncytiotrophoblast(7) นอกจากนี้ โปรตีนนี้อาจเกี่ยวข้องกับการฝังตัว (implantation) ของตัวอ่อนและสามารถจับกับสารเฮพพาริน(heparin) ด้วยเซลล์รกtrophoblastมีตำแหน่งยึดติดสารคล้ายเฮพพาริน(heparin-liked binding site) หากสูญเสียโปรตีนนี้ในบริเวณดังกล่าวจากการมีสารภูมิต้านทานจะทำให้ป้องกันการฝังตัว(implantation)หรือ ส่งผลให้เกิดลิ่มเลือดในช่องว่างระหว่างเซลล์รก(intervillous space) หรือทั้งสองอย่าง(12)
สารภูมิต้านทานต้านฟอสโฟสลิพิดอื่น (other antiphospholipidantibodies)
การตรวจทางห้องปฏิบัติการณ์สำหรับสารภูมิต้านทานอื่นไม่ใช้ในเกณฑ์การวินิจฉัย ผลการตรวจช่วยเพิ่มความถูกต้องในการวินิจฉัยกลุ่มอาการต้านฟอสโฟลิพิด(APS)เพียงเล็กน้อย และ ไม่แนะนำใช้การตรวจสารภูมิต้านทานเหล่านี้(1)
สารภูมิต้านทานต้านฟอสโฟลิพิดและการตั้งครรภ์ปกติ (antiphospholipidantibodies andnormal pregnancy)
อุบัติการณ์ประมาณ ร้อยละ 1 ถึง 5 ในสตรีสุขภาพดีทั่วไป(7)สามารถตรวจพบความเข้มข้นระดับต่ำมีรายงานว่าน้อยกว่าร้อยละ 1 ต่อปีของผู้ป่วยกลุ่มนี้เกิดลิ่มเลือดอุดตันได้ (1) และการศึกษาปีค.ศ. 2011 โดยPengo(13)และคณะ ศึกษาผู้ป่วยจำนวน 104 คน ผู้การทดสอบให้ผลบวกทั้ง 3 วิธีพร้อมติดตามผู้ป่วยมีระยะเวลาติดตามเฉลี่ย ประมาณ 4.5 ปี พบว่า 25 คน พบอุบัติการณ์ของการเกิดลิ่มเลือดอุดตันในหลอดเลือด (ร้อยละ 5.3 ต่อปี) และ งานวิจัยในปีค.ศ.2007 ของ Erkan และคณะ(14)ในคนที่ตรวจพบสารภูมิต้านทานต้านฟอสโฟลิพิด(aPL)จำนวน 98 คน แต่ไม่มีอาการ แบ่งกลุ่มสองกลุ่ม กลุ่มแรก ได้รับ ASA จำนวน 48 คน และกลุ่มสองได้รับยาหลอก พบว่าไม่มีความแตกต่างกันในการเกิดลิ่มเลือดระหว่างสองกลุ่ม ดังนั้น ไม่ควรได้รับการป้องกันการเกิดลิ่มเลือดแบบปฐมภูมิ(primary thromboprophylaxis) สำหรับกลุ่มตรวจพบโดยบังเอิญและไม่มีอาการ
พยาธิสรีรวิทยา (Pathophysiology) (7)
ความสัมพันธ์ระหว่างสารภูมิต้านทานต้านฟอสโฟลิพิด(aPL)กับภาวะหลอดเลือดมีลิ่มเลือด(thrombosis)ยังเป็นที่ถกเถียงกัน แม้ว่ามีการศึกษาในสัตว์ทดลองว่า aPL เป็นสารตั้งต้นของการแข็งตัวของเลือดผิดปกติ(prothrombotic) กลไกส่งผลให้เกิดภาวะหลอดเลือดมีลิ่มเลือดมีข้อสันนิษฐานหลายอย่าง เช่น เพิ่มการแสดงออกของปัจจัยเนื้อเยื่อบนเซลล์เม็ดเลือดขาวmonocyte หรือเซลล์บุผนังภายใน(endothelial cell),การทำลายของเกร็ดเลือดโดยตรงจาก aPLหรือ ถูกทำลายทางอ้อมโดยการจับ Beta 2 glycoprotein I ส่งผลให้เกิดการเกาะกลุ่มของเกร็ดเลือด(platelet aggregration), การยึดจับโดยaPLของ Beta 2 glycoprotein I หรือ annexin V ส่งผลต่อการป้องกันเซลล์บุผิวของ syncytiotrophoblastและendothelial cellทำให้สัมผัสกับเซลล์เนื้อเยื่อฐาน(basement membrane)ทำให้เกิดลิ่มเลือด(thrombus formation) นอกจากนี้ aPLลดการสร้างสารพรอสตร้าเกรนดินอี 2 (vasodilating PGE2)ลดการทำงานของ Protein C,S เพิ่มการทำงานของโปรธร็อมบิน(prothrombin) ตามมา สุดท้ายมีหลักฐานว่า การไม่สามารถควบคุมการกระตุ้น ของ complement จาก aPLอาจมีบทบาทต่อการเกิดการสูญเสียเด็ก(fetal loss)และทารกในครรภ์น้ำหนักตัวน้อย(intra uterine growth retardation – IUGR)ได้ส่วนการจับของ anti Beta 2 glycoprotein I ในหลายตำแหน่ง และ หลายชนิดของเซลล์ รวมทั้งเซลล์บุผนังภายใน, เกร็ดเลือด, platelet , เซลล์เม็ดเลือดขาว monocyte และเซลล์รก(trophoblast)อาจเป็นตัวกระตุ้นส่งสัญญาณภายในเซล์ และการตอบสนองของกระบวนการอักเสบตามมา
สตรีตั้งครรภ์ผู้เกิดลิ่มเลือดในหลอดเลือดรกอาจทำให้เกิดรกบกพร่อง(placental insufficiency) อันนำไปสู่ทารกเสียชีวิต(fetal death)การตรวจทางพยาธิวิทยาพบการขาดเลือด (infarction) ร่วมกับก้อนเลือดรก(placental thrombus), การสะสมเส้นใยรอบเซลล์รก (perivillous fibrin deposit)และรอยโรคอักเสบเรื้อรัง(chronic inflammatory lesion)เป็นต้น
ภาวะแทรกซ้อน (complication)
1. ภาวะแทรกซ้อนทางอายุรศาสตร์ (medicalcomplications ofAntiphosphoslipid syndrome)
1.1 ภาวะหลอดเลือดมีลิ่มเลือด(thrombosis)(1)
เป็นภาวะแทรกซ้อนสัมพันธ์กับ APS อันพบได้บ่อยที่สุดและอันตราย กล่าวคือ มีลิ่มเลือดอุดตันของหลอดเลือด ส่วนใหญ่ร้อยละ65ถึง70เกิดในหลอดเลือดดำ และประมาณร้อยละ2ของผู้ป่วยทั้งหมดของภาวะหลอดเลือดดำมีลิ่มเลือดพบผลการตรวจLAC ได้ผลบวกตำแหน่งเกิดบ่อยคือระยางค์ล่าง(lower extremity) ส่วนตำแหน่งอื่นเกิดได้เกือบทุกตำแหน่ง
การศึกษาแบบย้อนหลังหนึ่งในผู้ป่วย APS ผู้ไม่ได้รับการรักษา พบอัตราการเป็นซ้ำของภาวะหลอดเลือดลิ่มเลือด ร้อยละ 25 ต่อปี ส่วนอัตราการเกิดซ้ำลดลงด้วยการให้สารต้านการเกาะเป็นลิ่ม(anticoagulant)นอกจากนี้ความเสี่ยงของการเกิดลิ่มเลือดเพิ่มขึ้นอย่างมีนัยสำคัญทางสถิติ ระหว่างช่วงตั้งครรภ์หรือ ช่วงหลังคลอด (postpartum) ในผู้ป่วย APS สูงถึงร้อยละ 25 (15)สอดคล้องกับอีกงานวิจัยหนึ่งรายงานความเสี่ยงของการเกิดลิ่มเลือดในช่วงตั้งครรภ์ และ หลังคลอด เท่ากับ ร้อยละ 5 ถึง 12
ส่วนการเกิดลิ่มเลือดอุดตันในหลอดเลือดแดง สัมพันธ์กับสารต้านภูมิต้านทานฟอสโฟลิพิด(aPL)ด้วยและเกิดในตำแหน่งไม่ค่อยพบ เช่นหลอดเลือดแดงไต(retinal), หลอดเลือดแดงใต้กระดูกไหปลาร้า (subclavian), และ หลอดเลือดแดงนิ้ว (digital)และ หลอดเลือดแดงแขน (brachial)เป็นต้นผลตามมาที่พบบ่อยที่สุด คือ ภาวะโรคหลอดเลือดสมอง(stroke)จากการอุดตันของหลอดเลือดแดงสมองใหญ่เส้นกลาง(middle cerebral)ส่วนโรคหลอดเลือดสมองตีบชั่วคราว(transcient ischemic attack –TIA)และภาวะตามืดชั่วคราว(amaurosisfugax)สัมพันธ์กับaPL ด้วย ประมาณร้อยละ 4-6 ของผู้ป่วยโรคหลอดเลือดสมองผู้มีอายุน้อยกว่า 50 ปีสามารถตรวจพบ aPLเช่นกัน ดังนั้น ผู้ป่วยภาวะหลอดเลือดแดงมีลิ่มเลือดโดยอธิบายไม่ได้ (unexplained arterial thrombosis), โรคหลอดเลือดสมอง, ภาวะตามือชั่วคราว หรือ โรคหลอดเลือดสมองตีบชั่วคราว สมควรได้รับการทดสอบสารต้านภูมิต้านทานฟอสโฟลิพิด(aPL)
1.2 ภาวะเกร็ดเลือดน้อยจากภูมิต้านทานตัวเอง (autoimmune thrombocytopenia)
พบร้อยละ 40-50 ในผู้ป่วย APS ภาวะนี้แยกยากจาก Idiopathic thrombocytopenic purpura(ITP)แม้ว่าการรักษาทั้งสองภาวะเหมือนกัน
1.3 อื่นๆ
ความหลากหลายของภาวะทางอายุรศาสตร์(medical condition)สัมพันธ์กับสารภูมิต้านทานต้านฟอสโฟลิพิด(aPL)เช่นautoimmune hemolytic anemia, livedoreticularis, cutaneousulcers, chorea gravidarum, multi-infarct dementiaและ transverse myelitis เป็นต้น
หมายเหตุ Chorea คือ การเคลื่อนไหวแบบต่อเนื่อง ไม่เป็นจังหวะและไม่มีแบบแผนที่แน่นอน (continuous flow of random movements) ไม่ซ้ำแบบเดิมทุกครั้ง เกิดจากรอยโรคที่ caudate nucleus และ putamen ใน basal ganglion เป็นภาวะแทรกซ้อนหนึ่งของการตั้งครรภ์ที่มีภาวะ eclampsia
2 ภาวะแทรกซ้อนทางสูติศาสตร์(obstetric complication of Antiphosphoslipid syndrome)
2.1 การสูญเสียการตั้งครรภ์ซ้ำซากและสูญเสียทารก (fetal and recurrent pregnancy loss –RPL)
ผู้ป่วยกลุ่มอาการต้านฟอสโฟลิพิด(APS)ที่มีสูญเสียการตั้งครรภ์ซ้ำซากและสัมพันธ์กับสารภูมิต้านทานต้านฟอสโฟลิพิด(aPL)ส่วนใหญ่มักเกิดในช่วงอายุครรภ์มากกว่า 10 สัปดาห์(fetal period of gestation) อย่างไรก็ตามการเสียชีวิตในช่วงนี้เป็นสัดส่วนน้อยมากเมื่อเทียบกับทั้งหมด เนื่องจากส่วนใหญ่มักเกิดก่อนอายุครรภ์ 10 สัปดาห์ การศึกษาในปีค.ศ.2009 ของ Nodlerรายงานผู้ป่วยAPS ผู้มีความเข้มข้น (titre) ของ aPLสูงกว่า มีผลลัพธ์แย่กว่าเมื่อเปรียบเทียบกับกลุ่มความเข้มข้นต่ำต่ำ(16)แม้ว่า aPLไม่สัมพันธ์กับ sporadic embryonic pregnancy loss แต่ aPLสัมพันธ์กับการสูญเสียตัวอ่อนและทารกซ้ำซาก(recurrent embryonic หรือ fetal loss) งานวิจัยส่วนใหญ่รายงานการตรวจพบผลบวกของ aPLประมาณ ร้อยละ 5 ถึง 20 ในผู้ป่วยสูญเสียการตั้งครรภ์ซ้ำซากโดย LAC เกี่ยวข้องกับการสูญเสียการตั้งครรภ์สูง ขณะที่anti-b2GPIยังไม่เป็นทราบชัด (17)สำหรับACA ไม่ค่อยมีบทบาทต่อการเกิดทารกตายโดยอธิบายไม่ได้(Unexplained fetal death)มีการศึกษาในผู้ป่วยจำนวน 309 คนผู้พบผลบวกของ ACA เปรียบเทียบกับ สตรีตั้งครรภ์ปกติ จำนวน 618 คน แต่ไม่มีความแตกต่างกันอย่างมีนัยสำคัญทางสถิติมีการศึกษาในผู้ป่วย APS และ ไม่มีประวัติ thrombophilia ในครอบครัว จำนวน 97 ราย พบว่าผลบวกจากการตรวจ aPL3 และ 2ชนิดมีโอกาสเกิดการแท้งร้อยละ 52.6,2.2 ตามลำดับ
2.2 ภาวะครรถ์เป็นพิษ (preeclamsia)
ภาวะครรภ์เป็นพิษสัมพันธ์กับกลุ่มอาการต้านฟอสโฟลิพิด(APS) แม้ร้อยละ11ถึง 17 ของผู้ป่วยภาวะครรภ์เป็นพิษตรวจพบสารภูมิต้านทานต้านฟอสโฟลิพิด(aPL)(1) แต่ค่อนข้างมีความสัมพันธ์อย่างเด่นชัดกับผู้ป่วยผู้มีภาวะครรภ์เป็นพิษอย่างรุนแรง(severe preeclampsia)และอายุครรภ์น้อยกว่า 34 สัปดาห์ การศึกษาในปีค.ศ.2007 ของ Clark และคณะ(18)พบว่าหนึ่งในสามของผู้ป่วย APS เกิดภาวะครรภ์เป็นพิษขณะตั้งครรภ์และผลการศึกษาไปข้างหน้าในผู้ป่วยจำนวน 1,000 คน พบว่า aPLเพิ่มความเสี่ยงการเกิดความดันโลหิตสูงขณะตั้งครรภ์(pregnancy induced hypertension) ด้วยค่าความเป็นต่อ (Odd ratio) เท่ากับ 5.5 และความดันโลหิตสูงขณะตั้งครรภ์ชนิดรุนแรง(severe pregnancy induced hypertension) ด้วยค่าความเป็นต่อ (Odd ratio) เท่ากับ 8.1 (19)
2.3 ภาวะทารกเจริญเติบโตช้าในครรภ์(intrauterine growth retardation)
พบประมาณร้อยละ 15ถึง30 ในผู้ป่วยกลุ่มอาการต้านโฟสโฟลิพิด(APS)แม้ว่า APS สัมพันธ์กับการเกิดภาวะเจริญเติบโตช้าในครรภ์แต่ยังมีหลักฐานโต้แย้งเกี่ยวกับสารภูมิต้านทานต้านฟอสโฟลิพิด(aPL)เพียงอย่างเดียว ต่อการเกิดภาวะทารกเจริญเติบโตช้าในครรภ์ความแตกต่างนี้เป็นผลจากบางงานวิจัยรวมผู้ป่วยผู้มีการทดสอบสารภูมิต้านทานต้านฟอสโฟลิพิดผลบวกต่ำ (low positive test )รวมเข้าด้วยกัน
2.4 การคลอดก่อนกำหนด (preterm birth)
ผู้ป่วยผู้มีประวัติสูญเสียการตั้งครรภ์ซ้ำซากและมีสารภูมิต้านทานต้านผอสโฟลิพิด(aPL)มีอัตราการคลอดก่อนกำหนดสูงกว่าปกติ(20)
กลุ่มอาการต้านฟอสโฟลิพิดเหตุร้ายแรง (catastrophic antiphospholipidsyndrome-CAPS)
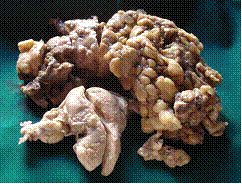
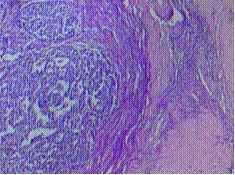
เป็นกลุ่มอาการต้านฟอสโฟลิพิดที่มีอาการฉับพลัน และมีภาวะล้มเหลวของหลายอวัยวะ(Multiorgan failure) (2, 4) ด้วยเกิดลิ่มเลือดขนาดเล็กจำนวนมากในหลายอวัยะที่พบบ่อยได้แก่ สมอง ไต ปอด และผิวหนัง เป็นอันตรายถึงชีวิตถึงร้อยละ 50 อุบัติการณ์ของภาวะเหตุร้ายแรงค่อนข้างต่ำ ปัจจุบันยังไม่มีการศึกษาทดลองควบคุมสุ่มอิสระ(randomized control trial – RCT) ชัดเจน ส่วนการตรวจทางห้องปฏิบัติการณพบเกร็ดเลือดต่ำ เม็ดเลือดแดงแตกสลาย หรือ การกระตุ้นระบบการแข็งตัวของเลือด เป็นต้น(3)การรักษาในกลุ่มนี้ ได้แก่ ยาต้านการแข็งตัวของเลือด , plasmapaeresis, IVIG, steroid และ rituximab เป็นต้น
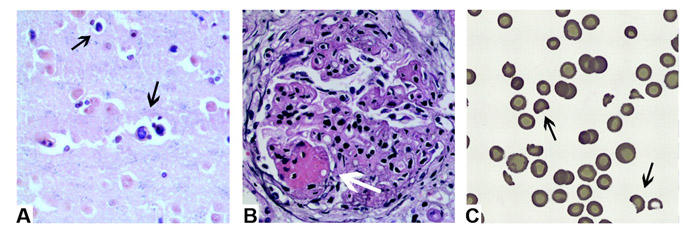
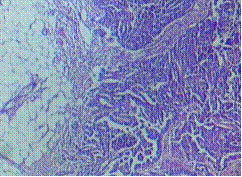
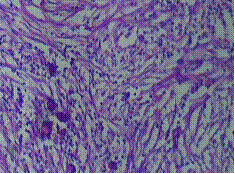
รูปภาพที่ 2 ลักษณะทางเนื้อเยื่อวิทยา(histology)ของ catastrophic APS (A) cerebral microthrombi (B) renal microthrobi (C) schistocytesจาก bloodsmear (2)
การจัดการ (management)
จุดมุ่งหมายของการรักษาขณะตั้งครรภ์เพื่อให้ผลลัพธ์ทั้งด้านแม่และลูกดีขึ้นการรักษาควรแบ่งผู้ป่วยเป็นสองกลุ่ม ตาม American College of Ostetricians and Gynecologists(ACOG) practice bulletin ปีค.ศ.2012ดังนี้ (1)
1. กลุ่มมีประวัติเหตุการณ์ลิ่มเลือดอุดหลอดเลือด(history of thrombotic event) (1)
ผู้เชี่ยวชาญส่วนใหญ่แนะนำการป้องกันต้านเลือดเกาะเป็นลิ่ม(prophylactic anticoagulant)ด้วย สาร heparin ตลอดการตั้งครรภ์และ 6 สัปดาห์หลังคลอดเป็นอย่างน้อยหรือควรได้รับตลอดไปการให้สาร heparin เพื่อลดความเสี่ยงภาวะลิ่มเลือดหลุดอุดหลอดเลือดในมารดา(maternal thromboembolism) ขณะตั้งครรภ์ครั้นหลังการคลอดสามารถเปลี่ยนเป็นยาwarfarin ได้ ส่วนประโยชน์ของยาaspirin ยังไม่เป็นที่ทราบชัด
2. กลุ่มไม่มีประวัติลิ่มเลือดอุดหลอดเลือดมาก่อน(no prior history of thrombotic event)(1)
ยังปราศจากการศึกษาที่ดีพอสำหรับการรักษาผู้ป่วยกลุ่มนี้อย่างเหมาะสมแต่ผู้เชี่ยวชาญแนะนำการเฝ้าระวังทางคลินิก(clinical surveillance) หรือ การสารต้านการเกิดลิ่ม(anticoagulant)ด้วย heparin ขณะตั้งครรภ์และ 6 สัปดาห์หลังคลอด ด้วยการพิจารณาอย่างสมเหตุสมผล นอกจากนี้ การศึกษาแบบทบทวนวรรณกรรมระบบเชิงปริมาณ(meta-analysis)สรุปว่าหากผู้ป่วยมีปัญหาการสูญเสียการตั้งครรภ์ซ้ำซาก และสารภูมิต้านทานต้านฟอสโฟลิพิด(aPL) การให้สารheparin ร่วมกับยาaspirin ขนาดต่ำ อาจช่วยลดปัญหาการสูญเสียการตั้งครรภ์ราวร้อยละ 54(21)ประมาณการว่าร้อยละ 75 ของสตรีตั้งครรภ์ในกลุ่มนี้สามารถตั้งครรภ์และสามารถคลอดบุตรได้ตามปกติการที่ได้รับการรักษาการร่วมกันดีกว่าการให้aspirin ขนาดต่ำอย่างเดียว หรือ การได้ยาprenisoloneดังนั้น สำหรับผู้ป่วยผู้มีปัญหาการสูญเสียการตั้งครรภ์ซ้ำซากแต่ไม่มีปัญหาลิ่มเลือดอุดตันหลอดเลือดมาก่อน ควรได้รับการการรักษาแบบใช้ยาร่วมกัน
ผู้ป่วยกลุ่มอาการต้านฟอสโฟลิพิด(APS)แม้ได้รับการรักษาแล้ว ร้อยละ 20ถึง30 ยังคงพบปัญหาการสูญเสียทารกในทางกลับกัน บางรายแม้พบสารภูมิต้านทานต้านฟอสโฟลิพิด(aPL)หรือ มีประวัติการตั้งครรภ์ผิดปกติมาก่อน กลับสามารถตั้งครรถ์และคลอดปกติโดยไม่ได้รับการรักษาใด
การรักษาทางยาสำหรับกลุ่มอาการต้านฟอสโฟลิพิด(medical treatment in APS)
1. Aspirin
กลไกการทำงานของ asprinคือ ยับยั้งการเปลี่ยน arachidonic acid เป็น thromboxane A2 ด้วยthromboxane A2 เป็นสาเหตุของplatelet aggregrationและ vasoconstriction ขณะที่มีการสร้าง prostacyclin อันมีผลตรงข้ามกัน ขนาดยาที่ใช้คือ 60 ถึง 80 มิลลิกรัมต่อวัน ผลข้างเคียงคือมีความเสี่ยงเลือดออกจากหลอดเลือดขนาดเล็กระหว่างการผ่าตัดการให้ aspirin อย่างเดียวเปรียบเทียบกับยาหลอกพบว่าไม่มีความแตกต่างอย่างมีนัยสำคัญทางสถิติในผู้ป่วย APS (22)
2. Unfractionated Heparin(UFH)
กลไกการทำงานของ heparin คือ ช่วยป้องกันการเกิดลิ่มเลือดอุดตันในหลอดเลือดดำ และหลอดเลือดแดง นอกจากนี้ยังช่วยป้องกันลิ่มเลือดภายใน microcirculation กล่าวคือ heparin จับกับ Beta 2 glycoprotein I ซึ่งคลุม syncytiotrophoblastการจับนี้ป้องกันการจับของ ACA และ anti Beta2 glycoprotein I ช่วยป้องกันการทำลายเซลล์ รายงานการวิจัยพบว่า heparin สามารถจับกับ aPLในหลอดทดลองได้ขนาดที่ใช้คือ 5,000ถึง 10,000 ยูนิต ฉีดเข้าชั้นไขมันใต้ผิวหนัง(subcutaneous fat) วันละ 2 ครั้งและ เมื่อเปรียบเทียบขนาดของยาพบว่าไม่มีความแตกต่างกันระหว่างขนาดสูง(high dose)กับขนาดต่ำ(low dose)(21) ผลข้างเคียงได้แก่ เลือดออก (bleeding), เกร็ดเลือดต่ำ (thrombocytopenia),กระดูกหัก(fracture),กระดูกบาง (osteopenia)และกระดูกพรุน(osteopororsis) เป็นต้น มีรายงานว่า unfractionated Heparin (UFH)ลดความหนาแน่นกระดูก(Bone Mass Density)ส่วน lumbar spine ประมาณ ร้อยละ 5.4 และ LMWH ลดความหนาแน่นกระดูกร้อยละ 5 เทียบกับร้อยละ 3 ในสตรีตั้งครรภ์ปกติและยังมีการศึกษาเกี่ยวกับunfractionated heparin ร่วมกับ aspirin ช่วยลดอุบัติการณ์เกิดการสูญเสียการตั้งครรภ์ เมื่อเปรียบเทียบกับ aspirin อย่างเดียว หรือช่วยภาวะทารกเจริญเติบโตช้าในครรภ์ร้อยละ 43(21
3. Low molecular weight heparin(LMWH)
การศึกษาในหลอดทดลองพบว่า LMWH สามารถช่วยฟื้นฟูการทำงานของtrophoblastได้ แต่การศึกษาพบว่า LWMH ร่วมกับ aspirin ไม่มีความแตกต่างทางสถิติ เมื่อเปรียบเทียบกับ asprinอย่างเดียวหรือการให้ภูมิต้านเข้าหลอดเลือดดำ(intravenous immunoglobulin – IVIG)ในการลดการเกิด pregnancy loss เดียว (21) ปัจจุบันไม่มีการศึกษาเปรียบเทียบอย่างแน่ชัดและดีเพียงพอระหว่าง LMWH กับ UFHจำเป็นที่ต้องมีการศึกษาในกลุ่มประชากรขนาดใหญ่ขึ้น และรูปแบบการศึกษาในเชิงทดลองมากขึ้นอย่างไรก็ตามมีการรวบรวมการศึกษาร่วมกันของ UFH และ LMWH พบว่าช่วยลดการสูญเสียการตั้งครรภ์หรือ คลอดก่อนกำหนดร้อยละ 35แม้ว่าLMWH และ UFH มีความแตกต่างกัน เช่น ความสามารถในการจับ thrombin หรือ โปรตีนอื่น โดยเฉพาะอย่างยิ่งขณะตั้งครรภ์ แต่ทั้ง2 ชนิด ต่างมีคุณสมบัติเท่ากันต่อการเป็นantithrombotic agent ในสตรีไม่ตั้งครรภ์ ดังนั้นไม่สามารถบอกแน่ชัดได้ว่าทั้ง 2 ชนิด มี biological effect เท่ากัน
4. Intravenous Immunoglobulin(IVIG)
แนะนำสำหรับผู้ป่วยเป็นโรครุนแรง, มี heparin-induced thrombocytopeniaหรือ ล้มเหลวจากการรักษาด้วยยาอื่นมาก่อนหน้า โดยเฉพาะภาวะครรภ์เป็นพิษ และ ภาวะทารกเจริญเติบโตช้าในครรภ์ ขนาดยา 0.4 กรัม/กิโลกรัม ระยะเวลา 5 วัน ให้ซ้ำได้ทุกเดือน หรือ ให้ขนาด 1 กรัม/กิโลกรัมทุกเดือน แต่ราคาของยาค่อนข้างแพง ผลการศึกษายังมีข้อโต้แย้งเกี่ยวกับประสิทธิภาพ ส่วนการศึกษาเชิงทดลองขนาดเล็กไม่พบประโยชน์จากการใช้ IVIGขณะที่บางการศึกษารายงานสามารถช่วยลดภาวะแทรกซ้อน จำเป็นต้องอาศัยการศึกษาแบบทดลองควบคุมแบบกลุ่มเพิ่มเติม
5. Prednisolone
ประสิทธิภาพในการรักษากลุ่มอาการต้านฟอสโฟลิพิด(APS)ยังไม่แน่ชัด และ มีความเสี่ยงสัมพันธ์กับการใช้ prednisolone เพื่อการป้องกัน(prophylaxis)พบว่ากลุ่มได้ยา prednisoloneเพิ่มการรับเด็กแรกเข้าหออภิบาลผู้ปวยหนักมากเป็น 9 เท่า, เพิ่มภาวะเบาหวานขณะตั้งครรภ์ 3.3.เท่า,เพิ่มความดันโลหิตสูงขณะตั้งครรภ์และเด็กแรกเกิดน้ำหนักน้อย เป็นต้นรายงานการรักษาเกี่ยวกับการใช้ prednisolone เพื่อรักษาใน APS พบ อัตราการประสบความสำเร็จการตั้งครรภ์ ถึง ร้อยละ 60ถึง 70 มีการศึกษาmeta-analysis สรุปว่าการให้ prednisolone และ low dose aspirin ไม่ช่วยลดการสูญเสียการตั้งครรภ์ในผู้ป่วยกลุ่มได้รับการรักษา ซึ่งการเปรียบเทียบผลการทดลองของแต่ละการวิจัยทำได้ยากเพราะว่ามีความแตกต่างกันเกี่ยวกับอาการทางคลินิก การตรวจห้องปฏิบัติการณ์ และ ขนาดของยา นอกจากนี้หลายงานวิจัยไม่เป็นการทดลองควบคุมแบบสุ่มอย่างไรก็ตามการให้prednisolone ในผู้ป่วย secondary APS สัมพันธ์กับ SLE active ควรได้รับในขนาดต่ำทีสุดอันสามารถป้องกันการกลับเป็นซ้ำของโรค
6. การรักษาด้วยการกดภูมิต้านทาน (immunosuppressive therapy)
เช่น azathioprine และ cyclosporine เป็นต้น ไม่มีการศึกษาประเมินที่ดี แต่ไม่พบว่าการรักษาด้วยยากลุ่มนี้จะช่วยเพิ่มประสิทธิภาพของการรักษามาตรฐานในปัจจุบัน
การตรวจติดตามสุขภาพทารก (Testing)
เนื่องจากผู้ป่วย APS มีความเสี่ยงต่อการเกิด IUGR และ stillbirth ได้ ดังนั้นการซักประวัติ ตรวจร่างกาย และ ตรวจติดตามสุขภาพนับว่ามีความสำคัญ แม้ว่าไม่มีข้อมูลทีสนับสนุนหรือคัดค้านแนวทางการปฏิบัติเฉพาะ แต่ผู้เชี่ยวชาญจำนวนมากแนะนำการตรวจสุขภาพทารกในครรภ์ในช่วงไตรมาสที่-3 ของการตั้งครรภ์ร่วมกับการตรวจอุลตราซาวด์เป็นระยะ
การรักษาผู้ป่วยในระยะยาว (long-term management)
ความเสี่ยงในระยะยาวของผู้ป่วย APS คือ thrombosis และ storkeมีรายงานการศึกษารวมในกลุ่มที่ไม่มีประวัติเรื่องลิ่มเลือดอุดตันมาก่อน พบว่า ประมาณ ร้อยละ 50 จะพบลิ่มเลือดอุดตัน ภายใน 3-10 ปีหลังจากตรวจติดตาม และ ร้อยละ 10 จะพบ SLE ตามมา (22) อย่างไรก็ตามยังไม่มีวิธีการในปัจจุบันสำหรับการทำนายว่าผู้ป่วยAPS ที่ได้รับการรักษาด้วย anticoagulant จะเกิด recurrent thrombosis ภายหลังจากการหยุดใช้ยา นอกจากนี้ ไม่มีหลักฐานที่ช่วยสนับสนุนการรักษาระยะ เมื่อมี thrombotic event เกิดขึ้น ดังนั้นการรักษาระยะควรส่งไปให้ผู้เชี่ยวชาญ เช่น internist ,hematologist หรือ Rheumatologist
การคุมกำเนิดในผู้ป่วย APS ไม่ควรใช้การคุมกำเนิดที่มีฮอร์โมนเอสโตรเจน เนื่องจากเพิ่มความเสี่ยงในการเกิดลิ่มเลือดอุดตันมากขึ้น ควรใช้ใช้โปรเจสเทอโรน(Progestin only forms) ในการคุมเนิด
ประมาณ ร้อยละ 30 ของเด็กแรกเกิดพบว่าได้รับ antiphospholipid antibodies จากมารดาได้ ซึ่งจากการศึกษาในปี ค.ศ. 2009 ของ Tincaniพบว่า เพิ่มความเสี่ยงการเกิดพัฒนาการเรียนรู้ทีผิดปกติ (learning disability) และ จากการศึกษาในปี ค.ศ. 2009 ของ Sichenพบเพิ่มความเสี่ยง 4 เท่าสำหรับการเกิด perinatal stroke ในทารก แต่ยังต้องการข้อมูลเพิ่มเติมเพื่อยืนยันข้อสรุปนี้
สรุป
APS เป็นโรคที่มีความสำคัญโรคหนึ่งสำหรับสตรีตั้งครรภ์ การวินิจฉัยและการรักษาตั้งแต่เริ่มแรกจะส่งผลที่ดีต่อทั้งมารดาและทารก ทั้งยังเป็นการช่วยป้องกันภาวะแทรกซ้อนที่อาจเกิดขึ้นได้ในอนาคต
เอกสารอ้างอิง
- D. Ware Branch, MD, Calla Holmgren, MD, and James D. Goldberg, MD..Antiphospholipid Syndrome. Practice Bulletin Number 132, December 2012.
- Cervera R, Piette JC, Font J, Khamashta MA, Shoenfeld Y, Camps MT, et al. Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of disease expression in a cohort of 1000 patients. Arthritis Rheum2002;46:1019-27.
- Danielle Cohen, Stefan P Berger, Gerda M Steup-Beekman, , Kitty W M Bloemenkamp, Ingeborg M Bajema.Diagnosis and management of the antiphospholipid syndrome. BMJ 2010; 340:2541.
- Cervera R, Piette JC, Font J, Khamashta MA, Shoenfeld Y, Camps MT, et al. Antiphospholipid syndrome: clinical and immunologic manifestations and patterns of disease expression in a cohort of 1000 patients. Arthritis Rheum2002;46:1019-27.
- David Keeling, Ian Mackie, Gary W. Moore, Ian A. Greer, Michael Greaves and British Committee for Standards Haematology . Guidelines on the investigation and management of antiphospholipidsyndrome.British Journal of Haematology, 2012, 157, 47–58
- Galli M, Luciani D, Bertolini G, Barbui T. Lupus anticoagulants are stronger risk factors for thrombosis than anticardiolipin antibodies in the antiphospholipid syndrome: a systematic review of the literature. Blood 2003; 101:1827–32.
- Lockshin MD. Update on antiphospholipid syndrome. Bull NYU HospJt Dis 2008;66:195–7.
- F. Gary Cunningham, Kenneth J. Leveno, Steven L. Bloom, John C. Hauth, Dwight J. Rouse, Catherine Y. Spong. Williams OBSTETRICS 23RDedition :The McGraw-Hill Companies;2010.p1151-1155.
- Rand JH, Wu XX, Andree HAM, et al: Pregnancy loss in the antiphospholipidantibody syndrome—a possible thrombogenic mechanism. N Engl J Med337:154, 1997a
- Triplett DA. Antiphospholipid antibodies. Arch Pathol Lab Med 2002;126:1424–9.
- Miyakis S, Lockshin MD, Atsumi T, Branch DW, Brey RL, Cervera R, et al. International consensus statement on an update of the classification criteria for definite antiphospholipid syndrome (APS). J ThrombHaemost 2006;4:295–306.
- Shi W, Chong BH, Hogg PJ, et al: Anticardiolipin antibodies block the inhibitionby _2 glycoprotein I of the factor Xa generating activity of platelets.ThrombHaemost 70:342, 1993
- Chamley LW, Duncalf AM, Konarkowska B, et al: Conformationally altered beta(2)-glycoprotein I is the antigen for anti-cardiolipin autoantibodies. ClinExpImmunol 115:571, 1999
- Vittorio Pengo, Amelia Ruffatti, Cristina Legnani, Sophie Testa, TizianaFierro, Francesco Marongiu. Incidence of a first thromboembolic event in asymptomatic carriers of study high-risk antiphospholipid antibody profile: a multicenter prospective. The American Society of Hematology2011; 118: 4714-4718
- Erkan, D., Harrison, M.J., Levy, R., Peterson, M.,Petri, M., Sammaritano, L., Unalp-Arida, A., Vilela, V., Yazici, Y. &Lockshin, M.D. (2007) Aspirin for primary thrombosis prevention in the antiphospholipid syndrome: a randomized, double-blind, placebo-controlled trial in asymptomatic antiphospholipid antibody-positive individuals. Arthritis and Rheumatism, 56, 2382– 2391
- Branch DW. Clinical consequences of antiphospholipidb antibodies: an historic cohort study. ObstetGynecol 1994;83:372–7.
- Nodler J, Moolamalla SR, Ledger EM, et al: Elevated antiphospholipid antibodytiters and adverse pregnancy outcomes: Analysis of a population-based hospital dataset. BMC Pregnancy Childbirth 9(1):11, 2009
- Opatrny L, David M, Kahn SR, Shrier I, Rey E. Association between antiphospholipid antibodies and recurrent fetal loss in women without autoimmune disease: a metaanalysis. J Rheumatol2006;33:2214-2
- Clark EAS, Silver RM, Branch DW: Do antiphospholipid antibodies causepreeclampsia and HELLP syndrome? Curr Rheum Reports 9:219, 2007b
- Yamada H, Atsumi T, Kobashi G, Ota C, Kato EH, Tsuruga N, et al. Antiphospholipid antibodies increase the risk of pregnancy-induced hypertension and adverse pregnancy outcomes. J ReprodImmunol 2009;79:188–95.
- Clark CA, Spitzer KA, Crowther MA, et al: Incidence of postpartum thrombosisand preterm delivery in women with antiphospholipid antibodies and recurrentpregnancy loss. J Rheumatol 34:992, 2007a
- Empson M, Lassere M, Craig J, Scott J. Prevention of recurrent miscarriage for women with antiphospholipid antibody or lupus anticoagulant . Cochrane Database of Systematic Reviews 2007.
- Tulppala M, Marttunen M, Soderstrom-Anttila V, Ailus K, PalosuoT, Ylikorkala O. Low dose aspirin in the prevention of miscarriage in women with unexplained or autoimmune related recurrent miscar- riage: effect on prostacyclin and thromboxane A2 production. Hu-man Reproduction 1997;12(1):191.