การเสริมสร้างภูมิคุ้มกันระหว่างตั้งครรภ์
การเสริมสร้างภูมิคุ้มกันระหว่างตั้งครรภ์
พญ.พนิดา มีลาภกิจ
อาจารย์ที่ปรึกษา อ.พญ.อินทิรา ศรีประเสริฐ
การสร้างภูมิคุ้มกันให้กับมารดา เป็นสิ่งที่ช่วยป้องกันอันตรายจากการติดเชื้อได้ทั้งในมารดาและทารก และยังสามารถป้องกันการติดเชื้อจากมารดาสู่ทารกหลังคลอดได้(1) สิ่งที่คาดว่าดีที่สุดคือการสร้างภูมิคุมกันให้กับมารดาตั้งแต่ก่อนตั้งครรภ์ แต่ถ้าไม่เคยได้ก่อนตั้งครรภ์บางครั้งอาจพิจารณาให้ขณะตั้งครรภ์ได้ตามความเหมาะสม
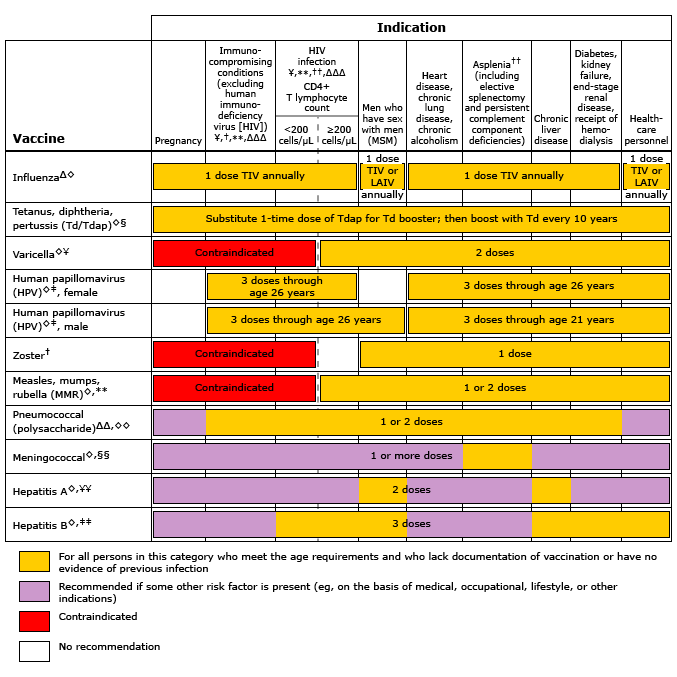
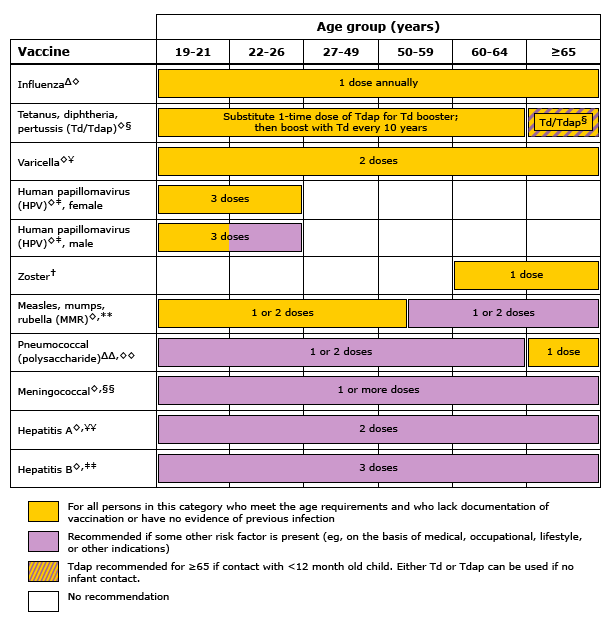
ผู้หญิงยังไม่มีภูมิคุ้มกัน สมควรจะได้รับการฉีดวัคซีนเมื่อมีความเสี่ยงสูงต่อการติดเชื้อ เนื่องจากถ้ามีติดเชื้อแล้วอาจมีอันตรายต่อทั้งมารดาและทารก ทั้งนี้การให้วัคซีนขณะตั้งครรภ์ก็ต้องมีการปรับเปลี่ยนตามความเหมาะสมด้วย และพบว่าการสร้างภูมิคุ้มกันในหญิงก่อนตั้งครรภ์และขณะตั้งครรภ์มีประสิทธิภาพดีพอๆกัน(2)
สมาคมโรคติดเชื้อแห่งประเทศสหรัฐอเมริกาได้เผยแพร่แนวทางการให้วัคซีนสำหรับหญิงตั้งครรภ์ไว้ว่า(3) ผู้ที่ให้วัคซีนควรเลือกวัคซีนชนิดที่เหมาะสมและมีข้อบ่งชี้ในการให้ โดยประเมินถึงความเสี่ยงที่ได้จากการรับวัคซีน และประโยชน์ต่อการป้องกันการติดเชื้อด้วย และถ้าหลังคลอดบุตรแล้วควรจะได้รับวัคซีนทั้งหมดที่แนะนำหรือยังไม่ได้ฉีดในขณะตั้งครรภ์ (เช่น หัด, คางทูม, หัดเยอรมัน, อีสุกอีใส, บาดทะยัก, ไอกรน เป็นต้น)
ความสำคัญอีกประการคือ สูตินรีแพทย์มักเป็นแพทย์คนแรกที่ได้พบหญิงวัยเจริญพันธุ์ที่กำลังเตรียมพร้อมต่อการมีบุตร ซึ่งเป็นโอกาสอันดีที่จะได้ตรวจคัดกรองหรือให้คำแนะนำในการฉีดวัคซีนที่เหมาะสม อย่างไรก็ตามปัจจัยทางเศรษฐสถานะของผู้ป่วย ความรู้ในการให้คำปรึกษาเกี่ยวกับวัคซีน ความปลอดภัยและวิธีการให้วัคซีนก็เป็นสิ่งที่ต้องคำนึงเช่นกัน (4,5)
การสร้างเสริมภูมิคุ้มกัน คือ การทำให้ร่างกายมีภูมิคุ้มกันมากขึ้น แบ่งออกได้เป็น 2 วิธี ได้แก่
- การให้ภูมิคุ้มกันจากคน หรือ สัตว์ที่สร้างมาก่อนแล้ว (passive immunization) โดยเรียกสารที่ให้นี้ว่า เซรุ่ม หรือ ซีรั่ม (serum) มักจะใช้ในกรณีที่ได้รับหรือสัมผัสกับสิ่งแปลกปลอมมาแล้ว ตัวอย่างของเซรุ่ม ได้แก่ เซรุ่มแก้พิษงู เซรุ่มแก้พิษสุนัขบ้า เป็นต้น
- การกระตุ้นให้ร่างกายสร้างภูมิคุ้มกันเอง (active immunization) โดยเรียกสารที่ให้ว่า วัคซีน (vaccine) มักจะใช้ในกรณีป้องกันก่อนสัมผัสสิ่งแปลกปลอม ตัวอย่างของวัคซีน ได้แก่ วัคซีนป้องกันหัดเยอรมัน วัคซีนป้องกันไข้หวัดใหญ่ เป็นต้น
ชนิดของวัคซีน วัคซีนแบ่งออกได้เป็น 3 ชนิด ได้แก่
- ท็อกซอยด์ (toxoids) เป็นวัคซีนที่ได้จากการนำเชื้อโรคมาทำลายความเป็นพิษให้หมดไป แต่ยังมีคุณสมบัติในการนำมากระตุ้นภูมิคุ้มกันได้ดี เช่น พิษจากโรคคอตีบ พิษจากโรคบาดทะยัก เป็นต้น
- วัคซีนชนิดเชื้อตาย (killed vaccine) เป็นวัคซีนที่ได้จากการนำเชื้อโรคมาทำให้ตาย อาจใช้เชื้อทั้งตัวหรือสกัดเอาบางส่วนของเชื้อมาทำวัคซีน เช่น วัคซีนไอกรน วัคซีนไข้หวัดตามฤดูกาล วัคซีนโปลิโอชนิดฉีด วัคซีนตับอักเสบบี เป็นต้น
- วัคซีนชนิดเชื้อเป็น (live attenuated vaccine) เป็นวัคซีนที่ได้จากการเพาะเลี้ยงเพิ่มจำนวนเชื้อโรค แล้วนำเชื้อโรคมาทำให้อ่อนแรงลง จนไม่สามารถก่อโรคได้ แต่ยังมีฤทธิ์กระตุ้นภูมิคุ้มกันได้ เช่น วัคซีนหัด-หัดเยอรมัน-คางทูม วัคซีนโปลิโอชนิดกิน เป็นต้น
วิธีการให้วัคซีน
- การรับประทาน เป็นวิธีการให้วัคซีนที่ง่ายที่สุด แต่มีวัคซีนเพียงไม่กี่ชนิดที่สามารถให้ด้วยวิธีนี้ได้ ทำให้เกิดภูมิคุ้มกันที่ลำไส้ได้ด้วย เช่น วัคซีนโปลิโอ วัคซีนไทฟอยด์
- การพ่นเข้าทางจมูก ทำให้เกิดภูมิคุ้มกันในทางเดินหายใจด้วย เช่นวัคซีนไข้หวัดใหญ่ชนิดพ่น
- การฉีดเข้าในชั้นผิวหนัง เป็นการให้วัคซีนที่ใช้ปริมาณน้อย การฉีดทำได้ยาก ต้องมีความชำนาญในการฉีด แต่ทำให้เกิดภูมิคุ้มกันได้ดี เช่น วัคซีนบีซีจี วัคซีนพิษสุนัขบ้า
- การฉีดเข้าใต้ผิวหนัง ใช้สำหรับวัคซีนที่ไม่มี adjuvant (เป็นสารประกอบ หรือ โมเลกุล ที่ช่วยให้แอนติเจนในวัคซีนชนิดใดชนิดหนึ่งกระตุ้นระบบภูมิคุ้มกันได้ดีขึ้น)
- การฉีดเข้ากล้ามเนื้อ ใช้สำหรับวัคซีนที่มี adjuvant วัคซีนแต่ละชนิดได้รับการออกแบบมาโดยมีวิธีการให้ที่เหมาะสม การให้วัคซีนจึงต้องทำโดยผู้ชำนาญเพื่อความปลอดภัยและประสิทธิภาพสูงสุดของวัคซีน
การเสริมสร้างภูมิคุ้มกันก่อนการตั้งครรภ์
การตั้งครรภ์ควรหลีกเลี่ยงภายหลังจากได้รับการฉีดวัคซีนอย่างน้อย 4 สัปดาห์
Human papillomavirus
HPV วัคซีนจัดอยู่ใน category B ตามการจัดแบ่งขององค์การอาหารและยา (FDA) ประสิทธิภาพของ HPV vaccine จะสูงที่สุดในสตรีที่ยังไม่ติดเชื้อ HPV ดังนั้นจึงควรฉีดวัคซีนก่อนถึงวัยที่จะมีเพศสัมพันธ์ เพื่อป้องกันการติดเชื้อ HPV และรอยโรคที่จะเกิดตามมา ช่วงอายุที่แนะนำคือ 9-26 ปี ส่วนสตรีที่มีอายุมากกว่า 26 ปี ยังไม่มีข้อมูลด้านประสิทธิภาพในการป้องกันการติดเชื้อ HPV และรอยโรค , และวัคซีนนี้ไม่แนะนำให้ฉีดในหญิงตั้งครรภ์
การฉีด HPV vaccine ให้ฉีด 0.5 มล. เข้ากล้ามเนื้อจำนวน 3 ครั้ง (3 เข็ม) ดังนี้
- ครั้งที่ 1 : ฉีดในวันที่กำหนดเลือก
- ครั้งที่ 2 : ฉีดในเดือนที่ 1-2 หลังจากการฉีดครั้งแรก
- ครั้งที่ 3 : ฉีดในเดือนที่ 6 หลังจากการฉีดครั้งแรก
Measles, mumps, rubella (โรคหัด, คางทูม, หัดเยอรมัน)
เป็นวัคซีนเชื้อเป็น (Live attenuated vaccine) เพราะฉะนั้นควรให้ในผู้หญิงที่ยังไม่ได้ตั้งครรภ์ที่ยังไม่มีภูมิคุ้มกัน และหากได้รับวัคซีนในช่วงก่อนตั้งครรภ์ภายใน 4 สัปดาห์หรือได้รับวัคซีนในขณะตั้งครรภ์ก็ไม่ใช่เหตุผลสำหรับยุติการตั้งครรภ์
โรคหัด ระหว่างการตั้งครรภ์นั้นสัมพันธ์กับการเพิ่มขึ้นของอัตราการคลอดก่อนกำหนด และอาจทำให้แท้งได้(6,7) แต่ยังไม่มีหลักฐานที่ชัดเจนว่าทำให้เกิดความพิการเพิ่มขึ้นหากมีการติดเชื้อระหว่างตั้งครรภ์(7)
โรคคางทูม ถ้าเป็นในช่วงไตรมาศแรกของการตั้งครรภ์ อาจจะสัมพันธ์กับการเสียชีวิตของทารก ส่วนเรื่องความผิดปกติของทารกยังไม่ปรากฏว่าเพิ่มขึ้น แม้ว่าจะสัมพันธ์กับ endocardial fibroelastosis จากที่พบในบางการศึกษาก็ตาม(8)
โรคหัดเยอรมัน สัมพันธ์ต่อการเพิ่มความเสี่ยงต่อการแท้งและการเสียชีวิตของทารก
โรคหัดเยอรมันในทารกแรกเกิด (Congenital rubella syndrome) จะมีอาการหูหนวก ความผิดปกติทางสายตา หัวใจพิการ ความผิดปกติของกระดูก รวมทั้งความผิดปกติของระบบประสาทรวมถึงสติปัญญาด้วย ซึ่งพบได้ประมาณ 20-85% ในทารกที่เกิดจากมารดาที่ได้รับเชื้อหัดเยอรมันก่อนอายุครรภ์ 20 สัปดาห์ ซึ่งมีความเสี่ยงสูงที่สุดหากได้รับการติดเชื้อในช่วงเดือนแรกของการตั้งครรภ์(6)
การตรวจเพื่อหาภูมิคุ้มกันโรคหัดเยอรมันใช้ IgG antibody titer และ IgM antibody titer ไม่ควรเจาะตรวจเพราะบอกได้แค่ว่ามีเชื้อเมื่อไม่นานหรือเพิ่งติดเชื้อ
วัคซีน MMR สามารถให้ได้ปลอดภัยหลังคลอดหรือในหญิงที่ให้นมบุตร แม้ว่า Rubella virus จะสามารถผ่านทางน้ำนมได้(9)
Varicella (โรคอีสุกอีใส)
โรคอีสุกอีใสที่เกิดในวัยเด็ก ไม่ต้องใช้ยา อาการต่างๆ ก็จะหายได้เอง แต่การติดเชื้อในทารกและผู้ใหญ่ ร้อยละ 20-30 จะเกิดอาการรุนแรง ได้แก่ ปอดอักเสบ และ สมองอักเสบ จนต้องเข้ารักษาตัวในโรงพยาบาล ต้องได้รับยาต้านไวรัส และอาจถึงแก่ชีวิตได้
มารดาที่ได้รับการติดเชื้อระหว่างตั้งครรภ์ในช่วง 20 สัปดาห์แรก เป็นสาเหตุให้เกิด Congenital rubella syndrome ซึ่งมีอาการดังนี้ แขนขาเล็ก, ศีรษะเล็ก ,ผิวหนังผิดปกติ และตาบอดได้ ซึ่งพบประมาณ 2% (10)
ในผู้หญิงทั่วไปที่ไม่ได้ตั้งครรภ์เมื่อฉีดวัคซีนแล้วควรหลีกเลี่ยงการตั้งครรภ์อย่างน้อย 1 เดือน ไม่แนะนำให้ฉีดวัคซีนขณะตั้งครรภ์ แต่ถ้าได้โดยบังเอิญก็ไม่ใช่เหตุผลอ้างอิงเพื่อยุติการตั้งครรภ์
การรับวัคซีนสำหรับเด็กอายุต่ำกว่า 13 ปี ที่ยังไม่เคยมีเป็นโรคอีสุกอีใส ให้รับ 2 เข็มห่างกันอย่างน้อย 3 เดือน สำหรับอายุ 13 ปีขึ้นไปและผู้ใหญ่ รับวัคซีน 2 เข็มห่างกันอย่างน้อย 1 เดือน
ปัจจุบันมีวัคซีนรวมป้องกันโรคหัด คางทูม หัดเยอรมัน และ อีสุกอีใส (MMRV) สำหรับเด็กอายุ 1-12 ปี จำหน่ายในประเทศสหรัฐอเมริกาตั้งแต่ปี พ.ศ. 2548 วัคซีนประสิทธิภาพดีพอพอกับวัคซีนเดี่ยว แต่พบมีไข้สูงและชักเนื่องจากไข้ ในเด็กอายุ 1-2 ขวบ หลังรับวัคซีนรวม MMRV บ่อยกว่าวัคซีนเดี่ยว จึงแนะนำให้รับเข็มแรกเป็นวัคซีนเดี่ยว และรับเข็มที่สองเป็นวัคซีนรวมเมื่ออายุ 4-6 ปี
ACIP จึงกำหนดให้รับวัคซีน 2 เข็มสำหรับทุกอายุ วัคซีน 1 เข็มป้องกันโรคได้เพียงร้อยละ 85.7 วัคซีน 2 เข็มป้องกันโรคได้สูงถึงร้อยละ 99.6 และคาดว่าภูมิคุ้มกันอยู่ได้นานตลอดชีวิต ดังนั้นผู้ที่เคยได้รับวัคซีนมาแล้ว 1 เข็มเมื่อวัคซีนนี้เพิ่งเข้าสู่ตลาดใหม่ ๆ ควรรับอีกหนึ่งเข็มทันที โดยที่ไม่จำเป็นต้องตรวจว่ามีภูมิคุ้มกันหรือไม่ เพราะการรับวัคซีนขณะที่มีภูมิคุ้มกันอยู่แล้วไม่มีอันตรายใดใด
เนื่องจากหญิงตั้งครรภ์มีความเสี่ยงสูงต่อการเกิดโรคหรือภาวะแทรกซ้อนที่รุนแรงของอีสุกอีใส การให้ VZIG (Varicella zoster immunoglobulin) ควรได้รับการแนะนำในหญิงตั้งครรภ์ที่ยังไม่มีภูมิคุ้มกันหรือไม่เคยเป็นโรคอีสุกอีใสมาก่อน แม้ว่า VZIG ไม่ได้ป้องกันการติดเชื้อเข้าสู่กระแสเลือดหรือการติดเชื้อในทารก congenital varicella syndrome ดังนั้นข้อบ่งชี้ในการให้เบื้องต้นเพื่อป้องกันภาวะแทรกซ้อนที่รุนแรง จากการเกิดโรคอีสุกอีใสในมารดามากกว่าป้องกันทารก
VZIG ผลิตจากพลาสมาสกัดที่มี anti varicella antibody ปริมาณสูง ให้ในมารดาที่มีความเสี่ยงหรือมีประวัติสัมผัสคนที่เป็นโรคอีสุกอีใส หรือโรคงูสวัสชัดเจน โดยสามารถให้ได้ภายใน 10 วันหลังสัมผัสเชื้อหรือทางที่ดีที่สุดคือให้เร็วที่สุดเท่าที่จะทำได้ โดยหลักการให้เน้นเพื่อป้องกันการเกิดภาวะแทรกซ้อนที่รุนแรงในมารดา ขนาดยาที่ให้ VZIG 400 mg/kg ครั้งเดียว
โรคงูสวัส(Zoster)
วัคซีนป้องกันโรคงูสวัส Zostavax เป็นวัคซีนเชื้อเป็น ที่ใช้ป้องกันโรคงูสวัสและอาการปวดแสบร้อนปลายประสาท (postherpetic neuralgia) ในผู้ป่วยที่อายุมากกว่า 60 ปี วัคซีนนี้ไม่ควรให้ในผู้หญิงที่กำลังตั้งครรภ์ และผู้หญิงที่จะตั้งครรภ์หลังจากฉีดวัคซีนแล้วควรหลีกเลี่ยงการตั้งครรภ์ไปก่อนอย่างน้อย 4 สัปดาห์ แต่ถ้าหากได้รับการฉีดวัคซีนขณะตั้งครรภ์โดยบังเอิญก็ไม่ใช่ข้อบ่งชี้ในการยุติการตั้งครรภ์(11,12)
การเสริมสร้างภูมิคุ้มกันขณะตั้งครรภ์
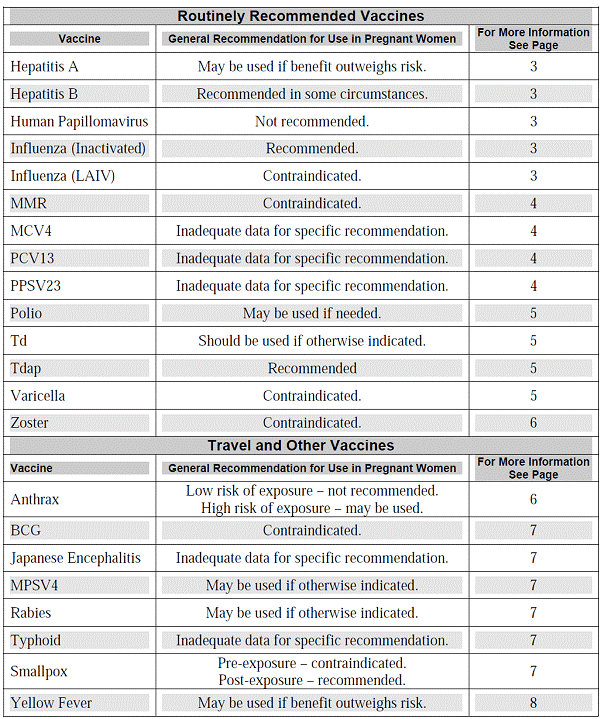
เมื่อได้รับวัคซีนขณะตั้งครรภ์ ต้องเปรียบเทียบข้อดีและข้อเสียของทั้งมารดาและทารก ในขณะนี้ยังไม่มีหลักฐานบ่งชี้ว่าวัคซีนเชื้อตาย (inactivated vaccine) จะเป็นอันตรายต่อมารดาหรือทารก อย่างไรก็ตามวัคซีนเชื้อเป็น(Live vaccine) แม้ว่าจะปลอดภัยในเด็กและผู้ใหญ่ แต่ก็อาจมีอันตรายต่อทารกขณะกำลังพัฒนาในครรภ์ได้
วัคซีนที่แนะนำให้ให้สำหรับผู้หญิงตั้งครรภ์ทุกราย
วัคซีนที่แนะนำให้ให้ในผู้หญิงตั้งครรภ์ทุกรายได้แก่ วัคซีนป้องกันโรคคอตีบ ไอกรนและบาดทะยัก (Tdap) และวัคซีนป้องกันไข้หวัดใหญ่(3) โดยการฉีดวัคซีนนั้นแนะนำให้เลื่อนไปจนกว่าจะเข้าไตรมาสที่ 2 หรือไตรมาสที่ 3 ของการตั้งครรภ์ ซึ่งมีผลกระทบต่อการเจริญที่ผิดปกติของตัวอ่อนน้อยมาก
วัคซีนป้องกันคอตีบ ไอกรน บาดทะยัก( Tetanus, diphtheria, pertussis) สามารถแบ่งให้ได้สามกลุ่ม
- ไม่เคยได้รับวัคซีนมาก่อน, ได้ไม่ครบ หรือไม่ทราบประวัติการฉีดวัคซีนป้องกันบาดทะยักและคอตีบมาก่อน
- ผู้หญิงที่ไม่เคยได้รีบวัคซีนมาก่อนเลย ควรได้รับการฉีดวัคซีนใหม่ครบ 3 เข็ม ที่ 0, 4 สัปดาห์ และที่ 6-12 เดือนหลังจากเข็มแรก
- และเพื่อป้องกันโรคไอกรนด้วย ควรให้ Tdap แทนที่การฉีด Td 1 เข็ม ช่วงเวลาที่เหมาะสมต่อการให้คือ หลัง 20 สัปดาห์จนกระทั่งคลอด เนื่องจากหลัง 20 สัปดาห์ไปจะมีผลกระทบต่อการเจริญของทารกในครรภ์น้อยมาก
- กรณีเคยได้รับวัคซีนบาดทะยักครบมาก่อนและยังอยู่ภายใน 5 ปี
- ผู้หญิงตั้งครรภ์ที่เคยได้รีบการฉีดวัคซีน Td ครบ 3 เข็ม ควรได้รับ Tdap 1 เข็มขณะตั้งครรภ์ โดยช่วงที่แนะนำคือหลังจากอายุครรภ์ 20 สัปดาห์
- แต่ถ้าไม่ได้รับ Tdap ในช่วงตั้งครรภ์ ควรให้ทันทีหลังคลอด ซึ่งสามารถสร้างภูมิคุ้มกันและส่งผ่านจากมารดาสู่ทารกได้จาก antibody ผ่านทางน้ำนม แต่อาจจะไม่ได้ป้องกันทันที ต้องรออย่างน้อย 2 สัปดาห์หลังจากมารดาได้รับวัคซีน(13)
- กรณีได้รับวัคซีนกระตุ้น Td booster เข็มสุดท้ายมานานกว่า 5 หรือ 10 ปี
- Tdap วัคซีน เป็นวัคซีนที่ควรได้รับในหญิงตั้งครรภ์ทุกราย ในรายที่เคยได้รับวัคซีนกระตุ้นเพื่อป้องกันบาดทะยักและคอตีบภายใน 5 หรือ 10 ปี หลังจากฉีดกระตุ้นเข็มสุดท้าย หากไม่เคยได้รับ Tdap มาก่อน
- แนะนำให้ฉีด Td booster ระหว่างตั้งครรภ์ หากเคยได้รับการกระตุ้นเข็มสุดท้ายมานานมากกว่า 10 ปี (แนะนำช่วงไตรมาศที่สองถึงสาม) แต่ถ้าหากต้องการฉีดกระตุ้นเพื่อดูแลรักษาบาดแผล จะแนะนำฉีดกระตุ้นเมื่อเคยได้รับเข็มสุดท้ายมานานมากกว่าหรือเท่ากับ 5 ปี
Influenza (วัคซีนป้องกันไข้หวัดใหญ่)
เป็นวัคซีนเชื้อตาย (Inactivated vaccine)- ไข้หวัดใหญ่ทำให้เกิดอันตรายต่อหญิงตั้งครรภ์ โดยอันตรายเพิ่มขึ้นจากการมีภาวะแทรกซ้อนและเป็นสาเหตุให้ต้องนอนโรงพยาบาลเพิ่มขึ้น(14-16) วิธีการบริหารยาเป็นแบบฉีดเข้ากล้ามเนื้อ และเนื่องจากวัคซีนทำจากเชื้อตายจึงแนะนำให้ให้ เพื่อลดความเสี่ยงต่อการเกิดอันตรายจากภาวะแทรกซ้อน และเพื่อเสริมสร้างภูมิคุ้มกันต่อทารกด้วย และไม่เป็นข้อห้ามต่อการให้นมบุตรด้วย(17-21)
ในประเทศสหรัฐอเมริกาแนะนำให้ฉีดวัคซีนในหญิงตั้งครรภ์ทุกราย ก่อนเข้าสู่ฤดูระบาดของโรคไข้หวัดใหญ่ คือ ช่วงตุลาคมถึงกลางเดือนพฤศจิกายน โดยวัคซีนจะมีผลครอบคลุมสูงสุดจนกระทั่งเดือนมกราคมหรือกุมภาพันธ์(22,23)
LAIV เป็นวัคซีนเชื้อเป็น ให้ผ่านการพ่นจมูก เพราะฉะนั้นไม่ควรให้ขณะตั้งครรภ์(20,24) ส่วนหลังคลอดสามารถให้ได้ แม้ว่าอาจจะมีโอกาสที่มารดาที่ได้รับวัคซีนจะเกิดการติดเชื้อแล้วสัมผัสกับทารกอย่างใกล้ชิด แต่ยังไม่มีข้อมูลชัดเจนว่าสามารถส่งผ่านไปทางน้ำนมได้ ดังนั้นจึงยังไม่เป็นข้อห้ามในหญิงที่ให้นมบุตร
ไวรัสตับอักเสบบี (Hepatitis B)
การติดเชื้อไวรัสตับอักเสบบี อาจทำให้เกิดโรคตับอักเสบเฉียบพลัน และอาจเกิดตับวายได้ หรือบางคนอาจกลายเป็นพาหะของโรค และต่อมาอาจกลายเป็นโรคตับแข็ง และมะเร็งตับในที่สุด เชื้อชนิดนี้ติดต่อไปยังผู้อื่นโดยผ่านทางเลือด การมีเพศสัมพันธ์ การใช้เข็มฉีดยา หรือของมีคมร่วมกัน เชื้อนี้สามารถติดจากแม่สู่ลูกได้ในขณะตั้งครรภ์ ดังนั้นในหญิงที่ตั้งครรภ์ การตรวจเลือดสามารถทราบว่าเป็นพาหะของเชื้อโรคนี้หรือไม่ และอาจพิจารณาได้ว่าควรได้รับวัคซีนป้องกันไวรัสตับอักเสบบีหรือไม่
ผู้หญิงตั้งครรภ์ที่ควรได้รับวัคซีนป้องกันไวรัสตับอักเสบบี ได้แก่ คนยังไม่มีภูมิคุ้มกันต่อไวรัสตับอักเสบบี หรือมีความเสี่ยงต่อการติดเชื้อไวรัสตับอักเสบบี เช่น มีคู่นอนมากกว่า 1 คนภายใน 6 เดือน หรือ คู่นอนมีผล HBsAg เป็นบวก ควรได้รับการฉีดวัคซีนและประเมินโรคติดต่อทางเพศสัมพันธ์ เป็นต้น(25)
ขนาดและการบริหารวัคซีน
กำหนด การให้วัคซีนมาตรฐานคือ ฉีดเข้ากล้าม 3 เข็ม โดย 2 เข็มแรกห่างกัน 1 เดือน และเข็มที่ 3 ห่างจากเข็มแรก 6 เดือน
การ ให้วัคซีนสำหรับทารกแรกเกิดทุกคน ให้วัคซีนเข็มแรกทันที (ไม่เกิน 24 ชั่วโมงหลังคลอด) เข็มที่สองเมื่ออายุ 1-2 เดือน และเข็มที่สามเมื่ออายุ 6 เดือน ทารกที่เกิดจากมารดาที่เป็นพาหะ ควรได้รับวัคซีนเข็มที่ 2 เมื่ออายุ 1 เดือน จะลดความเสียงต่อการติดเชื้อได้ดีกว่าการรับวัคซีนเมื่ออายุ 2 เดือน
เด็กที่เกิดจากมารดาที่ไม่ได้เป็นพาหะ เข็มแรกหลังคลอดรับเป็นวัคซีนเดี่ยว แต่เข็มต่อไปอาจรับเป็นวัคซีนรวมที่มีวัคซีนป้องกันโรคคอตีบ บาดทะยักและไอกรน เมื่ออายุ 2 เดือน 4 เดือน และ 6 เดือน รวมได้รับวัคซีนไวรัสตับอักเสบบี 4 เข็ม
วัคซีนป้องกันไวรัสตับอักเสบเอ
ไวรัสตับอักเสบเอเป็นสาเหตุของตับอักเสบที่พบบ่อยและมีความสำคัญเนื่องจากมีอันตรายต่อชีวิตได้ โดยมารดาที่เป็นโรคไวรัสตับอักเสบเอ อาจสัมพันธ์กับการคลอดก่อนกำหนด(26) การติดเชื้อในโพรงมดลูกก็มีการกล่าวถึง เช่น meconium peritonitis, ทารกมีน้ำในช่องท้องและภาวะน้ำคร่ำเกิน เป็นต้น
เป็นวัคซีนเชื้อตาย ได้จากการเลี้ยงไวรัสในเซลล์เพาะเลี้ยง (human fibroblast) และทำให้หมดฤทธิ์ด้วยฟอร์มาลิน สำหรับหญิงมีครรภ์ ไม่แนะนำให้รับวัคซีนทุกราย ยกเว้นรายที่มีความเสี่ยงสูงต่อการเกิดโรคไวรัสตับอักเสบเอ เนื่องจากยังไม่มีข้อมูลเรื่องความปลอดภัยของวัคซีนตับอักเสบเอสำหรับหญิงมีครรภ์ แต่ยังไม่มีหลักฐานว่าเป็นอันตรายต่อหญิงมีครรภ์และทารกในครรภ์ และเชื่อว่าความเสี่ยงต่ำมาก
วัคซีนป้องกัน Pneumococcus
แนะนำสำหรับผู้หญิงตั้งครรภ์ที่มีความเสี่ยงสูงต่อการเกิดโรค ยังมีข้อมูลเพียงเล็กน้อยเกี่ยวกับความปลอดภัยของการให้วัคซีนในช่วงไตรมาสแรกของการตั้งครรภ์ แต่พบว่ามีความปลอดภัยหากให้ในช่วงไตรมาสที่สองหรือสามของการตั้งครรภ์และยังมีประโยชน์เนื่องจากสามารถส่งผ่านไปให้ลูกได้ อย่างไรก็ตามยังไม่ได้พิสูจน์ว่าสามารถลดอัตราการติดเชื้อของเด็กแรกเกิดได้
วัคซีนป้องกันไข้เหลือง (Yellow fever)
ไข้เหลือง เป็นโรคติดต่อที่มียุงเป็นพาหะ โดยการถูกยุงที่เป็นพาหะกัด ยุงที่เป็นพาหะนำไข้เหลือง พบได้ในทวีปแอฟริกาบริเวณเส้นศูนย์สูตร (Equatorial Africa) และอเมริกาใต้ ไข้เหลืองเป็นโรคที่ช่วงฝักตัวเป็นเวลา 3-6 วัน โดยจะมีอาการเป็นไข้ ปวดหัว ปวดท้อง และอาเจียน หลังจากนี้จะเป็นช่วงฟื้นตัวขึ้นอย่างสั้นๆ โดยจะตามต่อด้วยอาการช็อค เลือดออก และการทำงานของตับล้มเหลวซึ่งเป็นสัญญาณของโรคดีซ่าน จึงทำให้เป็นที่มาของชื่อโรค “ไข้เหลือง” สำหรับโรคไข้เหลืองยังไม่มียารักษาโรค ประมาณ 5% ของผู้ติดเชื้อเสียชีวิต แต่สามารถฉีดวัคซีนป้องกันได้ซึ่งจะมีฤทธิ์ป้องกันโรคได้ถึง 10 ปีผู้ที่ได้รับวัคซีนแล้วจะได้สมุดเหลืองที่สามารถใช้เป็นหลักฐานการรับวัคซีน ดังนั้นหญิงตั้งครรภ์ควรหลีกเลี่ยงการเดินทางไปท่องเที่ยวในพื้นที่นั้นๆ แต่ถ้าหากไม่สามารถหลีกเลี่ยงได้ควรได้รับวัคซีนป้องกัน และกรณียังไม่ตั้งครรภ์แนะนำให้หลีกเลี่ยงการตั้งครรภ์อย่างน้อย 1 เดือนหลังเข้ารับการฉีดวัคซีน และหลังคลอดถ้าได้รับวัคซีนป้องกันไข้เหลืองควรงดการให้นมบุตร(27,28)
การป้องกันโรค สำหรับผู้ที่จะเดินทางไปประเทศที่เป็นเขตติดโรคไข้เหลืองควรฉีดวัคซีนป้องกันโรคล่วงหน้าก่อนออกเดินทาง 10 วัน และวัคซีนนี้จะให้ภูมิคุ้มกันได้นาน 10 ปี
วัคซีนป้องกันโรคโปลิโอ
แม้ว่ายังไม่มีผลกระทบที่ชัดเจนกับหญิงตั้งครรภ์หรือทารก แต่ตามทฤษฎีแล้วควรหลีกเลี่ยงการฉีดวัคซีน อย่างไรก็ตามโรคโปลิโอยังคงมีการระบาดอยู่ในประเทศกำลังพัฒนา เช่น อัฟกานิสถาน อินเดีย ปากีสถาน ไนจีเรียและแอฟริกา ดังนั้นหญิงตั้งครรภ์ควรหลีกเลี่ยงการเดินทางไปท่องเที่ยวในประเทศดังกล่าวหากเป็นไปได้
วัคซีนป้องกันโปลิโอเป็นวัคซีนเชื้อเป็น ให้โดยการรับประทานซึ่งพบว่าน้อยมากที่จะเกิดความเสี่ยงต่อการเป็นกล้ามเนื้อลีบ (paralytic poliomyelitis) หลังได้รับวัคซีน(29,30) ขณะนี้มีการผลิตวัคซีนโปลิโอจากเชื้อตาย (IVP) ได้แล้วที่ประเทศสหรัฐอเมริกา
วัคซีนป้องกันไข้ไทฟอยด์
ไข้ไทฟอยด์เกิดจากเชื้อ Salmonella Typhi โดยจะมีอาการไข้ต่ำช่วงแรก ตามด้วยอาการไข้สูง อ่อนแรง ปวดท้อง มักมีอาการท้องเสีย ปวดศีรษะ ไม่อยากรับประทานอาหารและอาจมีผื่นร่วมด้วย ติดต่อโดยการรับประทานอาหารหรือดื่มน้ำที่มีเชื้อ
ไข้ไทฟอยด์สามารถป้องกันได้โดยรับประทานอาการและดื่มน้ำที่สะอาด รวมถึงการได้รับวัคซีนป้องกันไข้ไทฟอยด์ วัคซีนป้องกันไข้ไทฟอยด์เป็นชนิดเชื้อเป็น(Ty21a) สามารถให้ในรูปของการรับประทาน ดังนั้นหญิงตั้งครรภ์ควรหลีกเลี่ยงไปท่องเที่ยวในถิ่นระบาด ขณะนี้ยังไม่มีข้อมูลรายงานการใช้วัคซีนขณะตั้งครรภ์
ขนาดที่ให้
- oral live-attenuated vaccine [vivotif] 1capsule on day 1,3,5 ก่อนอาหาร ให้ booster ทุก 5 ปี
- capsular polysaccharide vaccine ขนาด0.025 mg IM BOOSTER ทุก 2 ปี
วัคซีนป้องกันไข้ทรพิษ(smallpox)
ไม่แนะนำให้ให้ในหญิงตั้งครรภ์ในทุกอายุครรภ์ หรือวางแผนจะตั้งครรภ์ใน 1 เดือนหรือผู้ที่ให้นมบุตรเนื่องจากสามารถผ่านทางน้ำนมได้ วัคซีนนี้ผลิตจากไวรัสเชื้อเป็น (vaccinia virus) ไม่ได้เป็นสารที่ก่อให้เกิดความพิการ และทาง CDC ไม่แนะนำให้ใช้ vaccinia immune globulin (VIG) เพื่อป้องกันหรือลดความเสี่ยงต่อการเกิดโรคไข้ทรพิษในทารกด้วย(31,32)
วัคซีนป้องกันไข้ทรพิษระหว่างตั้งครรภ์ยังไม่มีคำอธิบายชัดเจนว่าสัมพันธ์กับการคลอดก่อนกำหนด เด็กมีน้ำหนักตัวน้อย หรือความผิดปกติตั้งแต่กำเนิด ดังนั้นจึงไม่ใช่ข้อบ่งชี้เพื่อยุติการตั้งครรภ์
วัคซีนป้องกันโรคพิษสุนัขบ้า (Rabies)
การตั้งครรภ์ไม่ได้เป็นข้อห้ามในการฉีดวัคซีนป้องกันโรคพิษสุนัขบ้าหลังสัมผัสเชื้อ(33,34) มีการศึกษาเมื่อเร็วๆนี้พบว่าไม่ได้เพิ่มอุบัติการณ์ของการแท้ง การคลอดก่อนกำหนดหรือพิการของทารกหลังจากมารดาได้รับการฉีดวัคซีน และไม่ใช้ข้อบ่งชี้ในการยุติการตั้งครรภ์
วัคซีนป้องกันโรคแอนแทรกซ์( Anthrax)
ไม่แนะนำให้ให้ในประชากรทั่วไป หรือในกลุ่มที่มีความเสี่ยงต่ำต่อการสัมผัสหรือสูดหายใจเอาเชื้อ B. anthracis เข้าไป ควรยืดเวลารับวัคซีนออกไปจนกว่าจะคลอดบุตรแล้ว(35) แต่ถ้ามีความเสี่ยงสูงก็อาจพิจารณาให้เป็น AVA ฉีดใต้ผิวหนัง 3 เข็มที่ 0,2 และ 4 สัปดาห์ ตามด้วยให้ยาต้านเชื้อต่ออีก 60 วัน
- Ciprofloxacin 500 mg ครั้งละ 1 เม็ด 2 เวลา
- Amoxycillin 500 mg ทุก 8 ชั่วโมง
- Doxycyclin 100 mg ครั้งละ 1 เม็ด 2 เวลา (แต่อาจมีผลต่อเด็กเช่น กดการเจริญของกระดูก เคลือบฟันโดนทำลาย ฟันเปลี่ยนสี) เป็นข้อบ่งชี้ในการใช้เฉพาะในหญิงตั้งครรภ์ที่ติดเชื้อ และมีอันตรายต่อชีวิตบางรายเท่านั้น
การเสริมสร้างภูมิคุ้มกันหลังคลอดบุตร
ข้อบ่งชี้ในการรับวัคซีนในหญิงหลังคลอดบุตรเหมือนกับประชากรทั่วไป สามารถให้ได้ทั้งวัคซีนจากเชื้อตายและวัคซีนจากเชื้อเป็น (ยกเว้นวัคซีนป้องกันไข้ทรพิษ) วัคซีนที่แนะนำให้ให้ก่อนออกจากโรงพยาบาลเพื่อป้องกันมารดาและทารก ได้แก่
- MMR
- Varicella ที่ 0,4 และ 8 สัปดาห์ สามารถให้ได้ในหญิงให้นมบุตร (36)
- Tdap ควรให้ในรายที่ยังไม่เคยได้รับมาก่อน
Immunoglobulins
สามารถให้เพื่อป้องกันหรือลดความรุนแรงของโรค แม้ว่ายังไม่ทราบความเสี่ยงต่อทารกจากการได้รับ passive immunization จากมารดาที่ได้ฉีด immunoglobulin ขณะตั้งครรภ์
ข้อสรุปและคำแนะนำ
- สำหรับหญิงที่ไม่ได้ตั้งครรภ์ที่วางแผนว่าจะมีบุตร ควรฉีดวัคซีนอย่างน้อย 1 เดือนก่อนตั้งครรภ์
- สำหรับผู้ที่มีความเสี่ยงต่อการติดเชื้อไวรัสตับอักเสบเอหรือบี , ปอดอักเสบหรือไข้สมองอักเสบ ก็ควรได้รับวัคซีนป้องกันไว้ด้วย
- การตรวจการตั้งครรภ์ในผู้หญิงทุกรายที่อยู่ในวัยเจริญพันธุ์ก่อนเข้ารับการฉีดวัคซีนนั้น ไม่จำเป็น
- ในฤดูที่มีการแพร่ระบาดของไข้หวัดใหญ่ซึ่งเป็นความเสี่ยงต่อหญิงตั้งครรภ์ แนะนำให้หญิงตั้งครรภ์ทุกคนเข้ารับการฉีดวัคซีน และภูมิคุ้มกันในมารดามีประโยชน์เนื่องจากสามารถส่งผ่านไปให้ทารกได้และสร้างภูมิคุ้มให้ในช่วง 2-3 เดือนแรกหลังคลอดด้วย
- หญิงตั้งครรภ์ควรหลีกเลี่ยงการเดินทางไปในถิ่นระบาดของโรค รับประทานอาหารที่ถูกสุขอนามัย ดื่มน้ำสะอาดหรือน้ำต้มสุกเป็นต้น
- เมื่อปรากฏว่าตั้งครรภ์หลังจากได้รับวัคซีนชนิดเชื้อเป็นภายใน 1 เดือน (MMR หรือ yellow fever vaccine) ไม่ได้เป็นข้อบ่งชี้ในการยุติการตั้งครรภ์ และยังไม่มีข้อพิสูจน์ว่าทำให้เกิดความผิดปกติในตัวอ่อน
- MMR และวัคซีนป้องกันอีสุกอีใส สามารถให้ได้อย่างปลอดภัยหลังคลอด หรือในหญิงที่ให้นมบุตร เนื่องจากเชื้อไวรัสไม่สามารถผ่านทางน้ำนมได้
- แนะนำให้ฉีดวัคซีนป้องกันบาดทะยัก คอตีบและไอกรน (Tdap) ในหญิงตั้งครรภ์ทุกราย โดยช่วงระยะเวลาที่ให้คือหลังอายุครรภ์ 20 สัปดาห์ไป เพื่อช่วยลดความเสี่ยงในการติดเชื้อไอกรนในมารดาซึ่งสามารถติดต่อสู่ลูกได้ รกสามารถส่งผ่าน antibody ของมารดา เพื่อช่วยเสริมสร้างภูมิคุ้มกันให้กับทารกจากโรคไอกรนได้ในช่วง 2-6 เดือนด้วย
CDC Guideline for vaccinating pregnant women (October2012)
Reference
- Englund JA. The influence of maternal immunization on infant immune responses. J Comp Pathol 2007; 137 Suppl 1:S16.
- Gonik B, Fasano N, Foster S. The obstetrician-gynecologist’s role in adult immunization. Am J Obstet Gynecol 2002; 187:984.
- Pickering LK, Baker CJ, Freed GL, et al. Immunization programs for infants, children, adolescents, and adults: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2009; 49:817.
- Leddy MA, Anderson BL, Power ML, et al. Changes in and current status of obstetrician-gynecologists’ knowledge, attitudes, and practice regarding immunization. Obstet Gynecol Surv 2009; 64:823.
- Akinsanya-Beysolow I, Wolfe CS. Update: Vaccines for women, adolescence through adulthood. J Womens Health (Larchmt) 2009; 18:1101.
- Watson JC, Hadler SC, Dykewicz CA, et al. Measles, mumps, and rubella–vaccine use and strategies for elimination of measles, rubella, and congenital rubella syndrome and control of mumps: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 1998; 47:1.
- Siegel M, Fuerst HT. Low birth weight and maternal virus diseases. A prospective study of rubella, measles, mumps, chickenpox, and hepatitis. JAMA 1966; 197:680.
- St Geme JW Jr, Noren GR, Adams P Jr. Proposed embryopathic relation between mumps virus and primary endocardial fibroelastosis. N Engl J Med 1966; 275:339.
- Landes RD, Bass JW, Millunchick EW, Oetgen WJ. Neonatal rubella following postpartum maternal immunization. J Pediatr 1980; 97:465
- Pastuszak AL, Levy M, Schick B, et al. Outcome after maternal varicella infection in the first 20 weeks of pregnancy. N Engl J Med 1994; 330:901.
- www.merck.com/product/usa/pi_circulars/z/zostavax/zostavax_pi.pdf (Accessed on October 01, 2007).
- www.cdc.gov/nip/recs/provisional_recs/zoster-11-20-06.pdf (Accessed on October 01, 2007).
- Håberg SE, Trogstad L, Gunnes N, et al. Risk of Fetal Death after Pandemic Influenza Virus Infection or Vaccination. N Engl J Med 2013.
- Tamma PD, Ault KA, del Rio C, et al. Safety of influenza vaccination during pregnancy. Am J Obstet Gynecol 2009; 201:547.
- Moro PL, Broder K, Zheteyeva Y, et al. Adverse events in pregnant women following administration of trivalent inactivated influenza vaccine and live attenuated influenza vaccine in the Vaccine Adverse Event Reporting System, 1990-2009. Am J Obstet Gynecol 2011; 204:146.e1.
- Moro PL, Broder K, Zheteyeva Y, et al. Adverse events following administration to pregnant women of influenza A (H1N1) 2009 monovalent vaccine reported to the Vaccine Adverse Event Reporting System. Am J Obstet Gynecol 2011; 205:473.e1.
- Pasternak B, Svanström H, Mølgaard-Nielsen D, et al. Vaccination against pandemic A/H1N1 2009 influenza in pregnancy and risk of fetal death: cohort study in Denmark. BMJ 2012; 344:e2794.
- Pasternak B, Svanström H, Mølgaard-Nielsen D, et al. Risk of adverse fetal outcomes following administration of a pandemic influenza A(H1N1) vaccine during pregnancy. JAMA 2012; 308:165.
- Munoz FM, Greisinger AJ, Wehmanen OA, et al. Safety of influenza vaccination during pregnancy. Am J Obstet Gynecol 2005; 192:1098.
- Pool V, Iskander J. Safety of influenza vaccination during pregnancy. Am J Obstet Gynecol 2006; 194:1200; author reply 1201.
- MacDonald NE, Riley LE, Steinhoff MC. Influenza immunization in pregnancy. Obstet Gynecol 2009; 114:365.
- McDuffie RS Jr, Bader T. Fetal meconium peritonitis after maternal hepatitis A. Am J Obstet Gynecol 1999; 180:1031.
- Leikin E, Lysikiewicz A, Garry D, Tejani N. Intrauterine transmission of hepatitis A virus. Obstet Gynecol 1996; 88:690.
- Chaithongwongwatthana S, Yamasmit W, Limpongsanurak S, et al. Pneumococcal vaccination during pregnancy for preventing infant infection. Cochrane Database Syst Rev 2012; 7:CD004903.
- Nasidi A, Monath TP, Vandenberg J, et al. Yellow fever vaccination and pregnancy: a four-year prospective study. Trans R Soc Trop Med Hyg 1993; 87:337.
- Suzano CE, Amaral E, Sato HK, et al. The effects of yellow fever immunization (17DD) inadvertently used in early pregnancy during a mass campaign in Brazil. Vaccine 2006; 24:1421.
- Centers for Disease Control and Prevention (CDC). Recommendations of the Advisory Committee on Immunization Practices: revised recommendations for routine poliomyelitis vaccination. MMWR Morb Mortal Wkly Rep 1999; 48:590.
- Garde V, Harper D, Fairchok MP. Tertiary contact vaccinia in a breastfeeding infant. JAMA 2004; 291:725.
- Cono J, Casey CG, Bell DM, Centers for Disease Control and Prevention. Smallpox vaccination and adverse reactions. Guidance for clinicians. MMWR Recomm Rep 2003; 52:1.
- Napolitano PG, Ryan MA, Grabenstein JD. Pregnancy discovered after smallpox vaccination: Is vaccinia immune globulin appropriate? Am J Obstet Gynecol 2004; 191:1863.
- The role of BCG vaccine in the prevention and control of tuberculosis in the United States. A joint statement by the Advisory Council for the Elimination of Tuberculosis and the Advisory Committee on Immunization Practices. MMWR Recomm Rep 1996; 45:1.
- Marin M, Güris D, Chaves SS, et al. Prevention of varicella: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2007; 56:1.
- Pavelka R, Salzer H, Reinold E. [Post partum rubella vaccination and anti-D prevention]. Zentralbl Gynakol 1978; 100:1025.
- www.cdc.gov/vaccines/pubs/preg-guide.htm#1 (Accessed on October 01, 2007).
- Edgar WM, Hambling MH. Rubella vaccination and anti-D immunoglobulin administration in the puerperium. Br J Obstet Gynaecol 1977; 84:754.
- Marin M, Güris D, Chaves SS, et al. Prevention of varicella: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 2007; 56:1.