Fetal growth restriction ภาวะทารกโตช้าในครรภ์
Fetal growth restriction
ภาวะทารกโตช้าในครรภ์
แพทย์หญิงปิ่นนภา เตอะอ้าย
อาจารย์ที่ปรึกษา อาจารย์แพทย์หญิงศิรินาถ ศิริเลิศ
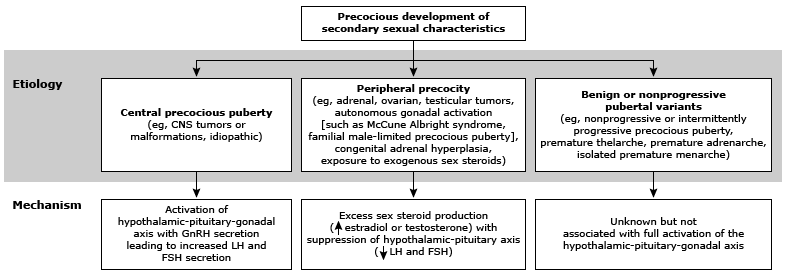
ทารกโตช้าในครรภ์ หรือ fetal growth restriction (FGR) เป็นภาวะแทรกซ้อนหนึ่งของการตั้งครรภ์ พบได้ประมาณร้อยละ 10 ของการตั้งครรภ์ (1) โดยภาวะดังกล่าวส่งผลเสียต่อการเจริญเติบโต การทำงานของระบบต่าง ๆ โดยเฉพาะระบบประสาท และเพิ่มอัตราการตายปริกำเนิดขึ้นเป็น 2 เท่าหรือเสียชีวิตร้อยละ 1.5 หากทารกมีน้ำหนักน้อยกว่าเปอร์เซ็นไทล์ที่ 10 และเพิ่มขึ้นเป็นร้อยละ 2.5 หากทารกน้ำหนักน้อยกว่าเปอร์เซ็นไทล์ที่ 5 ของอายุครรภ์นั้น ๆ (2) นอกจากนี้ในระยะยาวจะเพิ่มโอกาสการเกิดโรคทางเมตาบอลิก เช่น โรคเบาหวาน โรคอ้วน โรคหลอดเลือดหัวใจโคโรนารี และโรคหลอดเลือดสมอง (1)
การเจริญเติบโตของทารกในครรภ์ประเมินได้จากขนาดของทารกเทียบกับอายุครรภ์ โดยจะใช้คลื่นเสียงความถี่สูง (ultrasound) มาช่วยในการประเมินว่าขนาดและน้ำหนักของทารก (estimated fetal weight) เป็นไปตามเกณฑ์ปกติของอายุครรภ์หรือไม่ โดยใช้การวัดพารามิเตอร์ของทารก (biometric parameters) ได้แก่ ความกว้างของศีรษะ (BPD; biparietal diameter) เส้นรอบวงของศีรษะ (HC; head circumference) เส้นรอบวงของท้อง (AC; abdominal circumference) และความยาวของกระดูกต้นขา (FL; femur length) โดยสมาคมเวชศาสตร์มารดาและทารก (SMFM: The Society for Maternal-Fetal Medicine) แนะนำการใช้ข้อมูลอ้างอิงขนาดและน้ำหนักของทารกในครรภ์ตามกลุ่มประชากร (population-based fetal growth references ) ในการประเมินเปรียบเทียบ (3)
การวินิจฉัยภาวะทารกโตช้าในครรภ์ เบื้องต้นจะวินิจฉัยจากน้ำหนักของทารก ซึ่งคำนวณจากการวัดพารามิเตอร์ด้วยคลื่นเสียงความถี่สูง ได้ค่าน้อยกว่าเปอร์เซ็นไทล์ที่ 10 ของอายุครรภ์นั้น ๆ เมื่อตรวจพบน้ำหนักของทารกน้อยกว่าเปอร์เซ็นไทล์ที่ 10 สิ่งแรกที่ต้องจำแนก คือน้ำหนักตัวหรือขนาดที่น้อยของทารกเป็นภาวะโตช้าในครรภ์จริง หรือเป็นเพียงทารกตัวเล็ก (small for gestational age; SGA) เนื่องจากหากเป็นเพียงทารกตัวเล็กจะไม่มีผลกระทบต่ออัตราการเจริญเติบโตและไม่เพิ่มอัตราการเสียชีวิตในครรภ์ รวมถึงไม่ส่งผลกระทบระยะยาวต่อการพัฒนาของทารกหลังคลอด โดยเกณฑ์การวินิจฉัยมีดังนี้
เกณฑ์การวินิจฉัยภาวะทารกตัวเล็กและภาวะทารกโตช้าในครรภ์จาก The American College of Obstetricians and Gynecologists (ACOG) (2)
- ทารกตัวเล็ก (SGA) คือ ทารกที่มีน้ำหนักแรกคลอด (birth weight) น้อยกว่าเปอร์เซ็นไทล์ที่ 10 สำหรับอายุครรภ์นั้น ๆ
- ทารกโตช้าในครรภ์ (FGR) คือ ทารกที่มีน้ำหนัก หรือเส้นรอบวงของท้องน้อยกว่าเปอร์เซ็นไทล์ที่ 10 สำหรับอายุครรภ์นั้น ๆ
เกณฑ์การวินิจฉัยภาวะทารกตัวเล็กและภาวะทารกโตช้าในครรภ์จาก The International Society of Ultrasound in Obstetrics and Gynecology (ISUOG) (1)
- ทารกตัวเล็ก (SGA) คือ ทารกที่มีน้ำหนัก หรือเส้นรอบวงของท้องน้อยกว่าเปอร์เซ็นไทล์ที่ 10 สำหรับอายุครรภ์นั้น ๆ โดยไม่เพิ่มอัตราการตายปริกำเนิด
- ทารกโตช้าในครรภ์ (FGR) คือทารกที่มีน้ำหนักน้อยและเพิ่มอัตราการตายปริกำเนิด ดังนั้นการวินิจฉัยสำหรับภาวะนี้ทาง ISUOG กล่าวว่าไม่สามารถใช้น้ำหนักของทารกเพียงอย่างเดียวมาใช้ในการวินิจฉัย โดยแนะนำการวัดค่าดอปเพลอร์ (Doppler velocimetry) ที่ใช้สำหรับประเมินการไหลเวียนของเลือดจากรกมายังทารก (uteroplacental or fetoplacental circulation) มาช่วยในการวินิจฉัยเพื่อจำแนกภาวะทารกตัวเล็กและภาวะทารกโตช้าในครรภ์ ดังแสดงในตารางที่ 1
ตารางที่ 1 แสดงเกณฑ์การวินิจฉัยภาวะทารกตัวเล็กและภาวะทารกโตช้าในครรภ์จาก ISUOG (1)
|
SGA |
Early FGR อายุครรภ์ < 32 สัปดาห์ และไม่มีความผิดปกติแต่กำเนิดของทารก (congenital anomalies) |
Late FGR อายุครรภ์ ≥ 32 สัปดาห์ และไม่มีความผิดปกติแต่กำเนิดของทารก |
|
AC หรือ EFW < 10th centile
|
AC หรือ EFW < 3rd centile หรือ UA-AEDF หรือ 1. AC หรือ EFW < 10th centile ร่วมกับ 2. UtA-PI > 95th centile และ/หรือ 3. UA-PI > 95th centile |
AC หรือ EFW < 3rd centile หรือ อย่างน้อย 2 ใน 3 ของข้อต่อไปนี้ 1. AC หรือ EFW < 10th centile 2. AC หรือ EFW crossing centiles > 2 quartiles on growth centiles 3. CPR < 5th centile หรือ UA-PI > 95th centile |
AEDF: (absent end-diastolic flow); CPR: (cerebroplacental ratio); EFW: (estimated fetal weight); PI: (pulsatility index); UA: (umbilical artery); UtA: (uterine artery)
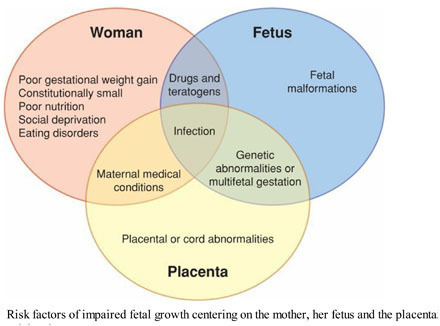
สาเหตุของการเกิดภาวะทารกโตช้าในครรภ์ แบ่งได้เป็น 3 กลุ่ม คือ สาเหตุจากมารดา สาเหตุจากทารก และสาเหตุจากรกและสายสะดือ โดยส่วนใหญ่ไม่ว่าจะเกิดทารกโตช้าในครรภ์จากสาเหตุใดจะส่งผลให้เข้าสู่กลไกร่วมคือทำให้การไหลเวียนเลือดจากแม่ไปสู่ลูกไม่เพียงพอ ส่งผลให้ทารกในครรภ์ได้รับเลือดและสารอาหารไม่เพียงพอต่อการเจริญเติบโต (2) โดยสาเหตุหลักมีดังนี้
• สาเหตุจากมารดา (maternal disorder) (2)
- โรคประจำตัวของมารดา เช่น โรคเบาหวาน โรคไตวาย โรคแพ้ภูมิตัวเอง (systemic lupus erythematosus) โรคหัวใจชนิดเขียว เป็นต้น โดยส่วนใหญ่จะเป็นโรคเรื้อรังที่ส่งผลต่อความผิดปกติของเส้นเลือด
- โรคความดันโลหิตสูงขณะตั้งครรภ์ (pregnancy induced hypertension)
- กลุ่มอาการต้านฟอสโฟลิพิด (antiphospholipid syndrome) และการแข็งตัวของเลือดมากผิดปกติ เช่น acquired immune meditated thrombophilia แต่กลุ่ม hereditary thrombophilia ไม่พบความสัมพันธ์ที่ชัดเจนกับภาวะทารกโตช้าในครรภ์
- ภาวะขาดสารอาหารในมารดา (malnutrition) โดยเฉพาะหากได้รับแคลอรี <600-900 kcal/day
- การใช้สารเสพติด เช่น บุหรี่ แอลกอฮอล์ โคเคน หรือยากลุ่มระงับปวด โดยมีรายงานว่าการสูบบุหรี่ในสตรีตั้งครรภ์เพิ่มการเกิดภาวะทารกโตช้าในครรภ์ได้ถึง 3.5 เท่าเมื่อเทียบกับมารดาที่ไม่สูบบุหรี่
• สาเหตุจากทารก (fetal disorder) (2)
o ครรภ์แฝด (multiple pregnancy) โดยครรภ์แฝดสอง (twin) จะมีโอกาสเกิดภาวะทารกโตช้าในครรภ์ประมาณร้อยละ 25 สำหรับครรภ์แฝดสาม (triplet) และครรภ์แฝดสี่ (quadruplet) จะมีโอกาสเกิดภาวะทารกโตช้าในครรภ์สูงถึงร้อยละ 60
- การได้รับสารก่อวิรูป (teratogen) เช่น cyclophosphamide, valproic acid, warfarin เป็นต้น ทั้งนี้ความสัมพันธ์ของสารดังกล่าวกับการเกิดภาวะทารกโตช้าในครรภ์ขึ้นอยู่กับความสามารถในการก่อวิรูป (teratogenicity) ของสารแต่ละชนิด ระยะเวลาที่สตรีตั้งครรภ์สัมผัสสาร รวมถึงอัตราการเผาผลาญสารต่าง ๆ ของแต่ละบุคคล
- โรคติดเชื้อ เช่น malaria, cytomegalovirus, rubella, toxoplasmosis หรือ syphilis
- ความผิดปกติทางพันธุกรรม เช่น trisomy 13, trisomy 18, confined placental mosaicism
- ความผิดปกติทางโครงสร้าง เช่น congenital heart disease หรือ gastroschisis
• สาเหตุจากรกและสายสะดือ (placental disorders and umbilical cord abnormalities) (2)
- ระบบการไหลเวียนของเลือดของรกผิดปกติ (placental insufficiency) ถือเป็นสาเหตุที่พบมากที่สุด
- ความผิดปกติของรก เช่น abruption, infarction, circumvallate shape, hemangioma, และ chorioangioma
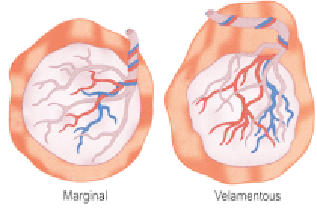
- ความผิดปกติของสายสะดือ เช่น velamentous หรือ marginal cord insertion
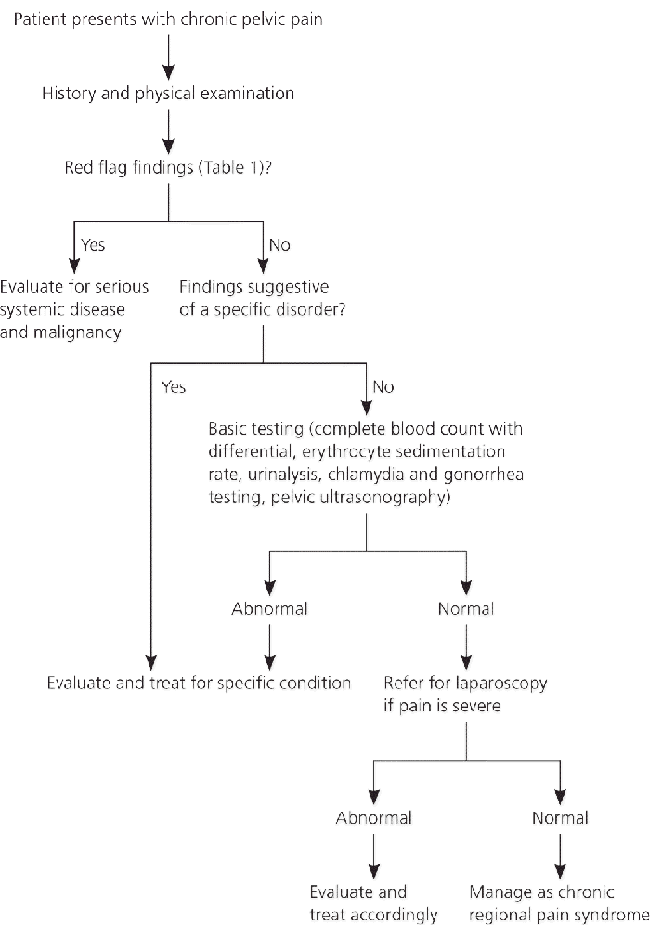
ภาพที่ 1 แสดง circumvallate placenta (4)
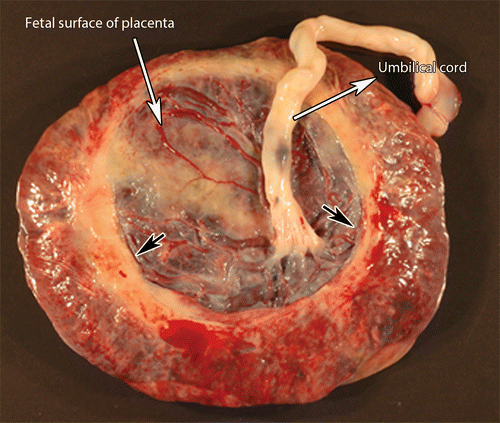
ภาพที่ 2 แสดง marginal and velamentous cord insertion (5)
การประเมินภาวะทารกโตช้าในครรภ์
• ซักประวัติตรวจร่างกาย
สำหรับการซักประวัติมารดาที่พบภาวะทารกโตช้าในครรภ์ สิ่งแรกที่ต้องคำนึงถึงคือ อายุครรภ์ว่าถูกต้องหรือไม่ ลักษณะตัวเล็กของทารกเป็นภาวะปกติตามพันธุกรรมหรือเชื้อชาติหรือไม่ มีปัจจัยที่เกี่ยวข้องกับการเติบโตช้าของทารกอะไรบ้าง เช่น พฤติกรรมการสูบบุรี่ ดื่มแอลกอฮอล์ การใช้สารเสพติด หรือการได้รับสารพวกก่อวิรูป รวมถึงประวัติการติดเชื้อในช่วงการตั้งครรภ์ของมารดา เพื่อนำมาช่วยในการวินิจฉัยและวิเคราะห์หาสาเหตุที่เป็นไปได้
สำหรับการตรวจร่างกาย ACOG 2021 (2) แนะนำใช้การวัดความสูงของยอดมดลูก (fundal height) เป็นตัวคัดกรองภาวะโตช้าในครรภ์ของทารก ซึ่งหากความสูงของยอดมดลูกกับอายุครรภ์ต่างกันมากกว่า 3 เซนติเมตร ควรสงสัยภาวะโตช้าในครรภ์และตรวจเพิ่มเติมด้วยการตรวจคลื่นเสียงความถี่สูง โดยจากรายงานพบว่าการวัดความสูงของยอดมดลูกในช่วงอายุครรภ์ 24-38 สัปดาห์ มีความไว (sensitivity) ร้อยละ 65-85 และความจำเพาะ (specificity) ร้อยละ 96 สำหรับการคัดกรองดังกล่าว แต่ในมารดาที่มีภาวะอ้วน ครรภ์แฝด หรือมีเนื้องอกมดลูก (leiomyoma) จะลดความน่าเชื่อถือและความแม่นยำของการวัดความสูงของยอดมดลูกนั้น แนะนำใช้การตรวจด้วยคลื่นความถี่สูงมาช่วยในการประเมินและคัดกรองเพื่อความแม่นยำที่มากขึ้น
• การประเมินด้วยคลื่นเสียงความถี่สูง (ultrasound)
o การวัด biometric parameters ของทารก
- ความกว้างของศีรษะ (BPD; biparietal diameter)
- เส้นรอบวงของศีรษะ (HC; head circumference)
- เส้นรอบวงของท้อง (AC; abdominal circumference)
- ความยาวของกระดูกต้นขา (FL; femur length)
เพื่อประเมินขนาดและน้ำหนักของทารกว่าอยู่ในเกณฑ์ปกติตามอายุครรภ์หรือไม่ รวมถึงใช้ติดตามอัตราการเจริญเติบโตของทารก
สิ่งที่แนะนำให้ประเมินร่วมด้วย มีดังนี้
- การประเมินน้ำคร่ำ (amniotic fluid assessment)
- การประเมินความผิดปกติทางกายภาพของทารก (fetal structural abnormality)
- การประเมินสุขภาพทารก (BPP; biophysical profile)
- การประเมิน Doppler velocity
Umbilical artery
เป็นเครื่องมือที่ใช้ในการประเมินและติดตามสุขภาพของทารก (fetal surveillance) ที่มีภาวะโตช้าในครรภ์ โดยการประเมิน umbilical artery Doppler velocity ถือว่าเป็นการตรวจเดียวที่มีรายงานจากการศึกษาของ PORTO (9) ว่าสามารถช่วยลดผลลัพธ์การตั้งครรภ์ที่ไม่พึงประสงค์ในทารก (adverse perinatal outcome) จากภาวะโตช้าในครรภ์ได้ ไม่ว่าจะเป็น ภาวะเลือดออกในสมอง (intraventricular hemorrhage) ภาวะสมองขาดออกซิเจน (hypoxic ischemic encephalopathy) ภาวะลำไส้เน่าตาย (necrotizing enterocolitis) โรคปอดเรื้อรัง (bronchopulmonary dysplasia) ภาวะติดเชื้อในกระแสเลือด (sepsis) และการเสียชีวิตของทารก เป็นต้น
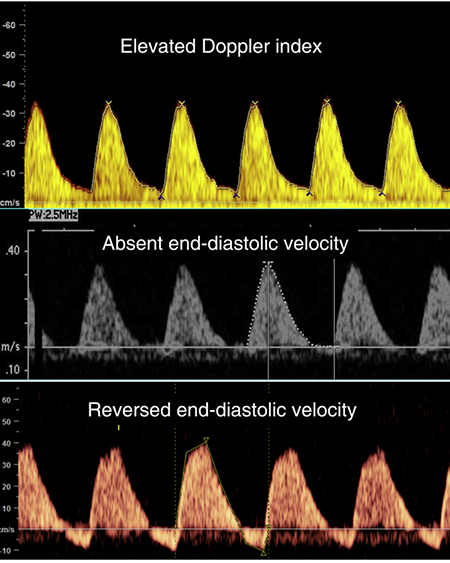
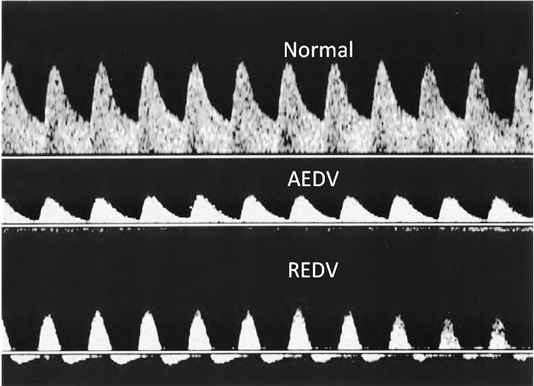
ความผิดปกติของ umbilical artery Doppler velocity ที่ตรวจพบได้แก่ pulsatility index (PI) >95th centile, absent end-diastolic flow (AEDV) และ reversed end-diastolic flow (REDV) ซึ่งแสดงถึงการมีแรงต้านในรก (placental resistance) หรือมีแรงต้านในเส้นเลือด umbilical artery (umbilical artery resistance) จากภาวะ placental insufficiency ที่เป็นสาเหตุของทารกโตช้าในครรภ์
ภาพที่ 3 แสดงความผิดปกติของ umbilical artery doppler velocity ในภาวะ placental insufficiency (10)
Ductus venosus
Ductus venosus เป็นตัวบอกสภาวะการไหลเวียนเลือดของทารก (hemodynamic status) ในภาวะปกติระบบไหลเวียนเลือดดำของทารก จะไหลไปข้างหน้าเพียงอย่างเดียว โดย ductus venosus จะนำเลือดที่มีออกซิเจนและสารอาหารมายังหัวใจทารก แต่เมื่อมีภาวะทารกโตช้าในครรภ์ร่วมกับมี umbilical artery pressure ที่สูงมากกว่าปกติ ส่งผลให้การไหลเวียนเลือดผ่านหัวใจทารกแย่ลง central venous pressure จึงเพิ่มขึ้น ทำให้ ductus venosus มีความดันภายในที่เพิ่มขึ้นเช่นกัน แสดงให้เห็นในรูปแบบ absent หรือ reversed ductus venous a-wave ซึ่งความผิดปกติที่พบมักจะพบในช่วงท้ายก่อนทารกจะเสียชีวิต นอกจากนั้นยังมีรายงานว่าการพบลักษณะดังกล่าวสัมพันธ์กับภาวะขาดออกซิเจน และเลือดเป็นกรดของทารก รวมถึงเพิ่มอัตราการเสียชีวิตของทารก (stillbirth) ร้อยละ 46 (3) ตามคำแนะนำของ ISUOG ใช้การวัดค่าดอปเพลอร์ของ ductus venosus ตรวจติดตามในรายที่มีภาวะทารกโตช้าในครรภ์ที่ได้รับการวินิจฉัยก่อนอายุครรภ์ 32 สัปดาห์ (early FGR) และใช้เป็นเกณฑ์ในการพิจารณาการคลอด พบว่าสามารถลดความผิดปกติของการพัฒนาทางระบบประสาทของทารกที่อายุ 2 ปีได้ เมื่อเทียบกับการติดตามทารกด้วยเครื่องติดตามการเต้นของหัวใจทารก (CTG) เพียงอย่างเดียว
ภาพที่ 4 แสดง ductus venosus Doppler (10)
Middle cerebral artery
การประเมิน middle cerebral artery Doppler สามารถบอกถึงสภาวะการไหลเวียนเลือดของทารกได้ กล่าวคือในภาวะปกติการไหลเวียนเลือดใน middle cerebral arteryของทารกจะมีแรงต้านในหลอดเลือดที่สูงกว่า umbilical artery แต่เมื่อมีภาวะโตช้าในครรภ์และภาวะขาดออกซิเจน จะเกิดการขยายตัวของหลอดเลือดสมอง (cerebral vasodilation) เพื่อเพิ่มการไหลเวียนของเลือดมายังสมองมากขึ้นชดเชยภาวะขาดออกซิเจน เรียกปรากฏการณ์นี้ว่า “brain sparing effect” (3) ซึ่งจะทำให้แรงต้านใน middle cerebral artery ต่ำกว่า umbilical artery
การประเมินจะดูจาก peak systolic to end diastolic blood flow velocity ratio (S/D), resistance index และ pulsatility index แต่ยังไม่มีรายงานว่าสามารถใช้ middle cerebral artery Doppler ในการตัดสินใจเรื่องกำหนดเวลาการคลอดของทารกโตช้าในครรภ์ เพียงนำมาช่วยประกอบการประเมินภาวะขาดออกซิเจนและผลลัพธ์ที่ไม่พึงประสงค์ของทารกร่วมกับการประเมิน umbilical artery Doppler เท่านั้น
ภาพที่ 5 แสดง middle cerebral artery Doppler ในทารกปกติ และในภาวะ placental insufficiency (10)
Cerebroplacental ratio (CPR)
คำนวณมาจากสัดส่วนของ pulsatility index ของ middle cerebral artery เทียบกับ umbilical artery (MCA-PI / UA-PI) เป็นค่าที่บ่งบอกว่ามีภาวะ fetal blood flow redistribution หรือเกิด brain sparing effect โดยจากการศึกษาของ PORTO (9) พบว่า CPR < 1 สัมพันธ์กับผลลัพธ์ที่ไม่พึงประสงค์ของทารก และพบว่ามีการพัฒนาของระบบประสาทและพัฒนาการที่แย่กว่าเมื่อเทียบกับกลุ่มที่มีค่า CPR สูง
Uterine artery (3)
ใช้ประเมินการไหลเวียนเลือดเข้าสู่มดลูก เป็นสิ่งที่ใช่ประเมินการ remodelling ของ spiral artery ซึ่งในภาวะปกติการไหลเวียนเลือดในเส้นเลือดนี้จะมีอัตราเร็วที่สูง และไหลอย่างต่อเนื่องไปด้านหน้า (continuous forward flow) หากมีความผิดปกติจะพบความต้านทานที่สูงขึ้น ค่า pulsatility index (PI) >95th percentile หรือพบลักษณะ diastolic notch ซึ่งสัมพันธ์กับผลลัพธ์การตั้งครรภ์ที่ไม่พึงประสงค์ต่าง ๆ
• การส่งตรวจเพิ่มเติม
o Genetic counselling and prenatal diagnostic test
ให้แนะนำเกี่ยวกับโรคทางพันธุกรรม และความคุ้มค่าของการตรวจสารพันธุกรรมของทารก โดย karyotyping และ chromosomal microarray analysis ซึ่งควรพิจารณาตรวจในกรณีดังต่อไปนี้
- วินิจฉัยภาวะทารกโตช้าในครรภ์ก่อนอายุครรภ์ 32 สัปดาห์ (early FGR)
- วินิจฉัยภาวะทารกโตช้าในครรภ์ร่วมกับตรวจพบภาวะน้ำคร่ำเยอะผิดปกติ (polyhydramnios)
- วินิจฉัยภาวะทารกโตช้าในครรภ์ร่วมกับตรวจพบความผิดปกติทางโครงสร้างของทารก
o Screening of infection
- แนะนำตรวจ PCR สำหรับหาการติดเชื้อ CMV ในกรณีที่ไม่สามารถอธิบายการเกิดทารกโตช้าในครรภ์ได้ โดยจะแนะนำตรวจจาก amniocentesis เนื่องจากการตรวจทาง serology สำหรับ CMV ยังมีการใช้ที่จำกัด
- ไม่แนะนำตรวจคัดกรองการติดเชื้อ toxoplasmosis, rubella, หรือ herpes ในมารดาที่ไม่มีประวัติปัจจัยเสี่ยงของการติดเชื้อและไม่พบความผิดปกติทางกายภาพของทารกจากการตรวจด้วยคลื่นความถี่สูง
การดูแลสตรีตั้งครรภ์ที่มีภาวะทารกโตช้าในช่วงก่อนคลอด (Antepartum care)
• การป้องกันการเกิดภาวะโตช้าในครรภ์
จากข้อมูลในปัจจุบัน ยังไม่มีการดูแลที่มีหลักฐานยืนยันว่าสามารถป้องกันการเกิดทารกโตช้าในครรภ์ ไม่ว่าจะเป็นการนอนพัก (bed rest) จำกัดการทำกิจกรรมต่างๆ หรือการเพิ่มสารอาหาร (nutritional and dietary supplement) สำหรับการใช้ยากลุ่ม low dose aspirin, low molecular weight heparin (LMWH) และ sildenafil ก็ยังไม่พบหลักฐานว่าสามารถช่วยเพิ่มการไหลเวียนเลือดของรก ดังนั้น SMFM 2020 จึงไม่แนะนำการใช้ยาเหล่านี้ในมารดาที่มีภาวะทารกโตช้าในครรภ์(3)
• การตรวจด้วยคลื่นเสียงความถี่สูง
การตรวจคัดกรองภาวะทารกโตช้าในครรภ์สามารถทำได้โดยการวัดความสูงของยอดมดลูก หากพบว่าความสูงของยอดมดลูกน้อยกว่าอายุครรภ์มากกว่า 3 เซนติเมตร ควรได้รับการตรวจด้วยคลื่นเสียงความถี่สูงเพิ่มเติม เพื่อหาสาเหตุของขนาดมดลูกที่เล็กกว่าอายุครรภ์ เช่น น้ำคร่ำน้อย ทารกโตช้าในครรภ์ หากพบมีภาวะทารกโตช้าในครรภ์ ควรตรวจดูปริมาณน้ำคร่ำแล Doppler เพื่อนำมาช่วยในการดูแลและวางแผนการคลอดของทารก นอกจากนั้นหากวินิจฉัยก่อนอายุครรภ์ 32 สัปดาห์ ควรตรวจดูความผิดปกติทางกายภาพของทารกโดยละเอียด เนื่องจากพบว่าภาวะนี้สัมพันธ์กับความผิดปกติทางกายภาพของทารกและสารพันธุกรรม
• การตรวจติดตามการเจริญเติบโตของทารก (follow up growth)
แนะนำตรวจติดตามการเจริญเติบโตของทารกด้วยคลื่นเสียงความถี่สูงอย่างน้อยทุก 3-4 สัปดาห์ แต่หากพบว่ามีภาวะทารกโตช้าในครรภ์ที่รุนแรงมากหรือพบว่ามีความผิดปกติของ umbilical artery Doppler สามารถเพิ่มความถี่ในการตรวจได้ทุก 2 สัปดาห์
• การตรวจประเมินสุขภาพทารก (fetal monitor and surveillance)
ในปัจจุบันพบว่าการประเมินสุขภาพทารกด้วยการตรวจ cardiotocography (CTG) และการตรวจ umbilical artery Doppler สามารถช่วยลดผลลัพธ์การตั้งครรภ์ที่ไม่พึงประสงค์และลดความผิดปกติของการพัฒนาระบบประสาทและการเจริญเติบโตของทารกหลังคลอดที่อายุ 2 ปี (6) ดังนั้น SMFM 2020 จึงแนะนำดังนี้
- กรณีพบการลดลงของ end-diastolic velocity ใน umbilical artery Doppler ที่มากกว่าเปอร์เซนไทล์ที่ 95 หรือพบทารกโตช้าที่รุนแรง (น้ำหนักน้อยกว่าเปอร์เซนไทล์ที่ 3) ควร ตรวจ CTG 1-2 ครั้งต่อสัปดาห์ และประเมิน umbilical artery Doppler ทุกสัปดาห์
- กรณีพบ AEDV ใน umbilical artery Doppler ควรตรวจ CTG 2 ครั้งต่อสัปดาห์ และประเมิน umbilical artery Doppler 2-3 ครั้งต่อสัปดาห์
- กรณีพบ REDV ใน umbilical artery Doppler แนะนำนอนโรงพยาบาล ควรตรวจ CTG 1-2 ครั้งต่อวัน และพิจารณาการคลอดของทารก
การประเมินสุขภาพทารกด้วย biophysical profile (BPP) หากพบความผิดปกติ มักจะเป็นอาการที่แสดงออกมาในช่วงท้ายของโรค โดยจะพบความผิดปกตินี้ประมาณ 48-72 ชั่วโมงหลังพบความผิดปกติของ ductus venosus Doppler และจากรายงานของ Cochrane review ยังไม่มีหลักฐานที่สนับสนุนการนำ BPP มาใช้ในการตรวจติดตามสุขภาพทารกแบบ routine เนื่องจากพบ false positive และ false negative ค่อนข้างมาก แต่มักใช้ร่วมประเมินทารกเมื่อพบความผิดปกติของ CTG หรือ umbilical artery Doppler หรือใช้ในกรณีที่บางสถานพยาบาลไม่มีเครื่อง CTG
อายุครรภ์ที่แนะนำให้คลอดสำหรับสตรีตั้งครรภ์ภาวะทารกโตช้าในครรภ์ (timing of delivery)
การดูแลทารกโตช้าในครรภ์ควรได้รับการดูแลในโรงพยาบาลที่มีความพร้อมในระดับตติยภูมิ (tertiary care) ต้องมีความพร้อมของสูติแพทย์ กุมารแพทย์ มีห้องอภิบาลทารกแรกเกิด (NICU; neonatal intensive care unit) สำหรับการพิจารณาเวลาที่เหมาะสมในการคลอดของทารกโตช้าในครรภ์ SMFM และ ACOG มีคำแนะนำดังนี้ (2,3)
- อายุครรภ์ 26 สัปดาห์ หรือน้ำหนักทารก 500 กรัม สำหรับ severe early-onset FGR แต่ทั้งนี้ทั้งนั้นต้องพิจารณาความพร้อมของทีมรักษา และต้องผ่านการพูดคุยถึงผลลัพธ์การตั้งครรภ์ที่ไม่พึงประสงค์ที่อาจเกิดขึ้นกับมารดา เพื่อพูดคุยถึงแนวทางการดูแล
- อายุครรภ์ 38-39 สัปดาห์ สำหรับทารกที่มีน้ำหนักอยู่ในช่วงเปอร์เซ็นไทล์ที่ 3-10 โดยที่ไม่พบความผิดปกติของ umbilical artery Doppler
- อายุครรภ์ 37 สัปดาห์ สำหรับทารกที่มีน้ำหนักน้อยกว่าเปอร์เซ็นไทล์ที่ 3 หรือ ทารกโตช้าที่ตรวจพบความผิดปกติ umbilical artery S/D ratio มากกว่าเปอร์เซ็นไทล์ที่ 95
- อายุครรภ์ 33-34 สัปดาห์ สำหรับทารกที่ตรวจพบ AEDV ใน umbilical artery Doppler
- อายุครรภ์ 30-32 สัปดาห์ สำหรับทารกที่ตรวจพบ REDV ใน umbilical artery Doppler
- อายุครรภ์ 34-37 6/7 สัปดาห์ สำหรับทารกที่ตรวจพบภาวะน้ำคร่ำน้อย (oligohydramnios) หรือโรคร่วมของมารดา เช่น ครรภ์เป็นพิษ ความดันโลหิตสูงเป็นต้น
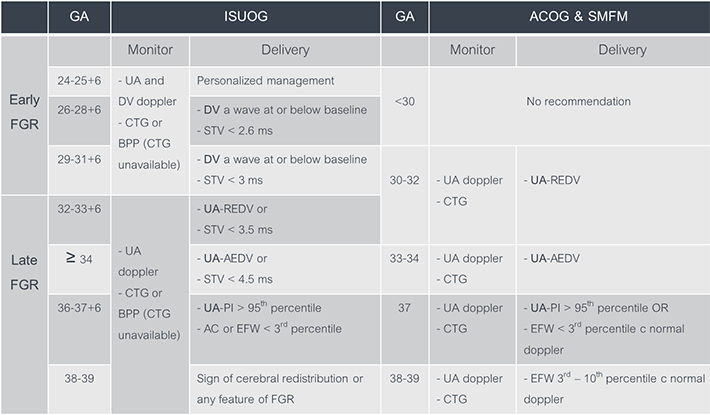
คำแนะนำจากองค์กรต่างๆ ในการดูแลสตรีตั้งครรภ์ที่มีภาวะทารกโตช้าในครรภ์ยังมีความแตกต่างกัน โดยเฉพาะส่วนของการตรวจติดตามสุขภาพทารกในครรภ์และอายุครรภ์ที่แนะนำให้คลอด ดังแสดงในตารางที่ 2 ดังนั้นการนำไปใช้จึงควรปรับให้เข้ากับบริบทอย่างเหมาะสม
ตารางที่ 2 แสดงการเปรียบเทียบการตรวจติดตามและการพิจารณาคลอดของภาวะทารกโตช้าในครรภ์ตามคำแนะนำของ ISUOG และ ACOG & SMFM (1,2,3)
การดูแลสตรีตั้งครรภ์ที่มีภาวะทารกโตช้าในช่วงระยะคลอด (Intrapartum care)
- ควรได้รับการดูแลจากสหสาขาวิชาชีพได้แก่ สูติแพทย์ สูติแพทย์เฉพาะทางเวชศาสตร์มารดาและทารก กุมารแพทย์เฉพาะทางสาขาทารกแรกเกิด
- ควรได้รับการติดตามดูลักษณะการเต้นของหัวใจทารกอย่างต่อเนื่อง (continuous fetal monitor) เพื่อเฝ้าระวังภาวะเครียดของทารก (fetal distress)
- การให้ antenatal corticosteroid (2)
มีประโยชน์และควรให้ในกรณีที่จะคลอดก่อนอายุครรภ์ 33 6/7 สัปดาห์ สำหรับในช่วงอายุครรภ์ 34 0/7 สัปดาห์ถึง 36 6/7 สัปดาห์ กรณีที่มีความเสี่ยงจะคลอดใน 7 วัน และไม่เคยได้รับ corticosteroid มาก่อน พิจารณาให้ได้หากประโยชน์มากกว่าความเสี่ยงที่จะเกิดขึ้นจากการได้รับยา - การให้ magnesium sulfate (2)
พิจารณาให้ในกรณีที่จะคลอดก่อนอายุครรภ์ 32 สัปดาห์ เพื่อหวังผลการป้องกันภาวะแทรกซ้อนทางระบบประสาท (neuroprotection) ในทารก - ช่องทางการคลอด (route of delivery)
ปัจจุบันข้อมูลยังมีจำกัดสำหรับการแนะนำช่องทางการคลอดที่เหมาะสมที่สุดสำหรับทารกโตช้าในครรภ์ การพิจารณาอาศัยสุขภาพทารกระหว่างเข้าสู่กระบวนการคลอดร่วมด้วย ซึ่งอาจพบการเต้นของหัวใจทารกผิดปกติที่แสดงถึงการขาดออกซิเจนในช่วงระยะคลอด และตามมาด้วยการผ่าตัดคลอด โดยเฉพาะในรายที่ตรวจพบความผิดปกติแบบ AEDV หรือ REDV ใน umbilical artery Doppler โดยทาง SMFM 2020 (3) ได้แนะนำให้การผ่าตัดคลอดในกรณีทารกโตช้าในครรภ์ที่พบความผิดปกติของ umbilical artery Doppler โดยพิจารณาร่วมกับบริบทอื่น ๆ ณ ขณะนั้น
ภาวะทารกโตช้าในครรภ์สามารถคลอดทางช่องคลอดได้และไม่เป็นข้อบ่งห้ามในการชักนำการคลอด จากการศึกษาของ DIGITAT (7) ที่ศึกษาการชักนำการคลอดของทารกที่โตช้าในครรภ์อายุครรภ์ 36 -41สัปดาห์ พบว่าไม่มีความสัมพันธ์กับการเพิ่มโอกาสการผ่าตัดคลอดเมื่อเทียบกับกลุ่มที่ไม่ชักนำคลอด (expectant group) และสามารถคลอดทางช่องคลอดได้สำเร็จถึงร้อยละ 85 ทั้งกลุ่มที่ได้รับการชักนำคลอดและไม่ได้รับการชักนำคลอด ดังนั้นในการกำหนดช่องทางการคลอดที่เหมาะสมควรได้รับการพิจารณาเป็นราย ๆ ตามบริบทของมารดาและทารกในครรภ์
ภาพที่ 6 แสดงแผนผังแนวทางการวินิจฉัยและการดูแลทารกโตช้าในครรภ์ (3)
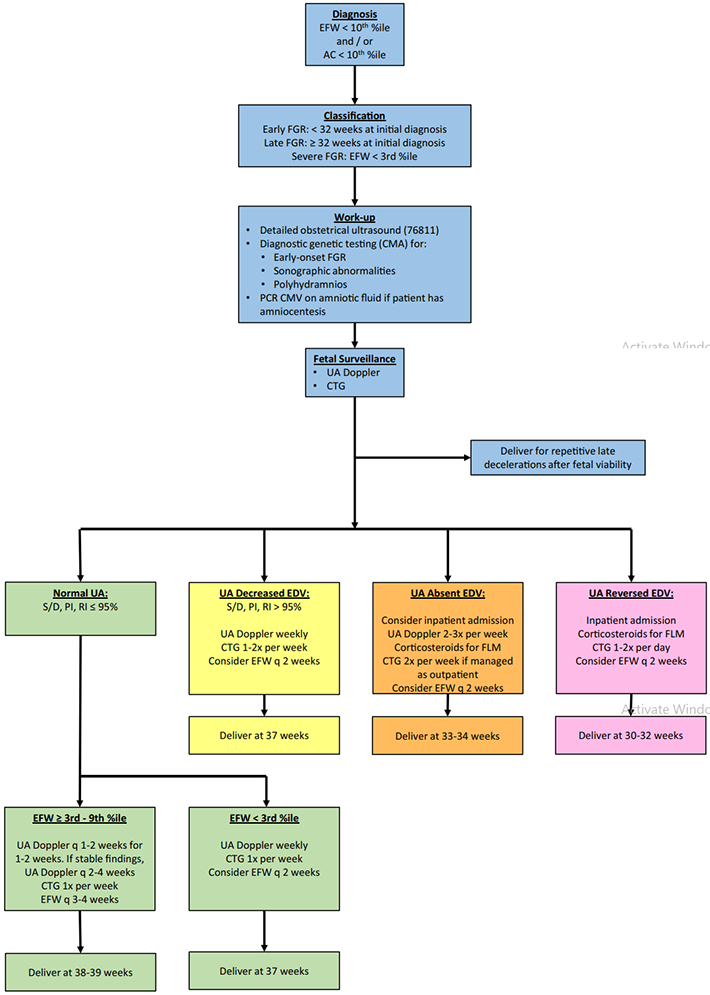
ภาวะทารกโตช้าในครรภ์ส่งผลเสียต่อการตั้งครรภ์ที่ เพิ่มโอกาสเสียชีวิตและพัฒนาการที่ผิดปกติในช่วงหลังคลอด เพิ่มโอกาสเกิดโรคเรื้องรังในวัยผู้ใหญ่ การดูแลรักษาภาวะนี้ จึงมุ่งเน้นการวินิจฉัยให้ได้อย่างรวดเร็ว (early diagnosis) การติดตามสุขภาพทารกที่มีประสิทธิภาพ และการกำหนดเวลาการคลอดที่เหมาะสม เพื่อผลลัพธ์ที่ดี
เอกสารอ้างอิง
- ISUOG Practice Guidelines: diagnosis and management of small-for-gestational-age fetus and fetal growth restriction. Ultrasound Obstet Gynecol 2020; 56: 298–312
- Fetal Growth Restriction. ACOG Practice Bulletin Number 227. the American College of Obstetricians and Gynecologists. vol. 137, no. 2, February 2021
- Juliana Gevaerd Martins, MD. Society for Maternal-Fetal Medicine Consult Series #52: Diagnosis and management of fetal growth restriction. Society for Maternal-Fetal Medicine (SMFM), October 2020
- Shaimaa Fadl, MD. Placental Imaging: Normal Appearance with Review of Pathologic Findings. radiographics.rsna.org. May-June, 2017
- Fox H, Sebire NJ. Pathology of the placenta. 3rd ed. Philadelphia, PA: W.B. Saunders; 2007
- G. H. A. VISSER. Fetal monitoring indications for delivery and 2-year outcome in 310 infants with fetal growth restriction delivered before 32 weeks’ gestation in the TRUFFLE study. Ultrasound Obstet Gynecol 2017; 50: 347–352
- Kim E Boers. Disproportionate Intrauterine Growth Intervention Trial At Term: DIGITAT. BMC Pregnancy and Childbirth 2007, 7:12
- Dawn-Marie Walker. The Growth Restriction Intervention Trial: long-term outcomes in a randomized trial of timing of delivery in fetal growth restriction. American Journal of Obstetrics & Gynecology; JANUARY 2011, 34e1-9
- Julia Unterscheider. Optimizing the definition of intrauterine growth restriction: the multicenter prospective PORTO Study. Am J Obstet Gynecol 2013;208:290.e1-6.
- Ahmet A. Baschat. Examination of the fetal cardiovascular system. Seminars in Fetal & Neonatal Medicine 16;2011, 2e12