Postoperative care in gynecologic patient
การดูแลผู้ป่วยหลังการผ่าตัดทางนรีเวชวิทยา:
Postoperative care in gynecologic patient
ปาจรีย์ เรือนเป็ง / อ.กิตติภัต เจริญขวัญ
การดูแลผู้ป่วยภายหลังการผ่าตัดทางนรีเวช เพื่อเป็นการป้องกันการเกิดภาวะแทรกซ้อนหลังผ่าตัด โดยภาวะแทรกซ้อนหลังผ่าตัดเป็นปัจจัยสำคัญที่สามารถบ่งบอกถึงผลการผ่าตัดในระยะสั้นได้ การลดอุบัติการณ์การเกิดภาวะแทรกซ้อนสามารถทำได้โดยการเตรียมตัวผู้ป่วยก่อนผ่าตัด เช่น การประเมิณความเสี่ยงการเกิด VTE และให้ prophylaxis การประเมิณโภชนาการและเสริมโภชนาการก่อนการผ่าตัดช่วยเพิ่มประสิทธิภาพในเรื่องการสมานแผล ลดrecovery time และ hospital stay
IMMEDIATE POSTOPERATIVE CARE
คำสั่งการรักษาหลังผ่าตัดมุ่งเน้นประเมิณในเรื่องสัญญาณชีพ การดูแลระบบหายใจ การระงับปวด อาหาร และ lab investigation การประเมิณสัญญาณชีพควรทำอย่างใกล้ชิดในช่วงหลังผ่าตัดทันที ที่ห้องพักฟื้นผู้ป่วยหลังผ่าตัด ความถี่ของการตรวจวัดสัญญาณชีพขึ้นกับความซับซ้อนของการผ่าตัดและสัญญาณชีพของผู้ป่วย ซึ่งการเปลี่ยนแปลงในสัญญาณชีพของผู้ป่วย ต้องมีการดูแลอย่างใกล้ชิดระหว่างแพทย์วิสัญญีและแพทย์ผู้ผ่าตัด
การบันทึกสัญญาณชีพระหว่างการผ่าตัดสามารถช่วยในการประเมิณภาวะการขาดน้ำและ การให้สารน้ำ รวมถึงประเมินปัสสาวะระหว่างการผ่าตัดได้อย่างแม่นยำ
การระงับความเจ็บปวด Pain Control
การระงับความเจ็บปวดหลังผ่าตัด พิจารณาเหมือนการรักษาผู้ป่วยหลังผ่าตัดทั่วไป ผู้ป่วยที่มีโรคประจำตัวเกี่ยวความ pain syndrome หรือมีประวัติการใช้ยาระงับอาการปวดในกลุ่ม opiods มักมีปัญหาการใช้ยาระงับความเจ็บปวดหลังผ่าตัดแบบ opioid group ไม่ได้ผล อย่างไรก็ตาม ระดับความเจ็บปวดของผู้ป่วยแต่ละคนก็แตกต่างกันได้แม้ได้รับหัตถการหรือการผ่าตัดแบบเดียวกัน ปัจจัยที่มีผลการระดับความเจ็บปวด เช่น ระยะเวลาในการผ่าตัด ชนิดของการลงแผล การใช้เครื่องมือถ่างขยายในการผ่าตัด การผ่าตัดแบบ minimal invasive surgery เป็นต้น
กลไกการเกิดอาการเจ็บปวดหลังการผ่าตัดบริเวณอวัยวะอุ้งเชิงกราน อธิบายได้จากการรับสัญญาณจาก pain receptor ผ่าน splanchnic afferent fibers ไปยัง CNS ผ่านไขสันหลัง ก้านสมอง ไปสู่สมองใหญ่ นอกจากนั้น ยังมีการตอบสนองต่อการกระตุ้น pain receptor ผ่าน anterior horn ของ spinal cord ทำให้เกิด skeletal muscle spasm, vasospasm, และ Gastrointestinal ileus ร่างกายตอบสนองต่อการกระตุ้นโดยการ มีการเปลี่ยนแปลงของค่าความดัน ระบบการหายใจ และระบบต่อมไร้ท่อ มีการเปลี่ยนแปลงของระบบอารมณ์ รู้สึกกลัวและกังวล ซึ่งเป็นผลมาจาก cortical response ทั้งสิ้น
การบรรเทาความเจ็บปวดหลังการผ่าตัดจะใช้การรักษาแบบ multimodal option โดยมี opioid และ non-opioid based-medication
Nonopioid treatment options
การใช้ Acetaminophen และ nonsteroid anti-inflammatory drugs (NSAIDs) ร่วมกับการระงับการปวดโดย opioid use สามารถลดระดับความเจ็บปวด ปริมาณการใช้ narcotic drug และลดอุบัติการณ์การเกิดอาการคลื่นไส้อาเจียนหลังผ่าตัดลงถึง 30% การใช้ Acetaminophen ปริมาณมาก อาจส่งผลต่อตับ จึงไม่ควรใช้เกิน 4,000 mg/d และ NSAIDs ขับออกทางไต จึงควรระมัดระวังการใช้ในผู้ป่วยที่มีโรคประจำตัวเป็นโรคไตหรือมีปัญหาเรื่องไตอยู่
Opioid treatment options
Opioid ที่มักใช้ในการระงับปวดในการผ่าตัดทางนรีเวชวิทยา ได้แก่ morphine, hydromorphone, and fentanyl
| ตารางที่ 1 oral and parenteral narcotic and Nonopioid analgesics for treatment of pain | |||||
| Generic name | Route | Starting dose (Mg) | Equianalgesic dosing (mg) | Duration (h) | Half-life (h) |
| Narcotic analgesic | |||||
| Morphine | IV/IM | 10 | 3-4 | 1.5-2 | |
| PO | 30 | 8-12 | |||
| Hydromorphone | IV/IM | 1.3-1.5 | 3-4 | 2-3 | |
| PO | 7.5 | ||||
| Fentanyl | IM | 0,1 | 0.5-1 | 2-4 | |
| Hydrocodone | PO | 5-10 | 30 | 4-5 | 2-3 |
| Oxycodone | PO | 5-10 | 15-30 | 3-6 | 4-5 |
| Nonopioid analgesics | |||||
| Acetaminophen | PO/IV | 100-325 ng q4-h (max 4,000 mg/24h) | 2-4 | ||
| Ibuprofen | PO/IV | 400-600 ng q6h (2,400mg/24 h max) | 4-8 | 2-4 | |
| Naproxen Sodium | PO | 550 mg q 12h (max 1,100mg/24h) | 12 | 13 | |
Morphine เป็นยาระงับปวดกลุ่ม opioid ทีใช้บ่อยในทางนรีเวช ออกฤทธิ์ 20 นาที และอยู่ได้นาน 3-4 ชั่วโมง ส่งผลให้เกิดภาวะ Euphoria, กดการทำงานของระบบทางเดินหายใจ และลดการขยับตัวของลำไส้ ผลข้างเคียงที่พบได้บ่อยคือภาวะคัน ซึ่งสามารถรักษาด้วย antihistamine
Hydromorphone (Dilaudid) เป็น semisynthetic analogue ของ morphine สามารถให้ได้หลายทาง เช่น ทางปาก ฉีดเข้าทางกล้างเนื้อ ฉีดเข้าทางเส้นเลือด ให้ทางรูทวาร หรือ ฉีดใต้ผิวหนัง ออกฤทธิ์ภายใน 15 นาทีหลังฉีดเข้าทางเส้นเลือดดำ และออกฤทธิ์นาน 3-4 ชั่วโมง hydromorphone เหมาะสำหรับใช้เป็นทางเลือกใน patient-controlled-analgesia (PCA) ในผู้ป่วยที่แพ้ morphine
Fentanyl ออกฤทธิ์เร็วกว่าและออกฤทธิ์ได้สั้นกว่า ประมาณ 30-60 นาที
อาหาร Diet
ผู้ป่วยหลังผ่าตัดสามารถกลับมารับประทานอาหารและน้ำดื่มได้เร็วที่สุดเท่าที่เป็นไปได้ภายหลังการผ่าตัด clear liquid สามารถเริ่มได้ตั้งแต่ 2 ชั่วโมงหลังผ่าตัดหากผู้ป่วยตื่นดีและสามารถรับประทานและกลืนได้ ในผู้ป่วยส่วนมาก solid food สามารถเริ่มได้ไม่ควรช้ากว่าวันที่ 1 หลังจากวันผ่าตัด Cochrane review พบว่าการให้ Early feeding หลังจากการผ่าตัดทางนรีเวชพบว่าปลอดภัยโดยไม่เพิ่มภาวะคลื่นไส้อาเจียนหลังการผ่าตัด, ภาวะท้องอืด, หรือการต้องใส่ nasogastric tube หลังผ่าตัด
สารน้ำและเกลือแร่ Fluids and Electrolytes
การประเมิณการให้สารน้ำหลังผ่าตัดควรพิจารณาร่วมจากปริมาณเลือดที่เสียไปในระหว่างการผ่าตัด และ insensible loss ระหว่างการผ่าตัดและหลังผ่าตัด ongoing fluid loss เช่น สารน้ำที่มาจากสายระบาย การเกิด third space loss จากภาวะ tissue edema, ascites, และ ileus การประมาณสารน้ำที่ผู้ป่วยควรได้รับในแต่ละวันสำหรับการทดแทนสารน้ำที่เสียไปตามน้ำหนักของผู้ป่วย โดยพิจารณาให้ เป็น 30เท่าของน้ำหนักผู้ป่วย (เช่น ผู้หญิงหนัก 60 กิโลกรัม คิดเป็น 30×60=1800 ml ใน 24 ชั่วโมง) การมี insensible loss อื่นๆ เช่น ภาวะไข้ การหายใจเร็ว (hyperventilation) หรือการมีภาวะติดเชื้อในกระแสเลือด ลำไส้อุดตัน จะทำให้มีการเพิ่มความต้องการสารน้ำทดแทนที่มากขึ้น ดังนั้นควรมีการเฝ้าติดตามประเมิณสารน้ำในร่างกายของผู้ป่วยอย่างใกล้ชิดเพื่อบริหารการให้สารน้ำทดแทนกับผู้ป่วยอย่างเหมาะสม
หลังผ่าตัดวันแรกควรมีการประเมิณสัญญาชีพ สารน้ำในร่างกายอย่างใกล้ชิดทุก 4-6 ชั่วโมง โดยประเมิณปัสสาวะ การเต้นของหัวใจ และความดัน ในช่วงแรกของการ recovery จะมีการกักเก็บสารน้ำเนื่องจาก stress response หลังจากที่ผ่านช่วงแรกไป สารน้ำจะกลับเข้าสู่กระแสเลือด ณ เวลานี้ การให้สารน้ำทางเส้นเลือดดำอาจจะไม่มีความจำเป็นแล้ว โดยผู้ป่วยจะมีลักษณะอาการบวมลดลง ปัสสาวะออกมากขึ้น ดังนั้นจึงต้องระมัดระวังการใช้ diuretics ในผู้ป่วยหลังผ่าตัดมากขึ้น เนื่องจากมีความเสี่ยงการเกิด intravascular volume depletion
ชนิดของสารน้ำที่ให้ในผู้ป่วย พิจารณาจากโรคประจำตัว ชนิดของการผ่าตัด และ comorbidity อื่นๆร่วม โดยปกติ ในผู้ป่วยที่ไม่ได้มีโรคประจำตัวที่ซับซ้อน นิยมให้ dextrose-containing intravenous fluid การให้น้ำตาลเพื่อเสริมคาร์โบไฮเดรตอย่างเพียงพอป้องการการสลายของกล้ามเนื้อในร่างกายจาก hepatic glycogen เพื่อผลิต glucose ผ่านกระบวนการ gluconeogenesis ในเวลาที่ต้องการใช้พลังงานมากขึ้น โดย 100 กรัม ของ glucose จากภายนอกร่างกายก็เพียงพอต้องการป้องกันการสลายของ body lean mass ได้
| ตารางที่ 2 Composition of IV Fluids | |||||||
| (mosm/L) | Na+ (mEq/L) | Cl- (mEq/L) | K+ (mEq/L) | Ca++ (mEq/L) | Glucose (g/L) | pH | |
| Normal plasma | 290 | 140 | 103 | 4 | 2.2 | 0.7-1 | 7.4 |
| 0.9% NaCl | 308 | 154 | 154 | 5.5 | |||
| LRS | 270 | 130 | 109 | 5 | 2 | 6.5 | |
| 5%DN/2 | 415 | 77 | 77 | 0 | 0 | 50 | 4 |
INTERMEDIATE POSTOPERATIVE CARE
ภาวะเพ้อสับสนหลังผ่าตัด Postoperative delirium
ภาวะเพ้อสับส้นหลังผ่าตัดเป็นภาสะที่มีการเปลี่ยนแปลงของการรับรู้โดยมีลักษณะ Fluctuating disorientation, sensory disturbance, and decreased attention โดยอุบัติการณ์พบได้ประมาณ 10-25% ของผู้ป่วยนรีเวช โดยฉพาะอย่างยิ่งในผู้ป่วยสูงอายุ ปัจจัยเสี่ยงที่สำคัญคือความเจ็บปวดหลังผ่าตัด เมื่อผู้ป่วยมีความเจ็บปวดหลังผ่าตัด ส่งผลให้ลดการเคลื่อนไหวของร่างกายทำให้เกิด respiratory compromise เกิดภาวพ lung atelectasis เกิดภาวะ hypoxemia หรือการให้ narcotic drugs ก็ทำให้เกิด respiratory depress เช่นกัน ทำให้เลือดเป็นกรดมากขึ้นจาก hypoxemia ปัจจัยที่ส่งผลทำให้เกิดภาวะเพ้อสับสนได้มากขึ้น ดังแสดงในตารางที่ 3
| ตารางที่ 3 ปัจจัยเสี่ยงการเกิดภาวะเพ้อสับสนหลังผ่าตัด | |
| ปัจจัยภายใน Intrinsic factors | ปัจจัยภายนอก Extrinsic factors |
|
|
ที่มา: Adapted from Schenning KJ, Deiner SG. Postoperative delirium in patient. Anesthesiol Clin 2015;33(3):505-516.
เมื่อสงสัยภาวะเพ้อสับสนในผู้ป่วยหลังผ่าตัด ควรตรวจร่างกายและส่งตรวจทางห้องปฏิบัติการเพิ่มเติมเพื่อหาสาเหตุที่แก้ไขได้ หรือสาเหตุที่อาจเป็น potential life threatening ที่ต้องได้รับการรักษาโดยทันที เช่น ภาวการณ์ติดเชื้อในกระแสเลือด ภาวะซีด การขาดน้ำ ประวัติการใช้ยา ประวัติการหยุดแอลกอฮอล์ในระหว่างนอนโรงพยาบาล
การรักษาภาวะเพ้อสับสน อันดับแรกคือรักษาสาเหตุที่พบ เช่น การให้ยาปฏิชีวนะในผู้ป่วยที่ติดเชื้อ การให้เลือดในกรณีที่ผู้ป่วยซีด ผู้ป่วยสูงอายุอาจมีสาเหตุมาจาก sleep wake cycle disturbance การรักษาโดยให้ญาติมีส่วนร่วมอาจช่วยให้การรักษาได้ผลมากขึ้น เช่นการช่วยปรับเปลี่ยนสิ่งแวดล้อมของผู้ป่วย กระตุ้นกิจกรรมในช่วงเวลากลางวันและการจัดสิ่งแวดล้อมให้เหมาะสมต่อการนอนหลับในช่วงเวลากลางคืน ลดการรบกวนผู้ป่วยในช่วงเวลากลางคืน การรับประทานอาหารอย่างเป็นเวลาและการพูดคุยโดยเฉพาะการ orientation to Time, Place, Person จะช่วยกระตุ้นให้ภาวะเพ้อสับสนให้ดีขึ้น ยาที่นิยมให้ neuroleptic drugs เมื่อต้องการ sedation เช่น Haloperidol, atypical neuroleptic drugs เช่น olanzapine หรือ SSRI เช่น Trazodone
ภาวะแทรกซ้อนทางระบบหัวใจ Cardiac complication
ความดันโลหิตสูง Hypertensive disease
ผู้ป่วยที่มีภาวะความดันโลหิตสูงที่ควบคุมไม่ได้ตั้งแต่ก่อนผ่าตัด (หมายถึง ความดัน diatolic > 110 mmHg) มีแนวโน้มที่จะมีความดันที่ค่อนสูงและควบคุมยากหลังผ่าตัดเมื่อเทียบกับคนที่มีความดันที่ควบคุมได้ดี หลังผ่าตัด 24 ชั่วโมงแรก จะมีการลดลงอย่างรวดเร็วของ B-blocker และยาที่ออกฤทธิ์ CNS Sympatholytic ที่ใช้ในระหว่างการดมยาสลบ เช่น clonidine ซึ่งมีผลทำให้เกิด rebound hypertension ร่วมกับมีการทำงานของระบบประสาท sympathetic ที่เพิ่มขึ้นจากภาวะความเจ็บปวดหลังผ่าตัด หรือจากการหยุดการใช้แอลกอฮอล์อย่างกระทันหันในผู้ป่วย alcohol dependent ทั้งหมดจะส่งผลให้ผู้ป่วยมีความดันโลหิตที่เพิ่มสูงมากขึ้น ค่าความดันโลหิตที่กำหนดหลังผ่าตัด ไม่ควรเกิน 160/100 mmHg หลังสูงกว่านี้ อาจจำเป็นต้องได้รับยาลดความดันโลหิตเพื่อป้องกันการเกิดภาวะแทรกซ้อนจากความดันโลหิตสูง
โรคกล้ามเนื้อหัวใจขาดเลือด Myocardial infarction
โรคกล้ามเนื้อหัวใจขาดเลือดหลังผ่าตัดพบได้ไม่บ่อย แต่อุบัติการณ์จะเพิ่มสูงขึ้นถึง 37% ในผู้ป่วยที่มีประวัติ recently MI ใน 3 เดือน การลดลงของปริมาณ oxygen และการเพิ่มความต้องการ oxygen จะทำให้เกิดความเสี่ยงของการเกิด perioperative coronary ischemia เช่น การมีภาวะ hypotension จะทำให้ coronary perfusion ลดลง หรือการมี poor capacity เช่น ภาวะซีด การเพิ่มขึ้นของ afterload เช่น tachycardia จะทำให้มีความต้องการการใช้ oxygen เพิ่มขึ้น
ผู้ป่วยส่วนใหญ่ที่มี operative MI มักจะไม่ได้มาด้วยอาการ typical symptom เช่น เจ็บหน้าอก/แน่นหน้าอก เนื่องจากอาการเจ็บปวดมักถูกบดบังด้วย analgesic drugs อาการที่พบได้บ่อยคือ อาการหายใจเหนื่อยและหายใจเร็ว Electrocardiogram มักมีลักษณะไม่ typical ดังนั้น การส่งตรวจทางห้องปฏิบัติการอาจช่วยสนับสนุนการวินิจฉัยได้ CK isoenzyme (CK-MB) มักเพิ่มขึ้นใน 6 ชั่วโมงหลังเกิด MI, Cardiac troponin I และ Troponin-T มักขึ้นตามหลังและมีความ specific ต่อ MI การรักษาผู้ป่วยที่มีกล้ามเนื้อหัวใจขาดเลือดอาจรักษาต่างจากผู้ป่วยที่เป็น non-operative การรักษาหลักมุ่งเน้นที่การรักษาสาเหตุที่ทำให้เกิดภาวะ cardiac oxygen insufficiency เช่นการรักษาภาวะซีด ภาวะ hypotension และภาวะ arrhythmia เป็นต้น การดูแลผู้ป่วยที่ critical unit มีความจำเป็นเนื่องจากต้องมีการเฝ้าติดตามสัญญาณชีพ การทำงานของหัวใจอย่างใกล้ชิด
ภาวะแทรกซ้อนทางระบบทางเดินหายใจ Pulmonary complications
ภาวะแทรกซ้อนทางระบบทางเดินหายใจมีความสำคัญในการดูแลผู้ป่วยหลังผ่าตัดอย่างยิ่ง เนื่องจากเพิ่มทั้ง morbidity และ mortality กับผู้ป่วย ภาวะ atelectasis, pneumonia, thromboembolic disease พบได้บ่อยตามหลังการผ่าตัด การดมยาสลบส่งผลต่อการเปลี่ยนแปลงการทำงานระบบทางเดินหายใจ โดยลดการทำงานของระบบการตอบสนองทางระบบหายใจ ลักษณะการหายใจจะเป็นแบบ rhythmic, rapid, shallow pattern โดยไม่มีช่วง intermittent large breathe และ ยาสลบแบบฉีดทางเส้นเลือดดำส่งผลให้มีการหายใจแบบ slow and deep ฤทธิ์ของยาสลบจะถูกกำจัดส่วนใหญ่ผ่านทางปอด ดังนั้นการผ่าตัดที่เวลาดมยาสลบนาน จะสัมพันธ์กับระดับความเข้มข้นของยาดมสลบที่สะสมในร่างกาย เมื่อหลังผ่าตัดจึงอาจยังเหลือฤทธิ์ของยาดมสลบที่ยังส่งผลกดระบบการหายใจอยู่
ตารางที่ 4 แสดงผลของยาสลบที่ส่งผลต่อระบบหายใจ
|
การเปลี่ยนแปลงระบบทางเดินหายใจจากผลของยาดมสบบทำให้ลด vital capacity, functional residual capacity และ ทำให้มี pulmonary edema การเปลี่ยนแปลงจะเพิ่มมากขึ้นในผู้ป่วยที่น้ำหนักตัวเกินเกณฑ์, สูบบุหรี่ หรือผู้ป่วยที่มีโรคเกี่ยวกับทางเดินหายใจเดิม เป็นต้น การที่ Functional residual capacity ลดลงจากการเกิด shallow tidal breathing และไม่มี respiratory response ที่ทำให้เกิด large breathing ร่วมกับการ relaxation ของ diaphragm muscle จากการที่ phrenic nerve ถูกรบกวนซึ่งเป็นผลจากการผ่าตัดในช่องท้อง ส่งผลการเกิดภาวะ V-Q mismatch และ Hypoxemia
Atelectasis เป็นผลจากการที่ปอดไม่สามารถถ่างขยาย ทำให้ไม่มี gas อยู่ใน alveoli การวินิจฉัยภาวะ atelectasis จากลักษณะ impair oxygenation ร่วมกับการมีไข้มากกว่า 38 องศา และมีลักษณะที่อธิบายได้จากภาพถ่ายทางรังสี ภาวะ atelectasis ส่งผลให้มีการลดลงของ respiratory compliance เพิ่ม pulmonary vascular resistance ทำให้เกิด hypoxemia ซึ่งสามารถพบได้ตั้งแต่ 5 นาทีภายหลังการดมยาสลบ ความเสี่ยงต่อการเกิด atelectasis เช่น ผู้สูงอายุ, ภาวะน้ำหนักเกินเกณฑ์, การติดเชื้อภายในช่องท้อง, การดมยาสลบเป็นเวลานาน, การใส่ nasogastric tube และ การสูบบุหรี่ การป้องกันหรือช่วยให้ภาวะ atelectasis ดีขึ้น คือ การ deep breathing และ early mobilization การใช้อุปกรณ์ฝึกการหายใจ เช่น incentive spirometer จะช่วยให้มี redistribution ของก๊าซกลับเข้าสู่ alveoli จะทำได้มีประสิทธิภาพในผู้ป่วยที่ตื่นและให้ความร่วมมือได้ดี การงดสูบบุหรี่อย่างน้อย 6-8 สัปดาห์ จะช่วย Improve mucociliary clearance ในระบบทางเดินหายใจเพื่อช่วยขับ secretion ได้ดีขึ้น
Pulmonary edema เกิดจาก high hydrostatic pressure เช่น การเกิด Left side heart failure หรือการมี volume overload ซึ่งจะทำให้ narrow bronchi ซึ่งจะไปเพิ่ม pulmonary vascular resistance การมี pulmonary edema จะเพิ่มความเสี่ยงการเกิด infection ได้ หากภายหลังการผ่าตัด ผู้ป่วยมีลักษณะอาการของ sepsis ร่วมกับมีลักษณะของ pulmonary edema การมี infection อาจจะมีแหล่งที่มาจากในปอด ซึ่งการให้ adequate antibiotics และ fluid resuscitation อย่างเร็วจะช่วยให้อาการผู้ป่วยดีขึ้นได้
Pneumonia ภาวะปอดติดเชื้อในโรงพยาบาลส่งผลต่อ morbidity และ mortality โดยเชื้อที่พบบ่อยทีทำให้เกิด hospital-acquired pneumonia มักเป็นกลุ่ม aerobic gram-negative bacilli เช่น Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae และ Acinetobacter species การวินิจฉัยโดยการตรวจพบ new lung infiltrate ร่วมกับอาการแสดงของการติดเชื้อ เช่น ไข้มากกว่า 38 องศา, purulent sputum, leukocytosis, deoxygenation การรักษาโดยการให้ broad spectrum antibiotics ถ้ามีประวัติการสำลักหรือสงสัย aspiration pneumonia ยาปฏิชีวนะต้องครอบคลุมกลุ่ม anaerobes (metronidazole หรือ clindamycin) โดยยาปฏิชีวนะที่ให้ควรให้เป็นแบบฉีดก่อน โดยจะเปลี่ยนเป็นแบบ oral ในคนที่ตอบสนองต่อการรักษาและระบบทางเดินอาหารทำงานปกติแล้ว ระยะเวลาการให้ยาปฏิชีวนะพิจารณาจากการตอบสนองของผู้ป่วย ปกติระยะเวลา ประมาณ 7-8 วัน หากสงสัย anaerobes อาจให้นานถึง 14-15 วัน หลังจากให้ยาปฏิชีวนะ พิจารณาการตอบสนองภายใน 24-72 ชั่วโมง หากอาการไม่ดีขึ้นอาจต้องนึกถึง drug-resistant organism หรือภาวะแทรกซ้อนเช่น parapneumonic effusion หรือ empyema หรืออาจติดเชื้อที่บริเวณอื่น หรือเป็นจากสาเหตุอื่นที่ไม่ใช่การติดเชื้อ เช่น drug-fever, drug-induced lung injury
| ตารางที่ 6 แนวทางยาปฏิชีวนะในผู้ป่วยที่มีปอดติดเชื้อจากเชื้อในโรงพยาบาล Hospital-Acquired Pneumonia | |
| Beta-lactam/beta-lactamase inhibitor
Or 3rd-gen nonpseudomonal cephalosporin Or Fluoroquinolones |
Early-onset HAP < 5d |
| Antipseudomonal cephalosporin
Or Fluoroquinolone |
Late-onset HAP > 5 d |
| Beta-lactams
+ Aminogylcoside Or Quinolone |
Severe HAP with risk factor for
P.Aeruginosa ,GNB |
| Carbapenems
Or beta-lactam/beta-lactamase inhibitor |
Anaerobes |
| Vancomycin
Or Linezolid |
MRSA |
ที่มา adapted from Kalil AC, Metersky ML, et al. Management of adults with hospital-acquired and ventilator-associated pneumonia: 2-16 clinical practice guidelines by the Infectious Disease Society of Ameica and the American Thoracic Society. Clin infect Dis 2016;63(5):e61-e111; Di Pasquale M, Aliberti S, Mantero M, et al. Non-intensive care unit acquired pneumonia: a new clinical entity? Int J Mol Sci 2016;17(3):287
Respiratory Failure ปัจจัยเสี่ยง เช่น major upper abdominal operations, severe trauma, preexisting lung disease จะส่งผลให้เกิด respiratory failure อย่างรวดเร็ว (ภายใน 2 ชั่วโมง) การเกิด late postoperative respiratory failure (ภายหลัง 48 ชั่วโมงหลังผ่าตัด) มักถูกกระตุ้นด้วยเหตุการณ์หลังผ่าตัด เช่น การเกิด pulmonary embolism, abdominal distension หรือ opioid overdose อาการแสดงผู้ป่วยมักมีอาการหายใจเร็ว (25-30 ครั้งต่อนาที)และ low tidal volume อาจตรวจพบค่า PCO2 > 45 mmHg และ PO2 < 60 mmHg การรักษาเบื้องต้นคือการช่วยหายใจด้วย endotracheal intubation และ ventilatory support เพื่อให้เกิด adequate alveolar ventilation นอกจากนั้นต้องหาสาเหตุที่กระตุ้นให้เกิดภาวะ respiratory failure หรือภาวะแทรกซ้อนที่เกี่ยวข้องกับอาการ respiratory failure เช่น การเกิด atelectasis, pneumonia หรือ pneumothorax การป้องกันคือการเกิด respiratory failure คือการดูแลหลังการผ่าตัดอย่างใกล้ชิด เฝ้าระวังการเกิดภาวะ dehydration ในผู้ป่วยที่มีโรคทางระบบทางเดินหายใจอยู่เดิม
ภาวะแทรกซ้อนทางระบบทางเดินอาหาร Gastrointestinal complications
การผ่าตัดทางช่องท้องทำให้มีผลลดการทำงานของลำไส้ โดยกระบวนการ peristalsis จะกลับมาทำงานได้ตามปกติ 24 ชั่วโมงในลำไส้เล็ก 48 ชั่วโมงใน right colon และ 72 ชั่วโมงใน left colon
อาการคลื่นไส้อาเจียน พบได้บ่อยภายหลังผ่าตัด อุบัติการณ์ 30-70% โดยพบมากขึ้นในเพศหญิง, มีประวัติ motion sickness มาก่อน หรือเคยมีประวัติคลื่นไส้อาเจียนในการผ่าตัดก่อนหน้านี้ การรักษาอาการคลื่นไส้อาเจียนเน้นรักษาแบบประคับประครอง ร่วมกับกระตุ้น enhance recovery after surgery เช่น การใช้ opioid-sparing analgesic technique และการให้สารน้ำอย่างเพียงพอ ยารักษาอาการคลื่นไส้อาเจียน ดังตารางที่ 7
| ตารางที่ 7 antiemetic medications | |||
| ชื่อ | ชนิด | ขนาดยา | อื่นๆ |
| Diphenhydramine | Antihistamine | 25-50 mg po q 6h
25 mg IVIM q 6h |
|
| Hydroxyzine | Antihistamine | 25-100 mg PO/IM q 6h |
|
| Phenergan | Phenothiazine derivative | 12.5-25 mg PO/IV/IM q 6h |
|
| Metoclopramide | Dopamine agonist | 5-10 mg PO q 6h
10-20 mg IM q 6h |
|
| Ondansetron | Serotonin antagonist | 4-8 mg PO/IN/IV q6-12h | ผลข้างเคียงน้อย |
Ileus ภาวะลำไส้เคลื่อนตัวน้อย/อืด เกิดจากการที่ GI motility หยุดพักการทำงานไปชั่วคราว อาการสำคัญคือ คลื่นไส้ อาเจียน ท้องอืด ปวดท้อง ไม่ถ่ายไม่ผายลม และมีลมหรือสารน้ำค้างอยู่ในลำไส้ ไม่สามารถทานอาหารได้ กลไกการเกิดยังไม่เป็นที่ทราบแน่ชัด บางการศึกษาคาดว่าเกิดจาก กระบวนการอักเสบที่อาจเกิดการหลั่ง inflammatory mediators เช่น Nitric oxide ที่ส่งผลให้เกิด bowel ileus สาเหตุอื่นที่พบได้ เช่น electrolyte abnormality การกระตุ้นให้ผู้ป่วยมี early ambulation ช่วยป้องกันภาวะ ileus ได้ การศึกษาในการผ่าตัด colorectal พบว่า การเคี้ยวหมากฝรั่ง ช่วยลดระยะเวลาที่เริ่มผายลมได้ การผ่าตัดแบบ minimally invasive surgery และการบรรเทาความเจ็บปวดโดยใช้ opioid-sparring analgesic protocol ช่วยลดอุบัติการณ์ bowel ileus เช่นกัน การรักษา bowel ileus โดยการให้ IV Fluid replacement เพื่อทดแทนสารน้ำที่เสียไปและแก้ภาวะ electrolyte imbalance โดยการ conservative treatment ต้องควบคู่ไปกับการประเมินอาการอย่างใกล้ชิดเป็นระยะ
Small Bowel Obstruction ภาวะลำไส้อุดตัน หลังผ่าตัด หากเกิดภาวะ bowel obstruction ในช่วง 30 วันแรก มักสัมพันธ์กับ mechanical obstruction โดย 90% มักเกิดจาก inflammatory adhesion อาการอาจมีอาการคล้ายกับ bowel ileus ได้ ลักษณะที่สงสัยภาวะ bowel obstruction เช่น ปวดท้อง cramp ท้องอืดโต ถ่ายไม่ออก ซึ่งจะต้องแยกให้ได้ การส่งตรวจเอกซเรย์คอมพิวเตอร์อาจช่วยแยกการวินิจฉัยได้ การเกิด inflammation ที่บริเวณ bowel surface และ peritoneum ระหว่างการทำ surgical manipulation เกิดการหลั่ง inflammatory mediators ทำให้เกิดการสร้าง fibrinous adhesion ระหว่าง serosa และ peritoneal surface นอกจากนี้การเกิด Internal hernia พบเป็นสาเหตุของ bowel obstruction บ่อยเป็นอันดับที่สอง โดย internal hernia เกิดเมื่อมี gap หรือช่องว่างระหว่าง mesentery หรือ omentum แล้วมีส่วนของลำไส้ไหลยื่นเข้าไปในช่องนั้น เกิดเป็นจุดให้มีการอุดตันของลำไส้ การเกิดลำไส้อุดตันจาก internal hernia จำเป็นต้องได้รับการผ่าตัดแก้ไขก่อนที่ลำไส้จะเกิดภาวะ strangulation
| ตารางที่ 9 ตารางแสดงความแตกต่างของอาการแสดงระหว่าง ileus และ bowel obstruction | ||
| อาการแสดง | Bowel ileus | Bowel obstruction |
| ปวดท้อง | ไม่สุขสบายท้อง ท้องอืด แต่จะไม่ปวด cramp | ปวดท้องลักษณะ cramp และเป็นมากขึ้น |
| ระยะเวลาจากการผ่าตัด | มักเกิด 48-73 ชั่วโมงหลังผ่าตัด | มักเกิดช่วง 5-7 วันหลังผ่าตัด |
| คลื่นไส้ อาเจียน | มี | มี |
| Distension | มี | มี |
| Bowel sounds | ไม่พบ หรือ hypoactive | Borborygmi with peristaltic rushes, high pitched tinkles |
| ไข้ | พบได้ หากสัมพันธ์กับ peritonitis | พบได้หากมี bowel grangrene |
| Radiographic finding | Distended loops of bowel, gas in colon | Single or multiple loops of distended bowel with air-fluid levels |
| การรักษา | Conservative treatment | Conservative treatment
Surgical exploration |
การรักษาภาวะลำไส้อุดตันขึ้นกับความรุนแรงของการอุดตัน การส่งตรวจเอกซเรย์คอมพิวเตอร์สามารถช่วยระบุตำแหน่งที่อุดตันได้ ภาวะลำไส้อุดตันที่เป็นไม่รุนแรงสามารถ conservative treatment โดยการ decompression ด้วย NG tube และประเมินและให้สารน้ำทดแทดในร่างกายอย่างเหมาะสม การ conservative treatment ในผู้ป่วยทั่วไป ปกติแล้วประมาณ 2-5 วัน อาการผู้ป่วยจะค่อยๆดีขึ้น หากอาการไม่ดีขึ้น อาจพิจารณาส่งตรวจเอกซเรย์คอมพิวเตอร์ประเมินความรุนแรงอีกครั้ง
การพิจารณาให้ Total parenteral nutrition ปกติแล้วหลังการผ่าตัดทางนรีเวช ผู้ป่วยสามารถเริ่มทานอาหารได้อย่างเร็ววัน ดังนั้นในการผ่าตัดหรือในผู้ป่วยทั่วไปไม่มีความจำเป็นในการให้สารอาหารทางเส้นเลือดดำ แต่ผู้ป่วยที่มีภาวะขาดสารอาหารอยู่แล้ว หรือผู้ป่วยที่ต้องเริ่มทานอาหารช้า (มากกว่า 7 วันหลังผ่าตัด) อาจมีความจำเป็นต้องให้สารอาหารทางเส้นเลือดดำทดแทน ปกติในผู้ป่วยทางนรีเวช การเริ่มทานอาหารทางปากสัมพันธ์กับภาวะ less morbidity เหมาะสมกับผู้ป่วยที่ระบบทางเดินอาหารกลับมาทำงานได้แล้ว ในบางกรณีผู้ป่วยจำเป็นต้องได้รับ total parenteral nutrition เช่น ผู้ป่วยที่มีภาวะ bowel obstruction, prolonged ileus, short bowel syndrome, radiation enteritis, intra-abdominal abscess, pancreatitis, regional enteritis, และ enterocutaneous fistula เป็นต้น ซึ่งผู้ป่วยที่รับสารอาหารทางปากไม่ได้มากกว่า 7 วัน ควรได้รับสารอาหารทดแทนทางเส้นเลือดดำเพื่อให้ได้รับสารอาหารอย่างเพียงพอ โดยปกติปกติปริมาณสารอาหารที่พึ่งได้ต่อวัน พิจารณาจากเพศ อายุ น้ำหนัก รวมไปถึงโรคประจำตัว มาคำนวณแคลอรี่ที่ควรได้ต่อวัน โดยปกติปริมาณแคลอรี่ที่ควรได้เบื้องต้น คือ 25 กิโลแคลอรี่/กิโลกรัมน้ำหนัก/วัน โดยโปรตีนประมาณ 1-1.5 กรัม/กิโลกรัม/วัน โดยอาหารที่ให้ควรมีการผสมสารอาหารอื่นร่วมด้วย เช่น คาร์โบไฮเดรต. ไขมัน, วิตามิน เป็นต้น เมื่อผู้ป่วยสามารถเริ่มกลับมาให้อาหารทางปากได้แล้วจึงค่อยๆพิจารณาลดปริมาณอาหารทางเส้นเลือดดำลง โดยไม่หยุดให้ในทันที ต้องค่อยๆลดปริมาณเนื่องจากการให้ TPN มีผลกระตุ้นการผลิต continuous insulin การหยุดการให้ TPN อย่างรวดเร็วจะทำให้เกิดภาวะ rebound hypoglycemia โดยปกติจะค่อยๆลดจนถึง 42 ml/h และให้ 10%Dextrose หลังจาก หยุด TPN ต่อไปอีก 12 ชั่วโมง
ภาวะแทรกซ้อนทางระบบไตและเกลือแร่ Renal complication and Electrolyte imbalances
การเฝ้าติดตามการทำงานของระบบไต โดยการติดตามปริมาณปัสสาวะ ค่าเกลือแร่ในร่างกาย หลีกเลี่ยงการใช้ยาที่มีผลเสียต่อไต การเพิ่มขึ้นของ BUN, Creatinine ร่วมกับการลดลงของปริมาณปัสสาวะเป็นลักษณะสำคัญของภาวะไตวาย โดยจะเพิ่ม morbidity และ mortality อย่างมาก
ภาวะ oliguria หากเป็น prerenal มักเป็นจากภาวะ hypovolemia โดยไปลด renal perfusion การมี intravascular volume depletion กระตุ้นทำให้เกิด reflex tachycardia และ orthostatic hypotension กระตุ้นระบบ renin-angiotensin-aldosterone เกิดการเก็บน้ำและโซเดียมกลับที่ renal tubule การให้ adequate fluid replacement คือหัวใจสำคัญของการรักษาการทำงานของระบบไต การเกิด renal oliguria มักเกิดจาก ischemic injury เช่น การใช้ยาที่มีผลต่อไต postrenal oliguria มักมีสาเหตุจาก obstruction เช่น foley catheter occlusion สาเหตุสำคัญที่ต้องระวังคือ ureter or bladder injury ผู้ป่วยจะมีอาการปัสสาวะเป็นเลือด ปวดบั้นเอว ท้องอืด ได้ การส่งตรวจ CT with IV contrast จะช่วยในการวินิจฉัย
การให้เลือดหลังการผ่าตัด Postoperative transfusion
การให้ส่วนประกอบของเลือด พิจารณาจากความจำเป็นของส่วนประกอบเลือดนั้นๆ โดยการให้ส่วนประกอบของเลือดแต่ละครั้ง จะมีความเสี่ยงในการเกิด reaction จากส่วนประกอบที่อยู่ใน blood component นั้น การให้ยา premedication จะช่วยลดอาการของการเกิด reaction ได้ เช่น การให้ acetaminophen และ diphenhydramine
Red blood cells พิจารณาเติมเลือด เมื่อ Hb < 7g/dL ในผู้ป่วยทั่วไป โดยการเติม PRC 1 unit จะมีปริมาณประมาณ 300-350 ml จะทำให้ Hb เพิ่มขึ้น 1 gm/dL หรือ Hct เพิ่มขึ้น 3%
Platelet เกล็ดเลือดพิจารณาให้ในรายที่มีปัญหา thrombocytopenia with active bleeding หรือ ผู้ป่วยที่มีปัญหาเรื่อง congenital platelet non-dysfunction โดยพิจารณาให้เมื่อ platelet < 50,000/uL และต้องทำหัตถการหรือการผ่าตัด plate concentration 4-6 unit จะมีปริมาณเทียบเท่ากับ single donor platelet 1 unit โดยจะเพิ่มเกล็ดเลือดได้ประมาณ 30,000-60,000 /uL อายุขัยของเกล็ดเลือดมีอายุสั้น การให้เกล็ดเลือดอาจจะต้องพิจารณาให้ซ้ำใน 3-4 วัน
Fresh frozen plasma (FFP) ประกอบไปด้วย clotting factors, albumin และ fibrinogen ข้อบ่งชี้ในการให้ คือ ให้ในผู้ป่วยที่ขาด clotting factor หลายชนิด เช่น ในภาวะ disseminated intravascular coagulation (DIC) หรือ massive transfusion
Cryoprecipitate คือ เป็นตะกอนโปรตีนที่เกิดจากการนำ FFP มาละลายที่ 4° ซ.แล้วบีบแยกส่วนพลาสมาเหนือตะกอนออกไปเป็น CRP โดยประกอบไปด้วย fibrinogen, factor VIII, factor XIII, vWF การให้ CRP 1 unit จะเพิ่ม fibrinogen 5-10 mg/dL พิจารณาให้ในคนที่มีภาวะ hypofibrinogenemia ในผู้ป่วย DIC นอกจากนี้ cryoprecipitate ช่วยเรื่อง platelet aggregation และ adhesion ช่วยลด bleeding ในผู้ป่วยที่มีภาวะ uremia
การดูแลแผลหลังผ่าตัด Wound care
ภายหลังแผลผ่าตัดถูกเย็บปิด บริเวณช่องว่างของแผลจะถูกเติมเต็มด้วย inflammatory exudateภายใน 48 ชั่วโมงหลังผ่าตัด สามารถปิดแผลผ่าตัดด้วยที่ปิดแผล sterile โดยไม่ต้องเปลี่ยนแผลหากแผลไม่ซึม หากแผลปิดด้วย staple สามารถนำออกได้วันที่ 5 หลังผ่าตัดและปิดด้วย steri-strip tape พิจารณา off staple ช้ากว่า 5 วัน ในกรณีที่แผล cross skin crease เช่น บริเวณขาหนีบ. Popliteal area เป็นต้น
Venous Thromboembolism ภาวะลิ่มเลือดอุดตันในหลอดเลือดดำ
ภาวะลิ่มเลือดอุดต้นในหลอดเลือดดำเป็นปัญหาสำคัญที่ก่อให้เกิด mortality ในผู้ป่วยอย่างมาก แต่ภาวะลิ่มเลือดอุดตันในหลอดเลือดดำนั้นสามารถป้องกันได้ อุบัติการณ์การเกิดภาวะแทรกซ้อน pulmonary embolism ประมาณร้อยละ 10 ในประเทศสหรัฐฯ อาการแสดงของผู้ป่วย VTE มีได้หลากหลายขึ้นกับตำแหน่งที่อุดตัน cardinal sign ของ DVT ประกอบไปด้วย ปวด, ร้อน และ บวมที่บริเวณขา ปัจจัยเสี่ยง เช่น น้ำหนักตัวเกินเกณฑ์ หญิงตั้งครรภ์ ผู้ป่วยมะเร็ง เป็นต้น ภายหลังการผ่าตัด หากผู้ป่วยแสดงอาการ เจ็บแน่นหน้าอก, ความดันโลหิตต่ำลง หรือมีอาการหัวใจเต้นผิดจังหวะ ให้สงสัยภาวะ pulmonary embolism ที่เกิดภายหลังการผ่าตัดได้ การวินิจฉัยอาจอาศัยจากประวัติร่วมกับการตรวจเพิ่มเติมทางรังสีมาประเมิน โดยที่ต้องตัดสาเหตุอื่นๆออก อาจใช้ wells criteria และ Geneva score มาร่วมประเมินเพื่อคิดความน่าจะเป็นของการเกิด DVT/PE เพื่อเป็นแนวทางในการสืบค้นและรักษาต่อไป ดังแสดงในตารางที่ 11
| ตารางที่ 10 Revised Geneva score | |
| ปัจจัยเสี่ยง | คะแนน |
| ลักษณะของผู้ป่วย | |
| อายุมากกว่า 65 | 1 |
| มีประวัติ DVT หรือ PE มาก่อน | 1 |
| ได้รับการผ่าตัดที่ได้ General anesthesia ภายใน 1 เดือน | 2 |
| Active malignant condition หรือ หายแล้ว < 1 ปี | 2 |
| อาการ | |
| Unilateral lower limb pain | 3 |
| Hemoptysis | 2 |
| อาการแสดง | |
| ชีพจร 75-94 bpm | 3 |
| ชีพจร > 95 bpm | 5 |
| Pain on lower limb deep venous palpation or unilateral edema | 4 |
| ความน่าจะเป็น | Total score |
| Low | 0-3 |
| Intermediate | 4-10 |
| High | >10 |
ที่มา adapted from Le Gal G, Righini M, Roy PM, et al. Prediction of pulmonary embolism in the emergency department: the revised Geneva score. Ann Intern Med 2006;144(3):165-171
แนวทางการสืบค้นเมื่อสงสัย DVT/PE 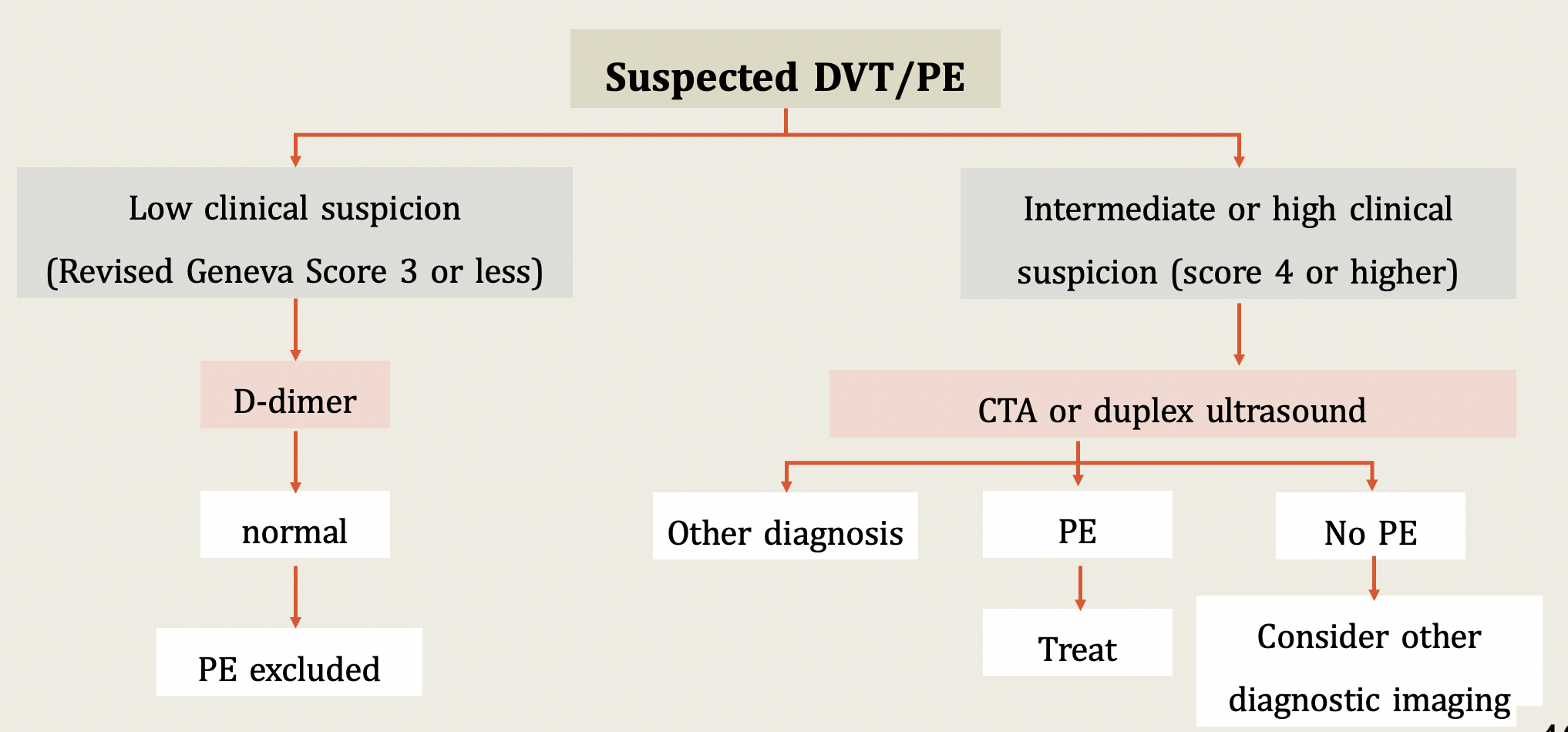
การส่งตรวจเพิ่มเติมเพื่อช่วยวินิจฉัย เช่น ภาพถ่ายรังสีทรวงอกสามารถบ่งบอกถึงสาเหตุอื่นทำให้มีอาการ chest pain with dyspnea ได้ เช่น pneumonia, effusion ในทางกลับกัน หากภาพ chest x-ray ปกติ ก็ยังไม่สามารถ exclude PE ได้ ภาพ duplex doppler ultrasound ถือเป็น practical gold standard สำหรับการวินิจฉัย DVT โดยจะเกิด vessel ที่ไม่สามารถ compressible และ ไม่มี flow ของ vessel ผ่าน
การตรวจ CT pulmonary angiography ปัจจุบันเป็นการตรวจทางรังสีที่ใช้เพื่อประเมินการเกิดภาวะAcute PE โดยมี high positive predictive value มากที่สุด สามารถประเมินตำแหน่งที่เกิดการอุดตันได้ อย่างไรก็ตาม การรักษา DVT กับ PE นั้นไม่ต่างกัน ดังนั้น หากวินิจฉัย DVT ได้ ก็สามารถเริ่มต้นให้การรักษาได้เลย
การรักษา DVT/PE โดยการให้ Anticoagulants โดยพิจารณาให้ low molecular weight heparin ซึ่งออกฤทธิ์เป็น anti-factor Xa ฉีดบริเวณใต้ผิวหนัง subcutaneous route เป็นยาที่นิยมใช้ใน initial treatment เนื่องจากไม่ต้อง monitor สามารถใช้ในหญิงตั้งครรภ์หรือผู้ป่วยมะเร็ง ใช้เป็นยาในการ bridging สู่ warfarin การให้ vitamin K antagonist จะต้องใช้เวลาเพื่อปรับระดับยาให้เข้าสู่ therapeutic range อย่างน้อย 24 ชั่วโมง หลังจากนั้นจึงจะได้ monotherapy โดยพิจารณาให้ warfarin, rivaroxaban,apixaban แล้วแต่ความเหมาะสมกับผู้ป่วย ระยะเวลาการให้ anticoagulant ให้ไปอย่างน้อย 6 เดือนแล้วแต่ข้อบ่งชี้
เอกสารอ้างอิง
- Cundiff, G. W., Azziz, R., & Bristow, R. E.. (2016). Te Linde’s atlas of gynecologic surgery . Philadelphia, PA : Wolters Kluwer/Lippincott Williams & Wilkins
- American Thoracic Society; Infectious Diseases Society of America. Guideline for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med 2005
- Barber EL, Clarke-Pearson DL. Prevention of venous thromboembolism in gynecologic oncology surgery. Gynocol Oncol 2017;144(2):420-427
- Committee on Practice Bulletins-Gynecology, American College of Obstetricians and Gynecologists. ACOG practice bulletin No. 84: prevention of deep vein thrombosis and pulmonary embolism. Obstet Gynecol 2007
- Raskob G, Silverstein R, Bratzler D, Heit J, White R. Surveillance for deep vein thrombosis and pulmonary embolism: recommendations from a national workshop. Am J Prev Med. 2010;38(4 Suppl):S502-9.
- Mangram AJ, Horan TC, Pearson ML, Silver LC, Jarvis WR. Guidelines for prevention of surgical site infection, 1999. Centres for Disease Control and Prevention (CDC) Hospital Infection Control Practices Advisory Committee. Am J Infect Control 1999;27:97–132.
- National Institute for Health and Care Excellence (NICE). Surgical site infections: prevention and treatment. NICE guideline [NG125]. London: NICE; 2019. p. 1–28