โรคของต่อมไทรอยด์ในสตรีตั้งครรภ์
โรคของต่อมไทรอยด์ในสตรีตั้งครรภ์
พญ. ปองปวัน เชียรวิชัย
อาจารย์ที่ปรึกษา รศ. พญ. สุชยา ลือวรรณ
โรคของต่อมไทรอยด์เป็นโรคของต่อมไร้ท่อที่พบได้บ่อยที่สุดในสตรีวัยเจริญพันธุ์ การเปลี่ยนแปลงของฮอร์โมนขณะตั้งครรภ์ รวมถึงความต้องการไอโอดีนสำหรับทารกในครรภ์ที่เพิ่มขึ้น ทำให้การทำงานและหลั่งฮอร์โมนของต่อมไทรอยด์เปลี่ยนไป และในหลายๆพื้นที่พบว่ายังมีประชากรที่ขาดไอโอดีนอยู่มาก ดังนั้นจึงเป็นเรื่องสำคัญที่จะดูแลสตรีตั้งครรภ์โดยเฉพาะกลุ่มที่มีภาวะผิดปกติของต่อมไทรอยด์อยู่เดิม ให้ควบคุมโรคได้อย่างเหมาะสม(1)
สรีรวิทยาของต่อมไทรอยด์ขณะตั้งครรภ์
การสร้างฮอร์โมนไทรอยด์จะสัมพันธ์กับ hypothalamic-pituitary-thyroid axis โดยเริ่มจากไฮโปทาลามัสหลั่ง thyrotropin-releasing hormone (TRH) เพื่อกระตุ้นต่อมใต้สมองส่วนหน้าให้หลั่ง thyrotropin หรือthyroid-stimulating hormone (TSH) จากนั้น TSH จึงไปกระตุ้นต่อมไทรอยด์ให้สร้างและหลั่งฮอร์โมนไทรอยด์ทั้ง 2 ตัว ได้แก่ thyroxine (T4) and triiodothyronine (T3) (1, 2) สำหรับ TSH นั้นจะประกอบด้วยไกลโคโปรตีนสองตัวได้แก่ β-subunit และ α-subunit ซึ่ง β-subunit เป็นไกลโคโปรตีนที่จำเพาะต่อ TSH ในขณะที่ α-subunit จะเหมือนกับไกลโคโปรตีนที่เป็นส่วนประกอบของฮอร์โมน Human chorionic gonadotropin (hCG) ดังนั้นในระหว่างตั้งครรภ์ ระดับ hCG ที่สูงขึ้น จะกระตุ้นการทำงานของต่อมไทรอยด์ได้ผ่านทาง α-subunit ของไกลโคโปรตีน ที่คล้ายกับใน TSH โดย hCG จะเพิ่ม¬สูงที่สุดช่วงอายุครรภ์ 10-12 สัปดาห์ ส่งผลให้สตรีตั้งครรภ์กว่าร้อยละ 80 มีค่า TSH ลดลง จากกระบวนการ negative feedback ของฮอร์โมนไทรอยด์ แต่ยังคงอยู่ในเกณฑ์ปกติของสตรีที่ไม่ตั้งครรภ์(2) โดย hCG ที่เพิ่มขึ้น 10,000 IU/L จะทำให้ค่า TSH ลดลง 0.1 mU/L(1) ซึ่งในระหว่างตั้งครรภ์จะมีการสร้างฮอร์โมนไทรอยด์เพิ่มขึ้นร้อยละ 40-100 เพื่อให้เพียงพอสำหรับมารดาและทารก สำหรับลักษณะทางกายวิภาคพบว่าต่อมไทรอยด์มีเลือดมาเลี้ยงเพิ่มขึ้นและมีขนาดโตขึ้นเล็กน้อย(2)
T4 และ T3 เกือบทั้งหมดจะจับกับโปรตีนเป็นส่วนใหญ่ ได้แก่ thyroid-binding globulin (TBG) และโปรตีนอื่นๆอีกเล็กน้อย เช่น thyroxine-binding prealbumin, albumin (1) มีฮอร์โมนเพียงร้อยละ 0.03 ที่เป็นอิสระ (free T4, free T3) และเป็นส่วนที่ออกฤทธิ์(3) ฮอร์โมน T4 ทั้งหมดจะสร้างจากต่อมไทรอยด์ และ T4 สามารถเปลี่ยนรูปเป็น T3 และ reverse T3 (reverse triiodothyronine, rT3 ) ที่ตับและไต ซึ่งเป็นรูปที่ไม่ออกฤทธิ์ (inactive form) ในขณะที่ T3 เองสร้างจากต่อมไทรอยด์เพียงร้อยละ 20 เท่านั้น ส่วนอีกร้อยละ 80 เกิดจากการเปลี่ยนรูปของ T4 ตามเนื้อเยื่อต่างๆ (Peripheral conversion) (1) ทั้งนี้ T3 ออกฤทธิ์ได้ดีกว่า T4 เนื่องจากสามารถจับกับ nuclear receptor ได้ดีกว่าถึง 10 เท่า(1)
การเปลี่ยนแปลงในสตรีตั้งครรภ์
ในไตรมาสแรก TSH จะลดลงจากระดับ hCG ที่เพิ่มขึ้นอย่างรวดเร็วตามกลไกที่ได้กล่าวไป โดยค่าปกติจะลดลงในช่วงไตรมาสแรก กล่าวคือค่าปกติต่ำสุดจะลดลง 0.4 mU/L และค่าปกติสูงสุดลดลง 0.5 mU/L (3) TBG จะถูกสร้างจากตับมากขึ้นและลดการสลายในช่วงไตรมาสแรก ระดับของ TBG จะเพิ่มสูงสุดช่วงอายุครรภ์ 20 สัปดาห์(2) เป็นผลมาจากเอสโตรเจนที่เพิ่มขึ้น ทำให้ total T4 และ T3 เพิ่มขึ้นตั้งแต่อายุครรภ์ 7 สัปดาห์ เพิ่มสูงที่สุดเมื่อ 16 สัปดาห์ และคงที่ไปตลอดการตั้งครรภ์เพื่อให้เพียงพอต่อความต้องการของมารดาและทารก(3) ในขณะที่ free T4 และ free T3 จะลดลงประมาณร้อยละ 10-15 (1) เนื่องจากไปจับกับโปรตีนมากขึ้น แต่ไม่ได้ส่งผลต่อการทำงานของต่อมไทรอยด์(2)
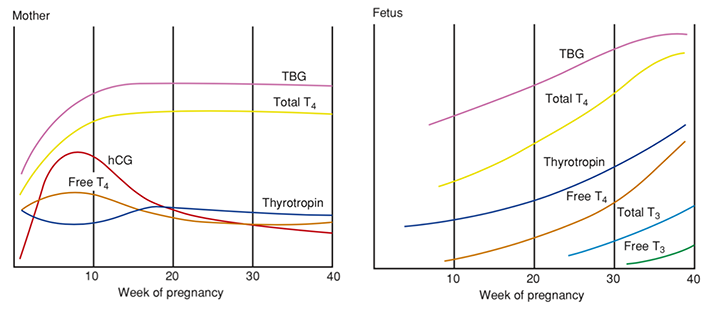
รูปที่ 1 เปรียบเทียบการเปลี่ยนแปลงของฮอร์โมนในมารดาและทารกในครรภ์
ที่มา : William obstetrics, 25th edition(2)
ทารกในครรภ์จะเริ่มสร้างไอโอดีนและฮอร์โมนไทรอยด์ตั้งแต่อายุครรภ์ 12 สัปดาห์ เนื่องจาก TSH ไม่สามารถผ่านรก ในช่วงแรกทารกในครรภ์ จะได้รับ T3 และ T4 ผ่านทางรกตั้งแต่อายุครรภ์ 6 สัปดาห์ ซึ่งเป็นช่วงสำคัญที่สุดของการพัฒนาระบบประสาท ไปจนถึงช่วงไตรมาสที่สอง ดังนั้นทารกที่มารดาขาดไอโอดีนในช่วงนี้ อาจส่งผลต่อพัฒนาการทางสมองได้ในระยะยาว ส่วนในไตรมาสสามจนถึงหลังคลอดช่วง 2-3 ปีแรก ทารกจะใช้ฮอร์โมนที่สร้างเองในการพัฒนาสมองต่อไป(1)
แอนติบอดีที่พบบ่อยในต่อมไทรอยด์
แอนติบอดีต่อ TSH receptor มีทั้งไปกระตุ้นการทำงาน ยังยั้ง หรือทำให้เกิดกระบวนการอักเสบของต่อมไทรอยด์ สำหรับแอนติบอดีที่จะกล่าวถึงและพบบ่อยได้แก่ thyroid- stimulating immunoglobulins (TSIs) ซึ่งจะกระตุ้นการทำงานของ TSH receptor ทำให้ต่อมไทรอยด์สร้างฮอร์โมนมากขึ้น TSIs เป็นแอนติบอดีที่จำเพาะต่อ Graves disease บางครั้งอาจเรียกกันว่า TSH receptor antibodies (TRAb) แอนติบอดีต่อเอนไซม์ Thyroid peroxidase (TPO) หรือ anti-TPO เป็นอีกชนิดที่พบบ่อย โดย Thyroid peroxidase (TPO) เป็นเอนไซม์ในกระบวนการสร้างฮอร์โมนไทรอยด์ anti-TPO พบในหญิงตั้งครรภ์ได้ประมาณร้อยละ 5-15 (2) และสามารถผ่านรกได้ แต่ Anti-TPO ที่ผ่านรกไปสู่ลูกไม่ส่งผลต่อการทำงานของไทรอยด์ในทารกหลังคลอด(3) มารดาที่มี anti-TPO มีแนวโน้มที่จะมี TSH สูงในช่วงไตรมาสแรก และเกิดภาวะ Subclinical hypothyroidism ในช่วงใกล้คลอดได้ประมาณร้อยละ 20 (4) มีการศึกษาพบว่า anti-TPO สัมพันธ์กับการเพิ่มขึ้นของการคลอดก่อนกำหนดและแท้ง ในช่วงไตรมาสแรกประมาณสองเท่า(5) อย่างไรก็ดี ยังไม่มีหลักฐานที่แน่ชัดในการรักษาด้วยยา Levothyroxine เพื่อลดการคลอดก่อนกำหนดและลดภาวะแท้ง ในรายที่ค่าไทรอยด์ปกติแต่ตรวจพบ anti-TPO(3) แนวปฏิบัติของ American Thyroid Association(ATA) ปีค.ศ. 2017 แนะนำให้ตรวจติดตาม TSH ทุก 4 สัปดาห์ตั้งแต่ทราบว่าตั้งครรภ์จนถึงช่วงกลางไตรมาสที่สอง เพื่อเฝ้าระวังภาวะฮอร์โมนไทรอยด์ต่ำ(3) นอกจากนี้ anti-TPO ยังสัมพันธ์กับการเกิดภาวะไทรอยด์อักเสบหลังคลอด (Postpartum thyroiditis) ได้(1)
ภาวะไทรอยด์เป็นพิษในหญิงตั้งครรภ์ (Thyrotoxicosis)
พบได้ประมาณร้อยละ 0.05-0.2 สาเหตุของไทรอยด์เป็นพิษร้อยละ 90-95 เกิดจากภาวะ Graves’ disease จากการที่มี thyroid- stimulating immunoglobulins (TSIs) หรือ TSH receptor antibodies (TRAb) เป็นแอนติบอดีที่จำเพาะต่อโรค กระตุ้นการทำงานของ TSH-receptor ที่ต่อมไทรอยด์ เพิ่มการสร้างฮอร์โมน T4 และ T3 ส่วนสาเหตุอื่นๆที่พบได้รองลงมาเช่น toxic multinodular goiter ,toxic adenoma ,subacute thyroiditis(3) และสาเหตุที่เกิดนอกต่อมไทรอยด์เช่น hyperemesis Gravidarum และ gestational trophoblastic disease เป็นต้น(1, 2)
gestational transient thyrotoxicosis จะพบได้ช่วงไตรมาสแรก เป็นภาวะที่มี TSH ต่ำ และ FT4 สูงซึ่งเป็นผลจากระดับ hCG ที่เพิ่มสูงขึ้นในระหว่างการตั้งครรภ์ โดยอาจพบร่วมกับ hyperemesis gravidarum ที่สำคัญคือต้องแยกระหว่างกับ gestationtal transient thyrotoxicosis กับ Graves’ disease โดยภาวะ gestational transient thyrotoxicosis นั้นสตรีตั้งครรภ์จะไม่มีลักษณะของต่อมไทรอยด์โต ตาโปน และมีอาการเพียงเล็กน้อยซึ่งสามารถหายได้เอง รวมถึงอาจมีประวัติคลื่นไส้อาเจียนรุนแรงร่วมด้วย (3) ซึ่งภาวะนี้จะรักษาตามอาการ ไม่จำเป็นต้องใช้ยาต้านไทรอยด์ เพราะ T4 จะลดลงสู่ระดับปกติในช่วงอายุครรภ์ 14-18 สัปดาห์ นอกจากนี้ยังมีภาวะอื่นๆที่สัมพันธ์กับ hCG สูงจนส่งผลให้มีอาการของไทรอยด์เป็นพิษ (hCG-induced thyrotoxicosis) เช่น ครรภ์แฝด ครรภ์ไข่ปลาอุก และมะเร็งของเนื้อรก เป็นต้น(3) การวินิจฉัยทำได้โดยการซักประวัติ ร่วมกับการตรวจร่างกายและตรวจค่าการทำงานของต่อมไทรอยด์ จะพบว่า free T4 และ free T3 มีค่าสูงขึ้น และ TSH มีค่าต่ำกว่าปกติเมื่อเทียบกับค่าปกติในไตรมาสนั้นๆ แต่ค่า free T4 อาจปกติได้ในกรณีที่เป็น T3 toxicosis การวินิจฉัยให้ตรวจ total T3 ในเลือดแทน จะพบว่าค่าสูงกว่าปกติ (1)
Subclinical hyperthyroid คือภาวะที่มี TSH ต่ำ โดยที่ค่า T4 ปกติ ซึ่งไม่ส่งผลกระทบต่อมารดาและทารก จึงไม่แนะนำให้รักษาด้วยยาต้านไทรอยด์ เนื่องจากยาต้านไทรอยด์อาจส่งผลเสียต่อทารกมากกว่าได้ประโยชน์ และพบว่าค่า TSH สามารถกลับมาสู่ปกติได้เองประมาณครึ่งหนึ่ง(1, 2)
อาการและอาการแสดง
อ่อนเพลีย ร้อนง่าย เหงื่อออกมาก มือสั่น ใจสั่น อารมณ์แปรปรวน น้ำหนักลดแม้จะรับประทานอาหารอย่างเพียงพอ ชีพจรเต้นเร็ว ต่อมไทรอยด์โตทั่วๆ และตาโปนจะพบได้ใน Graves’ disease
ผลกระทบต่อการตั้งครรภ์และทารก
ภาวะไทรอยด์เป็นพิษที่ไม่ได้รักษาหรือควบคุมโรคไม่ได้ จะส่งผลให้เกิดความดันโลหิตสูงขณะตั้งครรภ์รวมทั้งครรภ์เป็นพิษ ไทรอยด์เป็นพิษรุนแรง (Thyroid storm) คลอดก่อนกำหนด ภาวะแท้ง และหัวใจวาย(3) สำหรับทารกในครรภ์นั้นโดยส่วนมากการทำงานของไทรอยด์จะปกติ มีประมาณร้อยละ 1 ที่จะเกิดไทรอยด์เป็นพิษหลังคลอดในมารดาที่มีภาวะ Graves disease จากการที่ thyroid- stimulating immunoglobulins ผ่านรกและไปกระตุ้นการทำงานของต่อมไทรอยด์ ส่งผลให้หัวใจทารกเต้นเร็วมากกว่า 160 ครั้งต่อนาที ทารกโตช้าในครรภ์ ต่อมไทรอยด์โต อายุกระดูกมากกว่าอายุครรภ์(advanced bone age) รอยแยกของศีรษะเชื่อมต่อกันเร็วกว่าปกติ (craniosynostosis) หรือเกิดภาวะทารกบวมน้ำ (Nonimmune hydrops) และทารกเสียชีวิตในครรภ์ได้(1, 2)
สิ่งที่ทำนายการเกิดไทรอยด์เป็นพิษของทารกในครรภ์คือระดับของแอนติบอดีในสตรีตั้งครรภ์ ถ้าระดับแอนติบอดีที่สูงมากกว่า 3 เท่าของค่าปกติ หรือมากกว่า 5 IU/L จะมีโอกาสเกิดไทรอยด์เป็นพิษในทารกมากขึ้น โดยเฉพาะช่วงไตรมาสที่สองเป็นต้นไป(2) ดังนั้นจึงแนะนำให้ตรวจอัลตราซาวน์ประเมินทารกและต่อมไทรอยด์ ตอนอายุครรภ์ 18-20 สัปดาห์ ในสตรีตั้งครรภ์ที่มีระดับแอนติบอดีเกิน 2-3 เท่าของค่าปกติหรือในรายที่รักษาด้วยยาต้านไทรอยด์ขณะตั้งครรภ์(1) ตามแนวทางของสมาคมต่อมไร้ท่อ (Endocrine society) ปีค.ศ. 2012 แนะนำให้เจาะเลือดสายสะดือทารกเพื่อตรวจหาแอนติบอดี ในกรณีที่ไม่แน่ใจในการวินิจฉัยเนื่องจากอาการและผลตรวจอัลตราซาวน์ไม่ชัดเจน(6) ร่วมกับตรวจระดับแอนติบอดีในสตรีตั้งครรภ์ ที่อายุครรภ์ 22 สัปดาห์ใน 4 กรณี ดังนี้(6)
- สตรีตั้งครรภ์เป็น Graves’ disease
- มีประวัติรักษา Graves’ disease ด้วยการกลืนแร่ (I131 ablation) หรือผ่าตัดต่อมไทรอยด์
- มีประวัติทารกคนก่อนเป็น Graves’ disease
- มีประวัติระดับแอนติบอดีสูงมาก่อน
การรักษา
หากมีภาวะไทรอยด์เป็นพิษอยู่เดิม การเริ่มรับยาต้านไทรอยด์ก่อนการตั้งครรภ์จะมีผลลัพธ์ดีกว่าการเริ่มยาขณะตั้งครรภ์ ยาต้านไทรอยด์หรือยากลุ่ม Thionamides มีทั้งหมด 3 ตัว ได้แก่ Propylthiouracil (PTU) , Methimazole (MMI), Carbimazole (CM) โดยยาจะออกฤทธิ์ด้วยการจับกับเอมไซม์ peroxidase แทนที่ไอโอดีน ไอโอดีนจึงจับกับ Thyroglobulin ไม่ได้ จึงยับยั้งกระบวนการสร้างฮอร์โมนไทรอยด์ สำหรับ PTU ยังออกฤทธิ์ด้วยการยังยั้งการเปลี่ยน T4 เป็น T3 อีกด้วย ยาใช้อย่างแพร่หลายคือ PTU และ MMI โดยเป้าหมายของการรักษาคือการรักษาระดับ Free T4 ให้อยู่ในช่วงสูงสุดของค่าปกติเหรือเกินมาเล็กน้อย หรือค่า total T4 สูงกว่าค่าปกติของสตรีที่ไม่ได้ตั้งครรภ์ 1.5 เท่า และ TSH มีค่าน้อยกว่า 0.5 mU/L เพื่อป้องกันการเกิดภาวะฮอร์โมนไทรอยด์ต่ำในทารก เนื่องจากทารกจะตอบสนองต่อยามากกว่า โดยสตรีตั้งครรภ์ส่วนใหญ่อาจหยุดยาได้ในช่วงอายุครรภ์ 32-36 สัปดาห์ เนื่องจาก Graves’ disease มักจะสงบช่วงตั้งครรภ์(1, 3)
แนวทางการใช้ยากลุ่ม Thionamides
- Propylthiouracil (PTU) เป็นยาที่แนะนำให้ใช้ในช่วงไตรมาสแรกของการตั้งครรภ์ เนื่องจาก Methimazole (MMI) ทำให้เกิดความพิการและผิดปกติของทารกในครรภ์มากกว่า PTU
- กรณีมารดาที่เคยใช้ยา MMI ขนาดต่ำมา 12-18 เดือน ระดับ TSH ปกติ และไม่มี TRAb อาจพิจารณาหยุดยาและติดตามค่าการทำงานของไทรอยด์ทุกสัปดาห์ในช่วงไตรมาสแรก และทุก 1 เดือนตลอดการตั้งครรภ์(1)
- ผลข้างเคียงของ Methimazole (MMI) ได้แก่ ความผิดปกติของผิวหนัง (aplasia cutis), หนังศีรษะผิดปกติ (scalp defect) ภาวะจมูกด้านหลังตีบตัน (choanal atresia) หลอดอาหารอุดตัน (Esophageal atresia) ภาวะผนังหน้าท้องไม่ปิดแบบมีเยื่อบุช่องท้องคลุม (omphalocele) หลอดอาหารและหลอดลมเชื่อมกัน (tracheoesophageal fistula) ไปจนถึงความผิดปกติของใบหน้าต่างๆ (facial anomalies) (1-3)
- แนะนำให้เริ่มใช้ PTU กรณีที่ไม่เคยได้รับการรักษามาก่อนหรือวินิจฉัยครั้งแรกขณะเริ่มตั้งครรภ์ แล้วจึงเปลี่ยนเป็น MMI หลังอายุครรภ์ 16 สัปดาห์เป็นต้นไป อย่างไรก็ตามสามารถใช้ MMI ได้ในกรณีที่เกิดผลข้างเคียงจากยา PTU หรือสถานพยาบาลนั้นไม่มี PTU
- หากเปลี่ยนเป็น MMI แล้วให้ติดตามดูค่าการทำงานของไทรอยด์ทุก 2-4 สัปดาห์ หากอยู่ในระดับที่เหมาะสม ให้ติดตามต่อทุก 4 สัปดาห์(1, 3)
- ผลข้างเคียงของ PTU ที่สำคัญคือ เป็นพิษต่อตับ (Hepatotoxicity) จึงแนะนำให้เปลี่ยนเป็น MMI ช่วง ไตรมาสที่สองและสาม ส่วนผลข้างเคียงต่อทารกนั้นพบได้บ้าง แต่ไม่รุนแรงเท่า MMI (3)
- กรณีที่แพ้ยา MMI หรือเกิดภาวะ Thyroid storm สามารถให้ PTU ต่อไปได้ แต่ควรตรวจติดตามค่าการทำงานของตับเป็นระยะ อย่างไรก็ตามยังไม่มีการศึกษายืนยันว่าจะสามารถป้องกันการทำลายตับชนิดรุนแรง (Fulminant PTU-induced hepatotoxicity )ได้อย่างมีประสิทธิภาพ(3)
- ผลข้างเคียงอื่นๆของยากลุ่ม Thionamides ได้แก่ ผื่นคัน (น้อยกว่าร้อยละ 5) ไข้ ตับอักเสบ หลอดลมตีบ กลุ่มอาการคล้ายโรคลูปัส (Lupus-like syndrome) แต่ภาวะแทรกซ้อนที่รุนแรงคือ Agranulocytosis หรือภาวะที่มีเม็ดเลือดขาวต่ำมาก โดยเฉพาะชนิดนิวโทรฟิล ซึ่งเป็นภาวะที่พบได้น้อย ประมาณร้อยละ 0.1-0.3 (1, 2) แม้โอกาสเกิดน้อย แต่ก็ทำนายการเกิดได้ยาก เนื่องจากไม่สัมพันธ์กับขนาดยา และเมื่อเกิดมีโอกาสเกิดภาวะแทรกซ้อนได้มาก อาจติดเชื้อแทรกซ้อนและเสียชีวิตได้ โดยอาการที่พบบ่อยคือ ไข้และเจ็บคอ เมื่อตรวจเลือดจะพบเม็ดเลือดขาวต่ำ ค่า Absolute neutrophil count (ANC) ต่ำกว่า 100-200 ตัวต่อไมโครลิตร(7) ดังนั้นหากสตรีตั้งครรภ์ามีอาการไข้ เจ็บคอ ให้หยุดยาทันที และประเมินระดับเม็ดเลือดขาวเป็นระยะ ซึ่งปริมาณเม็ดเลือดขาวจะค่อยๆเพิ่มขึ้น และหากมีภาวะนี้เกิดขึ้นแล้วถือเป็นข้อห้ามในการให้ยากลุ่ม Thionamides (1)
- ยาต้านไทรอยด์สามารถใช้ในช่วงให้นมบุตรได้ โดยที่ยาสามารถผ่านทางน้ำนมได้ร้อยละ 10 ของระดับยาในเลือด(1) แต่ไม่ส่งผลต่อต่อมไทรอยด์รวมถึงพัฒนาการของทารก ทั้งนี้แนะนำให้ทานยาในช่วงหลังให้นมทันที เพื่อทิ้งระยะดูดซึมของยา 3-4 ชั่วโมงก่อนให้นมครั้งต่อไป(1)
- หลังคลอดมีโอกาสที่ Graves’ disease ที่อยู่ในระยะสงบ จะกำเริบได้สูงจึงควรติดตามค่า TSH และ FT4 ช่วง 6 สัปดาห์หลังคลอดเพื่อปรับยาให้เหมาะสม(1, 3)
ขนาดยาที่ใช้
- PTU ขนาดเริ่มต้น 200-400 มิลลิกรัมต่อวัน แบ่งรับประทาน 3 เวลา หลังอาหาร เนื่องจากค่าครึ่งชีวิตของ PTU สั้นกว่า MMI จึงควรแบ่งให้หลายครั้งต่อวัน
- MMI ขนาดเริ่มต้น 10-20 มิลลิกรัมต่อวัน รับประทานวันละ 1 ครั้ง หลังอาหาร
- Carbimazole ขนาดเริ่มต้น 10-40 มิลลิกรัมต่อวัน รับประทานวันละ 1 ครั้ง หลังอาหาร
- การเปลี่ยนยาให้คำนวณขนาดยา MMI:PTU เป็น 1:20 จึงจะได้การออกฤทธิ์ที่พอๆกัน เช่น MMI 5 มิลลิกรัม จะเทียบเท่า PTU 100 มิลลิกรัม เป็นต้น(3)
ยา β-Blockers
มีประโยชน์ในการควบคุมภาวะเมตาบอลิซึมที่มากผิดปกติ เช่น หัวใจเต้นเร็ว ซึ่งเป็นผลข้างเคียงจากไทรอยด์เป็นพิษ ยาที่ใช้แพร่หลายคือ Propranolol 10-40 มิลลิกรัมทุก 6-8 ชั่วโมง(3) ยาตัวอื่นในกลุ่มเดียวกันก็สามารถใช้ได้ เช่น ในภาวะฉุกเฉินอาจใช้ Esmolol ซึ่งเป็นรูปฉีดเข้าหลอดเลือดดำที่ออกฤทธิ์เร็ว ยกเว้น Atenolol ซึ่งเป็นยาใน Category D (1) ควรพิจารณาลดขนาดยาจนถึงหยุดยาเมื่อเข้าสู่ภาวะ euthyroid เนื่องจากการได้รับยา β-Blockers ต่อเนื่อง สัมพันธ์กับภาวะโตช้าในครรภ์ ทารกหัวใจเต้นช้า และน้ำตาลต่ำในทารก(3) ซึ่งยากลุ่มนี้ส่วนใหญ่ใช้เพื่อรักษาและควบคุมอาการก่อนผ่าตัดต่อมไทรอยด์
ไอโอไดด์ (Iodides)
ไอโอไดด์ออกฤทธิ์โดยการยับยั้งการหลังฮอร์โมนจากต่อมไทรอยด์ ทำให้ระดับ T4 และ T3 ลดลงประมาณร้อยละ 50 ภายใน 10 วัน โดยนิยมใช้รักษาภาวะ Thyroid storm ร่วมกับยากลุ่ม Thionamides และ β-Blockers โดยจะในรูปของใช้โพแทสเซียมไอโอไดด์ หรือ saturated solution of potassium iodide (SSKI) แต่เนื่องจากไอโอด์สามารถผ่านรกได้ จึงไม่ควรใช้เกิน 2 สัปดาห์เพื่อป้องกันต่อมไทรอยด์โตในทารก(1)
การรักษาด้วยการผ่าตัดต่อมไทรอยด์
การผ่าตัด Subtotal thyroidectomy อาจพิจารณาทำได้ในกรณีที่ ไม่ตอบสนองต่อการใช้ยาต้านไทรอยด์ขนาดสูง (MMI > 30 มิลลิกรัมต่อวัน หรือ PTU > 450 มิลลิกรัมต่อวัน) มีผลข้างเคียงรุนแรงจากยา ผู้ป่วยไม่รับประทานยาอย่างสม่ำเสมอ หรือเกิดภาวะ Agranulocytosis ซึ่งเป็นเหตุให้ต้องหยุดยา(6) โดยช่วงเวลาที่เหมาะสมที่สุดในการผ่าตัดคือช่วงไตรมาสที่สอง เพื่อลดโอกาสแท้งและคลอดก่อนกำหนด(3, 6)
สำหรับการรักษาโดยการกลืนน้ำแร่ไอโอดีน 131 หรือ I131 ablation ถือเป็นข้อห้ามในหญิงตั้งครรภ์และให้นมบุตร โดยเฉพาะหลังอายุครรภ์ 10-12 สัปดาห์ เนื่องจากสารรังสีจะไปทำลายการสร้างฮอร์โมนในต่อมไทรอยด์ของทารก โดยควรตั้งครรภ์หลังกลืนแร่ไปแล้วอย่างน้อย 6 เดือน แต่หากมีความจำเป็นต้องรักษาในช่วงให้นม ควรบีบน้ำนมทิ้งในช่วง 3-4 วันหลังกลืนแร่(1, 2, 6)
ภาวะไทรอยด์เป็นพิษรุนแรง (Thyroid storm)
เป็นภาวะฉุกเฉินที่อันตรายถึงชีวิตหากไม่ได้รับการดูแลอย่างรวดเร็วและใกล้ชิด โดยจะมีอาการของไทรอยด์เกิน แต่รุนแรงมากขึ้น มีเมตาบอลิซึมที่สูงมากผิดปกติ มีอาการทางระบบประสาท ได้แก่ ซึมลง สับสน กระสับกระส่าย จนถึงโคม่าได้ ส่วนระบบหัวใจและหลอดเลือด มักพบหัวใจเต้นเร็วกว่า 130 ครั้งต่อนาที หัวใจเต้นผิดจังหวะ ความดันโลหิตต่ำจนอาจเกิดภาวะหัวใจล้มเหลวได้ และมักพบไข้สูงมากกว่า 39.4 องศาเซลเซียส ส่วนค่าการทำงานของไทรอยด์ จะพบ TSH ต่ำ T3 และ T4 สูง แต่มักไม่รุนแรงกว่าภาวะฮอร์โมนไทรอยด์สูงทั่วๆไป (1, 2) ปัจจุบันมีการใช้เกณฑ์ “Burch-WartofskyPoint Scale” เพื่อช่วยในการวินิจฉัย โดยสิ่งกระตุ้นอาจเป็นได้ทั้ง การเจ็บครรภ์คลอด การผ่าตัดคลอด การติดเชื้อ ไปจนถึงภาวะครรภ์เป็นพิษ โดยแนวทางการรักษา จะต้องดูแลในห้องพักผู้ป่วยวิกฤต นอกจากการให้สารน้ำและการดูแลประคับประคองแล้ว ยังมีการรักษาที่จำเพาะ แสดงเป็นแผนภูมิการรักษาเรียงลำดับขั้นตอนดังต่อไปนี้(1, 2)

แผนภูมิที่ 1 แสดงแนวทางการรักษาภาวะ Thyroid storm
ที่มา William obstetrics, 25th edition(2)
ภาวะขาดไอโอดีน (Iodine insufficiency)
ช่วงตั้งครรภ์ความต้องการไอโอดีนจะมากขึ้นเนื่องจากมีการสร้างฮอร์โมนไทรอยด์เพิ่มขึ้นเพื่อส่งไปให้ทารกในครรภ์ และไอโอดีนถูกขับทางไตมากขึ้น(2) ดังนั้นหญิงวัยเจริญพันธุ์ที่วางแผนตั้งครรภ์ควรรับประทานไอโอดีนก่อนตั้งครรภ์ 3 เดือน ในรูปของโพแทสเซียมไอโอไดด์ ให้ได้ไอโอดีน 150 ไมโครกรัมต่อวัน และเมื่อตั้งครรภ์จนถึงช่วงให้นมบุตรควรได้รับไอโอดีนเสริม 250 ไมโครกรัมต่อวัน ตามคำแนะนำของ WHO รวมทั้ง สมาคมต่อมไร้ท่อแห่งสหรัฐอเมริกา และสมาคมไทรอยด์แห่งสหรัฐอเมริกา(ATA) (1, 3, 6) แต่ไม่ควรให้เกิน 500 ไมโครกรัมหรือ 2 ครั้งต่อวัน เนื่องจากมีรายงานว่าอาจเกิดภาวะ Subclinical hypothyroid และ Autoimmune thyroiditis ได้(2) ภาวะขาดไอโอดีนจะมีการสร้างฮอร์โมน Thyroxine(T4) ลดลง และ TSH เพิ่มขึ้น อาจมีต่อมไทรอยด์โตทั้งในหญิงตั้งครรภ์และทารก สมองทารกพัฒนาผิดปกติได้ หากขาดไอโอดีนรุนแรง คือได้ไอโอดีนน้อยกว่า 20-25 ไมโครกรัมต่อวัน ในทารกอาจเกิดภาวะ Cretinism หรือโรคเอ๋อได้ โดยลักษณะเด็กที่เป็นจะมีความบกพร่องทางสติปัญญาอย่างมาก เป็นใบ้ หูหนวก ตาเข โดยความรุนแรงขึ้นกับระดับการพร่องไอโอดีนและช่วงเวลาที่ขาดในขณะตั้งครรภ์(1)
ภาวะฮอร์โมนไทรอยด์ต่ำในหญิงตั้งครรภ์
ภาวะไทรอยด์ต่ำอาจแบ่งได้ 3 ชนิด ได้แก่
- Overt hypothyroidism คือมี TSH สูง และ T4 ต่ำ ซึ่งเป็นกลุ่มเดียวที่ต้องรักษาด้วยยา
- Subclinical hypothyroidism คือมีค่า TSH สูง แต่ T4 ปกติ เป็นกลุ่มที่ไม่ต้องรักษายกเว้นกรณีตรวจพบ Anti-TPO หรือค่า TSH สูงกว่า 10 mU/L(3)
- Isolated hypothyroxinemia คือกลุ่มที่มีค่า FT4 ต่ำกว่าเกณฑ์ แต่ค่า TSH ปกติ พบได้ประมาณร้อยละ 2 โดยจากการศึกษายังไม่พบประโยชน์ชัดเจนจากการรักษาด้วยยา Levothyroxine(2, 3) ทั้งนี้ American Thyroid association (ATA) กำหนดให้ค่าปกติของ TSH ในไตรมาสแรกไม่เกิน 2.5 mU/L ในไตรมาสที่สองและสามไม่เกิน 3.0 mU/L(3)
สาเหตุของภาวะไทรอยด์ต่ำที่พบได้บ่อยที่สุดคือ ต่อมไทรอยด์อักเสบเรื้อรัง (Hashimoto thyroiditis) เป็นภาวะที่เกิดจากการมี thyroid peroxidase antibody หรือ Anti-TPO ไปทำลายต่อมไทรอยด์ ทำให้ต่อมไทรอยด์ผลิตฮอร์โมนได้ลดลง ดังนั้น ATA แนะนำให้ตรวจ Anti-TPO ในมารดาทุกรายที่ตรวจพบค่า TSH น้อยกว่า 2.5 mU/L(3) สำหรับสาเหตุอื่นๆได้แก่ Graves’ disease ที่รักษาด้วยการกลืนแร่ไอโอดีน 131 แล้วเกิดภาวะฮอร์โมนไทรอยด์ต่ำภายหลัง หรือมีประวัติผ่าตัดต่อมไทรอยด์มาก่อน และที่พบได้น้อย เช่น subacute viral thyroiditis, suppurative thyroiditis เป็นต้น ลักษณะของ Hashimoto thyroiditis จะพบต่อมไทรอยด์โตท ไม่เจ็บ ภายในต่อมจะประกอบด้วย lymphocytes และ plasma cells
อาการของภาวะไทรอยด์ต่ำ ได้แก่ อ่อนเพลีย หนาวง่าย ผิวแห้ง แต่ส่วนใหญ่มักไม่มีอาการ(1, 6)
ผลกระทบต่อการตั้งครรภ์และทารก
ภาวะฮอร์โมนไทรอยด์ต่ำที่ไม่ได้รักษาอาจทำให้เกิดภาวะแทรกซ้อนได้มาก ได้แก่ ภาวะแท้งบุตร รกลอกตัวก่อนกำหนด ความดันโลหิตสูงขณะตั้งครรภ์และครรภ์เป็นพิษ คลอดก่อนกำหนด ตกเลือดหลังคลอด ส่วนในทารกจะส่งผลให้น้ำหนักตัวน้อย ภาวะตายคลอด ทารกหายใจลำบากหลังคลอด (1, 3, 6) สำหรับภาวะฮอร์โมนไทรอยด์ต่ำรุนแรงจะพบได้น้อย เนื่องจากส่วนใหญ่จะส่งผลต่อภาวะเจริญพันธุ์ ทำให้ไม่ตั้งครรภ์ หรือแท้งไปก่อนจึงไม่ได้ตั้งครรภ์ต่อจนตรวจพบ(2)
การรักษา
แนวทางปัจจุบันแนะนำให้รักษาด้วยยา Levothyroxine หรือ LT4 และไม่แนะนำให้ใช้ยาตัวอื่นที่เป็น T3 ร่วมกับ T4 เช่น Desiccated thyroid extract เพราะมีสัดส่วนของ T4 ไม่เพียงพอ เนื่องจากการพัฒนาสมองทารกต้องการ T4 เป็นหลัก และพบว่า T3 ผ่านเข้าระบบประสาททารกได้น้อย และมักเกิดจากการเปลี่ยนของ T4 เป็น T3 ในสมองมากกว่า(3)
ขนาดรักษา : LT4 แนะนำให้เริ่มที่ 1-2 ไมโครกรัมต่อกิโลกรัมต่อวัน(2) หรือ 0.1-0.15 มิลลิกรัมต่อวัน(1) และปรับยาทุก 4 สัปดาห์จน TSH ลดลงน้อยกว่าค่ากลางของเกณฑ์ปกติในไตรมาสนั้นๆ หรืออาจใช้ค่า TSH น้อยกว่า 2.5 mU/L ก็ได้ โดยเพิ่ม LT4 ครั้งละ 25-50 ไมโครกรัม(1-3, 6) สำหรับหญิงตั้งครรภ์ที่รักษาด้วยยามาก่อนการตั้งครรภ์ แนะนำให้เพิ่มขนาดยาร้อยละ 20-30 (3) หรืออาจมากกว่านี้ในกรณีที่ไม่มีเนื้อเยื่อต่อมไทรอยด์เหลืออยู่เลย เช่นกรณีผ่าตัดต่อมไทรอยด์ออก หรือทำ I131 ablation เนื่องจากขณะตั้งครรภ์ร่างกายจะต้องการ T4 เพิ่มขึ้นตั้งแต่อายุครรภ์ 5 สัปดาห์ จากผลของเอสโตรเจนที่เพิ่มขึ้น แล้วจึงปรับเป็นขนาดยาก่อนตั้งครรภ์ในช่วงหลังคลอด แต่ในมารดาที่เพิ่งเริ่มยาขณะตั้งครรภ์ก็มีโอกาสหยุดยาได้หลังคลอดเช่นกัน โดยเฉพาะรายที่ใช้ ขนาดยา LT4 น้อยกว่า 50 ไมโครกรัมต่อวัน แล้วแต่พิจารณารายบุคคล และหลังลดขนาดยาหรือหยุดยาแนะนำให้ตรวจค่า TSH อีก 6 สัปดาห์(3)
ภาวะไทรอยด์อักเสบหลังคลอด (Postpartum thyroiditis, PPT)
เป็นภาวะผิดปกติทางออโตอิมมูน พบได้ประมาณร้อยละ 5 โดยเกิดจากมีแอนติบอดีต่อต่อมไทรอยเช่น TSIs หรือ Anti-TPO ไปทำลายเซลล์ในต่อมไทรอยด์ โดยพบว่าหญิงตั้งครรภ์ที่มีแอนติบอดีในไตรมาสแรก มีโอกาสเกิดภาวะนี้ได้ร้อยละ 30-50 และผู้ป่วย type I diabetes มีความเสี่ยงที่จะเกิดภาวะไทรอยด์อักเสบหลังคลอดมากขึ้น(2, 3) โดยจะเกิดในช่วง 1 ปีแรกหลังคลอด อาจแสดงออกได้ทั้งลักษณะของ hyperthyroidism และ hypothyroidism โดยลักษณะ classic form จะประกอบด้วย 2 ช่วงคือ
- Transient thyrotoxicosis phase จะเกิดก่อน ในช่วง 6 สัปดาห์ถึง 6 เดือนหลังคลอด แต่ก็มีรายงานว่าอาจเกิดช้าได้ถึง 1 ปีหลังคลอด เกิดจากการทำลายต่อมไทรอยด์ ทำให้เซลล์ที่ถูกทำลาย ปล่อย T4 ออกมามากขึ้น อาจมีต่อมไทรอยด์โตเล็กน้อย มีอาการอ่อนเพลียหรือใจสั่น หรือไม่แสดงอาการเลยก็ได้ ระยะนี้ไม่จำเป็นต้องใช้ยาต้านไทรอยด์ เนื่องจาก T4 ที่เพิ่มขึ้นเกิดจากการทำลายของต่อมไทรอยด์ ไม่ได้เกิดจากการสร้าง T4 เพิ่มขึ้น ยาจึงใช้ไม่ได้ผล แต่หากมีอาการใจสั่นมาก สามารถใช้ยากลุ่ม β-Blockers ได้ เช่น Propranolol หรือ Metoprolol ซึ่งปลอดภัยในช่วงให้นมบุตร(1-3)
- Transient hypothyroid phase เกิดช่วง 4-8 เดือนหลังคลอดและมักสิ้นสุดภายใน 1 ปีหลังคลอด อาจมีอาการอ่อนเพลีย ผมร่วง ซึมเศร้า ผิวแห้ง และต่อมไทรอยด์โตชัดขึ้นได้ โดยระยะนี้ควรรักษาด้วย Levothyroxine 25-75 ไมโครกรัมต่อวัน และให้ต่อเนื่อง 6-12 เดือน (1, 2) เนื่องจากพบว่าเมื่อครบ 1 ปีหลังคลอด ยังพบภาวะฮอร์โมนไทรอยด์ต่ำอยู่ได้ประมาณร้อยละ 50
อย่างไรก็ตาม มีเพียงร้อยละ 20-25 เท่านั้นที่แสดงออกแบบ Classic form ส่วนใหญ่มักแสดงออกในรูปของ Hyperthyroidism หรือ Hypothyroidism เพียงอย่างเดียว และพบว่าผู้ป่วยทุกแบบมีโอกาสที่จะมีภาวะHypothyroidism ตลอดชีวิตประมาณร้อยละ 20-30(2)
การตรวจคัดกรอง PPT แนะนำให้ตรวจเฉพาะรายที่มีความเสี่ยง เช่น มีประวัติเคยเกิดภาวะไทรอยด์อักเสบหลังคลอดมาก่อน มี type I diabetes และแม้ว่าภาวะซึมเศร้าหลังคลอดจะยังไม่มีการศึกษาที่ยืนยันชัดเจนว่าเกี่ยวของกับภาวะไทรอยด์อักเสบหลังคลอด แต่ภาวะ Hypothyroidism ก็ทำให้เกิดอาการซึมเศร้าได้ ดังนั้น ATA และ Endocrine society จึงแนะนำให้ตรวจคัดกรองในมารดาหลังคลอดที่มีภาวะซึมเศร้าด้วย (3, 6)
ก้อนที่ต่อมไทรอยด์และมะเร็งไทรอยด์ (Thyroid nodules and cancer)
หากตรวจพบก้อนที่ต่อมไทรอยด์ ให้ตรวจดูค่าการทำงานไทรอยด์เบื้องต้นทุกราย ส่วนใหญ่กว่าร้อยละ 90 มักเป็นก้อนที่ไม่ใช่มะเร็ง เช่น Hyperplastic หรือ Colloid nodule และพบเป็นมะเร็งเพียงร้อยละ 7-8 โดยชนิดของมะเร็งที่พบบ่อยที่สุดคือชนิด Papillary cancer การตรวจที่แนะนำที่สุดคือการทำ Fine-needle biopsy (FNA) ซึ่งสามารถตรวจได้ทุกไตรมาส ตามแนวทางของ ATA แนะนำดังนี้(1, 3)
- ตรวจอัลตราซาวน์แล้วไม่พบลักษณะที่เหมือนมะเร็ง และขนาดก้อนน้อยกว่า 1.5 เซนติเมตร สามารถติดตามจนถึงหลังคลอดได้
- ตรวจอัลตราซาวน์พบลักษณะน่าสงสัยเช่น เป็น solid hypoechoic nodule, irregular margin, microcalcifications, taller than wide shape ให้ทำ FNA เมื่อก้อนมีขนาดมากกว่า 1 เซนติเมตร
- กรณีผลตรวจชิ้นเนื้อพบเป็น Papillary cancer แต่เป็น nonaggressive type แนะนำให้ผ่าตัดหลังคลอดได้ โดยตรวจอัลตราซาวน์ติดตามขนาดก้อนทุกไตรมาส
- ในรายที่ต้องรักษาด้วยการผ่าตัด เช่น ก้อนโตเร็ว มีมะเร็งลุกลามไปต่อมน้ำแหลือง แนะนำให้ผ่าตัดช่วงไตรมาสที่สอง (1)
สรุป
ในช่วงตั้งครรภ์ระดับฮอร์โมนไทรอยด์จะมีการเปลี่ยนแปลง โดย TSH จะลดลงช่วงไตรมาสแรก การประเมินค่าการทำงานของต่อมไทรอยด์จึงเปลี่ยนแปลงไปตามไตรมาส ซึ่งส่งผลต่อการรักษาและตรวจติดตาม ทั้งภาวะไทรอยด์เป็นพิษและภาวะไทรอยด์ต่ำ มีความต้องการฮอร์โมน Thyroxine สูงขึ้น เพื่อให้เพียงพอสำหรับหญิงตั้งครรภ์และทารก การให้ไอโอดีนเสริมที่เพียงพอจึงเป็นสิ่งสำคัญ นอกจากนี้ในช่วงหลังคลอดควรประเมินภาวะไทรอยด์อักเสบหลังคลอดในรายที่เป็นกลุ่มเสี่ยง และหากตรวจพบก้อนที่ต่อมไทรอยด์ ควรประเมินขนาดก้อนเพื่อส่งตรวจชิ้นเนื้อเพิ่มเติม และให้การรักษาที่เหมาะสมต่อไป
เอกสารอ้างอิง
- Robert Resnik CL, Thomas Moore, Michael Greene, Joshua Copel ,Robert Silver. Thyroid disease and pregnancy. Creasy and Resnik’s Maternal-Fetal Medicine: Principles and Practice. 8th ed. Philadelphia, United states of Ameriaca: ELSEVIER; 2018. p. 1116-34.
- F. Gary Cunningham KJL, Steven L. Bloom, Jodi S. Dashe, Barbara L. Hoffman, Brian M. Casey, Catherine Y. Spong. Thyroid disorders. In: April A. Bailey M, Donald D. McIntire, PhD,David B. Nelson, MD,, editor. Williams Obstertrics. 25th ed. United States of America: McGraw-Hill Education; 2018. p. 1118-28.
- Alexander EK, Pearce EN, Brent GA, Brown RS, Chen H, Dosiou C, et al. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. (1557-9077 (Electronic)).
- Negro R, Formoso G Fau – Mangieri T, Mangieri T Fau – Pezzarossa A, Pezzarossa A Fau – Dazzi D, Dazzi D Fau – Hassan H, Hassan H. Levothyroxine treatment in euthyroid pregnant women with autoimmune thyroid disease: effects on obstetrical complications. (0021-972X (Print)).
- Thangaratinam S, Tan A Fau – Knox E, Knox E Fau – Kilby MD, Kilby Md Fau – Franklyn J, Franklyn J Fau – Coomarasamy A, Coomarasamy A. Association between thyroid autoantibodies and miscarriage and preterm birth: meta-analysis of evidence. (1756-1833 (Electronic)).
- De Groot L, Abalovich M, Alexander EK, Amino N, Barbour L, Cobin RH, et al. Management of Thyroid Dysfunction during Pregnancy and Postpartum: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology & Metabolism. 2012;97(8):2543-65.
- Andersohn F, Konzen C Fau – Garbe E, Garbe E. Systematic review: agranulocytosis induced by nonchemotherapy drugs. (1539-3704 (Electronic)).