มะเร็งเยื่อบุโพรงมดลูก (Endometrial cancer)
มะเร็งเยื่อบุโพรงมดลูก (Endometrial cancer)
พญ. ปรัชญาวรรณ ทองนอก
อาจารย์ที่ปรึกษา อ.นพ. เศรษฐวัฒก์ เศรษฐเสถียร
ระบาดวิทยา (Epidemiology)
มะเร็งเยื่อบุโพรงมดลูก (Endometrial cancer) พบว่าเป็นมะเร็งในระบบสืบพันธุ์สตรีที่พบบ่อยที่สุดในกลุ่มประเทศพัฒนาแล้ว(1) โดยพบบ่อยเป็นอันดับที่ 4 รองมาจากมะเร็งเต้านม มะเร็งปอด และมะเร็งลำไส้ใหญ่ สำหรับประเทศไทยถือเป็นมะเร็งในระบบสืบพันธุ์สตรีที่พบบ่อยเป็นอันดับสาม รองจากมะเร็งปากมดลูกและมะเร็งรังไข่(2) โดยพบได้บ่อยในสตรีสูงอายุ เฉลี่ยประมาณ 60-70 ปี และร้อยละ 95 จะมีอายุมากกว่า 40 ปี
ปัจจัยเสี่ยง (Risk Factors)
มะเร็งเยื่อบุโพรงมดลูกแบ่งออกเป็นสองกลุ่มหลักตามปัจจัยเสี่ยง ได้แก่ ชนิดที่สัมพันธ์กับเอสโตรเจน (The Estrogen Related; Type I, Endometrioid) และชนิดที่ไม่สัมพันธ์กับเอสโตรเจน (Nonestrogen related; Type II, nonendometrioid)(3) ซึ่งพบว่าในแต่ละกลุ่มมักสัมพันธ์กับปัจจัยเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูกที่แตกต่างกัน(4) ดังแสดงในตารางที่ 1
|
ลักษณะ |
ชนิดที่ 1 |
ชนิดที่ 2 |
|
สัมพันธ์กับการได้รับฮอร์โมนเอสโตรเจนเป็นเวลานาน (Unopposed estrogen) – ไม่ตกไข่เรื้อรัง – ไม่มีบุตร – ภาวะอ้วน |
สัมพันธ์
สัมพันธ์ สัมพันธ์ สัมพันธ์ |
ไม่สัมพันธ์
ไม่สัมพันธ์ ไม่สัมพันธ์ ไม่สัมพันธ์ |
|
อายุ |
วัยก่อนหรือใกล้หมดประจำเดือน |
วัยหมดประจำเดือน |
|
การหนาตัวของเยื่อบุโพรงมดลูก (Endometrial hyperplasia) |
สัมพันธ์ |
ไม่สัมพันธ์ |
|
โรคเบาหวาน |
สัมพันธ์ |
ไม่สัมพันธ์ |
|
ระยะเวลาที่มีอาการ |
ช้า |
เร็ว |
|
ลักษณะทางพยาธิวิทยา |
มักเป็น Endometrioid, mucinous, villoglandular |
มักเป็น non-endometrioid เช่น clear cell หรือ serous CA |
|
ระยะของโรคที่มักพบ |
ระยะต้นๆ |
ระยะลุกลาม |
|
เกรดของมะเร็ง |
เกรดต่ำ (Low grade) |
เกรดสูง (High grade) |
|
การดำเนินโรคและพยากรณ์โรค |
ดำเนินช้า พยากรณ์โรคดี |
ดำเนินเร็ว พยากรณ์โรคไม่ดี |
|
การแสดงออกของตัวรับฮอร์โมน |
พบได้บ่อย |
พบได้น้อย |
|
การแสดงออกของ Oncogene บางชนิด -HER2/neu overexpression -P53 overexpression -PTEN mutations -Microsatellite instability |
ไม่พบหรือพบได้น้อย ไม่พบหรือพบได้น้อย พบได้บ่อย พบได้บ่อย |
พบได้บ่อย พบได้บ่อย ไม่พบหรือพบได้น้อย ไม่พบหรือพบได้น้อย |
ตาราง 1 แสดงปัจจัยเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูกทั้งสองชนิด
ปัจจัยที่เพิ่มความเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูก
- การได้รับฮอร์โมนเอสโตรเจนเป็นเวลานาน โดยไม่มีโปรเจสเตอโรนมาต้านฤทธิ์ (Unopposed Estrogen) ได้แก่ ภาวะไม่มีบุตร (Nulliparity) ภาวะอ้วน (Obesity) เคยได้รับ Estrogen replacement therapy ภาวะไม่ตกไข่เรื้อรัง (Anovulatory cycles) มี Estrogen-secreting tumors เช่น Granulosa cell tumor โดยภาวะ Unopposed estrogen เป็นปัจจัยเสี่ยงที่สัมพันธ์กับการเกิด Type I, Endometrioid cancer(5) แต่ในส่วนของ Type II, nonendometrioid cancer พบว่าปัจจัยที่เพิ่มความเสี่ยงจะตรงกันข้ามกัน(3) ได้แก่ มีประวัติมีบุตรหลายคน (Multiparity) Nonobese เป็นต้น
- ภาวะเยื่อบุโพรงมดลูกหนาตัวผิดปกติ (Endometrial hyperplasia) ซึ่งเกิดจากภาวะ unopposed estrogen ดังที่ได้กล่าวไปแล้วในข้อที่1 โดยภาวะเยื่อบุโพรงมดลูกหนาตัวผิดปกติชนิด Complex hyperplasia with nuclear atypia เป็นกลุ่มที่มีความเสี่ยงสูงสุดในการกลายเป็นมะเร็งเยื่อบุโพรงมดลูกโดยมีโอกาสเสี่ยงถึง 29%(6)
- กลุ่มอาการเมตาบอลิก (Metabolic syndromes) ประกอบไปด้วย โรคเบาหวาน ความดันโลหิตสูง ไขมันในเลือดสูง โดยสัมพันธ์กับภาวะดื้อต่ออินซูลิน (Insulin resistance) การมีระดับของ Insulin-like growth factors สูง และภาวะ Hyperinsulinemia ส่งผลขัดขวางระบบเมตาบอลิซึมของฮอร์โมนเอสโตรเจน(2) ส่วนผู้ที่มีภาวะอ้วนจะมีการเปลี่ยนฮอร์โมนแอนโดรเจนเป็นเอสโตรเจนในเนื้อเยื่อไขมัน (Aromatization) มากขึ้น(2) เมื่อระดับเอสโตรเจนในร่างกายสูงขึ้นจึงมีโอกาสเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูกมากขึ้น
- การถ่ายทอดทางพันธุกรรม โรคทางพันธุกรรมที่เกี่ยวข้อง ได้แก่ Lynch syndrome (Hereditary nonpolyposis colorectal cancer) ถ่ายทอดแบบ Autosomal dominant (AD) มีความผิดปกติของยีน MLH1, MSH2, MSH6, PMS2 หากสตรีมีภาวะนี้ จะมีโอกาสเกิดมะเร็งเยื่อบุโพรงมดลูกได้ถึงร้อยละ 27-71 และมีโอกาสเกิดมะเร็งเยื่อบุโพรงมดลูกขณะมีอายุน้อยกว่าผู้ป่วยทั่วไป คือ ช่วง 46-54 ปี(4)
- มะเร็งเต้านม มะเร็งเต้านมและมะเร็งเยื่อบุโพรงมดลูกมักมีปัจจัยเสี่ยงร่วมกัน และหากสตรีที่เป็นมะเร็งเต้านมมีการกลายพันธุ์ของยีน BRCA1 พบว่ามีความเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูกมากขึ้น แต่ปัจจุบันรายงานส่วนใหญ่พบว่าการเกิดมะเร็งเยื่อบุโพรงมดลูก Type II, nonendometrioid cancer มักสัมพันธ์กับการใช้ยา Tamoxifen มากกว่า gene mutation(3) โดยพบว่ายากระตุ้น Estrogen receptor ที่เยื่อบุโพรงมดลูก ทำให้เยื่อบุโพรงมดลูกหนาตัวและเพิ่มโอกาสการเป็นมะเร็งเยื่อบุโพรงมดลูกมากกว่าสตรีทั่วไป 2-3 เท่า(2)
การตรวจคัดกรองมะเร็งเยื่อบุโพรงมดลูก (Screening)
ปัจจุบันยังไม่มีการตรวจคัดกรองมะเร็งเยื่อบุโพรงมดลูกที่มีประโยชน์ดังเช่นมะเร็งปากมดลูก และไม่มีข้อแนะนำให้ตรวจคัดกรองในสตรีทั่วไปที่ไม่มีอาการผิดปกติใดๆ แม้จะมีปัจจัยเสี่ยง(1) เช่น มีโรคทางเมตาบอลิก มีภาวะอ้วน หรือมีประวัติใช้ยา Tamoxifen ก็ตาม โดยสตรีความเสี่ยงต่ำหรือปานกลางควรได้รับคำแนะนำให้มาตรวจวินิจฉัยเมื่อเริ่มมีอาการผิดปกติ(5) เช่น มีเลือดออกผิดปกติทางช่องคลอด โดยเฉพาะในสตรีวัยหมดระดู (Postmenopause) สตรีวัยหมดระดูที่พบการติดเชื้อในโพรงมดลูก (Pyometra) หรือในสตรีที่ผลการตรวจคัดกรองมะเร็งปากมดลูก (Pap smear) พบ Endometrial cell โดยเฉพาะหากพบลักษณะนิวเคลียสที่ผิดปกติ (Atypical) เป็นต้น(3)
ปัจจุบันความสำคัญของการคัดกรองมะเร็งเยื่อบุโพรงมดลูกยังมีเฉพาะในสตรีกลุ่มเสี่ยงสูง ได้แก่ สตรีที่มีความเสี่ยงทางพันธุกรรม กล่าวคือ มีภาวะ Lynch syndrome แต่อย่างไรก็ตาม ความถี่และความคุ้มค่าของการตรวจติดตามยังไม่ชัดเจน และไม่เพิ่มอัตราการรอดชีวิตเมื่อเทียบกับในรายที่มีอาการแล้วจึงมาพบแพทย์(5)
อาการและอาการแสดง (Clinical manifestations)
- ไม่มีอาการ (Asymptomatic) พบได้ประมาณร้อยละ 0.2-2.3 ของผู้ป่วย โดยได้รับการวินิจฉัยจากการทำ Pap smear หรือการสุ่มตัดชิ้นเนื้อในโพรงมดลูก
- เลือดออกผิดปกติทางช่องคลอด (Abnormal uterine bleeding; AUB) เป็นอาการแสดงที่พบในร้อยละ 90 ของผู้ป่วย โดยในสตรีวัยก่อนหมดประจำเดือนที่ควรได้รับการตรวจชิ้นเนื้อจากเยื่อบุโพรงมดลูก (Endometrial biopsy/ Endometrial sampling or Endometrial curettage) ได้แก่ สตรีที่มีปัญหาเลือดออกระหว่างรอบเดือน มีประจำเดือนมามากผิดปกติโดยเฉพาะมีประวัติ Chronic anovulation ร่วมด้วย(1)
สำหรับสตรีวัยหมดประจำเดือนที่มีปัญหาเลือดออกผิดปกติทางช่องคลอด (Postmenopausal bleeding) ควรได้รับการตรวจชิ้นเนื้อจากเยื่อบุโพรงมดลูกทุกราย อย่างไรก็ตามสาเหตุของภาวะเลือดออกผิดปกติทางช่องคลอดในสตรีวัยหมดประจำเดือนมีหลายสาเหตุ ดังแสดงในตารางที่ 2(3) โดยภาวะมะเร็งเยื่อบุโพรงมดลูกไม่ใช่สาเหตุของเลือดออกผิดปกติทางช่องคลอดในสตรีวัยหมดประจำเดือนที่พบบ่อยที่สุด
|
สาเหตุของ Postmenopausal bleeding |
ร้อยละของผู้ป่วยที่มีภาวะดังกล่าว |
|
เยื่อบุโพรงมดลูกฝ่อ (Atrophic endometritis/ vaginitis) |
30 |
|
การได้รับเอสโตรเจนจากภายนอกร่างกาย (exogenous estrogen) |
30 |
|
มะเร็งเยื่อบุโพรงมดลูก (Endometrial cancer) |
15 |
|
ติ่งเนื้อในโพรงมดลูกหรือปากมดลูก (Endometrial or cervical polyps) |
10 |
|
เยื่อบุโพรงมดลูกหนาตัวผิดปกติ (Endometrial hyperplasia) |
5 |
|
สาเหตุอื่นๆ เช่น มะเร็งปากมดลูก มะเร็งกล้ามเนื้อมดลูก (uterine sarcoma) อุบัติเหตุ เป็นต้น |
10 |
ตาราง 2 แสดงสาเหตุของ Postmenopausal bleeding และร้อยละของผู้ป่วยที่พบในแต่ละภาวะดังกล่าว
3. พบก้อนในอุ้งเชิงกราน
ความสำคัญของการประเมินผู้ป่วยมะเร็งเยื่อบุโพรงมดลูกที่มาด้วยเรื่องก้อนในอุ้งเชิงกรานคือ ก้อนดังกล่าวอาจเกิดจากมะเร็งเยื่อบุโพรงมดลูกแพร่กระจายไปที่รังไข่ (metastasis) หรือเป็นโรคที่เกิดพร้อมกันโดยไม่ได้สัมพันธ์กัน (Independent or synchronous tumor) หรือเป็นมะเร็งรังไข่ที่แพร่กระจายไปยังมดลูก(4) โดยมีลักษณะทางพยาธิวิทยาที่ช่วยในการแยกโรคดังแสดงในตารางที่ 3
|
พยาธิกำเนิดของมะเร็งรังไข่ |
ลักษณะมะเร็งเยื่อบุโพรงมดลูก |
ลักษณะมะเร็งรังไข่ |
|
มะเร็งรังไข่ปฐมภูมิ (Primary ovarian cancer) พบร่วมกัน (Synchronous) กับมะเร็งเยื่อบุโพรงมดลูก (Primary endometrial cancer) |
-พบการหนาตัวของเยื่อบุโพรงมดลูก -มักเป็นมะเร็งระยะเริ่มแรก กล่าวคือ มีการลุกลามเข้ากล้ามเนื้อมดลูกเล็กน้อยหรือไม่มี ไม่ลุกลามเข้าหลอดเลือดหรือน้ำเหลือง และไม่พบการกระจายไปที่อื่นนอกมดลูก |
-มักเป็นระยะเริ่มแรก กล่าวคือ เป็นข้างเดียว จำกัดอยู่ภายในเนื้อเยื่อรังไข่ -อาจพบรอยโรคของ Endometriosis ร่วมด้วย -มีพยาธิสภาพแตกต่างจากมะเร็งเยื่อบุโพรงมดลูก |
|
มะเร็งรังไข่ที่แพร่กระจายมาจากมะเร็งเยื่อบุโพรงมดลูก |
-มักเป็นมะเร็งระยะที่มีการลุกลาม ได้แก่ -ลุกลามเข้าชั้นลึกของกล้ามเนื้อมดลูก -ลุกลามเข้าหลอดเลือดหรือน้ำเหลือง -พบการกระจายไปปีกมดลูกและนอกมดลูก |
-มักเป็นสองข้าง -Multinodular และมีมะเร็งที่ผิวจำนวนมาก -มักไม่พบ endometriosis -พยาธิสภาพและเกรดเหมือนกับมะเร็งเยื่อบุโพรงมดลูก |
ตาราง 3 แสดงความแตกต่างทางพยาธิวิทยาระหว่างมะเร็งรังไข่ชนิดปฐมภูมิกับมะเร็งรังไข่ที่เกิดจากการแพร่กระจายของมะเร็งเยื่อบุโพรงมดลูก
การตรวจวินิจฉัยมะเร็งเยื่อบุโพรงมดลูก (Diagnosis)
- การเก็บตัวอย่างเนื้อเยื่อจากเยื่อบุโพรงมดลูก ทำได้หลายวิธี ได้แก่
- การสุ่มตรวจเยื่อบุโพรงมดลูก (Endometrial sampling) ปัจจุบันถือเป็นวิธีมาตรฐาน สามารถนำมาใช้ทดแทนการขูดมดลูกแบบแยกส่วน (Fractional curettage) เนื่องจากภาวะแทรกซ้อนน้อย สามารถทำได้โดยไม่ต้องให้ยาระงับความรู้สึกแก่ผู้ป่วย มีความไว (Sensitivity) สูงถึงร้อยละ 91-99 และมีความจำเพาะสูงถึงร้อยละ 98-100(7)
- การขูดมดลูกแบบแยกส่วน (Fractional curettage) ข้อดีคือสามารถเก็บเนื้อเยื่อแยกส่วนกันระหว่างคอมดลูก (Endocervix) และเยื่อบุโพรงมดลูก (Endometrium) จะมีประโยชน์ในรายที่สงสัยพยาธิสภาพที่ปากมดลูกร่วมด้วย หรือในรายที่ตรวจชิ้นเนื้อด้วยวิธีอื่นไม่พบเซลล์ผิดปกติหรือไม่เพียงพอต่อการแปลผล แต่ผู้ป่วยยังมีอาการเลือดออกผิดปกติทางช่องคลอดอยู่(7)
- การส่องกล้องตรวจโพรงมดลูก (Hysteroscopy) ข้อดีคือช่วยให้ตรวจหารอยโรคได้ดีและแม่นยำ แต่ต้องอาศัยทักษะของแพทย์ผู้ตรวจและต้องทำในห้องผ่าตัด และอาจทำให้มีการแพร่กระจายของเซลล์มะเร็งจากโพรงมดลูกเข้าสู่ช่องท้องได้(4)
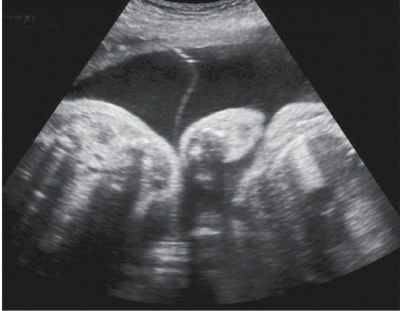
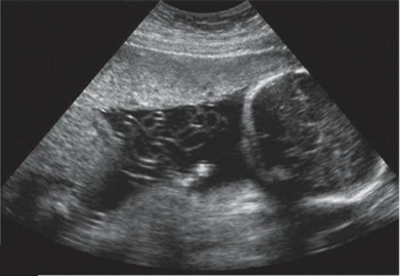
- การตรวจด้วยคลื่นเสียงความถี่สูงทางช่องคลอด (Transvaginal ultrasonography; TVS)
ข้อดีคือเป็นวิธีการตรวจที่ไม่รุกล้ำ (Non-invasive) มีประโยชน์สำหรับสตรีวัยหมดระดูที่มีเลือดออกผิดปกติทางช่องคลอดเพื่อวินิจฉัยแยกโรคระหว่างเลือดออกจากภาวะเยื่อบุโพรงมดลูกฝ่อ (Atrophic endometritis) กับสาเหตุจากการมีพยาธิสภาพในโพรงมดลูก โดยพบว่าหากความหนาของเยื่อบุโพรงมดลูก (Endometrial thickness) ที่วัดจาก TVS หนาไม่เกิน 4-5 มิลลิเมตร(3, 7) จะมีความเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูกต่ำมาก อย่างไรก็ตามการตรวจวิธีนี้มีความไวสูงถึงร้อยละ 96 แต่มีความจำเพาะเพียงร้อยละ 51 สำหรับสตรีวัยก่อนหมดระดูไม่แนะนำให้ตรวจวิธีนี้เนื่องจากมีเยื่อบุหนาตัวแตกต่างกันไปตามระยะของรอบระดูทำให้เกิดเป็นผลบวกลวง (False positive) ได้
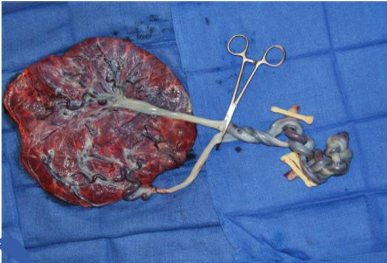
ลักษณะทางพยาธิวิทยาของมะเร็งเยื่อบุโพรงมดลูก (Pathologic features)
มะเร็งเยื่อบุโพรงมดลูกมีหลายชนิด ซึ่งชนิดและเกรดมีความสำคัญต่อพยากรณ์โรค มีรายละเอียดดังนี้
- Endometrioid carcinomaเป็นชนิดที่พบบ่อยที่สุด ประมาณร้อยละ 75-80 ของมะเร็งเยื่อบุโพรงมดลูก ถือเป็นมะเร็งเยื่อบุโพรงมดลูกชนิดที่ 1 (The Estrogen Related; Type I, Endometrioid) ลักษณะคือเซลล์เรียงตัวเป็น Columnar epithelial gland ส่วนเกรด (Grade) ของมะเร็งแบ่งตามปริมาณของ Solid area(5, 6) โดย Grade I (Well differentiated) คือมี solid area น้อยกว่าร้อยละ 5 ส่วน Grade II (Moderately differentiated) คือมี solid area ระหว่างร้อยละ 5-50 และ Grade III (Poorly differentiated) คือมี solid area มากกว่าร้อยละ 50 อย่างไรก็ตามหากมีนิวเคลียสเกรด 3 มากกว่าร้อยละ 50 จะเพิ่มเกรดมะเร็งขึ้นไปอีก 1 ขั้น(2)
- Squamous differentiation: พบร้อยละ 10-25 ของมะเร็งชนิด endometrioid เซลล์รูปร่าง Polygonal มี intercellular bridge หรือ keratin pearl โดยเกรดของ squamous epithelium มักสอดคล้องกับเกรดของส่วน gland ซึ่งสัมพันธ์กับพยากรณ์โรคโดยตรง(2)
- Villoglandular carcinoma: พบร้อยละ 40 ของมะเร็งเยื่อบุโพรงมดลูก ลักษณะเรียงตัวเป็น villous, papillary structure มีแกนเป็น fibrovascular ถือเป็น low-grade endometrioid carcinoma ซึ่งพยากรณ์โรคดี แต่อย่างไรก็ตามต้องวินิจฉัยแยกโรคกับ Papillary serous carcinoma(2) ซึ่งลักษณะทางพยาธิวิทยาค่อนข้างคล้ายกัน แต่พยากรณ์โรคแย่กว่า(1)
- Secretory carcinoma: พบร้อยละ 2 ของมะเร็งชนิด endometrioid พบเป็น glandular epithelium มีช่องว่างเล็กใสของไกลโคเจนอยู่ในไซโทพลาซึม โดยต้องแยกมะเร็งชนิดนี้กับชนิด clear cell (2)ซึ่งไซโทพลาซึมใสเหมือนกันแต่ clear cell จะพบนิวเคลียสผิดปกติมากกว่า เรียงตัวบิดเบือนมากกว่าและพยากรณ์โรคแย่กว่า(1)
- Mucinous carcinoma พบได้ร้อยละ 5 มักสัมพันธ์กับการได้ยา Tamoxifen(2) พบเซลล์เรียงตัวเป็น complex glandular หรือ microglandular และพบสาร mucin ในไซโทพลาซึมคล้าย mucinous tumor ของปากมดลูก จึงต้องแยกว่าเป็นมะเร็งปฐมภูมิที่ปากมดลูกหรือตัวมดลูกเนื่องจากมีผลต่อวิธีการผ่าตัดรักษา(4) โดยลักษณะที่บ่งชี้ว่าเป็นมะเร็งเยื่อบุโพรงมดลูกคือ พบเยื่อบุโพรงมดลูกหนาผิดปกติ พบ stromal foamy histiocyte พบ squamous differentiation หรือใช้การย้อมพิเศษทาง immunocytochemistry พบ vimentin (4)
- Serous carcinoma เป็นมะเร็งเยื่อบุโพรงมดลูกกลุ่มที่ 2 (Nonestrogen related; Type II, nonendometrioid) (2, 3)โดยมักพบเป็นระยะลุกลาม (Advanced stage) ได้แก่ ลุกลามเข้ากล้ามเนื้อมดลูกลึก ลุกลามไปหลอดเลือดและต่อมน้ำเหลือง หรือแพร่กระจายไปนอกมดลูก เซลล์เป็นมะเร็งเกรดสูง (High grade) นิวเคลียสผิดปกติ การย้อม immunohistochemistry พบ p53 หรือพบ Ki-67 จะช่วยแยก serous carcinoma ออกจาก villoglandular carcinoma ได้ดีขึ้น(2)
- Clear cell carcinoma มีการพยากรณ์โรคไม่ดี จัดเป็นมะเร็งเกรด 3 ลักษณะเป็น clear cell, solid area, glandular, tubulocystic หรือ papillary ไซโทพลาซึมใสหรือสีชมพู หรือพบลักษณะ hob-nail appearance คือเซลล์ที่มีไซโทพลาซึมน้อยและมีนิวเคลียสยื่นเข้าไปในช่องว่างตรงกลาง นิวเคลียสผิดปกติมาก (marked atypia) และแบ่งตัวสูง (high mitotic figures) (4)
- Mixed cell adenocarcinoma คือภาวะที่มีมะเร็งมากกว่า 2 ชนิด โดยมีมะเร็งชนิดที่ II อย่างน้อยร้อยละ 5 ก็ทำให้พยากรณ์โรคแย่ลง(2)
การแบ่งระยะของโรค (Staging)
ปัจจุบันใช้การแบ่งระยะโรคตาม International Federation of Gynecology and Obstetrics (FIGO) ปี 2009 ดังนี้(2, 3)
|
ระยะของโรค |
ลักษณะของโรค |
|
I* IA* IB* |
มะเร็งจำกัดอยู่ที่ตัวมดลูก ไม่มีหรือมีการลุกลามเข้ากล้ามเนื้อมดลูกน้อยกว่าครึ่ง ลุกลามเข้ากล้ามเนื้อมดลูกมากกว่าหรือเท่ากับครึ่ง |
|
II |
ลุกลามเข้าเนื้อเยื่อปากมดลูก (cervical stroma)** |
|
III IIIA IIIB IIIC
IIIC1 IIIC2 |
ลุกลามเฉพาะที่หรือเฉพาะบริเวณ ลุกลามไปถึงผิวนอกของมดลูกและ/หรือปีกมดลูก*** ลุกลามไปถึงช่องคลอดและ/หรือเนื้อเยื่อข้างปากมดลูก แพร่กระจายไปต่อมน้ำเหลืองในอุ้งเชิงกราน (pelvic lymph nodes) และ/หรือต่อมน้ำเหลืองข้างหลอดเลือดเอออร์ตา (para-aortic lymph nodes) แพร่กระจายไปต่อมน้ำเหลืองในอุ้งเชิงกราน แพร่กระจายไปต่อมน้ำเหลืองข้างหลอดเลือดเอออร์ตา โดยอาจมีการแพร่กระจายไปต่อมน้ำเหลืองในอุ้งเชิงกรานด้วยหรือไม่ก็ตาม |
|
IV IVA IVB |
ลุกลามไปเยื่อบุกระเพาะปัสสาวะหรือลำไส้หรือแพร่กระจายไปที่ต่างๆ ลุกลามไปเยื่อบุกระเพาะปัสสาวะหรือลำไส้ แพรกระจายไปที่ต่างๆ ในช่องท้องและ/หรือต่อมน้ำเหลืองที่ขาหนีบ |
ตาราง 4 การแบ่งระยะของมะเร็งเยื่อบุโพรงมดลูกตาม FIGO 2009
*ให้ระบุเกรดของมะเร็งว่าเป็น G1, G2 หรือ G3
**การลุกลามไปเยื่อบุต่อมที่ปากมดลูกไม่นับรวมอยู่ในระยะที่ II
***ผลจากการตรวจเซลล์ในช่องท้องไม่นับรวมอยู่ในระยะของโรคแต่ให้รายงานด้วย
การแพร่กระจายของมะเร็งเยื่อบุโพรงมดลูก (Spreading pattern)(3, 6)
- การลุกลามโดยตรงไปยังอวัยวะข้างเคียง (Direct extension to adjacent structures) เป็นการกระจายของมะเร็งที่พบบ่อยที่สุด โดยเป็นการลุกลามของมะเร็งเยื่อบุโพรงมดลุกเข้าชั้นกล้ามเนื้อมดลูกและอาจลามถึงเยื่อบุ serosa หรือลุกลามไปยังปากมดลูก ท่อนำไข่ ช่องคลอด หรือพารามีเตรียม (parametrium)
- การแพร่กระจายผ่านท่อนำไข่ (Transtubal dissemination) โดยมีการแพร่กระจายของเซลล์ผ่านทางท่อนำไข่ (Retrograde flow) เข้าสู่ช่องท้อง ทำให้พบการกระจายของเซลล์เมื่อตรวจจากน้ำล้างช่องท้อง (Peritoneal washing) ได้ แม้ในบางรายจะเป็นมะเร็งระยะต้นๆ ก็ตาม
- การแพร่กระจายผ่านท่อน้ำเหลือง (Lymphatic dissemination) โดยมักพบการแพร่กระจายของมะเร็งเยื่อบุโพรงมดลูกไปยังต่อมน้ำเหลืองบริเวณอุ้งเชิงกราน (Pelvic nodes) และต่อมน้ำเหลืองรอบหลอดเลือดเอออร์ตา (Para-aortic nodes)
- การแพร่กระจายผ่านทางกระแสเลือด (Hematogenous spread) พบการแพร่กระจายของมะเร็งไปยังปอดมากที่สุด รองลงมาคือ ตับ สมอง กระดูก
ปัจจัยการพยากรณ์โรค (Prognostic factors) (2-4)
- อายุ อายุถือเป็นปัจจัยอิสระสำหรับการพยากรณ์โรค โดยมีหลายการศึกษาพบว่าในผู้ป่วยอายุมากมีการพยากรณ์โรคที่แย่กว่า เนื่องจากในผู้ป่วยอายุน้อยมักจะเป็นมะเร็งเกรดต่ำและมีการแพร่กระจายไปต่อมน้ำเหลืองน้อยกว่า
- ชนิดของเซลล์มะเร็ง (Histologic type) พบว่าชนิด serous และ clear cell จะมีพยากรณ์โรคที่แย่กว่าชนิด endometrioid แม้โรคจะอยู่ในระยะแรกๆ ก็ตาม เนื่องจากมีการแพร่กระจายได้เร็วผ่านกระแสเลือด ส่วนมะเร็งชนิด endometrioid การพยากรณ์โรคจะขึ้นอยู่กับเกรดของมะเร็ง
- เกรด (grade) ของเซลล์มะเร็งและการลุกลามชั้นกล้ามเนื้อมดลูก ในมะเร็งเยื่อบุโพรงมดลูกชนิด endometrioid จากการศึกษาพบว่า มะเร็งเกรด 1 และในผู้ที่มีการลุกลามเข้าชั้นกล้ามเนื้อมดลูกน้อยกว่า มักจะมีพยากรณ์โรคที่ดีกว่ามะเร็งเกรด 2 หรือ 3 และพบการลุกลามไปยังต่อมน้ำเหลืองน้อยกว่า
- การลุกลามเข้าหลอดเลือดและหลอดน้ำเหลือง (Lymphovascular space invasion; LVSI) จากการศึกษาพบว่า หากพบการลุกลามเข้าหลอดเลือดและหลอดน้ำเหลือง มักพบความรุนแรงของการแพร่กระจายไปยังกล้ามเนื้อมดลูก อัตราการกลับเป็นซ้ำ และอัตราการเสียชีวิตมากขึ้น
- ขนาดก้อนมะเร็ง (Tumor size) จากการศึกษาพบว่า ในรายที่ขนาดก้อนมะเร็งใหญ่กว่า 2 เซนติเมตร มีโอกาสลุกลามไปยังต่อมน้ำเหลืองสูงกว่า
- ผลการตรวจน้ำในช่องท้อง (Peritoneal cytologic result) ปัจจุบันไม่ได้นำมากำหนดระยะของโรค โดยผลการศึกษาพบว่าไม่ใช่ตัวแปรอิสระในการพยากรณ์โรค (2, 7)
- การแสดงออกของตัวรับฮอร์โมน (Hormone receptor status) ได้แก่ Estrogen receptor และ Progesterone receptor (PR) โดยพบว่า Progesterone receptor สัมพันธ์กับพยากรณ์โรคมากกว่า Estrogen receptor และหากปริมาณ receptor มีมาก การพยากรณ์โรคจะค่อนข้างดี
- ลักษณะ DNA ploidy และ biologic markers อื่นๆ พบว่าในผู้ป่วยที่มี DNA aneuploidy ของมะเร็งเยื่อบุโพรงมดลูก มีอัตราการเสียชีวิตสูงกว่าปกติ 4 เท่า และในรายที่มี p53 mutation พบว่าสัมพันธ์กับพยากรณ์โรคที่แย่ลง (4)
- การลุกลามลงมาปากมดลูกหรือส่วนล่างของมดลูก ในรายที่พบก้อนมะเร็งอยู่ที่ส่วนล่างของมดลูก (Isthmus) หรือปากมดลูก มักมีการแพร่กระจายของโรคไปนอกมดลูกหรือต่อมน้ำเหลืองมากกว่าและมีโอกาสกลับเป็นซ้ำมากกว่า
- กระบวนการรักษา ในรายที่ได้รับการรักษาด้วยการผ่าตัด (Hysterectomy) หรือการผ่าตัดร่วมกับฉายรังสี (Hysterectomy and radiation) จะได้ผลการรักษาที่ดีกว่าการฉายรังสีเพียงอย่างเดียว (3)
การรักษามะเร็งเยื่อบุโพรงมดลูก (Treatment of endometrial cancer)
การประเมินก่อนการรักษา (7, 8)
- ซักประวัติและตรวจร่างกาย เพื่อประเมินความพร้อมก่อนการรักษา และตรวจหาการกระจายของโรค
- ส่งตรวจพื้นฐานก่อนการผ่าตัด (Pre-operative investigation) ได้แก่ CBC, BUN, creatinine, electrolyte, liver function test, urine analysis, EKG, Chest X-ray (CXR) โดยหาก CXR สงสัยความผิดปกติ เช่น การลุกลามของโรค แนะนำให้ตรวจเพิ่มเติมด้วย Computed tomography (CT) chest without contrast
- การพิจารณาส่ง CT chest/ abdomen/ pelvic จะพิจารณาส่งตรวจในรายที่ต้องได้รับการตรวจหาการแพร่กระจายของโรค เช่น คลำพบก้อนอยู่นอกมดลูก ตรวจพบ ascites คลำได้ตับโต หรือผล biopsy เป็นมะเร็งชนิด high-grade หรือตรวจพบมะเร็งเยื่อบุโพรงมดลูกหลังจากรับการผ่าตัดมดลูกแล้วด้วยข้อบ่งชี้อื่นๆ ซึ่งทำให้ยังไม่ได้รับการผ่าตัดเพื่อประเมินระยะโรค (Complete surgical staging; CSS)
- พิจารณาส่ง Magnetic resonance imaging; MRI abdomen เพื่อประโยชน์ในการประเมินจุดกำเนิดของมะเร็งว่ามาจากส่วน Endocervix หรือ Endometrium ประเมินความลึกของมะเร็งที่ลุกลามเข้ากล้ามเนื้อมดลูก และประเมินการแพร่กระจายไปยังต่อมน้ำเหลือง
- การพิจารณาส่งตรวจเพิ่มเติมอื่นๆ เช่น การส่องตรวจกระเพาะปัสสาวะ (Cystoscopy) การส่องตรวจลำไส้ใหญ่ (Colonoscopy) แนะนำให้ทำเมื่อสงสัยว่าจะมีการลุกลาม โดยอิงตามอาการแสดงของผู้ป่วย
กระบวนการรักษามะเร็งเยื่อบุโพรงมดลูก
1. การผ่าตัดเพื่อกำหนดระยะโรค (Surgical staging) (5, 7)
เป็นการรักษาหลักตามมาตรฐาน โดยเป็นการผ่าตัดมดลูกชนิดธรรมดา (Simple hysterectomy) ร่วมกับเลาะต่อมน้ำเหลืองเพื่อเป็นการกำหนดระยะโรค (Surgical staging) ซึ่งมีขั้นตอนการผ่าตัดดังนี้
- แนะนำให้เปิดแผลแนวกลางท้อง (Midline incision)
- ล้างช่องท้อง (Peritoneal washing) ด้วย Normal saline เพื่อส่งตรวจทางเซลล์วิทยา
- มองและคลำอวัยวะในช่องท้องเพื่อตรวจหาความผิดปกติ ได้แก่ เยื่อบุช่องท้อง กะบังลม ตับ ม้าม ลำไส้ โอเมนตัม (Omentum) รวมถึงต่อมน้ำเหลืองบริเวณอุ้งเชิงกรานทั้งสองข้าง (Bilateral pelvic node) และต่อมน้ำเหลืองรอบหลอดเลือด aorta (Paraaortic node)
- ใช้อุปกรณ์ผ่าตัดหนีบ 2 ข้างของมดลูก รวบ round ligament, ovarian ligament, fallopian tubes ทั้ง 2 ข้าง เพื่อป้องกันเซลล์มะเร็งกระจายไปทางท่อนำไข่
- ตัดมดลูก ท่อนำไข่ และรังไข่ทั้งสองข้าง (Total abdominal hysterectomy with bilateral salpingo-oophorectomy; TAH c BSO) โดยปกติจะเป็นการผ่าตัดมดลูกชนิดธรรมดา (Simple hysterectomy) แต่หากในรายที่พบการลุกลามของมะเร็งไปยังปากมดลูกชัดเจน อาจเปลี่ยนเป็นการตัดมดลูกแบบถอนรากถอนโคน (Radical hysterectomy) แทน เนื่องจากให้ผลการรักษาหรืออัตราการรอดชีวิตใกล้เคียงกับการตัดมดลูกแบบธรรมดาร่วมกับการให้รังสีรักษา
- การเลาะต่อมน้ำเหลืองในอุ้งเชิงกราน (Pelvic node) และรอบหลอดเลือดเอออร์ตา (Paraaortic node) พิจารณาทำในรายที่มีความเสี่ยงต่อการแพร่กระจายของมะเร็งออกนอกมดลูก(4) ได้แก่ ผล endometrial biopsy เป็นชนิด endometrioid เกรด 2-3 หรือ non-endometrioid type เช่น serous หรือ clear cell carcinoma ขนาดก้อนมะเร็งใหญ่กว่า 2 เซนติเมตร มะเร็งลุกลามเข้ากล้ามเนื้อมดลูกชั้นลึก ลามลงถึง isthmus หรือปากมดลูก หรือลามออกนอกมดลูก หรือคลำพบต่อมน้ำเหลืองโต
2. การรักษาเพิ่มเติมหลังผ่าตัด (Adjuvant treatment)
โดยเบื้องต้น ข้อมูลที่ได้จากการผ่าตัดจะนำมาประเมินระยะของโรคและจำแนกความเสี่ยงต่อการกลับเป็นซ้ำ รายละเอียดดังนี้ (4)
- กลุ่มความเสี่ยงต่ำ (Low risk) ได้แก่ มะเร็งระยะ IA เกรด 1 หรือ 2 ไม่จำเป็นต้องรับการรักษาเพิ่มเติมเนื่องจากโอกาสกลับเป็นซ้ำต่ำมาก
- กลุ่มความเสี่ยงปานกลาง (Intermediate risk) ได้แก่ มะเร็งระยะ IA เกรด 3 มะเร็งระยะ IB ถึง IIA ควรได้รับการรักษาด้วยรังสีรักษา
- กลุ่มความเสี่ยงสูง (High risk) ได้แก่ มะเร็งระยะ IIIA ขึ้นไป ถึง IV ควรได้รับการรักษาด้วยรังสีรักษาและพิจารณาเคมีบำบัดในผู้ป่วยบางราย
การให้รังสีรักษา (Radiotherapy) (3, 4, 8)
ประกอบไปด้วย การใส่แร่ทางช่องคลอด (Vaginal brachytherapy; VBT) การฉายรังสีบริเวณอุ้งเชิงกราน (External beam pelvic radiation therapy; EBPRT) การฉายรังสีรักษาบริเวณช่องท้อง (Whole abdominal radiation therapy; WART) หรือการฉายรังสีรักษาขยายไปที่ช่องท้องด้านบน (Extended field radiation therapy; EFRT) ซึ่งเป็นการรักษาเพิ่มเติมในผู้ป่วยกลุ่ม Intermediate หรือ high risk โดยในกลุ่มผู้ป่วย intermediate risk จะถูกจำแนกย่อยเพิ่มเติมเป็น low-intermediate risk และ high-intermediate risk โดย high-intermediate risk ได้แก่ อายุมากกว่า 50-60 ปี มีมะเร็งเกรด 2-3 หรือมีการลุกลามเข้ากล้ามเนื้อชั้นลึก (Deep myometrial invasion) หรือมี Lymphovascular space invasion มีหลายการศึกษาค้นพบว่า การให้รังสีรักษาในกลุ่ม high-intermediate risk และ high risk ช่วยลดอัตราการกลับเป็นซ้ำแบบเฉพาะที่ในอุ้งเชิงกรานได้อย่างมีนัยสำคัญทางสถิติ แต่ไม่พบความแตกต่างของอัตราการอยู่รอด ส่วนรูปแบบของรังสีรักษาที่ปัจจุบันนิยมใช้มากที่สุดคือ การฉายรังสีบริเวณอุ้งเชิงกราน (External beam pelvic radiation therapy; EBPRT) หรือการใส่แร่ทางช่องคลอด (Vaginal brachytherapy; VBT) อย่างไรก็ตามพบว่ากลุ่มที่ใส่แร่มีภาวะแทรกซ้อนต่อลำไส้ซึ่งมีผลต่อชีวิตประจำวัน ได้แก่ ท้องเสีย กลั้นอุจจาระลำบาก น้อยกว่ากลุ่มฉายรังสีบริเวณอุ้งเชิงกราน(2)
การให้เคมีบำบัด (Chemotherapy) (3, 7, 8)
ในการรักษามะเร็งเยื่อบุโพรงมดลูกด้วยเคมีบำบัด มักจะพิจารณาในรายที่มะเร็งลุกลามมาก หรือมีการแพร่กระจายไปต่อมน้ำเหลืองรอบหลอดเลือดเอออร์ตา (IIIC2) หรือระยะที่ IV เพื่อหวังผลลดอัตราการกลับเป็นซ้ำบริเวณนอกอุ้งเชิงกราน (Extrapelvic recurrence) ซึงเป็นข้อจำกัดของการรักษาด้วยรังสีรักษา นอกจากนี้ยังมีบทบาทหลักในการรักษาในรายที่กลับเป็นซ้ำ หรือในรายที่เป็นระยะลุกลามที่รักษาแบบประคับประคอง (Palliative treatment) สำหรับชนิดของยาเคมีบำบัดที่นิยมใช้ ได้แก่ Doxorubicin/ cisplatin หรือ Doxorubicin/ Cisplatin/ Cyclophosphamide และปัจจุบันมีการใช้ Paclitaxel และ Carboplatin มากขึ้น
การรักษาด้วยฮอร์โมน (Hormonal treatment)(3, 4)
การใช้ฮอร์โมนในการรักษามะเร็งเยื่อบุโพรงมดลูกจะพิจารณาในรายที่มะเร็งอยู่ในระยะลุกลามหรือกลับเป็นซ้ำ เนื่องจากผลการศึกษาพบว่าไม่มีประโยชน์ของฮอร์โมนในบทบาทของการรักษาเพิ่มเติมหลังการผ่าตัด (Adjuvant treatment) และมีข้อเสียที่สำคัญคือเพิ่มอัตราการเสียชีวิตจากสาเหตุอื่นที่ไม่ใช่มะเร็ง ได้แก่ โรคระบบหัวใจและหลอดเลือด (Thromboembolic disease)
การประเมินและส่งต่อผู้ป่วย หลังการผ่าตัดแล้วพบเป็นมะเร็งเยื่อบุโพรงมดลูกในภายหลัง และแนวทางการรักษาในกรณีผ่าตัดกำหนดระยะของโรคไม่ครบ
ในกรณีที่ผ่าตัดมดลูกด้วยข้อบ่งชี้ใดๆ ก็ตาม เมื่อประเมินพยาธิสภาพด้วยตาเปล่าแล้วพบลักษณะที่สงสัยว่าจะเป็นมะเร็งเยื่อบุโพรงมดลูก แต่หากไม่มีแพทย์ทางมะเร็งนรีเวชในโรงพยาบาลนั้นๆ ให้ผ่าตัดรังไข่ออก สำรวจอวัยวะอื่นๆ ในช่องท้อง และทำหัตถการอื่นๆ ตามขั้นตอนการผ่าตัดมะเร็งเยื่อบุโพรงมดลูกที่สามารถทำได้อย่างปลอดภัย(3, 4) จากนั้นควรบันทึกข้อมูลที่ได้จากการผ่าตัดครั้งแรกโดยละเอียดเนื่องจากมีผลในการพิจารณาให้การรักษาเพิ่มเติม ได้แก่ ขนาดและตำแหน่งของก้อนมะเร็ง ลักษณะก้อน ขอบเขตและความลึกที่ลุกลามเข้าไปชั้นกล้ามเนื้อมดลูก โดยบันทึกเป็นสัดส่วน เช่น 1/3 หรือ ½ ของความหนาของกล้ามเนื้อมดลูก และบันทึกผลการสำรวจอวัยวะอื่นในช่องท้องว่าสงสัยการลุกลามไปหรือไม่
การส่งต่อผู้ป่วยเพื่อรับการรักษาเพิ่มเติม ควรมีข้อมูลต่างๆ ประกอบ ได้แก่ ผลการตรวจทางรังสีก่อนผ่าตัด ข้อมูลจากการผ่าตัด (Operative findings) ผลทางพยาธิวิทยา สไลด์ชิ้นเนื้อ
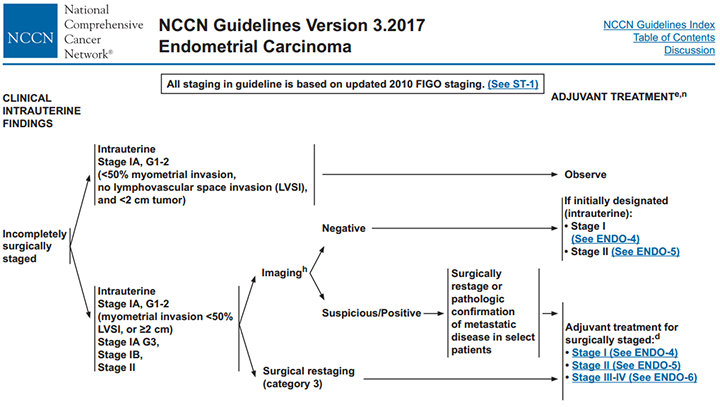
สำหรับแนวทางการรักษาเพิ่มเติม สำหรับมะเร็งระยะ I-II ได้มีคำแนะนำของ The National Comprehensive Cancer Network ดังแสดงในแผนภูมิที่ 1 โดยจะพิจารณาผ่าตัดซ้ำ (Surgical restaging) ในกรณีเป็นมะเร็งระยะ IA, grade 1-2 ที่มีการลุกลามเข้ากล้ามเนื้อมดลูกน้อยกว่าครึ่งหนึ่ง แต่พบ LVSI หรือขนาดก้อนมะเร็งมากกว่า 2 เซนติเมตร หรือเป็นมะเร็งระยะ IA, grade 3 หรือระยะ IB-II(8)
การตรวจติดตามหลังการรักษา (Surveillance)
ตามคำแนะนำของ The National Comprehensive Cancer Network (NCCN) แนะนำให้นัดตรวจติดตามทุก 3-6 เดือน ในช่วง 2-3 ปีแรก หลังจากนั้นจึงนัดห่างขึ้นเป็นทุก 6-12 เดือน(8) เนื่องจากมีอุบัติการณ์การกลับเป็นซ้ำของโรคสูงในช่วง 3 ปีแรก ได้แก่ ร้อยละ 34 ภายใน 1 ปี และร้อยละ 76 ภายใน 3 ปี(7) อย่างไรก็ตามสิ่งที่สำคัญคือการให้คำแนะนำสำหรับผู้ป่วยเกี่ยวกับอาการผิดปกติที่ต้องมาพบแพทย์ก่อนนัด เช่น เลือดออกผิดปกติทางช่องคลอด ปวดท้องน้อย ไอ น้ำหนักลด สำหรับการประเมินผู้ป่วยในช่วงติดตามการรักษา ประกอบไปด้วยการซักประวัติเพื่อหาอาการผิดปกติ การตรวจต่อมน้ำเหลืองลำคอและขาหนีบ ตรวจภายในและทวารหนักเพื่อประเมิน Vaginal stump และประเมินภายในบริเวณอุ้งเชิงกราน ส่วนการตรวจเพิ่มเติมทางรังสีให้พิจารณาตรวจเมื่อสงสัยการกลับเป็นซ้ำ หรือพิจารณาส่งตรวจในรายที่เป็นมะเร็งระยะที่ III-IV โดยส่ง CT chest/abdomen/pelvis ทุก 6 เดือนในช่วง 3 ปีแรก และจากนั้นทุก 6-12 เดือนในช่วง 2 ปีถัดไป (8)
หากพบการกลับเป็นซ้ำของโรค แนวทางการรักษาโดยสังเขป คือ ในกรณีที่เป็นการกลับเป็นซ้ำเฉพาะที่บริเวณช่องคลอดหรืออุ้งเชิงกราน มีทางเลือกในการรักษาระหว่างการผ่าตัดหรือรังสีรักษา ส่วนกรณีระยะแพร่กระจายจะต้องใช้หลายวิธีร่วมกัน ได้แก่ การผ่าตัด รังสีรักษา เคมีบำบัด ฮอร์โมน
เอกสารอ้างอิง
- Di Saia PJ, Creasman WT. Clinical Gynecologic Oncology. 8th edition ed. China: Elsevier Saunders; 2012.
- ตั้งจิตกมล ศ. มะเร็งเยื่อบุโพรงมดลูก Endometrial cancer พิมพ์ครั้งที่ 1 ed. กรุงเทพฯ คณะแพทยศาสตร์วชิรพยาบาล มหาวิทยาลัยนวมินทราธิราช; 2559.
- Berek JS, Hacker NF. Berek and Hacker’s gynecologic oncology: Lippincott Williams & Wilkins; 2015.
- ศรีสมบูรณ์ จ. มะเร็งนรีเวชวิทยา Gynecologic oncology. พิมพ์ครั้งที่ 1 ed. กรุงเทพฯ: ราชวิทย่าลัยสูตินรีแพทย์แห่งประเทศไทย; 2554.
- Barakat RR, Markman M, Randall M. Principles and practice of gynecologic oncology: Lippincott Williams & Wilkins; 2009.
- ทองสง ธ. นรีเวชวิทยา ฉบับสอบบอร์ด เรียบเรียงครั้งที่ 4 ed. เชียงใหม่: ภาควิชาสูติศาสตร์และนรีเวชวิทยา คณะแพทยศาสตร์ มหาวิทยาลัยเชียงใหม่; 2559.
- กิติรัตน์ เตชะไตรศักดิ์, ประสงค์ ตันมหาสมุทร, มงคล เบญจาภิบาล, อรรถพล ใจชื่น, ธันยารัตน์ วงศ์วนานุรักษ์. ตำรานรีเวชวิทยา ฉบับเรียบเรียงครั้งที่ 4 พิมพ์ครั้งที่ 1 ed. กรุงเทพฯ: ภาควิชาสูติศาสตร์-นรีเวชวิทยา คณะแพทยศาสตร์ศิริราชพยาบาล มหาวิทยาลัยมหิดล 2560.
- NCCN Guidelines Version 3.2017 Panel Members Uterine Neoplasm [Internet]. National Comprehensive Cancer Network. 2017.