ยาฝังคุมกำเนิด Implant contraception
ยาฝังคุมกำเนิด: Implant contraception
นพ.นาวิน ศักดาเดช
อาจารย์ที่ปรึกษา รศ.พญ.ทวิวัน พันธศรี
บทนำ
Long acting reversible contraception (LARC) เป็นวิธีการคุมกำเนิดแบบชั่วคราวชนิดหนึ่งที่มีประสิทธิภาพสูง สามารถคุมกำเนิดได้ในระยะยาว โดยประสิทธิภาพของการคุมกำเนิดชนิดนี้ไม่ขึ้นอยู่กับผู้ใช้งาน จึงลดโอกาสล้มเหลวของการคุมกำเนิด (1-3)
การคุมกำเนิดแบบชั่วคราวที่ออกฤทธิ์นาน ที่นิยมใช้ในปัจจุบันมี 3 วิธี ได้แก่ ยาฝังคุมกำเนิด (implant), ยาฉีดคุมกำเนิด (injectable contraception) และ ห่วงคุมกำเนิด (intrauterine device) (4)
ยาฝังคุมกำเนิด (Implant contraception)
จัดเป็นหนึ่งในวิธีคุมกำเนิดแบบชั่วคราวที่ออกฤทธิ์นานที่ได้รับความนิยม มีประสิทธิภาพในการคุมกำเนิดสูง โดยการฝังหลอดยาที่บรรจุฮอร์โมนเข้าไปใต้ผิวหนัง ฮอร์โมนจากแท่งยาจะค่อย ๆ ถูกปล่อยออกสู่กระแสเลือดและออกฤทธิ์ป้องกันการตั้งครรภ์ได้เป็นระยะเวลานาน เมื่อครบกำหนดต้องเอาหลอดยาเดิมออก เนื่องจากไม่มีคุณสมบัติสลายไปได้เอง(5)
ชนิดของยาฝังคุมกำเนิด
1. Levonorgestrel implant
Norplant
เริ่มจำหน่ายในปี พ.ศ. 2533 ประกอบด้วย levonorgestrel ซึ่งบรรจุใน silastic tube จำนวน 6 หลอด แต่ละหลอดมีฮอร์โมน 36 มิลลิกรัม (ทั้งหมด 216 มิลลิกรัม) จะหลั่งฮอร์โมนขนาด 85 ไมโครกรัมต่อวันในเดือนแรก หลังจากนั้นฮอร์โมนจะลดลงเหลือ 35 ไมโครกรัมต่อวัน และ 30 ไมโครกรัมต่อวัน หลังจาก 1 ปีและ 2 ปี ตามลำดับ ยาฝังชนิดนี้ไม่มีจำหน่ายแล้วตั้งแต่ปี พ.ศ.2545 เพราะความยุ่งยากในการฝังและถอดหลอดยา ประกอบกับมียาฝังรุ่นใหม่ที่ใช้งานสะดวกกว่า (4, 6)
Jadelle
เริ่มจำหน่ายในปี พ.ศ.2539 หลอดยาบาง ยืดหยุ่น ตัวยาบรรจุอยู่ใน silastic rod จำนวน 2 หลอด แต่ละหลอดจะมี levonorgestrel 75 มิลลิกรัม (ทั้งหมด 150 มิลลิกรัม) หลอดยามีขนาด 43 x 2.5 มิลลิเมตร จะหลั่งฮอร์โมนขนาด 100 ไมโครกรัมต่อวันในเดือนแรก หลังจากนั้นฮอร์โมนจะลดลงเหลือ 40 ไมโครกรัมต่อวัน และ 30 ไมโครกรัมต่อวัน หลังจาก 1 ปีและ 2 ปี ตามลำดับ สามารถคุมกำเนิดได้นาน 5 ปี ประสิทธิภาพและผลข้างเคียงเหมือนกับ Norplant แต่การถอดหลอดยาจะทำได้ง่ายกว่า (4, 6)
Sino-implant II
หลอดยาจำนวน 2 หลอด ปริมาณ levonorgestrel และการออกฤทธิ์เหมือนกับ Jadelle แต่สามารถคุมกำเนิดได้ 4 ปี ผลิตในประเทศจีน จำหน่ายในเอเชียและแอฟริกา (6)
2. Etonorgestrel implant
Nexplanon
หลอดยายืดหยุ่นได้ขนาดยาว 4 เซนติเมตร เส้นผ่านศูนย์กลาง 2 มิลลิเมตร ประกอบด้วย 3-ketodesogestrel (etonogestrel เป็น active metabolite ของ desogestrel) และ barium sulfate 15 มิลลิกรัม (สารทึบรังสี) มีอุปกรณ์สำหรับฝังยาเพื่อช่วยควบคุมตำแหน่งและความลึกของชั้นผิวหนัง (4, 6)
Implanon / Implanon NXT
Implanon เป็นยาฝังลักษณะคล้ายกับ Nexplanon มีขนาดและปริมาณยาเท่ากัน ต่างกันที่ไม่ได้เคลือบสารทึบรังสี แต่ปัจจุบันมีการผลิตยาฝังรุ่นใหม่ชื่อ Implanon NXT ออกแบบบรรจุภัณฑ์ใหม่ เพื่อให้ง่ายต่อการใช้ มีอุปกรณ์บังคับไม่ให้ฝังยาลึกเกินไปเหมือน Nexplanon ส่วนประกอบและคุณสมบัติเหมือน Implanon เดิมทุกประการ และเพิ่มการเคลือบ barium sulfate ทําให้เห็นได้จาก x-ray
ทั้ง Nexplanon และ Implanon จะปล่อยฮอร์โมน etonorgestrel วันละ 60-70 ไมโครกรัมในช่วงเดือนแรก หลังจากนั้นฮอร์โมนจะลดลงเหลือ 30 ไมโครกรัมหลังจาก 2 ปี สามารถยับยั้งการตกไข่ได้หลังจากฝังยา 8 ชั่วโมง ผลข้างเคียงไม่ต่างจาก Norplant และ Jadelle แต่จะมีเลือดออกน้อยกว่าและขาดประจำเดือนมากกว่า สามารถคุมกำเนิดได้นาน 3 ปี (4, 6)
ประสิทธิภาพของยาฝังคุมกำเนิด (1, 4, 7)
- ประสิทธิภาพสูงเทียบเท่าการทำหมันและการใส่ห่วงอนามัยและประสิทธิภาพดีกว่าการคุมกำเนิดแบบชั่วคราวชนิดอื่น
- อัตราการตั้งครรภ์ 0.2 ต่อ 100 women-years ในผู้ใช้ Norplant
- จากการศึกษาไม่พบการตั้งครรภ์เลย ในผู้ใช้ etonorgestrel 942 ราย
- ประสิทธิภาพของ Norplant และ Jadelle อาจจะลดลงเล็กน้อยในผู้ใช้ที่น้ำหนักมากกว่า 70 กิโลกรัม เมื่อใช้เป็นระยะเวลานาน แต่ประสิทธิภาพก็ยังเหนือกว่ายาเม็ดคุมกำเนิด
- น้ำหนักอาจมีผลต่อระดับ etonogestrel เพียงเล็กน้อย แต่พบว่าไม่เพิ่มอัตราการตั้งครรภ์
การตั้งครรภ์นอกมดลูก
อัตราการตั้งครรภ์นอกมดลูกในผู้ใช้ Norplant อยู่ระหว่าง 0.1-2.9 ต่อ 1,000 women-years ซึ่งค่อนข้างต่ำ แต่ถ้ามีการตั้งครรภ์เกิดขึ้นในระหว่างที่ใช้ยาฝังคุมกำเนิดต้องระวังการตั้งครรภ์นอกมดลูก โดยพบว่าร้อยละ 30 ของการตั้งครรภ์ในขณะใช้ Norplant และร้อยละ 2.3 ของการตั้งครรภ์ในขณะใช้ etonogestrel implant เป็นการตั้งครรภ์นอกมดลูก (4)
กลไกการคุมกำเนิด (4, 7)
โปรเจสตินในหลอดยาฝังซึมผ่านไปยังเนื้อเยื่อรอบ ๆ ดูดซึมเข้ากระแสเลือด กลไกการออกฤทธิ์เช่นเดียวกับการคุมกำเนิดด้วยฮอร์โมนโปรเจสตินเดี่ยว
1. ป้องกันการตกไข่ โดยฮอร์โมนโปรเจสตินจะกดการทำงานของไฮโปทาลามัสและต่อมใต้สมอง
- ในผู้ใช้ Norplant พบว่า มีการตกไข่ประมาณร้อยละ 10 ในช่วง 2 ปีแรก และมากกว่าร้อยละ 50 หลังจาก 5 ปี
- ในผู้ใช้ etonogestrel implant พบว่า หลังฝังยา 8 ชั่วโมง ระดับยาเพียงพอสำหรับป้องกันการตกไข่ และสามารถยับยั้งการตกไข่ได้ประมาณ 3 ปี แต่ช่วง 6 เดือนสุดท้ายจะเริ่มมีการตกไข่เกิดขึ้นบ้าง
2. เปลี่ยนแปลงมูกปากมดลูกให้ข้น ปริมาณน้อย ไม่เหมาะต่อการเคลื่อนผ่านของอสุจิ จากการศึกษา พบว่า กรณีที่ใช้ Norplant หรือ Jadelle ควรคุมกำเนิดด้วยวิธีอื่นอย่างน้อย 3 วันหลังฝังยา แต่ถ้าเป็น etonogestrel implant ไม่จำเป็นต้องคุมกำเนิดวิธีอื่นร่วมด้วย
3. เปลี่ยนแปลงเยื่อบุโพรงมดลูกให้ฝ่อ บาง ไม่เหมาะสมสำหรับการฝังตัวของตัวอ่อน
ข้อบ่งชี้
ยาฝังคุมกำเนิดเป็นทางเลือกการคุมกำเนิดที่ดีสำหรับหญิงวัยเจริญพันธุ์ ทีต้องการคุมกำเนิดต่อเนื่อง ระยะยาว โดยมีข้อพิจารณาดังนี้ (4)
- ผู้ที่ต้องการเว้นระยะห่างของการตั้งครรภ์อย่างน้อย 2-3 ปี
- ต้องการการคุมกำเนิดที่มีประสิทธิภาพ และคุมกำเนิดได้นาน
- มีข้อห้ามหรือผลข้างเคียงของการใช้ฮอร์โมนเอสโตรเจน
- ผู้ที่มีโอกาสลืมกินยาบ่อย ๆ และมีข้อห้ามสำหรับการใส่ห่วงอนามัย
- มีบุตรเพียงพอแล้ว แต่ไม่ต้องการคุมกำเนิดแบบถาวร เช่น การทำหมัน
- มีประวัติซีดร่วมกับมีประจำเดือนมากผิดปกติ
- มีโรคประจำตัวที่เป็นข้อห้ามสำหรับการตั้งครรภ์
ข้อบ่งห้าม
Absolute contraindication (1, 4)
- Active thrombophlebitis หรือหลอดเลือดอุดตัน
- เลือดออกผิดปกติทางช่องคลอดที่ยังไม่ได้รับการวินิจฉัย
- โรคตับเฉียบพลัน
- เนื้องอกหรือมะเร็งตับ
- สงสัยหรือเป็นมะเร็งเต้านม
- ตั้งครรภ์
- แพ้สารประกอบในยาฝังคุมกำเนิด
Relative contraindication (4)
- สูบบุหรี่ (>15 มวน/วัน) ในหญิงอายุมากกว่า 35 ปี
- ประวัติเคยตั้งครรภ์นอกมดลูก
- ไขมันในโลหิตสูง
- ความดันโลหิตสูง
- โรคหัวใจและหลอดเลือด (หัวใจขาดเลือด, หลอดเลือดสมองอุดตัน, ใส่ลิ้นหัวใจ)
- โรคถุงน้ำดี
- โรคเรื้อรัง เช่น โรคภูมิคุ้มกันบกพร่อง
**ภาวะดังต่อไปนี้ไม่ใช่ข้อห้ามสำหรับการใช้ยาฝังคุมกำเนิด แต่แนะนำให้ใช้วิธีอื่น
- เป็นสิวมาก, ไมเกรนรุนแรง, ซึมเศร้ารุนแรง
- กำลังใช้ยาที่มีผลเร่งการทำงานของเอ็นไซม์ตับ ได้แก่ carbamazepine, griseofulvin, nevirapine, phenobarbital, phenytoin, rifampicin, topiramate, vigabatrin เป็นต้น ซึ่งการใช้ยาเหล่านี้จะเพิ่มความเสี่ยงต่อการตั้งครรภ์เนื่องจากทำให้ระดับโปรเจสตินในเลือดลดลง
เวลาที่เริ่มใช้ยาฝังคุมกำเนิด (4, 7)
- เริ่มใช้ภายใน 5 วันแรกของระดู (กรณีไม่ได้ใช้ฮอร์โมนคุมกำเนิดมาก่อน)
- สามารถฝังยาได้เลยในช่วง hormone-free interval (กรณีที่ใช้ฮอร์โมนคุมกำเนิดมาก่อน)
- กรณีที่ใช้ฮอร์โมนโปรเจสตินชนิดเดี่ยว เช่น ยาฉีด ให้ฝังยาในวันครบกำหนดนัดฉีดยาเข็มถัดไป
- กรณีที่ใช้ฮอร์โมนคุมกำเนิดแบบต่อเนื่อง เช่น progestin-only pill สามารถฝังยาตอนไหนก็ได้
- หลังแท้งบุตร เริ่มฝังยาได้ทันทีหรือหลังแท้งภายใน 5 วัน
- หลังคลอดบุตร กรณีไม่ได้ให้นมบุตร ให้ฝังยาภายใน 4 สัปดาห์
- หลังคลอดบุตร กรณีให้นมบุตร ให้ฝังยาในช่วง 4 สัปดาห์ ถึง 4 เดือน อย่างไรก็ตาม สามารถฝังยาได้ทันทีหลังคลอดบุตร
- ไม่จำเป็นต้องใช้การคุมกำเนิดวิธีอื่น หากฝังยาตามช่วงเวลาที่แนะนำข้างต้น แต่ถ้าฝังยานอกเหนือจากช่วงเวลาดังกล่าว แนะนำให้คุมกำเนิดด้วยวิธีอื่นอย่างน้อย 3 วันหลังฝังยา
ผลต่อประจำเดือน (4)
ลักษณะเลือดออกจะมีความหลากหลาย ขึ้นอยู่กับชนิดของยาฝังที่ใช้
Levonorgestrel implants
- มีการเปลี่ยนแปลงของประจำเดือน เช่น ความถี่ของรอบเดือน, ปริมาณเลือดประจำเดือน, จำนวนวันที่เป็นหรือมีเลือดออกกะปริดกะปรอย ซึ่งพบได้ประมาณร้อยละ 80 ในปีแรก และจะลดลงเหลือร้อยละ 33 ในปีที่ 5 หลังฝังยา
- รอบประจำเดือนมาน้อยหรือขาดประจำเดือนสามารถเกิดได้ แต่พบได้น้อยกว่าร้อยละ 10 หลังฝังยา 1 ปี
Etonogestrel implants
- การขาดประจำเดือนพบได้มากกว่า levonorgestrel implants โดยพบได้ร้อยละ 21 ในปีแรก หลังจากนั้นพบได้ร้อยละ 30-40
- เลือดประจำเดือนจะออกน้อยลงและความถี่ลดลง
- อาจเกิดเลือดออกผิดปกติ (irregular bleeding) ซึ่งเป็นเหตุผลหลักของการหยุดใช้ยาฝัง
*ในรายที่ไม่สามารถทนต่ออาการเลือดออกผิดปกติได้สามารถให้ฮอร์โมนเอสโตรเจนวันละครั้งนาน 7 วัน (conjugated estrogen 1.25 mg หรือ estradiol 2 mg)
*ในรายที่มีการตกไข่หรือมีประจำเดือนมาสม่ำเสมอหลังฝังยา แล้วพบว่าขาดประจำเดือน ควรพิจารณาตรวจการตั้งครรภ์
ผลต่อเมทาบอลิซึม (4)
- ไม่มีการเปลี่ยนแปลงค่าการทำงานของตับ, ค่าการแข็งตัวของเลือด, ระดับภูมิคุ้มกัน, ระดับคอร์ติซอล
- มีการเปลี่ยนแปลงเล็กน้อยของระดับไขมัน (lipoproteins) ในกรณีที่ใช้ยาฝังมานาน
- ไม่มีผลต่อการทำงานของ insulin
- ไม่มีผลต่อการเผาผลาญคาร์โบไฮเดรต
- มีผลเล็กน้อยต่อโรคถุงน้ำดีในผู้ใช้ Norplant
- ไม่มีความแตกต่างของเมทาบอลิซึมในผู้ใช้ etonogestrel implants และ levonorgestrel implants
อาการข้างเคียง (4)
- การเปลี่ยนแปลงน้ำหนัก : มักมีน้ำหนักเพิ่มมากกว่าน้ำหนักลด อาจเกิดจากการออกกำลังกาย การรับประทานอาหาร ความอยากอาหารที่เพิ่มขึ้น แต่จากการศึกษาไม่พบการเปลี่ยนแปลงดัชนีมวลกายในผู้ใช้ Norplant
- เจ็บคัดตึงเต้านม : อาการเจ็บคัดตึงเต้านมทั้ง 2 ข้าง พบได้ประมาณร้อยละ 10 ในผู้ใช้ etonogestrel implants พบได้บ่อยช่วงก่อนมีระดูเป็นเพราะการคั่งของน้ำ ควรวินิจฉัยแยกสาเหตุอื่น เช่น การตั้งครรภ์ หากไม่พบสาเหตุอื่น อธิบายให้ความรู้และรักษาตามอาการ
- สิว : เป็นปัญหาผิวหนังที่พบได้บ่อยในผู้ใช้ levonorgestrel implants เป็นผลจาก androgenic effect และระดับ sex hormone binding globulin ลดลง ทำให้ free levonorgestrel และ free testosterone เพิ่มขึ้น แต่พบได้น้อยกว่าในผู้ใช้ etonogestrel implants การรักษาแนะนำเรื่องการรับประทานอาหารและการดูแลความสะอาดของผิวหนัง
- น้ำนมไหล : พบได้บ่อยในผู้ใช้ Norplant หลังจากหยุดให้นมบุตร ควรหาสาเหตุอื่น เช่น การตั้งครรภ์ ตรวจระดับ prolactin ให้ความรู้ ความมั่นใจ แนะนำลดการกระตุ้นบริเวณเต้านมขณะมีเพศสัมพันธ์
- ถุงน้ำรังไข่ : พบได้บ่อยในผู้ใช้ levonorgestrel implants เนื่องจากระดับโปรเจสตินไม่สามารถกดฮอร์โมน FSH ได้ จึงมีการกระตุ้นการเจริญของฟองไข่ อย่างไรก็ตามมักเป็นถุงน้ำรังไข่ชนิดธรรมดา (simple cyst) ซึ่งจะหายไปได้เอง แต่หากมีขนาดโตขึ้นและมีอาการเจ็บควรตรวจประเมินเพิ่มเติม
- อาการข้างเคียงของการฝังยา เช่น แผลติดเชื้อ, อาการคัน, ผื่น, ปวดบวมบริเวณที่ฝังยา
ภาวะเจริญพันธุ์ภายหลังหยุดยา (4)
- หลังถอดยาฝังออก ระดับของโปรเจสตินในกระแสเลือดจะลดต่ำมากภายใน 48 ชั่วโมง ส่วนระดับ etonogestrel จะไม่สามารถตรวจพบในกระแสเลือดภาย 1 สัปดาห์
- ส่วนใหญ่พบว่ามีการตกไข่เกิดขึ้นใน 1 เดือนแรกหลังถอดยาฝัง
- อัตราการตั้งครรภ์ใน 1 ปีแรกหลังถอดยาฝัง ไม่แตกต่างจากสตรีทั่วไปที่ไม่ได้คุมกำเนิด
- ไม่มีผลต่อภาวะเจริญพันธุ์ในระยะยาว
ข้อดีของยาฝังคุมกำเนิด (4)
- ปลอดภัย ประสิทธิภาพในการคุมกำเนิดสูง และคุมกำเนิดได้นาน
- ไม่ขัดขวางขั้นตอนต่าง ๆ ของการมีเพศสัมพันธ์
- ไม่มีผลข้างเคียงจากเอสโตรเจน
- เหมาะสำหรับสตรีที่ให้นมบุตร ไม่มีผลต่อคุณภาพและปริมาณน้ำนม
- ภาวะเจริญพันธุ์กลับมาปกติภายในไม่กี่สัปดาห์หลังหยุดยา
- ไม่รบกวนต่อเมตาบอลิซึมของร่างกาย
- อาจใช้รักษาอาการที่เกิดจากเยื่อบุโพรงมดลูกเจริญผิดที่ (endometriosis)
- ลดความเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูก มะเร็งรังไข่ ไม่เพิ่มความเสี่ยงต่อการเกิดมะเร็งเต้านม
ข้อด้อยของยาฝังคุมกำเนิด (4)
- มีอาการข้างเคียง เช่น ระดูผิดปกติ
- ผู้ให้บริการต้องเป็นแพทย์หรือเจ้าหน้าที่ที่มีความชำนาญในการฝังและถอดยา
- หลอดยาฝังอาจมองเห็นใต้ผิวหนัง
- ไม่ป้องกันโรคติดต่อทางเพศสัมพันธ์ เช่น HIV, Herpes, gonorrhea
- มีปฏิกิริยากับยากันชักและยาอื่น ๆ เช่น carbamazepine, phenytoin, phenobarbital, rifampicin, tetracycline เป็นต้น
เทคนิคการฝังยา (4, 6)
นอนหงายโดยให้กางแขนข้างที่ไม่ถนัดออกให้เห็นบริเวณท้องแขน งอข้อศอกและหงายฝ่ามือวางข้างศีรษะ หาตำแหน่งที่จะทำการฝังยาคือ ท้องแขนด้านในเหนือ medial epicondyle ของ humerus ขึ้นไป 8-10 เซนติเมตร (ดังรูปที่ 1) จุดตำแหน่งที่จะทำการฝังยา ทำความสะอาดบริเวณที่จะทำการฝังยา ฉีดยาชาให้ครอบคลุมตลอดทางที่จะแทง trocar ผ่าน แล้วจึงทำการฝังยา วิธีการฝังยาขึ้นอยู่กับชนิดของยาฝังคุมกำเนิด
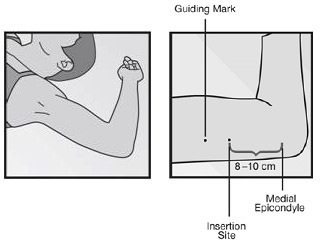
รูปที่ 1 แสดงตำแหน่งที่จะทำการฝังยา
Jadelle : ตัว trocar จะมีเส้นบอกระยะ 2 เส้น โดยเส้นที่ 1 จะเป็นตัวบอกตำแหน่งสุดที่จะใส่ trocar เข้าไปใต้ผิวหนัง ก่อนที่จะทำการบรรจุหลอดยา ส่วนเส้นที่ 2 บอกตำแหน่งที่จะถอย trocar ออกมาหลังจากฝังยาหลอดแรกเสร็จ แทง trocar เข้าไปตรงตำแหน่งที่จุดไว้ เมื่อแทงผ่านผิวหนังให้ยกปลาย trocar ขึ้นและดันราบไปกับผิวหนัง จนถึงเส้นบอกระยะที่ 1 ดึงแกนดันออก ใส่หลอดยาอันแรกเข้าไป จับแกนดันแล้วดึงเอา trocar ออกมาจนถึงเส้นบอกระยะที่ 2 ดัน trocar อีกแนวเป็นรูปตัว V จนถึงเส้นบอกระยะที่ 1 เอาแกนดันออกใส่หลอดยาอันที่ 2 จับแกนดันแล้วดึง trocar ออก แล้วปิดแผล
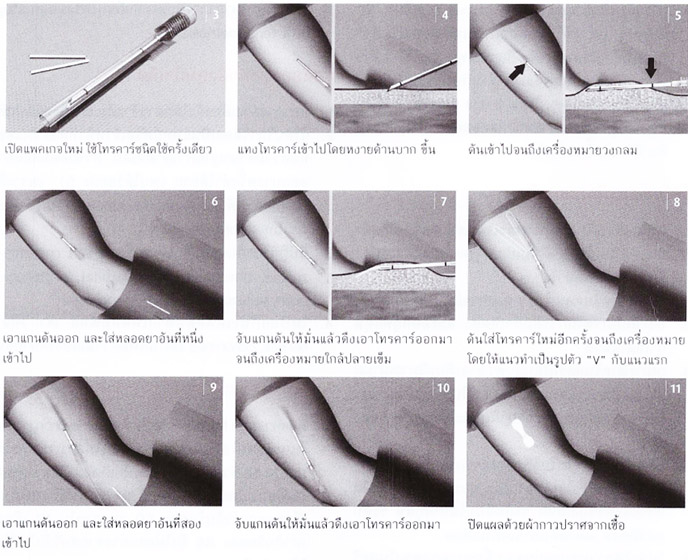
รูปที่ 2 แสดงการฝังยา Jadelle
ดัดแปลงจาก ธีระ ทองสง, บรรณาธิการ. นรีเวชวิทยา ฉบับสอบบอร์ด. กรุงเทพฯ : ลักษมีรุ่ง จำกัด ; 2559.
Implanon NXT : แกะตัวอุปกรณ์ออกมาและดึงปลอกหุ้มตัวเข็มออก ใช้นิ้วชี้และนิ้วหัวแม่มือดึงผิวหนังตรงตําแหน่ง insertion site ให้ตึง แทงเข็มลงไปให้ทํามุม 30 องศากับผิวหนัง เมื่อผ่านผิวหนังแล้ว ลดอุปกรณ์ลงในแนวราบ กระดกปลายเข็มขึ้นให้ผิวหนังยกขึ้น แล้วดันเข็มขนานกับผิวหนังจนสุด ค้างอุปกรณ์ไว้ตําแหน่งเดิม แล้วดันตัวสไลด์ลงมาจนสุด ตัวเข็มจะถูกดึงกลับเข้าตัวอุปกรณ์ และหลอดยาจะหลุดอยู่ใต้ผิวหนัง
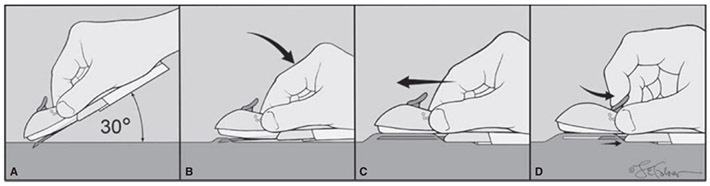
รูปที่ 3 แสดงการฝังยา Implanon NXT
เทคนิคการถอดยา (4)
นอนหงายเหมือนตอนฝังยา คลำหาตำแหน่งหลอดยา ทำความสะอาดบริเวณที่จะทำการถอดยาฝัง ฉีดยาชาเฉพาะที่ ใช้มีดกรีดเปิดแผลประมาณ 2 มิลลิเมตร ใช้คีมเล็กแหวกจับปลายของหลอดยา อาจใช้มืออีกข้างหนึ่งช่วยขยับหลอดยาอีกด้านให้ปลายโผล่ออกมาที่แผล เพื่อให้จับและดึงออกง่าย หากมีพังผืดรอบ ๆ หลอดยา อาจใช้มีดกรีดพังผืดออกก่อน กรณีที่จะฝังยาหลอดใหม่สามารถใส่หลอดยาได้ในตำแหน่งแผลเดิมทันที หรือจะฝังยาแขนอีกข้างก็ได้
เอกสารอ้างอิง
- Stoddard A, McNicholas C, Peipert JF. Efficacy and safety of long-acting reversible contraception. Drugs. 2011;71(8):969-80.
- Contraception, Reproductive Health: CDC; 2020 [October 4, 2020]. Available from: www.cdc.gov.
- Winner B, Peipert JF, Zhao Q, Buckel C, Madden T, Allsworth JE, et al. Effectiveness of long-acting reversible contraception. N Engl J Med. 2012;366(21):1998-2007.
- Taylor HS, Pal L, Seli E. Speroff’s Clinical Gynecologic Endocrinology and Infertility. 9, editor. Philadelphia: Wolters Kluwer; 2019.
- Berek JS, Berek DL. Berek & Novak’s Gynecology. 16 ed. Philadelphia: Wolters Kluwer; 2019.
- Cunningham FG, Leveno KJ, Bloom SL, Dashe JS, Hoffman BL, Casey BM, et al. Williams Obstetrics : Contraception. 25th ed. United state: Mc Graw Hill; 2018. p. 680-701.
- Practice Bulletin No. 186 Summary: Long-Acting Reversible Contraception: Implants and Intrauterine Devices. Obstet Gynecol. 2017;130(5):1173-5.