การดูแลเพศทางเลือกแบบองค์รวม
การดูแลเพศทางเลือกแบบองค์รวม
ธาวินี กฤตสรรค์วงศ์
อาจารย์ที่ปรึกษา อ. พญ. ณัฐนิตา มัทวานนท์
ภาวะเพศหลากหลายคือการที่บุคคลหนึ่งมีความรู้สึกภายใน การแสดงออก หรือความรู้สึกดึงดูดทางเพศที่แตกต่างไปจากเพศกำเนิดที่ติดตัวมา ซึ่งเรื่องเพศมีหลายแง่มุมมากกว่าแค่เพศหญิงแต่กำเนิดและชายแต่กำเนิด โดยอาจแบ่งได้เป็น 4 แง่มุมหลักๆ ดังนี้ (1)
- Biological sex หรือ natal sex คือเพศที่ติดตัวมาแต่กำเนิด กำหนดโดยอวัยวะเพศ ประกอบด้วยเพศหญิง, เพศชาย และ เพศกำกวม
- Gender Identity (อัตลักษณ์ทางเพศ) คือ เพศที่มีความรู้สึกว่าตนเองเป็นจากภายใน โดยไม่ขึ้นกับเพศกำเนิด ประกอบด้วยความต่อเนื่องตั้งแต่ Female ถึง Male
- Gender role หรือ gender expression คือ เพศตามบุคลิกภาพ พฤติกรรม นิสัย และการแสดงออก ประกอบด้วยความต่อเนื่องตั้งแต่ Feminine ถึง Masculine
- Sexual orientation หรือเพศวิถี คือ รูปแบบพื้นฐานอารมณ์ ความรัก และ ความสนใจทางเพศ โดยอาจจะตรงหรือไม่ตรงกับที่สังคมส่วนใหญ่เห็นชอบก็ได้ ประกอบด้วย
- Sexually attracted เพศที่บุคคลพึงมีความสัมพันธ์ทางกาย
- Romantically attracted เพศที่ที่บุคคลพึงมีความรัก และ ความสนใจ
โดยลักษณะของเพศ และ เพศสภาพทั้ง 4 มุมมองนี้ไม่ได้แบ่งเป็นเพียงกลุ่มหญิงกับกลุ่มชายเท่านั้น หากแต่เป็นความแตกต่างที่ต่อเนื่องระหว่างชายและหญิง (Unidimensional continuum) ซึ่งแต่ละแง่มุมก็ไม่จำเป็นต้องเป็นไปในทิศทางเดียวกัน กล่าวคือ ผู้มีเพศกำเนิดชาย อาจจะมีอัตลักษณ์ทางเพศแบบผู้หญิง ชอบแสดงออกเป็นกลางๆระหว่างชายและหญิง แต่มีความสนใจและดึงดูดทางเพศกับผู้หญิงเพียงอย่างเดียวก็ได้ เป็นต้น หากพิจารณาตามแง่มุมทางเพศต่างๆ 4 ชนิดข้างต้นจะพบว่ามีความเป็นไปได้มากมาย และบางครั้งอาจไม่สามารถจัดกลุ่มได้ชัดเจน นอกจากแง่มุมทางเพศข้างต้นแล้ว ยังมีคำที่ใช้บ่อยในกลุ่มเพศหลากหลายคำอื่น ๆ เช่น
- Cisgender คือ ผู้ที่เพศกำเนิดตรงกับเพศสภาพ
- Transgender หรือคนข้ามเพศ เป็นคำกว้าง ๆ ที่ใช้ระบุผู้ที่เพศกำเนิดไม่ตรงกับอัตลักษณ์ทางเพศ โดยมักแบ่งเป็น 2 กลุ่มใหญ่คือ
- Transgender woman, Transwoman, Transfeminine หรือหญิงข้ามเพศ คือ ผู้ที่เพศกำเนิดเป็นชายและมีอัตลักษณ์ทางเพศเป็นหญิง และมักต้องการเปลี่ยนลักษณะแสดงออกทางเพศเป็นหญิง
- Transgender man, Transman, Transmasculine หรือชายข้ามเพศ คือ ผู้ที่เพศกำเนิดเป็นหญิงและมีอัตลักษณ์ทางเพศเป็นชาย และมักต้องการเปลี่ยนลักษณะแสดงออกทางเพศเป็นชาย
- Gender Dysphoria คือ ความทุกข์ทรมานใจที่เกิดจากความไม่เข้ากันระหว่าง อัตลักษณ์ทางเพศ, การแสดงออกทางเพศ และเพศกำเนิด
- Gender nonconforming คือการที่อัตลักษณ์ทางเพศ ความชอบ บุคลิก การแสดงออก ความรู้สึกดึงดูดทางเพศ แตกต่างไปจากความเป็นชายหรือหญิงในบริบทของสังคมนั้นๆ
โดยในปัจจุบัน สังคมมีความตระหนักถึงความหลากหลายทางเพศมากขึ้น จึงมีการสร้างแนวทางต่าง ๆ เพื่อลดความเหลื่อมล้ำและเพื่อให้กลุ่มเพศทางเลือกสามารถใช้ชีวิตในสังคมได้อย่างมีความสุขและเท่าเทียม อาทิเช่นประเทศเนเธอแลนด์ได้ผ่านร่างผ่านกฎหมายอนุญาตให้มีการแต่งงานในเพศเดียวกัน และรับบุตรบุญธรรมได้เมื่อปี ค.ศ. 2000 เป็นประเทศแรกในโลก ตามมาด้วยประเทศเบลเยียม ในปี ค.ศ. 2003 และ แคนาดา ในปี ค.ศ. 2005 ในปัจจุบันมี 30 ประเทศที่มีกฎหมายดังกล่าว โดยประเทศไต้หวันเป็นประเทศแรกในเอเชียที่ผ่านร่างกฎหมายในปี ค.ศ. 2019 ที่ผ่านมา(2)
ในทางการแพทย์ก็มีความตระหนักถึงความสำคัญในการดูแลสุขภาพของกลุ่มเพศหลากหลายซึ่งมีความเฉพาะเจาะจงและแตกต่างจากประชากรทั่วไปในบางแง่มุม โดยเฉพาะในกลุ่ม transgender ที่ต้องการปรับเปลี่ยนลักษณะทางเพศโดยการใช้ฮอร์โมนหรือการผ่าตัด ทำให้องค์กรทางการแพทย์ต่าง ๆ ได้ออกแนวทางในการดูแลผู้มีความหลากหลายทางเพศอย่างต่อเนื่องในช่วงที่ผ่านมา โดยในปี ค.ศ. 2012 WPATH ได้จัดทำแนวทางการดูแลรักษาหรือ Standard of care ฉบับใหม่หรือ version 7 (1) ที่ได้รับการยอมรับอย่างแพร่หลายมาจนกระทั่งปัจจุบัน ต่อมาในปี ค.ศ. 2017 ทาง endocrine society ของสหรัฐอเมริกา ได้ตีพิมพ์ clinical practice guideline สำหรับการดูแลด้านฮอร์โมนในกลุ่ม transgender (3-5) ประเทศออสเตรเลียก็ได้ออกแนวทางการดูแล transgender ในปี ค.ศ.2018 (6) ส่วนหน่วยงานทางสูตินรีเวชเช่น American college of Obstetrics and Gynecology ได้ตีพิมพ์ committee opinion ในการดูแลกลุ่มเพศหลากหลายในปี ค.ศ. 2011 (reaffirmed ในปี ค.ศ.2019) (4) และแนวทางดูแลวัยรุ่นที่มีเพศหลากหลายเมื่อปี ค.ศ. 2017 (5) นอกจากนี้ American society of reproductive medicine ยังได้ออกแนวทางการให้บริการด้านภาวะเจริญพันธุ์ในกลุ่มเพศหลากหลายในปี ค.ศ. 2015 อีกด้วย (7)
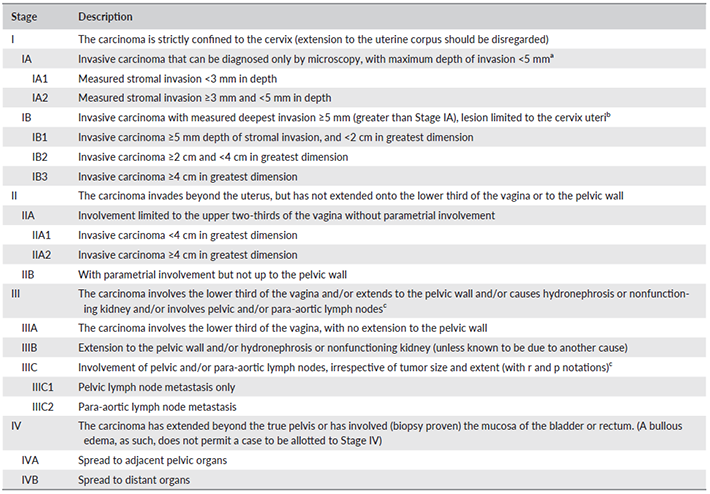
การวินิจฉัย
ในปัจจุบันการวินิจฉัยได้เปลี่ยนทิศทางจากการพยายามระบุความแตกต่างทางเพศของบุคคล (gender identity disorder) ไปสู่การระบุความทุกข์ด้านจิตใจ (Gender dysphoria) ที่เกิดจากความอึดอัดขับข้องใจในความไม่เข้ากันของเพศกำเนิดและอัตลักษณ์ทางเพศ โดยแนวทางการวินิจฉัย gender dysphoria ในปัจจุบันจะอ้างอิงตาม criteria ของ DSM 5 ที่จัดทำขึ้นโดย American Psychiatric Association (APA) ในปี ค.ศ. 2013 โดยเกณฑ์การวินิจฉัยแสดงใน Figure 1 (8)

Figure 1DSM5 criteria for gender dysphoria (3, 8)
การพัฒนาของเพศสภาพ
อัตลักษณ์ทางเพศเป็นผลรวมของปัจจัยหลายด้านทั้งด้านชีววิทยา เพศวิทยา และจิตวิทยา เกิดอย่างค่อยเป็นค่อยไปตั้งแต่วัยเด็ก เป็นกระบวนการเรียนรู้ผ่านการปฏิสัมพันธ์ต่อครอบครัว เพื่อน และ สิ่งแวดล้อม โดยพบว่าภาวะ gender dysphoria ในวัยเด็กมักจะหายไปเองก่อนเข้า puberty และมีเพียง 15% ของเด็กที่มี gender dysphoria เท่านั้นที่ต้องการปรับเปลี่ยนลักษณะภายนอกเมื่อเป็นวัยรุ่นหรือวัยผู้ใหญ่ อย่างไรก็ตามความรุนแรงของภาวะ gender dysphoria ในเด็กสามารถใช้คาดคะเนแนวโน้มได้ กล่าวคือในเด็กที่มี gender dysphoria รุนแรง จะมีโอกาสที่ภาวะดังกล่าวจะเป็นต่อเนื่องจนถึงวัยผู้ใหญ่ และความทุกข์ใจที่ต่อเนื่องส่งผลให้พบภาวะทางจิตเวชร่วมได้บ่อย เช่น ภาวะวิตกกังวล และ ซึมเศร้า เป็นต้น
เนื่องจากวัยรุ่นเป็นช่วงวัยที่มีการเปลี่ยนแปลงสรีระทางกายเป็นแบบชายหรือหญิงชัดเจน ทำให้ภาวะ gender dysphoria แย่ลงอย่างมาก อย่างไรก็ตาม Gender dysphoria ไม่จำเป็นต้องปรากฏตั้งแต่เด็ก สามารถปรากฏใหม่ในช่วงวัยรุ่นหรือวัยผู้ใหญ่ได้
Transgender care
ควรดูแลแบบองค์รวมทั้งทางกาย ทางจิตใจ สิ่งแวดล้อม และ สังคม ทีมผู้ดูแลจึงควรประกอบด้วยสหสาขาวิชาชีพ (Multidisciplinary Team) อาทิ จิตแพทย์ แพทย์ผู้ดูแลเรื่องฮอร์โมน และ ศัลยแพทย์ รวมไปถึงนักสังคมสงเคราะห์ และนักจิตวิทยาเป็นต้น โดยเป้าหมายของการรักษานั้นจะแตกต่างกันขึ้นกับความต้องการของผู้ป่วยเป็นหลัก การรักษาจะประกอบไปด้วย psychological support, social transitioning, Hormonal treatment และ sex reassignment surgery
การดูแลเบื้องต้น
- ประเมินเพศ และ เพศสภาพ,โรคทางอายุรกรรม, โรคทางจิตเวช รวมถึงประเมินครอบครัว และ สิ่งแวดล้อม
- วินิจฉัยภาวะ Gender dysphoria ตามเกณฑ์การวินิจฉัยของ DSM-V ตาม figure 1 และควรระมัดระวังโรคทางจิตเวชที่มีอาการคล้ายคลึง อาทิ Body dysmorphic disorder, Body identity integrity disorder, Eunuchism
- ให้ความรู้เกี่ยวกับภาวะ Gender dysphoria, วิธีการรักษา, ความสามารถในการเปลี่ยนแปลง, ข้อจำกัด, ประโยชน์ และ ความเสี่ยงของการรักษา ที่สำคัญควรแก้ความเข้าใจผิดเกินจริงของผลการรักษารวมถึงให้ความรู้ถึงผลกระทบต่อการเจริญพันธ์ และ ปรึกษาเรื่องการรักษาความสามารถในการเจริญพันธ์ก่อนการรักษา หากผู้รับคำปรึกษายังไม่บรรลุนิติภาวะ ควรมีผู้ปกครองร่วมตัดสินใจ
- รักษาโรคทางอายุรกรรมและจิตเวชที่มีอยู่ พิจารณาส่งต่อแพทย์ผู้เชี่ยวชาญรักษาด้วยฮอร์โมน หรือ ผ่าตัดเมื่อครบเกณฑ์ที่กำหนด
Psychological assessment
ก่อนเริ่มการรักษาทั้งหมด ควรได้รับการประเมินจากจิตแพทย์ที่มีความเชี่ยวชาญ เนื่องจากภาวะทางจิตใจอื่น ๆ อาจจะมีอาการแสดงที่คาบเกี่ยวกับภาวะ gender dysphoria ได้ การวินิจฉัยที่ผิดพลาดจะนำสู่การรักษาที่ไม่เหมาะสม และอาจจะเกิดความเสียใจหลังการได้รับฮอร์โมนข้ามเพศหรือการผ่าตัดแปลงเพศ นอกจากนี้กลุ่มผู้มีความหลากหลายทางเพศมีความเสี่ยงสูงต่อโรคทางจิตใจเช่นภาวะซึมเศร้าหรือวิตกกังวล ซึ่งต้องการการดูแลรักษาจากผู้ที่เชี่ยวชาญ และควรได้รับการรักษาจนอาการด้านจิตใจอยู่ในภาวะสงบและมีความสามารถในการตัดสินใจอย่างครบถ้วนเสียก่อน จึงค่อยตัดสินใจเริ่มการรักษาด้วยฮอร์โมนหรือการผ่าตัด
การเปลี่ยนแปลงทางสังคม(Social transitioning)
เป็นการเปลี่ยนการแสดงออกทางเพศ และ บทบาททางเพศไปเป็นแบบเพศที่ต้องการ และให้สังคมรับรู้ เพื่อลองดูว่าผลจากการเปลี่ยนนี้เป็นไปอย่างที่คาดหวังหรือไม่ ภาวะ gender dysphoria ดีขึ้นหรือไม่ โดยสามารถเลือกเปลี่ยนแปลงเป็นบางช่วงเวลา หรือตลอดเวลาก็ได้ตามความพร้อมของแต่ละบุคคล การเปลี่ยนแปลงทางสังคมควรทำร่วมกับการทำจิตบำบัด และควรมีจิตแพทย์ผู้เชี่ยวชาญคอยให้คำแนะนำในช่วงเปลี่ยนแปลง การทำ social transitioning ช่วยทำให้ยอมรับตนเอง และสามารถเลือกทางที่เหมาะตามเพศสภาพของตนได้ดีขึ้น โดย Social transitioning นี้สามารถเริ่มก่อนการรับฮอร์โมนหรือเริ่มพร้อมๆกับการใช้ฮอร์โมนก็ได้
Psychosocial support
การศึกษาที่ผ่านมาพบว่ากลุ่มคนข้ามเพศมีโอกาสเป็นโรควิตกกังวล โรคซึมเศร้า โรคย้ำคิดย้ำทำสูงกว่าทั่วไป รวมทั้งมีอัตราการทำร้ายตนเองและการฆ่าตัวตายสูง การยอบรับ สนับสนุนจากคนรอบข้างและสังคมเป็นปัจจัยสำคัญที่จะช่วยให้คนข้ามเพศสามารถก้าวข้ามความขัดแย้งในใจ ยอมรับในตัวตน และสามารถใช้ชีวิตในเพศที่ต้องการเป็นได้จริงอย่างมีความสุข
การรักษาโดยใช้ฮอร์โมน(Gender-Affirmation Hormonal treatment)
เมื่อผ่านการประเมินจากผู้เชียวชาญด้านจิตเวชแล้ว และมีความเหมาะสมที่จะเริ่มการใช้ฮอร์โมนได้ ผู้ป่วยควรได้รับข้อมูลและเข้าใจเกี่ยวกับข้อดีข้อเสีย และผลที่จะเกิดขึ้น ทั้ง reversible และ irreversible อย่างครบถ้วนเสียก่อน นอกจากนี้ ยังควรคำนึงถึงการเก็บรักษาภาวะเจริญพันธุ์และให้ทางเลือกในการเก็บก่อนที่จะเริ่มการรักษาเสมอ
Transwoman
การบริหารยาในหญิงข้ามเพศนั้นมีความซับซ้อนมากกว่าชายข้ามเพศเนื่องจาก Estrogen ใน physiologic level ไม่สามารถกดปริมาณ Testosterone ได้เพียงพอ จึงต้องใช้ฮอร์โมน 2 ชนิดคู่กันคือ Estrogen และ Androgen lowering agent โดยมีเป้าหมายระดับฮอร์โมนในเลือดเทียบเท่ากับหญิงวัยเจริญพันธุ์คือ ระดับ Testosterone < 50 ng/dl และ ระดับ Estradiol = 100-200 pg/ml
Estrogen ที่นิยมใช้คือ Estradiol valerate และ Estradiol Cypionate โดยให้ขนาด 2-6 มิลลิกรัมต่อวันในรูปแบบรับประทาน, 0.025-0.2 มิลลิกรัมต่อวันในรูปแบบผ่านผิวหนัง และ 5-30มิลลิกรัมทุก 2 อาทิตย์ในรูปแบบฉีดกล้ามเนื้อ(Figure 4) ไม่แนะนำให้ใช้ Ethinyl Estradiol เนื่องด้วยความเสี่ยงลิ่มเลือดอุดตันสูงสุด และ ยังไม่สามารถวัดระดับเลือดได้อีกด้วย ผลจากการใช้ Estrogen คือกดการผลิต Testosterone กระตุ้นการเปลี่ยนแปลงร่างกายให้แสดงความเป็นหญิง และ ปกป้องมวลกระดูกโดยเฉพาะในรายที่ผ่าน Gonadectomy ผลข้างเคียงจาก Estrogen ที่สำคัญคือภาวะลิ่มเลือดอุดตันซึ่งพบมาที่สุดในรูปแบบรับประทานเนื่องจากผ่านกระบวนการ First pass effect ต่างจากรูปแบบผ่านผิวหนัง และ ฉีดซึ่งมีประโยชน์มากในใช้ฮอร์โมนในวัยสูงอายุ ภาวะลิ่มเลือดอุดตันนอกจากขึ้นกับรูปแบบการได้รับฮอร์โมนแล้วยังขึ้นกับปริมาณ จึงควรเฝ้าระวังไม่ให้ระดับ Estrogen ในเลือดมากเกิน 200 pg/ml ไม่แนะนำให้ติดตามระดับ D-dimer ควรหลีกเลี่ยงการใช้ฮอร์โมนในรายที่มีประวัติภาวะลิ่มเลือดอุดตันหรือมีประวัติครอบครัวชัดเจน Androgen lowering agent ที่ใช้คือ Cyproterone acetate โดยให้ขนาด 25-50 มิลลิกรัมต่อวัน Spironolactone 100-300 มิลลิกรัมต่อวัน และ GnRH agonist 3.75 มิลลิกรัม ทุก1เดือน ผลข้างเคียงหรือข้อด้อยของ Androgen lowering agent คือ Cyproterone acetate จะเพิ่มความเสี่ยงในการเกิด Meningioma, Hyperprolactinemia และ Depression Spironolactone สามารถทำให้โพแทสเซียมในร่างกายต่ำ และ GnRH agonist ข้อเสียคือราคาที่สูง Androgen lowering agent ประเภท Peripheral androgen blocker เช่น Flutamide, Dutasteride ไม่สามารถลดระดับ Androgenได้เพียงพอ(3)
Second-line therapyได้แก่ Progestin หรือ Medroxyprogesterone ลดปริมาณ Testosteroneและเชื่อว่าช่วยกระตุ้นการพัฒนาเต้านมแต่ไม่มีการศึกษาชัดเจนในส่วนดังกล่าว ทั้งยังเพิ่มความเสี่ยงลิ่มเลือดอุดตันจึงไม่นิยมใช้progestinอย่างเป็นประจำ Finesteride หรือ 5alpha reductase inhibitor ช่วยรักษาอาการผมร่วง(Male pattern hair loss) ในรายที่ Extrogen ได้ระดับแล้วผมยังคงไม่หยุดร่วง แต่ไม่แนะนำให้ใช้ประจำ เนื่องจากผลข้างเคียง Sexual dysfunction และ Depression(9)
Feminization เป็นการเปลี่ยนแปลงสรีระของร่างกายให้มีความเป็นหญิง(Figure 2) การเปลี่ยนแปลงเต้านมเป็นการเปลี่ยนแปลงที่มีความสำคัญอันดับต้นที่ให้ความสำคัญ ผลจากฮอร์โมนสูงสุดเมื่อ 2 ปี และพบว่าน้อยกว่า 20% เต้านมพัฒนาถึง Tanner stage 4-5 สัดส่วนสรีระเป็นหญิงมากขึ้น คือ ลดปริมาณกล้ามเนื้อ เพิ่มไขมันบริเวณสะโพก และ ต้นขา เสียงไม่มีการเปลี่ยนแปลงจากฮอร์โมน ซึ่งสามารถทำ Voice training exercise, Laryngeal surgical treatmentได้ ขนบริเวณหน้าและลำตัวลดลง หากไม่สามารถลดได้ทั้งหมดสามารถทำเลเซอร์กำจัดขนร่วมได้ คะแนน Ferriman-Gallowayดีขึ้นใน 2 ปี หยุดผมร่วงแบบผู้ชาย(9)

Figure 2Feminizing (3)
การใช้ Estrogen ควรมีการติดตามที่ได้มาตรฐานเพื่อเฝ้าระวังผลข้างเคียงตาม(Figure 3) ติดตามระดับฮอร์โมนทั้ง Estrogen และ Testosterone หลีกเลี่ยงฮอร์โมนเกินระดับซึ่งเพิ่มความเสี่ยงต่อลิ่มเลือดอุดตัน,ตับทำงานผิดปกติ และ ความดันสูง ติดตามระดับ Prolactin เนื่องจากสามารถขึ้นผิดปกติได้จาก Estrogen และ Cyproterone acetate เนื่องจากกระตุ้นการเจริญเติบโตของ Lactrotroph cells จนทำให้เกิด Prolactinoma พบราว 20% และมักเป็นชนิด Microprolactinoma ในรายที่ใช้ Spironolactone ควรติดตามระดับโพแทสเซียม เฝ้าระวังความเสี่ยงต่อมะเร็งอันได้แก่ มะเร็งเต้านมความเสี่ยงเทียบเท่ากับหญิงทั่วไป แนะนำให้มีการตรวจคัดกรองตามหญิงทั่วไปหากไม่มีความเสี่ยงอื่นเพิ่มเติม มะเร็งเต้านมในหญิงข้ามเพศมักปรากฎในระยะสุดท้ายซึ่งต่างจากชายข้ามเพศที่มักพบในระยะเริ่มต้น มะเร็งต่อมลูกหมากเป็นมะเร็งที่ถูกกระตุ้นด้วยฮอร์โมนเพศดังนั้นในสภาวะที่มี Testosterone ต่ำจึงไม่ควรเกิดขึ้น อีกทั้ง Estrogen ไม่กระตุ้น Hypertrophy/Premalignant ของต่อมลูกหมาก จึงทำให้โดยรวมลดความเสี่ยงต่อการเป็นมะเร็งต่อมลูกหมาก แต่ยังมีรายงานต่อมลูกมากโต และ มะเร็งต่อมลูกหมาก จึงแนะนำให้ติดตามโดยการตรวจ per rectal examination และระดับ PSA ทุกปีตั้งแต่อายุ 50 ปีในรายที่ เริ่มฮอร์โมนตอนอายุมากกว่า 20 ปี
ความเสี่ยงด้านหัวใจและหลอดเลือดยังเป็นที่ถกเถียง เนื่องจากการเปลี่ยนแปลงไขมันเป็นในทางที่ดี ระดับ LDLลดลง HDL triglycerides เพิ่มขึ้น แต่น้ำหนัก, ความดัน และ ระดับ Insulin resistance เพิ่มขึ้น (3)

Figure 3 Follow up Transwoman (3)

Figure 4 Hormone regimen (3)
Transman
การบริหารยาในชายข้ามเพศนั้นมีความง่ายกว่าหญิงข้ามเพศ เพียงTestosterone อยู่ในระดับจะสามารถกดการผลิตของ Estrogen ได้อย่างสมบูรณ์ Testosterone ที่นิยมใช้คือTestosterone enanthate/cypionate 100-200 mg ทุก 2 อาทิตย์, Testosterone gel 50-100 มิลลิกรัมต่อวัน Testosterone patch 2.5-7.5 มิลลิกรัมต่อวัน(Figure 4) Testosterone ในรูปแบบของ Oral 17-alkylate testosterone ไม่แนะนำเนื่องจากทำอันตรายให้ตับอย่างรุนแรง Testosterone ช่วยกดการสร้าง Estrogen เปลี่ยนแปลงสรีระร่างกายให้มีความเป็นชายมาก ลดอาการวัยทอง และ กระดูกพรุน ก่อนการใช้ฮอร์โมนควรตรวจข้อห้ามก่อนโดยข้อห้ามเด็ดขาดของ Testosterone คือการตั้งครรภ์ ข้อห้ามอื่นๆเช่น ความดันสูงชนิดรุนแรง, นอนกรน, Polycytemia รวมถึงประเมินภาวะที่สามารถเป็นหนักขึ้นหากได้ฮอร์โมนคือ หัวใจล้มเหลว และ Polycytemia (3)
หากมีอาการเลือดออกผิดปกติ(Abnormal uterine bleeding) ซึ่งมักเกิดจากระดับ Testosterone ไม่เพียงพอ สามารถแก้ไขโดย Oral progesterone : Oral Lynestrenol/Medroxyprogesterone 5-10 mg/d, Endometrial ablation และ ใช้ GnRH analogue/DMPA เพื่อหยุดประจำเดือนในช่วงก่อนการเริ่มฮอร์โมน
Masculinizing เป็นการเปลี่ยนแปลงสรีระของร่างกายให้มีความเป็นชาย(รูปภาพที่ 3) ประจำเดือนเริ่มหยุดในเวลาที่ต่างกันตั้งแต่ 1-12 เดือน, มีคลิตอริสโตขึ้น, เพิ่มความต้องการทางเพศ สรีระรูปร่างเริ่มคล้ายชายมากขึ้นคือ กล้ามเนื้อเพิ่มขึ้น การกระจายของไขมันเป็นไปตามรูปลักษณ์ของชาย เสียงทุ้มมากขึ้น แต่พบว่า 10% ไม่มีการเปลี่ยนแปลงของเสียงจึงต้องทำ Voice therapy ร่วมด้วย ขนเพิ่มมากขึ้น เพิ่ม Ferriman-Galloway score แต่อาจพัฒนาผมร่วงแบบ Androgenic alopecia ได้ ซึ่งสามารถรักษาด้วย Finesteride 1mg/d นาน 12 เดือน นอกจากนี้ยังเพิ่มสิวทั้งบริเวณหน้า และ หลังอีกด้วย อย่างไรก็ตามยังมีข้อจำกัดเรื่องส่วนสูงและรูปทรงของกระดูกที่เปลี่ยนแปลงไม่ได้(9)(Figure 5)
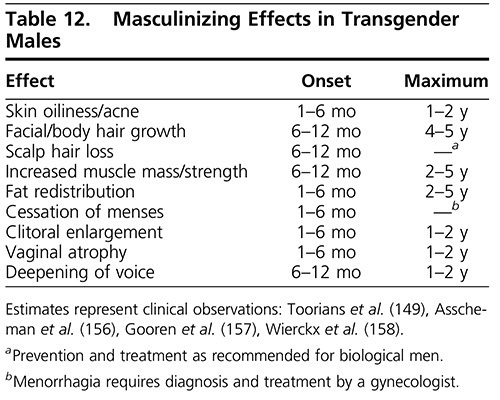
Figure 5 Masculinizing (3)
การใช้ Testosterone ควรมีการติดตามที่ได้มาตรฐานเพื่อเฝ้าระวังผลข้างเคียงตามรูปภาพที่ 6 ติดตามระดับฮอร์โมนอย่างสม่ำเสมอเพื่อป้องกันระดับฮอร์โมนที่สูงเกินจะเกิดผลข้างเคียง และ ต่ำกว่ามาตรฐานจนไม่สามารถรักษามวลกระดูก วัดระดับความเข้มข้นเลือดเพื่อเฝ้าระวัง polycythemia รวมถึงติดตามน้ำหนัก ความดัน และ ระดับไขมันอย่างสม่ำเสมอ ติดตามความเสี่ยงมะเร็ง มะเร็งเต้านมยังแนะนำให้ตรวจคัดกรองคล้ายหญิงเนื่องจากยังมีรายงานมะเร็งเต้านมแม้จะผ่านการตัดเต้านมมาแล้ว ซึ่งมักเกิดบริเวณที่เป็น Subareola area และมาในระยะเริ่มต้น มะเร็งมดลูกตามทฤษฎีแล้วการได้รับ Testosterone เข้าไปสามารถเปลี่ยนเป็น Estrogen ได้และกระตุ้นให้เกิด Endometrium hyperplasia และ Endometrial carcinoma ตามมาแต่ในความเป็นจริงพบการรายงานมะเร็งมดลูกในชายข้ามเพศน้อย อีกทั้งในรายที่ทาน Testosterone และเข้ารับการผ่าตัดนำมดลูกออกพบผลพยาธิของมดลูกส่วนใหญ่เป็น Atrophic endometrium อีกด้วย อย่างไรก็ตามยังคงแนะนำการผ่าตัดนำมดลูกเพื่อลดความเสี่ยงอยู่ดี โดย Laparoscopic เป็นวิธีการมาตรฐาน หรือจะผ่าตัดทางช่องคลอดก็ไม่เป็นข้อห้ามเช่นกัน มะเร็งรังไข่ยังมีรายงานแต่ไม่พบความเสี่ยงที่เพิ่มขึ้น มะเร็งปากมดลูกหากยังไม่ได้รับการตัดมดลูกยังคงแนะนำให้มาตรวจมะเร็งปากมดลูกทุกปีตามหญิงทั่วไป(3)
ความเสี่ยงด้านหัวใจและหลอดเลือดยังไม่แน่ชัด พบว่าลักษณะของไขมันเป็นไปในทางไม่ดีคือ เพิ่มระดับ LDL, Triglycerides และลดระดับ HDL ส่วนของ Insulin resistance ผลการศึกษายังกำกวม Testosterone เพิ่มระดับ Hemoglobin และ Hematocrit แต่ไม่เพิ่มความเสี่ยงลิ่มเลือดอุดตัน การตรวจคัดกรองภาวะ Thrombophilia ในทุกคนที่ไม่แนะนำเช่นกัน (3)

Figure 6 Follow up Transman (3)
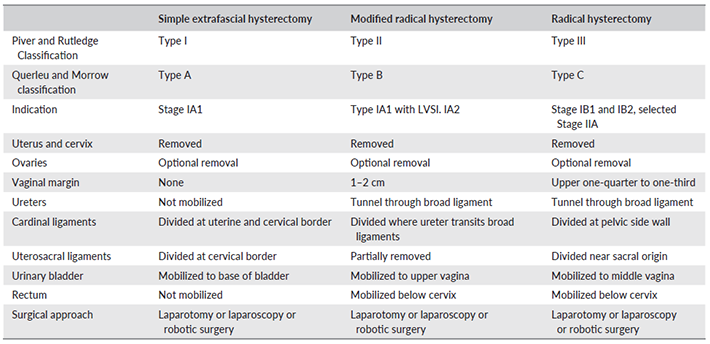
Gender-Affirming Surgery
มีเพียงครึ่งหนึ่งเท่านั้นที่ต้องการการผ่าตัด และมุมมองการผ่าตัดอาจเป็นเป้าหมายสูงสุดของการเปลี่ยนแปลงทางกาย แบ่งออกเป็น 2 ประเภทคือ 1. การผ่าตัดที่ไม่มีผลกระทบต่อการเจริญพันธ์ เช่น การผ่าตัดเต้านม การผ่าตัดเสริมความงาม 2.การผ่าตัดที่มีผลต่อการเจริญพันธ์ เช่น Gonadectomy การเปลี่ยนแปลงครั้งนี้เป็นการเปลี่ยนแปลงแบบ Irreversible ดังนั้นผู้ที่ได้รับการผ่าตัดควรมีนิติภาวะที่เหมาะสมอย่างน้อยอายุต้องมากกว่า 18 ปี แต่ WHO ได้กล่าวว่าอายุไม่ควรเป็นข้อบ่งชี้เดียว หากพบว่า Social transition, ผลจากการเปลี่ยนแปลงของฮอร์โมน ไม่เป็นที่พอใจ รวมถึงยังมีความลังเลในการผ่าตัด ไม่แนะนำให้ทำการผ่าตัด หากทานฮอร์โมนควรทานเป็นเวลาอย่างน้อย 1 ปีก่อนการผ่าตัดยกเว้นไม่ต้องการทานฮอร์โมน หรือมีข้อห้ามทางการแพทย์ และมีการลงความเห็นทั้งจากจิตแพทย์ และ แพทย์ที่ดูแลเรื่องฮอร์โมนว่าสามารถทำการผ่าตัดได้ตามข้อบ่งชี้ทางการแพทย์(Figure 7) ผู้แปลงเพศที่ตรงตามข้อบ่งชี้ตามรูปภาพที่ 7 ระยะเวลาในการผ่าตัดที่ไม่มีผลต่อการเจริญพันธุ์ขึ้นกับหลายปัจจัยทั้งสุขภาพจิต กฎหมายของแต่ละประเทศ ไม่มีอายุกำหนดไว้แน่นอน(3)

Figure 7 Criteria for Gender-Affirming Surgery (3)
Transwoman
การผ่าตัดที่มีผลต่อการเจริญพันธ์คือ Gonadectomy, Penectomy, vaginoplasty และ reconstructive surgery การทำ Vaginoplasty หรือ Neovagina สามารถทำได้โดยการกลับหนังpenileเข้าหรือจะใช้จากลำใส้ได้เช่นกัน Reconstructive surgery เป็นการผ่าตัดอวัยวะเพศภายนอกให้คล้ายเพศหญิงโดยจะดัดแปลง Scrotum เป็น Labia majora สร้าง Labia minora, Critoris and hood ขึ้นมาใหม่ การผ่าตัดควรระวังไม่ตัดเส้นประสาท ในบางครั้งอาจสร้างจุดรวมเส้นประสาทเทียบเท่า G spot ในผู้หญิง ผลข้างเคียงที่พบได้หลังผ่าตัดคือ Prolapse neovagina, Rectovaginal fistula, แผลรักษาตัวช้า และ ช่องคลอดตีบแคบแนะนำให้ถ่างขยายสม่ำเสมอหลังผ่าตัด(10)
การผ่าตัดอื่นที่ไม่มีผลต่อการเจริญพันธ์ เช่น Laryngeal surgery เพื่อเปลี่ยนเสียงให้มีความนุ่มนวลขึ้นแต่ไม่พบความแตกต่างของคุณภาพชีวิตอย่างมีนัยสำคัญ Breast surgery แนะนำให้รอจนรับประทานฮอร์โมนไปอย่างน้อย 2 ปีจึงพิจรณาผ่าตัดเสริมหน้าอกเพื่อรอให้ฮอร์โมนออกฤทธิ์ได้เต็มที่ก่อนนั่นเอง Removal hair การทำเลเซอร์เพื่อลดขนที่ไม่จำเป็นออก(10)
Transman
การผ่าตัดแปลงเพศในเพศชายควรรอ1-2ปี หลังทานAndrogen การผ่าตัดที่มีผลต่อการเจริญพันธ์คือ Complete hysterectomy, Oophorectomy, Vaginectomy สามารถผ่าตัดผ่านการส่องกล้องหรือ ทางช่องคลอดได้เช่นกัน การสร้าง Neopenis เป็นการผ่าตัดที่หลายขั้นตอน ราคาสูง และ มีความพึงพอใจหลังผ่าตัดที่ต่ำต่างจากการผ่าตัดแปลงเพศหญิงข้ามเพศ วิธีการผ่าตัดในปัจจุบันคือการทำ flap ซึ่ง Radical forearm flap เป็นส่วนที่นิยมมากที่สุด สามารถทำให้ Neopenis แข็งตัวได้โดยการนำเส้นประสาทมาต่อเข้าที่กล้ามเนื้อ flap และฝึกฝนให้กล้ามเนื้อหดตัว หรือ ทำโดยการใส่ Medical device เข้าไปแทน(10)
การผ่าตัดที่ไม่มีผลต่อการเจริญพันธ์ เช่น Metaloidoplasty คือการดึง Clitoris มาด้านหน้าทำให้สามารถยืนปัสสาวะได้คล้ายผู้ชาย Create scrotum สร้างจาก Labia majora และใส่ถุงอัณฑะเทียมเข้าไปแทน Mastectomy เป็นการผ่าตัดที่สำคัญในการสร้างลักษณะให้คล้ายชาย โดยส่วนใหญ่ขนาดหน้าอกจะเล็กลงหากใช้ Testosterone การผ่าตัดสามารถทำก่อนอายุ 18 ปีโดยระยะเวลาที่ทำขึ้นกับแต่ละบุคคล(10)
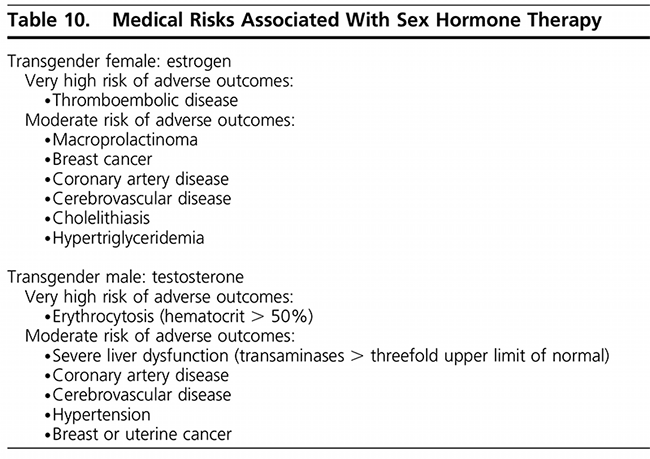
Figure 8 Medical Risk Associated with Sex Hormone Therapy (3)
Reference
1. Coleman E, Bockting W, Botzer M, Cohen-Kettenis P, DeCuypere G, Feldman J, et al. Standards of Care for the Health of Transsexual, Transgender, and Gender-Nonconforming People, Version 7. International Journal of Transgenderism. 2012;13(4):165-232.
2. Michael Lipka. Gay Marriage Around the World. 2017. Available from: http://www.pewforum.org/2017/08/08/gay-marriage-around-the-world-2013/.
3. Hembree WC, Cohen-Kettenis PT, Gooren L, Hannema SE, Meyer WJ, Murad MH, et al. Endocrine Treatment of Gender-Dysphoric/Gender-Incongruent Persons: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2017;102(11):3869-903.
4. Committee on Health Care for Underserved W. Committee Opinion no. 512: health care for transgender individuals. Obstet Gynecol. 2011;118(6):1454-8.
5. Committee on Adolescent Health C. Committee Opinion No. 685: Care for Transgender Adolescents. Obstet Gynecol. 2017;129(1):e11-e6.
6. Telfer MM, Tollit MA, Pace CC, Pang KC. Australian standards of care and treatment guidelines for transgender and gender diverse children and adolescents. Med J Aust. 2018;209(3):132-6.
7. Ethics Committee of the American Society for Reproductive Medicine. Access to fertility services by transgender persons: an Ethics Committee opinion. Fertil Steril. 2015;104(5):1111-5.
8. American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders 5th edition. American Psychiatric Association 2013;Arlington:451-9.
9. Guy T’Sjoen JA, Louis Gooren. Endocrinology of transgender medicine. Endocrine Reviews. 2019;40(1):20.
10. Joshua D. Safer VT. Care of Transgender Persons. The New England journal of medicine. 2019;381:10.