เยื่อบุโพรงมดลูกหนาตัวผิดปกติ (Endometrial hyperplasia)
เยื่อบุโพรงมดลูกหนาตัวผิดปกติ (Endometrial hyperplasia)
พญ.ดาราณี มีเงินทอง
อ.ที่ปรึกษา ผศ.นพ.สิทธิชา สิริอารีย์
เยื่อบุโพรงมดลูกหนาตัวผิดปกติ (Endometrial hyperplasia) เกิดจากการเพิ่มปริมาณของต่อมเยื่อบุโพรงมดลูก ทำให้เกิดต่อมมีขนาดและรูปร่างผิดปกติไป มีการเพิ่มของอัตราส่วนของต่อมในโพรงมดลูกต่อสโตรมา (stroma) ซึ่งการได้รับเอสโตรเจนพียงอย่างเดียวและเป็นเวลานานทำให้เกิดการหนาตัวของเยื่อบุโพรงมดลูกผิดปกติได้ (Endometrial hyperplasia) ซึ่งหากไม่ได้รับการรักษาที่เหมาะสมอาจกลายเป็นมะเร็งเยื่อบุโพรงมดลูกได้ (Cancer precursor lesion)[1]มะเร็งเยื่อบุโพรงมดลูก (Endometrial cancer) เป็นมะเร็งทางระบบสืบพันธุ์ทางนรีเวชที่พบมากที่สุดในประเทศที่มีรายได้สูง และพบเป็นอันดับ 4 ในทุกเชื้อชาติสำหรับในประเทศไทยพบมะเร็งเยื่อบุโพรงมดลูกรองจากมะเร็งปากมดลูกและมะเร็งรังไข่ (ตารางที่ 1)โดยจะพบในสตรีก่อนหมดประจำเดือน 25% และสตรีอายุน้อยกว่า 40 ปี 2.5-14.4 %[2]มะเร็งเยื่อบุโพรงมดลูกแบ่งเป็น 2 ชนิด[3] คือ
- ชนิดที่ 1 สัมพันธ์กับการได้รับฮอร์โมนเอสโตรเจนอย่างเดียวและเป็นเวลานาน (Unopposed estrogen) อ้วน เบาหวาน ความดันโลหิตสูง ภาวะไม่ตกไข่เรื้อรัง มีบุตรยาก และสัมพันธ์กับการหนาตัวผิดปกติของเยื่อบุโพรงมดลูก(Endometrial hyperplasia) โดยลักษณะทางพยาธิวิทยาจะไม่รุนแรง เช่น เอ็นโดเมทริออยด์ (Endometrioid)
- ชนิดที่ 2 ไม่สัมพันธ์กับการได้รับฮอร์โมนเอสโตรเจน มักมีลักษณะทางพยาธิวิทยาที่รุนแรง เช่น Clear cell หรือ Serous carcinoma โดยพยากรณ์โรคจะไม่ดี
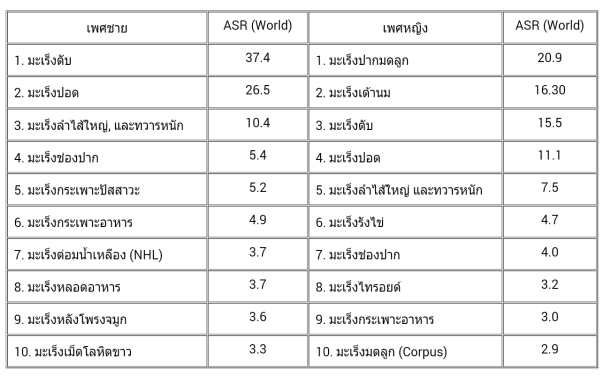
ตารางที่ 1แสดงโรคมะเร็งที่พบบ่อยในประชากรไทยจัดอันดับตามอัตราส่วนต่อประชากร 100,000 คน เปรียบเทียบกับประชากรโลกในวัยเดียวกัน (ASR, World) [4]
ปัจจัยเสี่ยงที่ทำให้เกิดเอสโตรเจนสูง ได้แก่ ไม่มีบุตร(Nulliparity) ประจำเดือนมาเร็วเข้าสู่วัยหมดประจำเดือนช้า ประจำเดือนมาไม่สม่ำเสมอ อ้วน เบาหวานชนิดที่ 2 โรคถุงน้ำรังไข่ (Polycystic ovarian syndrome) โรคเมตาบอลิก(Metabolic syndome) ได้รับการักษาด้วยเอสโตรเจนเพียงตัวเดียว รับยาทาม็อกซิเฟน (Tamoxifen) มีก้อนเนื้องอกที่หลั่งเอสโตรเจน (ตารางที่ 2)
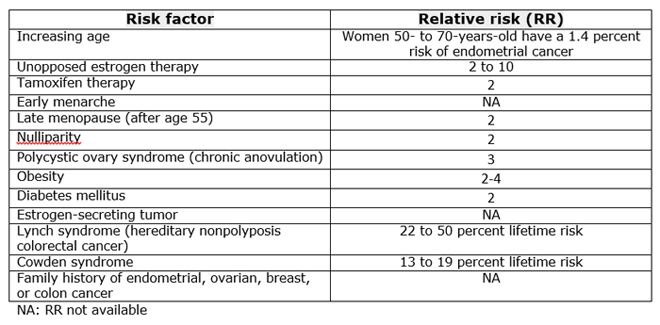
ตารางที่ 2 แสดงปัจจัยเสี่ยงที่ทำให้เกิดมะเร็งเยื่อบุโพรงมดลูกและความเสี่ยงสัมพัทธ์(อัตราส่วนของความน่าจะเป็นมะเร็งเยื่อบุโพรงมดลูก ในกลุ่มที่ได้รับและไม่ได้รับปัจจัยเสี่ยง)[5]
ผู้ป่วยที่เป็นเยื่อบุโพรงมดลูกหนาตัวผิดปกติ มักมาพบแพทย์ด้วยอาการเลือดออกผิดปกติจากโพรงมดลูก อาจจะมีปริมาณมาก บางครั้งอาจมีอาการปวดท้องน้อยร่วมด้วย ลักษณะประจำเดือนมาไม่สม่ำเสมอเหมือนคนไม่ตกไข่[6] หรืออาจพบความผิดปกติจากการตรวจแปบสเมียร์ (PAP smear)แต่ไม่มีเลือดออกผิดปกติทางช่องคลอดก็ได้
การหนาตัวของเยื่อบุโพรงมดลูกผิดปกติ (Endometrial hyperplasia) แบ่งตาม WHO ได้เป็น 4 ชนิด[7] ได้แก่
- Simple hyperplasia without atypia : ต่อมจะขยายหรือมีลักษณะเป็นถุงน้ำ (cyst) กลม รูปร่างไม่เรียบเล็กน้อยอัตราส่วนของต่อมต่อสโตรมาเพิ่มขึ้น โดยต่อมจะไม่หนาแน่นมาก ไม่มีลักษณะของ cytologic atypia
- Complex hyperplasia without atypia: ลักษณะของต่อมหนาแน่นขึ้น มีการแตกสาขา สโตรมาระหว่างต่อมน้อยลง อัตราส่วนของต่อมต่อสโตรมาเพิ่มขึ้นมากกว่า 50% ไม่มีลักษณะของ cytologic atypia
- Simple atypical hyperplasia
- Complex atypical hyperplasia: ปริมาณต่อมมาก ต่อมบุด้วย atypical cell
ชนิดที่ 3 และ 4 คือ มี Cytologic atypia คือ nuclei ขนาดใหญ่ หลากหลายขนาดและรูปร่าง อัตราส่วนของนิวเคลียสต่อไซโตพลาสซัมเพิ่มขึ้น โครมาตินจับเป็นก้อน
|
ชนิดของการหนาตัวผิดปกติ |
อัตราการกลายเป็นมะเร็ง (%) |
|
Simple hyperplasia without atypia |
1 |
|
Complex hyperplasia without atypia |
3 |
|
Simple atypical hyperplasia |
8 |
|
Complex atypical hyperplasia |
29 |
ตารางที่ 4 แสดงการกลายเป็นมะเร็งของการหนาตัวผิดปกติของมดลูกแต่ละชนิด หากไม่ได้รับการรักษา[8]
การวินิจฉัย
การประเมินเยื่อบุโพรงมดลูกเพื่อให้ได้การวินิจฉัยในสตรีที่มีความเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูกหรือระยะก่อนเป็นมะเร็ง การสุ่มตรวจชิ้นเนื้อเยื่อบุโพรงมดลูก(Endometrial sampling) ถือเป็นวิธีมาตรฐานที่ใช้ในการวินิจฉัย โดยสตรีที่ควรได้รับการตรวจเพื่อประเมินหาความผิดปกติ [9] ได้แก่
1. เลือดออกผิดปกติทางช่องคลอด
- สตรีวัยหมดประจำเดือน หรืออัลตราซาวด์ทางช่องคลอดแล้วพบว่ามีการหนาตัวของเยื่อบุโพรงมดลูกมากกว่า 4 มิลลิเมตร(แม้ว่าไม่มีเลือกออกทางช่องคลอด)
- อายุ 45 ปีถึงวัยก่อนหมดประจำเดือน และมีเลือดออกระหว่างรอบเดือน หรือประจำเดือนมามากกว่า 21 วัน หรือปริมาณมากกว่า 80 มิลลิลิตร หรือมานานกว่า 7 วัน
- อายุน้อยกว่า 45 ปี มีเลือดออกทางช่องคลอดต่อเนื่อง อ้วน มีภาวะไข่ไม่ตกเรื้องรัง ได้รับเอสโตรเจนชนิดเดี่ยว หรือมีเลือดออกหลังจากได้รับการรักษาด้วยยาแล้ว สตรีที่มีความเสี่ยงสูงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูก เช่น ได้รับยาทาม๊อกซิเฟน,Lynch syndrome, Cowden syndrome
- สตรีวัยก่อนหมดประจำเดือนที่ไข่ไม่ตกและประจำเดือนขาดเป็นเวลานาน (มากกว่า 6 เดือน)
2. ตรวจแปบเสมียร์แล้วพบความผิดปกติ ดังนี้
- Atypical glandular cells (AGC) endometrium
- Benign appearing endometrial cell ในสตรีอายุมากกว่า 40 ปี ที่มีเลือดออกผิดปกติหรือมีความเสี่ยงสูงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูก
วิธีการตรวจเยื่อบุโพรงมดลูกมีดังนี้ [9]
1. ดูดชิ้นเนื้อในโพรงมดลูก (Endometrial biopsy) หรือ Endocell เป็นวิธีที่สะดวก ไม่ต้องใช้ยาชาหรือยาแก้ปวด ไม่แพง และไม่ต้องขยายปากมดลูก แต่มีการศึกษาพบว่ามีเพียงน้อยกว่า 50% เท่านั้นที่จะถูกเก็บมาตรวจ ดังนั้นอาจตรวจไม่พบมะเร็งได้(ตารางที่3) แต่มีหลายการศึกษาพบว่าเนื้อเยื่อที่สุ่มตรวจถือว่าเพียงพอ โดยจะเหมาะสมสำหรับรายที่มีรอยโรคแบบทั่วโพรงมดลูก ไม่ใช่แบบเฉพาะที่
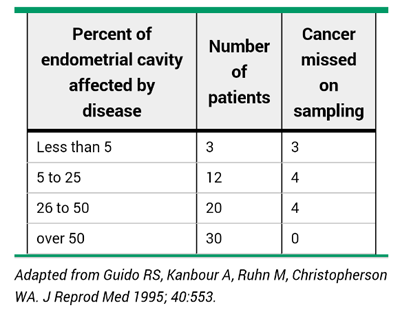
ตารางที่ 3 False negative endometrial biopsy in women with endometrial cancer undergoing hysterectomy [5]
2.อัลตราซาวด์ทางช่องคลอดเพื่อดูความหนาของเยื่อบุโพรงมดลูก โดยจะตรวจในแนวกลางมดลูก (Sagittal view) วัดระยะแนวหน้าหลังของเยื่อบุโพรงมดลูก จากชั้น basalis ด้านหนึ่งไปยังด้านหนึ่ง
- สตรีวัยหมดประจำเดือน หากมีความหนาเยื่อบุ น้อยกว่า 4-5 มิลลิเมตร พบว่าสัมพันธ์ต่อการเกิดมะเร็งเยื่อบุโพรงมดลูกน้อย จากคำแนะนำของ ACOG พบว่า ในการทำอัลตราซาวด์หรือการสุ่มตรวจเยื่อบุโพรงมดลูก (Endometrial sampling) ถือว่ามีประสิทธิภาพเท่ากัน สามารถใช้เป็นขั้นตอนแรกของการวินิจฉัยได้ในสตรีวัยหมดประจำเดือนที่มาด้วยเลือดออกผิดปกติ หรือหากทำ Endometrial sampling แล้วได้ชิ้นเนื้อเยื่อไม่เพียงพอสามารถอัลตราซาวด์ต่อเป็นขั้นตอนที่สองได้
- สตรีที่ไม่มีอาการแต่ตรวจอัลตราซาวด์พบว่ามีการหนาตัวของเยื่อบุโพรงมดลูกโดยบังเอิญ ถือว่าเป็นข้อบ่งชี้ในการตรวจชิ้นเนื้อเยื่อบุโพรงมดลูกต่อ เนื่องจากมีโอกาสเป็นมะเร็งได้ 5-20%
- สตรีวัยก่อนหมดประจำเดือน มักทำอัลตราซาวด์ในวันที่ 4-6 ของรอบเดือน ซึ่งเป็นช่วงที่เยื่อบุโพรงมดลูกบางที่สุด โดยปกติเยื่อบุโพรงมดลูกในระยะ Proliferative หนา 4-8 มิลลิเมตร ระยะ Secretory หนา 8-14 มิลลิเมตร ซึ่งการทำอัลตราซาวด์ยังไม่มีค่ามาตรฐานของความผิดปกติของสตรีวัยนี้ ดังนั้นจึงยังไม่เป็นที่ยอมรับ
3. ขูดมดลูก (Dilated & curettage) มีข้อบ่งชี้ในการทำ ดังนี้
- เมื่อผู้ป่วยไม่สามารถทนต่อการทำ Endometrial biopsy ได้ เช่น ปวด กังวล
- ไม่สามารถวินิจฉัยโรคได้จากการทำ Endometrial biopsy ในผู้ป่วยที่มีความเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูกสูง
- ในผู้ป่วยที่มีเลือดออกต่อเนื่องเป็นเวลานานแต่การทำ Endometrial biopsy พบว่าเป็นเนื้องอกธรรมดา
- ผู้ป่วยที่ทำ Endometrial biopsy แล้วได้เนื้อเยื่อไม่เพียงพอต่อการตรวจพยาธิวิทยา
- ปากมดลูกตีบ
4. ส่องกล้องโพรงมดลูก (Hysteroscopy) เป็นการส่องเข้าไปในโพรงมดลูกโดยตรง จึงทำให้สามารถเห็นจุดที่ผิดปกติและทำการตัดชิ้นเนื้อบริเวณที่สงสัยได้ แต่อย่างไรก็ตามวิธีนี้ต้องอาศัยความชำนาญ และถือว่าเป็นวิธีที่ลุกล้ำผู้ป่วย (Invasive) มากกว่าวิธีอื่น
การป้องกันการเกิดการหนาตัวผิดปกติของเยื่อบุโพรงมดลูก[2]
- ให้คำปรึกษาถึงความเสี่ยงของผู้ป่วย และแนะนำการคุมอาหาร ออกกำลังกาย ลดน้ำหนัก ปรับเปลี่ยนพฤติกรรม
- ให้ยาคุมกำเนิดชนิดฮอร์โมนรวม 12 เดือน จากการศึกษาพบว่าลดความเสี่ยงต่อการเกิดมะเร็งเยื่อบุโพรงมดลูกได้ 30-50%
- สตรีที่ BMI มากกว่า 22.1 ได้ประโยชน์จากการให้ High potency progestin therapy
- ห่วงคุมกำเนิดชนิดฮอร์โมนลีโวนอเจสเตรล 20 ไมโครกรัมต่อวัน สามารถลดความเสี่ยงการเกิดเยื่อบุโพรงมดลูกหนาตัวผิดปกติในสตรีที่มีความเสี่ยงสูง เช่น เป็นมะเร็งเต้านม และได้รับการรักษาด้วยทาม๊อกซิเฟน หรือได้รับฮอร์โมนเอสโตรเจน
- ยาฉีดคุมกำเนิด (DMPA) ลดความเสี่ยงการเกิดมะเร็งเยื่อบุโพรงมดลูก 80% ในสตรีวัยก่อนหมดประจำเดือน
การตรวจคัดกรอง
จากการอัลตราซาวด์ เอกซเรย์คอมพิวเตอร์ หรือคลื่นแม่เหล็กไฟฟ้า ไม่พบลักษณะจำเพาะที่จะแยกเยื่อบุโพรงมดลูกหนาตัวผิดปกติชนิดต่างๆ หรือมะเร็งเยื่อบุโพรงมดลูกได้ และยังไม่มีซีรัมมาร์คเกอร์จำเพาะของภาวะเหล่านี้ สำหรับสตรีที่มีความเสี่ยงสูงต่อการเกิดเยื่อบุโพรงมดลูกหนาตัวผิดปกติและมะเร็งเยื่อบุโพรงมดลูก [2] ได้แก่มีประวัติมะเร็งของคนในครอบครัว, Lynch syndrome, Cowden syndrome (พบน้อย), BRCA mutation 1, Single gene polymorphism
การคัดกรองผู้ที่มีความเสี่ยงสูง ควรได้รับการตรวจประจำปี เริ่มตั้งแต่อายุ 35 ปี โดยการทำอัลตราซาวด์ทางช่องคลอดและการตัดชิ้นเนื้อโพรงมดลูกทุกปีแล้วแต่ความเหมาะสม อย่างไรก็ตามยังไม่มีคำแนะที่ชัดเจน
Imaging
ก่อนการรักษาด้วยการรักษาแบบสังเกตอาการ จะต้องแยกภาวะที่นึกถึงมะเร็งออกไปก่อนโดยการอัลตราซาวด์ เอกซเรย์คอมพิวเตอร์ หรือคลื่นแม่เหล็กไฟฟ้า เพื่อดูว่าโรคอยู่ในโพรงมดลูก ไม่มีก้อนเนื้องอกรังไข่หรือต่อมน้ำเหลืองโต การวัดความหนาของเยื่อบุโพรงมดลูกสามารถทำนายการเกิดมะเร็งเยื่อบุโพรงมดลูกได้ในสตรีวัยหลังมดประจำเดือนแล้วเท่านั้น แต่ในสตรีวัยเจริญพันธุ์ไม่สามารถทำนายได้แน่ชัด สำหรับการตรวจด้วยคลื่นแม่เหล็กไฟฟ้าสามารถดูการล้ำของตัวโรคเข้าไปในกล้ามเนื้อมดลูกโดยสามารถตรวจได้ดีกว่าการอัลตราซาวด์ทางช่องคลอด แต่อาจดูก้อนที่ปีกมดลูกได้ไม่ชัด ส่วนการตรวจส่องกล้องทางช่องคลอดและทางช่องท้องยังไม่เป็นที่แนะนำ [2]
การรักษาแนวทางรักษาขึ้นอยู่กับ 2 ปัจจัย คือ Nuclear atypia และความต้องการบุตร การรักษา [10] ได้แก่
- ตัดมดลูก ซึ่งถือเป็นมาตรฐานการรักษาของเยื่อบุโพรงมดลูกผิดปกติชนิด Complex atypical hyperplasia โดยพิจารณาตัดรังไข่หรือไม่ตัดแล้วแต่ความเหมาะสม [11]
- รักษาด้วยฮอร์โมน
- เฝ้าติดตามด้วยการตรวจชิ้นเนื้อเยื่อบุโพรงมดลูกเป็นระยะ ซึ่งเหมาะสำหรับกรณีที่ไม่มี atypia มีความเสี่ยงในการเกิดมะเร็งต่ำ
ซึ่งในบทความนี้จะกล่าวถึงการรักษาด้วยฮอร์โมนเพียงเท่านั้น โดยเน้นในสตรีวัยเจริญพันธุ์ที่ต้องการมีบุตรหรือผู้ที่มีข้อห้ามในการผ่าตัด โดยฮอร์โมนที่ใช้ในการรักษาคือโปรเจสติน (Progestin) ซึ่งสามารถใช้ในการรักษาเยื่อบุโพรงมดลูกหนาตัวผิดปกติได้อย่างมีประสิทธิภาพ โดยโปรเจสตินจะออกฤทธิ์ที่โปรเจสตินรีเซปเตอร์ ทำให้เกิดการบางตัวของเยื่อบุโพรงมดลูก โปรเจสตินจะลดโปรเจสตินรีเซปเตอร์และเอสโตรเจนรีเซปเตอร์ และกระตุ้นเอนไซม์ไฮโดรเลสซึ่งจะเพิ่มการเปลี่ยนเอสตราไดออลเป็นเอสโตรนซึ่งเป็นเอสโตรเจนที่มีฤทธิ์อ่อนกว่า นอกจากนี้ยังทำให้เยื่อบุโพรงมดลูกอยู่ในระยะ Secretory และ Non-mitotic โดยเป้าหมายของการรักษาด้วยฮอร์โมนคือ
- ป้องกันการดำเนินโรคเป็นมะเร็ง
- ควบคุมการเกิดเลือดออกผิดปกติทางช่องคลอด
- โปรเจสตินชนิดทาน Medroxyprogesterone acetate (MPA) จัดเป็นยาตัวแรกที่ใช้ในการรักษาเยื่อบุโพรงมดลูกหนาตัวผิดปกติชนิด Non-atypical เหมาะในสตรีที่ต้องการมีบุตรหลังจากรักษาได้ผลสำเร็จ[12] สตรีที่ต้องการคุมกำเนิดแนะนำให้ใช้โปรเจสตินชนิดทานมากกว่าการใส่ห่วงคุมกำเนิดLNg20โดยให้ยาในปริมาณวันละ 10 มิลลิกรัม 3-6 เดือนโดยแนะนำแบบต่อเนื่องมากกว่าเป็นรอบๆ เนื่องจากผู้ป่วยจะได้ไม่มีเลือดออกทางช่องคลอดในระหว่างการรักษา ซึ่งหากให้เป็นรอบๆจะให้ 12-14 วันต่อเดือน
- ห่วงคุมกำเนิด Levonorgestrel-releasing intrauterine device 20 mcg/day (LNg20; Mirena)ออกฤทธิ์โดยตรงที่เยื่อบุโพรงมดลูก ความเข้มข้นของโปรเจสตินสูงกว่ายาชนิดทานและยาฉีด มีประสิทธิภาพมากกว่ายาทาน ไม่ต้องทานทุกวัน นอกจากนี้ยังมีประโยชน์ในเรื่องการคุมกำเนิดระยะยาวส่วนเรื่องเลือดออกผิดปกติทางช่องคลอดและคลื่นไส้อาเจียนไม่ต่างไปจากโปรเจสตินชนิดทานมีการศึกษาเปรียบเทียบห่วงคุมกำเนิดLNg20และโปรเจสตินชนิดทานพบว่าจะมีการลดลงของโรคชนิด Complex hyperplasia without atypia 92% และ 66% ตามลำดับ และชนิด Complex atypical hyperplasia 90% และ 69% ตามลำดับสำหรับผู้ป่วยที่มี BMI มากกว่า 40 ประสิทธิภาพของห่วงคุมกำเนิดในการลดรอยโรคจะลดลง[13]
- ห่วงคุมกำเนิดชนิดปล่อยฮอร์โมน14 ไมโครกรัมต่อวัน (Skyla)ยังไม่มีการศึกษาที่ชัดเจน
- ยาคุมกำเนิดชนิดทานเอสโตรเจนและโปรเจสเตอโรน โดยเน้นที่ระดับโปรเจสเตอโรนเป็นหลัก
- โปรเจสเตอโรนชนิดทาช่องคลอด (Micronized vaginal progesterone) ใช้ทาทุกวันที่ 10-25 ของรอบเดือน โดยจะสามารถลดการหนาตัวผิดปกติของเยื่อบุโพรงมดลูกชนิด ไม่ atypia เป็นเยื่อบุโพรงมดลูกที่ปกติได้ 91%
- ชักนำการตกไข่ จากนั้นจะเกิดคอร์ปัสลูเตียมตามมาทำให้มีการสร้างโปรเจสเตอโรน วิธีนี้เหมาะสำหรับสตรีที่มี การหนาตัวผิดปกติของเยื่อบุโพรงมดลูกชนิด ไม่ atypia และต้องการมีบุตร
- Megestrol acetate ใช้ในกรณีที่มีการหนาตัวผิดปกติของเยื่อบุโพรงมดลูกชนิดที่มี atypia ซึ่งถือว่ามีประสิทธิภาพมากกว่า Medroxyprogesterone acetate (MPA)โดยจะให้ปริมาณ 80 มิลลิกรัมสองครั้งต่อวัน ซึ่งหากการดำเนินโรคไม่ลดลง ให้เพิ่มเป็น 160 มิลลิกรัมสองครั้งต่อวัน
- Depot medroxyprogesterone acetate
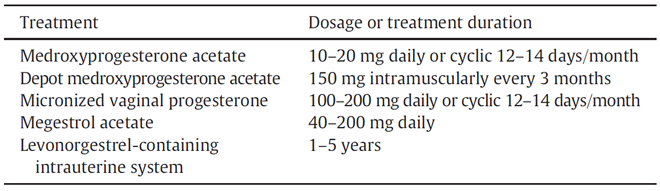
ตารางที่ 4 Hormonal treatment for complex atypical hyperplasia or early-stage endometrial cancer [2]
นอกจากยาโปรเจสตินแล้วยังมียาอื่น ๆ เช่น
- Danazol 400มิลลิกรัมต่อวัน เป็นเวลา 6 เดือน ซึ่งมีการศึกษาว่าสามารถลดรอยโรคได้อย่างสมบูรณ์ 83% แต่อย่างไรก็ตาม Danazol มีผลข้างเคียงมากกว่ายาชนิดอื่น
- GnRH agonist หรือ antagonist โดยจะทำให้ผู้ป่วยเข้าสู่ภาวะเหมือนวัยหมดประจำเดือน
- Aromatase inhibitor จะออกฤทธิ์ต้านการสร้างเอสโตรเจน
การติดตามการรักษา
ตรวจเยื่อบุโพรงมดลูก (Endometrial sampling) ทุก 3-6 เดือน(รูปที่ 1)[8] จนกระทั่งรอยโรคลดลง หากรอยโรคไม่ลดลงจนปกติหลังการรักษา 3-6 เดือน ควรพิจารณาเพิ่มปริมาณโปรเจสติน หรือให้โปรเจสตินแบบออกฤทธิ์ไปทั่วร่างกาย และห่วงคุมกำเนิดชนิด LNg20 มีรายงานระยะเวลาการลดลงของรอยโรค (Median time of regression) หลังจากรับยาโปรเจสติน อยู่ที่ 6-9 เดือน [14, 15] โดยจะมีปัจจัยหลายอย่างที่ช่วยในการทำนายการตอบสนอง (Response) และการกลับเป็นซ้ำ (Relapse)เช่น ภาวะอ้วน (BMI ≥ 30)[16]เมื่อตรวจเยื่อบุโพรงมดลูก (Endometrial sampling) แล้วพบว่าไม่มีการหนาตัวผิดปกติแล้ว ในรายที่ต้องการบุตรแนะนำให้ผู้ป่วยรีบมีบุตร โดยอาจใช้วิธีการกระตุ้นให้ไข่ตกในรายที่รังไข่ทำงานผิดปกติ หรือในรายที่ไม่สามารถตั้งครรภ์ด้วยวิธีธรรมชาติ พิจารณาทำเทคโนโลยีช่วยการเจริญพันธุ์ (Assisted reproductive technology; ART) [17] ได้แก่ เด็กหลอดแก้ว (In vitro fertilization; IVF)[18] ซึ่งเป็นวิธีที่มีประสิธิภาพสูง ใช้เวลาให้เกิดการตั้งครรภ์น้อย แต่อย่างไรก็ตามในปัจจุบันยังไม่มีรายงานถึงเวลาที่เหมาะสมต่อการตั้งครรภ์นับจากรอยโรคหาย สำหรับรายที่ยังไม่ต้องการมีบุตรพิจารณาให้โปรเจสตินต่อเพื่อป้องกันการกลับเป็นซ้ำ ซึ่งสามารถให้ได้ทั้ง Megestrol acetate, Medroxyprogesterone acetate (MPA), Depot medroxyprogesterone acetate, ยาคุมกำเนิดชนิดทานเอสโตรเจนและโปรเจสเตอโรน และ LNg20 โดยต้องทำการตรวจเยื่อบุโพรงมดลูกทุก 6-12 เดือน จากนั้นหากผลปกติ 1-2 ครั้ง ให้ยาในปริมาณเท่าเดิม (Maintenance regimen) และพิจารณาตรวจเยื่อบุโพรงมดลูกห่างออกเป็นทุก 1-2 ปีแล้วแต่ความเหมาะสม อย่างไรก็ตาม หากโรคกลับเป็นซ้ำและผู้ป่วยไม่ต้องการมีบุตรแล้วแนะนำให้ตัดมดลูก[12]
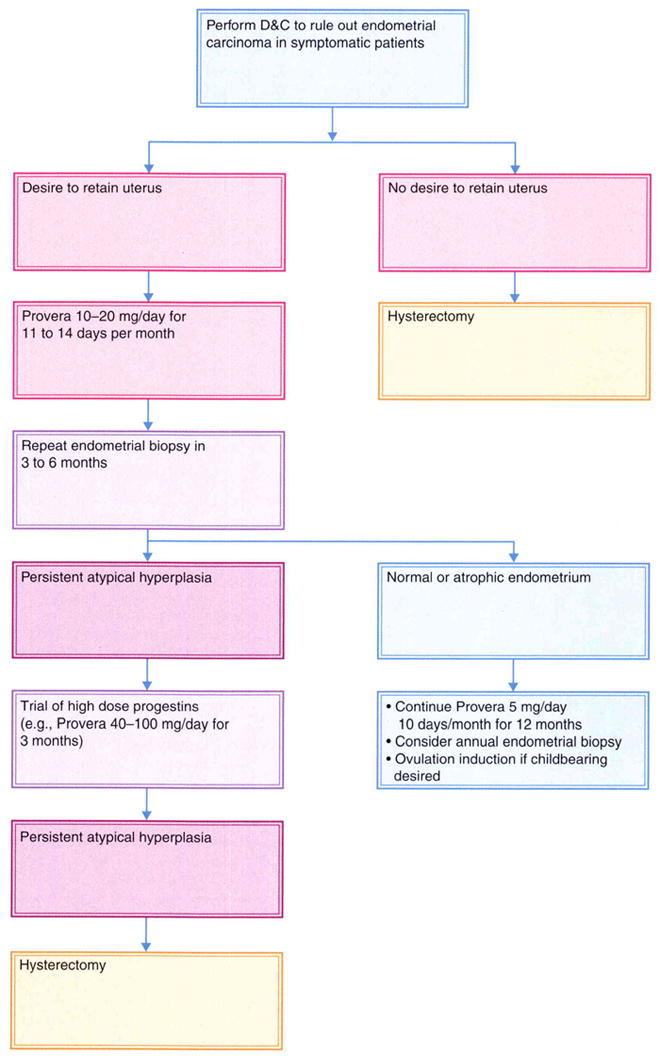
รูปที่ 1 Management of endometrial hyperplasia [8]
บรรณานุกรม
- Koji Matsuo , A.A.R., Marc R. Gualtieri, Paulette Mhawech-Fauceglia , Hiroko Machida , Aida Moeinia, Christina E. Dancz , Yutaka Ueda , Lynda D. Roman, Prediction of concurrent endometrial carcinoma in women with endometrial hyperplasia. Gynecologic Oncology 2015. 139 p. 261–267.
- Gregory M. Gressel , V.P., Lubna Pal Management options and fertility-preserving therapy for premenopausal endometrial hyperplasia and early-stage endometrial cancer. International Journal of Gynecology and Obstetrics 131 (2015) 234–239, 2015. 131 p. 234–239.
- ศรีสมบูรณ์, จ., มะเร็งนรีเวชวิทยา. มะเร็งเยื่อบุโพรงมดลูก.
- เชียรศิลป์, อ. ระบาดวิทยาของโรคมะเร็งในประเทศไทย http://www.oocities.org/suchartw/epidermiology.htm.
- Steven C Plaxe, M., Arno J Mundt, MD, Overview of endometrial carcinoma. Dec 2015: uptodate.
- ทองสง, ธ., นรีเวชวิทยา. Endometrial hyperplasia. Vol. 3. 419-424.
- Robert L Giuntoli, I., MD, Howard A Zacur, MD, PhD, Classification and diagnosis of endometrial hyperplasia. uptodate.
- Jonathan S. Berek, M., MMS, Berek&Novak’s Gynecology. 15 ed. General gynecology.
- Sarah Feldman, M., MPH, Evaluation of the endometrium for malignant or premalignant disease. uptodate.
- Robert L Giuntoli, I., MD,Howard A Zacur, MD, PhD, Management of endometrial hyperplasia. uptodate.
- K.M. Anderson, N.R.S., M.A. Davis, L.M. Bean, C.C. Saenz, S.C. Plaxe, M.T. McHale. UCSD Rebecca and John Moores Cancer Center, La Jolla, CA, USA, The safety of ovarian preservation in women with complex endometrial hyperplasia with atypia. 2015. p. 82-83.
- Andrea N. Simpson , T.F., Blaise A. Clarke, Lilian T. Gien , Nadia Ismiil, Stephane Laframboise , Christine Massey , Sarah E. Ferguson, Fertility sparing treatment of complex atypical hyperplasia and lowgrade endometrial cancer using oral progestin. Gynecologic Oncology, 2014. 133 p. 229–233.
- A. Graul, A.F.H., H. Reed, S.H. Kim, Conservative management of endometrial hyperplasia/carcinoma with levonorgestrel intrauterine system may be less effective in patients with morbid obesity. Abstracts / Gynecologic Oncology 2015. 137 (doi:10.1016/j.ygyno.2015.01.380).
- Luis Chiva , F.L., Lucia González-Cortijo, Natalia Carballo, Juan F. García,Alejandro Rojo, Antonio Gonzalez-Martín, Sparing fertility in young patients with endometrial cancer. Gynecologic Oncology 2008. 111: p. S101–S104.
- Camille C. Gunderson , A.N.F., Kathryn A. Carson , Robert E. Bristow, Oncologic and Reproductive outcomes with progestin therapy in women with endometrial hyperplasia and grade 1 Adenocarcinoma: A systematic review. Gynecologic Oncology 2012. 125 p. 477–482.
- Yuh-Cheng Yanga, C.-C.W., Chie-Pein Chena, Chih-Long Changa, Kung-Liang Wanga, Reevaluating the safety of fertility-sparing hormonal therapy for early endometrial cancer. Gynecologic Oncology 2005. 99 p. 287 – 293
- Yu-Feng Yang a, Y.-Y.L.b., Xian-lian Liu, Shu-Guang Su , Lin-Zhu Li , Ning-Fu Peng, Prognostic factors of regression and relapse of complex atypical hyperplasia and well-differentiated endometrioid carcinoma with conservative treatment. Elsevier Inc. Gynecologic Oncology 2015. 139 p. 419–423.
- K. Shen. Peking Union Medical College Hospital, B., China, Outcomes of fertility-sparing treatment with progestin in patient with early-stage endometrial cancer or severe atypical hyperplasia: Preliminary results of a phase II study in China. doi:10.1016/j.ygyno.2015.01.225: p. 91.

