Osteoporosis in Menopause
Osteoporosis in Menopause
ณัฐกานต์ เสงี่ยมพร
ณัฐพัชร์ จันทรสกา
วัยหมดประจำเดือน หรือวัยทอง (menopause) เป็นภาวะที่มีการทำงานของรังไข่ลดลง ซึ่งมีผลต่อการสร้างฮอร์โมนเอสโตรเจนในร่างกายลดลงไปด้วย ผลจากการลดลงของฮอร์โมนดังกล่าว ทำให้เกิดภาวะ vasomotor symptoms (เช่น ร้อนวูบวาบ นอนไม่หลับ หนาวสั่น หงุดหงิดง่าย เป็นต้น), genitourinary symptoms (แสบร้อนช่องคลอด ช่องคลอดแห้ง ปัสสาวะเล็ด/บ่อย เป็นต้น) อีกทั้งยังเพิ่มความเสี่ยงต่อการเกิดโรคสำคัญ เช่น โรคหัวใจและหลอดเลือด (cardiovascular disease), โรคกระดูกพรุน (osteoporosis), โรคมะเร็งเต้านม (breast cancer), และโรคความจำเสื่อม (dementia) เป็นต้น ในที่นี่จะขอกล่าวถึงเฉพาะในส่วนของโรคกระดูกพรุน
โรคกระดูกพรุน (Osteoporosis) คือ โรคที่มีความหนาแน่นและมวลของกระดูกลดลง ส่งผลให้กระดูกเกิดความเสื่อม เปราะบาง ผิดรูปและมีโอกาสแตกหักง่ายมากขึ้น ส่วนใหญ่โรคกระดูกพรุนมักไม่ค่อยแสดงอาการจนกว่าจะเกิดกระดูกหักขึ้น(1) ตำแหน่งที่พบว่ามีกระดูกหักบ่อย ได้แก่ กระดูกสะโพก, กระดูกสันหลัง, และกระดูกแขน โดยปกติระดับมวลกระดูกจะสูงที่สุดที่ช่วงอายุประมาณ 30 ปี(2) หลังจากนั้นมวลกระดูกจะเริ่มมีการลดลง ซึ่งจากอุบัติการณ์ของโรคกระดูกพรุนในผู้หญิงไทยที่อายุตั้งแต่ 70 ปีขึ้นไป พบได้มากกว่าร้อยละ 50 ซึ่งการที่กระดูกหักจากโรคกระดูกพรุนนั้น ถือว่าส่งผลกระทบต่อทั้งสังคมในแง่ของค่าใช้จ่ายและส่งผลกระทบต่อผู้ป่วยในแง่ของการเจ็บป่วย และการเสียชีวิตอีกด้วย(3), (4)
สรีรวิทยาของกระดูก (Bone physiology)
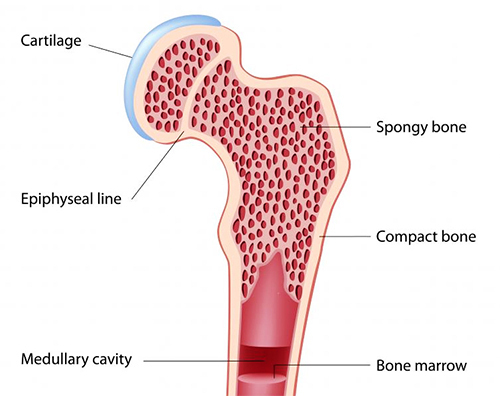
กายวิภาคปกติของกระดูกมี 2 ส่วน ได้แก่
- Cortex หรือ Compact bone เป็นชั้นนอกสุดที่แข็ง หนา และอัดแน่น มีส่วนประกอบของแคลเซียมร้อยละ 80
- Trabecular bone เป็นชั้นที่เป็นแกนกลางของกระดูก มีลักษณะเป็นรูพรุน พื้นที่ผิวเยอะ มีส่วนประกอบของแคลเซียมอยู่พียงร้อยละ 20 ส่วนที่เหลือเป็นหลอดเลือด เนื้อเยื่อเกี่ยวพัน และไขกระดูก ซึ่งจะตอบสนองต่อการสร้างเม็ดเลือดแดง(2) กระดูกส่วนนี้จะทำหน้าที่เกี่ยว
กับการเมตาบอลิสม์ของร่างกาย
ทั้งกระดูก cortical และ trabecular bone ต่างประกอบด้วยส่วนที่เป็นเนื้อกระดูก (matrix) และเซลล์ต่างๆ ภายในกระดูกเหมือนกัน ได้แก่ เซลล์กระดูก (osteocyte), เซลล์สร้างกระดูก (osteoblast), และเซลล์ทำลายกระดูก (osteoclast)
เซลล์กระดูก (Osteocyte)
มีต้นกำเนิดมาจาก osteoblast ซึ่งฝังตัวอยู่ใน lacuna เกิดจากการตกตะกอนของ osteoblast แต่ละเซลล์จะเชื่อมต่อกันผ่านร่างแห่ง (canaliculi) โดยจะทำหน้าที่ในการติดต่อประสานงานกับเซลล์อื่นๆ เรียกว่า gap junction และติดต่อกับ bone lining cell ที่อยู่บนผิวกระดูก ซึ่งจะตอบสนองต่อแรงกลที่มากระทำกับกระดูก ทำให้มีการสังเคราะห์ prostacyclin,
nitric oxide และ insulin-like growth factor เพิ่มมากขึ้น ส่งผลกระตุ้นให้เกิดการปรับแต่งกระดูกใหม่ (remodeling) (5)
เซลล์สร้างกระดูก (Osteoblast)
Osteoblast ทำหน้าที่ผลิต collagen และผลิตสารเคมีที่มีผลควบคุมการทำงานของเซลล์กระดูก เช่น RANK-ligand, colony stimulating factor, interleukin-6 และ interleukin-11 ซึ่งมีผลต่อการพัฒนาของเซลล์สลายกระดูก (osteoclast) เซลล์ osteoblast นั้นจะมีระดับของ alkaline phosphatase (ALP) สูง และมี parathyroid hormone (PTH) receptor อยู่ที่ผิวเซลล์ ส่วนภายในนิวเคลียสจะมี receptor สำหรับ estrogen และ vitamin D3 เมื่อหมดช่วงระยะเวลาสร้างกระดูก osteoblast จะตกตะกอนกลับไปเป็น flat lining cell หรือกลายเป็น osteocyte ในที่สุด (5)
เซลล์ทำลายกระดูก (Osteoclast)
Osteoclast พัฒนามาจาก mononuclear / macrophage ซึ่งมีลักษณะเฉพาะเป็นเซลล์ขนาดใหญ่มีนิวเคลียสหลายอัน (giant multinucleated cell) โดย osteoclast precursor จะมีการเจริญและพัฒนาการได้อย่างเต็มที่นั้น ต้องมีการกระตุ้น RANK receptor ที่อยู่บนผิวเซลล์ด้วย RANKL (RANK ligand) ที่สร้างมาจาก osteoblast กล่าวคือต้องมี RANK-RANKL binding เกิดขึ้น จึงจะสามารถพัฒนาไปเป็น mature osteoclast ได้
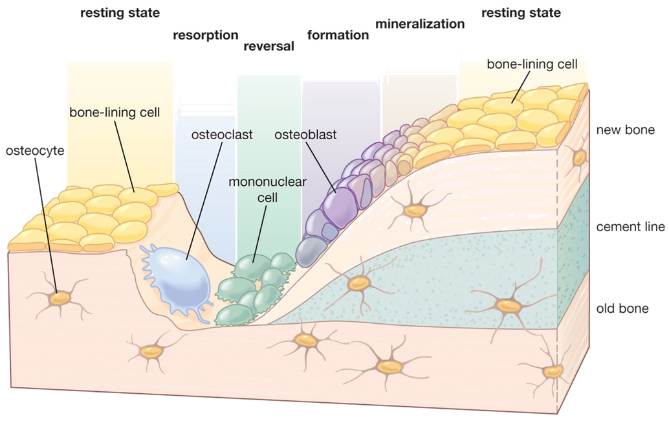
ในภาวะปกติทั้งสองเซลล์จะทำหน้าที่ในการสร้างความสมดุลของเกลือแร่ต่างๆ ภายในร่างกาย เพื่อสุขภาพของกระดูกที่แข็งแรง ซึ่งวงจรที่มีการสร้างและสลายของกระดูก เรียกว่า Bone remodeling ดังภาพ
ฮอร์โมนเอสโตรเจน (estrogen) ทำหน้าที่ในการควบคุมการสร้างของ osteoblast และ osteoclast แต่เมื่อเข้าสู่วัยหมดประจำเดือน (menopause) จะเริ่มมีการลดลงของฮอร์โมนเอสโตรเจน ทำให้เกิดผลกระทบต่อกระบวนการควบคุมของเซลล์ทั้งสองนี้ไป ส่งผลให้มีการสร้าง osteoblast ลดลง แต่มีการสร้าง osteoclast เพิ่มมากขึ้น ผลที่เกิดขึ้นคือ มีการสลายกระดูก (bone reabsorption) มากขึ้น ทำให้เกิดโรคกระดูกบาง (osteopenia) หรือกระดูกพรุน (osteoporosis) ตามมาได้(2)
ความเสี่ยงของภาวะกระดูกพรุน (Risk factors for osteoporosis) (6) สามารถแบ่งออกได้เป็น
- Nonmodifiable risk ได้แก่ อายุ, เชื้อชาติ (เอเชีย, ผิวขาว), รูปร่างเล็ก, หมดประจำเดือนเร็ว, มีประวัติกระดูกหักก่อนวัยอันควร, มีประวัติคนในครอบครัวเป็นกระดูกพรุน
- Modifiable risk ได้แก่ การรับแคลเซียม/วิตามินดีไม่เพียงพอ, น้ำหนักน้อย, สูบบุหรี่, ดื่มสุรา, วิถีชีวิตแบบนั่งนอนมาก
- Associated medical conditions เช่น chronic anovulation, hyperparathyroidism, hyperthyroidism, chronic renal disease, rheumatoid arthritis, โรคหรือภาวะใดๆ ก็ตามที่ จำเป็นต้องรับประทานคอร์ติโคสเตียรอยด์
การประเมินความเสี่ยง (Risk assessment)
เครื่องมือที่นำมาใช้ประเมินความเสี่ยงนั้นมีให้ใช้หลากหลาย แต่ที่นิยมใช้กันอย่างแพร่หลายมากที่สุดคือ Fracture Risk Assessment Tool (FRAX) ซึ่งใช้ทำนายความเสี่ยงต่อการเกิดกระดูกหักบริเวณสะโพก หรือกระดูกหักที่ตำแหน่งสำคัญ (เช่น กระดูกสันหลัง กระดูกสะโพก กระดูกต้นแขน และกระดูกแขน) ในระยะเวลาอีก 10 ปีข้างหน้า เครื่องมือนี้ช่วยประเมินความจำเป็นในการส่งตรวจมวลกระดูกในคนที่อายุน้อยกว่า 65 ปี และยังช่วยประเมินความจำเป็นในการเริ่มรักษาโดยการใช้ยา
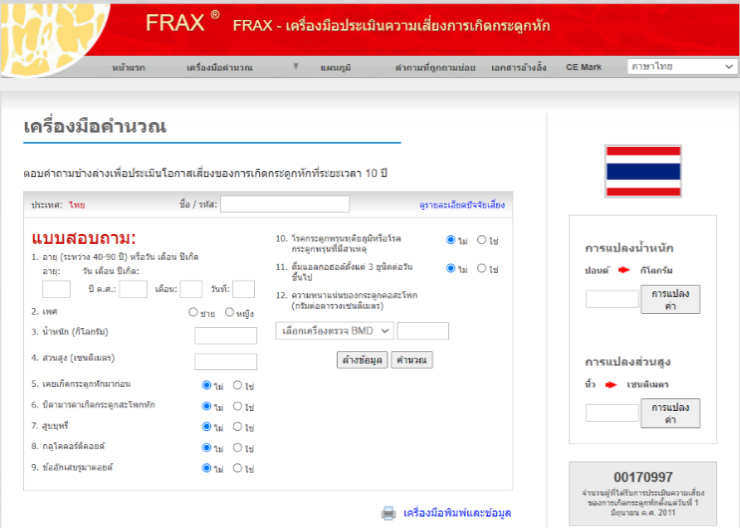
ข้อมูลที่ต้องใช้ในการประเมิน ได้แก่ เชื้อชาติ, เพศ, อายุ, ส่วนสูง, น้ำหนัก, ประวัติกระดูกหักมาก่อน, ประวัติกระดูกสะโพกหักของพ่อแม่, ประวัติการใช้สเตียรอยด์, การสูบบุหรี่ และดื่มสุรา, โรคข้ออักเสบรูมาตอยด์, และโรคกระดูกพรุนแบบทุติยภูมิ (secondary causes of bone loss) ซึ่งจะรวมข้อมูลผลตรวจความหนาแน่นมวลกระดูก (bone marrow density) ไปด้วยหรือไม่ก็ได้ ซึ่งเครื่องมือนี้เป็นที่นิยมใช้ เพราะใช้งานง่าย สะดวกในการเข้าถึง ใช้งานได้ตลอดเวลา ไม่สิ้นเปลืองค่าใช้จ่าย
โดยสามารถเข้าไปประเมินตามเว็บไซต์ https://www.sheffield.ac.uk/FRAX/
แนวทางการวินิจฉัย (Diagnosis)
ในผู้ที่ไม่มีอาการสามารถทำได้โดยการตรวจมวลกระดูก (bone marrow density; BMD) หรือภาพถ่ายรังสีของกระดูกสันหลัง (vertebral imaging) แต่ในกรณีที่มีการหักของกระดูกสะโพกหรือกระดูกสันหลังจากอุบัติเหตุที่ไม่รุนแรง จะสามารถวินิจฉัยว่ามีภาวะกระดูกพรุนได้เลยโดยไม่ต้องส่งตรวจอื่นๆ เพิ่มเติม นอกจากนี้ เราจำเป็นต้องหาสาเหตุอื่นๆ ของการเกิดภาวะกระดูกพรุน นอกเหนือไปจากการขาดฮอร์โมนในวัยหมดระดู (เช่น osteomalacia, hyperparathyroidism และอื่นๆ ดังแสดงในตารางที่ 1) เพื่อที่จะได้รักษาและป้องกันไม่ให้เป็นมากขึ้นได้ จึงจำเป็นต้องมีการส่งตรวจเลือด และปัสสาวะเพิ่มเติม ตามภาวะหรือโรคที่สงสัย
- การวัดความหนาแน่นของมวลกระดูก (Bone marrow density; BMD)
หน่วยของการวัดความหนาแน่นของกระดูก แบ่งออกเป็น 2 แบบ ได้แก่
- T-score เป็นค่าที่เปรียบเทียบกับกระดูกของผู้ที่อยู่ในวัย 30 ปี (อายุที่มวลกระดูกสูงที่สุด) เป็นมาตรฐาน
- Z-score เป็นค่าที่เปรียบเทียบกับกระดูกของผู้ที่อยู่ในวัยเดียวกัน เพศเดียวกัน และเชื้อชาติเดียวกัน
แต่อย่างไรก็ตาม ค่า Z-Score เพียงค่าเดียว ไม่อาจบ่งชี้ได้ว่าในระหว่าง 2 คนนั้น ผู้ใดเป็นโรคกระดูกพรุนแล้วหรือไม่อย่างไร ซึ่งแตกต่างจากค่า T-Score ที่อาจใช้บ่งชี้ได้ชัดเจน
ดังนั้น การวินิจฉัยโรคกระดูกพรุนจึงให้ใช้ค่า T-score เป็นหลัก ส่วนค่า Z-Score มีประโยชน์ในแง่ของการเฝ้าระวังโรคกระดูก หรือช่วยบ่งชี้สาเหตุที่ก่อให้เกิดโรคกระดูกบางโรคที่มีมวลลดน้อยลงไปได้
WHO definition of osteoporosis by BMD
| Classification | T-score |
| Normal | ≥ -1.0 |
| Low bone mass (Osteopenia) | -1.0 to -2.5 |
| Osteoporosis | ≤ -2.5 |
| Severe or established osteoporosis | ≤ -2.5 with fragility fracture |
ข้อบ่งชี้ในการส่งตรวจความหนาแน่นของกระดูก(7)
แนะนำส่งตรวจความหนาแน่นของกระดูกโดยอาศัยเกณฑ์อายุและปัจจัยเสี่ยงทางคลินิก ข้อใดข้อหนึ่งต่อไปนี้
- ผู้หญิงอายุ 65 ปีขึ้นไป และผู้ชายอายุ 70 ปีขึ้นไป
- ผู้หญิงที่หมดประจำเดือนก่อนอายุ 45 ปี ซึ่งรวมถึงผู้ที่ถูกตัดรังไข่ทั้งสองข้าง
- ผู้หญิงที่มีภาวะฮอร์โมนเอสโตรเจนต่ำ (hypoestrogenism) ต่อเนื่องนานกว่า 1 ปี ก่อนเข้าสู่วัยหมดประจำเดือน ซึ่งพบได้ในผู้ป่วยที่ได้รับ GnRH agonist หรือมี functional hypothalamic amenorrhea เช่น ผู้ป่วยโรคเรื้อรังทางอายุรกรรม คนที่ออกกำลังกายอย่างหนักเป็นเวลานาน เป็นต้น โดยยกเว้นกรณีตั้งครรภ์และให้นมบุตร
- ผู้หญิงวัยหมดประจำเดือนที่อายุน้อยกว่า 65 ปี หรือผู้ชายที่มีอายุน้อยกว่า 70 ปี ที่มีความเสี่ยงข้อใดข้อหนึ่งดังต่อไปนี้
- กำลังเริ่มยา หรือได้รับยา glucocorticoid ขนาดเทียบเท่าหรือมากกว่า prednisolone 5 มิลลิกรัมต่อวัน ต่อเนื่องกันตั้งแต่ 3 เดือนขึ้นไป
- มีบิดาหรือมารดากระดูกสะโพกหักจากอุบัติเหตุที่ไม่รุนแรง
- ดัชนีมวลกายน้อยกว่า 20 กก./ตร.ม.
- ส่วนสูงลดลงตั้งแต่ 4 ซม.ขึ้นไป เมื่อเทียบกับประวัติส่วนสูงที่สูงสุด หรือตั้งแต่ 2 ซม.ขึ้นไปจากบันทึกการวัดส่วนสูง 2 ครั้ง
- ผู้หญิงที่ได้รับการรักษาด้วย aromatase inhibitor หรือผู้ชายที่ได้รับ androgen deprivation therapy
- ภาพถ่ายรังสีแสดงลักษณะ radiographic osteopenia หรือกระดูกสันหลังผิดรูปจาก vertebral fracture
- มีประวัติกระดูกหักจากอุบัติเหตุไม่รุนแรง (fragility fracture)
- ก่อนเริ่มยารักษาโรคกระดูกพรุน และติดตามผลที่ 1-2 ปีหลังการรักษา
2. ภาพถ่ายรังสีของกระดูกสันหลัง (Vertebral imaging)
โดยส่วนใหญ่ภาวะกระดูกสันหลังหักมักจะไม่มีอาการ ดังนั้น การส่งภาพถ่ายรังสีจึงเป็นหนึ่งในช่องทางที่จะช่วยวินิจฉัยกระดูกสันหลังหักได้ อีกทั้งการที่พบว่ามีกระดูกสันหลังหักนั้นก็ยังเป็นข้อบ่งชี้ในการเริ่มรักษาโดยการใช้ยาอีกด้วยเช่นกัน
ข้อบ่งชี้ในการส่งตรวจภาพถ่ายรังสีของกระดูกสันหลัง(7) ประกอบด้วยข้อใดข้อหนึ่งต่อไปนี้
- T-score < -1.0 ร่วมกับมีเกณฑ์ข้อใดข้อหนึ่งดังต่อไปนี้
- ผู้หญิงอายุตั้งแต่ 70 ปีขึ้นไป หรือผู้ชายอายุตั้งแต่ 80 ปีขึ้นไป
- ประวัติความสูงลดลงมากกว่า 4 ซม.
- ประวัติกระดูกสันหลังหัก แต่ยังไม่มีหลักฐาน
- ได้รับ glucocorticoid ขนาดเทียบเท่าหรือมากกว่า prednisolone 5 มก./วัน ติดต่อกันตั้งแต่ 3 เดือนขึ้นไป
- T-score ≤ -2.5
- มีกระดูกหักจากอุบัติเหตุที่ไม่รุนแรง
แนวทางการรักษา (Treatment)
Universal Recommendations for all patients
- รับประทานแคลเซียม และวิตามินดี (Calcium and vitamin D)
- รับประทานแคลเซียมควบคู่กับวิตามินดีอย่างเพียงพอ ช่วยลดความเสี่ยงในการเกิดกระดูกหัก(8) และหากร่างกายได้แคลเซียมจากภายนอกไม่เพียงพอต่อความต้องการ ร่างกายจะมีการสลายกระดูก เพื่อคงระดับของแคลเซียมในเลือดไว้
- ปริมาณแคลเซียมที่แนะนำสำหรับหญิงที่อายุตั้งแต่ 50 ปีขึ้นไป คือ 1200 มก./วัน (การรับประทานอาหารในแต่ละวัน จะได้รับแคลเซียมเฉลี่ยอยู่ที่ประมาณ 600-700 มก./วัน) แต่อย่างไรก็ตามการที่ได้รับแคลเซียมในปริมาณที่มากกว่า 1200-1500 มก./วัน อาจจะไปเพิ่มความเสี่ยงต่อการเกิดนิ่วที่ไต, โรคหลอดเลือดหัวใจ, หรือโรคหลอดเลือดสมองได้
- NOF แนะนำปริมาณวิตามินดีสำหรับผู้ที่อายุตั้งแต่ 50 ปีขึ้นไป คือ 800-1000 ยูนิต/วัน(9) Institute of medicine dietary reference intake แนะนำให้ 600 ยูนิต/วัน ไปจนถึงอายุ 70 ปี หลังจากนั้นเพิ่มเป็น 800 ยูนิต/วัน(10)
- ผู้ป่วยบางรายมีโอกาสเสี่ยงสูงต่อการขาดวิตามินดี เช่น Celiac disease, Inflammatory bowel disease, gastric bypass surgery, Chronic renal disease, Limited sun exposure เป็นต้น
- การประเมินระดับวิตามินดีในเลือดว่าเพียงพอหรือไม่ สามารถเจาะตรวจ Serum 25(OH)D level โดยค่าปกติจะอยู่ที่ประมาณ 30 ng/ml (75 nmol/L) ในผู้ป่วยกระดูกพรุนแนะนำให้อยู่ในระดับ 30-50 ng/ml
- ออกกำลังกาย (Weight-bearing and Muscle strengthening exercise)
- ช่วยเพิ่มความหนาแน่นของกระดูก ความคล่องแคล่ว ความแข็งแรง และการทรงตัวที่ดี ลดโอกาสการลื่นล้มได้
- ตัวอย่างของ Weight-bearing exercise เช่น การเดิน การวิ่ง การเต้น ไทเก๊ก การปีนเขา เป็นต้น
- ตัวอย่างของ Muscle strengthening exercise เช่น Weight training, โยคะ เป็นต้น
- โปรตีน
- รับประทานโปรตีนให้เพียงพอ (1-1.2 กรัม/กก./วัน) ร่วมกับออกกำลังกายเป็นประจำ เพื่อประโยชน์ต่อกระดูกและ กล้ามเนื้อ โดยแหล่งอาหารโปรตีนควรมาจากสัตว์และจากพืชในสัดส่วนที่เท่ากัน
- การป้องกันการล้ม
- ทำได้โดยประเมินความเสี่ยงของการล้ม การออกกำลังกายตามที่ได้กล่าวไปข้างต้น สร้างสภาพแวดล้อมภายในบ้านให้ปลอดภัย (Home Safety Assessment) ลดปริมาณยาที่มีผลต่อระดับความรู้สึกตัว และแก้ไขปัญหาทางสายตา
- เลิกสูบบุหรี่ ลดเครื่องดื่มแอลกอฮอล์ และกาแฟ
Pharmacologic Therapy
ก่อนเริ่มรักษาโดยการใช้ยา อย่าลืมค้นหาสาเหตุอื่นๆ ของภาวะกระดูกพรุน (secondary causes of osteoporosis) ต่อมาควรมีการตรวจวัดมวลกระดูก ภาพถ่ายรังสีของกระดูกสันหลัง เพื่อนำไปใช้ในการติดตามผลการรักษา โดยการรักษาโดยการให้ยานั้น จะพิจารณาในหญิงวัยหมดประจำเดือนที่มีความเสี่ยงต่อการเกิดกระดูกหักสูงและสูงมาก โดยใช้เกณฑ์ดังนี้ (7)
เกณฑ์สำหรับความเสี่ยงต่อการเกิดกระดูกหักสูง ข้อใดข้อหนึ่งดังนี้
-
- มีกระดูกสันหลังหัก หรือกระดูกสะโพกหักจากโรคกระดูกพรุน
- T-score น้อยกว่าหรือเท่ากับ – 2.5
- ความเสี่ยงต่อการเกิดกระดูกสะโพกหักในช่วงเวลา 10 ปี ซึ่งประเมิน โดย FRAX สำหรับประเทศไทย ≥ 3%
- T-score ระหว่าง -1.0 และ -2.5 ร่วมกับมีกระดูกหักจากโรคกระดูกพรุน ในตำแหน่งอื่นที่ไม่ใช่กระดูกสันหลัง และกระดูกสะโพก ได้แก่ กระดูกหัก ในตำแหน่ง proximal humerus, pelvis หรือ forearm
เกณฑ์สำหรับความเสี่ยงต่อการเกิดกระดูกหักสูงมาก ข้อใดข้อหนึ่งดังนี้
- กระดูกสันหลังหรือกระดูกสะโพกหักจากโรคกระดูกพรุนภายในระยะเวลา 12 เดือน ในผู้ป่วยที่อายุตั้งแต่ 65 ปีขึ้นไป ที่มี T-score ≤ -2.5
- มีกระดูกสันหลังหักซ้ำ หรือหักตั้งแต่ 2 ระดับขึ้นไป และมีความรุนแรงระดับปานกลางถึงรุนแรงมากทั้ง 2 ระดับ
- มีกระดูกสะโพกหักสองข้างจากโรคกระดูกพรุน กระดูกสะโพกและกระดูกสันหลังหักจากโรคกระดูกพรุน หรือกระดูกหักจากโรคกระดูกพรุนซ้ำตั้งแต่ 3 ครั้ง หรือ 3 ตำแหน่งขึ้นไป
- มีกระดูกหักจากโรคกระดูกพรุนเกิดขึ้นในระหว่างที่ได้รับยารักษาโรคกระดูกพรุนอย่างสม่ำเสมอและต่อเนื่องเป็นระยะเวลาตั้งแต่ 2 ปีขึ้นไป ร่วมกับไม่พบสาเหตุอื่นของโรคกระดูกพรุนชนิดทุติยภูมิ
- ผู้หญิงอายุตั้งแต่ 65 ปีหรือผู้ชายอายุตั้งแต่ 70 ปี ที่มี T-score ≤ 3.5 ที่ตำแหน่งกระดูกสันหลังหรือกระดูกสะโพก
ยาที่ได้รับการยอมรับจาก FDA ในการใช้เพื่อป้องกัน / รักษาโรคกระดูกพรุนในหญิงวัยหมดประจำเดือน ได้แก่ Bisphosphonate, Calcitonin, Estrogens/Hormone therapy, Estrogen agonist/antagonist, Tissue-selective estrogen complex, Receptor activator of nuclear factor kappa-B (RANK) ligand (RANKL) inhibitor, Parathyroid hormone, Sclerostin inhibitor แบ่งตามกลไกออกได้เป็น 2 กลุ่ม(2) คือ กลุ่มที่ป้องกันการสลายของกระดูก (antiresorptive medications) ซึ่งได้แก่ Bisphosphonate, Calcitonin, Estrogens, SERM, RANK-RANKL inhibitor และกลุ่มที่ช่วยสร้างกระดูก (anabolic medications) ซึ่งได้แก่ Parathyroid hormone, Sclerostin inhibitor โดยการจะเลือกใช้ยานั้นขึ้นอยู่กับความรุนแรงของโรค, อายุ, ความต้องการ, อาการร่วมอื่นๆ และค่าใช้จ่ายของยา(2)
- Bisphosphonate
- ยาที่ได้รับการยอมรับโดย FDA ได้แก่ Alendronate, Ibandronate, Risedronate, และ Zoledronic acid
- ผลข้างเคียง: ปวดกระดูก/ข้อ/กล้ามเนื้อ, แคลเซียมในเลือดต่ำ, ตาอักเสบ, คลื่นไส้, ระคายเคืองทางเดินอาหาร นอกจากนี้ ยังมีผลข้างเคียงที่พบน้อยแต่รุนแรง ได้แก่ osteonecrosis of jaw และ atypical femur fracture(2)
ซึ่งหากพบภาวะทั้งสองเกิดขึ้น ควรพิจารณาหยุดยาทันที - ประเมินความเสี่ยงซ้ำหลังจากเริ่มการรักษา 3-5 ปี หากยังมีความเสี่ยงสูง พิจารณาให้การรักษาต่อ แต่หากความเสี่ยงต่ำถึงปานกลาง จะพิจารณาหยุดการให้ Bisphosphonate เป็นระยะเวลา 2-5 ปี หรือเรียกว่า “bisphosphonate holiday” ในระหว่างนี้ให้ติดตามมวลกระดูกร่วมกับประเมินความเสี่ยงทุก 2-4 ปี หากผลแย่ลง ให้พิจารณากลับมาเริ่มรักษาอีกครั้ง (2), (11)
- Calcitonin(2) (ชื่อทางการค้า Miacalcin®, Fortical®)
- เป็นฮอร์โมนที่สร้างจากต่อมไทรอยด์ ทำหน้าที่เกี่ยวกับเมตาบอลิซึมของกระดูก และควบคุมระดับแคลเซียมในร่างกาย
- แนะนำให้ใช้รักษาโรคกระดูกพรุนในหญิงที่หมดประจำเดือนมานานอย่างน้อย 5 ปีขึ้นไป
- ขนาดยา: 200 IU single daily intranasal spray
- ผลข้างเคียงของยาแบบพ่น: จมูกอักเสบ, เลือดกำเดาไหล, ปวดศีรษะ, ปวดหลัง/ข้อ
- ผลข้างเคียงของยาแบบฉีด: หน้าหรือมือแดง, ผื่น, คลื่นไส้, ปัสสาวะบ่อย
- Estrogen therapy / Hormone therapy(9)
- จุดประสงค์หลักของการรักษาด้วยวิธีนี้ เพื่อป้องกันโรคกระดูกพรุน, ลด vasomotor symptoms และ vulvovaginal atrophy ที่เกิดจากวัยหมดประจำเดือน
- ถ้ายังมีมดลูก พิจารณาให้เป็น combined estrogen-progestin therapy เพื่อลดความเสี่ยงของมะเร็งเยื่อบุมดลูก
- มีการศึกษาพบว่าการรักษาวิธีนี้เพิ่มความเสี่ยงต่อการเป็นเส้นเลือดหัวใจ/เส้นเลือดสมองตีบ, มะเร็งเต้านม, ลิ่มเลือดอุดกั้นในปอด, และลิ่มเลือดอุดตันในหลอดเลือดดำส่วนลึก หลังรักษาเป็นระยะเวลา 5 ปี(12) แต่อีกการศึกษาหนึ่งกลับพบว่าไม่เพิ่มความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจ(13)
- Selective estrogen receptor modulators (SERMs) (Raloxifene ชื่อทางการค้า Evista®)
- Estrogen agonist/antagonist
- ช่วยลดความเสี่ยงต่อการเกิดกระดูกสันหลังหัก 30-50%, ช่วยลดการเกิดมะเร็งเต้านม
- วิธีใช้: Raloxifene 60 mg 1 tab oral daily
- ผลข้างเคียง: ร้อนวูบวาบ, ตะคริวที่ขา, เพิ่มความเสี่ยงต่อการเกิดภาวะลิ่มเลือดอุดตันในหลอดเลือดดำ
- Tissue selective estrogen complex (TSEC) (Bazedoxifene ชื่อทางการค้า Duavee®)
- Conjugated estrogens/bazedoxifene
- แนะนำให้ใช้ในหญิงวัยหมดประจำเดือนที่ยังมีมดลูก และมีภาวะ vasomotor symptoms ในระดับปานกลางถึงมาก
- ช่วยลดความเสี่ยงต่อการเกิดภาวะ endometrial hyperplasia ที่เกิดจากการให้ estrogen อย่างเดียว ดังนั้น การใช้ยานี้จึงไม่จำเป็นต้องได้ยา progestin เพิ่มเติม
- วิธีใช้: Conjugated estrogens/bazedoxifene (0.45 mg/20 mg) วันละครั้ง
- ผลข้างเคียง: เวียนศีรษะ ปวดคอ เจ็บภายในช่องปาก คลื่นไส้ ปวดท้อง ท้องเสีย ตะคริว
- RANKL / RANKL inhibitor (Denozumab ชื่อทางการค้า Prolia®)
- ใช้สำหรับรักษาภาวะกระดูกพรุนในหญิงวัยหมดประจำเดือนที่ความเสี่ยงกระดูกหักสูง และแนะนำให้ใช้รักษาในหญิงที่เป็นมะเร็งเต้านม และรักษาด้วยยา Aromatase inhibitor
- วิธีใช้: Denosumab 60 mg ฉีดใต้ผิวหนัง ทุกๆ 6 เดือน
- ผลข้างเคียง: hypocalcemia (ดังนั้น ก่อนเริ่มยาควรมีการตรวจและแก้ไขแคลเซียมในเลือด), เพิ่มความเสี่ยงต่อการเกิดผิวหนังอักเสบ (cellulitis) หรือผื่น, อาจทำให้เกิดภาวะ osteonecrosis of jaw และ atypical femur fracture
- หลังการรักษาด้วยยากลุ่มนี้ ควรคงสภาพของมวลกระดูกต่อด้วยการให้ยาในกลุ่ม Antiresorptive
- Parathyroid hormone (Teriparatide ชื่อทางการค้า Forteo®)
- ปกติกลไกของ Parathyroid hormone คือ กระตุ้นการสลายแคลเซียมออกจากกระดูก ส่งผลให้มวลกระดูกลดลง แต่ได้มีการศึกษาในปี 1997 พบว่าการให้ PTH เข้าไป กลับพบว่ามีการสร้างกระดูกขึ้น จากการที่มีการสร้าง osteoblast เพิ่มมากขึ้น และยับยั้งการสลาย osteoblast ส่งผลให้มี bone turnover และ formation เพิ่มขึ้นมาแทน(14)
- แนะนำให้ใช้ในหญิงวัยหมดประจำเดือนที่มีภาวะกระดูกพรุนที่มีความเสี่ยงต่อการเกิดกระดูกหักสูงมาก
- วิธีใช้: Teriparatide 20 ug ฉีดใต้ผิวหนังวันละครั้ง โดยระยะเวลาในการให้ไม่ควรเกิน 18-24 เดือน
- หลังการรักษาด้วยยากลุ่มนี้ ควรคงสภาพของมวลกระดูกต่อด้วยการให้ยาในกลุ่ม Antiresorptive
- ผลข้างเคียง: เวียนศีรษะ คลื่นไส้ ตะคริว
- หลีกเลี่ยงการใช้ยานี้ในผู้ป่วยที่มีความเสี่ยงต่อการเกิดโรคมะเร็งกระดูก osteosarcoma (เช่น Paget’s disease of bone, prior radiation therapy of skeleton), bone metastasis, history of skeletal malignancy
- Tibolone (ชื่อทางการค้า Livial®)(11)
- Selective tissue estrogenic activity regulator (STEAR)
- ในยุโรปมีการใช้ยาตัวนี้เพื่อรักษา vasomotor symptoms และเพื่อป้องกันโรคกระดูกพรุน แต่อย่าง ไรก็ตาม ยาตัวนี้ไม่ได้ถูกยอมรับจาก FDA ว่าให้ใช้ในประเทศอเมริกา และแคนาดา (9), (11)
- แนะนำในรายที่มีความเสี่ยงกระดูกหักสูง, อายุน้อยกว่า 60 ปี หรือหมดประจำเดือนไปไม่เกิน 10 ปี, มีความเสี่ยงต่ำต่อการเกิดลิ่มเลือดอุดตันขา, มีอาการของ VSM, และไม่เหมาะกับการใช้ยากลุ่ม bisphosphonate หรือ denosumab
- ข้อห้ามในการใช้: มีประวัติโรคเส้นเลือดหัวใจตีบ/ตัน หรือเส้นเลือดสมองตีบ/แตก, เป็นมะเร็งเต้านม
- Romosozumab (ชื่อทางการค้า Evenity®) (15)
- Sclerostin inhibitor
- กลไก: ยับยั้งการทำงานของ Sclerostin ซึ่งเป็น Glycoprotein ที่สร้างจากเซลล์กระดูก Sclerostin มีหน้าที่ยับยั้ง Wnt signaling ที่มีบทบาทสำคัญในการเจริญของเซลล์ osteoblast
- แนะนำให้ใช้ในหญิงวัยหมดประจำเดือนที่มีภาวะกระดูกพรุนที่มีความเสี่ยงต่อการเกิดกระดูกหักสูงมาก
- เพิ่มการสร้างและลดการสลายของกระดูก หลังจากรักษาไปประมาณ 1 ปีสามารถเพิ่มมวลกระดูกสันหลังและสะโพก
- หลังการรักษาด้วยยากลุ่มนี้ ควรคงสภาพของมวลกระดูกต่อด้วยการให้ยาในกลุ่ม Antiresorptive
- วิธีใช้: Romosozumab 210 mg ฉีดเข้าใต้ชั้นผิวหนังทุกเดือน เป็นเวลา 12 เดือน
- ข้อระวังในการใช้: เพิ่มความเสี่ยงต่อการเกิดโรคเส้นเลือดหัวใจตีบ/ตัน หรือ เส้นเลือดสมองตีบ/แตก
การตรวจติดตาม (Follow up & Monitoring)
วัตถุประสงค์ของการติดตาม
- ประเมินวินัยในการรับประทานยา
- ประเมินความเสี่ยงของการเกิดกระดูกหัก
- ส่งเสริมการรับประทานยาแคลเซียมและวิตามินดี
- ประเมินความจำเป็นในการใช้ยาต่อ
สิ่งที่เราจะพิจารณาตรวจติดตาม ได้แก่
- ส่วนสูง
- ความหนาแน่นมวลกระดูก
- ภาพถ่ายรังสีของกระดูกสันหลัง
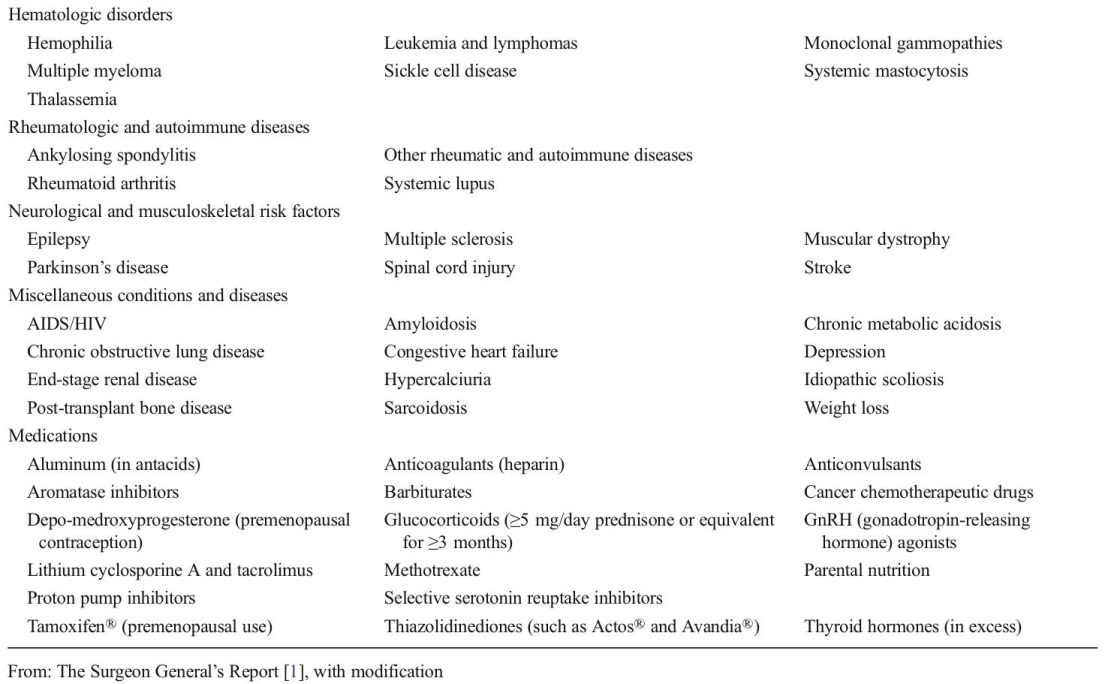 ตารางที่ 1 แสดงสาเหตุอื่นๆ ของภาวะกระดูกพรุน (Secondary causes of osteoporosis)(9)
ตารางที่ 1 แสดงสาเหตุอื่นๆ ของภาวะกระดูกพรุน (Secondary causes of osteoporosis)(9)
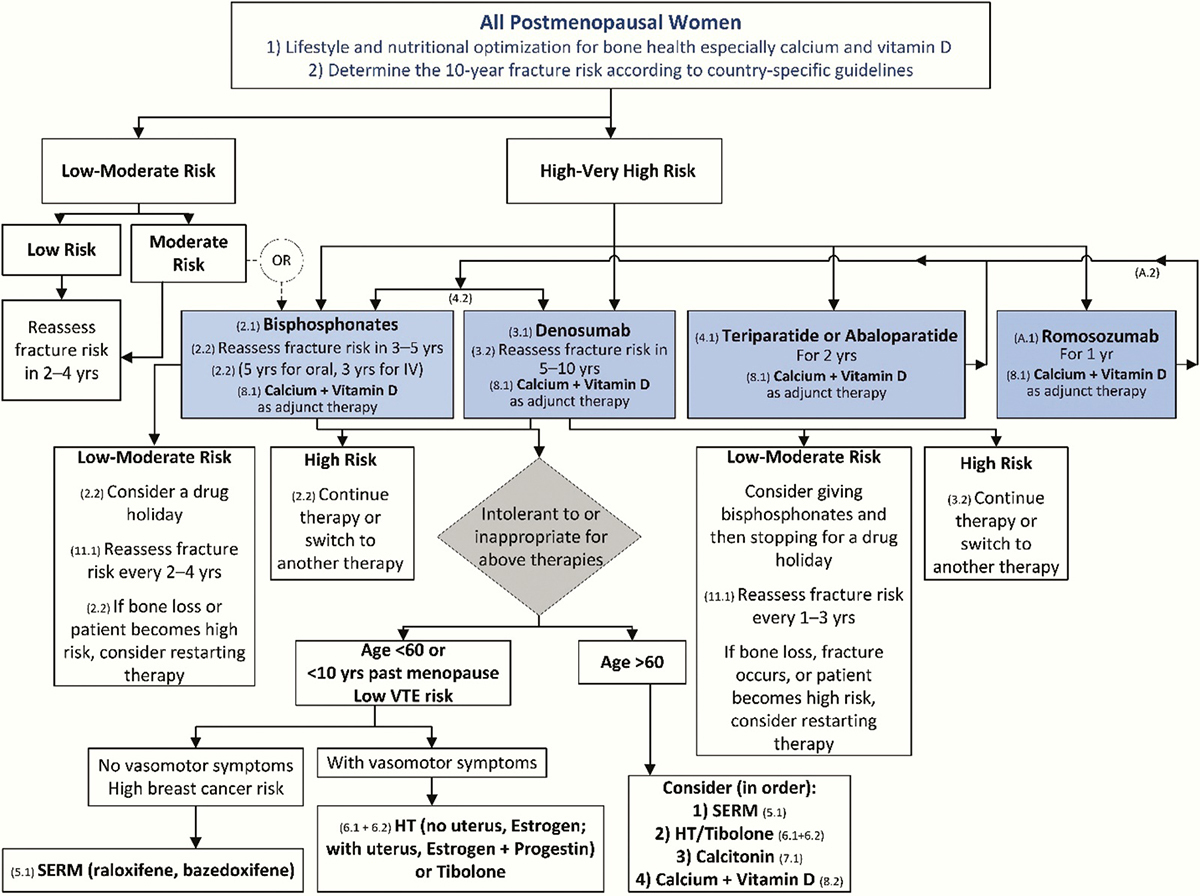
ภาพแสดง แนวทางการดูแลรักษาโรคกระดูกพรุนในหญิงวัยหมดประจำเดือน (15)
เอกสารอ้างอิง
1. Osteoporosis Prevention, Screening, and Diagnosis: ACOG Clinical Practice Guideline No. 1. Obstetrics & Gynecology. 2021;138(3):494-506.
2. Fontenot H, Harris A. Pharmacologic Management of Osteoporosis. Journal of obstetric, gynecologic, and neonatal nursing : JOGNN / NAACOG. 2014;43.
3. Sakondhavat C, Thangwijitra S, Soontrapa S, Kaewrudee S, Somboonporn W. Prevalence of osteoporosis in postmenopausal women at Srinagarind Hospital. Maturitas. 2009;63.
4. Limpaphayom KK, Taechakraichana N, Jaisamrarn U, Bunyavejchevin S, Chaikittisilpa S, Poshyachinda M, et al. Prevalence of osteopenia and osteoporosis in Thai women. Menopause. 2001;8(1):65-9.
5. Florencio-Silva R, Sasso GR, Sasso-Cerri E, Simões MJ, Cerri PS. Biology of Bone Tissue: Structure, Function, and Factors That Influence Bone Cells. Biomed Res Int. 2015;2015:421746.
6. Berek JS, Berek DL. Berek & Novak’s gynecology. Sixteenth edition. ed. Philadelphia: Wolters Kluwer; 2020.
7. มูลนิธิโรคกระดูกพรุนแห่งประเทศไทย. คำแนะนำเวชปฏิบัติการดูแลรักษาโรคกระดูกพรุน ฉบับย่อ 2564.
8. Larsen ER, Mosekilde L, Foldspang A. Vitamin D and calcium supplementation prevents osteoporotic fractures in elderly community dwelling residents: a pragmatic population-based 3-year intervention study. J Bone Miner Res. 2004;19(3):370-8.
9. Cosman F, de Beur SJ, LeBoff MS, Lewiecki EM, Tanner B, Randall S, et al. Clinician’s Guide to Prevention and Treatment of Osteoporosis. Osteoporos Int. 2014;25(10):2359-81.
10. Institute of Medicine Committee to Review Dietary Reference Intakes for Vitamin D, Calcium. The National Academies Collection: Reports funded by National Institutes of Health. In: Ross AC, Taylor CL, Yaktine AL, Del Valle HB, editors. Dietary Reference Intakes for Calcium and Vitamin D. Washington (DC): National Academies Press (US) Copyright © 2011, National Academy of Sciences.; 2011.
11. Shoback D, Rosen CJ, Black DM, Cheung AM, Murad MH, Eastell R. Pharmacological Management of Osteoporosis in Postmenopausal Women: An Endocrine Society Guideline Update. J Clin Endocrinol Metab. 2020;105(3).
12. Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML, et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results From the Women’s Health Initiative randomized controlled trial. Jama. 2002;288(3):321-33.
13. Manson JE, Allison MA, Rossouw JE, Carr JJ, Langer RD, Hsia J, et al. Estrogen therapy and coronary-artery calcification. N Engl J Med. 2007;356(25):2591-602.
14. Lindsay R, Nieves J, Formica C, Henneman E, Woelfert L, Shen V, et al. Randomised controlled study of effect of parathyroid hormone on vertebral-bone mass and fracture incidence among postmenopausal women on oestrogen with osteoporosis. Lancet. 1997;350(9077):550-5.
15. Shoback D, Rosen CJ, Black DM, Cheung AM, Murad MH, Eastell R. Pharmacological Management of Osteoporosis in Postmenopausal Women: An Endocrine Society Guideline Update. The Journal of Clinical Endocrinology & Metabolism. 2020;105(3):587-94.