Ovarian Hyperstimulation Syndrome (OHSS)
Ovarian Hyperstimulation Syndrome (OHSS)
พญ. ชลธิชา ตานา
อาจารย์ที่ปรึกษา อ. พญ. วรชร ลัทธิวงศกร
บทนำ
ภาวะรังไข่ถูกกระตุ้นมากเกินไป หรือ ovarian hyperstimulation syndrome (OHSS) คือ ภาวะที่รังไข่มีการตอบสนองที่มากเกินไปต่อการกระตุ้นไข่ในกระบวนการเทคโนโลยีช่วยการเจริญพันธุ์ ซึ่งภาวะนี้ถือเป็นภาวะแทรกซ้อนที่เกิดได้ไม่บ่อย แต่มีความสำคัญเนื่องจากในรายที่รุนแรงจะมีรังไข่ที่โตมาก มีน้ำในช่องท้องและช่องอก ปัสสาวะออกน้อย ความเข้มข้นของเลือดเพิ่มขึ้น เส้นเลือดอุดตันและอาจทำให้อันตรายถึงชีวิตได้ ส่วนใหญ่เกิดจากการกระตุ้นไข่ด้วย gonadotropins แต่การเกิดอาการไม่ได้ขึ้นกับขนาดยา gonadotropins เพราะบางรายที่ได้ยาปริมาณน้อยก็ทำให้เกิดอาการได้ นอกจากนี้ยังสามารถพบในการตั้งครรภ์เองได้ เช่นภาวะครรภ์ไข่ปลาอุก (molar pregnancy) หรือครรภ์แฝด เป็นต้น ซึ่งสัมพันธ์กับการมีฮอร์โมน human chorionic gonadotropin (hCG) สูง
อุบัติการณ์ของ OHSS มีความแตกต่างกันไปตามรายงาน โดยขึ้นอยู่กับคำจำกัดความและเกณฑ์ที่ใช้ในการแบ่งกลุ่มความรุนแรง โดยส่วนใหญ่พบว่ามีอาการรุนแรงน้อยถึงปานกลาง (mild to moderate OHSS)ร้อยละ 20-30 ส่วนกลุ่มที่มีอาการรุนแรงมาก(severe OHSS) พบได้ประมาณร้อยละ 2-3 ของรอบการกระตุ้นไข่ทั้งหมด(1) โดยผู้ป่วยที่เป็น polycystic ovarian syndrome จะมีโอกาสพบความรุนแรงสูงมากกว่าปกติ
พยาธิกำเนิด
กลไกหลักที่ทำให้เกิดภาวะนี้เชื่อว่ามาจากการที่มีรังไข่มีการตอบสนองที่มากเกินไปต่อการถูกกระตุ้น ทำให้มีการพัฒนาของไข่หลายใบ ขนาดของรังไข่โตขึ้น มีการสร้างหลอดเลือดใหม่ (angiogenesis) และมีการสร้างสาร vasoactive substances ปริมาณมาก ทำให้เกิด vascular permeability ที่เสียไปเกิดการรั่วของสารน้ำออกมานอกหลอดเลือด(fluid shift to third space) ไปสะสมตามบริเวณต่าง ๆเช่น pleural effusion , ascites, pericardial effusion เป็นต้น ทำให้เกิดอาการหายใจลำบาก อืดแน่นท้อง การบีบตัวของหัวใจลำปาก ปริมาณเลือดในหลอดเลือดลดลงทำให้เลือดไหลเวียนไปไตลดลง ทำให้เกิด hypotension ปัสสาวะออกน้อยลง และไตวายในที่สุด ถึงแม้ว่าปริมาณเลือดจะลดลงแต่เลือดมีความเข้มข้นที่มากขึ้น (hemoconcentration) ทำให้เกิดการแข็งตัวของเลือดง่ายขึ้น อาจเกิดการอุดตันของหลอดเลือดหรือเกิดการเคลื่อนที่ของก้อนลิ่มเลือดไปอุดตันตามเส้นเลือดที่อวัยวะสำคัญต่าง ๆ (thromboembolism) เช่นปอด หัวใจ และสมองเป็นต้น ซึ่งในรายที่มีอาการรุนแรงมากนั้นอาจทำให้เกิด multiorgan failure ได้แก่ acute respiratory distress syndrome (ARDS), renal failure, liver failure และเสียชีวิตได้ในที่สุด
โดยสาร vasoactive substances ที่มีบทบาทสำคัญที่สุดในการเกิด OHSS คือ vascular endothelial growth factor (VEGF) โดยพบว่าปริมาณ VEGF ที่มากขึ้นสัมพันธ์โดยตรง severity ของ OHSS อย่างมีนัยสำคัญ และสัมพันธ์กับระดับของ hCG ที่สูงขึ้น ยิ่งที่ให้มีการสร้าง VEGF ที่มากขึ้น และ VEGF expression ที่ granulosa cells มากขึ้นด้วย VEGF มีผลต่อ follicular growth, angiogenesis และ corpus luteum function โดยจับกับ VEGFR2 บนผนังหลอดเลือดเพิ่ม vascular permeability เกิดภาวะต่าง ๆ ตามมาดังกล่าวข้างต้น ส่วน local vasoactive substance อื่น ๆที่มีผล เช่น interleukins ( IL-1B, IL6), renin-angiotensin system , angiotensin-II, insulin-like growth factor 1(IGF-1), epidermal growth factor(EGF), transforming growth factor (TGF) เป็นต้น (2)
อาการและอาการแสดง
การวินิจฉัยภาวะรังไข่ถูกกระต้นมากเกินไป (OHSS) นั้นจะใช้อาการเป็นหลัก (clinical diagnosis) โดยการส่งตรวจเลือดทางห้องปฏิบัติการหรือการตรวจภาพทางรังสีนั้น อาจพิจารณาทำในเฉพาะบางรายที่ประเมินแล้วคิดว่ามีความจำเป็นเพิ่มเติมเพื่อช่วยในการประเมินความรุนแรงและภาวะแทรกซ้อนต่าง ๆหรือสงสัยจากการซักประวัติและการตรวจร่างกาย โดยทั่วไปจะมีการจำแนกกลุ่มของอาการ( classification) ออกเป็น 2 แบบ คือ แบ่งตามช่วงเวลาที่แสดงอาการ และแบ่งตามความรุนแรงของอาการ ดังนี้
1. แบ่งตามระยะเวลาที่เกิดอาการ
1.1 Early onset OHSS หมายถึง มีอาการแสดงของ OHSS เกิดขึ้นภายใน 9 วันแรก หลังจากได้ยากระตุ้นการตกไข่ (oocyte triggering) โดยกลไกการเกิดในกลุ่มนี้มักจะสัมพันธ์กับการตอบสนองของรังไข่ต่อยาที่ใช้กระตุ้น ซึ่งหากไม่มีการตั้งครรภ์เกิดขึ้นส่วนใหญ่อาการมักจะไม่รุนแรงและสามารถจะหายได้เอง
1.2 Late onset OHSS หมายถึง มีอาการแสดงของ OHSS เกิดขึ้นตั้งแต่วันที่ 10 ของการได้ยากระตุ้นการตกไข่เป็นต้นไป โดยกลไกการเกิดอาการในกลุ่มนี้สัมพันธ์กับฮอร์โมน hCG ที่ร่างกายสร้างขึ้นมาเองจาก trophoblast ของตัวอ่อน ซึ่งบ่งบอกว่าน่าจะมีการตั้งครรภ์เกิดขึ้น ในกลุ่มนี้มักจะมีอาการที่รุนแรงกว่า คงอยู่นานกว่า และมีโอกาสที่จะต้องได้รับการรักษาในโรงพยาบาลมากกว่ากลุ่มแรก
2.แบ่งตามความรุนแรง
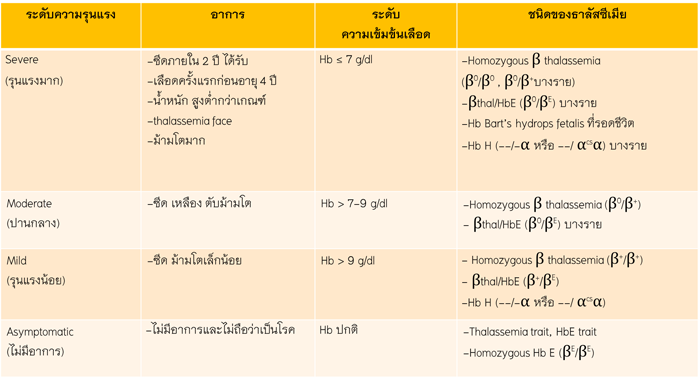
การแบ่งอาการตามความรุนแรงจะใช้ อาการ ขนาดของรังไข่ การตรวจพบน้ำในช่องท้อง (ascites) ผลการตรวจความเข้มข้นของเลือด โดยจะแบ่งเป็นกลุ่มที่มีอาการเล็กน้อย(mild) รุนแรงปานกลาง(moderate) รุนแรงมาก(severe) และอาการวิกฤต(critical) เพื่อประโยชน์ในการวางแผนการรักษาได้อย่างเหมาะสม ดังแสดงในตารางที่1
ตารางที่1 การจำแนกความรุนแรงของภาวะรังไข่ถูกกระตุ้นมากเกินไป
|
OHSS stage |
Clinical feature |
Laboratory feature |
|
Mild
|
Abdominal distension/discomfort Mild dyspnea Mild nausea/vomiting Diarrhea Enlarged ovaries |
No important alterations |
|
Moderate |
Mild features Ultrasonographic evidence of ascites |
Hemoconcentration (Hct >41%) Elevated WBC (>15,000 mL) |
|
Severe |
Mild and moderate feature Clinical evidence of ascites Severe dyspnea Pleural effusion Oliguria/anuria Intractable nausea/vomiting Low blood/central venous pressure Rapid weight gain (> 1kg/24 h) Severe abdominal pain Syncope Venous thrombosis |
Severe hemoconcentration (Hct > 55%) WBC > 25,000 mL CrCl <50 mL/min Cr > 1.6 mg/dL Na <135 mEq/L K > 5 mEq/L Elevate liver enzyme |
|
Critical
|
Anuria/Acute renal failure Arrhythmia Thromboembolism Pericardial effusion Massive pleural effusion Arterial thrombosis Adult respiratory distress syndrome Sepsis |
Worsening of finding |
ที่มา : Practice Committee of the American Society for Reproductive Medicine. Prevention and treatment of moderate and severe OHSS. Fertil Steril 2016.(3)
ปัจจัยเสี่ยง
ภาวะ OHSS นั้นสามารถเกิดขึ้นได้กับผู้ที่ได้รับการกระตุ้นไข่ด้วย gonadotropins แต่จากหลายการศึกษาที่ผ่านมาพบว่า โอกาสการเกิดจะสูงขึ้นอย่างมีนัยสำคัญในกลุ่มที่มีปัจจัยเสี่ยง ดังนั้นการประเมินปัจจัยเสี่ยงของผู้ป่วยก่อนที่จะเริ่มกระบวนการกระตุ้นไข่ ถือเป็นหลักการที่สำคัญที่จะป้องกันการเกิด OHSS ได้อย่างมีประสิทธิภาพ เนื่องจากมีประโยชน์ช่วยในการเลือกวิธีการและยาที่จะใช้ในการกระตุ้นไข่ โดยจะแบ่งปัจจัยเสี่ยงออกเป็นสองกลุ่ม คือ
1.ปัจจัยเสี่ยงปฐมภูมิ ได้แก่
ปัจจัยทางกายภาพ (demographics) เช่น อายุน้อยกว่า 35 ปี มีดัชนีมวลกายน้อย(BMI) มีภาวะ polycystic ovarian syndrome (PCOS) เชื้อชาติผิวดำ หรือเคยมีประวัติเป็น OHSS มาก่อน(4)
ปัจจัยทางชีวภาพ (biomarker) ได้แก่ ovarian reserve marker โดยพบว่าหากมีระดับของ AMH สูงกว่า 3.36 ng/ml ก่อนที่จะได้รับการกระตุ้นไข่เพิ่มโอกาสการเกิด OHSS อย่างมีนัยสำคัญและถือว่ามีความแม่นยำมากกว่าการใช้อายุและดัชนีมวลกายในการทำนาย คิดเป็นความไวร้อยละ 90.5 และความจำเพาะร้อยละ 81.3 (5) นอกจากนี้หากตรวจอัลตราซาวน์แล้วพบถุงไข่จำนวนมากกว่าหรือเท่ากับ 24 ใบ จะเพิ่มโอกาสการเกิด OHSS ถึงร้อยละ 8.6(6)
2.ปัจจัยเสี่ยงทุติยภูมิ
คือปัจจัยเสี่ยงที่เกิดขึ้นตามมาหลังจากกระบวนการกระตุ้นไข่ได้ดำเนินไปแล้ว โดยเป็นการตรวจเพื่อดูการตอบสนองของรังไข่ต่อการกระตุ้น โดยจากการศึกษาพบว่าสิ่งที่จะช่วยทำนายการเกิด OHSS ได้แก่ การตรวจพบว่ามีการเจริญของ follicles ที่มีขนาดใหญ่มากกว่าหรือเท่ากับ 10 มม. จำนวนมากกว่า 19 ใบ จำนวนไข่ที่เก็บได้มากกว่า 24 ใบ และ ระดับของ estradiol มากกว่า 3,500 pg/ml พบว่ามีความไวในการทำนาน OHSS ถึงร้อยละ 82 ความจำเพาะร้อยละ 90 (7)
การป้องกันการเกิดภาวะ OHSS
การป้องกันการเกิดภาวะ OHSS นั้นเป็นสิ่งสำคัญที่จะต้องคำนึงถึงทุกครั้งที่จะเริ่มให้การรักษาโดยการกระตุ้นไข่ แต่การจะป้องกันไม่ให้เกิดขึ้นเลยโดยสิ้นเชิงนั้นเป็นไปได้ยาก เนื่องจากกระบวนการกระตุ้นไข่นั้นจำเป็นต้องใช้ gonadotropins เพื่อเป้าหมายคือต้องการให้ได้ไข่จำนวนมากพอ และการศึกษาที่ผ่านมายังไม่สามารถกำหนดแบ่งชัดเจนถึงขนาดยาที่จะทำให้เกิดหรือไม่เกิดภาวะ OHSS ดังนั้นการป้องกันจึงมุ่งไปที่การลดโอกาสการเกิด OHSS ชนิดรุนแรงในรายที่ประเมินแล้วพบว่าอยู่ในกลุ่มที่มีความเสี่ยงสูง โดยสามารถทำในแต่ละขั้นตอนของวิธีการช่วยการเจริญพันธุ์ ดังต่อไปนี้
1.ระยะการเตรียมและคัดเลือกคู่สมรส
1.1 ประเมินเพื่อคัดกรองหารายความเสี่ยงสูง เพื่อวางแผนการกระตุ้นไข่ที่เหมาะสม
1.2 ให้คำแนะนำทุกขั้นตอนของการรักษา
2.ระยะการกระตุ้นไข่ (controlled ovarian hyperstimulation)
2.1 GnRH antagonist protocol
การกระตุ้นไข่โดยทั่วไปจะใช้ยากระตุ้นไข่(gonadotropins) ร่วมกับการให้ยาต้านฮอร์โมนจากต่อมใต้สมอง (prevent premature LH surge) ซึ่งสูตรยาที่ใช้ยับยั้งต่อมใต้สมองที่มีใช้ในปัจจุบันมี 2 กลุ่ม คือ GnRH agonist และ GnRH antagonist หากประเมินแล้วพบว่ามีความเสี่ยงสูงต่อการเกิด OHSS ควรจะเลือกใช้ GnRH antagonist protocol เนื่องจากมีการศึกษาแล้วพบว่าเกิด OHSS น้อยกว่าสูตรอื่น Cochrane review ปี 2016 โดย Al-Inany และคณะพบว่าการใช้ GnRH antagonist protocol นั้นสามารถลดการเกิด OHSS ได้อย่างมีนัยสำคัญโดยที่ผล live birth rate ไม่แตกต่างกันเมื่อเทียบกับ GnRH agonist protocol (8) เชื่อว่าสาเหตุเนื่องจาก GnRH antagonist นั้นจะสามารถยับยั้งการหลั่งฮอร์โมนจากต่อมใต้สมองได้ทันทีที่ได้รับยาและมีระดับของ estradiol ที่ต่ำกว่า นอกจากนั้นการใช้ GnRH agonist แทน hCG ในขั้นตอน oocyte maturation ยังมีส่วนช่วยสนับสนุนการลด OHSS ใน antagonist protocol อีกด้วย
2.2 ลดขนาดของ gonadotropins โดยให้ในขนาดที่ต่ำกว่าคนทั่วไปในรายที่มีความเสี่ยงสูง
2.3 Insulin sensitizing agents (Metformin)
ในรายที่มีประวัติเป็น polycystic ovarian syndrome (PCOS) จะมีภาวะ insulin resistance มีผลให้รังไข่สร้างฮอร์โมน androgen สูงกว่าคนทั่วไป ซึ่งผลของฮอร์โมน androgen นี้จะทำให้รังไข่มีการตอบสนองต่อ gonadotropins ที่สูงกว่าปกติ (androgen priming theory) ทำให้ผู้ป่วย PCOS มีความเสี่ยงที่จะเกิด OHSS สูง ดังนั้นเชื่อว่าการให้ metformin ซึ่งเป็น insulin sensitizing agents จะช่วยลด การสร้าง androgen ของรังไข่ และลดการตอบสนองต่อ gonadotropins ตามมา การศึกษา meta-analysis ปี 2015 ของ Xiaman H.และคณะศึกษาการให้ metformin ในผู้ป่วย PCOS ที่เข้ารับการรักษา ART พบว่า metformin อาจไม่ช่วย improve pregnancy outcome แต่สามารถลดการเกิด OHSS ชนิดรุนแรงได้อย่างมีนัยสำคัญ(9)
2.4 ASA
สาร VEGF ที่เป็นตัวหลักในการเกิด OHSS นั้น สามารถกระตุ้น platelet ให้สร้างสาร vasoactive substance อื่น ๆ ที่ส่งเสริมให้เกิดการเพิ่มขึ้นของ vascular permeability เกิดภาวะ OHSS ตามมา ดังนั้นจึงเชื่อว่าการให้ ASA ซึ่ง inhibit platelet function (inhibit COX-1) ทำให้ลดการหลั่งสาร histamine, serotonin, platelet derived growth factor, lysophosphatidic acid จึงลดการเกิด OHSS ได้ โดยขนาดของยาที่ใช้เป็นขนาดต่ำ 100 mg/day เริ่มตั้งแต่วันแรกที่มีการกระตุ้นไข่ การหยุดยานั้นหากในรอบที่ไม่มีการย้ายตัวอ่อนจะหยุดเมื่อเริ่มมีประจำเดือนครั้งถัดไป แต่หากมีการย้ายตัวอ่อนจะหยุดยาเมื่อพบการเต้นของหัวใจทารกจากอัลตราซาวน์ (10)
2.5 การตรวจติดตามระหว่างการดำเนินการกระตุ้นไข่
การตรวจติดตามดูระดับของ estradiol ในเลือด และจำนวนไข่ที่ได้จากอัลตราซาวน์ หากมี estradiol สูงเกิน 3,500 pg/ml หรือ จำนวนไข่ที่มีขนาดโตกว่า 10 mm มากว่า 19 ใบ พบว่าความเสี่ยงในการเกิด OHSS จะสูงอย่างมีนัยสำคัญ ซึ่งควรที่จะมีการลดขนาด gonadotropins หรือหยุดให้ไปช่วงหนึ่ง หรือ เปลี่ยนมาใช้ GnRH agonist ในการ trigger แทน hCG หรือหากฮอร์โมน estradiol สูงมาก ๆ ก็อาจจะต้องพิจารณาหยุดกระบวนการทั้งหมดในการกระตุ้นไข่รอบนั้น ๆไป
3. ระยะชักนำการตกไข่
3.1 GnRH agonist for triggering final maturation แทนการใช้ hCG
ยาที่ใช้เพื่อทำให้เกิดการพัฒนาขั้นสุดท้ายของไข่ (final maturation) ซึ่งเป็นการเลียนแบบการหลั่ง LH จากต่อมใต้สมอง (LH surge) ที่มีใช้ทั่วไปคือ ฮอร์โมน hCG ซึ่งมีโครงสร้างคล้ายกับ LH จับ LH receptor แต่เนื่องจาก hCG มีค่าครึ่งชีวิตที่นานกว่าจึงออกฤทธิ์กระตุ้น corpus luteum หลังการเก็บไข่ได้นานและนำไปสู่การเกิด OHSS ได้ ดังนั้นหากประเมินแล้วพบว่าผู้ป่วยมีความเสี่ยงสูงที่จะเกิด OHSS จึงควรเลือกใช้ยาตัวอื่นแทน ซึ่งก็คือ GnRH agonist ที่ออกฤทธิ์กระตุ้นให้เกิดการหลั่ง endogenous LH จากต่อมใต้สมอง จึงลดโอกาสเกิด OHSS ได้ Cochrane review ในปี 2014 รวบรวม 17 การศึกษา เปรียบเทียบการใช้ GnRH agonist กับ hCG ในการ trigger ovulation พบว่ากลุ่ม GnRH agonist ลดการเกิด OHSS ชนิดรุนแรงได้ทั้งใน donor cycle และ fresh cycle แต่มี live birth rate ที่ด้อยกว่าในกลุ่ม fresh cycle (11)
3.2 Dopamine agonist
Cabergoline ( dopamine agonist) สามารถออกฤทธิ์ยับยั้ง VEGF ได้โดยการจับจับ VEGF receptor2 (VEGFR-2) แล้วไปยับยั้งกระบวนการ phosphorylation มีผลให้ลด vascular permeability และลดการเกิด OHSS ได้ โดยการศึกษาของ Valeria M. ในปี 2014 พบว่าการให้ cabergoline 500 mcg/day เป็นเวลา 8 วันเริ่มทานในวันที่มีการให้ GnRH agonist หรือ hCG เพื่อ trigger ovulation สามารถลดการเกิด OHSS ได้อย่างมีนัยสำคัญเมื่อเทียบกับกลุ่มที่ไม่ได้ยา โดยไม่มีผลต่อจำนวนไข่ที่เก็บได้หรือผลต่อการตั้งครรภ์ (12)
3.3 Coasting
คือการหยุด gonadotropins ระหว่างกระตุ้นไข่และเลื่อนการฉีด hCG ออกไป มักจะทำเมื่อมีการตรวจติดตามแล้วพบว่าระดับฮอร์โมน estradiol สูงเกิน 3,000 pg/ml เนื่องจากมีโอกาสเสี่ยงสูงที่จะเกิด OHSS แล้วรอให้ระดับ estradiol ลดลงมาต่ำกว่า 3,000 pg/ml จึงเริ่มการ trigger ovulation และเก็บไข่ต่อไป โดยใช้หลักการคือหากมีการหยุด gonadotropins ไปแล้ว ไข่ที่โตพอเป็น mature follicles จะยังคงสามารถเจริญต่อไปได้ แต่ small follicles จะเกิดการ apoptosis ไป ในระยะที่มีการหยุด FSH และรอนี้เรียกว่า “coasting period” ใช้เวลาตั้งแต่ 2-10 แต่จากศึกษา Cochrane review ในปี 2017 ยังไม่พบว่า coasting มีข้อเหนือกว่าวิธีการอื่นในการป้องกัน OHSS และหากระยะเวลา coasting มากกว่า 4 วันขึ้นไปยังลด pregnancy rate อีกด้วย(13)
3.4 Cycle cancellation
จะพิจารณาในกรณีที่ระดับฮอร์โมน estradiol สูงมาก ๆ หรือมี follicles โตปริมาณมาก หากดำเนินการกระตุ้นไข่ต่อไปหรือ trigger ovulation อาจจะมีความเสี่ยงสูงมากต่อการเกิด OHSS จึงอาจต้องพิจารณาหยุดกระบวนการทั้งหมดในการกระตุ้นไข่ไป และไม่ทำการเก็บไข่ในรอบนั้น วิธีนี้ถือเป็นวิธีที่มีประสิทธิภาพสูงสุดที่จะยับยั้งไม่ให้เกิด OHSS แต่จะพิจารณาเป็นทางเลือกสุดท้าย เนื่องจากค่าใช้จ่ายที่ดำเนินการไปแล้วเป็นภาระต่อผู้ป่วยนอกจากนี้ยังต้องคำนึงถึงสภาพจิตใจของผู้ป่วยด้วย
4.ระยะเก็บไข่
4.1 Albumin
การให้ albumin ซึ่งเป็นตัวช่วยเพิ่ม plasma oncotic pressure เพื่อหวังผลลดการเกิด fluid shift to extravascular space และยังอาจไปจับกับสารบางอย่างที่รังไข่สร้างขึ้นที่เป็นผลให้เกิด OHSS นั้นยังไม่แนะนำให้ทุกราย เนื่องจากในปัจจุบันยังไม่มีหลักฐานสนับสนุนชัดเจนว่ามีประโยชน์ช่วยป้องกัน OHSS
4.2 Calcium gluconate
การให้ Calcium gluconate นั้นเพื่อเพิ่มระดับความเข้มข้นของ calcium ในกระแสเลือด ยับยั้ง cyclic AMP มีผลลดการหลั่ง renin และลดการเปลี่ยน angiotensinogen ไปเป็น angiotensin ลดการสร้าง VEGF โดยให้ 10% calcium gluconate 10 ml ภายใน30 นาทีหลังการเก็บไข่ หลังจากนั้นให้ต่อ อีก 3 วัน มีการศึกษาพบว่าสามารถลดการเกิด OHSS ได้โดยที่ไม่ส่งผลต่ออัตราการตั้งครรภ์(14)
5.ระยะย้ายตัวอ่อน
5.1 Cryopreservation of all embryos
เนื่องจากการตั้งครรภ์นั้นทำให้เกิดภาวะ late onset OHSS ได้ ซึ่งจะมีความรุนแรงเพิ่มขึ้นและเป็นนานขึ้น ในรายที่มีความเสี่ยงสูงต่อการเกิด OHSS หลังจากทำการเก็บไข่ (oocyte pick up) ผสมกับอสุจิจนเป็นตัวอ่อนแล้ว จะทำการแช่แข็งตัวอ่อนเก็บไว้ทั้งหมด ยังไม่ทำการย้ายตัวอ่อนในรอบการกระตุ้นไข่นั้น แล้วจึงค่อยนำมาย้ายตัวอ่อนสู่โพรงมดลูกในรอบระดูถัดไป อย่างไรก็ตามวิธีนี้จะไม่สามารถป้องกัน early onset OHSS ได้ แต่ป้องกัน late onset OHSS ได้ มีการศึกษาที่ผ่านมาพบว่าด้วยเทคโนโลยีการแช่แข็งตัวอ่อนที่พัฒนามากขึ้นทำให้อัตราการตั้งครรภ์โดยวิธีนี้ได้ผลเป็นที่น่าพอใจไม่แตกต่างจากการย้ายตัวอ่อนทันที
5.2 หลีกเลี่ยงการให้ hCG for luteal support
เนื่องจากในการกระตุ้นไข่นั้นมีการใช้ยาเพื่อกดการทำงานของต่อมใต้สมอง คือ ยากลุ่ม GnRH agonist หรือ antagonist ซึ่งหลังการหยุดยาแล้ว gonadotropins จะถูกยับยั้งต่อไปอีก 7-14 วัน เป็นผลให้อาจมีการขาด LH ซึ่งมีความจำเป็นต่อการทำงานของ corpus luteum ทำให้ สร้างฮอร์โมน progesterone ได้ไม่เพียงพอต่อการเตรียมเยื่อบุโพรงมดลูกเพื่อรับการตั้งครรภ์ การให้ฮอร์โมนพยุงการตั้งครรภ์ภายหลังการย้ายตัวอ่อน (luteal phase support) จึงมีความจำเป็นสำหรับผู้ป่วยกลุ่มนี้
โดยทั่วไปยาที่นิยมใช้ ได้แก่ hCG และ progesterone แต่เนื่องจากพบว่า การใช้ hCG เพิ่มโอกาสการเกิด OHSS ดังนั้นในรายที่มีความเสี่ยงจึงควรหลีกเลี่ยงการให้ hCG ควรเลือกให้เป็น progesterone แทน โดยเริ่มตั้งแต่วันแรกที่มีการ trigger ovulation หรือวันที่เก็บไข่ หรือวันที่จะทำการย้ายตัวอ่อน และมักจะให้จนอายุครรภ์ประมาณ 8-12 สัปดาห์
การดูแลรักษาผู้ป่วย OHSS
หลักการสำคัญในการรักษาภาวะ OHSS คือการรักษาตามอาการ จนกระทั่งการดำเนินโรคค่อยๆดีขึ้นเอง ดังนั้นในรายที่มีอาการน้อยถึงปานกลาง (mild to moderate) มักจะสามารถให้การรักษาแบบผู้ป่วยนอกได้ และให้การตรวจติดตามอย่างใกล้ชิด ส่วนในรายที่มีอาการรุนแรงมาก (severe) มีความจำเป็นต้องให้การรักษาในโรงพยาบาล(15)
1.การรักษาแบบผู้ป่วยนอก
ในกรณีที่ผู้ป่วยจัดอยู่ในกลุ่มที่มีอาการ mild to moderate OHSS และสามารถให้ความร่วมมือในการรักษาและประเมินตัวเองทุกวันได้ มารับการตรวจติดตามได้อย่างใกล้ชิด จึงสามารถให้การดูแลแบบผู้ป่วยนอกได้ ซึ่งหลักการในการให้การดูแลมีดังนี้
- การให้คำอธิบายถึงการดำเนินโรค เพื่อให้ผู้ป่วยมีความตระหนักถึงความสำคัญในการประเมินอาการด้วยตนเองและการมารับการตรวจติดตามอย่างใกล้ชิด
- การให้ยาเพื่อรักษาตามอาการที่เกิดขึ้น เช่น ลดอาการปวด คลื่นไส้อาเจียน หรือเกลือดแร่แทน เป็นต้น
- ดื่มน้ำอย่างน้อยวัยละ 1 ลิตร
- ชั่งน้ำหนักตัวทุกวัน เพิ่มขึ้นได้ไม่เกิน 0.91 กิโลกรัมต่อวัน
- สังเกตปัสสาวะทั้งความถี่ และปริมาณปัสสาวะ
- สามารถทำกิจกรรมในชีวิตประจำวันได้ หลีกเลี่ยงการมีเพศสัมพันธ์ ไม่ควรทำกิจกรรมที่ต้องเคลื่อนไหวใช้แรงมาก เนื่องจากรังไข่มีขนาดใหญ่มีโอกาสเกิดภาวะแทรกซ้อนได้ง่าย เช่น บิดขั้ว (torsion) หรือ มีเลือดออก (hemorrhage) เป็นต้น แต่ไม่ควรนอนพักมากเกินไป เพราะมีความเสี่ยงที่จะเกิดลิ่มเลือดอุดตันได้ เช่นกัน
- สังเกตอาการที่แสดงถึงการดำเนินโรคที่รุนแรงมากขึ้น เช่น อาการหายใจเหนื่อย อืดแน่นท้อง ท้องโตขึ้น ปวดท้องมากขึ้นมาฉับพลัน มีปัสสาวะออกน้อยลง มีอาการปวดขาและขาบวม เป็นต้น หากมีอาการเหล่านี้ผู้ป่วยต้องมารับการตรวจประเมินที่โรงพยาบาลทันที
- การนัดตรวจติดตามเพื่อประเมินอาการและผลการตรวจเลือดโดย อาจจะนัดทุก 2-3 วัน โดยจะถือว่ามีการเปลี่ยนแปลงอย่างมีนัยสำคัญเมื่อ
- Hemoconcentration (Hct > 55%)
- WBC > 25,000 mL
- CrCl <50 mL/min
- Cr > 1.6 mg/dL
- Na <135 mEq/L
- K > 5 mEq/L
- Elevate liver enzyme มากกว่า 2 เท่าของ upper normal limit
2. การรักษาแบบผู้ป่วยใน
ในกรณีที่มีอาการรุนแรง (severe OHSS) หรือได้รับการรักษาแบบผู้ป่วยนอกแล้วอาการไม่ดีขึ้น ควรได้รับการรักษาในโรงพยาบาลอย่างใกล้ชิด โดยมีแนวทางในการให้การดูแลดังนี้
- การให้สารน้ำอย่างเหมาะสม
- โดยเบื้องต้นจะให้ normal saline 500-1,000 ml intravenous bolus เพื่อแก้ไขภาวะ hemoconcentration หลังจากนั้นปรับ ให้ maintenance ต่อเพื่อให้มี urine output มากกว่า 0.5 ml/kg/hr
- การให้ 25% Albumin 50-100 g และให้ซ้ำได้ทุก 4-12 ชั่วโมงตามความจำเป็น albumin เป็นสารในกลุ่ม volume expander สามารถให้ได้เมื่อไม่สามารถ หลังจากให้สารน้ำ normal saline อย่างเหมาะสมแล้ว
- หลีกเลี่ยงการให้ dextran เนื่องจากทำให้เกิด acute respiratory distressได้
- Diuretic มีข้อบ่งชี้ในการให้เมื่อไม่สามารถควบคุม urine output ให้ได้ตามเกณฑ์ หลังจากได้สารน้ำอย่างเพียงพอแล้ว และเริ่มมีอาการที่บ่งบอกว่าจะมีสารน้ำเกินในร่างกาย
- การตรวจติดตามเลือดเป็นระยะ ได้แก่ CBC, electrolyte, creatinine, liver enzyme
- การตรวจภาพทางรังสีทรวงอกและอัลตราซาวน์ ทำในรายที่สงสัย
- ตรวจประเมิน เป็นระยะในเรื่องของ สัญญาณชีพ ปริมาณน้ำเข้า/ ออก น้ำหนักตัว รอบเอว ตรวจประเมินน้ำในท้อง ฟังปอด เป็นต้น
- การป้องกันการเกิด thromboembolism เช่น
- full length compressive venous stocking
- low molecular weight heparin (LMWH) 5,000 unit subcutaneous วันละครั้ง พิจารณาให้เป็นบางรายที่มีความเสี่ยงสูงมาก เช่น มีประวัติภาวะลิ่มเลือดอุดตันง่าย (thrombophilia) ไม่สามารถเคลื่อนไหวลงเตียงได้ หรือ ภาวะ hemoconcentration ที่ไม่สามารถแก้ไขได้ หลังให้สารน้ำไปแล้ว 48 ชั่วโมง (hematocrit >50%)
- โดยตามคำแนะนำของ American college of chest physician แนะนำให้ LMWH ต่อเนื่องไป 3 เดือน หลังเกิด severe OHSS
- การเจาะระบายน้ำในช่องท้อง (abdominal paracentesis)
- มีข้อบ่งชี้เมื่อ
- มีอาการอืดแน่นท้องมากจาก tense ascites
- ทำให้เกิดการหายใจลำบาก
- การเจาะน้ำในท้องนั้นอาจะทำผ่านทางหน้าท้องหรือช่องคลอดก็ได้ แต่จะต้องทำภายใต้การทำอัลตราซาวน์ เพื่อหลีกเลี่ยงการเจาะโดนรังไข่ที่มีขนาดใหญ่มาก
- มีข้อบ่งชี้เมื่อ
- การเจาะระบายน้ำในช่องปอด
- มีข้อบ่งชี้เมื่อ ยังมีน้ำในช่องปอดมากหลังจากเจาะน้ำในท้องไปแล้ว และทำให้การหายใจได้ไม่เต็มที่ ต้องการเครื่องช่วยหายใจ เป็นต้น
- สามารถทำได้โดยใช้เครื่องอัลตราซาวน์ช่วย
- ในรายที่ critical OHSS อาจมีความจำเป็นต้องพิจารณายุติการตั้งครรภ์ เพื่อยุติการดำเนินโรค
เอกสารอ้างอิง
- Papanikolaou EG, Pozzobon C, Kolibianakis EM, Camus M, Tournaye H, Fatemi HM, et al. Incidence and prediction of ovarian hyperstimulation syndrome in women undergoing gonadotropin-releasing hormone antagonist in vitro fertilization cycles. Fertil Steril. 2006;85(1):112-20.
- Whelan JG, 3rd, Vlahos NF. The ovarian hyperstimulation syndrome. Fertil Steril. 2000;73(5):883-96.
- Prevention and treatment of moderate and severe ovarian hyperstimulation syndrome: a guideline. Fertil Steril. 2016;106(7):1634-47.
- Luke B, Brown MB, Morbeck DE, Hudson SB, Coddington CC, 3rd, Stern JE. Factors associated with ovarian hyperstimulation syndrome (OHSS) and its effect on assisted reproductive technology (ART) treatment and outcome. Fertil Steril. 2010;94(4):1399-404.
- Lee TH, Liu CH, Huang CC, Wu YL, Shih YT, Ho HN, et al. Serum anti-Mullerian hormone and estradiol levels as predictors of ovarian hyperstimulation syndrome in assisted reproduction technology cycles. Hum Reprod. 2008;23(1):160-7.
- Jayaprakasan K, Chan Y, Islam R, Haoula Z, Hopkisson J, Coomarasamy A, et al. Prediction of in vitro fertilization outcome at different antral follicle count thresholds in a prospective cohort of 1,012 women. Fertil Steril. 2012;98(3):657-63.
- Kahnberg A, Enskog A, Brannstrom M, Lundin K, Bergh C. Prediction of ovarian hyperstimulation syndrome in women undergoing in vitro fertilization. Acta Obstet Gynecol Scand. 2009;88(12):1373-81.
- Al-Inany HG, Youssef MA, Ayeleke RO, Brown J, Lam WS, Broekmans FJ. Gonadotrophin-releasing hormone antagonists for assisted reproductive technology. Cochrane Database Syst Rev. 2016;4:CD001750.
- Huang X, Wang P, Tal R, Lv F, Li Y, Zhang X. A systematic review and meta-analysis of metformin among patients with polycystic ovary syndrome undergoing assisted reproductive technology procedures. Int J Gynaecol Obstet. 2015;131(2):111-6.
- Varnagy A, Bodis J, Manfai Z, Wilhelm F, Busznyak C, Koppan M. Low-dose aspirin therapy to prevent ovarian hyperstimulation syndrome. Fertil Steril. 2010;93(7):2281-4.
- Youssef MA, Van der Veen F, Al-Inany HG, Mochtar MH, Griesinger G, Nagi Mohesen M, et al. Gonadotropin-releasing hormone agonist versus HCG for oocyte triggering in antagonist-assisted reproductive technology. Cochrane Database Syst Rev. 2014(10):CD008046.
- Leitao VM, Moroni RM, Seko LM, Nastri CO, Martins WP. Cabergoline for the prevention of ovarian hyperstimulation syndrome: systematic review and meta-analysis of randomized controlled trials. Fertil Steril. 2014;101(3):664-75.
- D’Angelo A, Amso NN, Hassan R. Coasting (withholding gonadotrophins) for preventing ovarian hyperstimulation syndrome. Cochrane Database Syst Rev. 2017;5:CD002811.
- El-Khayat W, Elsadek M. Calcium infusion for the prevention of ovarian hyperstimulation syndrome: a double-blind randomized controlled trial. Fertil Steril. 2015;103(1):101-5.
- Practice Committee of American Society for Reproductive M. Ovarian hyperstimulation syndrome. Fertil Steril. 2008;90(5 Suppl):S188-93.