การติดเชื้อไวรัสเอชไอวีในสตรีตั้งครรภ์
การติดเชื้อไวรัสเอชไอวีในสตรีตั้งครรภ์
(Human Immunodeficiency Virus infection in pregnancy)
พญ.จุฬาลักษณ์ จิระพัฒน์สกุล
อาจารย์ที่ปรึกษา ร.ศ.พ.ญ. เกษมศรี ศรีสุพรรณดิฐ
1. บทนำ
การติดเชื้อไวรัสเอชไอวี (Human immundeficiency virus infection : HIV) ทำให้เกิดกลุ่มอาการภูมิคุ้มกันบกพร่อง(Acquired immunodeficiency syndrome: AIDS) ซึ่งปัจจุบันยังไม่มีการรักษาที่หายขาด แต่สามารถควบคุมการติดเชื้อ โดยการให้ยาต้านไวรัสที่ทำให้ผู้ป่วยมีคุณภาพชีวิตที่ดีขึ้น มีการติดเชื้อแทรกซ้อนลดลง โดยเฉพาะในหญิงตั้งครรภ์ ซึ่งจะกล่าวในที่นี้ ควรจะมีการดูแลที่เป็นระบบรวมถึงการให้คำปรึกษา เป้าหมายคือเพื่อให้มารดามีสุขภาพที่ดี ได้รับยาต้านไวรัสที่เหมาะสมและลดอัตราการถ่ายทอดเชื้อจากมารดาสู่ทารก
2. ระบาดวิทยา
เชื้อไวรัส HIV เป็นไวรัสชนิด RNA retrovirus โดยแบ่งเป็นสองสายพันธุ์ได้แก่ HIV-1 ซึ่งพบเป็นส่วนใหญ่ทั่วโลก และ HIV-2 ที่พบส่วนใหญ่ในประเทศแถบทวีปแอฟริกา การติดต่อสามารถติดต่อได้ทางการสัมผัสเลือด(รับเลือดหรือฉีดยาเสพติด) ทางเพศสัมพันธ์ และทางมารดาสู่ทารกขณะตั้งครรภ์ รวมไปถึงการให้นมบุตร โดยในประเทศไทยมีรายงานผู้ป่วยรายแรกเมื่อปี พ.ศ. 2527 และเริ่มมีรายงานการติดเชื้อเอชไอวีในหญิงตั้งครรภ์ตั้งแต่ปี พ.ศ.2531 โดยค่าเฉลี่ยการติดเชื้อในหญิงตั้งครรภ์ในปี พ.ศ. 2556 คิดเป็นร้อยละ 0.6 ซึ่งมีแนวโน้มลดลงจากร้อยละ 0.8 ในปีพ.ศ.2551(1)
จากฐานข้อมูลของสำนักงานหลักประกันสุขภาพแห่งชาติ โดยอ้างอิงจากรายงานเด็กที่รับการตรวจหาการติดเชื้อเอชไอวีด้วยวิธี PCR พบว่าอัตราการติดเชื้อเอชไอวีจากแม่สู่ลูกลดลงจากร้อยละ 3.8 ในปี พ.ศ.2551 เหลือร้อยละ 2.1 ในปี พ.ศ. 2555 แต่หากใช้วิธีคาดประมาณเพื่อรวมเด็กที่ไม่ได้รับการตรวจ PCR โดยใช้สัดส่วนของสูตรยาต้านไวรัสที่แม่ได้รับระหว่างตั้งครรภ์ พบอัตราการติดเชื้อเอชไอวีจากแม่สู่ลูกจะอยู่ที่ร้อยละ 4.6 ในปี พ.ศ.2551 และลดลงเหลือร้อยละ 2.8 ในปี พ.ศ. 2555 อย่างไรก็ตามก็ยังไม่ถึงเป้าหมายของกระทรวงสาธารณสุขที่ต้องการลดอัตราการติดเชื้อเอชไอวีจากแม่สู่ลูกให้ต่ำกว่าร้อยละ 2
3. การถ่ายทอดเชื้อHIVจากมารดาสู่ทารก
ทารกสามารถได้รับเชื้อจากมารดาได้ 3 ทางดังนี้
- ทางรก (transplacental transmisssion) เชื้อไวรัสเอชไอวีสามารถผ่านรกไปสู่ทารกในครรภ์ได้ อาจพบได้ตั้งแต่ระยะแรกของการตั้งครรภ์
- ขณะคลอด(intrapartum) โดยการสัมผัสเลือดและสารคัดหลั่งระหว่างคลอด
- ทางน้ำนม (breastfeeding) โดยอัตราการติดเชื้อเป็นได้ตั้งแต่ ร้อยละ 5-20 (2) ซึ่งขึ้นกับปัจจัยต่างๆ ได้แก่ ระดับ HIV-RNA ในมารดา ,ระดับภูมิคุ้มกันในมารดา , เต้านมมีความผิดปกติ เช่น การอักเสบ และระยะเวลาการเลี้ยงลูกด้วยนมมารดา
การถ่ายทอดเชื้อเอชไอวีจากแม่สู่ลูก เกิดขึ้นตั้งแต่ในระยะแรกของการตั้งครรภ์ โดยพบว่าทารกที่เกิดจากมารดาที่ติดเชื้อเอชไอวีโดยไม่ได้รับยาต้านไวรัสและไม่ให้นมบุตร จะมีโอกาสติดเชื้อร้อยละ 15-40 โดยเฉลี่ยร้อยละ 25 2 โดยสัดส่วนของโอกาสที่ทารกจะติดเชื้อแตกต่างไปตามระยะเวลาของการตั้งครรภ์ได้แก่
- เริ่มตั้งครรภ์จนถึงก่อน 36 สัปดาห์ มีโอกาสติดเชื้อในทารก ร้อยละ 20
- ระยะใกล้คลอด ตั้งแต่ 36 สัปดาห์จนถึงเจ็บครรภ์ มีโอกาสติดเชื้อในทารก ร้อยละ 50
- ระยะคลอด มีโอกาสติดเชื้อในทารก ร้อยละ 30
ซึ่งปัจจัยที่มีผลต่อการติดเชื้อของทารกในครรภ์ สามารถแบ่งได้เป็นสามระยะ ได้แก่ ระยะก่อนคลอด ,ระยะคลอด และระยะหลังคลอด(3)
ระยะก่อนคลอด (antepartum factors)
- ปริมาณไวรัสในเลือดมารดา(Viral load) โดยจัดเป็นปัจจัยสำคัญที่สุด พบว่าปริมาณไวรัสน้อยกว่า 400 copies/mL โอกาสที่ทารกจะติดเชื้อคือร้อยละ 1 แต่กรณีปริมาณไวรัสมากกว่า 100,000 copies/mL ร่วมกับไม่ได้รับยาต้านไวรัส จะมีโอกาสถึงร้อยละ 30-60
- ระดับ CD4 เป็นตัวบอกถึงภาวะภูมิคุ้มกันในมารดา หากต่ำโอกาสที่ทารกติดเชื้อจะเพิ่มขึ้น
- น้ำหนักก่อนการตั้งครรภ์ และภาวะโภชนาการของสตรีตั้งครรภ์ โดยสัมพันธ์กับภาวะภูมิคุ้มกันของมารดา
- การใช้สารเสพติดหรือการสูบบุหรี่ พบว่าการใช้โคเคน หรือเฮโรอีน เพิ่มการติดเชื้อในทารก 3-4 เท่า
- การทำหัตถการวินิจฉัยก่อนคลอด (Prenatal diagnosis) ได้แก่การเจาะชิ้นเนื้อรก การเจาะน้ำคร่ำ การเจาะเส้นเลือดสายสะดือ โดยมีการศึกษาแบบ systemic review(4) พบว่าหากสตรีตั้งครรภ์ที่ติดเชื้อไวรัสเอชไอวี รับประทานยาต้านไวรัสแบบ HARRT และปริมาณไวรัสอยู่ในระดับต่ำตรวจไม่พบ(undetectable) การเจาะน้ำคร่ำไม่ได้ทำให้การถ่ายทอดเชื้อไปยังทารกเพิ่มขึ้นอย่างมีนัยสำคัญ และแนะนำว่าควรหลีกเลี่ยงการเจาะผ่านหรือใกล้รก เพื่อลดโอกาสการติดเชื้อ แต่อย่างไรก็ตาม ข้อมูลเกี่ยวกับการติดเชื้อของทารกจากการทำหัตถการเหล่านี้มีจำกัด ดังนั้นก่อนทำหัตถการควรให้คำปรึกษาถึงประโยชน์และความเสี่ยงเสมอ
- การรับประทานยาต้านไวรัส มีผลลดโอกาสการถ่ายทอดเชื้อไปยังทารกซึ่งขึ้นกับสูตรยาและระยะเวลาที่ได้รับยา โดยพบว่าหากรับประทานยาสูตร HARRT ตั้งแต่ระยะแรกของการตั้งครรภ์ อัตราการถ่ายทอดเชื้อจากมารดาสู่ทารกจะอยู่ที่ประมาณร้อยละ 1-2 แต่หากรับประทานยาต้านไวรัสน้อยกว่า 4 สัปดาห์ก่อนคลอดหรือรับประทานยาไม่สม่ำเสมอ ทารกจะมีความเสี่ยงในการติดเชื้อประมาณร้อยละ 9.3 (5)
ระยะคลอด (intrapartum factors)
- ปริมาณไวรัสในมารดา(viral load) มีผลต่อความเสี่ยงในการถ่ายทอดเชื้อไปยังทารก
- อายุครรภ์ที่คลอด เด็กทารกที่คลอดก่อนกำหนด มีโอกาสติดเชื้อเพิ่มขึ้นเกือบ 4 เท่า
- โรคติดต่อทางเพศสัมพันธ์ หากมารดามีการติดเชื้อ Herpes simplex virus type 2 สามารถเพิ่มการติดเชื้อจากแม่สู่ลูกได้ร้อยละ 50
- ช่องทางคลอด การผ่าตัดคลอดจะเป็นการหลีกเลี่ยงการสัมผัสเชื้อ ซึ่งอยู่ในสารคัดหลั่งในช่องคลอด หากผ่าตัดคลอดก่อนที่จะมีการเจ็บครรภ์ หรือ มีน้ำเดินในรายที่ไม่ได้รับยาต้านไวรัส จะสามารถลดการติดเชื้อได้ 2 – 5 เท่า (6)
- ภาวะถุงน้ำคร่ำแตก(rupture of membrane) หากถุงน้ำคร่ำแตกนานมากกว่า 4 ชั่วโมง จะเพิ่มโอกาสการติดเชื้อเกือบ 2 เท่า และข้อมูลในปัจจุบันพบว่า หากมารดาได้รับยา HARRT และปริมาณไวรัสน้อยกว่า 1000 copies/mL ระยะเวลาของน้ำเดินไม่มีผลต่อการติดเชื้อของทารกในครรภ์
- ภาวะ chorioamnionitis ทำให้ทารกมีโอกาสติดเชื้อเพิ่มขึ้น 2.45 เท่า (7)
- การทำหัตถการขณะคลอด เช่น การใส่ fetal scalp electrode , การคลอดด้วยเครื่องดูดสุญญากาศ หรือ คีมช่วยคลอด, การตัดแผลฝีเย็บ โดยเพิ่มโอกาสที่ทารกจะสัมผัสกับเลือดและสารคัดหลั่งของมารดา
ระยะหลังคลอด(postpartum factors)
- การให้นมบุตร(breast feeding) ถือเป็นปัจจัยสำคัญที่สุดในระยะหลังคลอด การติดเชื้อในระยะหลังคลอด ประมาณร้อยละ 66 เกิดในช่วง 6 สัปดาห์แรก โดยอุบัติการณ์การพบเชื้อเอชไอวีในน้ำนมประมาณร้อยละ 58 โดยพบมากที่สุด ในสามเดือนแรกหลังคลอดบุตรและมีความสัมพันธ์กับระดับภูมิคุ้มกันที่ต่ำของมารดา ,การติดเชื้อที่เต้านมหรือเต้านมอักเสบ (mastitis)
ดังนั้นมารดาที่ติดเชื้อเอชไอวี หลังคลอดควรงดการให้นมบุตร ในประเทศไทยสามารถรับนมผสมได้ฟรีจนทารกอายุ 6 เดือน กรณีในพื้นที่ที่มารดาไม่สามารถมารับนมได้ตลอด หรือไม่สามารถหาน้ำสะอาดได้ เช่นในพื้นที่ป่า เขา ทางองค์การอนามัยโลก (WHO) 2016 แนะนำให้เลี้ยงทารกด้วยนมมารดาอย่างเดียว (exclusive breast feeding) ร่วมกับมารดาที่รับประทานยาต้านไวรัส(8)
4. ผลของโรคต่อการตั้งครรภ์
ไม่ได้เพิ่มความพิการแต่กำเนิดในทารก แต่จากการศึกษาแบบ meta-analysis(9) พบว่าการติดเชื้อเอชไอวีเพิ่มการแท้งบุตร ทารกโตช้าในครรภ์ ทารกตายคลอด การคลอดก่อนกำหนด ทารกน้ำหนักน้อย อัตราการตายปริกำเนิด และอัตราตายของทารก แต่หากสตรีตั้งครรภ์ได้รับยา HARRT ตั้งแต่แรกที่มาฝากครรภ์ พบว่าภาวะทารกโตช้าในครรภ์ การคลอดก่อนกำหนด และทารกน้ำหนักน้อยลดลงอย่างมีนัยสำคัญ เมื่อเทียบกับสตรีที่ไม่ได้รับยาต้านไวรัส(10)
5. ผลของการตั้งครรภ์ต่อโรค
พบว่าในระหว่างตั้งครรภ์มีการลดลงของระดับ CD4 และกลับเพิ่มขึ้นเท่าเดิมในระยะหลังคลอด จึงทำให้พบภาวะ HIV-related illness เช่น weight loss, oral hairy , leukoplakia และ herpes zoster infection เพิ่มขึ้น แต่อย่างไรก็ตามไม่พบว่าสตรีตั้งครรภ์ที่ติดเชื้อเอชไอวีมีความเสี่ยงต่อการเสียชีวิตหรือมีการดำเนินโรคไปเป็นโรคเอดส์มากกว่าสตรีไม่ตั้งครรภ์ ดังนั้นการเตรียมสุขภาพสตรีตั้งครรภ์ในผู้ที่ทราบว่าติดเชื้ออยู่แล้ว เป็นเรื่องสำคัญ เพื่อลดความเสี่ยงต่อภาวะแทรกซ้อนที่อาจเกิดขึ้นในระหว่างตั้งครรภ์และการคลอด โดยช่วงเวลาที่เหมาะสมสำหรับการมีบุตรคือ มีปริมาณไวรัส(viral load) น้อยกว่า 50 copies/mL , CD4 > 350 cell/mm3
6. การตรวจคัดกรองการติดเชื้อเอชไอวีในสตรีตั้งครรภ์ (Prenatal HIV screening)
ทาง CDC(Center for Disease Control and Prevention), ACOG(American College of Obstetricians and Gynecologists;2011) , AAP(American Academy of Pediatrics) แนะนำให้ตรวจคัดกรองหาการติดเชื้อเอชไอวีในสตรีตั้งครรภ์โดยใช้วิธี Opt-out approach คือ สตรีตั้งครรภ์ทุกรายจะได้รับการแจ้งว่ามีการทดสอบการติดเชื้อเอชไอวีรวมอยู่ในการตรวจเลือดเพื่อฝากครรภ์ โดยได้รับข้อมูลเกี่ยวการติดเชื้อเอชไอวี และไม่จำเป็นต้องเซ็นใบยินยอมเพื่อรับการทดสอบ แต่อาจปฏิเสธไม่รับการทดสอบก็ได้
ในประเทศไทย ทาง Thailand National Guidelines on HIV/AIDS Treatment and Prevention 2014 ได้แนะนำเรื่องการให้คำปรึกษาแบบคู่สามี ภรรยา เพื่อคัดกรองโรคต่างๆ(1) ดังนี้
หญิงตั้งครรภ์ : Hct/CBC ,VDRL, HBsAg ,Blood gr, Rh, anti-HIV, thalassemia screening และทำ ultrasound ตามข้อบ่งชี้
สามี : anti-HIV , VDRL, thalassemia screening (ในรายที่ภรรยาเป็นพาหะ thalassemia)
โดยการคัดกรองจะใช้การตรวจหา HIV antibody ใช้การตรวจ Enzyme-linked immunosorbent assays(ELISA) ซึ่งมี sensitivity มากกว่าร้อยละ 99.5 หลังการตรวจที่ได้ผลบวกจะต้องยืนยันด้วยวิธี Western blot หรือ immunofluorescence assays
หากทราบว่าสตรีตั้งครรภ์ติดเชื้อ ควรพิจารณาตรวจคัดกรองเพิ่มเติม ต่อไปนี้
- CD4 count ทันทีและติดตามทุก 6 เดือน
- Viral load ที่อายุครรภ์ 36 สัปดาห์ และกินยาต้านไวรัสมาแล้วอย่างน้อย 4 สัปดาห์ขึ้นไป
- ตรวจภายในและคัดกรองโรคติดต่อทางเพศสัมพันธ์อื่นๆ เช่น หนองในแท้ หนองในเทียม ไม่ว่าจะมีอาการหรือไม่ก็ตาม เนื่องจากสตรีตั้งครรภ์มีความเสี่ยงต่อการติดโรคติดต่อทางเพศสัมพันธ์
- ตรวจคัดกรองภาวะติดเชื้อร่วมอื่นๆ (co-infection) เช่น Anti-HCV
- คัดกรองประวัติสัมผัสวัณโรค อาการและอาการแสดงของวัณโรค เช่น ไอ มีไข้ น้ำหนักลด
- ตรวจพิเศษอื่นๆ เพื่อสืบค้นโรคติดเชื้อฉวยโอกาสตามอาการ
7. การดูแลขณะตั้งครรภ์
จุดประสงค์สำคัญเพื่อให้สตรีตั้งครรภ์มีสุขภาพดี ,ป้องกันการถ่ายทอดเชื้อจากมารดาสู่ทารก และป้องกันการถ่ายทอดเชื้อแก่คู่นอน ซึ่งสามารถให้การดูแลสตรีตั้งครรภ์ โดยแบ่งตามลักษณะการติดเชื้อและการรับประทานยาต้านไวรัส
7.1 สตรีตั้งครรภ์ไม่เคยได้รับยาต้านไวรัสมาก่อน
ตามคำแนะนำขององค์การอนามัยโลก(WHO)ปี 2016มีหลักในการพิจารณาให้ยาดังตารางที่ 1 และทางเลือกที่ควรเลือกเป็นอันดับแรกคือ option B+(8) ซึ่งสูตรยาที่ให้ควรประกอบด้วย Nucleoside reverse-transcriptase inhibitors(NRTIs) 2 ตัวร่วมกับ non-nucleoside reverse transcriptase inhibitors(NNRTI) 1 ตัว โดยยาสูตรแรกตาม WHO 2016 ที่แนะนำ คือ TDF + 3TC (or FTC) + EFV สำหรับสูตรยาทางเลือกได้แก่ AZT+ 3TC+ EFV(or NVP) หรือ TDF + 3TC (or FTC) + NVP
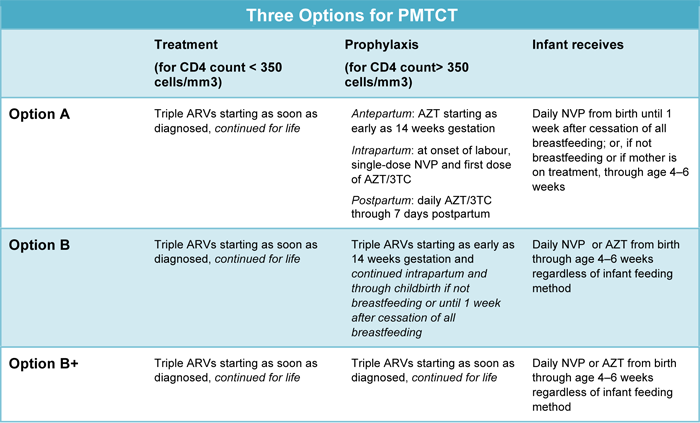
ตารางที่ 1 ทางเลือกในการให้ยาต้านไวรัสเพื่อป้องกันการถ่ายทอดเชื้อจากสตรีตั้งครรภ์สู่ทารกในครรภ์(11)
Option A : คือให้ AZT ในมารดาระหว่างตั้งครรภ์, single dose NVP ร่วมกับ AZT และ 3TC เมื่อมาคลอด และต่อเนื่อง 1 สัปดาห์หลังคลอด โดยปัจจุบันไม่แนะนำทางเลือกนี้แล้ว
Option B: คือให้ยาต้านไวรัส 3 ตัวแก่สตรีตั้งครรภ์และให้นมบุตร หลังคลอดบุตรพิจารณาให้ยาต้านไวรัสตามข้อบ่งชี้
Option B+: คือให้ยาต้านไวรัส 3 ตัวแก่สตรีตั้งครรภ์และให้นมบุตร ให้ไปตลอดชีวิตทุกรายโดยไม่คำนึงถึงระยะของโรคหรือระดับ CD4
ซึ่งค่อนข้างสอดคล้องกับ Thailand National Guidelines on HIV/AIDS Treatment and Prevention 2014 โดยมีแนวทางการพิจารณาให้ยาดังตารางที่ 2

ตารางที่ 2 แสดงสูตรยาต้านไวรัสและระยะเวลาในการให้ยาต้านไวรัสสำหรับหญิงตั้งครรภ์ที่ไม่เคยได้รับยาต้านไวรัสก่อนเริ่มตั้งครรภ์(1)
โดยขนาดยาที่เริ่ม TDF 300mg ทุก 24 ชั่วโมง + 3TC 300 mg + EFV 600mg ทุก 24 ชั่วโมง ซึ่งจะเห็นได้ว่าการบริหารยาด้วยวิธีดังกล่าว คือการให้ยา HARRT แก่สตรีตั้งครรภ์และให้นมบุตรทุกราย โดยไม่คำนึงถึงระดับ CD4 และระยะของโรค และให้สูตรเดียวกันไปตลอด โดยมีข้อดีคือมีการบริหารยาที่ง่าย และเกิดประโยชน์ในแง่สุขภาพมารดา ทารก รวมถึงคู่นอน
7.2 สตรีตั้งครรภ์ที่ได้รับยาต้านไวรัสมาก่อนเริ่มตั้งครรภ์
- ควรใช้สูตรยาที่ทำให้ Viral load ลดลงจนวัดไม่ได้ (< 50 copies/mL) ตลอดการตั้งครรภ์จึงจะดีที่สุด
- หากสงสัยการรักษาล้มเหลว Viral load > 1000 copies/mL ทั้งที่กินยาสม่ำเสมอเป็นเวลานานกว่า 6 เดือน ให้ส่งปรึกษาผู้เชี่ยวชาญทันที
- หากการรักษายังได้ผลดีสามารถให้สูตรเดิมต่อไปได้ แม้จะเป็นสูตรที่มี EFV ก็ตาม เพราะปัญหา neural tube defect ที่เกิดขึ้นกับทารก มักจะเกิดก่อนที่จะทราบว่าตั้งครรภ์ (ไม่เกินสัปดาห์ที่ 6 ของการตั้งครรภ์) ดังนั้นเมื่อทราบว่าตั้งครรภ์จึงมักพ้นช่วงเวลาที่จะเกิดปัญหาไปแล้ว แต่ควรแจ้งให้หญิงตั้งครรภ์ทราบโอกาสที่จะเกิดผลข้างเคียงนี้ และต้องตรวจ ultrasound ติดตามต่อไป
ร่วมกับควรมีการตรวจทางห้องปฏิบัติการทั้งก่อนเริ่มยาและหลังเริ่มยา เพื่อติดตามภาวะแทรกซ้อนที่อาจเกิดจากการรับประทานยาต้านไวรัส ในสตรีตั้งครรภ์ โดยมีแนวทางดังตารางที่ 3
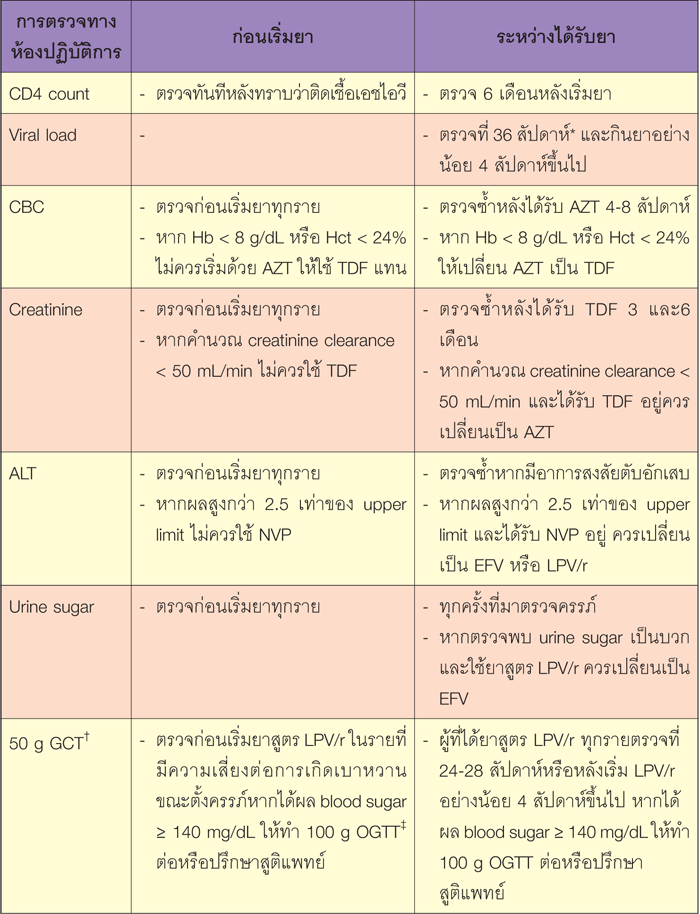
ตารางที่ 3 แสดงการตรวจทางห้องปฏิบัติการที่แนะนำสำหรับหญิงตั้งครรภ์ที่ได้รับยา HARRT(1)
8.การดูแลในระยะคลอด
สามารถให้การดูแลสตรีตั้งครรภ์ที่ติดเชื้อเอชไอวี โดยแบ่งเป็นสามกลุ่มดังนี้
8.1 กลุ่มที่ได้รับการฝากครรภ์และได้รับยาต้านไวรัส
8.1.1 กรณีรับประทานยาต้านไวรัสต่อเนื่องมากกว่า 4 สัปดาห์
- ให้ยาต้านไวรัสตามสูตรที่ได้ระหว่างตั้งครรภ์ต่อไป และให้เพิ่ม AZT 300 mg ทุก 3 ชั่วโมงหรือ AZT 600 mg ครั้งเดียวเข้าไปด้วย แม้ว่าสูตรยาที่ได้รับอยู่เป็นสูตรใดก็ตาม หรือแม้ว่าแม่จะมีประวัติดื้อ AZT มาก่อนก็ตาม เพื่อเตรียมระดับ AZT ในทารกให้พร้อมกับการป้องกันการติดเชื้อระหว่างคลอด ร่วมกับเชื้อที่ถ่ายทอดไปยังทารกอาจเป็น wild type ซึ่งยา AZT ยังได้ผล หากจะคลอดโดยการผ่าตัดให้กินยาก่อนเริ่มผ่าตัดอย่างน้อย 4 ชั่วโมง โดยอาจพิจารณายกเว้นการให้ AZT ระหว่างคลอดเฉพาะในรายที่ viral load < 50 copies/mL
- หากระหว่างตั้งครรภ์ได้รับสูตร HARRT ไม่ต้องให้ NVP ระหว่างคลอดอีก เพราะมีประสิทธิภาพสูงแล้ว และไม่ต้องเสี่ยงกับการดื้อยาภายหลัง
8.1.2 กรณีรับประทานยาน้อยกว่า 4 สัปดาห์ก่อนคลอด หรือ รับประทานยาไม่สม่ำเสมอระหว่างตั้งครรภ์ หรือปริมาณ VL ที่อายุครรภ์ 36 สัปดาห์ > 50 copies/mL
- หากสูตรยาที่ได้รับเป็นสูตรยาที่มี NVP หรือ EFV อยู่แล้วเมื่อเจ็บครรภ์คลอด แนะนำให้ AZT 600 mg เพิ่มครั้งเดียวหรือ AZT 300 mg ทุก 3 ชั่วโมง
- หากสูตรยาที่ได้รับเป็นสูตรยาที่ไม่มี NVP หรือ EFV เมื่อเจ็บครรภ์คลอดแนะนำให้ AZT 600 mg เพิ่มครั้งเดียวหรือ AZT 300 mg ทุก 3 ชั่วโมง และ NVP 200 mg 1 dose
8.2 กลุ่มที่ทราบว่าติดเชื้อ ไม่ได้ฝากครรภ์ และไม่เคยได้รับยาต้านไวรัสมาก่อน
- เมื่อเจ็บครรภ์คลอดแนะนำ AZT 600 mg ครั้งเดียว และหากคาดว่าจะยังไม่คลอดใน 2 ชั่วโมง ให้ NVP 1 dose แต่หากว่าจะคลอดภายใน 2 ชั่วโมงให้งดยา NVP เนื่องจากยา NVP จะส่งไปถึงลูกไม่ทันและอาจก่อให้เกิดการดื้อยา NVP ในแม่โดยไม่จำเป็น
8.3 กลุ่มที่ไม่มีผลตรวจเอชไอวี
กลุ่มนี้แนะนำให้ตรวจ rapid test ในช่วงที่คลอด(3)
- กรณี Reactive: ให้คำปรึกษาเบื้องต้น และเริ่มให้ยาต้านไวรัสแก่หญิงตั้งครรภ์เหมือนกลุ่มที่ไม่ได้ฝากครรภ์ ,งดให้นมแม่หลังคลอดร่วมกับให้ยาต้านไวรัสแก่ทารก และส่งตรวจยืนยันการติดเชื้อ(confirm test) ถ้า positive ก็ให้ยาต้านไวรัสแก่ทารกต่อ และแนะนำสามีให้มาตรวจเลือด ถ้า confirm test: negative จึงหยุดยาต้านไวรัสในทารก และ เริ่มให้นมแม่
- กรณี Non-reactive: ให้คำปรึกษาเบื้องต้น แต่หากว่ามีความเสี่ยงและคาดว่าอยู่ใน window period แนะนำให้ตรวจซ้ำเมื่อครบ 1 เดือน
- กรณีมารดาไม่ยินยอมในการตรวจ : ให้คำปรึกษาและแนะนำในการตรวจหาเชื้อเอชไอวีในช่วงหลังคลอด
9. การพิจารณาผ่าตัดคลอด
การผ่าตัดคลอดเป็นวิธีที่สามารถลดการถ่ายทอดเชื้อไปยังทารกได้ดี โดยในประเทศไทยมีแนวทางการพิจารณาดังนี้
9.1 การผ่าตัดคลอดก่อนการเจ็บครรภ์คลอด (elective cesarean section) หรือการผ่าตัดคลอดเมื่ออยู่ในช่วงระยะ latent phase
โดยพิจารณาผ่าตัดคลอดที่อายุครรภ์ 38 สัปดาห์ เพื่อลดความเสี่ยงภาวะเจ็บครรภ์และน้ำเดินก่อนคลอด ซึ่งต้องมีอายุครรภ์ที่เชื่อถือได้ร่วมกับอยู่ในสถานที่ที่มีความพร้อมในการทำการผ่าตัดคลอด
1. Viral load ขณะอายุครรภ์ 36 สัปดาห์ > 1000 copies/mL หรือไม่ทราบระดับ Viral load มาก่อน
2. สตรีตั้งครรภ์ที่รับประทานยาไม่สม่ำเสมอหรือมาฝากครรภ์ช้า ทำให้ได้รับยาต้านไวรัสน้อยกว่า 4 สัปดาห์ และไม่รู้ระดับ Viral load
3. สตรีตั้งครรภ์ที่ไม่ได้รับการฝากครรภ์มาก่อน
4. ผู้ที่มีความเสี่ยงที่จะต้องได้รับการผ่าตัดคลอดตามข้อบ่งชี้ทางสูติศาสตร์
9.2 การผ่าตัดคลอดแบบเร่งด่วน (emergency cesarean section)
ในสตรีตั้งครรภ์ที่มีอาการเจ็บครรภ์และน้ำเดินแล้ว สามารถทำได้ตามข้อบ่งชี้ทางสูติกรรม อย่างไรก็ตาม ประโยชน์ในการป้องกันการถ่ายทอดเชื้อจากแม่สู่ลูกยังไม่ชัดเจน
ผู้ป่วยทุกรายที่จะผ่าตัดคลอดแนะนำให้ AZT 600 mg ครั้งเดียว และยา NVP 200 mg ครั้งเดียวในกรณีครรภ์เสี่ยงสูง อย่างน้อยสี่ชั่วโมงก่อนการผ่าตัด ร่วมกับการให้ prophylactic antibiotic ทุกรายด้วย Ampicillin หรือ Cefazolin
10. ข้อพิจารณาในระยะคลอด
- หลีกเลี่ยงการใช้เครื่องมือ หรือทำหัตถการ เช่น การคลอดด้วยเครื่องสุญญากาศ หรือคีมช่วยคลอด การใส่ scalp electrode การตัดแผลฝีเย็บ เนื่องจากอาจทำให้ทารกบาดเจ็บและเพิ่มความเสี่ยงต่อการสัมผัสเลือดแม่ แต่หากมีข้อบ่งชี้ สามารถทำได้ ด้วยความระมัดระวัง
- หลีกเลี่ยงภาวะน้ำเดินเกิน 4 ชั่วโมง ได้แก่ หลีกเลี่ยงการเจาะถุงน้ำคร่ำในระยะต้นของการคลอด หรือในรายที่มีน้ำเดินมา แนะนำให้ oxytocin เพื่อเร่งคลอด
- หลีกเลี่ยงการโกนขนบริเวณอวัยวะเพศภายนอก
- ในสตรีตั้งครรภ์ที่ได้รับยา LPV/r หรือ EFV ให้หลีกเลี่ยงการใช้ยากลุ่ม ergot เช่น methergine เนื่องจากยาต้านไวรัสเหล่านี้เป็น potent CYP3A4 enzyme inhibitors ทำให้เสริมฤทธิ์การหดตัวของหลอดเลือดในยากลุ่ม ergot ให้รุนแรงขึ้น (severe vasoconstriction)
11.การดูแลระยะหลังคลอด
11.1 สตรีที่เริ่มยาต้านไวรัสระหว่างตั้งครรภ์
เมื่อพ้นช่วงตั้งครรภ์และให้นมบุตรไปแล้ว องค์การอนามัยโลก(WHO)2016 ยังคงแนะนำให้สตรีทุกรายรับยาต้านไวรัสไปตลอดชีวิต 8 อย่างไรก็ตามในแนวทางประเทศไทย หากไม่มีข้อบ่งชี้สตรีรายนั้นสามารถเลือกที่จะรับยาต้านไวรัสต่อ หรือเลือกที่จะหยุดยาได้ตามความสมัครใจ แต่หากมีข้อบ่งชี้ (1) ที่ควรได้รับยา ก็ให้รับยาต่อเนื่องตลอดชีวิต โดยมีข้อบ่งชี้ดังนี้
- CD4 < 500 cell/mm3 หรือมีอาการของโรคเอดส์ในระยะ 3-4 ตาม WHO clinical staging
- สามีมีผลเลือดลบหรือไม่ทราบผลเลือดของสามี
- มีการติดเชื้อร่วม เช่น วัณโรค ตับอักเสบบี ตับอักเสบซี
โดยให้ส่งต่อแผนกอายุรศาสตร์เพื่อให้การรักษาต่อเนื่องตามแนวทางการดูแลในผู้ใหญ่
หากไม่มีข้อบ่งชี้ และไม่พร้อมที่จะรับยาต่อหลังคลอดให้หยุดยาต้านไวรัส และนัดตรวจติดตามระดับ CD4 ทุก 6 เดือน โดยการหยุดยามีแนวทางปฏิบัติดังนี้
- ถ้าขณะตั้งครรภ์ ได้สูตรยาที่มี PI เช่น LPV/r ให้หยุดยาทุกตัวพร้อมกัน
- ถ้าขณะตั้งครรภ์หรือคลอด ได้ยาสูตรที่มี NNRTI เช่น EFV หรือ NVP ให้หยุดยากลุ่ม NNRTI แต่ยังคงทานยากลุ่ม NRTI เช่น AZT หรือ TDF ร่วมกับ 3TC ต่ออีก 7 วัน
- ถ้ารับประทานยาก่อนคลอดน้อยกว่า 4 สัปดาห์ ควรเปลี่ยน EFV หรือ NVP เป็น LPV/r และทานร่วมกับ NRTI นาน 4 สัปดาห์ แล้วหยุดยาทั้งหมดพร้อมกัน เนื่องจากกลุ่มนี้จะมีระดับไวรัสที่สูง และมีโอกาสเสี่ยงต่อการดื้อยา NVP สูง
- ถ้าไม่ได้รับยาต้านไวรัสมาก่อน เนื่องจากไม่ได้ฝากครรภ์ ควรพิจารณาเริ่มยาต้านไวรัสตามแนวทาง
11.2 สตรีตั้งครรภ์ที่เคยได้รับยามาก่อนตั้งครรภ์
หากมีการเปลี่ยนสูตรยาระหว่างตั้งครรภ์ สามารถกลับมาใช้สูตรเดิมได้ เมื่อพิจารณาแล้วว่าเป็นสูตรที่ได้ผล และไม่ดื้อยา
การดูแลระยะหลังคลอด ควรงดนมบุตรทุกราย เพื่อป้องกันการถ่ายทอดเชื้อจากมารดาสู่ทารกในระยะหลังคลอด แนวทางในประเทศไทย แนะนำให้กินนมผสม โดยในปัจจุบันกรมอนามัยให้การสนับสนุนนมผสมสำหรับทารกที่คลอดจากแม่ที่ติดเชื้อเอชไอวีฟรีนาน 18 เดือน
ห้ามมิให้มารดาเคี้ยวข้าวเพื่อป้อนให้เด็กกิน เนื่องจากมีโอกาสติดเชื้อเอชไอวีได้
กรณีที่ต้องการให้นมบุตร แนะนำให้นมบุตร (exclusive breast feeding) ได้จนอายุ 6 เดือน ร่วมกับมารดารับประทานยาต้านไวรัส และเริ่มเสริมอาหารอื่นร่วมกับให้นมบุตรจนครบ 12 เดือน เพราะเชื่อว่าประโยชน์จากการให้นมบุตร 12 เดือนในแง่การป้องกันการเสียชีวิตของทารกจากท้องเสีย ปอดอักเสบ และภาวะทุพโภชนาการไม่มีนัยสำคัญ อีกทั้งการให้นานเกินไป เนื่องจากยังไม่มีข้อมูลมากพอในเรื่องของความปลอดภัย หรือ ผลข้างเคียงจากการที่ทารกได้ยาต้านไวรัสในระดับต่ำผ่านทางน้ำนมแม่(12,13)
12. การดูแลสตรีตั้งครรภ์ที่มีผลเลือดต่าง (HIV – serodiscordant couples)
12.1 กรณีสตรีตั้งครรภ์มีผลเลือดบวก แต่สามีผลเลือดลบ
- ให้ยาต้านไวรัสต่อเนื่องในสตรีตั้งครรภ์ โดยไม่หยุดยาหลังคลอด ไม่ว่าระดับ CD4 เท่าใด
- เน้นการป้องกันการถ่ายทอดเชื้อเอชไอวีไปสู่คู่นอน และ การใช้ถุงยางอนามัยทุกครั้งเวลามีเพศสัมพันธ์
12.2 กรณีสตรีตั้งครรภ์มีผลเลือดลบ แต่สามีมีผลเลือดบวก
การดูแลสตรีตั้งครรภ์กลุ่มนี้ให้ประเมินความเสี่ยงการติดเชื้อ ซึ่งอาจต้องประเมินโดยการซักประวัติต่อไปนี้
- ประวัติการมีเพศสัมพันธ์โดยไม่ได้ป้องกันในช่วง 3 เดือนที่ผ่านมา
- ประวัติอาการของ acute retroviral syndrome (ARS) เช่น ไข้ ต่อมน้ำเหลืองโต ปวดข้อ ปวดกล้ามเนื้อ เจ็บคอ ผื่น เป็นต้น
- ประวัติการรักษา และระดับไวรัสในเลือดของสามี
โดยจะสามารถทำการดูแลรักษาตามความเสี่ยง ดังนี้
12.2.1 กลุ่มความเสี่ยงต่ำ ได้แก่ สามี VL < 50 copies/mL หรือ ไม่มีเพศสัมพันธ์
– ติดตามผลเลือดต่อเนื่อง โดยตรวจ anti- HIV ซ้ำเมื่ออายุครรภ์ 32-34 สัปดาห์ เมื่อเจ็บท้องคลอด และทุก 6 เดือนหลังคลอด
– ดูแลสตรีตั้งครรภ์และทารกเหมือนปกติ กินนมแม่ได้หากผลเลือดเป็นลบ และ ไม่มีความเสี่ยงเพิ่มเติม
– แนะนำการใช้ถุงยางอนามัยทุกครั้งเวลามีเพศสัมพันธ์
12.2.2 กลุ่มความเสี่ยงสูง ได้แก่ มีเพศสัมพันธ์โดยไม่ได้ป้องกันภายใน 1 เดือนที่ผ่านมา, มีโอกาสอยู่ในช่วง window period, สามียังไม่ได้รับการรักษา หรือ VL สูง หรือไม่แน่ใจในประวัติ
กรณีอายุครรภ์ < 36 สัปดาห์
- ตรวจ anti-HIV ซ้ำทันที , อีก 2 สัปดาห์ต่อมา, ที่ 32-34 สัปดาห์ และ เมื่อเจ็บครรภ์คลอด
- ดูแลรักษาตามผลเลือดที่พบ หากยังมีพฤติกรรมเสี่ยงสูงโดยไม่ป้องกันและใกล้คลอด (อายุครรภ์มากกว่า 32 สัปดาห์) พิจารณาให้การป้องกันเหมือนสตรีติดเชื้อไปก่อนและงดนมแม่
กรณีอายุครรภ์ > 36 สัปดาห์
- พิจารณาให้การป้องกันเหมือนสตรีติดเชื้อไปก่อน งดนมแม่
- ตรวจ anti-HIV ซ้ำเมื่อเจ็บครรภ์คลอด ถ้าเป็นลบให้หยุดยาต้านไวรัสในแม่
- ติดตามผลเลือดสตรีตั้งครรภ์จนพ้นระยะ window period และงดนมแม่
12.2.3 กลุ่มสตรีตั้งครรภ์ที่มีภาวะติดเชื้อเฉียบพลัน (AHI)
หมายถึงช่วงระยะเวลา 4-6 สัปดาห์แรกของการติดเชื้อ ผู้ที่มีภาวะ AHI มักมีจำนวนไวรัสสูงมาก และร้อยละ 60-90 จะมีอาการของการติดเชื้อระยะเฉียบพลัน จากการศึกษาในคนไทย พบว่า อาการที่พบบ่อยที่สุดคือ ไข้ ปวดเมื่อยตามตัว ตามด้วยเจ็บคอ เป็นแผลในปาก ท้องเสีย อาเจียน แต่พบต่อมน้ำเหลืองโตได้เพียงร้อยละ 10 ซึ่งภาวะนี้เพิ่มโอกาสการถ่ายทอดเชื้อไปสู่ผู้อื่นทางเพศสัมพันธ์หรือจากมารดาสู่ทารกสูงมาก จึงต้องทำการรักษาทันที โดยมีแนวทางการดูแลดังนี้
- มารดาควรได้รับยา HARRT ทันที
- ดูแลระหว่างคลอดและหลังคลอด เช่นเดียวกับทารกที่มีความเสี่ยงสูง ยกเว้น ทราบว่าผล VL เมื่อใกล้คลอดน้อยกว่า 50 copies/mL
- พิจารณาผ่าตัดคลอดก่อนเจ็บครรภ์
13. การให้ยาป้องกันโรคติดเชื้อฉวยโอกาสในสตรีตั้งครรภ์
13.1 ในสตรีตั้งครรภ์ที่มีระดับ CD4 < 200 cells/mm3 ควรป้องกันการติดเชื้อฉวยโอกาส PCP ด้วยการรับประทาน TMP-SMZ 2 เม็ดวันละ 1 ครั้ง โดยไม่ต้องหยุด TMP-SMX ในสตรีตั้งครรภ์ที่ได้รับยาอยู่แล้ว
กรณียังไม่ได้เริ่มยาต้านไวรัส ควรเริ่มยาต้านไวรัสก่อนอย่างน้อย 2 สัปดาห์ และให้เสริม folic acid ไปด้วย
13.2 ในสตรีตั้งครรภ์ที่มีระดับ CD4 < 100 cells/mm3 ไม่แนะนำการป้องกันการติดเชื้อ cryptococcal meningitis ด้วยการให้ fluconazole ในสตรีตั้งครรภ์
13.3 ในสตรีตั้งครรภ์ที่มีประวัติสัมผัสวัณโรคหรือป่วยเป็นวัณโรค โดยมีแนวทางการดูแลรักษาเหมือนผู้ใหญ่ กล่าวคือ เมื่อสงสัยว่าจะเป็นวัณโรค ควรได้รับการตรวจคัดกรอง เมื่อทราบว่าเป็นวัณโรค ควรให้ยาต้านไวรัสคู่กับยารักษาวัณโรคทุกราย โดยระยะเวลาเริ่มยาต้านไวรัสพิจารณาจากระดับ CD4 และความรุนแรงของโรค
- CD4 ≤ 50 cells/mm3 เริ่มภายใน 2 สัปดาห์หลังเริ่มยาวัณโรค
- CD4 > 50 cells/mm3 และอาการวัณโรครุนแรงเริ่มภายใน 2 สัปดาห์ ถ้าอาการวัณโรคไม่รุนแรงเริ่มระหว่าง 2-8 สัปดาห์หลังเริ่มยาวัณโรค
- กรณีที่ไม่มี rifampicin ในสูตรยารักษาวัณโรคให้พิจารณาเริ่มสูตรยาต้านไวรัสตามปกติ
- กรณีที่มี rifampicin ในสูตรยารักษาวัณโรคให้เริ่มสูตรยาต้านไวรัสที่มี EFV เป็นส่วนประกอบ ถ้าไม่สามารถใช้ EFV ได้ให้พิจารณา NVP หรือ RAL ตามลำดับ
- หากจำเป็นต้องใช้ยาต้านไวรัสที่มี protease inhibitor ให้ปรับสูตรยารักษาวัณโรคเป็นสูตรที่ไม่มียา rifampicin
เอกสารอ้างอิง
- กระทรวงสาธารณสุข ก. Thailand National Guidelines on HIV/AIDs treatment and prevention 2014 [cited 2016 december]. 237-76]. Available from: www.thaiaidssociety.org.
- Suksomboon N, Poolsup N, Ket-Aim S. Systematic review of the efficacy of antiretroviral therapies for reducing the risk of mother-to-child transmission of HIV infection. J Clin Pharm Ther. 2007;32(3):293-311.
- Thongprasert F. Chiang Mai Textbook of OB&GYN : Advanced update , HIV management in pregnancy. 2015:76-87.
- Gagnon A, Davies G, Wilson RD, Wilson RD, Audibert F, Brock JA, et al. Prenatal invasive procedures in women with hepatitis B, hepatitis C, and/or human immunodeficiency virus infections. J Obstet Gynaecol Can. 2014;36(7):648-55.
- Hoffman RM, Black V, Technau K, van der Merwe KJ, Currier J, Coovadia A, et al. Effects of highly active antiretroviral therapy duration and regimen on risk for mother-to-child transmission of HIV in Johannesburg, South Africa. J Acquir Immune Defic Syndr. 2010;54(1):35-41.
- Briand N, Jasseron C, Sibiude J, Azria E, Pollet J, Hammou Y, et al. Cesarean section for HIV-infected women in the combination antiretroviral therapies era, 2000-2010. Am J Obstet Gynecol. 2013;209(4):335.e1-.e12.
- Landesman SH, Kalish LA, Burns DN, Minkoff H, Fox HE, Zorrilla C, et al. Obstetrical factors and the transmission of human immunodeficiency virus type 1 from mother to child. The Women and Infants Transmission Study. N Engl J Med. 1996;334(25):1617-23.
- organization Wh. Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection 2016 [updated june 2016; cited 2016 december]. second:[Available from: www.who.int/hiv/pub/arv/arv-2016/en/.
- Brocklehurst P, French R. The association between maternal HIV infection and perinatal outcome: a systematic review of the literature and meta-analysis. Br J Obstet Gynaecol. 1998;105(8):836-48.
- Joseph O, Biodun O, Michael E. Pregnancy outcome among HIV positive women receiving antenatal HAART versus untreated maternal HIV infection. J Coll Physicians Surg Pak. 2011;21(6):356-9.
- UNICEF. Option B and B+ : key considerations for countries to implement an equity-focused approach 2012 [cited 2016 december]. Available from: www.unicef.org/aids/files/hiv_Key_considerations_options_B.pdf.
- Becquet R, Ekouevi DK. Breastfeeding, triple ARV prophylaxis, and MTCT prevention. Lancet Infect Dis. 2011;11(3):154-5.
- de Vincenzi I. Triple antiretroviral compared with zidovudine and single-dose nevirapine prophylaxis during pregnancy and breastfeeding for prevention of mother-to-child transmission of HIV-1 (Kesho Bora study): a randomised controlled trial. Lancet Infect Dis. 2011;11(3):171-80.