การป้องกันการติดเชื้อสเตร๊บโตคอคคัสกรุ๊ปบีในทารกแรกเกิด
การป้องกันการติดเชื้อสเตร๊บโตคอคคัสกรุ๊ปบีในทารกแรกเกิด
(Prevention of Perinatal Group B Streptococcal Disease)
จิตรลดา คำจริง
ร.ศ. นพ. ดร. วีรวิทย์ ปิยะมงคล
เชื้อก่อโรค
เชื้อ Group B Streptococcus (GBS)หรือ Streptococcus agalactiaeเป็นเชื้อแบคทีเรีย ที่จัดอยู่ในกลุ่มStreptococci ตาม Lancefield group B ที่มีลักษณะกลม ติดสีกรัมบวกอยู่เป็นคู่ สามารถเจริญเติบโตบนอาหารเลี้ยงเชื้อได้หลายชนิด เมื่อเพาะเลี้ยงบน sheep blood agarเชื้อจะเจริญเป็นนิคมขนาดเล็ก 3-4 มิลลิเมตร เป็นนิคมสีขาวเทาแบนราบมีเมือกหุ้ม ล้อมรอบด้วยพื้นที่แคบๆ ที่เป็น beta-hemolysis (1-3)เชื้อ GBSแบ่งเป็น 10 ซีโรทัยพ์ ตาม capsular polysaccharides (Ia, Ib, II, III, IV, V, VI, VII, VIII , provisional IX)(4-6)โดยพบว่าซีโรทัยพ์Ia, Ib, II, III, V ก่อให้เกิดการติดเชื้อของทารกแรกคลอดแบบ Early onset ได้มากกว่า 95 เปอร์เซ็นต์และแบบ Late onset มากกว่า 90 เปอร์เซ็นต์ โดยซีโรทัยพ์III มีความสัมพันธ์อย่างชัดเจนกับการเกิดเยื่อหุ้มสมองอักเสบในทารกแรกคลอดในช่วงสัปดาห์แรกหลังคลอด (7) ซึ่งเชื้อ GBS นั้นสามารถก่อให้เกิดโรครุนแรงได้ในประชากร 3 กลุ่ม ดังนี้
1. ผู้ใหญ่อายุมากกว่า 65 ปี (8-10)ซึ่งมีความบกพร่องของระบบภูมิคุ้มกันซึ่งเกิดเนื่องมาจากโรคประจำตัวที่มีอยู่ เช่น โรคเบาหวาน, โรคมะเร็ง, โรคตับ/ไตทำงานบกพร่อง, โรคภูมิคุ้มกันบกพร่องจากการติดเชื้อเฮชไอวี (8,11-13) ซึ่งมักทำให้เกิดการติดเชื้อแบคทีเรียในกระแสเลือดแบบไม่เฉพาะเจาะจง , อาการติดเชื้อรุนแรงในกระแสเลือด , การติดเชื้อของเนื้อเยื่อใต้ผิวหนัง เป็นต้น ซึ่งอาการติดเชื้อเหล่านี้สัมพันธ์กับอัตราการเจ็บป่วยและเสียชีวิตตามมาได้สูงแม้จะได้รับการรักษาด้วยยาปฏิชีวนะที่เหมาะสมแล้วก็ตาม(14-16) ซึ่งไม่ขอลงรายละเอียดในบทความนี้
2. หญิงตั้งครรภ์และหลังคลอด พบว่าเชื้อ GBS เป็นสาเหตุที่พบได้บ่อยที่ทำให้เกิดการมีแบคทีเรียในปัสสาวะแบบไม่ปรากฏอาการ, การติดเชื้อของระบบทางเดินปัสสาวะ, การติดเชื้อของระบบสืบพันธ์ส่วนบน ( เช่น การอักเสบติดเชื้อของถุงน้ำคร่ำ) , เยื่อบุโพรงมดลูกอักเสบหลังคลอด (8 เปอร์เซ็นต์), ปอดอักเสบติดเชื้อ (2 เปอร์เซ็นต์), การติดเชื้อในกระแสเลือดหลังคลอด (2 เปอร์เซ็นต์) และการติดเชื้อแบคทีเรียในกระแสเลือดแบบไม่เฉพาะเจาะจง (31 เปอร์เซ็นต์) นอกจากนี้ยังอาจทำให้เกิดการติดเชื้อตามอวัยวะต่างๆอีก เช่น เยื่อหุ้มสมองอักเสบ, เยื่อบุหัวใจอักเสบได้ แต่พบได้ไม่บ่อยนัก (17-19) และการติดเชื้อ GBS แบบรุนแรงในมารดาขณะตั้งครรภ์ (invasive infection)ยังพบว่าสัมพันธ์กับการเกิดการแท้งบุตรและการคลอดก่อนกำหนดได้(17,20)
จากการศึกษาและเก็บข้อมูลของ Centers for Disease Control and Prevention (CDC) ในปี 1999-2005 พบว่ามีอัตราการติดเชื้อGBS แบบรุนแรง (นิยามคือมีการแยกเชื้อ GBS จากเลือด หรือบริเวณที่ปลอดเชื้ออื่นๆของร่างกายยกเว้นปัสสาวะ )ในมารดาขณะตั้งครรภ์ คือ อัตรา 0.12 ต่อ 1,000 การคลอดมีชีพ (17) ซึ่งพบเป็นการติดเชื้อของระบบสืบพันธ์ส่วนบนเป็นครึ่งหนึ่งของการติดเชื้อทั้งหมด และพบการติดเชื้อแบคทีเรียในกระแสเลือดประมาณ 1 ใน 3 ของอัตราการติดเชื้อ และพบว่าสามารถแยกเชื้อ GBS ได้จากเลือดของมารดาประมาณครึ่งหนึ่ง ซึ่งในกลุ่มของหญิงตั้งครรภ์ที่ทราบผลของการตั้งครรภ์พบว่าประมาณครึ่งหนึ่งของมารดาที่มีการติดเชื้อ GBS ทำให้เกิดการเสียชีวิตของทารกในครรภ์, การติดเชื้อของทารกแรกเกิด, การเสียชีวิตของทารกแรกเกิด หรือการแท้งตามมาได้
Colonization คือการที่มารดามีเชื้อ GBS โดยไม่มีอาการ ซึ่งพบว่าเป็นปัจจัยเสี่ยงสำคัญของการเกิดการติดเชื้อ GBS ของทารกแรกเกิด ซึ่งจะอธิบายเรื่องการป้องกันการติดเชื้อGBSในทารกแรกเกิดต่อไป
3. ทารกแรกเกิด การติดเชื้อ GBS ของทารกแรกเกิดแบ่งออกได้เป็น 3 ระยะ ตามอายุที่เกิดอาการของโรค(21) คือ
- Early-onset GBS กลุ่มนี้โดยทั่วไปจะเกิดอาการภายใน 24 ชั่วโมงหลังคลอด แต่ยังสามารถเกิดได้ภายใน 6 วันหลังการเกิดมีชีพโดยโรคที่มักจะพบได้คือ
- ติดเชื้อในกระแสเลือดแบบแพร่กระจาย(80-85 เปอร์เซ็นต์) โดยอาการที่นำมามักไม่เฉพาะเจาะจง เช่น ซึมลง กระสับกระส่าย มีอาการทางระบบทางเดินหายใจ(เช่น หายใจเร็ว หายใจมีเสียงดัง ระดับออกซิเจนในเลือดต่ำ) อุณหภูมิร่างกายผิดปกติ ความดันโลหิตต่ำ
- ปอดอักเสบติดเชื้อ(10 เปอร์เซ็นต์) โดยอาการนำ คือ หายใจเร็ว หายใจมีเสียงดัง ระดับออกซิเจนในเลือดต่ำ มีการใช้กล้ามเนื้อช่วยในการหายใจเพิ่มขึ้น
- เยื่อหุ้มสมองอักเสบ(7 เปอร์เซ็นต์) มักพบอาการนำคืออาการผิดปกติทางระบบทางเดินหายใจ เช่น หายใจเร็วหรือหยุดหายใจ ซึ่งส่วนน้อยที่จะมีอาการทางระบบประสาทเป็นอาการนำ
- โดยพบว่ามากกว่า 90 เปอร์เซ็นต์จะพบอาการของโรคได้ภายใน 24 ชั่วโมงแรกหลังคลอด (9)
- Late-onset GBSมักเกิดอาการใน 4-5 สัปดาห์หลังคลอด (อายุระหว่าง 7-89 วัน) โดยโรคที่มักจะพบได้ในระยะนี้คือ
- การติดเชื้อแบคทีเรียในกระแสเลือด (65 เปอร์เซ็นต์) โดยมักมีอาการนำมาด้วยมีไข้มากกว่า/เท่ากับ 38 องศาเซลเซียส ซึ่งมักพบว่ามีประวัติการติดเชื้อระบบทางเดินหายใจส่วนบนนำมาก่อน อาการอื่นๆที่พบได้คือ ซึมลง กระสับกระส่าย ทานได้น้อย หายใจเร็ว หายใจมีเสียงดัง และหยุดหายใจเป็นบางครั้ง
- เยื่อหุ้มสมองอักเสบ (25-30 เปอร์เซ็นต์)(22)มักมีอาการติดเชื้อในระบบทางเดินหายใจส่วนบนนำมาก่อนประมาณ 20-30 เปอร์เซ็นต์ (23-25)และอาการ Classic sign ของเยื่อหุ้มสมองอักเสบ เช่น กระหม่อมโป่ง คอแข็ง และการตรวจพบความผิดปกติของระบบประสาทซึ่งมักพบได้ในเยื่อหุ้มสมองอักเสบแบบ Late-onset GBS มากกว่า Early-onset GBS(26)
- การติดเชื้อเฉพาะที่ มักมาด้วยอาการปอดอักเสบติดเชื้อ ข้อติดเชื้อ การอักเสบติดเชื้อของกระดูก เนื้อเยื่อผิวหนังอักเสบ และต่อมน้ำเหลืองอักเสบ(27) ส่วนที่พบได้ไม่บ่อยคือ เยื่อบุหัวใจอักเสบ กล้ามเนื้อหัวใจอักเสบ เยื่อหุ้มหัวใจอักเสบ กรวยไตอักเสบ การติดเชื้อภายในลูกตา ฝีหนองในสมอง เป็นต้น(22)
- Late,late-onset GBS (หรือ very-late-onset GBS หรือ GBS beyond early infancy)เกิดในทารกที่มีอายุมากกว่า 3 เดือน มักพบในทารกที่คลอดก่อนอายุครรภ์ 28 สัปดาห์ หรือในเด็กที่มีภาวะภูมิคุ้มกันบกพร่อง (28-29) โดยอาการที่มักพบคือ การติดเชื้อแบคทีเรียในกระแสเลือดแบบไม่เฉพาะเจาะจง หรือการติดเชื้อเฉพาะที่ของระบบประสาท เนื้อเยื่อ กระดูกและข้อ หรือวัสดุสายสวนหลอดเลือด(9,22,28)
ปัจจัยของการเกิดการติดเชื้อ GBS แบบ Early onsetในทารกแรกเกิด
การมีเชื้อ GBS colonization อยู่บริเวณช่องคลอดและทวารหนักของมารดาในช่วงintrapartum ถือเป็นปัจจัยหลักของการเกิดการติดเชื้อ GBS แบบ Early onset ในทารกโดยเป็นการติดเชื้อแบบ vertical transmission ในช่วงที่มีการเจ็บครรภ์หรือช่วงที่มีการคลอด จากการศึกษาวิจัยแบบ prospective cohort study ที่เก็บข้อมูลในช่วงปี 1980-1989 พบว่า หญิงตั้งครรภ์ที่มี GBS colonizationมีความเสี่ยงมากกว่าถึง 25 เท่าในการเกิดการติดเชื้อ GBS แบบ Early onset ในทารกเมื่อเทียบกับหญิงตั้งครรภ์ที่ไม่มีเชื้อ GBS colonization อยู่ (30) ซึ่งในช่วงที่ยังไม่มีการให้ยาเพื่อป้องกันการติดเชื้อ GBS จากมารดาสู่ทารกนั้นพบว่า 1-2 เปอร์เซ็นต์ของทารกที่มารดามี GBS colonization ในช่วง intrapartum มีการติดเชื้อ GBS แบบ Early onset(30-32) โดยพบว่า 10-30 เปอร์เซ็นต์ของหญิงตั้งครรภ์มีเชื้อ GBS colonization อยู่บริเวณช่องคลอดและทวารหนัก(33-35)ซึ่งการพบ GBS colonization นั้น อาจพบได้ทั้งแบบชั่วคราวหรือถาวรก็ได้แต่อย่างไรก็ตามพบว่าไม่สัมพันธ์กับการ colonization ในครรภ์ถัดไป
ปัจจัยอื่นๆที่สัมพันธ์กับการเกิดการติดเชื้อ GBS แบบ Early onset ในทารกประกอบด้วย การคลอดที่อายุครรภ์น้อยกว่า 37 สัปดาห์, ความยาวนานของการแตกของถุงน้ำคร่ำ, การอักเสบติดเชื้อภายในถุงน้ำคร่ำ, มารดาที่อายุน้อย, หญิงผิวดำ และมารดาที่มี GBS-specific anticapsular antibody ต่ำ (36-43)ซึ่งยังพบอีกว่าการคลอดทารกที่มีการติดเชื้อ GBS แบบรุนแรงในครรภ์ก่อนเป็นปัจจัยในการเกิดการติดเชื้อ GBS แบบ Early onset ของทารกในครรภ์ถัดไปได้ หรือการมี GBS colonization ปริมาณมาก เช่น GBS bacteriuria ก็เพิ่มปัจจัยเสี่ยงการติดเชื้อเช่นกัน (44-47) จากการศึกษาในปี 1985 พบว่าการคลอดที่อายุครรภ์น้อยกว่า 37 สัปดาห์, ความยาวนานของการแตกของถุงน้ำคร่ำมากกว่า 12 ชั่วโมง หรืออุณหภูมิร่างกายขณะคลอดมากกว่า 37.5 องศาเซลเซียส มีความเสียงเพิ่มขึ้น 6.5 เท่าในการเกิดการติดเชื้อแบบ Early-onset GBS เมื่อเทียบกับไม่มีปัจจัยดังกล่าว(30)
ตั้งแต่ปี 1990 เป็นต้นมาหลังจากได้มีการให้ยาปฏิชีวนะเพื่อป้องกันการติดเชื้อ GBS สู่ทารก(Intrapartum antibiotic prophylaxis)พบว่ามีการลดลงของอุบัติการณ์การเกิด Early-onset GBS sepsis ถึง 80 เปอร์เซ็นต์(จาก 1.7 ลดลงเหลือ 0.4 เคสต่อ 1,000 การคลอดมีชีพ)
Candidates for Intrapartum antibiotic prophylaxis
The CDC guideline 2010 (48) ได้ให้คำแนะนำถึงการทำการเพาะเชื้อ GBS บริเวณช่องคลอดและทวารหนักของหญิงตั้งครรภ์ทุกคนที่อายุครรภ์ 35-37 สัปดาห์เพื่อประเมินหาผู้ที่ควรได้รับยาปฏิชีวนะเพื่อป้องกันการติดเชื้อ GBS ในช่วง intrapartumโดยจะเก็บโดยใช้ไม้พันสำลีปราศจากเชื้อป้ายเก็บที่บริเวณช่องคลอด(ด้านนอก) และทวารหนัก(ผ่านหูรูดทวารหนัก) แล้วนำเก็บใน transport media (selective broth ที่เหมาะแก่การเก็บส่งเชื้อ เช่น Stuart หรือ Amies media) แล้วจึงนำไปเพาะเชื้อต่อไป โดยหญิงตั้งครรภ์ทุกคนที่มีผลการเพาะเชื้อ GBS เป็นผลบวกจะต้องได้รับยาปฏิชีวนะเพื่อป้องกันการติดเชื้อ GBS ในช่วง intrapartum(Intrapartum antibiotic prophylaxis) ยกเว้นในรายที่มีการผ่าตัดคลอดก่อนที่จะมีการเจ็บครรภ์และถุงน้ำคร่ำยังไม่แตก
การทำการเพาะเชื้อ GBS บริเวณช่องคลอดและทวารหนักของหญิงตั้งครรภ์จะยกเว้นไม่ต้องทำในรายที่มีการติดเชื้อ GBS ในปัสสาวะ(GBS bacteriuria) ในครรภ์ปัจจุบัน หรือในรายที่มีประวัติให้กำเนิดทารกแรกเกิดที่ติดเชื้อ Early-onset GBS ในครรภ์ก่อน เพราะในสองกรณีดังกล่าว มารดาควรได้รับ intrapartum antibiotic prophylaxis อยู่แล้ว และหากตรวจพบ GBS bacteriuria ในช่วงใดก็ตามของการตั้งครรภ์ควรได้รับยาปฏิชีวนะเพื่อรักษาด้วย
เนื่องจากในหญิงตั้งครรภ์ที่เคยมีประวัติ GBS colonization ในครรภ์ก่อนมักจะไม่สัมพันธ์กับการมี GBS colonization ในครรภ์ถัดไป ดังนั้นจึงควรได้รับการเพาะเชื้อเหมือนหญิงตั้งครรภ์ปกติ และไม่จำเป็นต้องได้รับ intrapartum antibiotic prophylaxis ยกเว้นมีข้อบ่งชี้ในการให้ในครรภ์ปัจจุบัน
Indication และ Nonindication ในการให้ยาปฏิชีวนะเพื่อป้องกันการติดเชื้อ GBS ในช่วง intrapartum(48)
Indications
- ทารกคนก่อนมีการติดเชื้อ GBSแบบรุนแรง
- ตรวจพบ GBS bacteriuria ในไตรมาสใดก็ตามของการตั้งครรภ์ปัจจุบัน
- ผลการเพาะเชื้อ GBS บริเวณช่องคลอดและทวารหนักในระยะท้ายของการตั้งครรภ์(ระยะเวลาที่เหมาะสมคือช่วงอายุครรภ์ 35-37 สัปดาห์)ให้ผลเป็นบวกในครรภ์ปัจจุบัน
- ไม่ทราบสถานะของการพบเชื้อ GBS ในช่วงเจ็บครรภ์คลอด (ไม่เคยทำการเพาะเชื้อ, ทำการเพาะเชื้อไม่สมบูรณ์ หรือ ไม่ทราบผลของการเพาะเชื้อ) และมีลักษณะใดๆดังต่อไปนี้
- คลอดบุตรที่อายุครรภ์น้อยกว่า 37 สัปดาห์
- ถุงน้ำคร่ำแตกมากกว่าหรือเท่ากับ 18 ชั่วโมง
- มีอุณหภูมิกายในช่วง intrapartumมากกว่าหรือเท่ากับ 38.0 องศาเซลเซียสหรือ100.4 องศาฟาเรนไฮต์ (หากสงสัยว่าเกิดถุงน้ำคร่ำอักเสบติดเชื้อ ควรให้ยาปฏิชีวนะชนิด broad-spectrum ที่ครอบคลุมเชื้อ GBS แทน)
- ผลการทดสอบ nucleic acid amplification test (NAAT) สำหรับเชื้อ GBS ให้ผลบวกในช่วง intrapartum (การทดสอบ NAAT สำหรับเชื้อ GBSเป็นทางเลือก และอาจไม่มีใช้ในบางสถานที่ และถ้าหากผลทดสอบ intrapartum NAAT ให้ผลลบแต่มีปัจจัยเสี่ยงใดๆในข้อ a., b. หรือ c. ก็จะถือว่ามีข้อบ่งชี้ในการให้ intrapartum antibiotic prophylaxis )
Nonindications
- มี GBS colonization ในการตั้งครรภ์ครั้งก่อน (ยกเว้นมีข้อบ่งชี้ในครรภ์ปัจจุบัน)
- มี GBS bacteriuria ในการตั้งครรภ์ครั้งก่อน(ยกเว้นมีข้อบ่งชี้ในครรภ์ปัจจุบัน)
- มีการผ่าตัดคลอดก่อนที่จะมีการเจ็บครรภ์และถุงน้ำคร่ำยังไม่แตกโดยไม่คำนึกถึงผล GBS colonization หรือ อายุครรภ์
- ผลการเพาะเชื้อ GBS บริเวณช่องคลอดและทวารหนักในระยะท้ายของการตั้งครรภ์(ระยะเวลาที่เหมาะสมคือช่วงอายุครรภ์ 35-37 สัปดาห์)ให้ผลเป็นลบในครรภ์ปัจจุบัน โดยไม่คำนึกถึงปัจจัยเสี่ยงอื่นๆในช่วง intrapartum
Intrapartum antibiotic prophylactic agents (48)
ยาที่เหมาะสมที่สุดยังคงเป็น Penicillin โดยอาจใช้ Ampicillin เป็นทางเลือกรองได้ และ Cefazolinยังคงเป็นยาที่เหมาะสมที่สุดในผู้ป่วยที่แพ้ Penicillin แบบไม่รุนแรง [ไม่มีปฏิกิริยาแพ้อย่างเฉียบพลัน(anaphylaxis), ผื่นลมพิษของเยื่อบุผิว(angioedema), หายใจลำบาก(respiratory distress) หรือผื่นลมพิษเฉียบพลัน(urticaria)] และCDC guideline 2010 ไม่แนะนำให้ใช้ยา Erythromycin แล้ว เนื่องจากมีการดื้อยาสูง
รูปที่ 1 แนวทางการให้ยาปฏิชีวนะเพื่อป้องกันการติดเชื้อ GBS ในช่วง intrapartum(48)
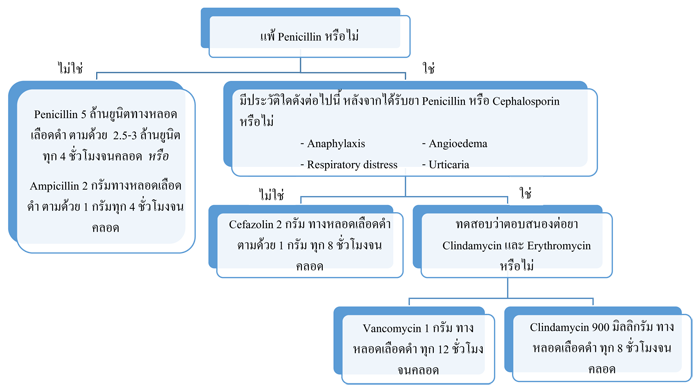
Ref: Centers for Disease Control and Prevention (CDC). Prevention of perinatal group B streptococcal disease–revised guidelines, 2010.(48)
Intrapartum antibiotic prophylaxis
ประโยชน์ในการให้ยาปฏิชีวนะเพื่อป้องกันการติดเชื้อ GBS ในเด็กแรกเกิดนั้นยังต้องคำนึงถึงความเสี่ยงของมารดาและทารกจากอาการแพ้ยาในช่วงระยะคลอดด้วย ซึ่งอัตราการแพ้ยาเกิดขึ้นโดยประมาณ 0.7-4 เปอร์เซ็นต์ของการรักษาด้วยยา Penicillin ทั้งหมด โดยมีความเสี่ยงต่อการเกิด anaphylaxis ประมาณ 4/10,000 – 4/100,000 ราย
ซึ่ง American College of Obstetricians and Gynecologists (ACOG)(49)และ Centers for Disease Control and Prevention (CDC) (48) ได้ให้คำแนะนำว่าแต่ละพื้นที่สุขภาพควรมีการเก็บอุบัติการณ์การเกิดการติดเชื้อ GBS ในทารกแรกเกิด, การเกิดการติดเชื้อเฉียบพลันในมารดาและทารกที่เกิดจากเชื้อที่ดื้อยา และรวมถึงผลแทรกซ้อนอื่นๆที่เกิดจากการให้ยาปฏิชีวนะแก่มารดา เช่น อาการแพ้รุนแรง เป็นต้น นอกจากนี้ ACOG นั้นไม่เห็นด้วยอย่างยิ่งต่อการให้ intrapartum GBS prophylaxis ในรายที่มีน้ำเดินมากกว่า 18 ชั่วโมงแต่ผลการเพาะเชื้อ GBS ในช่วงอายุครรภ์ 35-37 สัปดาห์เป็นลบ ยกเว้นจะให้ยาเฉพาะในรายที่ไม่ทราบผลการเพาะเชื้อเท่านั้น และในรายที่มีอาการของถุงน้ำคร่ำอักเสบติดเชื้อหรืออาการติดเชื้ออื่นๆเช่นกรวยไตอักเสบเท่านั้นจึงจะพิจารณาให้ยาปฏิชีวนะในช่วง intrapartum
การเจ็บครรภ์คลอดก่อนกำหนด และการมีถุงน้ำคร่ำแตกที่อายุครรภ์ก่อนกำหนด(Preterm labor and Preterm premature rupture of membranes)
CDC guildline 2010 ได้ปรับปรุงแนวทางการรักษาเพิ่มเติม ดังนี้
รูปที่ 2 การให้ยาป้องกันการติดเชื้อ GBS ในช่วง Intrapartum ในกรณีเจ็บครรภ์คลอดก่อนกำหนด(48)
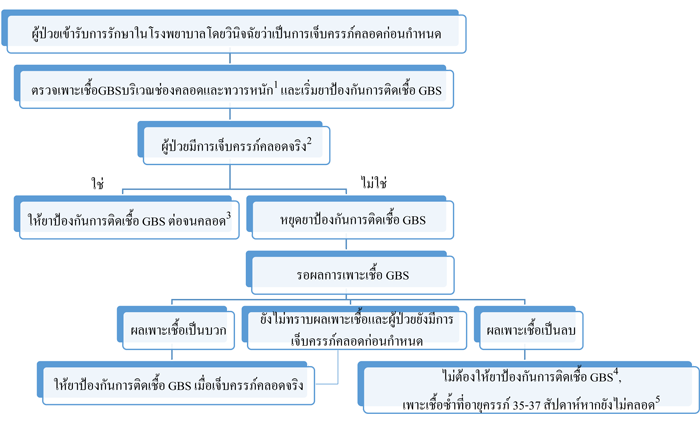
Ref: Centers for Disease Control and Prevention (CDC). Prevention of perinatal group B streptococcal disease–revised guidelines, 2010.(48)
หมายเหตุ :
- หากเคยได้รับการเพาะเชื้อบริเวณช่องคลอดและทวารหนักเพื่อตรวจหาเชื้อ GBS ภายใน 5 สัปดาห์ ผลของการเพาะเชื้อจะใช้เป็นแนวทางในการรักษา ไม่จำเป็นต้องให้ยาปฏิชีวนะในรายที่ผลเพาะเชื้อเป็นลบภายใน 5 สัปดาห์ที่ผ่านมา
- ควรเฝ้าติดตามการเข้าสู่ระยะเจ็บครรภ์คลอดจริงเป็นระยะและหยุดการให้ยาหากไม่ใช่เจ็บครรภ์คลอดจริง
- หากทราบผลการเพาะเชื้อ GBS ว่าให้ผลเป็นลบก่อนคลอด ให้หยุดยาปฏิชีวนะได้
- ยกเว้นหากผลการเพาะเชื้อหลังจากนั้นให้ผลเป็นบวก
- ผลลบจากการเพาะเชื้อ GBS จะใช้ได้ 5 สัปดาห์ หากนานกว่านั้นให้เพาะเชื้อซ้ำและให้แนวทางการรักษาตามผลการเพาะเชื้อล่าสุด
รูปที่ 3 การให้ยาป้องกันการติดเชื้อGBS ในช่วงIntrapartum กรณีถุงน้ำคร่ำแตกอายุครรภ์ก่อนกำหนด (48)
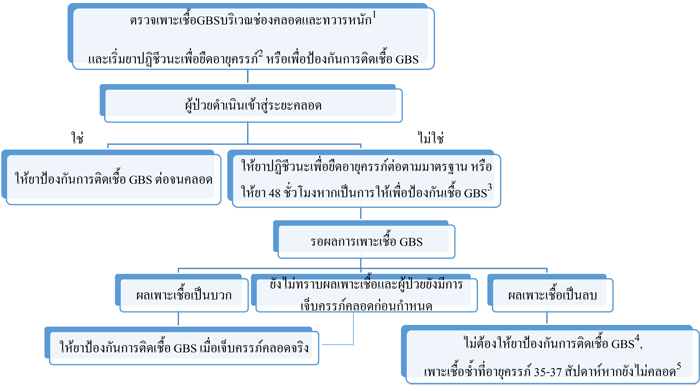
Ref: Centers for Disease Control and Prevention (CDC). Prevention of perinatal group B streptococcal disease–revised guidelines, 2010.(48)
หมายเหตุ :
- หากเคยได้รับการเพาะเชื้อบริเวณช่องคลอดและทวารหนักเพื่อตรวจหาเชื้อ GBS ภายใน 5 สัปดาห์ ผลของการเพาะเชื้อจะใช้เป็นแนวทางในการรักษา ไม่จำเป็นต้องให้ยาปฏิชีวนะในรายที่ผลเพาะเชื้อเป็นลบภายใน 5 สัปดาห์ที่ผ่านมา
- ยาปฏิชีวนะเพื่อยืดอายุครรภ์ในรายที่ถุงน้ำคร่ำแตกก่อนกำหนด คือ Ampicillin 2 กรัม ทางหลอดเลือดดำ ตามด้วย 1 กรัม ทุก 6 ชั่วโมง อย่างน้อย 48 ชั่วโมงจึงจะเพียงพอในการป้องกันเชื้อ GBS
- การให้ยาปฏิชีวนะเพื่อป้องกัน GBS ในรายที่ถุงน้ำคร่ำแตกก่อนกำหนดที่ไม่มีการเจ็บครรภ์คลอดจะให้เพียง 48 ชั่วโมง หากผลการเพาะเชื้อ GBS ขณะที่รักษาพบว่าเป็นลบภายในช่วง 48 ชั่วโมงที่ได้ยาอยู่ สามารถหยุดยาได้
- ยกเว้นหากผลการเพาะเชื้อหลังจากนั้นให้ผลเป็นบวก
- ผลลบจากการเพาะเชื้อ GBS จะใช้ได้ 5 สัปดาห์ หากนานกว่านั้นให้เพาะเชื้อซ้ำและให้แนวทางการรักษาตามผลการเพาะเชื้อล่าสุด
นอกจากนี้ทาง ACOG 2011(49)และ CDC 2010(48)มีความเห็นตรงกันว่า ไม่แนะนำให้มีการให้ยาปฏิชีวนะเพื่อป้องกันการติดเชื้อ GBS ในหญิงตั้งครรภ์ที่มีการวางแผนการผ่าตัดคลอดที่ไม่มีอาการเจ็บครรภ์คลอดและไม่มีถุงน้ำคร่ำแตกโดยไม่คำนึงถึงอายุครรภ์ถึงแม้ว่าผลการเพาะเชื้อ GBS จะเป็นผลบวกก็ตาม และทุกรายที่มีการวางแผนการผ่าตัดคลอดควรได้รับยาปฏิชีวนะก่อนทำการผ่าตัดเพื่อลดความเสี่ยงของการเกิดแผลติดเชื้อหลังผ่าตัด โดยผู้ป่วยในกลุ่มนี้ก็ควรได้รับการทำการเพาะหาเชื้อ GBS ที่อายุครรภ์ 35-37 สัปดาห์เนื่องจากอาจมีการเกิดการเจ็บครรภ์คลอดหรือน้ำเดินก่อนกำหนดการผ่าตัดได้
การดูแลรักษาด้านสูติศาสตร์อื่นๆ (48)
จาก CDC 2010 Guidelineพบว่ายังไม่มีข้อมูลเพียงพอในการแนะนำในมารดากลุ่มที่มี GBS colonization ว่ามีผลแตกต่างในการทำหัตถการเพื่อติดตามสุขภาพของทารกในครรภ์, การกระตุ้นปากมดลูกเพื่อเร่งการคลอดหรือการชักนำการคลอดอย่างไรบ้าง ทั้งนี้การทำหัตถการดังกล่าวควรทำตามข้อบ่งชี้ที่เหมาะสมและทำได้ไม่เปลี่ยนแปลงในกลุ่มมารดาที่มี GBScolonizationและนอกจากนี้ยังมีข้อมูลไม่เพียงพอในเรื่องของระยะเวลาในการทำหัตถการที่สัมพันธ์กับการดำเนินการคลอดเช่นการเจาะถุงน้ำคร่ำเพื่อเร่งคลอดในมารดากลุ่มที่มี GBScolonization โดยพบว่าการให้ยาเพื่อป้องกันการติดเชื้อ GBS ในทารกแรกเกิดนั้นจะเพียงพอเมื่อได้รับยาปฏิชีวนะอย่างน้อย 4 ชั่วโมงก่อนคลอด ดังนั้นจึงควรคำนึงถึงระยะเวลาในการทำหัตถการเร่งคลอดดังกล่าวหากเป็นไปได้ แต่อย่างไรก็ตามไม่ควรให้หัตถการใดๆที่จำเป็นต้องล่าช้าเพื่อรอระยะเวลา 4 ชั่วโมงก่อนคลอดดังกล่าวเช่นกัน
การเก็บสิ่งส่งตรวจเพื่อตรวจหาเชื้อ GBS (48)
ดังที่ได้กล่าวไปแล้วว่าการเก็บสิ่งส่งตรวจจะเก็บโดยใช้ไม้พันสำลีปราศจากเชื้อป้ายเก็บที่บริเวณช่องคลอด(ด้านนอก) และทวารหนัก(ผ่านหูรูดทวารหนัก) แล้วนำเก็บใน transport media แล้วจึงนำไปเพาะเชื้อต่อไปนั้น ทาง CDC 2010 ได้มีการแนะนำการส่งตรวจทางห้องปฏิบัติตามเพิ่มเติมในการระบุหาเชื้อ GBS โดยการใช้ pigmented broth หรือ DNA probe ที่เรียกว่า Latex agglutination หรือ Nucleic acid amplification test (NAAT) โดยตรวจหลังจาก incubation ประมาณ 18-24 ชั่วโมง อย่างไรก็ตามการส่งตรวจ NAAT เพื่อหาเชื้อ GBS โดยตรงจากช่องคลอดและทวารหนัก(โดยไม่รอ incubation 18-24 ชั่วโมง)นั้น ยังมีบทบาทน้อยในการใช้ทดสอบอยู่ โดยในบางที่ที่มีการทดสอบ NAAT ใช้ได้นั้นมักจะทำการทดสอบในช่วง intrapartum กรณีที่ไม่ทราบผลการเพาะเชื้อ GBS และในขณะนั้นไม่มีความเสี่ยงอื่นๆ(เช่น อุณหภูมิกายมากกว่าหรือเท่ากับ 38.0 องศาเซลเซียส หรือ มีน้ำเดินนานกว่าหรือเท่ากับ 18 ชั่วโมง)ในช่วงเวลาที่ทำการทดสอบNAATในรายที่เป็นการตั้งครรภ์ครบกำหนด
ในรายที่ผลการทดสอบ NAAT ต่อเชื้อ GBS ให้ผลเป็นบวก ควรได้รับยาปฏิชีวนะเพื่อป้องกันเชื้อ GBS ในช่วง intrapartum โดยหากในรายใดมีความเสี่ยงต่อการติดเชื้อ GBS ดังที่กล่าวข้างต้นเกิดตามมาหลังจากการทำการทดสอบ NAAT แล้วก็ควรได้รับยาปฏิชีวนะเพื่อป้องกันเชื้อ GBS ในช่วง intrapartumด้วยโดยไม่ต้องสนใจผลของการตรวจ NAAT
แนวทางการรักษาทารกแรกเกิด (48)
รูปที่ 4 แนวการการป้องกันการติดเชื้อ GBS ในทารกแรกดเกิดแบบปฐมภูมิ (48
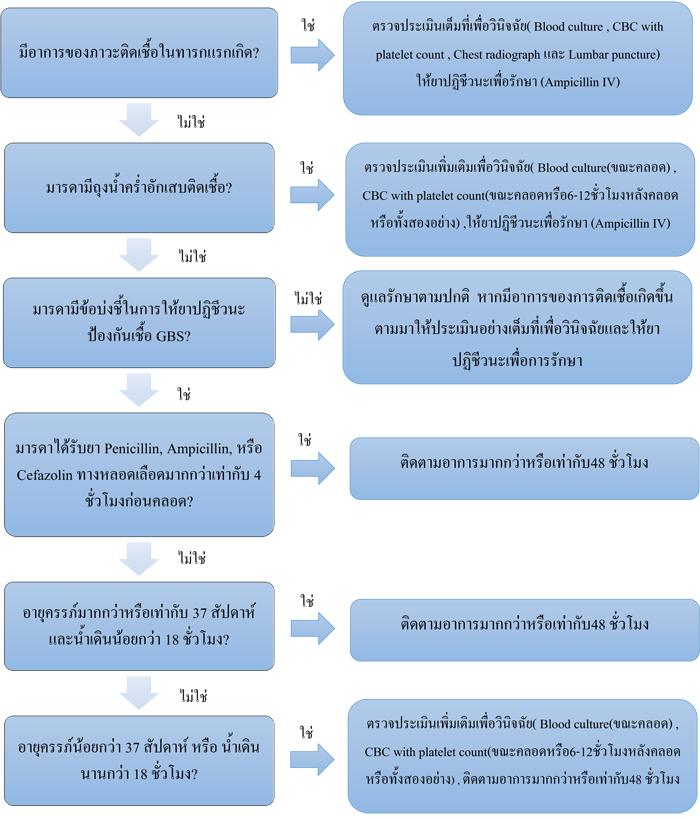 )
)
Ref: Centers for Disease Control and Prevention (CDC). Prevention of perinatal group B streptococcal disease–revised guidelines, 2010.(48)
บทสรุป
โดยสรุปแล้ว Group B streptococci (GBS) หรือ เชื้อ Streptococcus agalactiae เป็นเชื้อก่อโรคสำคัญที่ทำให้เกิดการติดเชื้อรุนแรงและการตายของทารกแรกเกิด จากงานวิจัยที่ผ่านมาพบว่า หญิงตั้งครรภ์ร้อยละ 10-30 มีเชื้อนี้แฝงอยู่ที่ช่องคลอดและทวารหนักหรืออาจเรียกว่าเป็นพาหะของเชื้อ GBS ซึ่งสามารถทำให้หญิงตั้งครรภ์เกิดการติดเชื้อในทางเดินปัสสาวะ การติดเชื้อของเยื่อบุโพรงมดลูก ถุงน้ำคร่ำอักเสบ ติดเชื้อในกระแสเลือด หรืออาจพบเยื่อหุ้มสมองอักเสบจากเชื้อนี้ได้ ซึ่งการถ่ายทอดเชื้อจากมารดาสู่ทารกนั้นมักเกิดจากการติดเชื้อระหว่างคลอด ในช่วงที่ทารกคลอดผ่านช่องคลอดที่มีเชื้อ GBS แฝงอยู่ได้
สำหรับในประเทศไทยนั้นได้เคยมีการศึกษาความชุกของพาหะของเชื้อ GBS ในสตรีตั้งครรภ์ที่โรงพยาบาลธรรมศาสตร์ซึ่งพบว่าความชุกของพาหะของเชื้อ GBS คือ ร้อยละ16 (50)และโรงพยาบาลศรีนครินทร์พบว่าความชุกของพาหะของเชื้อ GBS คือ ร้อยละ 6.22 (51)สำหรับในโรงพยาบาลมหาราชนครเชียงใหม่นั้นยังไม่ทราบความชุกของพาหะ GBS อย่างแน่ชัด ดังนั้นการให้ยาปฏิชีวนะเพื่อป้องกันการติดเชื้อ GBS จากแม่สู่ลูกในช่วงการคลอดจึงให้ตามความเสี่ยงของหญิงตั้งครรภ์ตามคำแนะนำของCDC 2010เท่านั้น ซึ่งหากโรงพยาบาลใดมีการตรวจคัดกรองเชื้อ GBS ในหญิงตั้งครรภ์ที่อายุครรภ์ 35-37 สัปดาห์ ก็สามารถให้ยาเพื่อป้องกันการติดเชื้อสู่ทารกได้ตามแนวทางการรักษาของ CDC 2010 ดังที่ได้กล่าวข้างต้น
เอกสารอ้างอิง
- Edwards MS, Nizet V, Baker CJ. Group B Streptococcal Infections. In: Infectious Diseases of the Fetus and Newborn Infant, 7th ed, Remington JS, Klein JO, Wilson CB, et al (Eds), Elsevier Saunders, Philadelphia 2011. p.419.
- Madoff, LC, Kasper, DL. Group B streptococcal infection. In: Obstetric and Perinatal Infections, Charles, D (Ed), Mosby Year Book, Boston, 1993, p. 210.
- Lancefield RC. A SEROLOGICAL DIFFERENTIATION OF SPECIFIC TYPES OF BOVINE HEMOLYTIC STREPTOCOCCI (GROUP B). J Exp Med 1934; 59:441.
- Jennings HJ, Katzenellenbogen E, Lugowski C, Kasper DL. Structure of native polysaccharide antigens of type Ia and type Ib group B Streptococcus. Biochemistry 1983; 22:1258.
- Jennings HJ, Rosell KG, Katzenellenbogen E, Kasper DL. Structural determination of the capsular polysaccharide antigen of type II group B Streptococcus. J BiolChem 1983; 258:1793.
- Wessels MR, Benedí WJ, Jennings HJ, et al. Isolation and characterization of type IV group B Streptococcus capsular polysaccharide. Infect Immun 1989; 57:1089.
- Doran KS, Engelson EJ, Khosravi A, et al. Blood-brain barrier invasion by group B Streptococcus depends upon proper cell-surface anchoring of lipoteichoic acid. J Clin Invest 2005; 115:2499.
- Schrag SJ, Zywicki S, Farley MM, et al. Group B streptococcal disease in the era of intrapartum antibiotic prophylaxis. N Engl J Med 2000; 342:15.
- Phares CR, Lynfield R, Farley MM, et al. Epidemiology of invasive group B streptococcal disease in the United States, 1999-2005. JAMA 2008; 299:2056.
- Centers for Disease Control and Prevention. Active Bacterial Core Surveillance (ABCs) Report, Emerging Infections Program Network, group B streptococcus, 2003. 2004. www.cdc.gov/incidod/dbmd/abcs/survreports/gbs03.pdf (Accessed on September 22, 2005).Farley MM, Harvey RC, Stull T, et al. A population-based assessment of invasive disease due to group B Streptococcus in nonpregnant adults. N Engl J Med 1993; 328:1807.
- Farley MM, Harvey RC, Stull T, et al. A population-based assessment of invasive disease due to group B Streptococcus in nonpregnant adults. N Engl J Med 1993; 328:1807.
- Schwartz B, Schuchat A, Oxtoby MJ, et al. Invasive group B streptococcal disease in adults. A population-based study in metropolitan Atlanta. JAMA 1991; 266:1112.
- Jackson LA, Hilsdon R, Farley MM, et al. Risk factors for group B streptococcal disease in adults. Ann Intern Med 1995; 123:415.
- Blumberg HM, Stephens DS, Modansky M, et al. Invasive group B streptococcal disease: the emergence of serotype V. J Infect Dis 1996; 173:365.
- Schuchat A, Oxtoby M, Cochi S, et al. Population-based risk factors for neonatal group B streptococcal disease: results of a cohort study in metropolitan Atlanta. J Infect Dis 1990; 162:672.
- Trivalle C, Martin E, Martel P, et al. Group B streptococcal bacteraemia in the elderly. J Med Microbiol 1998; 47:649.
- Phares CR, Lynfield R, Farley MM, et al. Epidemiology of invasive group B streptococcal disease in the United States, 1999-2005. JAMA 2008; 299:2056.
- Phares CR, Lynfield R, Farley MM, et al. Epidemiology of invasive group B streptococcal disease in the United States, 1999-2005. JAMA 2008; 299:2056.
- Krohn MA, Hillier SL, Baker CJ. Maternal peripartum complications associated with vaginal group B streptococci colonization. J Infect Dis 1999; 179:1410.
- Zaleznik DF, Rench MA, Hillier S, et al. Invasive disease due to group B Streptococcus in pregnant women and neonates from diverse population groups. Clin Infect Dis 2000; 30:276.
- American Academy of Pediatrics. Group B streptococcal infections. In: Red Book: 2015 Report of the Committee on Infectious Diseases, 30th ed, Kimberlin DW (Ed), American Academy of Pediatrics, 2015. p.745.
- Edwards, MS, Nizet, V. Group B streptococcal infections. In: Infectious Diseases of the Fetus and Newborn Infant, 7th ed, Remington, JS, Klein, JO, Wilson, CB, et al (Eds), Elsevier Saunders, Philadelphia 2011. p.419.
- Baker CJ, Barrett FF. Transmission of group B streptococci among parturient women and their neonates. J Pediatr 1973; 83:919.
- Baker CJ, Barrett FF, Gordon RC, Yow MD. Suppurative meningitis due to streptococci of Lancefield group B: a study of 33 infants. J Pediatr 1973; 82:724.
- Franciosi RA, Knostman JD, Zimmerman RA. Group B streptococcal neonatal and infant infections. J Pediatr 1973; 82:707.
- Pannaraj PS, Baker CJ. Group B streptococcal infections. In: Feigin and Cherry’s Textbook of Pediatric Infectious Diseases, 7th, Cherry JD, Harrison GJ, Kaplan SL, et al. (Eds), Elsevier Saunders, Philadelphia 2014. p.1153.
- Berardi A, Rossi C, Lugli L, et al. Group B streptococcus late-onset disease: 2003-2010. Pediatrics 2013; 131:e361.
- Hussain SM, Luedtke GS, Baker CJ, et al. Invasive group B streptococcal disease in children beyond early infancy. Pediatr Infect Dis J 1995; 14:278.
- Guilbert J, Levy C, Cohen R, et al. Late and ultra late onset Streptococcus B meningitis: clinical and bacteriological data over 6 years in France. ActaPaediatr 2010; 99:47.
- Boyer KM, Gotoff SP. Strategies for chemoprophylaxis of GBS early-onset infections. AntibiotChemother 1985;35:267–80
- CDC. Prevention of perinatal group B streptococcal disease: a public health perspective. MMWR 1996;45(No. RR-7).
- National Institutes of Health. Summary of the workshop on perinatal infections due to group B Streptococcus. J Infect Dis 1977; 136:137–52.
- Regan JA, Klebanoff MA, Nugent RP. The epidemiology of group B streptococcal colonization in pregnancy. Vaginal Infections and Prematurity Study Group. ObstetGynecol1991;77:604–10.
- Yancey MK, Schuchat A, Brown LK, Ventura VL, Markenson GR. The accuracy of late antenatal screening cultures in predicting genital group B streptococcal colonization at delivery. ObstetGynecol1996;88):811–5.
- Campbell JR, Hillier SL, Krohn MA, Ferrieri P, Zaleznik DF, Baker CJ. Group B streptococcal colonization and serotype-specific immunity in pregnant women at delivery. ObstetGynecol2000 Oct;96(4):498–503.
- Baker CJ, Edwards MS, Kasper DL. Role of antibody to native type III polysaccharide of group B Streptococcus in infant infection. Pediatrics 1981;68:544–9.
- Boyer KM, Gadzala CA, Burd LI, Fisher DE, Paton JB, Gotoff SP. Selective intrapartum chemoprophylaxis of neonatal group B streptococcal early-onset disease. I. Epidemiologic rationale. J Infect Dis 1983;148:795–801.
- Schuchat A, Oxtoby M, Cochi S, Sikes RK, Hightower A, Plikaytis B, et al. Population-based risk factors for neonatal group B streptococcal disease: results of a cohort study in metropolitan Atlanta. J Infect Dis 1990;162:672–7.
- Schuchat A, Deaver-Robinson K, Plikaytis BD, Zangwill KM, Mohle-Boetani J, Wenger JD. Multistate case-control study of maternal risk factors for neonatal group B streptococcal disease. The Active Surveillance Study Group. Pediatr Infect Dis J 1994;13:623–9.
- Schuchat A, Zywicki SS, Dinsmoor MJ, et al. Risk factors and opportunities for prevention of early-onset neonatal sepsis: a multicenter case-control study. Pediatrics 2000;105(1 Pt 1):21–6.
- Zaleznik DF, Rench MA, Hillier S, et al. Invasive disease due to group B Streptococcus in pregnant women and neonates from diverse population groups. Clin Infect Dis 2000;30:276–81.
- Oddie S, Embleton ND. Risk factors for early onset neonatal group B streptococcal sepsis: case-control study. BMJ (Clinical research ed 2002;325(7359):308.
- Adair CE, Kowalsky L, Quon H, et al. Risk factors for early-onset group B streptococcal disease in neonates: a population-based case-control study. CMAJ 2003;169:198–203.
- Carstensen H, Christensen KK, Grennert L, Persson K, Polberger S. Early-onset neonatal group B streptococcal septicaemia in siblings. J Infect 1988;17:201–4.
- Christensen KK, Dahlander K, Linden V, Svenningsen N, Christensen P. Obstetrical care in future pregnancies after fetal loss in group B streptococcal septicemia. A prevention program based on bacteriological and immunological follow-up. Eur J ObstetGynecolReprodBiol1981;12:143–50.
- Faxelius G, Bremme K, Kvist-Christensen K, Christensen P, Ringertz S. Neonatal septicemia due to group B streptococci—perinatal risk factors and outcome of subsequent pregnancies. J Perinat Med 1988;16: 423–30.
- Schrag SJ, Zell ER, Lynfield R, et al. A population-based comparison of strategies to prevent early-onset group B streptococcal disease in neonates. N Engl J Med 2002;347:233–9.
- Verani JR, McGee L, Schrag SJ, Division of Bacterial Diseases, National Center for Immunization and Respiratory Diseases, Centers for Disease Control and Prevention (CDC). Prevention of perinatal group B streptococcal disease–revised guidelines from CDC, 2010. MMWR Recomm Rep 2010; 59:1.
- Prevention of early-onset group B streptococcal disease in newborns. committee opinion. No. 485. American College of Obstetricians and Gynecologists. ObstetGynecol2011;117:1019-27.
- Tor-Udom S, Tor-Udom P, Hiriote W. The prevalence of streptococcus agalactiae (group B) colonization in pregnant women at Thammasat Hospital. Journal of the Medical Association of Thailand. 2006;89(4):411.
- Werawatakul Y, Wilailuckana C, Taksaphan S, Thinkumrup J, Pragarasung M, Chouwajaroen P, et al. Prevalence and risk factors of Streptococcus agalactiae (group B) colonization in mothers and neonatal contamination at Srinagarind Hospital. Journal of the Medical Association of Thailand. 2001;84(10):1422-9.
สำหรับในประเทศไทยนั้นได้เคยมีการศึกษาความชุกของพาหะของเชื้อ GBS ในสตรีตั้งครรภ์ที่โรงพยาบาลธรรมศาสตร์ซึ่งพบว่าความชุกของพาหะของเชื้อ GBS คือ ร้อยละ16 (50)และโรงพยาบาลศรีนครินทร์พบว่าความชุกของพาหะของเชื้อ GBS คือ ร้อยละ 6.22 (51)สำหรับในโรงพยาบาลมหาราชนครเชียงใหม่นั้นยังไม่ทราบความชุกของพาหะ GBS อย่างแน่ชัด ดังนั้นการให้ยาปฏิชีวนะเพื่อป้องกันการติดเชื้อ GBS จากแม่สู่ลูกในช่วงการคลอดจึงให้ตามความเสี่ยงของหญิงตั้งครรภ์ตามคำแนะนำของCDC 2010เท่านั้น ซึ่งหากโรงพยาบาลใดมีการตรวจคัดกรองเชื้อ GBS ในหญิงตั้งครรภ์ที่อายุครรภ์ 35-37 สัปดาห์ ก็สามารถให้ยาเพื่อป้องกันการติดเชื้อสู่ทารกได้ตามแนวทางการรักษาของ CDC 2010 ดังที่ได้กล่าวข้างต้น