บทบาทของนรีแพทย์ในการดูแลหญิงข้ามเพศ
บทบาทของนรีแพทย์ในการดูแลหญิงข้ามเพศ
(Male to Female Transgender in Gynecologist’s Aspect)
แพทย์หญิงจงปีติ วุฒิสรรพ์
อาจารย์แพทย์หญิงอุบล แสงอนันต์
ในอดีตเรื่องของเพศ (sex) ถือได้ว่าเป็นเรื่องส่วนตัวและเป็นความต้องการพื้นฐานของมนุษย์ตามธรรมชาติ เรื่องของเพศที่ถูกต้องงดงามมักถูกจัดวางให้สอดคล้องกับความเป็นธรรมชาติที่ในสังคมสามารถเห็นได้อย่างชัดเจน บุคคลในสังคมมักจะแยกประเภทของความสัมพันธ์ทางเพศโดยใช้ธรรมชาติเป็นเกณฑ์ และมีความเชื่อที่ว่าเพศนั้นไม่สามารถที่จะเปลี่ยนแปลงได้ ดังนั้นความสัมพันธ์ทางเพศแบบอื่นที่มองดูผิดธรรมชาติจึงมักถูกมองว่ามีความวิปริตเบี่ยงเบน จนทำให้บุคคลเหล่านี้รู้สึกว่าตนเองเป็นส่วนด้อยของสังคม ไม่สามารถที่จะรับสิทธิที่เท่าเทียมกับคนอื่นๆได้ บางครั้งคนเหล่านี้ก็ถูกมองว่าเป็นเรื่องตลกน่าขบขันและมักถูกล้อเลียนอยู่เสมอ ดังนั้นจึงมีความจำเป็นที่เราในฐานะที่เป็นสูตินรีแพทย์ต้องมีความรู้ความเข้าใจ ในคำจำกัดความ ประเภท สาเหตุ การรักษาแต่ละวิธี ตลอดจน เข้าใจถึงจิตใจของบุคคลดังกล่าว เพื่อให้บุคคลข้ามเพศเหล่านี้สามารถดำรงชีวิตอยู่ในสังคมได้อย่างมีความสุข
นิยามศัพท์ (1, 2)
เพศ (sex) หมายถึง ลักษณะเฉพาะซึ่งกำหนดขอบเขตของบุคคลว่า เป็นหญิงหรือชาย โดยเป็นเพศที่แสดงออกให้เห็นทางกายภาพหรือทางสรีระ(biological sex)
เพศสภาพหรือเพศภาวะ (gender) หมายถึง ภาวะความเป็นชายหรือหญิงที่ไม่ได้ถูกกำหนดโดยระบบชีววิทยา แต่ถูกกำหนดโดยปัจจัยทางวัฒนธรรม สังคม และอื่นๆ รวมทั้งประสบการณ์และการแสดงออกของบุคคลต่อเพศนั้นๆ ตลอดจนกิจกรรมและพฤติกรรมทางเพศทุกรูปแบบ
วิถีทางเพศ (sexuality or sexual orientation) หมายถึง ความสามารถของบุคคลเกี่ยวกับแรงดึงดูดอันลึกล้ำด้านอารมณ์ เสน่หาด้านเพศและความสัมพันธ์ทางเพศกับบุคคลซึ่งมีเพศภาวะที่แตกต่างกันหรือเหมือนกันหรือมีมากกว่าหนึ่งเพศภาวะ มีทั้งกับเพศตรงข้าม (heterosexuality) กับเพศเดียวกัน (homosexuality) กับทั้งสองเพศ (bisexuality) กับทุกเพศ (pansexuality) กับหลายเพศ แต่ไม่ทุกเพศ (polysexuality) และไม่มีอารมณ์รักกับเพศใดเลย (asexuality) ก็ได้
อัตลักษณ์ทางเพศ (gender identity) หมายถึง ความรู้สึกล้ำลึกภายในของบุคคลเกี่ยวกับเพศภาวะ ซึ่งอาจจะสอดคล้องหรือตรงข้ามกับเพศโดยกำเนิดของตน รวมทั้งความรู้สึกทางสรีระ (ซึ่งหากสามารถเลือกได้อาจเกี่ยวข้องกับการเปลี่ยนแปลงแก้ไขลักษณะและการทำงานทางกายภาพด้วยวิธีทางการแพทย์ การผ่าตัดหรือวิธีอื่นใด) รวมทั้งการแสดงออกทางเพศภาวะ เช่น การแต่งกาย การพูดจาและกิริยาอื่นๆ เป็นต้น
เพศลักษณ์ (sexual characteristics) หมายถึง ลักษณะทางกายภาพของเพศนั้น แบ่งได้ 2 ลักษณะคือ เพศลักษณ์ปฐมภูมิ (primary sexual characteristics) เช่น การมีอัณฑะในเพศชายและการมีช่องคลอดในเพศหญิง เป็นต้น และเพศลักษณ์ทุติยภูมิ (secondary sexual characteristics) เช่น เต้านมที่โตขึ้นในเพศหญิง เป็นต้น
คนที่มีจิตใจเหมือนเพศตรงข้าม (transsexual) หมายถึง คนที่เกิดมามีสภาพด้านร่างกายเป็นเพศหนึ่งแต่มีอารมณ์ จิตใจ และเลือกที่จะใช้ชีวิตในบทบาททางเพศที่เป็นอีกแบบหนึ่งไปจนถึงการเลือกที่จะแปลงเพศ
คนข้ามเพศ (transgender) หมายถึง ผู้ที่รู้สึกพึงพอใจกับเพศภาวะหรืออัตลักษณ์ทางเพศที่ตรงข้ามกับเพศกำเนิดของตน ซึ่งมักจะหมายถึงผู้ที่ได้รับการแปลงเป็นเพศที่ต้องการแล้ว
Male to female transgender (MtF) หมายถึง หญิงที่ได้รับการแปลงเพศมาจากเพศชายเรียบร้อยแล้วหรือเรียกว่า หญิงข้ามเพศ (transwoman)
Female to male transgender (FtM) หมายถึง ชายที่ได้รับการแปลงเพศมาจากเพศหญิงเรียบร้อยแล้วหรือเรียกว่า ชายข้ามเพศ (transman)
ความชุก
ความชุกของภาวะต่างๆ ทางเพศวิทยานั้นศึกษาได้ยาก เนื่องจากมีหลายคำจำกัดความหลายอย่างและยังมีปัจจัยทางด้านสังคมมาเกี่ยวข้อง ทำให้การเก็บข้อมูลไม่ตรงกับความเป็นจริงและมีความแปรปรวนจากเชื้อชาติ ศาสนา ความเชื่อและวัฒนธรรมของท้องถิ่นหรือประเทศนั้นๆ ดังนั้นความชุกที่ได้จึงมักจะต่ำกว่าความเป็นจริงได้มีการรายงานความชุกของ transgender ไว้โดยเฉลี่ยอยู่ที่ร้อยละ 0.3 – 0.5 (3) โดยในสหรัฐอเมริกาได้รายงานความชุกของ MtF ไว้ประมาณ 1:30,000 ราย สำหรับในประเทศไทยยังไม่มีการรายงานที่ชัดเจน แต่ข้อมูลจากสมาคมสตรีข้ามเพศแห่งประเทศไทย (Trans-female Association of Thailand) พบว่ามีหญิงที่แปลงเพศจากชายลงทะเบียนเป็นสมาชิกแล้วอย่างน้อย 2,000 คน (2)
สาเหตุ
ในอดีตเชื่อกันว่าสาเหตุนั้นเกิดมาจากการเลี้ยงดูในครอบครัวโดยเฉพาะแม่ที่อยากให้ลูกชายกลายเป็นลูกสาว หรือเกิดจากบทบาทของพ่อแม่ที่ไม่ถูกต้อง เช่น บางบ้านแม่มีบทบาทหรืออิทธิพลมากกว่าพ่อ ลูกชายจะเลียนแบบแม่ทำให้มีความอยากเป็นผู้หญิงเหมือนแม่
สาเหตุที่แท้จริงในปัจจุบันนั้นยังไม่เป็นที่ทราบแน่ชัด(4) แต่มีความเชื่อในเรื่องปัจจัยทางชีวภาพมากกว่าปัจจัยอื่นๆ เช่น ปัจจัยจากสารพันธุกรรม มีรายงานการศึกษาที่สนับสนุนความคิดนี้โดยพบว่ามีความสัมพันธ์กับส่วนสมองที่เรียกว่า the bed nucleus of the stria terminalis (BST) โดยเฉพาะในส่วนกลางของ BST (central part: BSTc) ซึ่งมี somatostatin cells และ vasoactive intestinal peptide innervation อยู่ โดยพบว่า BSTc ของ MtF มีขนาดและปริมาตรคล้ายคลึงกันมาก กับ BSTc ของหญิงแท้ และ BSTc ของ FtM กับ BSTc ของชายแท้ก็มีความเหมือนกันด้วย (5, 6)
สำหรับปัจจัยทางจิตวิทยานั้นในปัจจุบันไม่ได้เป็นที่ยอมรับกันเหมือนสมัยก่อน ส่วนปัจจัยทางสังคมหรือสิ่งแวดล้อมและการเลี้ยงดูนั้นอาจเป็นปัจจัยเสริมได้เล็กน้อยแต่ไม่ใช่ปัจจัยหลัก
การวินิจฉัย
โดยส่วนใหญ่เด็กจะรับรู้ตัวเองว่าเป็นเพศใด ตอนอายุประมาณ 3-5 ขวบ(7) มีการรายงานว่า 1 ใน 3 ของ transgender นั้นสามารถพบพฤติกรรมที่เลียนแบบเพศตรงข้ามได้ตั้งแต่วัยเด็กอายุน้อยกว่า 12 ปี (childhood) ที่เหลืออีก 1 ใน 3 จะพบได้ในช่วงตอนเป็นผู้ใหญ่(8) ดังนั้นผู้ที่มีพฤติกรรมเบี่ยงเบนทางเพศหรือภาวะความไม่พอใจในเพศของตัวเอง (gender dysphoria หรือ gender identity disorder: GID) จึงแบ่งได้เป็นสองระยะตามอายุที่พบคือ childhood type และ adolescent/adult type ซึ่งสามารถวินิจฉัยได้ดังนี้ (9)
- การที่บุคคลใดบุคคลหนึ่งมีความรู้สึกอึดอัดไม่สบายใจอย่างคงที่ต่อเพศที่แท้จริงของตนเอง
- มีความต้องการที่จะหลีกหนีหรือหลีกเลี่ยงเพศลักษณ์ที่แท้จริงของตนเอง
- มีความต้องการที่จะมีเพศลักษณ์ตรงข้ามกับเพศที่แท้จริงของตนเอง
- มีความต้องการจะเป็นเพศอื่น
- มีความต้องการที่จะได้รับการปฏิบัติเช่นเดียวกับเพศตรงข้ามกับเพศที่แท้จริงของตนเอง
- มีความรู้สึกและเอาแบบอย่างเพศตรงข้ามอย่างชัดเจน และเป็นอยู่ตลอด
อาการดังกล่าวต้องเป็นอยู่นานอย่างน้อย 6 เดือน โดยที่ childhood type จะต้องมีอาการครบทั้ง 6 ข้อ ส่วนกลุ่มที่เป็น adolescent/ adult type จะต้องมีอาการอย่างน้อย 2 ข้อขึ้นไป
การดูแลรักษา
เมื่อได้เกิดปัญหาเรื่องความไม่พึงพอใจในเพศของตนเองนั้น ผู้ป่วยมักจะมาขอคำปรึกษาจากแพทย์ผู้เชี่ยวชาญ ซึ่งแนวทางในการดูแลรักษาบุคคลเหล่านี้ประกอบไปด้วย 3 วิธีการหลักๆ ได้แก่ การรักษาสภาพจิตใจ การรักษาด้วยการใช้ฮอร์โมนและการผ่าตัดแปลงเพศ ซึ่งมีรายละเอียดดังต่อไปนี้
1. การรักษาสภาพจิตใจ (Psychotherapy) จิตแพทย์จะมีบทบาทสำคัญมากที่สุดในส่วนนี้โดยเน้นในเรื่องต่างๆ ดังต่อไปนี้ (10)
- การให้ความรู้ (psychoeducation) แก่ผู้ป่วยและครอบครัวในเรื่องของตัวโรค กระบวนการรักษา ผลที่จะเกิดขึ้นในกระบวนการรักษาและหลังการรักษา
- ครอบครัวบําบัด (family therapy) ให้คําแนะนําแก่พ่อแม่และญาติพี่น้องในครอบครัวให้เกิดความเข้าใจและยอมรับ พร้อมปรับทัศนคติของคนในครอบครัวให้ยอมรับการเลือกสภาพเพศของผู้ป่วย
- ทดลองให้ผู้ป่วยใช้ชีวิตเป็นเพศตรงกันข้ามตามที่ตนต้องการ (real life experience) เป็นเวลาอย่างน้อย 12 เดือน ซึ่งประกอบด้วย
- การแต่งกายแบบเพศตรงกันข้ามตลอดเวลา
- การเข้าร่วมกิจกรรม กลุ่มเพื่อน กีฬา งานอดิเรก
- การใช้ชีวิตในสังคมที่มีการแยกกิจกรรมหรือสถานที่ที่มีการกําหนดเพศ เช่น ห้องน้ำสาธารณะ
- การดําเนินชีวิตเกี่ยวกับการเรียนหรือการทํางาน ความสัมพันธ์กับบุคคล
- การเผชิญปัญหาอุปสรรคที่คาดว่าจะเกิดขึ้น เช่น การเกณฑ์ทหาร การใช้คํานําหน้า
โดยทางจิตแพทย์เองจะเป็นผู้ทำการประเมินข้อมูลรอบด้านจากหลายแหล่ง เช่น ผู้ป่วย พ่อแม่ญาติ ครูอาจารย์ เพื่อนและบุคคลรอบข้าง เพื่อให้ได้ข้อสรุปว่าการดําเนินชีวิตที่ได้ทํามาก่อนหน้านั้น มีความต่อเนื่องยาวนานครบถ้วนทั้ง12 เดือน และผู้ป่วยสามารถปรับตัวใช้ชีวิตอยู่ได้โดยปกติจริง
2. การรักษาด้วยการใช้ฮอร์โมน (Hormone treatment) (2, 9)
ภายหลังจากจิตแพทย์ช่วยเหลือและติดตามผลการรักษาตามขั้นตอนข้างต้นแล้ว หากผู้ป่วยยังคงมีความต้องการและยืนยันที่จะทำการแปลงเพศ จิตแพทย์จะส่งปรึกษากุมารแพทย์หรืออายุรแพทย์เฉพาะทางระบบต่อมไร้ท่อ เพื่อพิจารณาการรักษาด้วยฮอร์โมนหรือยาก่อนที่จะทำการแปลงเพศ การรักษาด้วยการใช้ฮอร์โมนนี้มีวัตถุประสงค์เพื่อลดการเจริญของเส้นขน กระตุ้นให้เกิดการเจริญเติบโตของเต้านมและเพิ่มไขมันตามส่วนต่างๆของร่างกาย ซึ่งฮอร์โมนที่นิยมใช้ ได้แก่ estrogen, progesterone, anti-androgen และ GnRH agonist ดังแสดงในตารางที่ 1
ตารางที่1 แสดงขนาดและวิธีใช้ฮอร์โมนในกลุ่ม MtF (Adapted from the Endocrine Society Guiddelines2009)(11)
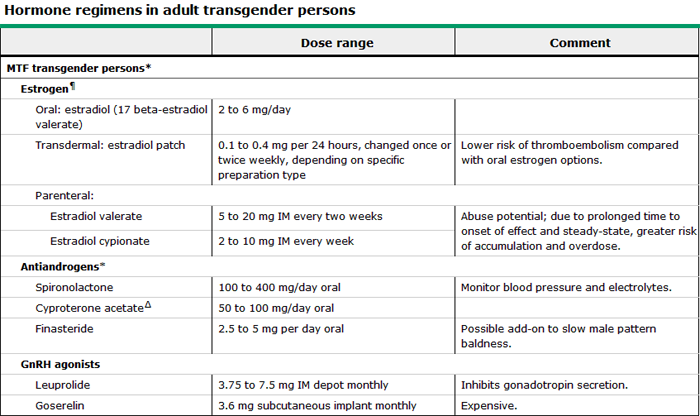
แต่ก่อนเริ่มการรักษาด้วยการใช้ฮอร์โมน แพทย์ต้องมั่นใจว่าผู้ป่วยไม่มีข้อห้ามในการใช้ฮอร์โมนและไม่มีโรคประจำตัวที่ทำให้กำเริบมากขึ้นหากใช้ฮอร์โมน โดยเฉพาะอย่างยิ่งกลุ่มที่มีความเสี่ยงต่อการใช้ฮอร์โมนเอสโตรเจนในขนาดสูงหรือในระยะยาว เช่น มีประวัติหลอดเลือดอุดตัน (thromboembolism) โรคตับเรื้อรังหรือโรคตับขั้นรุนแรง โรคหลอดเลือดหัวใจ ภาวะโปรแลคตินในเลือดสูงหรือ prolactinoma ปวดศีรษะไมเกรนที่มี aura และมีประวัติมะเร็งชนิดที่ไวต่อ estrogen เช่น มะเร็งเต้านมในครอบครัว เป็นต้น
นอกจากนี้ยังต้องประเมินก่อนว่าผู้ป่วยอยู่ในวัยใด โดยหากเป็นผู้ใหญ่สามารถเริ่มยาฮอร์โมนได้เลย โดยนิยมใช้ยาในกลุ่ม anti-androgen และ estrogen หากเป็นวัยรุ่นจะต้องมีอายุมากกว่า 16 ปีบริบูรณ์ และต้องได้รับการยินยอมจากผู้ปกครองก่อนเสมอ จากนั้นแพทย์จะต้องทำการประเมินระยะของเพศลักษณ์ทุติยภูมิ โดยอาศัยเกณฑ์ตาม Tanner staging criteria ว่าเข้าสู่ระยะที่ 2 เป็นอย่างน้อย จึงจะเริ่มให้ยากลุ่ม GnRH agonist เพื่อยับยั้งการสร้าง gonadotropins และเพื่อชะลอการเปลี่ยนแปลงสภาพร่างกายของวัยหนุ่ม (ยากลุ่ม GnRH agonist ออกฤทธิ์โดยการกระตุ้นต่อมใต้สมองในช่วงแรกหลังจากนั้นจะกดการทำงานของต่อมใต้สมองและลดการสร้างฮอร์โมนเพศ) แล้วจึงตามด้วยฮอร์โมนเอสโตรเจนเพื่อชักนำให้เกิดภาวะวัยสาวต่อไป
การให้ฮอร์โมนในระยะก่อนผ่าตัดแปลงเพศจะใช้ฮอร์โมนเอสโตรเจนในปริมาณที่มากและต้องให้anti-androgen ร่วมด้วย ซึ่งแตกต่างจากภายหลังที่ได้รับการผ่าตัดแปลงเพศไปแล้วนั้นจะให้เฉพาะฮอร์โมนเอสโตรเจนและลดปริมาณยาที่ใช้ลงเรื่อยๆ แต่ยังคงต้องใช้ต่อเนื่องต่อไปโดยอาศัยหลักการเดียวกับการให้ฮอร์โมนทดแทนในหญิงวัยหมดประจำเดือน ดังนั้นจึงต้องอยู่ในความดูแลของแพทย์อย่างต่อเนื่อง
ไม่แนะนำให้ใช้ ethinyl estradiol ในรูปแบบรับประทานเพียงอย่างเดียวเนื่องจากมีความเสี่ยงในการเกิดภาวะลิ่มเลือดอุดตันสูง แต่แนะนำให้ใช้คู่กับยากลุ่ม antiandrogen หรือ GnRH agonist นอกจากนี้ยังแนะนำใช้ให้ฮอร์โมนเอสโตรเจนในรูปแบบแปะผิวหนังมากกว่าเนื่องจากผลข้างเคียงน้อยและไม่ผ่าน first pass metabolism ที่ตับด้วย
การใช้ยา spironolactone ไม่ควรให้ในผู้ป่วยโรคไต เนื่องจากเป็น potassium- sparing diuresis อาจทำให้เกิด hyperkalemia ได้
การติดตามการรักษาหลังการใช้ฮอร์โมน (2, 9, 11)
เนื่องจากมีการใช้ฮอร์โมนที่มีปริมาณสูงและใช้เป็นระยะเวลานานดังนั้นจึงควรนัดผู้ป่วยมาตรวจติดตามอาการและตรวจร่างกายเพื่อค้นหาอาการข้างเคียงและภาวะแทรกซ้อนที่อาจเกิดขึ้นจากการใช้ฮอร์โมนต่างๆ โดยแนะนำว่าในช่วง 1 ปีแรกควรนัดตรวจทุก 2-3 เดือน หากผู้ป่วยไม่มีภาวะแทรกซ้อนจากการใช้ฮอร์โมนอาจนัดห่างเป็นปีละ1-2 ครั้ง และในช่วงปีแรกควรจะเจาะเลือดเพื่อตรวจระดับฮอร์โมน testosterone และ estradiol ทุกๆ 3 เดือน ซึ่งระดับของ testosterone ควรจะน้อยกว่า 55 ng/dL และระดับของ estradiol ควรมีค่าในช่วง 100–200 pg/dL
หากผู้ป่วยมีประวัติใช้ยา spironolactone ควรเจาะเลือดประเมินค่า electrolytes ทุก 2-3 เดือน นอกจากนี้ควรมีการเจาะเลือดเพื่อประเมินระดับ prolactin เพื่อเป็นค่าพื้นฐาน 1 ปีหลังเริ่มการรักษา จากนั้นให้ทำการเจาะตรวจทุก2ปี
3. การผ่าตัดแปลงเพศ (Sexual reassignment surgery: SRS )
ถ้าผู้ป่วยมีความต้องการผ่าตัดแปลงเพศ จิตแพทย์ผู้รักษาจะส่งผู้ป่วยเพื่อปรึกษาแพทย์ผู้ผ่าตัดแปลงเพศ (ซึ่งอาจเป็นแพทย์ศัลยกรรมตกแต่งหรือสูตินรีแพทย์) พร้อมจดหมายแสดงความคิดเห็น (letter of recommendation) ระบุถึงการตรวจวินิจฉัยโรคทางจิตเวช แผนการรักษา ผลการรักษาและการติดตาม ตลอดจนความเห็นของจิตแพทย์ต่อการพิจารณาผ่าตัดและการประเมินความพร้อมในการรับการผ่าตัดแปลงเพศ
แพทย์ผู้ผ่าตัดแปลงเพศ จะให้ความรู้ผู้ป่วยในเรื่องของกระบวนการผ่าตัด ผลการผ่าตัด ผลทางร่างกายหลังการผ่าตัด ปัญหาและผลแทรกซ้อนที่อาจเกิดขึ้นหลังการผ่าตัดอย่างละเอียด เนื่องจากหากตัดสินใจผ่าตัดแล้วจะไม่สามารถผ่าตัดกลับคืนมาเป็นเพศเดิมได้อีก หากผู้ป่วยยืนยันจะผ่าตัด แพทย์ผู้ผ่าตัดจะส่งผู้ป่วยไปขอความเห็นในเรื่องการวินิจฉัยโรคทางจิตเวชจากจิตแพทย์อีกท่านหนึ่ง เพื่อทำการตรวจวินิจฉัยและให้จดหมายยืนยันการวินิจฉัยว่าเป็น gender dysphoria หรือให้ความเห็นตรงกับจิตแพทย์ท่านแรกที่ส่งมาหรือไม่ เมื่อความเห็นการวินิจฉัยของจิตแพทย์ทั้งสองคนตรงกันว่าผู้ป่วยมีปัญหาเรื่อง gender dysphoria แพทย์ผู้ผ่าตัดจึงจะสามารถผ่าตัดแปลงเพศให้ผู้ป่วยได้ ดังแสดงในแผนภูมิที่ 1 (10)
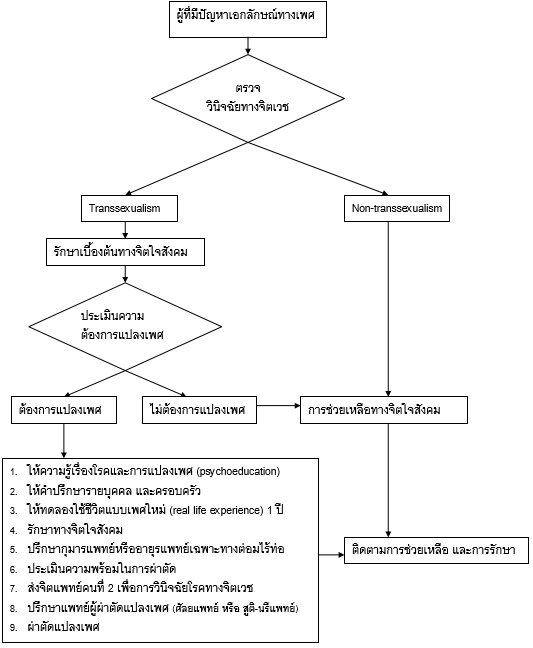
แผนภูมิที่1 แสดงแนวทางการช่วยเหลือและรักษาโรค gender dysphoria (10)
การผ่าตัดแปลงเพศ (Sex reassignment surgery: SRS) มีขั้นตอนหลัก 4 ขั้นตอน ดังนี้ (12)
- การตัดองคชาติ (penectomy) โดยส่วน corpus carvenosum และ corpus spongiosum จะถูกตัดทิ้ง แต่จะเก็บส่วน tip of glands penis มาทำเป็น clitoris เพื่อให้สามารถรับความรู้สึกทางเพศได้
- การตัดอัณฑะ (orchidectomy) ทำให้น้ำอสุจิไม่มีและไม่ผลิต
- การสร้างช่องคลอด (vaginoplasty) วิธีที่นิยมมี 2 วิธี ได้แก่
- Penile inversion, invert skin flap technique คือการนำผิวหนังขององคชาติและถุงอัณฑะมาทำเป็นช่องคลอดเทียมเพื่อให้เกิดความรู้สึก เนื่องจากมีเส้นประสาทมาเลี้ยงมาก
- Sigmoid colon technique คือการนำลำไส้ใหญ่ส่วน colon มาทำเป็นช่องคลอดเทียม
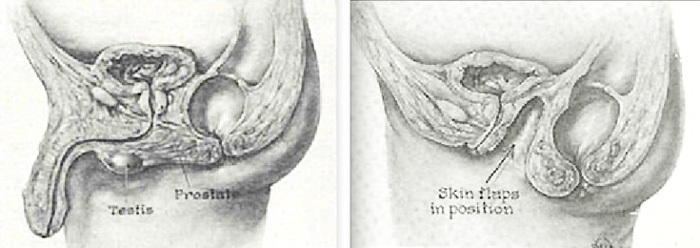
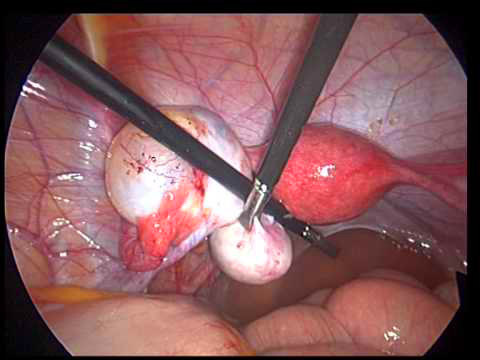
ภาพที่1-2 แสดงการทำ Penile inversion technique
(www.surgeryencyclopedia.com)
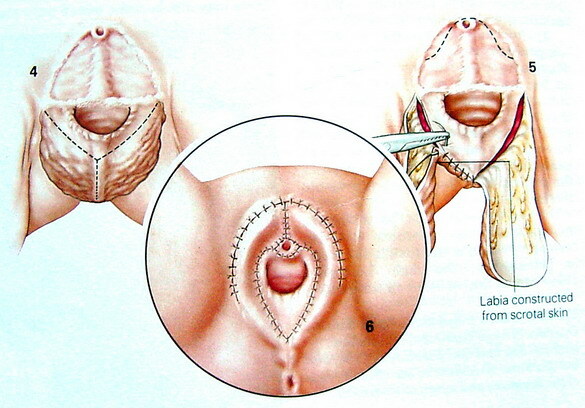
4. การตกแต่งให้ส่วนอื่นๆ เป็นอวัยวะเพศหญิง (feminizing genitoplasty) ผิวหนังถุงอัณฑะที่เหลือจะถูกดัดแปลงเป็น labia majora ท่อปัสสาวะจะถูกตัดให้สั้นลง ส่วนต่อมลูกหมากนั้นไม่ได้ทำการตัดออกเนื่องจากการตัดต่อมลูกหมากนั้นเป็นการผ่าตัดที่ค่อนข้างยาก ทำให้มีความเสี่ยงต่อการเกิดภาวะแทรกซ้อนหลังผ่าตัดต่อมลูกหมากสูงขึ้น (8)
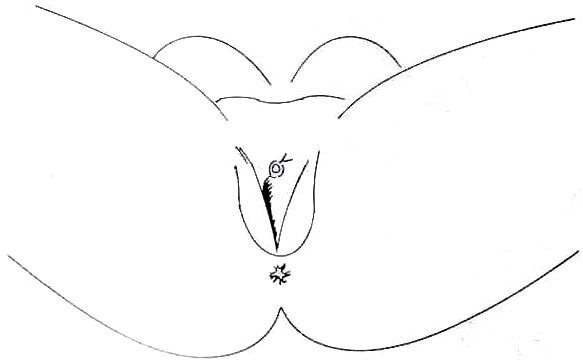
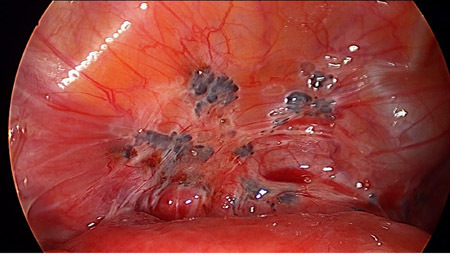
ภาพที่3 แสดงอวัยวะเพศเทียมหลังผ่าตัดเสร็จ
(www.surgeryencyclopedia.com)
ภายหลังผ่าตัดแปลงเพศแล้วนั้นลักษณะกายวิภาคของอวัยวะเพศหญิงที่สร้างขึ้นมาใหม่จะมีลักษณะแตกต่างจากเพศหญิงปกติ ดังนี้ (2)
- ช่องคลอดที่สร้างขึ้นใหม่ ไม่มี skene’s gland ดังนั้นในการทำช่องคลอดแบบ penile inversion จึงไม่มีน้ำหล่อลื่น ในขณะที่การทำช่องคลอดแบบ sigmoid colon technique จะมีการหลั่งสารคัดหลั่งจาก columnar epithelium โดยตรงได้ (13)
- ไม่มี Bartholin’s gland
- ไม่มี labia minora และไม่มีเยื่อพรหมจรรย์ (hymen)
- กล้ามเนื้อหุ้มรอบช่องคลอดที่สร้างขึ้นใหม่มีความแข็งแรงมากกว่าช่องคลอดของหญิงแท้ ดังนั้นการดูแลหลังการผ่าตัดจึงต้องมีการช่วยขยายช่องคลอด (dilator) ด้วยเพื่อไม่ให้เกิดการตีบตัน นอกจากนี้เวลาเราใส่นิ้วเพื่อตรวจภายในจะรู้สึกว่ามีความตึงตัวของกล้ามเนื้อรอบช่องคลอดมากกว่าหญิงแท้
- แกนช่องคลอดของกลุ่ม MtF จะมีความลาดเอียงลงไปทางด้านหลังมากกว่าและไม่อยู่ในแกนตั้งเหมือนหญิงแท้ นอกจากนี้บริเวณ posterior labial commissure จะถูกยกขึ้นมาทางด้านหน้า ดังนั้นเมื่อจะใส่เครื่องมือตอนตรวจภายในต้องใส่เครื่องมือตามแนวแกนของช่องคลอด หากใส่ผิดแนวผู้ป่วยอาจเจ็บได้
- ให้พึงระลึกอยู่เสมอว่ากลุ่ม MtF นั้นยังมีต่อมลูกหมากอยู่ ดังนั้นเวลาตรวจภายในแพทย์จะต้องทำการตรวจทางทวารหนักเพื่อคลำต่อมลูกหมากด้วยทุกครั้ง
การดูแลรักษาผู้ป่วยกลุ่ม MtF (ในบทบาทของนรีแพทย์)
ผู้ป่วยกลุ่มนี้มักจะขาดความรู้ ความเข้าใจ ไม่ทราบว่าควรจะไปพบแพทย์สาขาไหนดี อีกทั้งยังมีความกลัวไม่กล้ารับการบริการการตรวจรักษาจากแพทย์และกลัวการไม่ยอมรับจากแพทย์ (14) นอกจากนี้ยังพบอุบัติการณ์ในการเกิดโรคซึมเศร้าได้บ่อยในผู้ป่วยที่ได้รับการแปลงเพศแล้วด้วย (15) สืบเนื่องมาจากการถูกปฏิเสธจากครอบครัวและเพื่อนฝูงจึงทำให้มาพบแพทย์ช้ากว่าปกติ ดังนั้นในฐานะที่เป็นนรีแพทย์จึงควรใช้การสื่อสารด้วยภาวะที่เหมาะสมกับเพศภาวะ เช่น ใช้สรรพนาม “คุณ” แทนคำว่า “นาย” นอกจากนี้ควรหลีกเลี่ยงถ้อยคำเชิงดูถูกหรือล้อเลียนผู้ป่วย (16)
การซักประวัติ ทำการซักประวัติตามอาการสำคัญ ประวัติปัจจุบัน ตามมาตรฐานทางการแพทย์ปกติ ดังนี้
- การใช้ฮอร์โมน เช่น ชนิด ขนาดและระยะเวลาที่ใช้ ตลอดจนอาการข้างเคียงและภาวะแทรกซ้อนที่เกิดขึ้น
- การทำศัลยกรรมแปลงเพศ ระยะเวลาและวิธีการผ่าตัด
- การทำศัลยกรรมเต้านมและการฉีดซิลิโคน
- การใช้ยานอนหลับ สารเสพติด และบุหรี่
- การมีเพศสัมพันธ์และการป้องกัน
การตรวจร่างกาย
- การตรวจอวัยวะเพศ ควรใช้คำที่เป็นกลางทางเพศภาวะ
- การตรวจเต้านม ในกลุ่ม MtF ที่มีการผ่าตัดเสริมเต้านมด้วยซิลิโคน ทำให้การประเมินด้วยการตรวจร่างกายหรือเอกซเรย์เต้านมทำได้ยากขึ้น
- การตรวจภายใน ให้เลือก speculum ขนาดที่เหมาะสม ควรเริ่มที่ขนาดเล็กเนื่องจาก posterior labial commissure จะถูกยกขึ้นมาทางด้านหน้าทำให้แกนของช่องคลอดมีความลาดลงมากกว่าเมื่อเทียบกับหญิงแท้ ดังนั้นการสอด speculum ควรสอดเครื่องมือไปทางด้านหลังมากกว่า
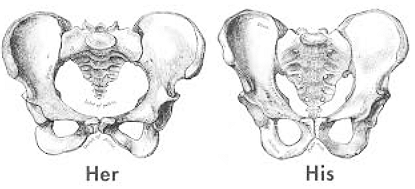
ภาพที่4 แสดงลักษณะทางกายวิภาคของอุ้งเชิงกรานผู้หญิงและผู้ชาย (www.surgeryencyclopedia.com) - การตรวจคัดกรองมะเร็งปากมดลูก ปัจจุบันยังไม่มีข้อสรุปของการตรวจคัดกรอง neovagina (ช่องคลอดที่สร้างขึ้นใหม่) แต่อย่างไรก็ตามมีรายงานพบว่าผู้ป่วยเป็นมะเร็งบริเวณ neoclitoris ที่ดัดแปลงมาจาก tip of gland of penis จึงแนะนำให้ผู้ป่วยกลุ่มนี้ทำการตรวจ cytology screening บริเวณ neoclitoris ซึ่งเป็นบริเวณที่มีการติดเชื้อ HPV ได้มากที่สุด (17)
- การตรวจช่องคลอด ให้ดูลักษณะความผิดปกติที่เห็นด้วยตาเปล่า (gross pathology ) หากพบความผิดปกติ ให้ทำการตัดชิ้นเนื้อส่งตรวจทางพยาธิวิทยา
- การตรวจต่อมลูกหมาก หลังได้ฮอร์โมนต่อมลูกหมากจะมีขนาดเล็กลงและเปลี่ยนรูปร่างจากคล้ายลูกเกาลัดกลายเป็นลูกเชอร์รี่ (18) โอกาสในการเกิด benign prostatic hypertrophy ลดลง แต่โอกาสในการเกิดมะเร็งต่อมลูกหมากนั้นยังงมีอยู่ดังเช่นชายปกติ ดังนั้นแพทย์จะต้องทำการตรวจทางทวารหนักด้วยทุกครั้ง
ปัญหาที่พบบ่อย
1. ตกขาว ผู้ป่วยกลุ่มนี้มีโอกาสติดเชื้อได้ง่าย เนื่องจากขาดกลไกป้องกันทางชีวภาพ คือไม่มี labia minora เป็นตัวกั้นเชื้อโรคไม่ให้เข้าไปในช่องคลอด (19) และไม่มี Doderlein bacilli ที่ผลิตกรดในช่องคลอด(20) แต่ต้องพึงระวังไว้ด้วยว่าตกขาวที่เกิดขึ้นในผู้ป่วยกลุ่มไม่ได้มีเพียงแต่เรื่องการติดเชื้อเสมอไป ควรที่จะต้องคิดถึงภาวะอื่นๆที่อาจเกิดจากการผ่าตัดด้วยเสมอ ได้แก่
- ผู้ป่วยที่ทำช่องคลอดวิธี penile inversion จะมีการสะสมของรังแคและไขมันที่ผลิตจากรากขนบริเวณถุงอัณฑะ ส่วน columnar mucous พบใน sigmoid colon technique ซึ่งจะพบได้บ่อยที่บริเวณ posterior neovaginal wall
- exudate ที่เกิดจาก granulation tissue ภายหลังจากทำการผ่าตัด
- neovaginal folliculitis พบใน penile inversion เชื้อที่พบบ่อยคือ Staphylococus aureus เกิดจากการที่ hair follicle จากถุงอัณฑะและองคชาติติดมาตอนที่ทำช่องคลอดเทียม วิธีป้องกันคือการทำelectrolysisทำลาย hair follicles ก่อนวาง scrotal graft
- becterial vaginosis แนะนำให้ใช้ clindamycin ในการรักษา แทน metronidazole เนื่องจากจุลชีพที่พบบ่อยจะเป็นเชื้อที่พบในลำไส้ใหญ่และทวารหนัก เช่น Mobiluncus และ anaerobic bacteria ทั้งหลายซึ่งดื้อต่อmetronidazole ได้บ่อย (21)
- Gonococcal neovaginitis พบได้ในการทำ sigmoid colon technique
- Vaginal intraepithelial neoplasia (VIN) ต้องทำการตรวจดูลักษณะช่องคลอดอย่างละเอียด
2. โรคติดเชื้อทางเพศสัมพันธ์ ที่พบบ่อยได้แก่
- การติดเชื้อHIV ผู้ป่วยกลุ่มนี้มักขาดโอกาสในการสมัครงานจึงทำงานบริการทางเพศ นอกจากนี้ยังมีพฤติกรรมทางเพศแบบไม่ป้องกันทำให้มีอุบัติการณ์การติดเชื้อ HIV สูงถึงร้อยละ 13.5 (14)
- การติดเชื้อ HPV พบบ่อยใน penile inversion ซึ่งบริเวณที่พบบ่อยได้แก่ neoclitoris และทวารหนัก นอกจากนี้ HPV ยังทำให้เกิดหูดหงอนไก่ตามที่ต่างๆ เช่น ช่องคลอด ทวารหนักและช่องปาก ซึ่งการรักษาให้รักษาเหมือนกับการรักษาหูดหงอนไก่ในหญิงและชายทั่วไป และยังมีรายงานการเกิด VIN ร่วมกับการติดเชื้อ HPV ได้เช่นกัน
- มีการศึกษาถึงการใช้ HPV vaccine ในผู้ชายพบว่าสามารถป้องกันการติดเชื้อ HPV ที่ทำให้เกิดมะเร็งที่องคชาติ มะเร็งทวารหนัก รวมถึงมะเร็งช่องปากและลำคอได้ (22) โดยแนะนำให้ฉีดในผู้ชายอายุ 9-26 ปี แต่ยังไม่มีการศึกษาถึงการให้ HPV vaccine ในกลุ่มที่เป็น MtF
- ปัจจุบันการทำ vaginal Pap smear ยังไม่มีการศึกษาและกล่าวถึงในผู้ป่วยกลุ่มนี้ (23)
3. อาการทางระบบทางเดินปัสสาวะ
- ท่อปัสสาวะอักเสบ (urethritis) พบได้บ่อยเนื่องจากในกระบวนการผ่าตัดต้องมีการตัดท่อปัสสาวะให้สั้นลงและเปิดรูให้กว้างขึ้นเพื่อป้องกันการตีบตัน โดยเชื้อที่พบบ่อยได้แก่ Escherichia coli และ Ecterococcus fecalis ดังนั้นควรที่จะต้องทำการเพาะเชื้อก่อนให้การรักษาเสมอ
- urinary stress incontinence มีรายงานพบสูงถึงร้อยละ 16 (13) ซึ่งอาจเกิดจากขั้นตอนในการผ่าตัดแปลงเพศทำให้มีการบาดเจ็บต่อระบบประสาทบริเวณกระเพาะปัสสาวะ
4. ปัญหาเกี่ยวกับเพศสัมพันธ์ (2)
- แนะนำให้ใส่ถุงยางอนามัยทุกครั้งเวลามีเพศสัมพันธ์
- ช่องคลอดของกลุ่ม MtF จะมีน้ำหล่อลื่นน้อยกว่าช่องคลอดหญิงแท้ ทำให้มีโอกาสเกิดบาดแผลและการติดเชื้อได้ง่ายกว่าปกติ จึงแนะนำให้ใช้สารหล่อลื่นเวลามีเพศสัมพันธ์ เพื่อลดการเสียดสี
- กล้ามเนื้อช่องคลอดของกลุ่ม MtF จะมีความแข็งแรงมากกว่าหญิงแท้ และหากเป็นการทำช่องคลอดแบบ penile inversion จะเกิดการตีบตันได้ง่าย หากยังไม่มีเพศสัมพันธ์ควรใช้อุปกรณ์ขยายช่องคลอดเป็นประจำ โดยทำวันละ 2 ครั้ง ครั้งละ 30 นาที
- แกนช่องคลอดของกลุ่ม MtF จะมีความลาดลงมากกว่าหญิงแท้ ดังนั้นเวลามีเพศสัมพันธ์แบบสอดใส่ต้องระวังเวลาสอดใส่องคชาติ เพราะจะมีอาการเจ็บได้
5. ภาวะผิดปกติทางmetabolism (9)
- การใช้ฮอร์โมนเอสโตรเจนเป็นระยะเวลานานจะกระตุ้นให้มีการเจริญของ visceral fat มากขึ้น กระตุ้นให้เกิดภาวะinsulin resistance เพิ่มระดับtriglyceride ส่งผลให้การทำงานของตับเสียไป และทำให้เพิ่มความดันโลหิตได้ ดังนั้นเพื่อลดการเกิดภาวะดังกล่าว จึงแนะนำดังนี้
- ให้ใช้ฮอร์โมนเอสโตรเจนแบบรับประทานในขนาดที่ต่ำที่สุดหรือใช้แบบแผ่นแปะผิวหนังแทน
- หากอายุมากกว่า 18 ปี แนะนำให้วัดความดันโลหิตเป็นประจำทุกปี ควบคุมความดันโลหิตให้ไม่เกิน 135/80 มิลลิเมตรปรอท
- หากผู้ป่วยอายุมากกว่า 20 ปี แนะนำให้ตรวจระดับไขมันในเลือดเป็นประจำทุกปี
- หากผู้ป่วยทำการผ่าตัดแปลงเพศแล้ว หลังผ่าแนะนำให้ใช้ฮอร์โมนเอสโตรเจนต่อเพื่อลดความเสี่ยงในการเกิดภาวะมวลกระดูกลดลงและกระดูกพรุน นอกจากนี้ยังแนะนำให้รับประทานวิตามินดีและแคลเซียมเสริม ในกรณีที่ผู้ป่วยไม่ได้ใช้ฮอร์โมนเอสโตรเจนต่อหรือมีอายุมากกว่า 65 ปี ควรตรวจมวลกระดูกทุก10ปี (9)
6. ภาวะลิ่มเลือดอุดตัน พบได้ร้อยละ 0.4-2.6 ต่อปี (24) โดยส่วนใหญ่มักเกิดจากการใช้ฮอร์โมนเอสโตรเจนในขนาดที่สูง โดยเฉพาะการใช้ ethinyl estradiol ดังนั้นควรค่อยๆลดขนาดของฮอร์โมนให้เหลือน้อยที่สุดหรือเปลี่ยนเป็นชนิดที่มีฮอร์โมนเอสโตรเจนต่ำหรือเปลี่ยน เป็นแบบแผ่นแปะผิวหนัง
7. การเกิดมะเร็ง
- มะเร็งต่อมลูกหมาก มีโอกาสเกิดเท่ากับประชากรชายปกติเนื่องจากไม่ได้ทำการตัดออกด้วยขณะทำการแปลงเพศ ดังนั้นผู้ป่วยที่มีอายุมากกว่า 50 ปีควรตรวจต่อมลูกหมากทางทวารหนักเป็นประจำทุกปี (25) สำหรับการเจาะเลือดเพื่อตรวจค่า prostatic- specific antigen (PSA) ไม่แนะนำเนื่องจากผู้ป่วยกลุ่มนี้มักใช้ฮอร์โมนเอสโตรเจนดังนั้นค่าที่ได้อาจต่ำกว่าความเป็นจริง (26)
- มะเร็งเต้านม ยังไม่มีข้อสรุปถึงอัตราการเกิดชัดเจนในผู้ป่วยกลุ่มนี้ แต่หากอายุมากกว่า 40ปี ก็แนะนำให้ตรวจ mammogram ทุก 1 ปีเช่นเดียวกับหญิงปกติ
- มะเร็งลำไส้ใหญ่ ในผู้ป่วยที่ผ่าตัดแปลงเพศด้วยวิธี sigmoid colon inversion หากมีข้อบ่งชี้ในการทำ sigmoidoscopy หรือ colonoscopy ให้ทำ vaginoscopy ด้วย
สรุป
ปัจจุบันเรื่องของการแปลงเพศนั้นพบได้ทั่วไปในสังคมปัจจุบัน และการดูแลผู้ป่วยกลุ่มนี้ต้องอาศัยแพทย์หลากหลายสาขาวิชาชีพในการดูแลผู้ป่วย ซึ่งจิตแพทย์จะมีบทบาทสำคัญที่สุดโดยเฉพาะการประเมินผู้ป่วยในขั้นตอนแรก ส่วนเราในฐานะสูตินรีแพทย์ที่จะต้องมีโอกาสให้การดูแลรักษาผู้ป่วยในกลุ่มนี้มากขึ้นก็ควรที่จะต้องมีความรู้ความเข้าใจในขั้นตอนของการรักษาต่างๆ รวมทั้งให้ความเคารพในความเป็นมนุษย์ของผู้ป่วย ตลอดจนเข้าใจถึงจิตใจของผู้ป่วยเพื่อให้บุคคลข้ามเพศเหล่านี้สามารถดำรงชีวิตอยู่ได้อย่างมีความสุข มีสิทธิเท่าเทียมและความเสมอเทียบเท่ากับอื่นๆในสังคม
เอกสารอ้างอิง
- สุริยสาร บ. อัตลักษณ์และวิถีทางเพศในประเทศไทย; องค์การแรงงานระหว่างประเทศ ประจำประเทศไทย กัมพชูา และ สาธารณรัฐประชาธิปไตยประชาชนลาว. โครงการส่งเสริมสิทธิ ความหลากหลาย และความเท่าเทียมในโลกของ การทำงาน (PRIDE) – กรุงเทพฯ : องค์การแรงงานระหว่างประเทศ, 2557.
- กมุทมาศ รนอ. นรีเวชวิทยาในหญิงที่่เปลี่ยนเพศจากชาย Female transsexual gynecology. 2555.
- Reisner SL, Conron KJ, Tardiff LA, Jarvi S, Gordon AR, Austin SB. Monitoring the health of transgender and other gender minority populations: validity of natal sex and gender identity survey items in a U.S. national cohort of young adults. BMC public health. 2014;14:1224.
- Saraswat A, Weinand JD, Safer JD. Evidence supporting the biologic nature of gender identity. Endocrine practice : official journal of the American College of Endocrinology and the American Association of Clinical Endocrinologists. 2015;21(2):199-204.
- Zhou JN, Hofman MA, Gooren LJ, Swaab DF. A sex difference in the human brain and its relation to transsexuality. Nature. 1995;378(6552):68-70.
- Kruijver FP, Zhou JN, Pool CW, Hofman MA, Gooren LJ, Swaab DF. Male-to-female transsexuals have female neuron numbers in a limbic nucleus. The Journal of clinical endocrinology and metabolism. 2000;85(5):2034-41.
- Sigmund Freud. Stage of Psychosexual Development. 1856 – 1938.
- Cohen-Kettenis PT, Pfafflin F. The DSM diagnostic criteria for gender identity disorder in adolescents and adults. Archives of sexual behavior. 2010;39(2):499-513.
- Unger CA. Care of the transgender patient: the role of the gynecologist. American journal of obstetrics and gynecology. 2014;210(1):16-26.
- ศ.พญ วบ. แนวทางปฏิบัติสำหรับจิตแพทย์ในการช่วยเหลือผู้ที่มีปัญหาเอกลักษณ์ทางเพศ 2552 ราชวิทยาลัยจิตแพทย์แห่งประเทศไทย (18 กันยายน 2552) (Clinical Practice Guideline in Management of Gender Dysphoria and Transsexualism 2009) 2552.
- Hembree WC, Cohen-Kettenis P, Delemarre-van de Waal HA, Gooren LJ, Meyer WJ, 3rd, Spack NP, et al. Endocrine treatment of transsexual persons: an Endocrine Society clinical practice guideline. The Journal of clinical endocrinology and metabolism. 2009;94(9):3132-54.
- Perovic S, Djinovic R. Genitoplasty in male-to-female transsexuals. Current opinion in urology. 2009;19(6):571-6.
- Masters WH, Johnson VE. The artificial vagina: anatomic, physiologic, psychosexual function. Western journal of surgery, obstetrics, and gynecology. 1961;69:192-212.
- Guadamuz TE, Wimonsate W, Varangrat A, Phanuphak P, Jommaroeng R, McNicholl JM, et al. HIV prevalence, risk behavior, hormone use and surgical history among transgender persons in Thailand. AIDS and behavior. 2011;15(3):650-8.
- Garofalo R, Deleon J, Osmer E, Doll M, Harper GW. Overlooked, misunderstood and at-risk: exploring the lives and HIV risk of ethnic minority male-to-female transgender youth. The Journal of adolescent health : official publication of the Society for Adolescent Medicine. 2006;38(3):230-6.
- Williamson C. Providing care to transgender persons: a clinical approach to primary care, hormones, and HIV management. The Journal of the Association of Nurses in AIDS Care : JANAC. 2010;21(3):221-9.
- Fernandes HM, Manolitsas TP, Jobling TW. Carcinoma of the neovagina after male-to-female reassignment. Journal of lower genital tract disease. 2014;18(2):E43-5.
- Jin B, Turner L, Walters WA, Handelsman DJ. The effects of chronic high dose androgen or estrogen treatment on the human prostate [corrected]. The Journal of clinical endocrinology and metabolism. 1996;81(12):4290-5.
- Sutcliffe PA, Dixon S, Akehurst RL, Wilkinson A, Shippam A, White S, et al. Evaluation of surgical procedures for sex reassignment: a systematic review. Journal of plastic, reconstructive & aesthetic surgery : JPRAS. 2009;62(3):294-306; discussion -8.
- Weyers S, Verstraelen H, Gerris J, Monstrey S, Santiago Gdos S, Saerens B, et al. Microflora of the penile skin-lined neovagina of transsexual women. BMC microbiology. 2009;9:102.
- Meltzer MC, Desmond RA, Schwebke JR. Association of Mobiluncus curtisii with recurrence of bacterial vaginosis. Sexually transmitted diseases. 2008;35(6):611-3.
- Gillison ML, Chaturvedi AK, Lowy DR. HPV prophylactic vaccines and the potential prevention of noncervical cancers in both men and women. Cancer. 2008;113(10 Suppl):3036-46.
- Oon SF, Hanly A, Winter DC. Pap smears for men: a vision of the future? Irish journal of medical science. 2010;179(3):459-62.
- van Kesteren PJ, Asscheman H, Megens JA, Gooren LJ. Mortality and morbidity in transsexual subjects treated with cross-sex hormones. Clinical endocrinology. 1997;47(3):337-42.
- Lipworth L, Tarone RE, Friis S, Ye W, Olsen JH, Nyren O, et al. Cancer among Scandinavian women with cosmetic breast implants: a pooled long-term follow-up study. International journal of cancer. 2009;124(2):490-3.
- Epstein JI. PSA and PAP as immunohistochemical markers in prostate cancer. The Urologic clinics of North America. 1993;20(4):757-70.