Update in Management of Abnormal Cervical Cancer Screening Tests
Update in Management of
Abnormal Cervical Cancer Screening Tests
พญ.มนฤดี เตชะอินทร์
อาจารย์ที่ปรึกษา: ผศ.นพ.ฉลอง ชีวเกรียงไกร
บทนำ
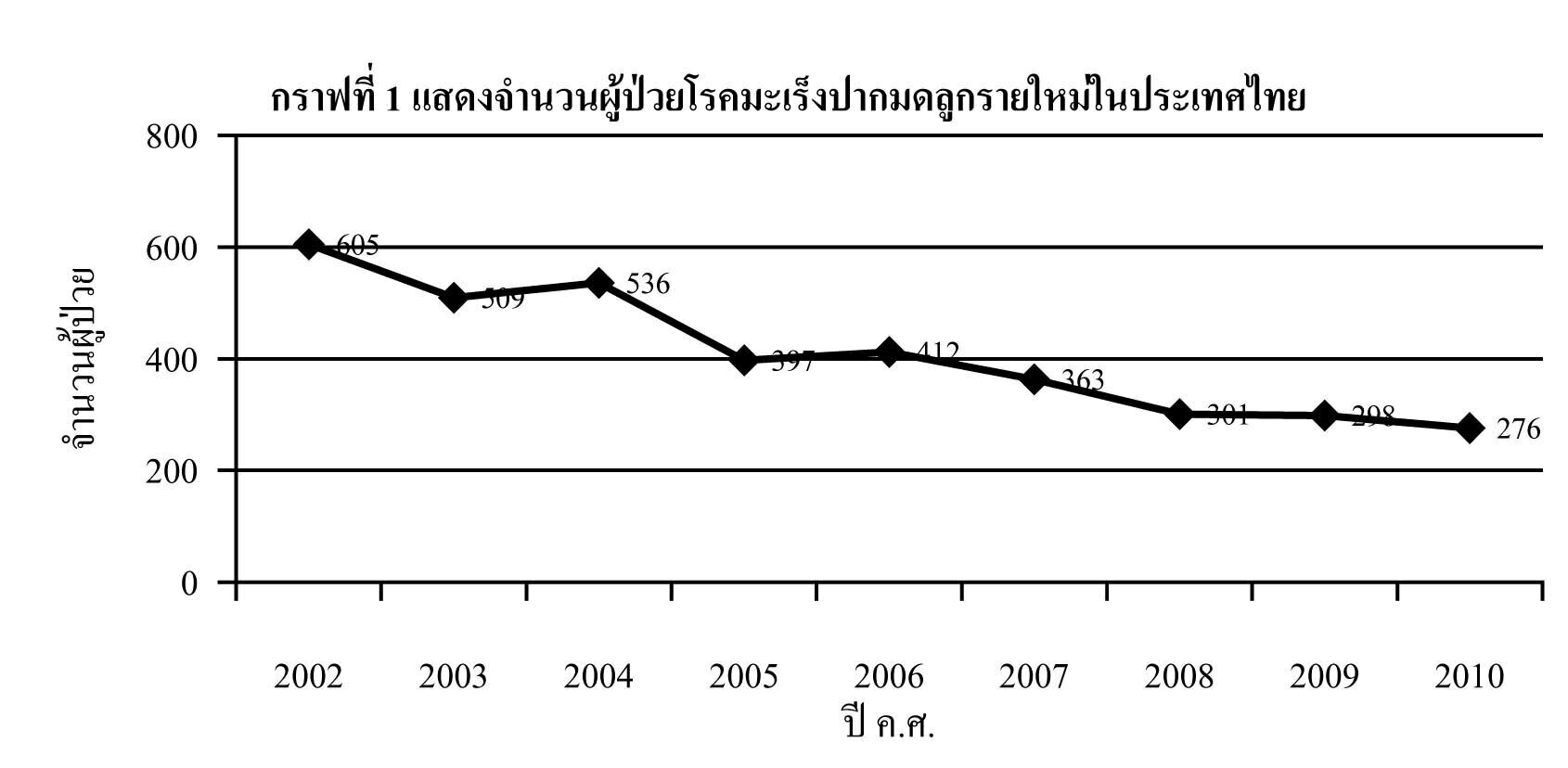
มะเร็งปากมดลูก เป็นมะเร็งที่พบมากเป็นอับดับสองในสตรีไทย โดยมีแนวโน้มอัตราของผู้ป่วยรายใหม่ในแต่ละปีลดลงอย่างต่อเนื่อง1 อันเป็นผลจากการรณรงค์ของกระทรวงสาธารณสุขที่ให้สตรีไทยที่มีอายุมากกว่า 35 ปี ขึ้นไป รับการตรวจคัดกรองมะเร็งปากมดลูกทุกระยะ 5 ปี2
สิ่งสำคัญประการหนึ่งคือ การดูแลผู้ป่วยที่มีผลการคัดกรองผิดปกติอย่างถูกต้อง เพื่อค้นหาพยาธิสภาพระยะก่อนลุกลาม และให้การรักษาอย่างเหมาะสมต่อไป
ความผิดปกติทางเซลล์วิทยาของเยื่อบุปากมดลูก
ในการตรวจคัดกรองมะเร็งปากมดลูก จะรายงานผลตาม The 2001 Bethesda System ซึ่งได้ถูกพัฒนาขึ้นเพื่อให้มีแนวทางในการดูแลรักษาเยื่อบุปากมดลูกผิดปกติที่ชัดเจนต่อไป3 การรายงานผลจะประกอบด้วยส่วนหลักๆ ได้แก่ Specimen Adequacy ซึ่งจะรายงานเป็น satisfactory หรือ unsatisfactory for evaluation และ Interpretation แบ่งเป็น Negative for Intraepithelial Lesion of Malignancy กับ Epithelial Cell Abnormalities ในที่นี้จะขอกล่าวรายละเอียดเฉพาะลักษณะเซลล์เยื่อบุปากมดลูกที่ผิดปกติเท่านั้น ความผิดปกติแบ่งได้เป็น
- Squamous cell
1.1. Atypical squamous cells (ASC)
1.1.1. of undetermined significance (ASC-US)
1.1.2. cannot exclude HSIL (ASC-H)
1.2. Low-grade squamous intraepithelial lesion (LSIL) ได้แก่ human papillomavirus (HPV) infection และ mild dysplasia หรือ cervical intraepithelial neoplasia (CIN) 1
1.3. High-grade squamous intraepithelial lesion (HSIL) ได้แก่ moderate dysplasia, severe dysplasia และ carcinoma in situ หรือ CIN 2 และ CIN 3
1.4. Squamous cell carcinoma
- Glandular cell
2.1. Atypical glandular cells (AGC) โดยให้ระบุว่าเป็น endocervical, endometrial หรือ not otherwise specified (AGC-NOS)
2.2. Atypical glandular cells, favor neoplastic (AGC-FN) ให้ระบุว่าเป็น endocervical หรือ not otherwise specified
2.3. Endocervical adenocarcinoma in situ (AIS)
2.4. Adenocarcinoma
การดูแลรักษาสตรีที่มีผลเซลล์วิทยาผิดปกติ
ในปี 2006 สมาคมผู้เชี่ยวชาญ และองค์กรระดับนานาชาติต่างๆ ได้มีการประชุมเพื่อหาข้อตกลงร่วมกัน ในการปรับปรุงแนวทางการรักษาสตรีที่มีผลการคัดกรองมะเร็งปากมดลูกผิดปกติ4 โดยการนำของ the American Society for Colposcopy and Cervical Pathology (ASCCP) ซึ่งได้แก้ไขจากแนวทางเดิมในปี 20015 โดยอาศัยข้อมูลจากงานวิจัยที่ตีพิมพ์หลังปี 2000 รวมถึงการศึกษา ASCUS/LSIL Triage Study (ALTS)6,7 และจากการใช้ HPV DNA testing ร่วมในการคัดกรองที่เพิ่มมากขึ้น โดยแยกตามผลเซลล์วิทยาที่ผิดปกติได้ ดังนี้
Atypical squamous cells (ASC)
แบ่งออกได้เป็น atypical squamous cells of undetermined significance (ASC-US) และ atypical squamous cells, cannot exclude HSIL (ASC-H) โดยมีปัจจัยหลายๆ อย่างที่ต้องคำนึงถึง ในการดูแลสตรีที่มีผลเซลล์วิทยา ASC กล่าวคือ ASC เป็นความผิดปกติของเซลล์วิทยาที่มีความรุนแรงน้อยที่สุด8-10 โดยมีอุบัติการณ์ในการกลายเป็นมะเร็งระยะลุกลามเพียง 0.1-0.2%11,12 ซึ่งโอกาสที่จะพบรอยโรค CIN 2,3 มีประมาณ 5-17% โดยพบในสตรีที่มีผลเซลล์วิทยา ASC-H 24-94% ซึ่งมากกว่าสตรีที่มีผลเซลล์วิทยา ASC-US13-16 ด้วยเหตุนี้จึงควรให้ความสำคัญต่อผลเซลล์วิทยา ASC-H เทียบเท่ากับ HSIL
ข้อมูลจาก ALTS และการศึกษาอื่นๆ ได้แสดงให้เห็นว่า การตรวจด้วยคอลโปสโคป 1 ครั้ง ร่วมกับการตรวจหาเชื้อ HPV ที่ 12 เดือน และการตรวจทางเซลล์วิทยาทุก 6 เดือน 2 ครั้ง มีความปลอดภัยและมีประสิทธิภาพเพียงพอในการดูแลสตรีที่มีผลเซลล์วิทยา ASC-US17-19
การเก็บเซลล์ตัวอย่างในของเหลวเพื่อตรวจทางเซลล์วิทยา (liquid-based cytology) แล้วนำสิ่งส่งตรวจดังกล่าวมาตรวจหาเชื้อ HPV ภายหลังได้โดยไม่ต้องเรียกผู้ป่วยมาตรวจซ้ำอีก เรียกว่า “Reflex HPV DNA testing” วิธีการนี้ช่วยลดความจำเป็นของผู้ป่วยที่จะต้องเข้ารับการตรวจซ้ำ และลดจำนวนผู้ป่วยที่ต้องได้รับการตรวจด้วยคอลโปสโคปได้ 40-60%20,21
ในสตรีที่มีผลเซลล์วิทยาเป็น ASC-US พบว่า มีอุบัติการณ์การพบเชื้อ HPV แตกต่างกันตามอายุ โดยจะพบมากในหญิงอายุน้อย15,22,23 แต่เป็นกลุ่มที่มีความเสี่ยงต่ำที่จะกลายเป็นมะเร็ง จึงแนะนำให้ทำการตรวจหาเชื้อ HPV เฉพาะในกลุ่มสตรีที่มีอายุมากขึ้นเท่านั้น23,33 สำหรับในกลุ่มสตรีที่ติดเชื้อ HIV และมีผลเซลล์วิทยา ASC-US เคยมีการแนะนำให้ทำการตรวจด้วยคอลโปสโคปในผู้ป่วยกลุ่มนี้ทุกรายเนื่องจากพบอุบัติการณ์ของการติดเชื้อ HPV และรอยโรคขั้นสูงได้มากในผู้ป่วยกลุ่มนี้ แต่จากการศึกษาล่าสุดพบอุบัติการณ์ของรอยโรคขั้นสูงและการติดเชื้อ HPV ที่ลดลง จึงแนะนำให้ทำการรักษาสตรีที่มีภูมิคุ้มกันต่ำเช่นเดียวกับสตรีทั่วไป24,25 และสำหรับหญิงตั้งครรภ์ที่มีผลเซลล์วิทยา ASC-US พบว่ามีความเสี่ยงต่ำที่จะกลายเป็นมะเร็ง จึงไม่แนะนำให้ทำการตรวจด้วยคอลโปสโคปในช่วงก่อนคลอด26
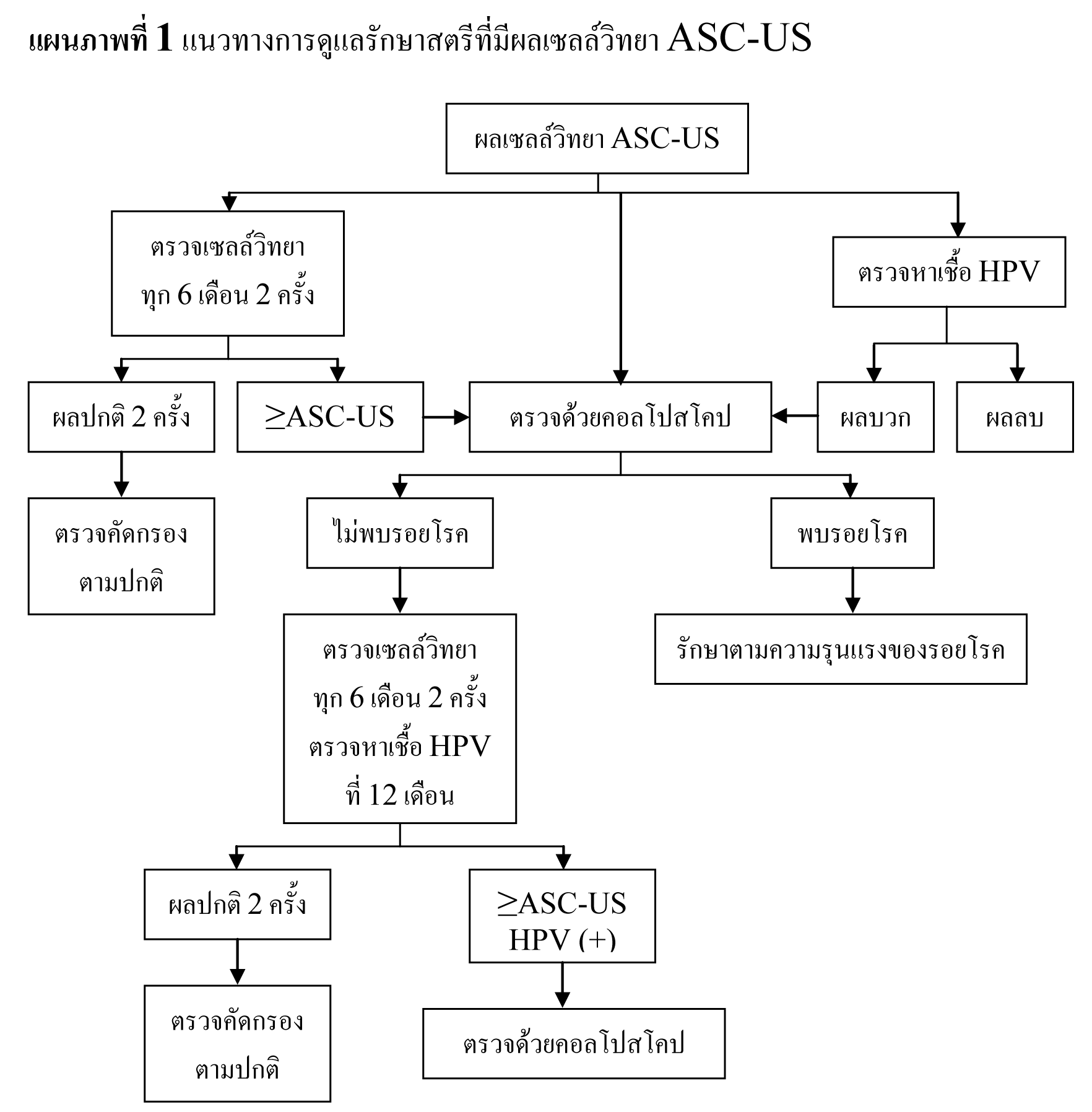
แนวทางการดูแลรักษาสตรีที่มีผลเซลล์วิทยา ASC-US
สามารถทำได้ 3 แนวทาง คือ
- การตรวจติดตามด้วยการตรวจเซลล์วิทยาทุก 6 เดือน 2 ครั้ง
- oหากผลตรวจติดตามพบเซลล์ผิดปกติตั้งแต่ ASC-US ขึ้นไป ให้รับการตรวจด้วยคอลโปสโคป
- oหากผลตรวจติดตามเป็นปกติ 2 ครั้งติดต่อกัน สามารถตรวจคัดกรองได้ตามปกติ
- การตรวจหาเชื้อ HPV
- oสตรีที่มีผลตรวจ HPV DNA negative ให้รับการตรวจทางเซลล์วิทยาซ้ำที่ 12 เดือน
- oสตรีที่มีผลตรวจ HPV DNA positive ให้รับการดูแลเช่นเดียวกับสตรีที่มีผลเซลล์วิทยา LSIL และให้รับการตรวจด้วยคอลโปสโคป
- การตรวจด้วยคอลโปสโคป
- oการเก็บตัวอย่างเยื่อบุปากมดลูกด้านใน แนะนำในสตรีที่ไม่พบรอยโรคหรือผลการตรวจไม่เป็นที่น่าพอใจจากการตรวจด้วยคอลโปสโคป แต่ก็สามารถทำได้ในกลุ่มที่เห็นรอยโรคอยู่ภายใน transformation zone และการตรวจด้วยคอลโปสโคปเป็นที่น่าพอใจ
- oในรายที่ผลการตรวจด้วยคอลโปสโคปไม่พบ CIN สามารถตรวจติดตามด้วยการตรวจเซลล์วิทยาทุก 6 เดือน 2 ครั้ง และตรวจหาเชื้อ HPV ที่ 12 เดือน
- หากผลตรวจติดตามพบเซลล์ผิดปกติตั้งแต่ ASC-US ขึ้นไป ให้รับการตรวจด้วยคอลโปสโคป
- หากผลตรวจติดตามเป็นปกติ 2 ครั้งติดต่อกัน สามารถตรวจคัดกรองได้ตามปกติ
- oในรายที่ตรวจพบรอยโรค CIN ให้รับการดูแลรักษาตาม 2006 Consensus Guidelines for the Management of Cervical Intraepithelial Neoplasia ต่อไป
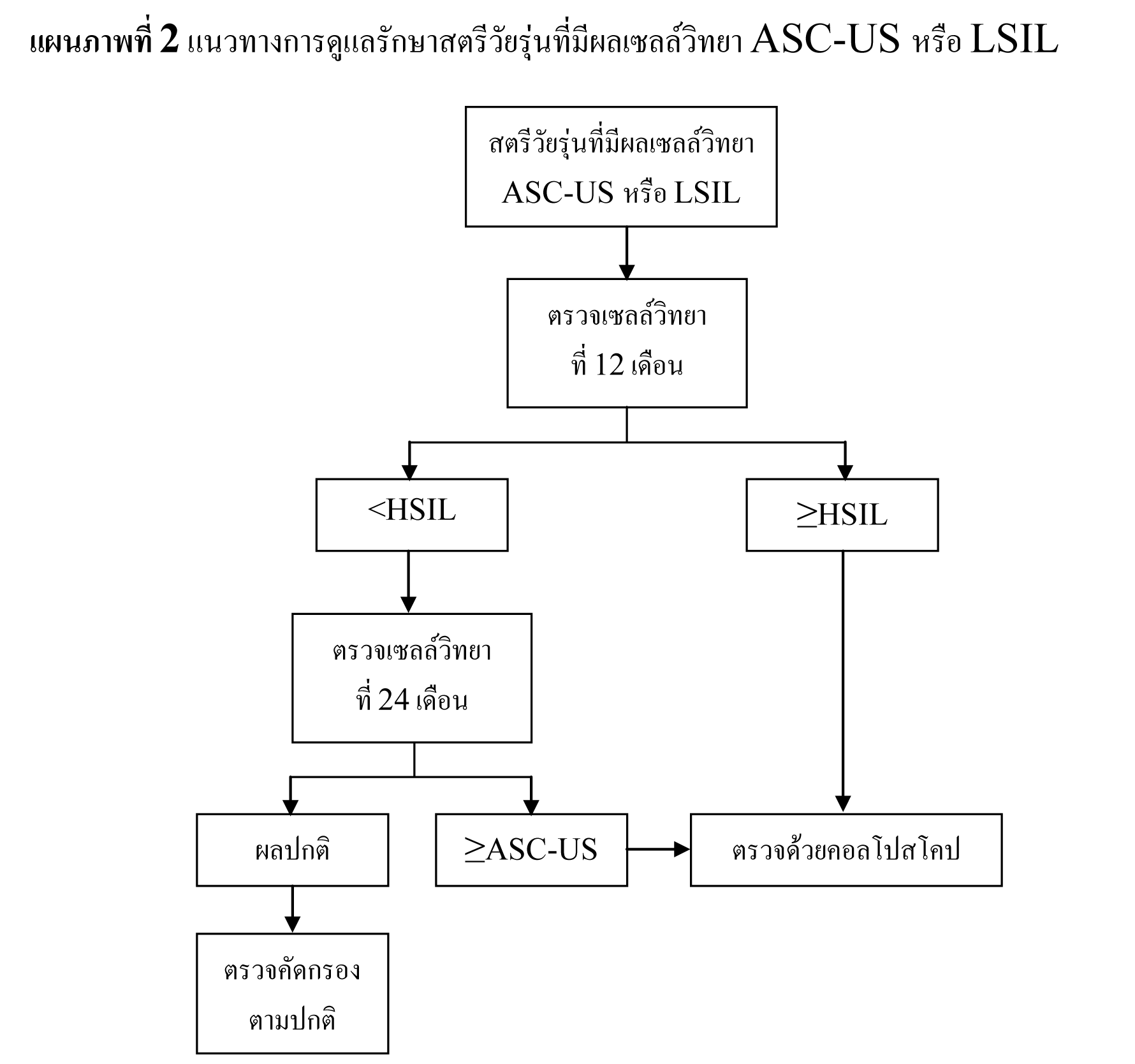
แนวทางการดูแลรักษาสตรีวัยรุ่นที่มีผลเซลล์วิทยา ASC-US
- ตรวจติดตามด้วยเซลล์วิทยาทุกปี
- oหากผลการตรวจติดตามที่ 12 เดือน เป็น HSIL หรือผิดปกติมากกว่า ให้ทำการตรวจด้วยคอลโปสโคปี
- oหากผลการตรวจติดตามที่ 24 เดือน เป็น ASC-US หรือผิดปกติมากกว่า ให้ทำการตรวจด้วยคอลโปสโคปี
แนวทางการดูแลรักษาสตรีติดเชื้อ HIV และสตรีวัยหมดประจำเดือนที่มีผลเซลล์วิทยา ASC-US
- ให้ทำการดูแลรักษาสตรีกลุ่มนี้เช่นเดียวกับสตรีทั่วไป
แนวทางการดูแลรักษาสตรีตั้งครรภ์ที่มีผลเซลล์วิทยา ASC-US
- ในหญิงตั้งครรภ์ที่มีอายุมากกว่า 20 ปี ให้ทำการดูแลรักษาเช่นเดียวกับสตรีที่ไม่ได้ตั้งครรภ์ แต่สามารถยืดระยะเวลาการตรวจด้วยคอลโปสโคลปีจนกระทั่ง 6 สัปดาห์หลังคลอดได้
- หลีกเลี่ยงการทำ endocervical curettage ในสตรีตั้งครรภ์
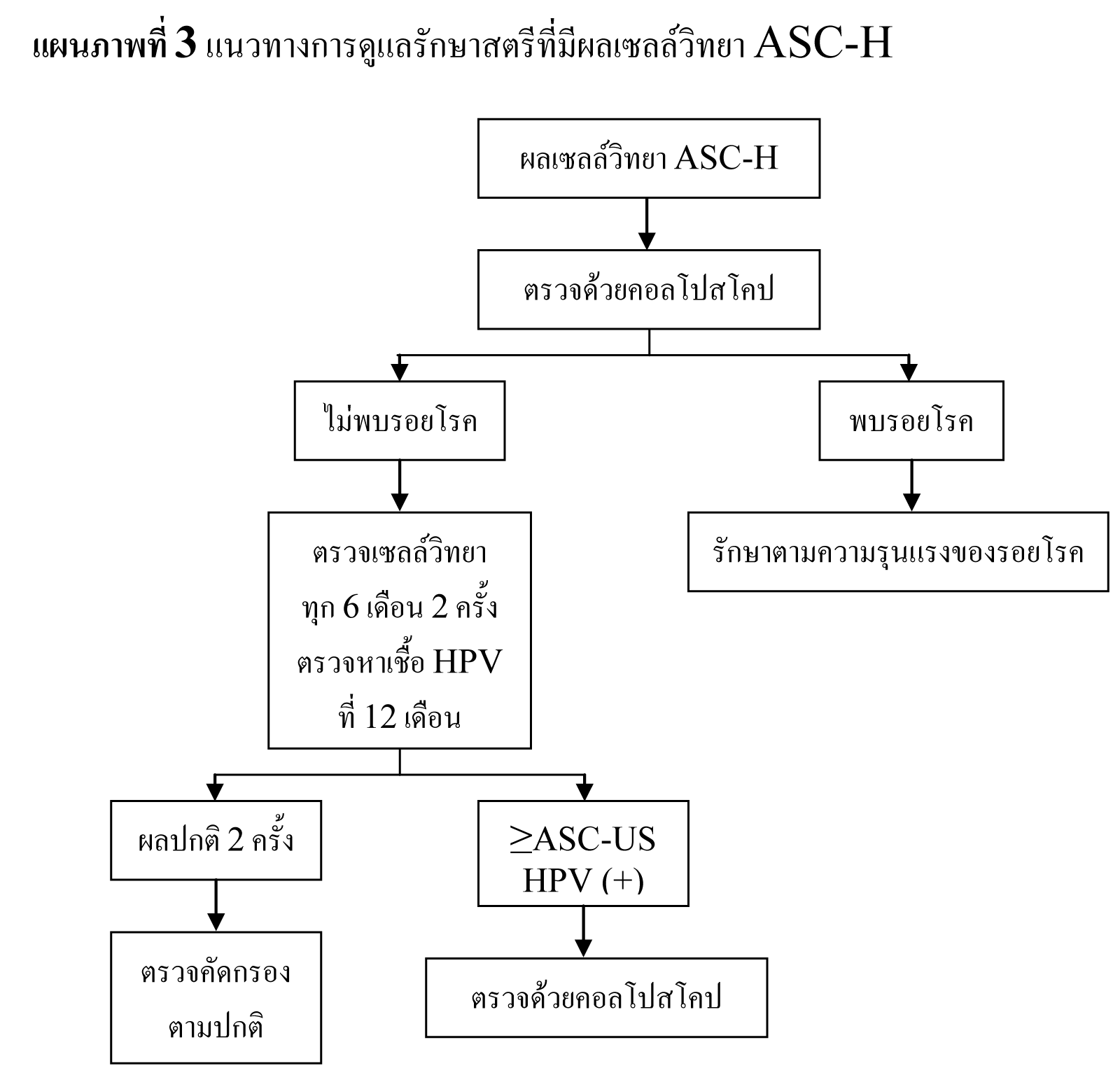
แนวทางการดูแลรักษาสตรีที่ผลเซลล์วิทยา ASC-H
- ให้ทำการตรวจด้วยคอลโปสโคป
- หากไม่พบรอยโรค CIN 2,3 ให้ตรวจติดตามด้วยการตรวจเซลล์วิทยาทุก 6 เดือน 2 ครั้ง และตรวจหาเชื้อ HPV ที่ 12 เดือน
- oหากผลตรวจเซลล์วิทยาผิดปกติตั้งแต่ ASC-US ขึ้นไป หรือพบการติดเชื้อ HPV ให้ทำการตรวจด้วยคอลโปสโคปซ้ำ
- oหากผลตรวจเซลล์วิทยาปกติทั้งสองครั้ง และตรวจไม่พบการติดเชื้อ HPV สามารถตรวจคัดกรองได้ตามปกติ
Low-grade squamous intraepithelial lesion (LSIL)
ในช่วงทศวรรษที่ผ่านมา พบอุบัติการณ์ของ LSIL เพิ่มสูงขึ้น โดยในปี 2003 มีการรายงานผล LSIL จากการเก็บเซลล์ตัวอย่างในของเหลวเฉลี่ย 2.9%27 พบการติดเชื้อ high-risk HPV ในสตรีที่มีผลเซลล์วิทยา LSIL 76.6%28 และพบรอยโรคขั้นสูงจากการตรวจด้วยคอลโปสโคป 12-16%7,29,30 จากข้อมูลของ ALTS ความเสี่ยงของการพบรอยโรค CIN 2,3 ในสตรีที่มีผลเซลล์วิทยา LSIL มีพอๆ กับสตรีที่มีผลเซลล์วิทยา ASC-US ที่พบการติดเชื้อ high-risk HPV31 ดังนั้นจึงสนับสนุนให้ทำการดูแลรักษาสตรีทั้งสองกลุ่มไปในแนวทางเดียวกัน จากการศึกษาไปข้างหน้าในสตรีวัยรุ่นที่มีผลเซลล์วิทยา LSIL พบอัตราการกลับมาเป็นปกติได้สูง32 และพบว่าอุบัติการณ์การติดเชื้อ HPV และการพบรอยโรคขั้นสูงในสตรีที่มีผลเซลล์วิทยา LSIL ลดลงตามอายุ33,34
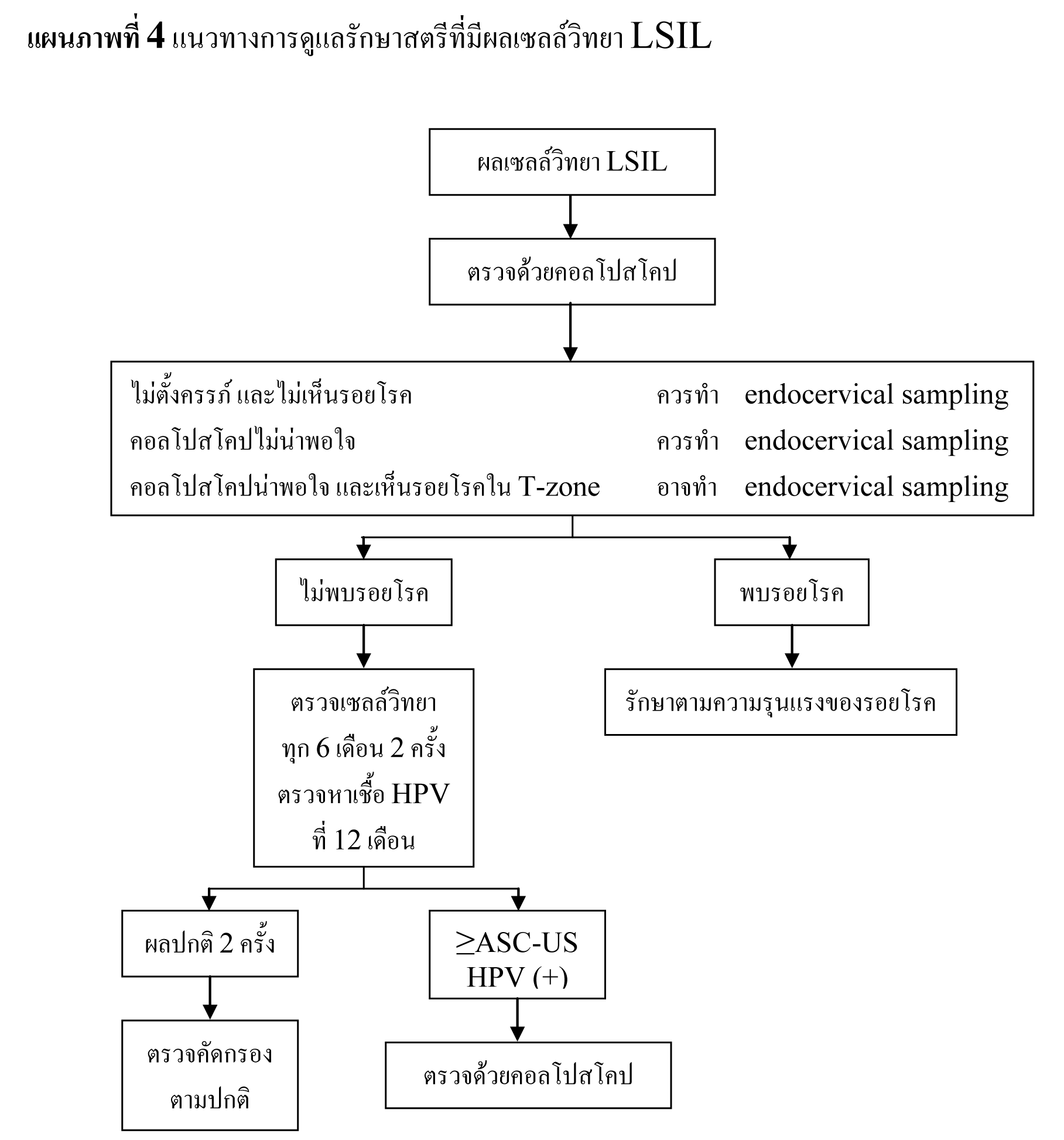
แนวทางการดูแลรักษาสตรีที่มีผลเซลล์วิทยา LSIL
- แนะนำให้ทำการตรวจด้วยคอลโปสโคปในสตรีที่มีผลเซลล์วิทยา LSIL (ยกเว้นในประชากรบางกลุ่ม ซึ่งจะได้กล่าวต่อไป)
- แนะนำให้ทำการเก็บตัวอย่างเยื่อบุปากมดลูกด้านในสำหรับสตรีที่ไม่ได้ตั้งครรภ์ และไม่เห็นรอยโรค หรือการตรวจด้วยคอลโปสโคปไม่เป็นที่น่าพอใจ แต่ก็สามารถทำได้ในกลุ่มที่เห็นรอยโรคอยู่ภายใน transformation zone และการตรวจด้วยคอลโปสโคปเป็นที่น่าพอใจ
- ในรายที่ผลการตรวจด้วยคอลโปสโคปไม่พบ CIN 2,3 ให้ทำการตรวจหาเชื้อ high-risk HPV ที่ 12 เดือน และตรวจทางเซลล์วิทยาทุก 6 เดือน 2 ครั้ง
- oหากไม่พบเชื้อ HPV หรือผลตรวจทางเซลล์วิทยาเป็นปกติ 2 ครั้งติดต่อกัน ให้ทำการตรวจคัดกรองได้ตามปกติ
- oหากพบเชื้อ HPV หรือผลตรวจทางเซลล์วิทยาเป็น ASC-US หรือรุนแรงกว่า ให้ทำการตรวจด้วยคอลโปสโคปอีกครั้ง
- ในรายที่ตรวจพบรอยโรค CIN ให้รับการดูแลรักษาตาม 2006 Consensus Guidelines for the Management of Cervical Intraepithelial Neoplasia ต่อไป
แนวทางการดูแลรักษาสตรีวัยรุ่นที่มีผลเซลล์วิทยา LSIL
- ตรวจติดตามด้วยเซลล์วิทยาทุกปี
- oหากผลการตรวจติดตามที่ 12 เดือน เป็น HSIL หรือผิดปกติมากกว่า ให้ทำการตรวจด้วยคอลโปสโคปี
- oหากผลการตรวจติดตามที่ 24 เดือน เป็น ASC-US หรือผิดปกติมากกว่า ให้ทำการตรวจด้วยคอลโปสโคปี
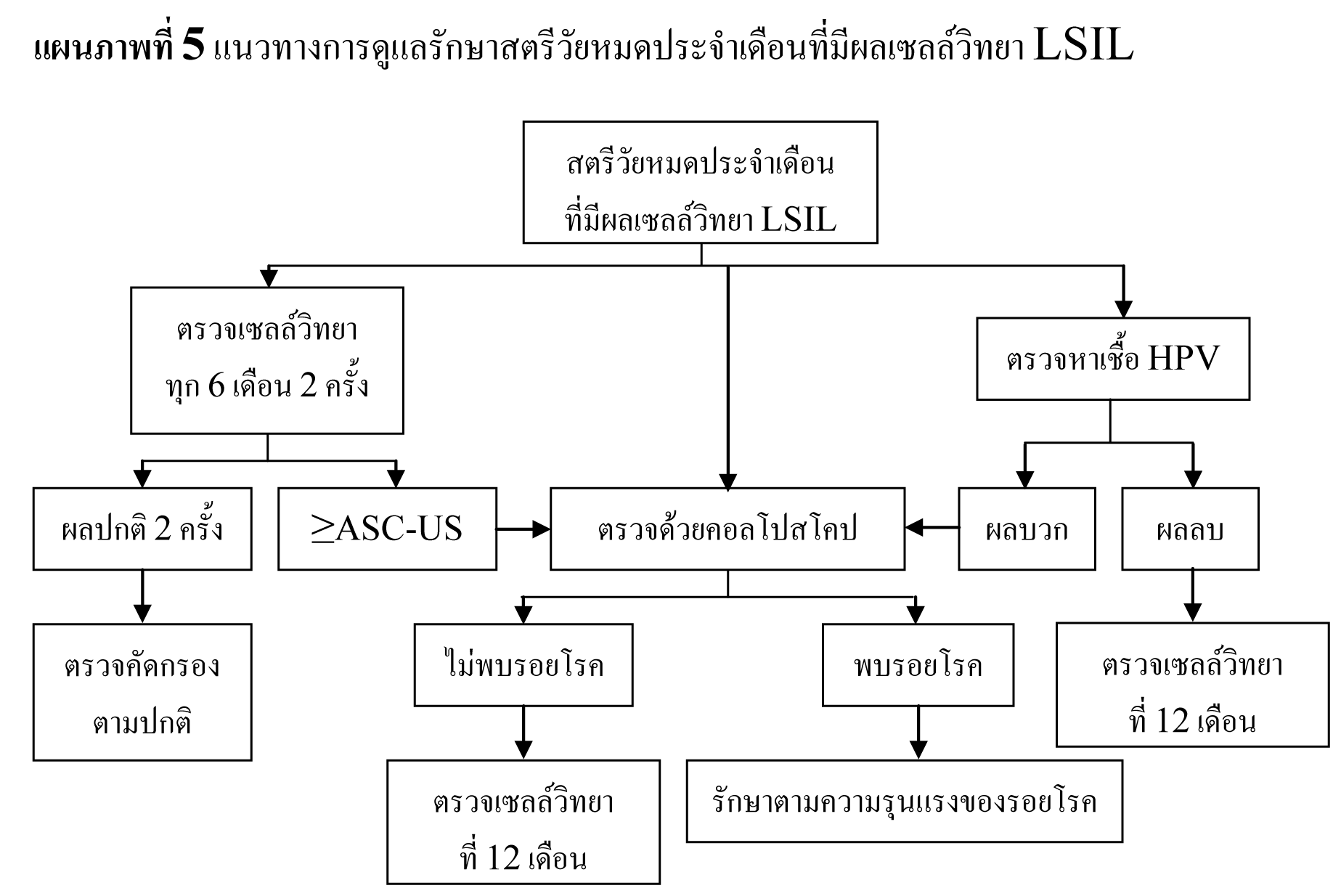
แนวทางการดูแลรักษาสตรีวัยหมดประจำเดือนที่มีผลเซลล์วิทยา LSIL
- ตรวจติดตามด้วยเซลล์วิทยาทุก 6 เดือน 2 ครั้ง ร่วมกับ Reflex HPV DNA testing
- oหากไม่พบการติดเชื้อ HPV หรือการตรวจด้วยคอลโปสโคปไม่พบ CIN ให้ทำการตรวจเซลล์วิทยาซ้ำที่ 12 เดือน
- oหากตรวจพบการติดเชื้อ HPV หรือผลเซลล์วิทยาผิดปกติตั้งแต่ ASC-US ขึ้นไป ให้ทำการตรวจด้วยคอลโปสโคปซ้ำ
- oหากผลเซลล์วิทยาเป็นปกติ 2 ครั้งติดต่อกัน สามารถทำการตรวจคัดกรองได้ตามปกติ
แนวทางการดูแลรักษาสตรีตั้งครรภ์ที่มีผลเซลล์วิทยา LSIL
- แนะนำให้ทำการตรวจด้วยคอลโปสโคปในสตรีตั้งครรภ์ที่ไม่ใช่วัยรุ่น
- หลีกเลี่ยงการทำ endocervical curettage ในสตรีตั้งครรภ์
- สามารถยืดระยะเวลาการตรวจด้วยคอลโปสโคลปจนกระทั่ง 6 สัปดาห์หลังคลอดได้
- หากตรวจด้วยคอลโปสโคปแล้วไม่พบรอยโรคขั้นสูง ให้ทำการตรวจติดตามหลังคลอดอีกครั้ง ไม่ควรทำการตรวจซ้ำในระหว่างการตั้งครรภ์
High-grade squamous intraepithelial lesion (HSIL)
พบอัตราการรายงานผลเซลล์วิทยา HSIL เฉลี่ย 0.7%27 โดยมีอัตราลดลงตามอายุ สตรีที่มีผลเซลล์วิทยา HSIL มีความเสี่ยงสูงที่จะมีพยาธิสภาพของปากมดลูก จากการตรวจด้วยคอลโปสโคปพบรอยโรคขั้นสูง 53-66% และจากการตัดปากมดลูกด้วยห่วงไฟฟ้าพบรอยโรคขั้นสูง 84-97%29,35,36 โดยประมาณ 2% ของสตรีที่มีผลเซลล์วิทยา HSIL จะพบว่าเป็นมะเร็งระยะลุกลาม37 เนื่องจากการตรวจด้วยคอลโปสโคปอาจไม่พบรอยโรคขั้นสูง จึงแนะนำให้ทำการวินิจฉัยด้วยการตัดปากมดลูกในสตรีที่มีผลเซลล์วิทยา HSIL36,38,39 แต่ในกลุ่มสตรีอายุน้อย รอยโรค CIN 2,3 สามารถหายได้เอง40,41
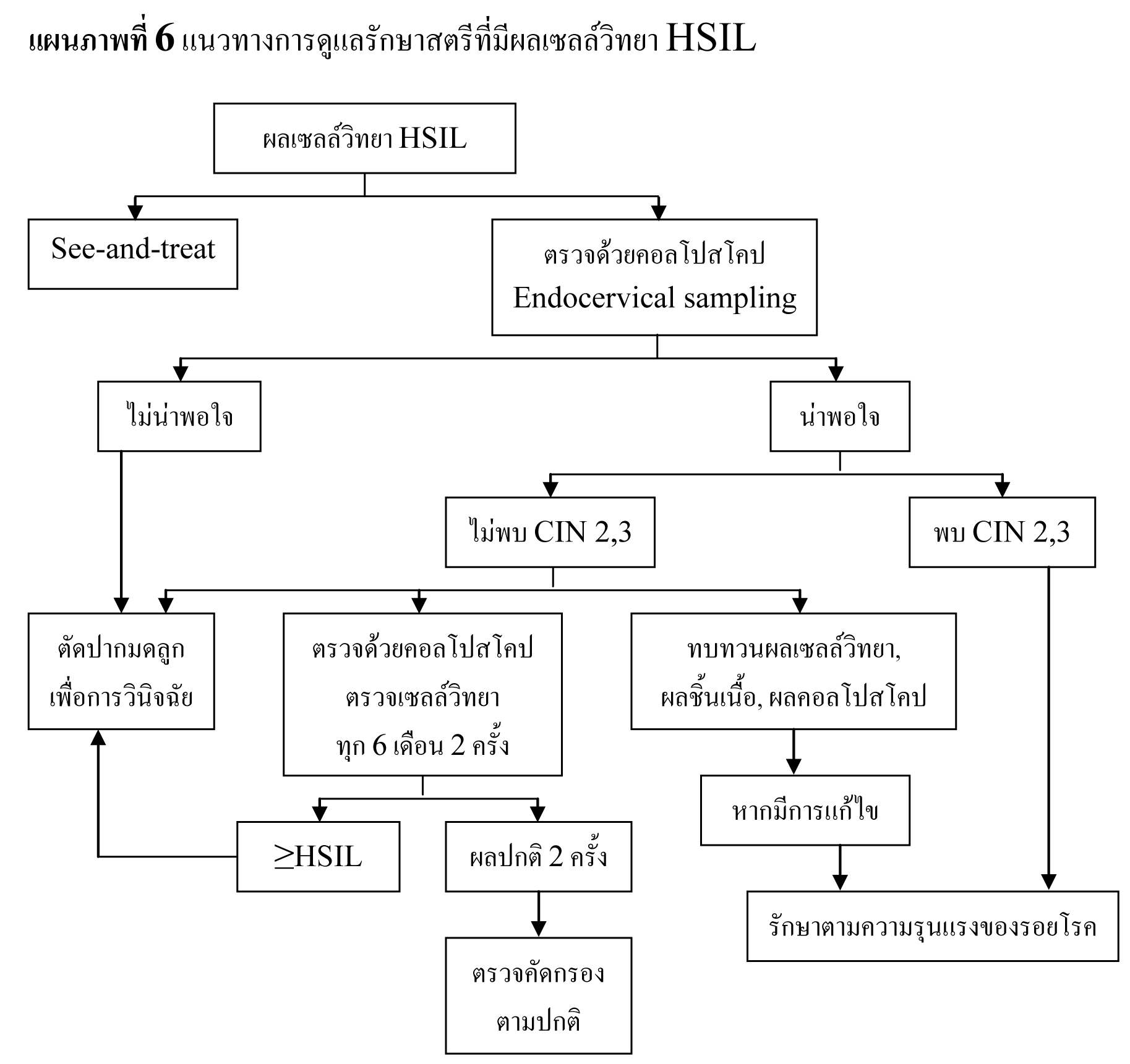
แนวทางการดูแลรักษาสตรีที่มีผลเซลล์วิทยา HSIL
- สามารถให้การรักษาด้วยทำการตัดปากมดลูกด้วยห่วงไฟฟ้าหลังการตรวจด้วยคอลโปสโคป (see-and-treat) หรือการตรวจด้วยคอลโปสโคปร่วมกับเก็บตัวอย่างเยื่อบุปากมดลูกด้านในได้ (ยกเว้นในประชากรบางกลุ่ม ซึ่งจะได้กล่าวต่อไป)
- หากการตรวจด้วยคอลโปสโคปเป็นที่น่าพอใจ และผลชิ้นเนื้อไม่พบ CIN 2,3 สามารถทำการดูแลรักษาต่อ ดังนี้
- oตัดปากมดลูกเพื่อการวินิจฉัย
- oตรวจด้วยคอลโปสโคปซ้ำร่วมกับตรวจเซลล์วิทยาทุก 6 เดือน 2 ครั้งได้
- หากทำการตรวจติดตามด้วยคอลโปสโคปร่วมกับตรวจเซลล์วิทยาแล้ว ยังคงพบ HSIL ให้ทำการตัดปากมดลูกเพื่อการวินิจฉัย
- หากทำการตรวจติดตามด้วยคอลโปสโคปร่วมกับตรวจเซลล์วิทยาแล้ว ผลเป็นปกติ สามารถทำการตรวจคัดกรองได้ตามปกติ
- oนำผลเซลล์วิทยา, ผลชิ้นเนื้อ และผลตรวจจากคอลโปสโคป มาพิจารณาอีกครั้ง หากมีการแก้ไขให้ดูแลรักษาตามผลการพิจารณาครั้งหลัง
- หากการตรวจด้วยคอลโปสโคปไม่เป็นที่น่าพอใจ ให้ทำการตัดปากมดลูกเพื่อการวินิจฉัย (ยกเว้นในประชากรบางกลุ่ม เช่น สตรีตั้งครรภ์)
- ในรายที่ตรวจพบรอยโรค CIN 2,3 ให้รับการดูแลรักษาตาม 2006 Consensus Guidelines for the Management of Cervical Intraepithelial Neoplasia ต่อไป
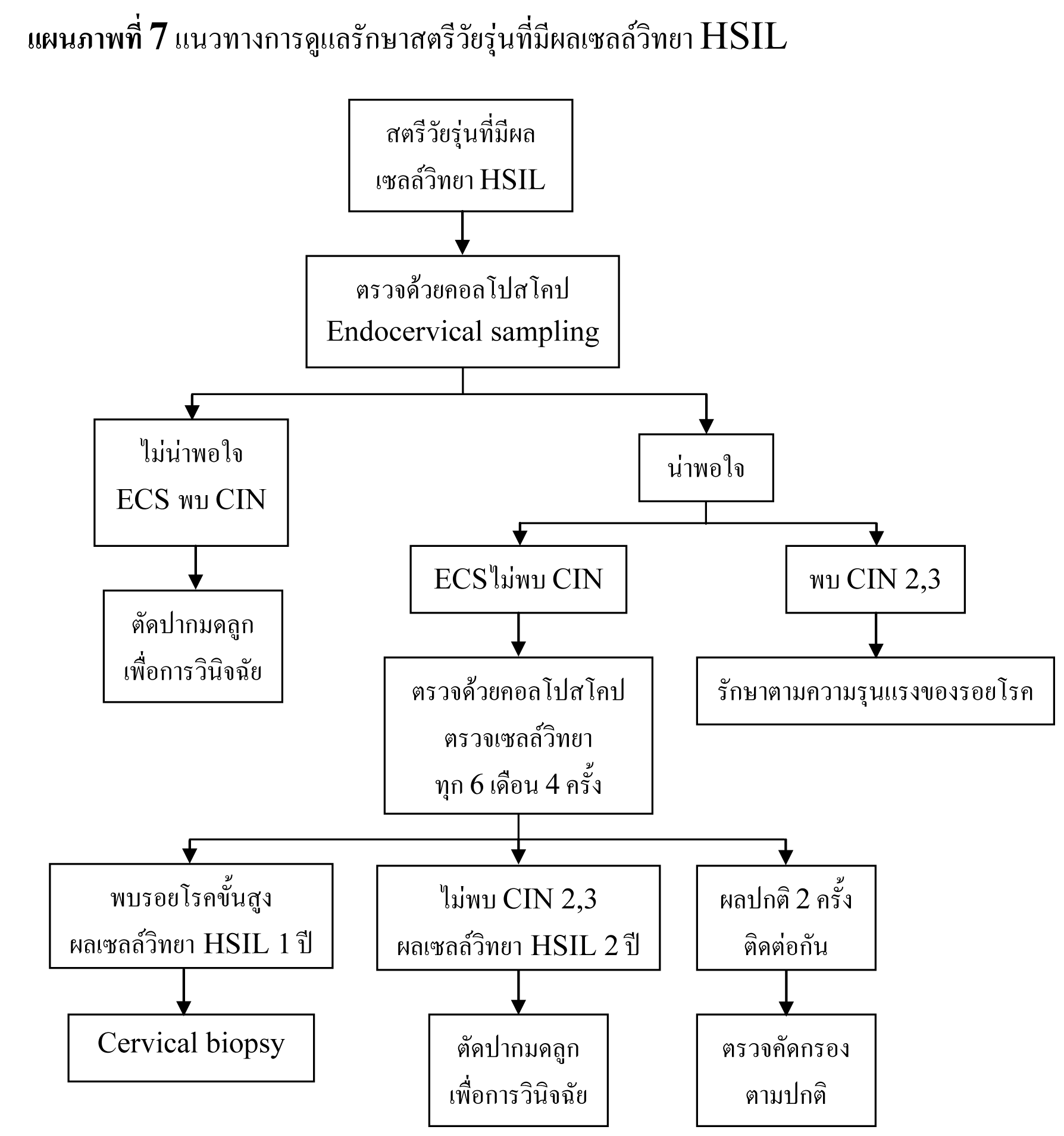
แนวทางการดูแลรักษาสตรีวัยรุ่นที่มีผลเซลล์วิทยา HSIL
- ให้ทำการตรวจด้วยคอลโปสโคปในสตรีวัยรุ่นที่มีผลเซลล์วิทยา HSIL
- ไม่แนะนำการตัดปากมดลูกด้วยห่วงไฟฟ้าในสตรีวัยรุ่นหลังจากการตรวจด้วยคอลโปสโคปในครั้งแรก (see-and-treat)
- หากการตรวจด้วยคอลโปสโคปเป็นที่น่าพอใจ และผลชิ้นเนื้อจากการเก็บตัวอย่างเยื่อบุปากมดลูกด้านในไม่พบความผิดปกติ ให้ทำการตรวจด้วยคอลโปสโคปซ้ำร่วมกับตรวจเซลล์วิทยาทุก 6 เดือน 4 ครั้งได้
- oหากระหว่างการตรวจติดตามพบรอยโรคขั้นสูง หรือผลเซลล์วิทยายังคงเป็น HSIL ในเวลา 1 ปี แนะนำให้ทำการตัดเนื้อเยื่อบางส่วนเพื่อตรวจวินิจฉัย
- oหากผลเซลล์วิทยายังคงเป็น HSIL เป็นเวลา 2 ปี โดยตรวจไม่พบพยาธิสภาพ CIN 2,3 แนะนำให้ทำการตัดปากมดลูกเพื่อการวินิจฉัย
- oหากผลการตรวจติดตามเป็นปกติ 2 ครั้งติดต่อกัน สามารถทำการตรวจคัดกรองได้ตามปกติ
- หากการตรวจด้วยคอลโปสโคปไม่เป็นที่น่าพอใจ หรือการเก็บตัวอย่างเยื่อบุปากมดลูกด้านในพบ CIN แนะนำให้ทำการตัดปากมดลูกเพื่อการวินิจฉัย
- ในรายที่ตรวจพบรอยโรค CIN 2,3 ให้รับการดูแลรักษาตาม 2006 Consensus Guidelines for the Management of Cervical Intraepithelial Neoplasia ต่อไป
แนวทางการดูแลรักษาสตรีตั้งครรภ์ที่มีผลเซลล์วิทยา HSIL
- ให้ทำการตรวจด้วยคอลโปสโคปในสตรีตั้งครรภ์ที่มีผลเซลล์วิทยา HSIL
- สำหรับรอยโรคที่สงสัย CIN 2,3 หรือ มะเร็ง สามารถทำการตัดชิ้นเนื้อบางส่วนเพื่อการวินิจฉัยได้
- หลีกเลี่ยงการทำ endocervical curettage ในสตรีตั้งครรภ์
- หลีกเลี่ยงการตัดปากมดลูกเพื่อการวินิจฉัยในสตรีตั้งครรภ์ ยกเว้นในกรณีที่สงสัยมะเร็งระยะลุกลาม
- การตรวจติดตามด้วยการตรวจเซลล์วิทยา และการตรวจด้วยคอลโปสโคป ให้ทำหลังคลอด 6 สัปดาห์
Atypical glandular cells (AGC) and adenocarcinoma in situ (AIS)
อัตราการรายงานผล AGC พบได้น้อย เฉลี่ยเพียง 0.4%27 ถึงแม้ AGC จะมีสาเหตุจากพยาธิสภาพที่ไม่รุนแรง แต่จากการศึกษาล่าสุดพบว่า 9-38% ของสตรีที่มีผลเซลล์วิทยา AGC มีรอยโรคขั้นสูง และพบมะเร็งระยะลุกลามได้ 3-17%42-45 โดยมะเร็งนรีเวชมักจะพบได้น้อยในสตรีที่อายุน้อยกว่า 35 ปี42 และการตั้งครรภ์ไม่ได้เปลี่ยนแปลงความสัมพันธ์ระหว่าง AGC กับ พยาธิสภาพทางนรีเวช
เนื่องจากความหลากหลายของพยาธิสภาพที่เกี่ยวข้องกับ AGC การประเมินจึงต้องอาศัยการตรวจหลายๆ อย่างร่วมกัน ได้แก่ การตรวจด้วยคอลโปสโคป, การเก็บตัวอย่างเยื่อบุปากมดลูกด้านใน, การตรวจหาเชื้อ HPV และการตรวจเยื่อบุโพรงมดลูก45,47 หากการตรวจเบื้องต้นไม่พบความผิดปกติอาจจำเป็นต้องทำการตัดปากมดลูกเพื่อการวินิจฉัยร่วมด้วยสำหรับสตรีที่มีผลเซลล์วิทยา AGC-FN, AIS หรือ AGC เมื่อทำการตรวจเซลล์วิทยาซ้ำ5
ประมาณ 0.5-1.8% ของตัวอย่างเซลล์วิทยาปากมดลูกที่เก็บจากสตรีอายุ 40 ปี ขึ้นไปจะพบเซลล์เยื่อบุโพรงมดลูก ซึ่งในสตรีวัยก่อนหมดประจำเดือน เนื้อเยื่อเหล่านี้มักไม่สัมพันธ์กับพยาธิสภาพที่สำคัญ48 แต่ในสตรีวัยหมดประจำเดือน โดยเฉพาะในรายที่ได้รับฮอร์โมนทดแทน พบอุบัติการณ์ของพยาธิสภาพที่สำคัญมากขึ้น49
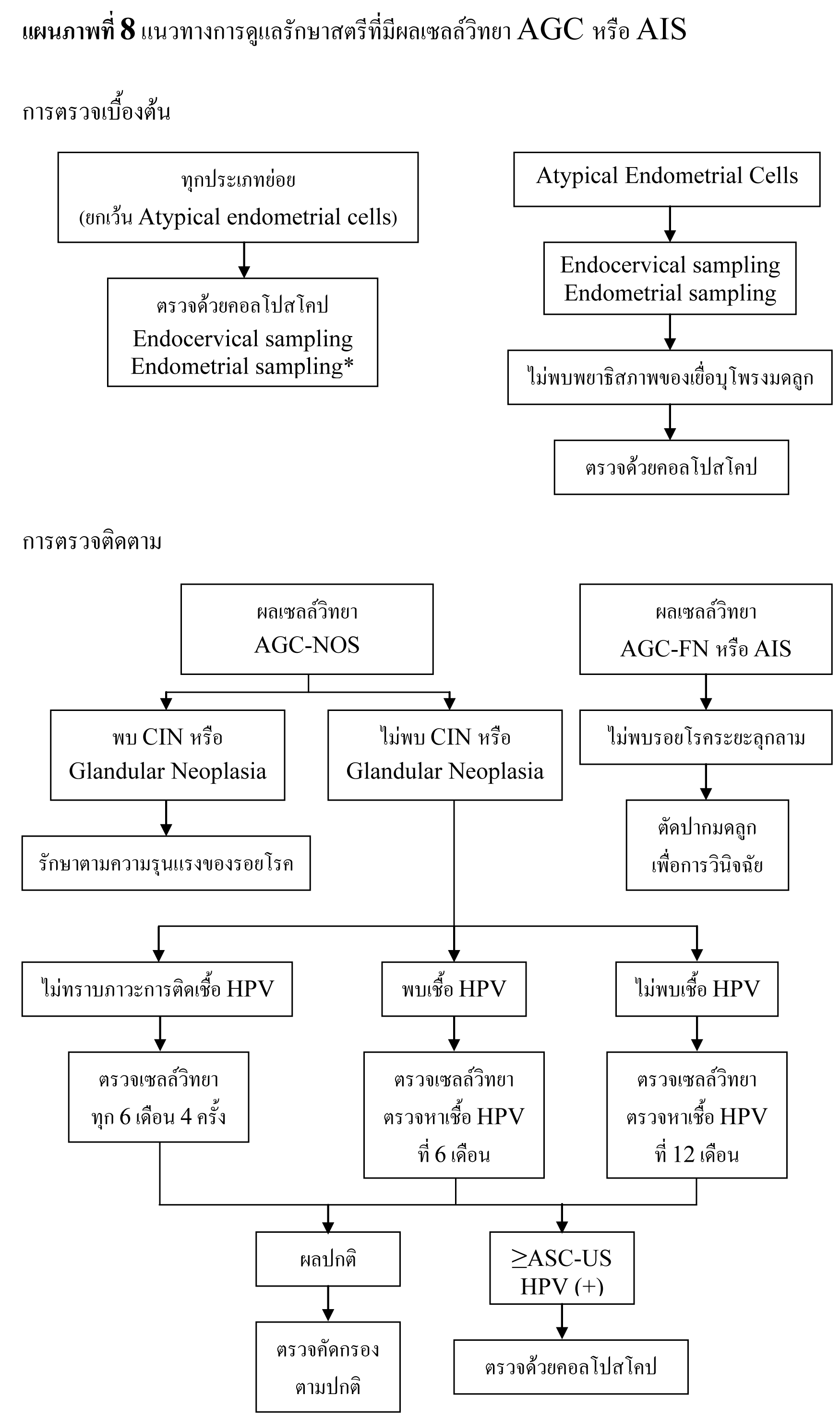
แนวทางการดูแลรักษาสตรีที่มีผลเซลล์วิทยา AGC หรือ AIS
- ให้ทำการตรวจด้วยคอลโปสโคปีร่วมกับการเก็บตัวอย่างเยื่อบุปากมดลูกด้านใน ในสตรีที่มีผลเซลล์วิทยา AGC และ AIS
- ให้ทำการเก็บตัวอย่างเยื่อบุโพรงมดลูกเพิ่มเติมในสตรีที่มีอายุ 35 ปีขึ้นไป แต่สำหรับสตรีที่อายุน้อยกว่า 35 ปี ให้ทำเฉพะในรายที่มีความในเสี่ยงที่จะเกิดพยาธิสภาพของเยื่อบุโพรงมดลูก เช่น มีเลือดออกทางช่องคลอดผิดปกติ, ภาวะไม่ตกไข่เรื้อรัง
- สำหรับสตรีที่มีผลเซลล์วิทยา atypical endometrial cells ให้ทำการเก็บตัวอย่างทั้งจากเยื่อบุปากมดลูกด้านใน และเยื่อบุโพรงมดลูก ส่วนการตรวจด้วยคอลโปสโคปนั้นอาจทำตั้งแต่ต้น หรือรอจนกว่าจะทราบผลชิ้นเนื้อก็ได้ หากไม่พบพยาธิสภาพของเยื่อบุโพรงมดลูกจึงพิจารณาตรวจด้วยคอลโปสโคปต่อไป
- สำหรับสตรีที่มีผลเซลล์วิทยา AGC-NOS หากยังไม่ได้ทำการตรวจหาเชื้อ HPV ให้ทำการตรวจพร้อมกับการตรวจด้วยคอลโปสโคป
- สำหรับสตรีที่มีผลเซลล์วิทยา AGC-NOS ร่วมกับผลชิ้นเนื้อไม่พบ CIN หรือ glandular neoplasia
- oหากพบการติดเชื้อ HPV ก่อนหน้านี้ ให้ทำการตรวจติดตามด้วยการตรวจเซลล์วิทยา ร่วมกับการตรวจหาเชื้อ HPV ที่ 6 เดือน
- oหากไม่พบการติดเชื้อ HPV ก่อนหน้านี้ ให้ทำการตรวจติดตามด้วยการตรวจเซลล์วิทยา ร่วมกับการตรวจหาเชื้อ HPV ที่ 12 เดือน
- หากผลการตรวจติดตามพบเซลล์วิทยาผิดปกติตั้งแต่ ASC-US ขึ้นไป หรือพบการติดเชื้อ high-risk HPV ให้ทำการตรวจด้วยคอลโปสโคปซ้ำ
- หากผลการตรวจติดตามเป็นปกติ สามารถตรวจคัดกรองได้ตามปกติ
- oหากไม่ทราบภาวะการติดเชื้อ HPV ให้ทำการตรวจติดตามด้วยการตรวจเซลล์วิทยาทุก 6 เดือน หากผลปกติ 4 ครั้งติดต่อกัน สามารถตรวจคัดกรองได้ตามปกติ
- หากผลชิ้นเนื้อพบ CIN แต่ไม่พบ glandular neoplasia ให้รับการดูแลรักษาตาม 2006 Consensus Guidelines for the Management of Cervical Intraepithelial Neoplasia ต่อไป
- สำหรับสตรีที่มีผลเซลล์วิทยา AGC-FN หรือ AIS หากตรวจด้วยคอลโปสโคปแล้วไม่พบรอยโรคระยะลุกลาม ให้ทำการตัดปากมดลูกเพื่อการวินิจฉัย ร่วมกับการเก็บตัวอย่างเยื่อบุปากมดลูกด้านใน
แนวทางการดูแลรักษาสตรีตั้งครรภ์ที่มีผลเซลล์วิทยา AGC
- ให้ทำการดูแลรักษาเช่นเดียวกับสตรีที่ไม่ได้ตั้งครรภ์ ยกเว้นการทำ endocervical curettage และการตัดชิ้นเนื้อเยื่อบุโพรงมดลูก
การใช้ HPV DNA Testing ในการตรวจคัดกรองมะเร็งปากมดลูก
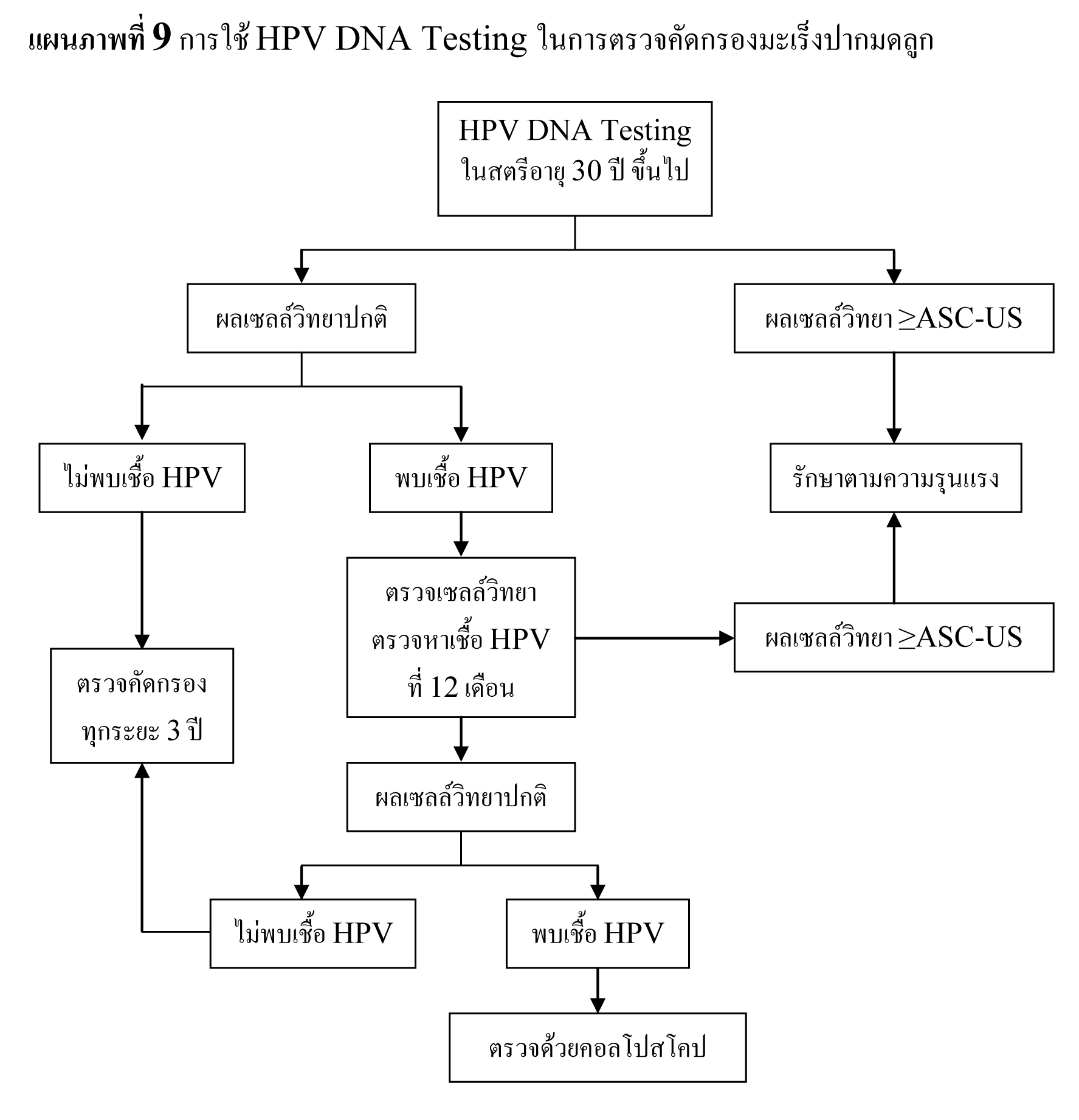
เนื่องจากการคัดกรองมะเร็งปากมดลูกด้วยการตรวจเซลล์วิทยายังมีข้อจำกัดอยู่มาก ทำให้มีความสนใจที่จะใช้การตรวจหาเชื้อ HPV ร่วมในการคัดกรอง50 พบอุบัติการณ์ของการติดเชื้อ HPV ได้มากในกลุ่มวัยรุ่น ซึ่งสามารถหายได้เอง ทำให้พบการติดเชื้อ HPV ลดลงตามอายุ51 ดังนั้นจึงควรใช้การตรวจหาเชื้อ HPV ในการคัดกรองมะเร็งปากมดลูกเฉพาะในสตรีอายุ 30 ปีขึ้นไป52
พบว่า การใช้การตรวจหาเชื้อ HPV เพื่อหารอยโรคขั้นสูงในสตรีอายุ 35 ปีขึ้นไป มีความไว 95% และความเฉพาะเจาะจง 93% ส่วนการใช้การตรวจเซลล์วิทยาในการตรวจคัดกรอง มีความไว 60% และความเฉพาะเจาะจง 97% และเมื่อนำทั้งสองวิธีการมาใช้ร่วมกัน จะทำให้ความไวในการตรวจคัดกรองเพิ่มขึ้นอย่างชัดเจน โดยมีค่า negative predictive value ที่ 99-100%53,54
สตรีที่มีผลตรวจเซลล์วิทยาปกติ และตรวจไม่พบการติดเชื้อ HPV มีความเสี่ยงที่จะพบรอยโรคขั้นสูงน้อยกว่า 1 ใน 1000 และเมื่อติดตามต่อไปเป็นเวลา 10 ปี พบอัตราการกลายเป็นรอยโรคขั้นสูงที่ค่อนข้างต่ำ55,56 มีการศึกษาที่แสดงให้เห็นว่า การตรวจคัดกรองด้วยการตรวจเซลล์วิทยาร่วมกับการตรวจหาการติดเชื้อ HPV ในสตรีอายุ 30 ปีขึ้นไป โดยการตรวจทุกระยะ 3 ปี มีประโยชน์เทียบเท่าหรือมากกว่าการตรวจเซลล์วิทยาแบบธรรมดาทุกปี57 ดังนั้นสตรีที่มีผลเซลล์วิทยาปกติ และตรวจไม่พบการติดเชื้อ HPV จึงไม่จำเป็นต้องรับการตรวจคัดกรองซ้ำในเวลา 3 ปี
พบว่า 58% ของสตรีที่มีการติดเชื้อ HPV มีผลการตรวจเซลล์วิทยาที่ปกติ ซึ่งความเสี่ยงที่จะไม่สามารถตรวจพบรอยโรคขั้นสูงที่อาจซ้อนเร้นในสตรีกลุ่มนี้ค่อนข้างต่ำ อยู่ที่ประมาณ 2.4-5.1%58-61 ร่วมกับการติดเชื้อ HPV นั้นสามารถหายได้เมื่อทำการตรวจติดตาม โดยหลังจากติดตามเป็นระยะเวลาเฉลี่ย 6 เดือน พบว่า 60% ของสตรีที่เคยตรวจพบการติดเชื้อ HPV ไม่พบการติดเชื้อเมื่อทำการตรวจซ้ำ61 จากข้อมูลเหล่านี้จึงให้สตรีที่มีผลตรวจเซลล์วิทยาปกติ แต่ตรวจพบการติดเชื้อ HPV รับการตรวจทั้งสองซ้ำที่ 12 เดือน หากยังคงพบการติดเชื้อ HPV ให้ทำการตรวจด้วยคอลโปสโคปต่อไป แต่ถ้าตรวจไม่พบการติดเชื้อ ให้ทำการตรวจคัดกรองซ้ำที่ระยะ 3 ปี
แนวทางการดูแลรักษาสตรีตามผลการตรวจคัดกรองมะเร็งปากมดลูกโดยเซลล์วิทยา ของราชวิทยาลัยสูตินรีแพทย์แห่งประเทศไทย62
- การตรวจซ้ำ (repeat screening)
- ในกรณีตัวอย่างเซลล์ไม่เพียงพอ ไม่สามารถประเมินทางเซลล์วิทยาได้
- การตรวจคัดกรองเป็นระยะๆ (recall for periodic screening)
- ในกรณีผลเซลล์วิทยาปกติ ไม่พบเซลล์มะเร็ง
- การรักษา (treat)
- ในกรณีตรวจพบการติดเชื้อแบคทีเรีย เชื้อรา หรือเชื้อปรสิต
- การตรวจซ้ำทุก 6 เดือน (repeat screening every 6 months)
- ในกรณีผลเซลล์วิทยาเป็น ASC-USและ LSIL
- oถ้าผลเซลล์วิทยาปกติ 2 ครั้ง ให้ตรวจคัดกรองทุก 12 เดือน
- oถ้าผลเซลล์วิทยาเป็น ASC-US หรือรุนแรงกว่า ให้ส่งตรวจด้วยคอลโปสโคป
- การส่งต่อเพื่อตรวจด้วยคอลโปสโคป (refer for colposcopy)
- ในกรณีผลเซลล์วิทยาเป็น
- oASC-US หรือ LSIL ที่พบการติดเชื้อ HPV หรือในรายที่มีโอกาสสูงที่จะไม่กลับมาตรวจติดตามได้ตามนัด
- oASC-H, HSIL, squamous cell carcinoma, AGC, AIS และ adenocarcinoma
เอกสารอ้างอิง
- National Cancer Institute, Department of Medical Services, Ministry ofPublic Health,Thailand. Hospital-Based Cancer Registry 2002-2010
- สำนักพัฒนาวิชาการแพทย์ กรมการแพทย์ กระทรวงสาธารณสุข. แนวทางเวชปฏิบัติการตรวจคัดกรองมะเร็งปากมดลูก และการรักษาผู้ป่วยที่มีความผิดปกติของปากมดลูก. กรุงเทพฯ: โรงพิมพ์ชุมนุมสหกรณ์การเกษตรแห่งประเทศไทย 2547;9.
- Solomon D, Davey D, Kurman R, Moriarty A, O’Connor D, Prey M, et al. The 2001Bethesdasystem: terminology for reporting results of cervical cytology. JAMA 2002;287:2114-9.
- Wright TC, Massad LS, Dunton CJ, Spitzer M, Wilkinson EJ, Solomon D. 2006 consensus guidelines for the management of women with abnormal cervical cancer screening tests. Am J Obstet Gynecol 2007;197:346-55.
- Wright TC, Cox JT, Massad LS, Twiggs LB, Wilkinson EJ. 2001 consensus guidelines for the management of women with cervical cytology abnormalities. JAMA 2002;287:2120-9.
- Results of a randomized trial on the management of cytology interpretations of atypical squamous cells of undetermined significance. ASCUS-LSIL Triage Study (ALTS) Group. Am J Obstet Gynecol 2003;188:1383-92
- A randomized trial on the management of low-grade squamous intraepithelial lesion cytol0gy interpretations. ASCUS-LSIL Triage Study (ALTS) Group. Am J Obstet Gynecol 2003;188:1393-400.
- Stoler MH, Schiffman M. Interobserver reproducibility of cervical cytologic and histologic interpretations: realistic estimates from the ASCUS-LSIL Triage Study. JAMA 2001;285:1500-5.
- Confortini M, Carozzi F, Dalla Palma P, et al. Interlaboratory reproducibility of atypical squamous cells of undetermined significance report : a national survey. Cytopathology 2003;14:253-8
- Gatscha RM, Abadi M, Babore S, Chhieng D, Miller MJ, Saifo PE. Smears diagnosed as ASCUS: interobserver variation and follow-up. Diagn Cytopathol 2001;25:138-40
- Jones BA, Novis DA, Follow-up of abnormal gynecologic cytology: acollegeofAmericanpathologists Q-probes study of 16132 cases from 306 laboratories. Arch Pathol Lab Med 2000;124:665-7.
- LonkyNM, Sadeghi M, Tsadik GW, Petitti D. The clinical significance of the poor correlation of cervical dysplasia and cervical malignancy with referral cytologic results. Am J Obstet Gynecol 1999;181:560-6
- Kobelin MH, Kobelin CG, Burke L, Lavin P, Niloff JM, Kim YB. Incidence and predictors of cervical dysplasia in patients with minimally abnormal Papanicolaou smears. Obstet Gynecol 1998;92:356-9.
- Schoolland M, Sterrett GF, Knowles SA, Mitchell KM, Kurinczuk JJ. The “Inconclusive-possible high grade epithelial abnormality” category in Papanicolaou smear reporting. Cancer 1998;84:208-17.
- ShermanME, Solomon D, Schiffman M. Qualification of ASCUS: a comparison of equivocal LSIL and equivocal HSIL cervical cytology in the ASCUS-LSIL Triage Study (ALTS). Am J Clin Pathol 2001;116:386-94
- Quddus MR, Sung CJ, Steinhoff MM,LauchlanSC, Singer DB, Hutchinson ML. Atypical squamous metaplastic cells. Cancer 2001;94:16-22.
- Manos MM, Kinner WK, Hurley LB, et al. Identifying women with cervical neoplasia: using human papillomavirus DNA testing for equivocal Papanicolaou results. JAMA 1999;281:1605-10.
- LonkyNM, Felix JC, Naidu YM, Wolde-Tsadik G. Triage of atypical squamous cells of undetermined significance with hybrid capture II: colposcopy and histologic human papillomavirus correlation. Obstet Gynecol 2003;101:481-9.
- Bergeron C, Jeannel D, Poveda J, Cassonnet P, Orth G. Human papillomavirus testing in women with mild cytologic atypia. Obstet Gynecol 2000;95:821-7.
- Kulasingam SL, Kim JJ,LawrenceWF, et al. Cost-effectiveness analysis based on the atypical squamous cells of undetermined significance/low-grade squamous intraepithelial lesion Triage Study (ALTS). J Natl Cancer Inst 2006;98:92-100.
- Kim JJ, Wright TC, Goldie SJ. Cost-effectiveness of alternative triage strategies for atypical squamous cells of undetermined significance. JAMA 2002;287:2382-90.
- Boardman LA, Stanko C, Weitzen S, Sung CJ. Atypical squamous cells of undetermined significance: human papillomavirus testing in adolescents. Obstet Gynecol 2005;105:741-6.
- Eltoum IA, Chhieng DC, Roberson J, McMillon D, Partridge EE. Reflex human papilloma virus infection testing detects the same proportion of cervical intraepithelial neoplasia grade 2-3 inyoung versus elderly women. Cancer 2005;105:194-8.
- Massad LS, Schneider MF,WattsDH, et al. HPV testing for trige of HIV-infected women with Papanicolaou smears read as atypical squamous cells of uncertain significance. J Womens Health (Larchmt) 2004;13:147-53.
- Kirby TO, Allen ME,Alvarez RD, Hoesley CJ, Huh WK. High-risk human papillomavirus and cervical intraepithelial neoplasia at time of atypical squamous cells of undetermined significance cytologic results in a population with human immunodeficiency virus. J Low Genit Tract Dis 2004;8:298-303.
- Dunn TS, Bajaj JE,StammCA, Beaty B. Management of the minimally abnormal Papanicolaou smear in pregnancy. J Low Genit Tract Dis 2001;5:133-7.
- Davey DD, Neal MH, Wilbur DC, Colgan TJ, Styer PE, Mody DR. Bethesda 2001 implementation and reporting rates: 2003 practices of participants in theCollegeofAmerican Pathologists Interlaboratory Comparison Programin Cervicovaginal Cytology. Arch Pathol Lab Med 2004;128:1224-9.
- Arbyn M, Sasieni P, Meijer CJ, Clavel C, Koliopoulos G, Dillner J. Chapter 9: clinical applications of HPV testing: a summary of meta-analyses. Vaccine 2006;25(Suppl 3):S78-89.
- Alvarez RD, Wtight TC. Effective cervical neoplasia detection with a novel optical detection system: a randomized trial. Gynecol Oncol 2007;104:281-9.
- Chute DJ, Covell J, Pambuccian SE, Stelow EB. Cytologic-histologic correlation of screening and diagnostic Papanicolaou tests. Diagn Cytopathol 2006;34:503-6.
- Cox JT, Schiffman M, Solomon D. Prospective follow-up suggests similar risk of subsequent cervical intraepithelial neoplasia grade 2 or 3 among women with cervical intraepithelial neoplasia grade 1 or negative colposcopy and directed biopsy. Am J Obstet Gynecol 2003;188:1406-12.
- MoscickiAB, Shiboski S, Hills NK, et al. Regression of low-grade squamous intra-epithelila lesions in young women. Lancet 2004;364:1678-83.
- Sherman ME, Schiffman M, Cox JT, Group TA. Effects of age and HPV load on colposcopic triage: data from the ASCUS LSIL Triage Study (ALTS). J Natl Cancer Inst 2002;94:102-7.
- Evans MF, Adamson CS, Papillo JL, St John TL, Leiman G, Cooper K. Distribution of human papillomavirus types in ThinPrep Papanicoloau tests classified according to the Bethesda 2001 terminology and correlations with patient age and biopsy outcomes. Cancer 2006;106:1054-64.
- Massad LS, Collins YC, Meyer PM. Biopsy correlates of abnormal cervical cytology classified using theBethesdasystem. Gynecol Oncol 2001;82:516-22.
- Dunn TS, Burke M, Shwayder J. A ”see and treat” management for high-grade squamous intraepithelial lesion pap smears. J Low Genit Tract Dis 2003;7:104-6.
- Jones BA, Davey DD. Quality management in gynecologic cytology using interlaboratory comparison. Arch Pathol Lab Med 2000;124:672-81.
- Holschneider CH, Ghosh K, Montz FJ. See-and-treat in the management of high-grade squamous intraepithelial lesions of the cervix: a resource utilization analysis. Obstet Gynecol 1999;94:377-85.
- Numnum TM, Kirby TO, LeathCA3rd, Huh WK,Alvarez RD, Straughn JM. A prospective evaluation of “see and treat” in women with HSIL Pap smear results: is this an appropriate strategy? J Low Genit Tract Dis 2005;9:2-6.
- Melnikow J, Nuovo J, Willan AR, Chan BK, Howell LP. Natural history of cervical squamous intraepithelial lesions: a meta-analysis. Obstet Gynecol 1998;02:727-35.
- Peto J, Gilham C, Deacon J, et al. Cervical HPV infection and neoplasia in a large population-based prospective study: the Manchester cohort. Br J Cancer 2004;91:942-53.
- Sharpless KE, Schnatz PF, Mandavilli S, Greene JF, Sorosky JI. Dysplasia associated with atypical glandular dells on cervical cytology. Obstet Gynecol 2005;105:494-500.
- DeSimone CP, Day ME, Tovar MM, Dietrich CS 3rd, Eastham ML, Modesitt SC. Rate of pathology from atypical glandular dell Pap tests classified by the Bethesda 2001 nomenclature. Obstet Gynecol 2006;107:1285-91.
- Tam KF, Cheung AN, Liu KL, et al. A retrospective review on atypical glandular cells of undetermined significance (AGUS) using the Bethesda 2001 classification. Gynecol Oncol 2003;91:603-7.
- Derchain SF, Rabelo-Santos SH, Sarian LO, et al. Human papillomavirus DNA detection and histological finding in women referred for atypical glandular dells or adenocarcinoma in situ in their Pap smears. Gynecol Oncol 2004;95:618-23.
- Diaz-Montes TP, Farinola MA, Zahurak ML, Bristow RE, Rosenthal DL. Clinical utility of atypical glandular cells (AGC) classification: cytohistologic comparison and relationship to HPV results. Gynecol Oncol 2006;104:366-71.
- Krane JF, Lee KR, Sun D, Yuan L, Crum CP. Atypical glandular cells of undetermined significance. Outcome predictions based on human papillomavirus testing. Am J Clin Pathol 2004;121:87-92.
- Greenspan DL, Cardillo M, Davey DD, Heller DS, Moriarty AT. Endometrial cells in cervical cytology: review of cytological features and clinical assessment. J Low Genit Tract Dis 2006;10:111-22.
- Simsir A, Carter W, Elgert P, Cangiarella J. Reporting endometrial cells in women 40 years and older: assessing the clinical usefulness of Bethesda 2001. Am J Clin Pathol 2005;123:571-5.
- Wright TCJr. HPV DNA testing for cervical cancer screening. Int J Gynecol Obstet 2006;95(Suppl 1):S239-46.
- Dunne EF, Unger ER, Sternberg M, et al. Prevalence of HPV infection among females in theUnited States. JAMA 2007;297:813-9.
- Saslow D, Runowicz CD, Solomon D, et al. American Cancer Society guideline for the early detection of cervical neoplasia and cancer. CA Cancer J Clin 2002;52:342-62.
- Cuzick J, Clavel C, Petry KU, et al. Overview of the European and North American studies on HPV testing in primary cervical cancer screening. Int J Cancer 2006;119:1095-101.
- ACOG practice bulletin. Clinical Management Guidelines for Obstetrician-Gynecologists. Number 61, April 2005. Human papillomavirus. Obstet Gynecol 2005;105:905-18.
- Kjaer S, Hogdall E, Frederksen k, et al. The absolute risk of cervical abnormalities in high-risk human papillomavirus-positive, cytologically normal women over a 10-year period. Cancer Res 2006;66:10630-6.
- Khan MJ,CastlePE, Lorincz AT, et al. The elevated 10-year risk of cervical precancer and cancer in women with human papillomavirus (HPV) type 16 or 18 and the possible utility of type-specific HPV testing in clinical practice. J Natl Cancer Inst 2005;97:1072-9.
- Goldie SJ, Kim JJ, Wright TC. Cost-effectiveness of human papillomavirus DNA testing for cervical cancer screening in women aged 30 years or more. Obstet Gynecol 2004;103:619-31.
- Ronco G, Segnan N, Giogi-Rossi P, et al. Human papillomavirus testing and liquid-based cytology: results at recruitment from the new technologies for cervical cancer randomized controlled trial. J Natl Cancer inst 2006;96:765-74.
- Bigras G, de Marval F. The probability for a Pap test to be abnormal is directly proportional to HPV viral load: results from a Swiss study comparing HPV testing and liquid-based cytology to detect cervical cancer precursors in 13,842 women. Br J Cancer 2005;93:575-81.
- Cuzick J, Szarewski A, Cubie H, et al. Management of women who test positive for high-risk types of human papillomavirus : the HART study. Lancet 2003;362:1871-6.
- Clavel C, Masure M, Bory JP, et al. Human papillomavirus testing in primary screening for the detection of high-grade cervical lesions: as study of 7932 women. Br J Cancer 2001;89:1616-23.
- คณะอนุกรรมการมะเร็งอวัยวะสืบพันธุ์สตรี และคณะกรรมการมาตรฐานวิชาชีพ. แนวทางการดูแลรักษาสตรีตามผลการตรวจคัดกรองมะเร็งปากมดลูกโดยเซลล์วิทยา. สูตินรีแพทย์สัมพันธ์ 2549;15(5):20-3.