Down syndrome screening
การตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์
(Down syndrome screening)
ผศ. พญ. เฟื่องลดา ทองประเสริฐ
Introduction
ทารกกลุ่มอาการดาวน์ (Down syndrome) คือ กลุ่มอาการที่เกิดจากการที่โครโมโซมคู่ที่ 21 เกินมา 1 โครโมโซม โดยมีลักษณะการแสดงออกเด่นทางระดับสติปัญญาที่ด้อยกว่าคนปกติ คือ มีระดับสติปัญญา (I.Q.) ประมาณ 25 – 50 นอกจากมีภาวะปัญญาอ่อนแล้วผู้ป่วยยังมีลักษณะหน้าตาที่จำเพาะ เช่น มีศีรษะเล็กกลม (small head) ท้ายทอยแบน (flattened occiput) ลิ้นใหญ่จุกปาก (tongue protrusion) หางตาชี้ขึ้น (up-slanting palpebral fissures) ดั้งจมูกแบน (flat nasal bridge) และพบลักษณะผิวหนังบริเวณต้นคอหย่อน (redundant nuchal tissue) ลายฝ่ามือตัดขวาง (single transverse palmar crease) กระดูกข้อกลางของนิ้วก้อยสั้นหรือหายไป (hypoplasia of the middle phalanx of the fifth finger) มีช่องว่างระหว่างนิ้วเท้าที่หนึ่งและสองกว้างกว่าปกติ (sandal-toe-gap) และพบภาวะกล้ามเนื้ออ่อนแรง (hypotonia) หัวใจพิการแต่กำเนิดโดยเฉพาะอย่างยิ่งภาวะผนังกั้นห้องหัวใจรั่ว (endocardial cushion defects) ลำไส้อุดตัน (duodenal atresia) ต่อมไธรอยด์ทำงานผิดปกติ (hypothyroidism) เพิ่มโอกาสเกิดมะเร็งเม็ดเลือดขาว (leukemia) เป็นต้น
อุบัติการณ์ของทารกกลุ่มอาการดาวน์พบประมาณ 1 ใน 800 ถึง 1 ใน 1,000 ของการคลอดทั้งหมด(1) (ในกรณีไม่มีการตรวจวินิจฉัยก่อนคลอด) ประมาณร้อยละ 95 ของทารกกลุ่มอาการดาวน์ทั้งหมดเกิดจากภาวะ maternal nondisjunction of chromosome 21 (ร้อยละ 75 เกิดในระยะ meiosis I และอีกร้อยละ 25 เกิดในระยะ meiosis II) ส่วนอีกร้อยละ 5 เกิดจากภาวะ mosaicism และภาวะ translocation ความเสี่ยงต่อการตั้งครรภ์ทารกกลุ่มอาการดาวน์จะค่อยๆ เพิ่มขึ้นเมื่ออายุมารดามากขึ้นและเพิ่มอย่างรวดเร็วหลังจากอายุ 35 ปีขึ้นไปดังแสดงในตารางที่ 1
การตรวจวินิจฉัยก่อนคลอดเพื่อวินิจฉัยทารกกลุ่มอาการดาวน์เริ่มต้นขึ้นในช่วงปี 1970s โดยเริ่มจากการเจาะดูดน้ำคร่ำ (amniocentesis) ในช่วงแรกการตรวจคัดกรองเพื่อค้นหามารดาที่มีความเสี่ยงต่อการมีทารกกลุ่มอาการดาวน์จะใช้เพียงอายุมารดาเป็นหลักเกณฑ์สำคัญในการตรวจคัดกรอง โดยถือเอามารดาที่อายุมากกว่าหรือเท่ากับ 35 ปีขึ้นไป (นับถึงวันกำหนดคลอด) ต้องได้รับคำปรึกษาแนะนำถึงความเสี่ยง และอาจเลือกตรวจวินิจฉัยด้วยการเจาะดูดน้ำคร่ำ (amniocentesis) หรือการตรวจชิ้นเนื้อรก (chorionic villus sampling)(2) เนื่องจากมารดาที่มีอายุมากกว่า 35 ปีจะมีความเสี่ยงในการตั้งครรภ์ทารกกลุ่มอาการดาวน์เท่าๆ กับความเสี่ยงต่อการสูญเสียบุตรจากการเจาะดูดน้ำคร่ำในช่วงไตรมาสที่สองของการตั้งครรภ์(3)
|
Maternal age |
Midtrimester |
Term liveborn |
||
|
Down Syndrome |
All aneuploidies |
Down Syndrome |
All aneuploidies |
|
|
33 34 35 36 37 38 39 40 41 42 43 44 45 |
1/417 1/333 1/250 1/192 1/149 2/115 1/89 1/69 1/53 1/41 1/31 1/25 1/19 |
1/208 1/152 1/132 1/105 1/83 1/65 1/53 1/40 1/31 1/25 1/19 1/15 1/12 |
1/626 1/500 1/384 1/303 1/227 1/175 1/137 1/106 1/81 1/64 1/50 1/38 1/30 |
1/345 1/278 1/204 1/167 1/130 1/103 1/81 1/63 1/50 1/39 1/30 1/24 1/19 |
ตารางที่ 1 ความเสี่ยงต่อการตั้งครรภ์ทารกกลุ่มอาการดาวน์และภาวะโครโมโซมผิดปกติอื่นๆ ในขณะกึ่งกลางการตั้งครรภ์ (midtrimester risk) และขณะคลอด (term risk) (ที่มา: ปรับปรุงจาก American College of Obstetricians and Gynecologists Committee on Practice Bulletins–Obstetrics. ACOG Practice Bulletin. Clinical Management Guidelines for Obstetrician-Gynecologists. Prenatal diagnosis of fetal chromosomal abnormalities. Obstet Gynecol 2001; 97: suppl 1-12)
อย่างไรก็ตามทารกที่คลอดจากมารดาที่อายุมากกว่า 35 ปีมีเพียง 12.9% ของทารกที่คลอดทั้งหมด ดังนั้นแม้มารดาที่อายุมากกว่า 35 ปีจะได้รับการเจาะดูดน้ำคร่ำทุกราย ก็จะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้เพียง 30-40% เท่านั้น เนื่องจากทารกกลุ่มอาการดาวน์ส่วนใหญ่เกิดในมารดาอายุน้อย(3)
ในช่วงปีค.ศ. 1980s มีรายงานการตรวจวัดระดับสารชีวเคมีบางตัวในกระแสเลือดมารดาในไตรมาสที่สองสามารถนำมาใช้คำนวณเพื่อบอกความเสี่ยงในการตั้งครรภ์ทารกกลุ่มอาการดาวน์ได้ โดยสารชีวเคมีดังกล่าวได้แก่ alpha-fetoprotein (AFP), human chorionic gonadotropin (hCG) และ unconjugated estriol (uE3) หรือที่รู้จักกันอย่างแพร่หลายในชื่อ triple marker test ซึ่งพบว่าเมื่อนำมาใช้ตรวจคัดกรองร่วมกับการใช้อายุมารดามากกว่า 35 ปี จะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้ถึง 69% นอกจากนี้ยังมีการเพิ่มประสิทธิภาพของการตรวจคัดกรองในไตรมาสสองด้วยการนำ inhibin A มาใช้ร่วมกับ triple marker test (quadruple marker test) พบว่าสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้ถึง 80-85%(4) นอกจากนี้ยังมีการนำการตรวจวัดระดับสารชีวเคมีบางชนิดในไตรมาสแรกได้แก่ pregnancy-associated plasma protein A (PAPP-A) และ human chorionic gonadotropin (hCG) มาใช้ร่วมกับการตรวจอัลตราซาวด์ความหนาต้นคอทารก (nuchal translucency) พบว่ามีประสิทธิภาพในการตรวจคัดกรองสูงเช่นเดียวกัน
The American College of Obstetricians and Gynecologists (ACOG) ปี 2007 จึงได้แนะนำให้สตรีตั้งครรภ์ทุกรายที่มาฝากครรภ์ก่อน 20 สัปดาห์ ต้องได้รับคำแนะนำในการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ ดังนั้นไม่ว่าสตรีตั้งครรภ์รายนั้นจะอายุเท่าใดควรได้รับคำแนะนำให้เข้าใจถึงความแตกต่างระหว่างการตรวจคัดกรอง (screening tests) และการตรวจวินิจฉัย (diagnostic tests) และให้ทางเลือกในการตรวจวินิจฉัยก่อนคลอดในกรณีที่ผลการตรวจคัดกรองอยู่ในกลุ่มความเสี่ยงสูง(5) ดังนั้นจึงนับว่ามีความสำคัญยิ่งที่สูติแพทย์ต้องทราบและเข้าใจแนวทางการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์เพื่อนำไปใช้ในเวชปฏิบัติต่อไป
First-Trimester Screening
1. Human Chorionic Gonadotropin (hCG)
ในไตรมาสแรกระดับ hCG ในกระแสเลือดมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะสูงเป็น 2 เท่าของมารดาที่ตั้งครรภ์ปกติ หรือค่ามัธยฐานของ hCG ในมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะมีค่าประมาณ 2 MoM และสามารถนำมาใช้ตรวจคัดกรองในช่วงไตรมาสแรกของการตั้งครรภ์ได้เช่นเดียวกัน ในขณะที่ค่ามัธยฐานของสารชีวเคมีต่างๆ ในมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์ที่ตรวจวัดในไตรมาสที่สองมีค่าค่อนข้างคงที่ระหว่างอายุครรภ์ 15 – 20 สัปดาห์(4) แต่ในไตรมาสแรกพบว่าค่ามัธยฐานของ hCG ในมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์เพิ่มขึ้นระหว่างอายุครรภ์ 9 – 13 สัปดาห์ ในขณะที่ระดับ hCG ในการตั้งครรภ์ปกติจะลดลงเมื่ออายุครรภ์เพิ่มขึ้น ส่งผลให้ประสิทธิภาพของ hCG ในการแยกการตั้งครรภ์ทารกกลุ่มอาการดาวน์ออกจากทารกปกติดีขึ้นหากตรวจคัดกรองในอายุครรภ์ที่มากขึ้น(6) นอกจากนี้ยังพบว่าหากตรวจคัดกรองในอายุครรภ์น้อยกว่า 11 สัปดาห์ ควรตรวจระดับ free β-hCG เท่านั้นเนื่องจาก total β-hCG ไม่มีประสิทธิภาพเพียงพอในการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ก่อนอายุครรภ์ 11 สัปดาห์ ในขณะที่การตรวจคัดกรองระหว่างอายุครรภ์ 11 – 13 สัปดาห์ ไม่พบความแตกต่างกันของ free β-hCG และ total β-hCG หากใช้ร่วมกับการตรวจวัดระดับ PAPP-A และการวัด nuchal translucency(6)
2. Pregnancy-associated placenta protein A (PAPP-A)
PAPP-A เป็น glycoprotein ซึ่งสร้างมาจากรก โดยจะพบระดับที่สูงขึ้นเมื่ออายุครรภ์มากขึ้น ในไตรมาสแรกระดับ PAPP-A ในกระแสเลือดมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะต่ำกว่ามารดาที่ตั้งครรภ์ปกติ โดยค่ามัธยฐานของ PAPP-A ในมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะมีค่าประมาณ 0.4 MoM นอกจากนี้ยังพบว่าค่ามัธยฐานของ PAPP-A ในมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์เพิ่มขึ้นจาก 0.4 MoM ที่อายุครรภ์ 10 สัปดาห์ เป็น 0.7 MoM ที่อายุครรภ์ 13 สัปดาห์ ดังนั้นประสิทธิภาพของ PAPP-A ในการแยกการตั้งครรภ์ทารกกลุ่มอาการดาวน์ออกจากทารกปกติจะลดลงหากตรวจคัดกรองในอายุครรภ์ที่มากขึ้น(7)
3. Nuchal translucency (NT)
Nuchal translucency หรือ NT คือน้ำที่สะสมบริเวณด้านหลังต้นคอ (ท้ายทอย) ทารกที่มีลักษณะใส (sonolucent) ไม่มีความเข้มเสียงจากการตรวจคลื่นเสียงความถี่สูง ดังแสดงในรูปที่ 1 การวัดความหนาของน้ำที่สะสมใต้ท้ายทอยทารกนี้ถูกนำมาใช้ในการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์และภาวะโครโมโซมผิดปกติอื่นๆ โดยพบว่าประมาณ 1 ใน 3 ของทารกที่มี NT หนาผิดปกติจะมีโครโมโซมผิดปกติและครึ่งหนึ่งของทารกกลุ่มที่มีโครโมโซมผิดปกตินี้จะเป็นทารกกลุ่มอาการดาวน์(8) NT ที่หนาผิดปกตินี้ (รูปที่ 2) ไม่ถือว่าเป็นความพิการของทารกในครรภ์ แต่เป็นเครื่องหมายแสดงถึงความเสี่ยงที่เพิ่มขึ้น NT จะมีความหนามากขึ้นในทารกที่อายุครรภ์มากขึ้น เมื่อวัด NT เป็นมิลลิเมตรแล้วนำมาเทียบกับค่ามัธยฐานของ NT ที่อายุครรภ์นั้นๆ เพื่อปรับค่าให้แสดงเป็น MoM จะสามารถนำมาคำนวณความเสี่ยงในการตั้งครรภ์ทารกกลุ่มอาการดาวน์ร่วมกับการตรวจ PAPP-A และ hCG ในไตรมาสแรกได้ (combined test) โดยพบว่าประสิทธิภาพในการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์เท่ากับร้อยละ 79 – 87(1) ซึ่งประสิทธิภาพดีเทียบเท่ากับการตรวจ quadruple marker test ในไตรมาสสอง อายุครรภ์ที่วัดความหนาของ NT ก็ส่งผลต่อประสิทธิภาพของ NT ในการแยกการตั้งครรภ์ทารกกลุ่มอาการดาวน์ออกจากทารกปกติ โดยพบว่าประสิทธิภาพจะลดลงหากตรวจคัดกรองในอายุครรภ์ที่มากขึ้น
การวัดความหนาของ NT อย่างเดียวประสิทธิภาพจะเท่ากับร้อยละ 64 – 70 ดังนั้นการวัดความหนาของ NT เพียงอย่างเดียวจึงถูกแนะนำให้ใช้เฉพาะการตรวจคัดกรองทารกกลุ่มอาการดาวน์ในกรณีการตั้งครรภ์แฝด(5)
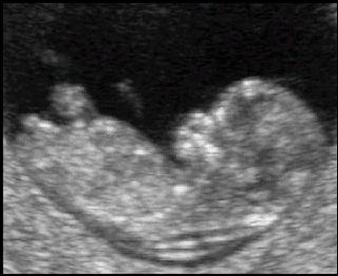
รูปที่ 1 ภาพคลื่นเสียงความถี่สูงแสดงความหนาของน้ำที่สะสมบริเวณด้านหลังต้นคอทารก (nuchal translucency: NT)
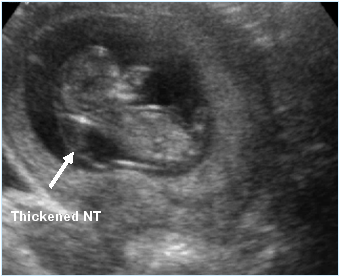
รูปที่ 2 ตัวอย่างภาพคลื่นเสียงความถี่สูงแสดงให้เห็นน้ำที่สะสมบริเวณด้านหลังต้นคอทารก (nuchal translucency: NT) ที่หนาผิดปกติ
Second-Trimester Screening
1. Alpha-fetoprotein (AFP)
ในปี 1984 Merkatz และคณะพบว่าระดับ AFP ในกระแสเลือดมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะมีค่าต่ำกว่ามารดาที่ตั้งครรภ์ปกติ(9) โดยระดับของ AFP ทั้งในมารดาที่ตั้งครรภ์ปกติและมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะไม่มีการเปลี่ยนแปลงตามอายุมารดา ทำให้สามารถนำมาใช้คำนวณความเสี่ยงร่วมกับการใช้อายุมารดาที่มากกว่า 35 ปีได้
จากการศึกษาโดย New England Regional Genetics Group Prenatal Collaborative Study of Down Syndrome Screening ในปี 1986-1987 พบว่าการใช้ระดับ AFP เพื่อตรวจคัดกรองเพียงอย่างเดียวในมารดาทุกรายโดยไม่คำนึงถึงอายุ (ใช้ระดับ AFP < 0.5 MoM เป็นค่า cut-off) จะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้ 20% (false positive rate 5%) และหากตรวจคัดกรองโดยใช้ AFP ในมารดาอายุน้อยกว่า 35 ปีจะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้ 25% (false positive rate 5%)(10) แต่ถ้านำอายุมารดาที่มากกว่า 35 ปีมาใช้คำนวณความเสี่ยงร่วมด้วยจะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้ 37% (false positive rate 5%)(9)
เนื่องจากระดับ AFP มีการเปลี่ยนแปลงตามอายุครรภ์ การรายงานผลการตรวจคัดกรองเพื่อนำมาคำนวณความเสี่ยงจะใช้หน่วยเป็นจำนวนเท่าของค่ามัธยฐาน (MoM) ของแต่ละอายุครรภ์
เช่น มารดาที่อายุครรภ์ 17 สัปดาห์จะมีค่ามัธยฐานของ AFP เท่ากับ 40 ng/mL (1 MoM)
หากตรวจระดับ AFP ได้เท่ากับ 80 ng/mL แสดงว่ามีค่า AFP เท่ากับ 2 MoM
หากตรวจระดับ AFP ได้เท่ากับ 20 ng/mL แสดงว่ามีค่า AFP เท่ากับ 0.5 MoM เป็นต้น
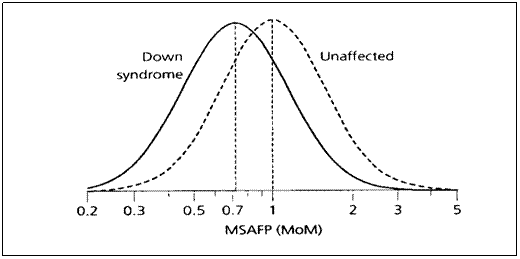
รูปที่ 3 The distribution of maternal serum alpha-fetoprotein (MSAFP)
measurements in pregnancies with and without Down syndrome(2)
รูปที่ 3 แสดงให้เห็นว่าค่ามัธยฐานของ AFP ในมารดาที่ตั้งครรภ์ปกติจะมีค่าเท่ากับ 1 MoM ขณะที่ค่ามัธยฐานของ AFP ในมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะมีค่าเท่ากับ 0.72 MoM และแสดงให้เห็นว่ามีพื้นที่บางส่วนซ้อนทับกันอยู่ นั่นคือมีโอกาสเป็นไปได้ทั้งการตั้งครรภ์ปกติและการตั้งครรภ์ทารกกลุ่มอาการดาวน์ เมื่อนำมาคำนวณหาค่าความเป็นไปได้ที่จะเกิดโรค (likelihood ratio: LR) ก็จะสามารถบอกความเป็นไปได้ว่าจะมีโอกาสในการตั้งครรภ์ทารกกลุ่มอาการดาวน์เป็นกี่เท่าของโอกาสในการตั้งครรภ์ปกติ ดังแสดงในรูปที่ 4
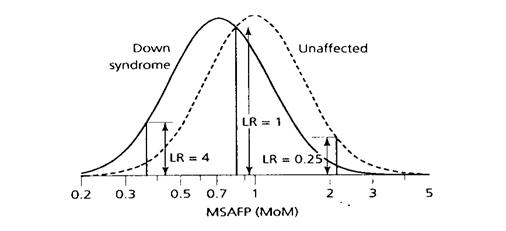
รูปที่ 4 The relative increase or decrease in Down syndrome risk at
three different maternal serum alpha-fetoprotein (MSAFP) levels(2)
ตัวอย่าง 1 AFP = 0.35 MoM LR = 4 (โอกาสเสี่ยงเพิ่มขึ้น 4 เท่า)
ตัวอย่าง 2 AFP = 0.84 MoM LR = 1 (โอกาสเสี่ยงไม่เปลี่ยนแปลง)
ตัวอย่าง 3 AFP = 2.20 MoM LR = 0.25 (โอกาสเสี่ยงลดลง 4 เท่า)
ค่า LR ที่ได้สามารถนำมาคำนวณเพื่อหาค่าความเสี่ยงในการตั้งครรภ์ทารกกลุ่มอาการดาวน์ ดังจะกล่าวต่อไป
2. Human Chorionic Gonadotropin (hCG)
ในปี 1987 Bogart และคณะ รายงานว่าระดับ hCG ในกระแสเลือดมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะสูงเป็น 2 เท่าของมารดาที่ตั้งครรภ์ปกติหากตรวจในช่วงไตรมาสที่สองของการตั้งครรภ์(11) หรือค่ามัธยฐานของ hCG ในมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะมีค่าเท่ากับ 2 MoM และสามารถนำมาใช้ตรวจคัดกรองเพื่อค้นหามารดาที่มีความเสี่ยงต่อการตั้งครรภ์ทารกกลุ่มอาการดาวน์ได้ มีรายงานการศึกษาพบว่าหากกำหนดให้ false positive rate คงที่ 5% การใช้ hCG เพียงอย่างเดียวเพื่อตรวจคัดกรองโดยไม่คำนึงถึงอายุมารดาจะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้ 36% หากใช้อายุมารดาที่มากกว่า 35 ปีร่วมกับการตรวจคัดกรองด้วย hCG จะสามารถตรวจพบได้ 49% และหากใช้อายุมารดาที่มากกว่า 35 ปีร่วมกับการตรวจคัดกรองด้วย hCG และ AFP (double marker test) จะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้ถึง 56%(12)
ในการตรวจระดับ hCG ในกระแสเลือดมารดาสามารถตรวจได้ทั้ง free β-hCG หรือ total β-hCG (intact β-hCG) โดยพบว่า detection rate ไม่แตกต่างกันมาก เมื่อใช้ตรวจคัดกรองร่วมกับอายุมารดามากกว่า 35 ปี, AFP และ uE3 มีการศึกษาพบว่า intact β-hCG มี detection rate 57% ขณะที่ free β-hCG มี detection rate 62% ที่ false positive rate 5%(13) จึงสามารถใช้แทนกันได้ สำหรับในห้องปฏิบัติการแต่ละแห่งจะเลือกตรวจเพียงอย่างใดอย่างหนึ่ง เนื่องจากมีวิธีการตรวจทางห้องปฏิบัติการและค่าปกติที่แตกต่างกัน
3. Unconjugated estriol (uE3)
ในปี 1988 Canick และคณะรายงานว่าระดับ uE3 ในกระแสเลือดมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะมีค่าต่ำกว่ามารดาที่ตั้งครรภ์ปกติ 25%(14) โดยค่ามัธยฐานของ uE3 ในมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะมีค่าเท่ากับ 0.8 MoM มีรายงานการศึกษาพบว่าหากกำหนดให้ false positive rate คงที่ 5% การใช้ uE3 เพียงอย่างเดียวเพื่อตรวจคัดกรองโดยไม่คำนึงถึงอายุมารดาจะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้ 31% หากใช้อายุมารดาที่มากกว่า 35 ปีร่วมกับการตรวจคัดกรองด้วย uE3 จะสามารถตรวจพบได้ 41% และหากใช้อายุมารดาที่มากกว่า 35 ปีร่วมกับการตรวจคัดกรองด้วย uE3, hCG และ AFP (triple marker test) จะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้ถึง 69%(14)
รูปที่ 5 แสดงให้เห็นการเปรียบเทียบ detection rate ของสารชีวเคมีแต่ละชนิดโดยกำหนดให้ false positive rate คงที่ 5% แล้ว พบว่า AFP, uE3 และ hCG มี detection rate 18%, 31% และ 36% ตามลำดับ นั่นแสดงว่า hCG เป็นสารชีวเคมีที่มีคุณค่าที่สุดในการตรวจคัดกรองด้วยวิธี triple marker test
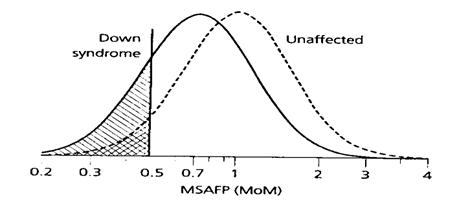
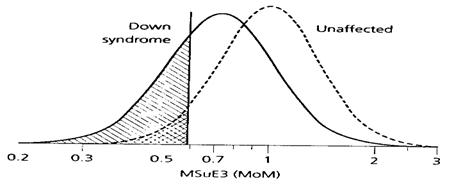
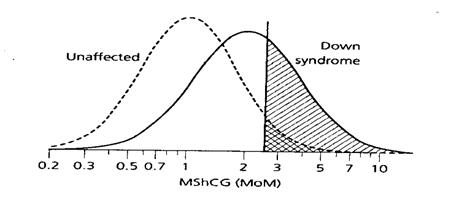
รูปที่ 5 The distribution of maternal serum levels of alpha-fetoprotein (MSAFP), unconjugated estriol (uE3) and human chorionic gonadotropin (hCG) in unaffected pregnancies and pregnancies affected by Down syndrome(2)
จากรายงานในปี 1988 พบว่าสารชีวเคมีแต่ละชนิดไม่มีการเปลี่ยนแปลงตามอายุมารดา และสารชีวเคมีแต่ละชนิดเป็นอิสระต่อกัน จึงสามารถนำมาใช้ร่วมกันในการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ได้(12) ในการตรวจคัดกรองจะรายงานเป็นจำนวนเท่าของค่ามัธยฐาน (MoM) ในแต่ละอายุครรภ์ นำมาคำนวณเพื่อหาค่าความเป็นไปได้ในการตั้งครรภ์ทารกกลุ่มอาการดาวน์ (LR) โดยใช้หลักการเดียวกับการตรวจคัดกรองโดย AFP ดังกล่าวข้างต้น
Triple marker test
หลังจากมีการค้นพบว่า hCG และ uE3 สามารถนำมาใช้ร่วมกับ AFP ในการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ได้ตั้งแต่ปี 1988 มีการศึกษาวิจัยจำนวนมากศึกษาถึงประสิทธิภาพของ triple marker test นี้ จากการศึกษาของ Wald ในปี 1997 พบว่าหากกำหนดให้ false positive rate 5% triple marker test จะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้ 69% ดังแสดงในรูปที่ 6
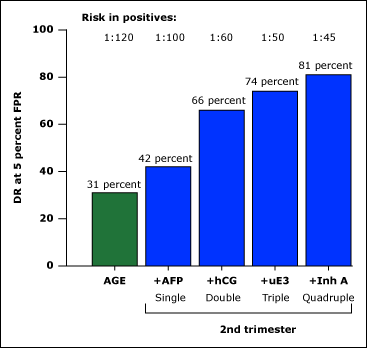
รูปที่ 6 Performance of maternal age and various second trimester maternal serum combinations in screening for Down syndrome(4)
Quadruple marker test
หลังจากมีการใช้ triple marker test เพื่อตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์อย่างแพร่หลาย ก็มีผู้พยายามค้นหาสารชีวเคมีตัวใหม่ที่จะมาเพิ่มประสิทธิภาพให้กับการตรวจคัดกรอง โดยจุดมุ่งหวังให้มี detection rate มากที่สุด ในขณะที่ false positive rate น้อยที่สุด และต้องเป็นสารชีวเคมีที่เป็นอิสระไม่ขึ้นกับอายุมารดาและสารชีวเคมีชนิดอื่นๆ สารชีวเคมีที่พบว่าสามารถนำมาใช้ได้ คือ inhibin A ซึ่งมีรายงานว่าระดับ inhibin A ในกระแสเลือดมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะมีค่าสูงเป็น 2 เท่าของมารดาตั้งครรภ์ปกติ(15) โดยค่ามัธยฐานของ inhibin A ในมารดาที่ตั้งครรภ์ทารกกลุ่มอาการดาวน์จะมีค่าเท่ากับ 1.8 MoM และเมื่อนำมาตรวจคัดกรองร่วมกับ AFP, hCG และ uE3 (quadruple marker test) จะมี detection rate ถึง 80-85% (false positive rate 6%)(16) หรือถ้ากำหนดให้ false positive rate คงที่ 5% จะมี detection rate 76%(4) นั่นคือสามารถเพิ่ม detection rate ได้โดยไม่เพิ่ม false positive rate
ในปัจจุบันการตรวจ quadruple marker test ถือว่าเป็นการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ที่ดีที่สุดในช่วงไตรมาสที่สองของการตั้งครรภ์(17) การตรวจคัดกรองด้วย quadruple หรือ triple marker test นี้จะตรวจในช่วงอายุครรภ์ 15-20 สัปดาห์ (ดีที่สุดในช่วงอายุครรภ์ 16-18 สัปดาห์) เนื่องจากเป็นช่วงอายุครรภ์ที่สารชีวเคมีทั้ง 4 ชนิดมีการเปลี่ยนแปลงตามอายุครรภ์ และมีระดับที่แตกต่างกันระหว่างการตั้งครรภ์ปกติและการตั้งครรภ์ทารกกลุ่มอาการดาวน์ค่อนข้างชัดกว่าช่วงอายุครรภ์อื่น(3)
หลักการคำนวณค่าความเสี่ยงในการตั้งครรภ์ทารกกลุ่มอาการดาวน์
การคำนวณความเสี่ยงในการตั้งครรภ์ทารกกลุ่มอาการดาวน์ ใช้ความเสี่ยงพื้นฐานตามอายุมารดา (age-related risk) ในการคำนวณร่วมกับค่าความเป็นไปได้ในการตั้งครรภ์ทารกกลุ่มอาการดาวน์ที่ได้จากการตรวจสารชีวเคมีแต่ละชนิด โดยมีสมการคำนวณดังนี้
Down Syndrome risk = age-related risk x LR(AFP) x LR(hCG) x LR(uE3) x LR(inhA)
โดยสามารถเทียบ age-related risk ได้ดังตารางที่ 1 หรือใช้อุบัติการณ์ของการเกิดทารกกลุ่มอาการดาวน์ในประชากรหญิงตั้งครรภ์ทุกกลุ่มอายุ คูณกับค่า LR ตามอายุมารดา (LR based on maternal age)
ตัวอย่างการคำนวณความเสี่ยง
อุบัติการณ์ของการเกิดทารกกลุ่มอาการดาวน์ในประชากรหญิงตั้งครรภ์ทุกกลุ่มอายุ = 1/830
LR ถ้ามารดาตั้งครรภ์ตอนอายุ 27 ปี = 0.68
Age-related risk ถ้ามารดาตั้งครรภ์ตอนอายุ 27 ปี = 1/830 x 0.68 = 1/1200
ตัวอย่างที่ 1 กำหนดให้ AFP = 0.65 (LR = 1.5)
uE3 = 0.60 (LR = 2.7)
hCG = 2.50 (LR = 2.2)
inhA = 2.10 (LR = 2.0)
Down Syndrome risk = 1/1200 x 1.5 x 2.7 x 2.2 x 2.0 = 1/80
ตัวอย่างที่ 2 กำหนดให้ AFP = 0.70 (LR = 1.0)
uE3 = 0.80 (LR = 1.0)
hCG = 2.00 (LR = 1.0)
inhA = 1.80 (LR = 1.0)
Down Syndrome risk = 1/1200 x 1.0 x 1.0 x 1.0 x 1.0 = 1/1200
ตัวอย่างที่ 3 กำหนดให้ AFP = 1.55 (LR = 0.41)
uE3 = 1.20 (LR = 0.27)
hCG = 0.80 (LR = 0.29)
inhA = 0.90 (LR = 0.5)
Down Syndrome risk = 1/1200 x 0.41 x 0.27 x 0.29 x 0.50 = 1/46000
ทั้ง 3 ตัวอย่างแสดงให้เห็นว่า quadruple marker test สามารถเปลี่ยนแปลงความเสี่ยงในมารดาแต่ละรายถึงแม้จะตั้งครรภ์ตอนอายุเท่ากัน สามารถนำความเสี่ยงที่คำนวณได้นั้นไปใช้ประกอบการให้คำปรึกษาแนะนำในการตรวจวินิจฉัยก่อนคลอดต่อไป
Combined First- and Second-Trimester Screening
เป็นการนำการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ในไตรมาสแรกและไตรมาสสองมาใช้ร่วมกันเพื่อเพิ่มประสิทธิภาพในการตรวจคัดกรอง โดยมีวิธีการต่างๆ ดังต่อไปนี้
1. Integrated screening
คือการนำผลการตรวจคัดกรองในไตรมาสแรกและไตรมาสสองมารวมคำนวณเพื่อหาความเสี่ยงเพียงค่าเดียวซึ่งพบว่ามีประสิทธิภาพสูงที่สุดในการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์คือเท่ากับร้อยละ 90 – 96(1) อย่างไรก็ตามข้อจำกัดของการตรวจคัดกรองด้วย integrated screening คือผลการตรวจคัดกรองจะทราบในไตรมาสที่สองเท่านั้น เนื่องจากต้องรอตรวจคัดกรองในไตรมาสสองให้แล้วเสร็จจึงจะสามารถคำนวณความเสี่ยงได้ ในกรณีไม่สามารถตรวจวัดความหนาของ NT ได้ อาจตรวจเฉพาะสารชีวเคมีในไตรมาสแรกและไตรมาสสอง (quadruple marker test) แล้วนำมาคำนวณความเสี่ยงรวมกัน เรียกว่า serum integrated screening แต่ประสิทธิภาพจะไม่ดีมากเท่ากับการใช้ NT มาคำนวณความเสี่ยงร่วมด้วย
2. Sequential screening
คือการตรวจคัดกรองในไตรมาสแรกและไตรมาสสองอย่างเป็นลำดับขั้นตอน โดยเปิดเผยผลการตรวจคัดกรองไตรมาสแรกแก่หญิงตั้งครรภ์ที่ผลการตรวจคัดกรองอยู่ในกลุ่มความเสี่ยงสูง เพื่อให้โอกาสในการตรวจวินิจฉัยก่อนคลอดได้เร็วขึ้น ซึ่งเป็นการลดข้อจำกัดจากการตรวจคัดกรองด้วย integrated screening โดยแบ่งเป็น 2 วิธีการดังนี้
a. Stepwise sequential screening
แบ่งกลุ่มหญิงตั้งครรภ์เป็น 2 กลุ่มหลังจากตรวจคัดกรองไนไตรมาสแรกแล้วเสร็จ คือกลุ่มความเสี่ยงสูง และกลุ่มความเสี่ยงต่ำ หญิงตั้งครรภ์ที่ผลการตรวจคัดกรองอยู่ในกลุ่มความเสี่ยงสูงจะได้รับคำแนะนำและให้ทางเลือกในการตรวจวินิจฉัยก่อนคลอด ส่วนหญิงตั้งครรภ์ที่ผลการตรวจคัดกรองอยู่ในกลุ่มความเสี่ยงต่ำจะได้รับการตรวจคัดกรองในไตรมาสสองต่อ
b. Contingent sequential screening
แบ่งกลุ่มหญิงตั้งครรภ์เป็น 3 กลุ่มหลังจากตรวจคัดกรองไนไตรมาสแรกแล้วเสร็จ คือกลุ่มความเสี่ยงสูง กลุ่มความเสี่ยงปานกลาง และกลุ่มความเสี่ยงต่ำ หญิงตั้งครรภ์ที่ผลการตรวจคัดกรองอยู่ในกลุ่มความเสี่ยงสูงจะได้รับคำแนะนำและให้ทางเลือกในการตรวจวินิจฉัยก่อนคลอด หญิงตั้งครรภ์ที่ผลการตรวจคัดกรองอยู่ในกลุ่มความเสี่ยงต่ำจะได้รับแจ้งผลและไม่จำเป็นต้องตรวจคัดกรองในไตรมาสที่สองอีก ส่วนหญิงตั้งครรภ์ที่ผลการตรวจคัดกรองอยู่ในกลุ่มความเสี่ยงปานกลางจะได้รับการตรวจคัดกรองในไตรมาสสองต่อ การตรวจคัดกรองด้วย contingent sequential screening นี้พบว่ามีความคุ้มทุนมากที่สุดในการตรวจคัดกรองในประชากรจำนวนมาก เนื่องจากสามารถลดความจำเป็นในการตรวจคัดกรองในไตรมาสสองได้ในหญิงตั้งครรภ์กลุ่มความเสี่ยงต่ำซึ่งเป็นประชากรส่วนมากถึงร้อยละ 80 – 85 ของหญิงตั้งครรภ์ที่ได้รับการตรวจคัดกรองทั้งหมด
|
Strategy |
Analytes |
Detection rate* (%) |
|
First trimester screening |
||
|
NT |
64–70 |
|
NT + PAPP-A + hCG |
79–87 |
|
Second trimester screening |
||
|
MSAFP + hCG + uE3 |
60–69 |
|
MSAFP + hCG + uE3 + inhA |
67–81 |
|
Combined First and Second trimester screening |
||
|
First-trimester screen + Quadruple test (results withheld until Quad test completed) |
94–96 |
|
First-trimester screen + Quadruple test – 1% offered diagnostic test after first trimester screen – 99% proceed to Quad test ( results withheld until Quad test completed) |
90–95
|
|
First-trimester screen + Quadruple test – 1% offered diagnostic test after first trimester screen – 15% proceed to Quad test ( results withheld until Quad test completed) – 84% have no additional test after first trimester screen |
88–94 |
|
* Based on a 5% positive screen rate |
||
ตารางที่ 2 แสดงประสิทธิภาพของการตรวจคัดกรองทารกกลุ่มอาการดาวน์ด้วยวิธีการต่างๆ
(ที่มา: ปรับปรุงจาก Cunningham FG, Leveno KJ, Bloom SL, Hauth JC, Rouse DJ, Spong CY. Prenatal diagnosis and fetal therapy. Williams Obstetrics. 23rd ed. New York: McGraw-Hill, 2010: 287-311)
ตัวแปรที่มีผลต่อการตรวจคัดกรองด้วย serum marker test
1. Selection of markers
ดังได้กล่าวไปแล้วข้างต้น การเลือกวิธีการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ให้มีประสิทธิภาพสูงสุด คือเลือกวิธีที่มี detection rate มากที่สุดในขณะที่ false positive rate น้อยที่สุด หรือเลือกวิธีที่เพิ่ม detection rate โดย false positive rate ไม่เปลี่ยนแปลง
การตรวจคัดกรองโดยใช้อายุมารดามากกว่า 35 ปีร่วมกับสารชีวเคมีชนิดใดชนิดหนึ่ง พบว่ามีประสิทธิภาพน้อย โดยถ้ากำหนดให้ false positive rate คงที่ 5% detection rate จากการใช้อายุมารดามากกว่า 35 ปีร่วมกับ AFP, uE3, hCG หรือ inhibin A จะมีค่าเท่ากับ 37%, 41%, 49% และ 44% ตามลำดับ หากตรวจคัดกรองโดยใช้
- double markers คือใช้อายุมารดามากกว่า 35 ปีร่วมกับ AFP และ hCG จะได้ detection rate 59%
- triple markers คือใช้อายุมารดามากกว่า 35 ปีร่วมกับ AFP, hCG และ uE3 จะได้ detection rate 69%
- quadruple markers คือใช้อายุมารดามากกว่า 35 ปีร่วมกับ AFP, hCG, uE3 และ inhibin A จะได้ detection rate 76%(4)
ดังนั้น quadruple marker test จึงนับว่าเป็นวิธีการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ที่ดีที่สุดในไตรมาสที่สอง(17) แต่อย่างไรก็ตาม integrated test (NT และ PAPP-A ในไตรมาสแรกร่วมกับ AFP, hCG, uE3 และ inhibin A ในไตรมาสที่สอง) ถือว่าเป็นวิธีการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ที่ดีที่สุด(7)
2. Selection of risk cut-off
การเลือก risk cut-off เพื่อกำหนดค่าความเสี่ยงที่จะถือว่าผลการตรวจคัดกรองเป็นบวกหรือลบนั้น จะต้องคำนึงถึง detection rate และ false positive rate เป็นสำคัญ ดังแสดงในตารางที่ 3 ถ้าเลือก risk cut-off สูง จะมีจำนวนมารดาที่ผลการตรวจคัดกรองเป็นบวกน้อยราย ทำให้มี false positive rate ต่ำแต่ก็จะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้น้อยลงไปด้วย (low detection rate) แต่ถ้าหากเลือก risk cut-off ต่ำ จะสามารถตรวจพบทารกกลุ่มอาการดาวน์ได้มากขึ้นในขณะเดียวกันจะมีจำนวนมารดาที่ผลการตรวจคัดกรองเป็นบวกมากขึ้นไปด้วย ทำให้มี false positive rate สูง ดังนั้นการจะเลือก risk cut-off ที่ระดับใดจึงต้องคำนึงถึง detection rate ที่มากที่สุดที่ false positive rate พอยอมรับได้
|
Risk cut-off (at term) |
มีค่าเท่ากับ maternal age cut-off |
Detection rate (%) |
False positive rate (%) |
|
> 1 : 250 |
> 37 |
69 |
4.9 |
|
1 : 300 |
> 36 |
72 |
5.9 |
|
1 : 350 |
> 35 |
74 |
6.8 |
ตารางที่ 3 แสดงผลของการเลือก risk cut-offs ที่แตกต่างกันต่อประสิทธิภาพของ triple marker test performance(18) (ที่มา: ปรับปรุงจาก Canick JA, Messerlian GM. Laboratory issues related to maternal serum screening for Down syndrome. 2011 [updated 2011; cited 2011 Jan 18]; Available from: http://www.uptodate.com/contents/laboratory-issues-related-to-maternal-serum-screening-for-down-syndrome?source=search_result&selectedTitle=5%7E20)
โดยทั่วไปแล้วมักถือเอา risk cut-off ที่ 1/380 (term risk) หรือ 1/270 (midpregnancy risk) ซึ่งจะเท่ากับ age-related risk ของมารดาอายุมากกว่าหรือเท่ากับ 35 ปีขึ้นไป โดยพบว่า detection rate ประมาณ 75% ขณะที่ false positive rate ประมาณ 7%-10%(4)
3. Midpregnancy versus term risk
age-related risk สามารถใช้นำมาคำนวณความเสี่ยงได้ 2 ช่วง คือ term risk หมายถึงความเสี่ยงที่มารดาจะคลอดทารกกลุ่มอาการดาวน์ตอนครบกำหนด หรือ midpregnancy risk หมายถึงความเสี่ยงที่มารดาจะตั้งครรภ์ทารกกลุ่มอาการดาวน์ตอนไตรมาสที่สอง (อายุครรภ์ 16-18 สัปดาห์) มีการศึกษาพบว่า term risk จะมีความเสี่ยงต่ำกว่า midpregnancy risk ประมาณ 23% จากการมี spontaneous fetal loss ในช่วงระหว่างนั้น(2) เช่น ถ้า term risk ของมารดาอายุ 35 ปีเท่ากับ 1/380 midpregnancy risk จะเท่ากับ 1/270 เป็นต้น
ปัจจุบันยังไม่พบว่าการใช้ term risk หรือ midpregnancy risk จะมีข้อดีข้อด้อยมากน้อยไปกว่ากัน จึงสามารถใช้ได้ทั้ง 2 แบบ แต่ต้องกำหนดให้ชัดเจนเนื่องจากป้องกันการสับสนในการใช้คำนวณความเสี่ยง
4. Effect of maternal age
เนื่องจากมารดาแต่ละรายมีความเสี่ยงพื้นฐานของตัวเองไม่เท่ากัน ขึ้นอยู่กับ age-related risk ตามอายุที่ตั้งครรภ์ (นับถึงวันกำหนดคลอด) โดยความเสี่ยงในการตั้งครรภ์ทารกกลุ่มอาการดาวน์จะเริ่มตั้งแต่ 1/1500 ในมารดาอายุน้อย จนถึง 1/10 ในมารดาอายุ 48 ปีโดยความเสี่ยงจะคงที่ในช่วงอายุ 15-25 ปี จากนั้นความเสี่ยงจะค่อยๆ เพิ่มขึ้นเมื่ออายุ 25-35 ปี และเพิ่มมากขึ้นเป็น 4 เท่าเมื่ออายุ 35-40 ปี และเมื่ออายุมากกว่า 40 ปี ความเสี่ยงจะเพิ่มมากถึง 10 เท่า ดังแสดงในรูปที่ 7(19)
เนื่องจากมารดาที่มีอายุมากจะมีความเสี่ยงในการตั้งครรภ์ทารกกลุ่มอาการดาวน์ได้มากกว่ามารดาที่มีอายุน้อย ดังนั้นโอกาสที่ผลการตรวจคัดกรองด้วย triple marker test ให้ผลบวก (screen positive rate) จะมากกว่ามารดาที่มีอายุน้อย และ detection rate จะสูงตามไปด้วย ดังแสดงในตารางที่ 4
|
Maternal age |
Screen positive rate (%) |
Detection rate (%) |
|
20 |
2.4 |
41 |
|
25 |
2.9 |
44 |
|
30 |
5.0 |
52 |
|
35 |
14.0 |
71 |
|
40 |
40.0 |
91 |
ตารางที่ 4 แสดงประสิทธิภาพของการตรวจคัดกรองทารกกลุ่มอาการดาวน์ในมารดาอายุต่างๆ(3) (ที่มา: ปรับปรุงจาก ACOG Practice Bulletin No. 27: Clinical Management Guidelines for Obstetrician-Gynecologists. Prenatal diagnosis of fetal chromosomal abnormalities. Obstet Gynecol. 2001 May; 97(5 Pt 1): suppl 1-12.)
5. Prior pregnancy history
โดยทั่วไปหากมารดาที่เคยตั้งครรภ์ทารกกลุ่มอาการดาวน์มาก่อน (noninherited type) จะถือว่ามี recurrence risk อย่างน้อยประมาณ 1% แต่จากการศึกษาล่าสุดพบว่าความเสี่ยงในการตั้งครรภ์ทารกกลุ่มอาการดาวน์ในการตั้งครรภ์ครั้งนี้จะเพิ่มจาก age-related term risk 0.34%(20) ส่วน recurrence risk ของการตั้งครรภ์ทารกกลุ่มอาการดาวน์ที่ได้รับการถ่ายทอดจากบิดาหรือมารดา (inherited type) นั้นจะสูงกว่านี้ขึ้นอยู่กับชนิดของ translocation
6. Method of gestational age determination
การประเมินอายุครรภ์ผิดพลาดเป็นสาเหตุที่สำคัญที่สุดของ false positive result เนื่องจากค่าปกติของสารชีวเคมีทั้ง 3 ชนิด มีการเปลี่ยนแปลงขึ้นลงตามอายุครรภ์ที่มากขึ้น ดังนั้นหากอายุครรภ์ที่แท้จริงน้อยกว่าอายุครรภ์ที่ใช้รายงานผลการตรวจ ระดับ AFP และ uE3 อาจเข้าใจว่ามีค่าต่ำผิดปกติสำหรับอายุครรภ์ดังกล่าวทั้งที่จริงแล้วอาจเป็นค่าที่ปกติตามอายุครรภ์ที่แท้จริง (falsely lowered) ส่วน hCG และ inhibin A อาจมีค่าสูงผิดปกติสำหรับอายุครรภ์ดังกล่าวซึ่งที่จริงแล้วเป็นค่าที่ปกติตามอายุครรภ์ที่แท้จริง (falsely increased) ทำให้เมื่อนำมาคำนวณความเสี่ยงจะผิดพลาดจากความเป็นจริงได้ ดังนั้นการทราบอายุครรภ์ที่แน่นอนเป็นสิ่งสำคัญยิ่ง โดยอาจถือตามวันแรกของประจำเดือนครั้งสุดท้ายที่เชื่อถือได้ (LMP dating) หรือใช้คลื่นเสียงความถี่สูงช่วยในการประเมินอายุครรภ์ (U/S dating) โดยถืออายุครรภ์ตาม biparietal diameter (BPD) หรือ crown lump length (CRL) ก็ได้เนื่องจากทั้ง 2 parameters ไม่ได้รับผลกระทบจากการที่ทารกเป็นกลุ่มอาการดาวน์(21) หาก U/S dating แล้วพบว่าอายุครรภ์ที่ได้แตกต่างจากอายุครรภ์เดิมตาม LMP dating ตั้งแต่ 8 วันขึ้นไปจำเป็นต้องรายงานผลการตรวจใหม่โดยใช้อายุครรภ์ที่ได้จาก U/S dating
การใช้ U/S dating จะทำให้ detection rate สูงกว่าการใช้ LMP dating เช่นในการตรวจ quadruple test หากกำหนดให้ false positive rate คงที่ 5% การใช้ U/S dating จะเพิ่ม detection rate จาก 67% เมื่อใช้ LMP dating เป็น 76% หลังปรับอายุครรภ์แล้ว(4)
7. Adjustments to the MoM
ปัจจัยที่อาจมีผลต่อระดับของสารชีวเคมีในกระแสเลือดมารดา ซึ่งอาจต้องทำการปรับเพื่อรายงานระดับสารชีวเคมีที่ถูกต้อง มีดังต่อไปนี้
7.1 เชื้อชาติ (Race)
ระดับ AFP ในสตรีผิวดำ จะสูงกว่าสตรีผิวขาว และสตรีชาวเอเชีย(22) เช่นเดียวกับระดับ uE3, total β-hCG และ free β-hCG จะสูงในสตรีผิวดำเมื่อเทียบกับสตรีผิวขาว(23) ในขณะที่ระดับ Inhibin A จะต่ำในสตรีผิวดำ ดังนั้นจึงควรใช้ระดับปกติของประชากรเชื้อชาตินั้นๆ มาใช้ในการแปลผล
7.2 น้ำหนักตัวมารดา (Body weight)
ระดับสารชีวเคมีในกระแสเลือดมารดาจะต่ำลง หากน้ำหนักตัวมารดามากขึ้น เนื่องจาก blood volume ที่เพิ่มขึ้นจะไป dilute ความเข้มข้นของสารชีวเคมีต่างๆ ในกระแสเลือด (volume of distribution มากขึ้น) ในการรายงานผลการตรวจจึงควรนำน้ำหนักตัวมารดา (ชั่งในวันที่เจาะเลือด) มาใช้ปรับเพื่อรายงานระดับสารชีวเคมีที่ถูกต้อง
7.3 การตั้งครรภ์แฝด (Multiple gestation)
ระดับสารชีวเคมีแต่ละชนิดในกระแสเลือดมารดาที่ตั้งครรภ์แฝดจะสูงประมาณ 2 เท่าของมารดาที่ตั้งครรภ์เดี่ยว หากสมมติว่าทารกแต่ละคนสร้างสารชีวเคมีได้ในอัตราเท่าๆ กัน นำระดับที่ได้เทียบกับระดับปกติของระดับสารชีวเคมีที่ได้จากการตั้งครรภ์เดี่ยวนำมาใช้ในการคำนวณความเสี่ยง พบว่าอาจทำให้การแปลผลผิดพลาดได้ เนื่องจากทารกแต่ละคนอาจมีความเสี่ยงไม่เท่ากัน เช่น ทารกคนหนึ่งอาจปกติ ในขณะที่ทารกอีกคนอาจเป็นทารกกลุ่มอาการดาวน์ นอกจากนี้ระดับปกติของสารชีวเคมีในมารดาที่ตั้งครรภ์เดี่ยวอาจใช้ไม่ได้กับมารดาที่ตั้งครรภ์แฝด
7.4 เบาหวานในมารดา (Diabetes mellitus)
ระดับของ AFP ในมารดาที่เป็น type 1 DM (IDDM) จะต่ำกว่าปกติประมาณ 20% การปรับระดับ AFP ใหม่ทำได้โดยใช้ระดับที่ตรวจได้หารด้วย 0.8(2) ส่วนสารชีวเคมีชนิดอื่น เช่น uE3 และ Inhibin A ก็พบว่ามีระดับต่ำในมารดาที่เป็นเบาหวานเช่นกัน(24)
7.5 การตั้งครรภ์ด้วยวิธี In vitro fertilization (IVF)
ในกรณีมารดาได้รับการกระตุ้นด้วยฮอร์โมนระหว่างการใช้เทคโนโลยีช่วยการเจริญพันธุ์ด้วยวิธี IVF เมื่อตรวจวัดระดับสารชีวเคมีในกระแสเลือดพบว่า ระดับ hCG มีแนวโน้มจะสูง ส่วนระดับ uE3 มีแนวโน้มจะต่ำกว่าปกติ(25) หากไม่ปรับระดับสารชีวเคมีให้ถูกต้องเสียใหม่พบว่า screen positive rate ในมารดากลุ่มนี้จะสูงเป็น 2 เท่าของอัตราที่ควรจะเป็น
ส่วนการใช้เทคโนโลยีช่วยการเจริญพันธุ์ด้วยวิธี oocyte donation, ovulation induction และ intrauterine insemination (IUI) พบว่าอาจมีผลต่อระดับสารชีวเคมีได้เช่นเดียวกัน แต่ยังมีข้อมูลการศึกษาไม่เพียงพอ
7.6 ปัจจัยอื่นๆ
- มารดาที่สูบบุหรี่จะมีระดับ hCG ต่ำกว่าปกติ 20-30% ส่วนระดับ uE3 และ AFP ก็อาจมีผลได้เล็กน้อย(26)
- ทารกเพศชายจะมีระดับ AFP สูงกว่าทารกเพศหญิง
- ปัจจัยอื่นๆ เช่น parity และ SLE พบว่ามีอิทธิพลต่อระดับสารชีวเคมีได้เช่นกัน แต่ไม่จำเป็นต้องปรับระดับใหม่เนื่องจากผลดังกล่าวมีน้อย และยังมีข้อมูลการศึกษาไม่พอเพียงในการนำมาใช้ในทางปฏิบัติ
Sonographic screening
1. Major structural defects
ทารกที่มีโครโมโซมผิดปกติรวมถึงทารกกลุ่มอาการดาวน์มักจะมีความพิการแต่กำเนิดของอวัยวะต่างๆ ร่วมด้วย ซึ่งอาจเป็นไปทั้งความพิการแต่กำเนิดชนิด major (hard) anatomical malformations หรือ minor (soft) markers ซึ่งจะได้กล่าวถึงต่อไป ในกรณีที่พบความผิดปกติของอวัยวะบางอย่างเพียงอย่างใดอย่างหนึ่งจากการตรวจคลื่นเสียงความถี่สูง อาจให้คำแนะนำและทางเลือกในการตรวจวินิจฉัยก่อนคลอดหากลักษณะที่พบเป็น major anomaly ที่มีความเสี่ยงสูงต่อภาวะโครโมโซมผิดปกติดังแสดงในตารางที่ 5 อย่างไรก็ตามทารกกลุ่มอาการดาวน์เพียงร้อยละ 25 – 30 เท่านั้นที่จะพบ major anomaly จากการตรวจคลื่นเสียงความถี่สูงในไตรมาสสอง(1)
|
Selected major anomalies |
Aneuploidy risk (%) |
Common aneuploidy |
|
50 |
45X,21,18,13, triploidy |
|
10–20 |
21,18,13,45X triploidy |
|
5–25 |
13,18,21, triploidy |
|
40–60 |
13,18,22, triploidy |
|
30–50 |
18,13,21, triploidy |
|
5–15 |
18,13 |
|
10–30 |
21,18,13,45X, 22q microdeletion |
|
5–15 |
18,13,21 |
|
10–40 |
18,21 |
|
30–40 |
21 |
|
Minimal |
None |
|
Minimal |
None |
|
30–50 |
18,13,21, triploidy |
|
5–20 |
18,13 |
ตารางที่ 5 แสดงความพิการแต่กำเนิดบางชนิดและความเสี่ยงต่อภาวะโครโมโซมผิดปกติ
(ที่มา: ปรับปรุงจาก Cunningham FG, Leveno KJ, Bloom SL, Hauth JC, Rouse DJ, Spong CY. Prenatal diagnosis and fetal therapy. Williams Obstetrics. 23rd ed. New York: McGraw-Hill, 2010: 287-311)
2. Second-trimester sonographic markers (soft signs)
การตรวจคลื่นเสียงความถี่สูงในไตรมาสสองอาจนำไปสู่การค้นพบทารกกลุ่มอาการดาวน์ได้มากขึ้นจากการมองหาสิ่งผิดปกติเล็กๆ น้อยๆ ซึ่งเป็นเครื่องหมายหรือสัญญาณเตือนให้นึกถึงภาวะโครโมโซมผิดปกติเพิ่มมากขึ้น เครื่องหมายเหล่านี้เรียกว่า soft signs หรือ soft markers ซึ่งไม่ส่งผลต่อสุขภาพของทารกใดๆ หากทารกนั้นมีโครโมโซมปกติและไม่มีความพิการแต่กำเนิดอื่นๆ ร่วมด้วย soft markers ที่พบบ่อยในทารกกลุ่มอาการดาวน์แสดงดังตารางที่ 6 ซึ่ง soft markers บางตัวสามารถนำมาใช้เพื่อบอกความเสี่ยงในการตั้งครรภ์ทารกกลุ่มอาการดาวน์ได้โดยการคำนวณจากค่าความเป็นไปได้ (likelihood ratio) ดังแสดงในตารางที่ 7
|
Second-Trimester Markers or “Soft Signs” |
|
ตารางที่ 6 แสดง soft signs ที่อาจพบได้จากการตรวจคลื่นเสียงความถี่สูงในไตรมาสสองของทารกกลุ่มอาการดาวน์ (ที่มา: ปรับปรุงจาก Cunningham FG, Leveno KJ, Bloom SL, Hauth JC, Rouse DJ, Spong CY. Prenatal diagnosis and fetal therapy. Williams Obstetrics. 23rd ed. New York: McGraw-Hill, 2010: 287-311)
การตรวจหา soft markers ร่วมด้วยในการตรวจคลื่นเสียงความถี่สูงเพื่อดูความสมบูรณ์ของทารกในไตรมาสสองจะให้ประสิทธิภาพในการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ได้ร้อยละ 50 – 75 (5) อย่างไรก็ตามอย่างน้อยร้อยละ 10 ของการตั้งครรภ์ทารกปกติจะตรวจพบ soft markers ตัวใดตัวหนึ่ง (10% false positive rate)
|
Sonographic markers |
Likelihood ratio |
Prevalence in unaffected fetuses (%) |
|
11–17 |
0.5 |
|
1.5–1.9 |
2.0–2.2 |
|
1.4–2.8 |
3.8–3.9 |
|
6.1–6.7 |
0.5–0.7 |
|
1.2–2.7 |
3.7–3.9 |
|
5.1–7.5 |
0.4 |
|
Any 1 marker |
1.9–2.0 |
10.0–11.3 |
|
2 markers |
6.2–9.7 |
1.6–2.0 |
|
3 or more markers |
80–115 |
0.1–0.3 |
ตารางที่ 7 แสดงความน่าจะเป็นของการตรวจพบ soft markers แต่ละชนิดต่อการตั้งครรภ์ทารกกลุ่มอาการดาวน์ และโอกาสตรวจพบในการตั้งครรภ์ปกติ (ที่มา: ปรับปรุงจาก Cunningham FG, Leveno KJ, Bloom SL, Hauth JC, Rouse DJ, Spong CY. Prenatal diagnosis and fetal therapy. Williams Obstetrics. 23rd ed. New York: McGraw-Hill, 2010: 287-311)
บทสรุปและข้อแนะนำ
The American College of Obstetricians and Gynecologists (ACOG) ได้รวบรวมหลักฐานทางการแพทย์และสรุปแนวทางปฏิบัติสำหรับการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์และความผิดปกติทางโครโมโซมต่างๆ ไว้ดังนี้(5)
Level A
- การตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ในไตรมาสแรก (first-trimester screening) ด้วยสารชีวเคมีและการวัดความหนาต้นคอทารกในครรภ์ (NT) เป็นวิธีที่มีประสิทธิภาพในการตรวจคัดกรองในประชากรทั่วไป โดยมีประสิทธิภาพดีกว่าการตรวจคัดกรองด้วยวิธี triple marker test และเทียบเท่ากับการตรวจคัดกรองด้วยวิธี quadruple marker test ในไตรมาสสอง
- การวัดความหนาต้นคอทารกในครรภ์ (NT) เพียงอย่างเดียวมีประสิทธิภาพในการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์น้อยกว่าการวัดความหนาต้นคอทารกในครรภ์ร่วมกับการตรวจวัดระดับสารชีวเคมีในกระแสเลือดมารดา (combined test) ในไตรมาสแรก
- หญิงตั้งครรภ์ที่อยู่ในกลุ่มความเสี่ยงสูงจากการตรวจคัดกรองในไตรมาสแรกควรได้รับคำแนะนำและทางเลือกในการตรวจวินิจฉัยทารกในครรภ์ด้วยการเจาะชิ้นเนื้อรก (CVS) ในไตรมาสแรกหรือการเจาะน้ำคร่ำ (amniocentesis) ในไตรมาสสอง
- การวัดความหนาต้นคอทารกในครรภ์ (NT) ให้มีประสิทธิภาพในการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ควรทำโดยบุคลากรที่ผ่านการฝึกฝนโดยเฉพาะ มีระบบตรวจประเมินคุณภาพอย่างสม่ำเสมอ และใช้เครื่องตรวจคลื่นเสียงความถี่สูงที่เหมาะสม
- การตรวจคัดกรองภาวะท่อประสาทไขสันหลังไม่ปิด (neural tube defects) ในไตรมาสสองควรถูกแนะนำในหญิงตั้งครรภ์ที่เลือกเฉพาะการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ในไตรมาสแรก
Level B
- ควรให้คำแนะนำการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ (และการตรวจวินิจฉัยก่อนคลอด) ในหญิงตั้งครรภ์ทุกราย (โดยไม่จำกัดอายุมารดา) ที่มาฝากครรภ์ก่อนอายุครรภ์ 20 สัปดาห์ และควรเน้นให้หญิงตั้งครรภ์เข้าใจความแตกต่างระหว่างการตรวจคัดกรอง (screening test) และการตรวจวินิจฉัย (invasive diagnostic test)
- Integrated screening มีประสิทธิภาพดีกว่า และ false positive rate ต่ำกว่าการตรวจคัดกรองด้วย first-trimester screening อย่างเดียว
- Serum integrated screening เป็นการตรวจคัดกรองที่มีประโยชน์ในกรณีที่ไม่สามารถตรวจวัดความหนาต้นคอทารกในครรภ์ (NT) ได้
- หญิงตั้งครรภ์ที่ตรวจคลื่นเสียงความถี่สูงในไตรมาสสองพบความพิการแต่กำเนิดของทารกชนิด major anomaly ที่เพิ่มความเสี่ยงต่อภาวะโครโมโซมผิดปกติ ควรได้รับคำปรึกษาแนะนำและทางเลือกในการตรวจวินิจฉัยก่อนคลอด
- หญิงตั้งครรภ์ที่ตรวจพบความหนาต้นคอทารกในครรภ์ (NT) มากกว่า 3.5 มม. ในไตรมาสแรก ควรได้รับคำปรึกษาแนะนำและทางเลือกในการตรวจคลื่นเสียงความถี่สูงเพื่อดูความสมบูรณ์ของทารกในครรภ์อย่างละเอียด (targeted ultrasound examination) และ/หรือ การตรวจหัวใจทารกในครรภ์อย่างละเอียด (fetal echocardiogram) แม้ว่าผลการตรวจคัดกรองหรือผลการตรวจโครโมโซมทารกจะปกติก็ตาม
- การตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์ด้วยการตรวจวัดระดับสารชีวเคมีในไตรมาสแรกและไตรมาสสองในการตั้งครรภ์แฝดจะมีประสิทธิภาพน้อยกว่าการตั้งครรภ์เดี่ยว
- การตรวจวัดความหนาต้นคอทารกในครรภ์ในไตรมาสแรกในการตั้งครรภ์แฝดสามารถทำได้ง่าย แต่ประสิทธิภาพยังด้อยกว่าการตรวจคัดกรองด้วยวิธี first-trimester screening ในการตั้งครรภ์เดี่ยว
Level C
- เมื่อตรวจคัดกรองในไตรมาสแรกแล้วเสร็จ ไม่จำเป็นต้องตรวจคัดกรองในไตรมาสสองต่อ หากไม่ได้ตรวจคัดกรองด้วยวิธี integrated screening, stepwise sequential screening หรือ contingent sequential screening
- การตรวจคลื่นเสียงความถี่สูงในไตรมาสสองพบ soft markers ควรแปลผลและพิจารณาร่วมกับปัจจัยด้านอายุมารดา, ประวัติ และ ผลการตรวจคัดกรองการตั้งครรภ์ทารกกลุ่มอาการดาวน์
References
1. Prenatal diagnosis and fetal therapy. In: Cunningham FG, Leveno KJ, Bloom SL, Hauth JC, Rouse DJ, Spong CY, editors. Williams Obstetrics. 23 ed. New York: McGraw-Hill; 2010. p. 287-311.
2. Haddow JE, Palomaki GE. Biochemical screening for neural tube defects and Down syndrome. In: Rodeck CH, editor. Fetal medicine:Basic science and clinical practice. London: Churchill livingstone; 1999. p. 373-88.
3. ACOG Practice Bulletin No. 27: Clinical Management Guidelines for Obstetrician-Gynecologists. Prenatal diagnosis of fetal chromosomal abnormalities. Obstet Gynecol. 2001 May;97(5 Pt 1):suppl 1-12.
4. Wald NJ, Kennard A, Hackshaw A, McGuire A. Antenatal screening for Down’s syndrome. J Med Screen. 1997;4(4):181-246.
5. ACOG Practice Bulletin No. 77: screening for fetal chromosomal abnormalities. Obstet Gynecol. 2007 Jan;109(1):217-27.
6. Evans MI, Krantz DA, Hallahan TW, Galen RS. Meta-analysis of first trimester Down syndrome screening studies: free beta-human chorionic gonadotropin significantly outperforms intact human chorionic gonadotropin in a multimarker protocol. Am J Obstet Gynecol. 2007 Mar;196(3):198-205.
7. Wald NJ, Rodeck C, Hackshaw AK, Walters J, Chitty L, Mackinson AM. First and second trimester antenatal screening for Down’s syndrome: the results of the Serum, Urine and Ultrasound Screening Study (SURUSS). J Med Screen. 2003;10(2):56-104.
8. Snijders RJ, Noble P, Sebire N, Souka A, Nicolaides KH. UK multicentre project on assessment of risk of trisomy 21 by maternal age and fetal nuchal-translucency thickness at 10-14 weeks of gestation. Fetal Medicine Foundation First Trimester Screening Group. Lancet. 1998 Aug 1;352(9125):343-6.
9. Merkatz IR, Nitowsky HM, Macri JN, Johnson WE. An association between low maternal serum alpha-fetoprotein and fetal chromosomal abnormalities. Am J Obstet Gynecol. 1984 Apr 1;148(7):886-94.
10. Combining maternal serum alpha-fetoprotein measurements and age to screen for Down syndrome in pregnant women under age 35. New England Regional Genetics Group Prenatal Collaborative Study of Down Syndrome Screening. Am J Obstet Gynecol. 1989 Mar;160(3):575-81.
11. Bogart MH, Pandian MR, Jones OW. Abnormal maternal serum chorionic gonadotropin levels in pregnancies with fetal chromosome abnormalities. Prenat Diagn. 1987 Nov;7(9):623-30.
12. Wald NJ, Cuckle HS, Densem JW, Nanchahal K, Royston P, Chard T, et al. Maternal serum screening for Down’s syndrome in early pregnancy. BMJ. 1988 Oct 8;297(6653):883-7.
13. Knight GJ, Palomaki GE, Neveux LM, Fodor KK, Haddow JE. hCG and the free beta-subunit as screening tests for Down syndrome. Prenat Diagn. 1998 Mar;18(3):235-45.
14. Canick JA, Knight GJ, Palomaki GE, Haddow JE, Cuckle HS, Wald NJ. Low second trimester maternal serum unconjugated oestriol in pregnancies with Down’s syndrome. Br J Obstet Gynaecol. 1988 Apr;95(4):330-3.
15. Wald NJ, Densem JW, George L, Muttukrishna S, Knight PG. Prenatal screening for Down’s syndrome using inhibin-A as a serum marker. Prenat Diagn. 1996 Feb;16(2):143-53.
16. Wald NJ, Densem JW, Smith D, Klee GG. Four-marker serum screening for Down’s syndrome. Prenat Diagn. 1994 Aug;14(8):707-16.
17. Wald NJ, Huttly WJ, Hackshaw AK. Antenatal screening for Down’s syndrome with the quadruple test. Lancet. 2003 Mar 8;361(9360):835-6.
18. Canick JA, Messerlian GM. Laboratory issues related to maternal serum screening for Down syndrome. 2011 [updated 2011; cited 2011 Jan 18]; Available from: http://www.uptodate.com/contents/laboratory-issues-related-to-maternal-serum-screening-for-down-syndrome?source=search_result&selectedTitle=5%7E20.
19. Cuckle HS, Wald NJ, Thompson SG. Estimating a woman’s risk of having a pregnancy associated with Down’s syndrome using her age and serum alpha-fetoprotein level. Br J Obstet Gynaecol. 1987 May;94(5):387-402.
20. Noble J. Natural history of Down’s syndrome: a brief review for those involved in antenatal screening. J Med Screen. 1998;5(4):172-7.
21. Wald NJ, Smith D, Kennard A, Palomaki GE, Salonen R, Holzgreve W, et al. Biparietal diameter and crown-rump length in fetuses with Down’s syndrome: implications for antenatal serum screening for Down’s syndrome. Br J Obstet Gynaecol. 1993 May;100(5):430-5.
22. Baumgarten A. Racial difference and biological significance of maternal serum alpha-fetoprotein. Lancet. 1986 Sep 6;2(8506):573.
23. Simpson JL, Elias S, Morgan CD, Shulman L, Umstot E, Andersen RN. Second trimester maternal serum human chorionic gonadotropin and unconjugated oestriol levels in blacks and whites. Lancet. 1990 Jun 16;335(8703):1459-60.
24. Palomaki GE, Knight GJ, Haddow JE. Human chorionic gonadotropin and unconjugated oestriol measurements in insulin-dependent diabetic pregnant women being screened for fetal Down syndrome. Prenat Diagn. 1994 Jan;14(1):65-8.
25. Wald NJ, White N, Morris JK, Huttly WJ, Canick JA. Serum markers for Down’s syndrome in women who have had in vitro fertilisation: implications for antenatal screening. Br J Obstet Gynaecol. 1999 Dec;106(12):1304-6.
26. Cuckle HS, Wald NJ, Densem JW, Royston P, Knight GJ, Haddow JE, et al. The effect of smoking in pregnancy on maternal serum alpha-fetoprotein, unconjugated oestriol, human chorionic gonadotrophin, progesterone and dehydroepiandrosterone sulphate levels. Br J Obstet Gynaecol. 1990 Mar;97(3):272-4.

