การตั้งครรภ์แฝด : Multifetal Pregnancy
การตั้งครรภ์แฝด Multifetal Pregnancy
พ.ญ ชญานิษฐ์ คุณานุกุลวัฒนา
รองศาสตราจารย์ แพทย์หญิง เกษมศรี ศรีสุพรรณดิฐ
บทนำ (Introduction)
การตั้งครรภ์แฝด คือการตั้งครรภ์ที่มีทารกในครรภ์มากกว่าหนึ่งคนขึ้นไป การตั้งครรภ์แฝดเพิ่มความเสี่ยงในการเกิดภาวะแทรกซ้อนมากขึ้นทั้งในมารดาและทารก ยกเว้นภาวะแทรกซ้อนของการตั้งครรภ์เกินกำหนดและภาวะทารกในครรภ์ตัวโต โดยอัตราเสี่ยงจะเพิ่มมากขึ้นตามจำนวนของทารกในครรภ์ อัตราการเสียชีวิตของทารกในครรภ์แฝดเพิ่มมากขึ้น 4 เท่า เมื่อเทียบกับครรภ์เดี่ยว และ 12 เท่าในครรภ์แฝดสาม 1 ภาวะแทรกซ้อนที่พบได้ในมารดา ได้แก่ ความเสี่ยงในการเกิดภาวะครรภ์เป็นพิษ ภาวะตกเลือดหลังคลอด และเสียชีวิตได้ พบว่ามีความเสี่ยงเพิ่มขึ้น 2 เท่า เทียบกับครรภ์เดี่ยว 2
การจำแนกการตั้งครรภ์แฝด (Determining Chorionicity/Amnionicity)
แบ่งตาม zygosity
1. Monozygotic (Identical twin)
เกิดจากการผสมของไข่ 1 ใบ และ อสุจิ 1 ตัว แต่เกิดการแบ่งตัวได้เป็นทารก 2 คน
2. Dizygotic (Fraternal twin)
เกิดจากการผสมของไข่ 2 ใบ และ อสุจิ 2 ตัว เกิดเป็นทารก 2 คน พบว่าทารกที่มีเพศต่างกันโดยส่วนมากแล้วจะเกิดจาก dizygotic twin
แบ่งตาม chorionicity and amnionicity
การบอก chorionicity และ amnionicity เป็นสิ่งสำคัญในครรภ์แฝด เนื่องจากครรภ์แฝดชนิด monochorionic twins จะมีความเสี่ยงในการเกิดภาวะแทรกซ้อนระหว่างตั้งครรภ์ได้สูงกว่าชนิด dichorionic twins การตรวจอัลตราซาวน์เพื่อดูเยื่อกั้นระหว่างถุงการตั้งครรภ์จะสามารถวินิจฉัยได้ดีที่สุดในช่วงอายุครรภ์ 11-13+6 สัปดาห์ หากการอัลตราซาวน์ทางหน้าท้องไม่สามารถระบุเยื่อกั้นระหว่างถุงการตั้งครรภ์ได้ แนะนำให้ทำอัลตราซาวน์ทางช่องคลอด หรือส่งตัวผู้ป่วยไปพบกับแพทย์ผู้เชี่ยวชาญเฉพาะทางเพื่อตรวจเพิ่มเติม หากไม่สามารถระบุได้ ควรตรวจติดตามผู้ป่วยแบบ monochorionic twins เพื่อป้องกันภาวะแทรกซ้อนที่พบได้มากกว่า
หากอัลตราซาวน์พบว่ามีสายสะดือพันกันระหว่างแฝดสองคน ช่วยบ่งบอกว่าเป็น monochorionic twins
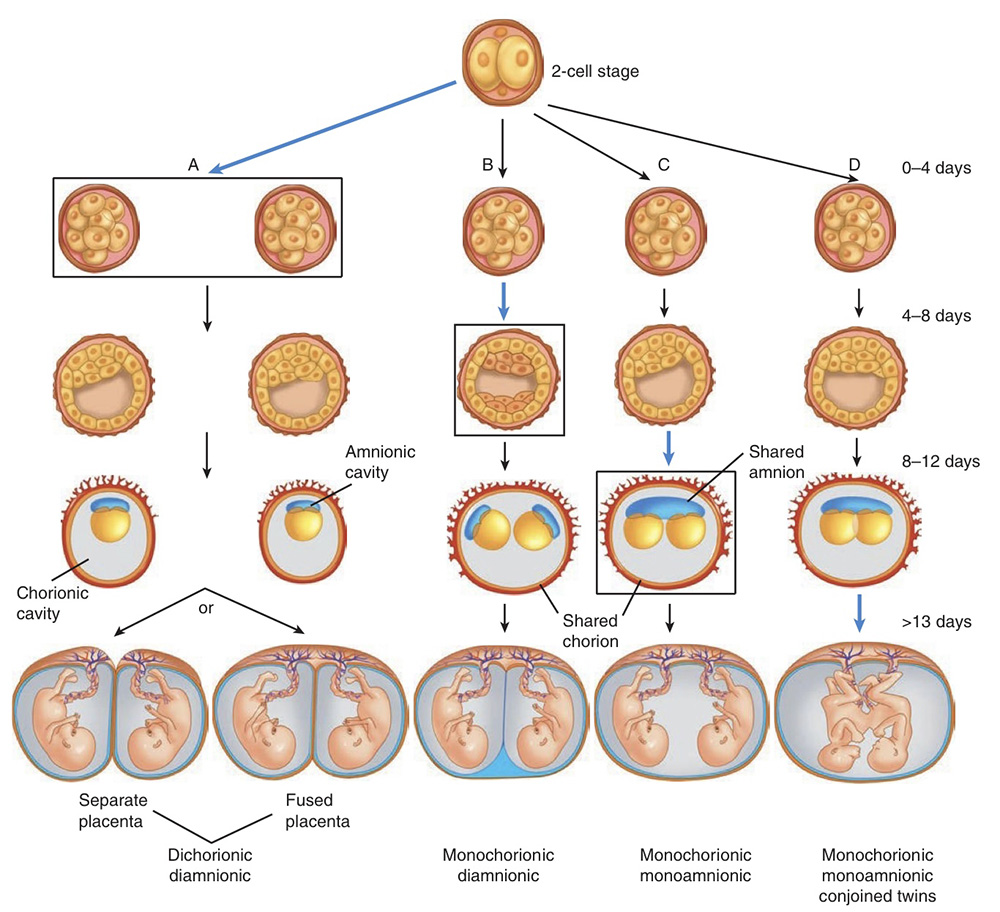
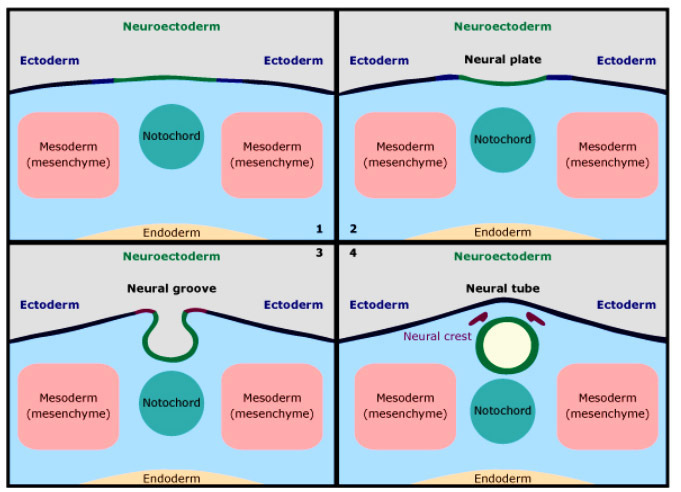
รูปที่ 1 แสดงถึงระยะเวลาที่เกิดการแบ่งตัวของ embryo
- กรอบ A คือเกิดการแบ่งตัวที่ 0-4 วัน หลังการปฏิสนธิ เกิดการแยกเป็น 2 chorion 2 amnion (dichorionic diamnionic)
- กรอบ B คือเกิดการแบ่งตัวที่ 4-8 วัน หลังการปฏิสนธิ มีการสร้าง chorion ขึ้นแล้ว จึงกลายเป็น 2 amnion (monochorionic diamnionic)
- กรอบ C คือการแบ่งตัวที่ 8-12 วันหลังการปฏิสนธิ มีการสร้าง chorion และ amnion ขึ้นแล้ว (monochorionic monoamnionic) และ D คือ การแบ่งตัวหลัง 13 วันหลังจากการปฏิสนธิ เกิดเป็น conjoined twins
(ที่มา: Cunningham FG, Leveno KJ, Dashe JS, Hoffman BL, Spong CY, Casey BM. Editors. Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022.)
ปัจจัยที่ส่งผลต่อการตั้งครรภ์แฝด (Factors affecting twinning)
1. เทคโนโลยีเจริญพันธ์ (Infertility therapy)
การกระตุ้นให้เกิดการตกไข่ด้วยการใช้ยา clomiphene citrate หรือฮอร์โมน FSH, hCG ทำให้เกิดการตกไข่หลายใบพร้อมๆกัน หรือในขั้นตอนการย้ายตัวอ่อนที่เลือกย้ายหลายตัวอ่อนเข้าฝังบริเวณโพรงมดลูก 3
2. อายุมารดาที่มากขึ้น (Advance maternal age)
ปริมาณฮอร์โมน FSH จะเพิ่มมากขึ้นตามอายุ เพื่อกระตุ้นการตกไข่ให้ดียิ่งขึ้น พบว่าปริมาณฮอร์โมน FSH ที่เพิ่มสูงมากขึ้นมีความสัมพันธ์กับ dizygotic twinning 3
3. เชื้อชาติ (Race)
อุบัติการณ์การเกิดครรภ์แฝดในกลุ่มคนผิวสีดำสูงกว่าผิวขาว ซึ่งอาจสัมพันธ์กับความแปรปรวนของปริมาณฮอร์โมน FSH ในแต่ละเชื้อชาติ 4
4. กรรมพันธุ์ (Heredity)
พบว่าในรายที่ฝ่ายหญิงมีประวัติครรภ์แฝดในครอบครัว ทำให้เพิ่มโอกาสในการเกิด dizygotic twins ได้มากขึ้น 3
5. น้ำหนักและส่วนสูงของมารดา (Maternal weight and height)
พบว่าในผู้หญิงที่มีน้ำหนักตัวมาก (BMI ≥ 30 kg/m2) และสูง (Height ≥ 164 cm.) มีโอกาสที่จะเกิด dizygotic twins ได้มากกว่าผู้หญิงที่เตี้ยร้อยละ 23-30 5, 6
Superfecundation and superfetation
Superfecundation
การที่มีไข่ตก 2 ใบ ในรอบเดือนเดียวกัน และเกิดการปฏิสนธิทั้ง 2 ใบ อาจเป็นอสุจิจากคนละคนได้ เกิดขึ้นเป็นครรภ์แฝด เรียกว่า heteropaternity
Superfetation
การที่มีไข่ตก 1 ใบ ปฏิสนธิและได้ฝังตัวในโพรงมดลูกแล้ว มีไข่ตกเพิ่มอีก 1 ใบ ในรอบเดือนถัดมา และเกิดการปฏิสนธิอีกครั้ง ทำให้เกิดเป็นครรภ์แฝดขึ้น
การวินิจฉัย (Diagnosis) 3
อาการแสดง (Clinical)
1. การตรวจความสูงของระดับมดลูก (Fundal height) แล้วมีขนาดโตกว่าอายุครรภ์
2. คลำพบรยางค์ของทารกมากกว่าหนึ่งคน
3. คลำพบศีรษะของทารกได้มากกว่าหนึ่งคน
4. ตรวจพบเสียงหัวใจเต้นแตกต่างกัน 2 บริเวณ
การตรวจคลื่นเสียงความถี่สูง (Ultrasonography)
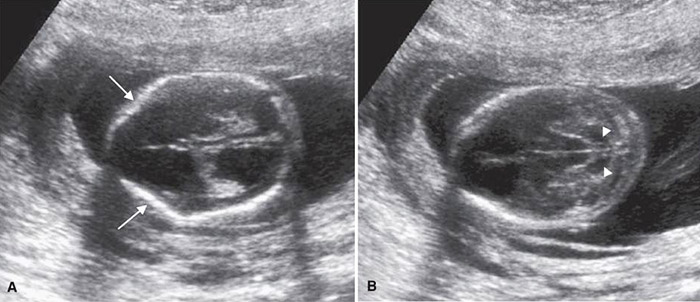
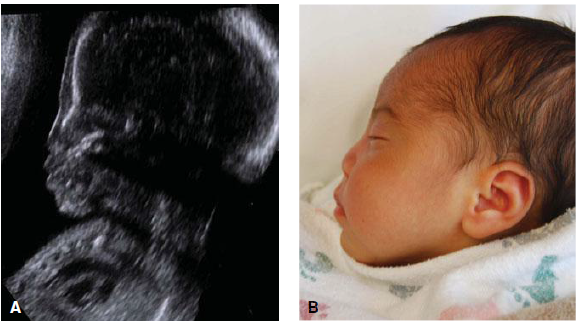
1. Twin peak sign (Lambda sign)
ลักษณะของเยื่อกั้นระหว่างทารกในแฝดชนิด dichorionic twins บริเวณที่รกทั้งสองคนมาอยู่ติดกัน เห็นเป็นลักษณะสามเหลี่ยมยื่นเข้าไปในเยื่อกั้นระหว่างทารกและด้านในคือส่วนของเนื้อรก บริเวณเยื่อกั้นทารกจะประกอบด้วย chorion 2 ชั้น และ amnion 2 ชั้น การวัดความหนาของเยื่อกั้นระหว่างทารกได้หนามากกว่าเท่ากับ 2 มิลลิเมตร 7 มีแนวโน้มที่จะเป็นการตั้งครรภ์แฝดแบบ dichorionic twins
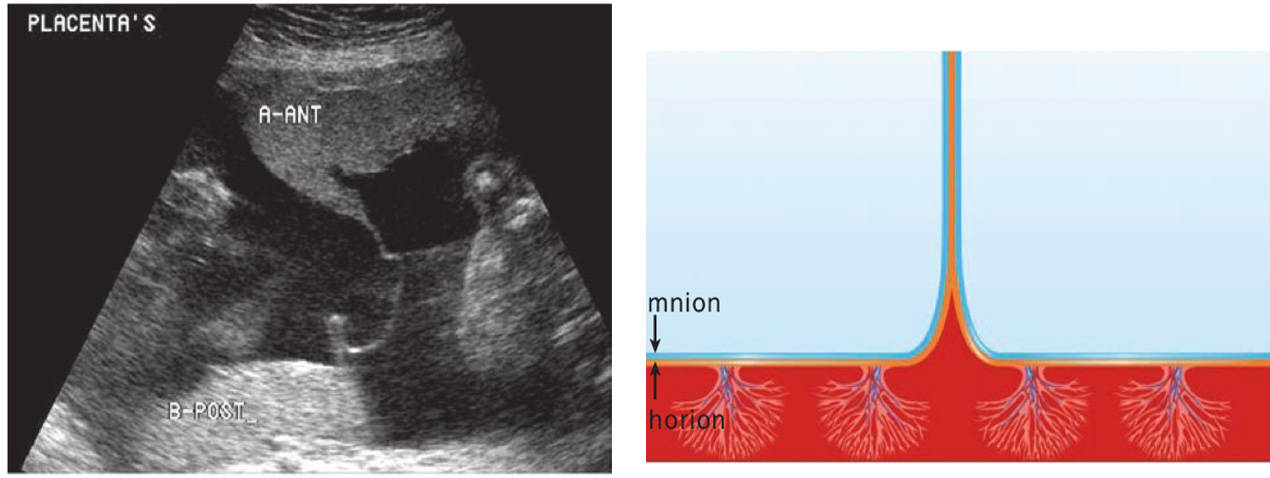
รูปที่ 2 ภาพอัลตราซาวน์และรูปแสดงลักษณะของ Lambda sign เห็น Chorion เป็นรูปสามเหลี่ยมยื่นเข้าไปบริเวณเยื่อกั้นระหว่างถุงน้ำ (ที่มา: Cunningham FG, Leveno KJ, Dashe JS, Hoffman BL, Spong CY, Casey BM. Editors. Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022.)
2. T sign
ลักษณะของเยื่อกั้นระหว่างทารกในแฝดชนิด monochorionic diamniotic twins เห็นเป็นเส้นบางๆกั้นระหว่างแฝด 2 คน เกิดจาก amnion ของแฝดทั้งสองคนมาเชื่อมติดกัน โดยทั่วไปแล้วจะใช้ค่าความหนาของเยื่อกั้นน้อยกว่า 2 มิลลิเมตร
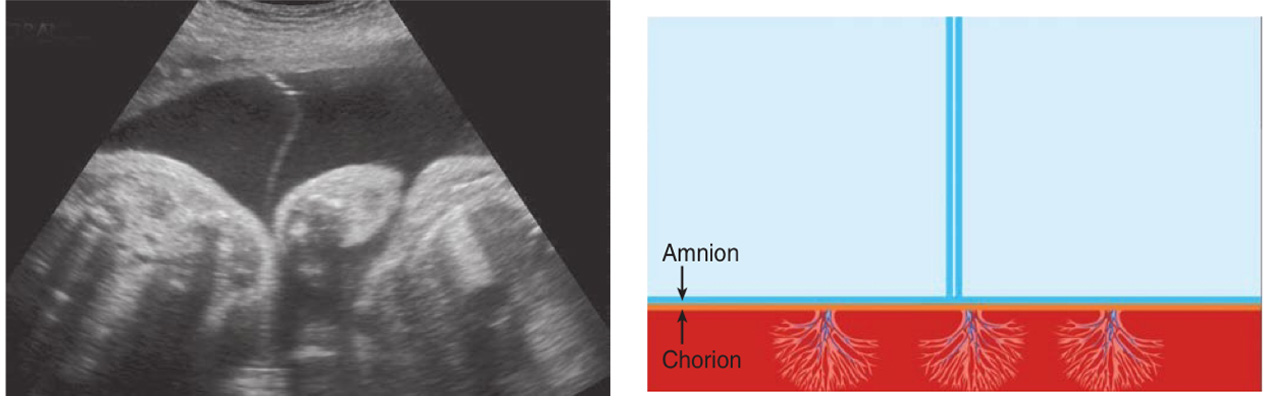
รูปที่ 3 ภาพอัลตราซาวน์และรูปแสดงลักษณะของ T sign คือ Amnion เป็นเส้นบางๆกั้นระหว่างถุงน้ำ (ที่มา: Cunningham FG, Leveno KJ, Dashe JS, Hoffman BL, Spong CY, Casey BM. Editors. Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022.)
การตรวจรก (Placental examination)
การตรวจรกหลังคลอดสามารถบอก zygosity และ Chorionicity ได้เช่นกัน จากการดูจำนวนรก จำนวน chorion และ amnion
รูปที่ 4 แสดงลักษณะของ dichorionic diamniotic เห็นเป็น chorion คั่นกลางระหว่าง amnion 2 ชั้น
(ที่มา: Cunningham FG, Leveno KJ, Dashe JS, Hoffman BL, Spong CY, Casey BM. Editors. Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022.)
ภาวะแทรกซ้อนจากการตั้งครรภ์แฝด (Pregnancy complications)
Spontaneous abortion and vanishing fetus
ครรภ์แฝดมีโอกาสเกิดการแท้งสูงกว่าครรภ์เดี่ยว และพบว่า monochorionic twins มีอัตราการแท้งสูงกว่า dichorionic twins ในบางรายพบว่าสามารถเกิดการแท้งเพียงคนเดียวได้ โดยอีกคนสามารถตั้งครรภ์ต่อไปได้ โดยหากเกิดขึ้นในไตรมาสแรก ทารกอีกคนที่แท้งไป อาจจะสลายหายไปได้ เรียกว่า vanishing fetus สามารถพบได้ร้อยละ 10-40 ของครรภ์แฝด8
Congenital anomaly
อุบัติการณ์ในการเกิดความพิการแต่กำเนิดในการตั้งครรภ์แฝดสูงกว่าการตั้งครรภ์ปกติ ในครรภ์แฝดพบได้ 406 ต่อ 10,000 และในครรภ์เดี่ยวพบได้ 238 ต่อ 10,000 และพบว่าใน monochorionic twins มีโอกาสเกิดความผิดปกติได้สูงกว่า dichorionic twin มากถึงสองเท่าตัว 9
Low birth weight
ทารกในครรภ์แฝดมีแนวโน้มที่จะมีน้ำหนักตัวน้อยกว่าทารกครรภ์เดี่ยว สาเหตุมาจาก ทารกเจริญเติบโตช้าในครรภ์ และการคลอดก่อนกำหนด
Hypertension
ความเสี่ยงในการเกิดความดันโลหิตสูงขณะตั้งครรภ์และภาวะครรภ์เป็นพิษเพิ่มมากขึ้นในครรภ์แฝด เนื่องจากมีระดับของ sFlt-1 (soluble Fms-like tyrosine kinase-1) ซึ่งเป็น antiangiogenic factors เพิ่มสูงขึ้น และ PIGF (placental growth factor) ลดลง 10
Preterm birth
พบว่าอัตราการคลอดก่อนกำหนดในครรภ์แฝดพบได้ร้อยละ 60 และร้อยละ 98 ในครรภ์แฝดสาม 11
ภาวะแทรกซ้อนที่พบใน Monochorionic twins
1. Twin-Twin transfusion syndrome (TTTS)
พบได้ร้อยละ 10-15 ใน monochorionic twins สาเหตุเกิดจากความผิดปกติของการถ่ายเทเลือดให้กันระหว่างแฝด ผ่านเชื่อมต่อของเส้นเลือด artery – vein anastomoses ทำให้มีการถ่ายเทเลือดจากเส้นเลือดแดงของแฝดผู้ให้ (donor) ไปยังเส้นเลือดดำของแฝดผู้รับ (recipient) แฝดผู้ให้จะซีด ตัวเล็ก ปริมาณเลือดในร่างกายลดลง เลือดที่มาเลี้ยงไตจึงลดลงตามไปด้วย ปัสสาวะจึงลดลง น้ำคร่ำน้อยลง (oligohydramnios) ส่วนแฝดผู้รับจะตัวแดงเนื่องจากมีปริมาณเลือดในร่างกายมาก ปัสสาวะมากขึ้น จึงมีน้ำคร่ำมาก (polyhydramnios) และเกิดภาวะหัวใจล้มเหลว บวมน้ำได้
การตรวจคัดกรอง (Screening) ภาวะ TTTS
ควรเริ่มตรวจติดตามอัลตราซาวน์ทุก 2 สัปดาห์ใน monochorionic twins เริ่มที่อายุครรภ์ 16 สัปดาห์ หากเริ่มพบความแตกต่างของปริมาณน้ำคร่ำ แต่ยังไม่เข้าเกณฑ์วินิจฉัยให้ตรวจติดตามทุก 1 สัปดาห์ 12
การแบ่งระดับความรุนแรงของ TTTS ตาม Quintero staging 13
Stage I : มีความแตกต่างของปริมาณน้ำคร่ำ ในแฝดผู้รับมีน้ำคร่ำมาก (polyhydramnios) พบมี DVP (deep vertical pocket) > 8 ซม. แฝดผู้ให้มีน้ำคร่ำน้อย (oligohydramnios) มี DVP < 2 ซม. และยังเห็นกระเพาะปัสสาวะของแฝดผู้ให้อยู่
Stage II : ไม่เห็นกระเพาะปัสสาวะของแฝดผู้ให้
Stage III : พบความผิดปกติของ doppler artery ของ umbilical artery, ductus venosus, umbilical vein
Stage IV : ทารกคนใดคนหนึ่งบวมน้ำ
Stage V : ทารกคนใดคนหนึ่งเสียชีวิต
แนวทางการรักษา (Management)
การพยากรณ์โรคขึ้นกับ Quintero stage และอายุครรภ์ที่ตรวจพบความผิดปกติ
Stage I สามารถเลือกการรักษาแบบประคับประคอง (expectant management) ตรวจติดตามและเฝ้าระวัง
หรือการใช้เลเซอร์จี้ทำลายบริเวณเส้นเลือดที่เชื่อมต่อกัน (laser ablation)
Stage II – IV สามารถเลือกใช้ได้หลายวิธี วิธีรักษาที่ดีที่สุดคือการรักษาด้วยการใช้เลเซอร์จี้ทำลายบริเวณเส้นเลือดทื่เชื่อมต่อกัน 14 โดยพบว่ามีอุบัติการณ์การเกิดซ้ำร้อยละ 14 15
การเจาะระบายน้ำคร่ำ (amnioreduction) ควรทำหลังจากอายุครรภ์ 26 สัปดาห์ 14
selective fetocide ควรทำก่อนอายุครรภ์ 20 สัปดาห์ โดยใช้ radiofrequency ablation, fetoscopic ligation, coagulation with laser
2. Twin anemia-polycythemia sequence (TAPS)
สาเหตุเกิดจากการมี arteriovenous anastomoses จากเส้นเลือดเส้นเล็ก เกิดการถ่ายเทเลือดแบบทางเดียวจากแฝดผู้ให้ไปยังแฝดผู้รับในปริมาณเล็กน้อยแต่เรื้อรัง TAPS สามารถเกิดขึ้นได้ในทุกอายุครรภ์ หรือเกิดตามหลังการทำ laser ablation ในการรักษา TTTS โดยพบได้ร้อยละ 13 และพบว่ามักเกิดขึ้นภายใน 5 สัปดาห์หลังทำ laser ablation 15
การวินิจฉัย (Diagnosis)
การวินิจฉัยขณะตั้งครรภ์ ใช้การอัลตราซาวน์ดู MCA-PSV หากมีค่ามากกว่า 1.5 MoM ในแฝดผู้ให้ และมีค่าน้อยกว่า 1 MoM ในแฝดผู้รับ จะวินิจฉัยว่ามีภาวะ TAPS ส่วนการวินิจฉัยหลังคลอด คือมีค่าฮีโมโกลบินหลังคลอดแตกต่างกันมากกว่า 8 g/dL16, 17
ตารางแสดงการแบ่งระยะของ TAPS ก่อนคลอดและหลังคลอด 16
การแบ่งระยะต่างๆของ TAPS โดยใช้ค่า MCA-PSV เพื่อแบ่งระยะตอนก่อนคลอด และใช้ค่าฮีโมโกลบินเพื่อแบ่งระยะตอนหลังคลอด โดยมีทั้งหมด 5 ระยะ ดังต่อไปนี้
| Stage | Antenatal staging | Postnatal staging
Hb difference (g/dL) |
| 1 | Donor MCA-PSV > 1.5 MoM and recipient MCA-PSV < 1 MoM, without other signs of fetal compromise | >8 |
| 2 | Donor MCA-PSV > 1.7 MoM and recipient MCA-PSV < 0.8 MoM, without other signs of fetal compromise | >11 |
| 3 | Stage 1 or 2 and cardiac compromise in donor (UA-AREDF, UV pulsatile flow, or DV increased or reversed flow) | >14 |
| 4 | Hydrops of donor twin | >17 |
| 5 | Death of one or both fetuses, preceded by TAPS | >20 |
แนวทางการรักษา (Management)
ทางเลือกของการรักษาขึ้นอยู่กับหลายปัจจัย ได้แก่ อายุครรภ์ที่วินิจฉัย, การตัดสินใจของสตรีตั้งครรภ์, ระดับความรุนแรงของตัวโรค, ความพร้อมของบุคลากรและการเข้าถึงอุปกรณ์การรักษา
ทางเลือกการรักษา ได้แก่
1. การรักษาแบบตรวจติดตามต่อเนื่อง
2. การให้คลอด
3. การใช้ laser surgery
4. การเติมเลือดให้ทารกในครรภ์ (intrauterine transfusion)
5. การยุติการตั้งครรภ์ของทารกหนึ่งคน (selective feticide)
6. การยุติการตั้งครรภ์
ส่วนการรักษาหลังคลอดแล้ว ได้แก่ การเติมเลือดให้แก่แฝดผู้ให้ และการทำ Partial exchange transfusion ให้แฝดผู้รับ
3. Twin reversed-arterial-perfusion sequence (TRAPS)
Twin reversed-arterial-perfusion sequence หรือ acardiac twin พบได้ไม่บ่อย แต่เป็นภาวะแทรกซ้อนที่รุนแรง อุบัติการณ์อยู่ที่ 1 ต่อ 35000 การคลอด โดยเกิดจากการมี artery to artery shunt ขนาดใหญ่ ทำให้เลือดดำที่ค่าออกซิเจนต่ำไหลเวียนจากแฝดผู้ให้ไปยังแฝดผู้รับ โดยไม่ผ่านรก และไหลเวียนสู่ iliac vessels ผ่านไปยังส่วนล่างของร่างกาย ทำให้ไม่มีการเจริญของอวัยวะส่วนบนของร่างกาย และแฝดผู้ให้จะมีภาวะหัวใจล้มเหลว เกิดภาวะบวมน้ำ และเสียชีวิตได้
แนวทางการรักษา (Management)
การทำ radiofrequency ablation (RFA) พบว่าอัตราการรอดชีวิตของแฝดผู้ให้หลังจากทำ RFA คือร้อยละ 80 18
4. ทารกมีการเจริญเติบโตไม่เท่ากัน (Discordant growth)
พบได้ร้อยละ 15 ในการตั้งครรภ์แฝด และหากวินิจฉัยก่อนอายุครรภ์ 20 สัปดาห์ พบว่ามีโอกาสเสียชีวิตได้ร้อยละ 8-15
การวินิจฉัย ได้แก่ ร้อยละของความแตกต่างของน้ำหนักตัวทารก คิดได้จาก
(น้ำหนักทารกที่ตัวโตกว่า – น้ำหนักทารกที่ตัวเล็กกว่า) / น้ำหนักทารกที่ตัวโตกว่า
หากมีความแตกต่างที่มากกว่าร้อยละ 20 ถือว่าทารกมีการเจริญเติบโตที่ไม่เท่ากัน
พบว่าร้อยละของความแตกต่างของน้ำหนักตัวทารกที่มีค่ามากกว่า 25-30 จะเพิ่มโอกาสการเกิดภาวะแทรกซ้อนหลังคลอดได้ เช่น ภาวะหายใจเหนื่อยหลังคลอด ภาวะเลือดออกในสมอง เนื้อเยื่อรอบโพรงสมองได้รับความเสียหาย ชัก ติดเชื้อในกระแสเลือด ลำไส้อักเสบชนิดเนื้อตาย เป็นต้น
Selective fetal growth restriction (sFGR)
การตั้งครรภ์แฝดที่มีทารกหนึ่งคนโตช้าในครรภ์ พบได้มากในช่วงปลายของมาสที่ 2 ถึงช่วงต้นของไตรมาสที่ 3 การวินิจฉัย ได้แก่ ร้อยละของความแตกต่างของน้ำหนักตัวทารกมีค่ามากกว่า 20 หรือตรวจพบว่ามีความแตกต่างของเส้นรอบวงท้องมากกว่า 20 มิลลิเมตร จะถือว่าเป็นการตั้งครรภ์แฝดที่มีทารกหนึ่งคนโตช้าในครรภ์ 3 หรือตรวจพบว่าทารกคนใดคนหนึ่งมีน้ำหนักตัวน้อยกว่าเปอร์เซ็นต์ไทล์ที่ 10 และมีความแตกต่างของน้ำหนักตัวมากกว่าร้อยละ 25 16
สาเหตุของการเกิดภาวะทารกหนึ่งคนโตช้าในครรภ์ได้แก่
1. เกิดจากการแบ่งตัวของรกขนาดไม่เท่ากัน
2. ตำแหน่งที่สายสะดือเกาะกับรกผิดปกติ เช่น velamentous insertion, marginal insertion, vasa previa
3. ตำแหน่งที่รกเกาะตัวไม่เพียงพอสำหรับรกทั้งหมด
4. ระบบไหลเวียนโลหิตระหว่างทารก 2 คนไม่เท่ากัน
5. แฝดคนใดคนหนึ่งมีความผิดปกติของอวัยวะ
6. เกิดจากความแตกต่างของพันธุกรรมในแฝด dizygotic twins เช่น แฝดเป็นคนละเพศกัน
ภาวะ selective fetal growth restriction สามารถจำแนกได้เป็น 3 กลุ่ม จาก doppler ultrasound 19
Type 1 : positive end-diastolic flow พบว่ามีการพยากรณ์โรคที่ดีกว่าแบบอื่น
Type 2 : persistently absent end-diastolic flow ในทารกที่โตช้ากว่า พบว่ามีโอกาสสูงที่จะแย่ลงกว่าเดิม และเสียชีวิตได้
Type 3 : intermittently absent or reversed end-diastolic flow มีความเสี่ยงที่จะแย่ลง น้อยกว่า type 2
แนวทางการรักษา (Management)
หากพบว่ามีภาวะ sFGR จำเป็นจะต้องตรวจติดตามดูสุขภาพทารกในครรภ์ ปริมาณน้ำคร่ำ และ umbilical artery doppler velocimetry ทุก 1 สัปดาห์ และตรวจติดตามการเจริญเติบโตของทารกทุก 3 สัปดาห์
ทารกแฝดคนหนึ่งเสียชีวิตในครรภ์ (Single fetal demise)
สาเหตุของทารกแฝดหนึ่งคนเสียชีวิตในครรภ์ พบว่ามักเกิดจาก ภาวะแทรกซ้อนของการสร้างอวัยวะที่ผิดปกติ หรือเกิดจากภาวะแทรกซ้อนของครรภ์แฝด หากเกิดขึ้นในช่วงไตรมาสแรกของการตั้งครรภ์ ทารกคนหนึ่งที่เสียชีวิตจะหายไป หรือเรียกว่า vanishing twin และเมื่อเกิดขึ้นในไตรมาสหลัง ทารกที่เสียชีวิตอาจจะถูกกดทับ เรียกว่า fetus compressus และเมื่อถูกกดทับจนแบนติดไปกับเยื่อหุ้มทารก จะเรียกว่า fetus papyraceus
ในอายุครรภ์ที่มากขึ้น เมื่อทารกคนหนึ่งเสียชีวิต ทารกอีกคนหนึ่งที่ยังมีชีวิตอยู่ พบว่ามีความเสี่ยงในการเกิด การเสียชีวิต โดยครรภ์แฝดชนิด monochorionic diamniotic จะมีความเสี่ยงเพิ่มขึ้น 16 เท่ามากกว่าครรภ์แฝดชนิด dichorionic diamniotic การคลอดก่อนกำหนด และเกิดความเสียหายต่อระบบประสาท เนื่องจากเกิดความแตกต่างของความดันในหลอดเลือดอย่างรวดเร็ว ทำให้เลือดจากแฝดที่มีชีวิตไหลผ่านรกไปหาแฝดที่เสียชีวิต ทำให้เกิดความเสียหายต่อระบบประสาทในแฝดที่ยังมีชีวิตอยู่ เกิดเป็นความพิการทางสมองที่ไม่สามารถป้องกันได้
ตารางแสดงความเสี่ยงในการเกิดภาวะแทรกซ้อนหลังจากทารกคนหนึ่งเสียชีวิตในแฝด monochorionic และ dichorionic 20
| ภาวะแทรกซ้อน | Monochorionic twins | Dichorionic twins |
| ทารกอีกคนเสียชีวิต | 15% | 3% |
| การคลอดก่อนกำหนด | 68% | 54% |
| พบความผิดปกติจากการตรวจวินิจฉัยทางรังสีบริเวณสมองหลังคลอด | 34% | 16% |
| ความผิดปกติของพัฒนาการทางสมองของทารกที่รอดชีวิต | 26% | 2% |
แนวทางการรักษาทารกอีกคนที่มีชีวิตหลังจากทารกคนหนึ่งเสียชีวิต
1. ส่งตัวผู้ป่วยเข้ารับการรักษาที่โรงพยาบาลที่มีความพร้อมด้านแพทย์ผู้เชี่ยวชาญ
2. ultrasound doppler ดู MCA-PSV
เพื่อดูลักษณะของภาวะซีดทุก 2-4 สัปดาห์
3. การรักษาแบบประคับประคองในรายที่ยังตั้งครรภ์ไม่ครบกำหนด
อายุครรภ์ที่เหมาะสมสำหรับการคลอดคือ 34-36 สัปดาห์ ร่วมกับการให้เสตอรอยด์เพื่อช่วยกระตุ้นการเจริญเติบโตของปอด
ตรวจรังสีวินิจฉัยบริเวณสมอง 4-6 สัปดาห์หลังจากทารกคนหนึ่งเสียชีวิต
4. สำหรับรายที่ตั้งครรภ์ครบกำหนดแล้วแนะนำให้คลอด
5. พูดคุยกับคนไข้เกี่ยวกับการพยากรณ์โรคของทารกในครรภ์
6. ตรวจติดตามพัฒนาการทางสมองหลังทารกคลอดครบ 2 ปี
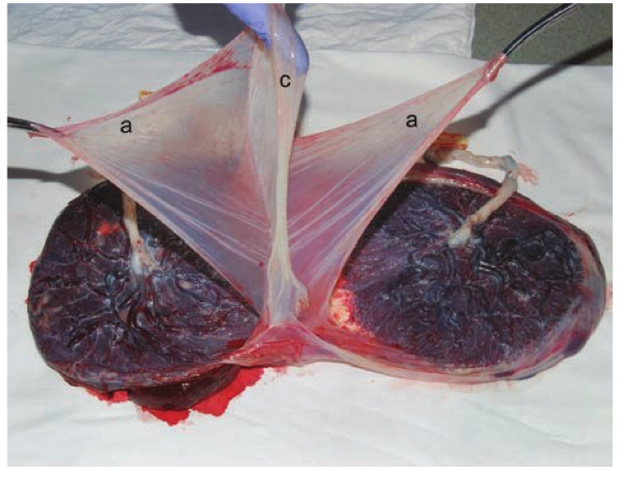
ภาวะแทรกซ้อนที่พบใน Monoamniotic twin
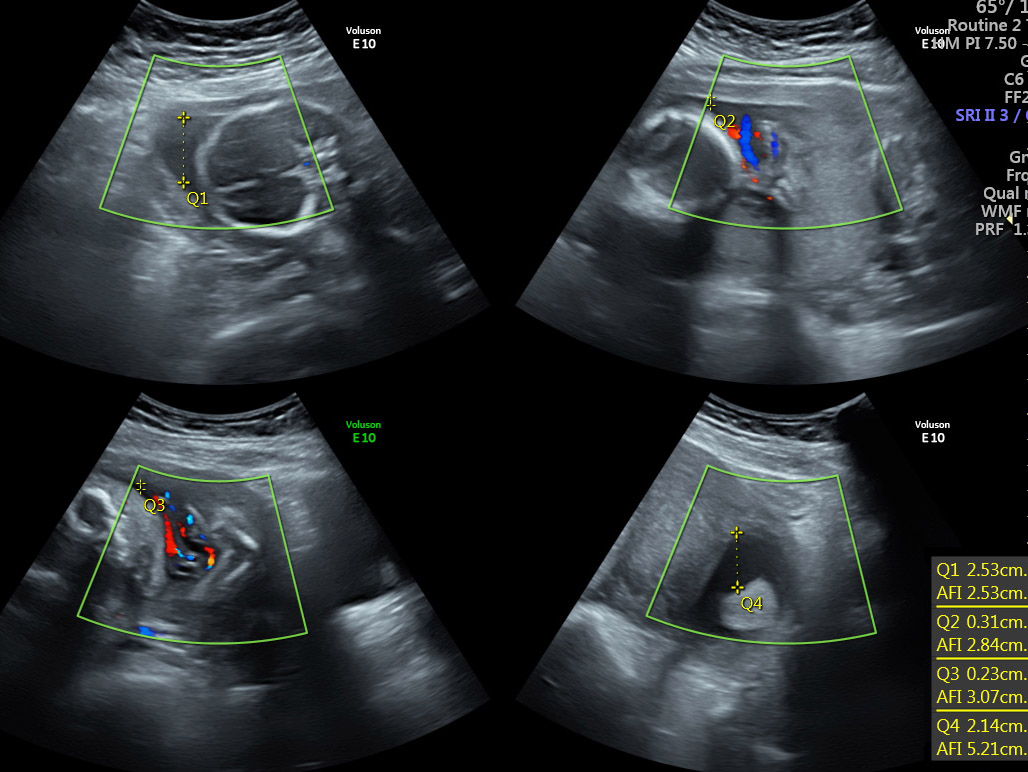
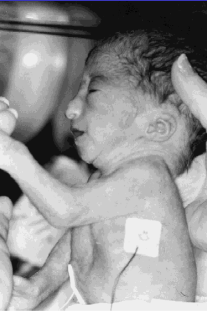
ภาวะสายสะดือพันกัน (Intertwin cord entanglement)
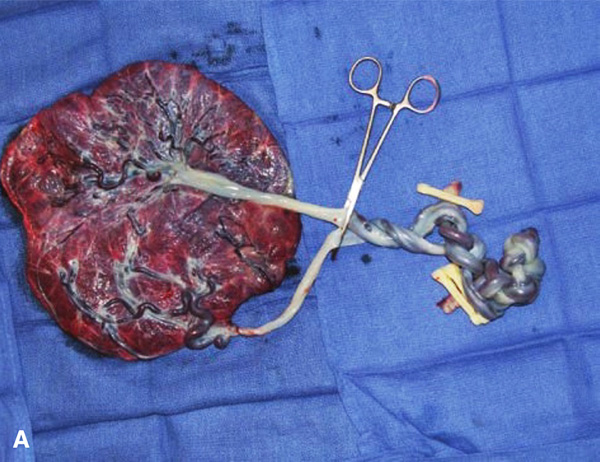
รูปที่ 5 รกของ monochorionic monoamniotic twin แสดงลักษณะของสายสะดือพันกัน
(ที่มา: Cunningham FG, Leveno KJ, Dashe JS, Hoffman BL, Spong CY, Casey BM. Editors. Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022.)
พบได้บ่อยในแฝดชนิด monochorionic monoamniotic และสามารถทำให้ทารกในครรภ์เสียชีวิตได้ สามารถใช้การทำอัลตราซาวน์ color-flow doppler ช่วยในการวินิจฉัยได้ สายสะดือมีโอกาสที่จะพันกันแบบหลวมตั้งแต่การตั้งครรภ์ไตรมาสแรก และสามารถพันกันแน่นขึ้นได้ตลอด โดยที่ไม่สามารถคาดเดาได้ก่อน
แนะนำให้นอนโรงพยาบาลตั้งแต่อายุครรภ์ 24 ถึง 28 สัปดาห์ และตรวจติดตามสุขภาพทารกในครรภ์ทุกวัน วันละ 1 ชั่วโมง และทำการผ่าตัดคลอดตอนอายุครรภ์ 32 – 24 สัปดาห์ พิจารณาให้สเตอรอยด์เพื่อกระตุ้นการทำงานของปอดทารกก่อน
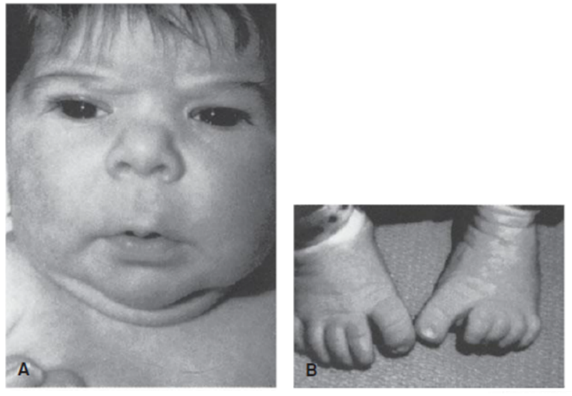
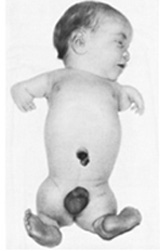
แฝดติดกัน (Conjoined twins)
พบได้ 1:100,000 การตั้งครรภ์ และพบใน monochorionic monoamniotic twin เท่านั้น วินิจฉัยได้จากอัลตราซาวน์ บริเวณที่ติดกันมากที่สุด ได้แก่ ส่วนหน้าอกติดกัน (thoracopagus) สำหรับการวางแผนการคลอด ควรเป็นการนัดผ่าตัดคลอด เนื่องจากการคลอดผ่านทางช่องคลอดมีโอกาสที่จะเกิดการคลอดติด การฉีกขาดของช่องทางคลอด มดลูกแตกได้
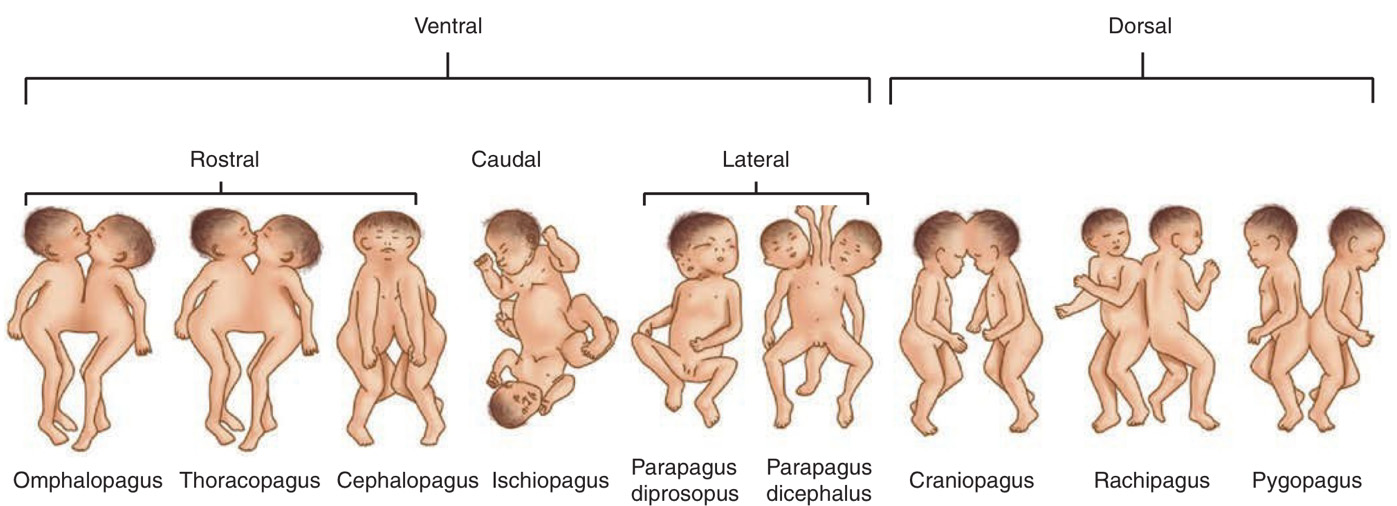
รูปที่ 6 แสดงลักษณะของแฝดที่เชื่อมต่อกันด้วยอวัยวะต่างๆ เกิดเป็น Conjoined twins (ที่มา: Cunningham FG, Leveno KJ, Dashe JS, Hoffman BL, Spong CY, Casey BM. Editors. Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022.)
ภาวะโภชนาการในหญิงตั้งครรภ์ (Nutrition in pregnancy) 21
สัดส่วนขององค์ประกอบทางโภชนาการที่เหมาะสมคือ โปรตีน : ไขมัน : คาร์โบไฮเดรต ในสัดส่วน 2 : 4 : 4 ในสตรีตั้งครรภ์แฝดปกติ ควรแบ่งมื้ออาหารออกเป็น อาหารหลัก 3 มื้อ และ อาหารมื้อย่อยอีก 3 มื้อ ในสตรีตั้งครรภ์แฝดที่มีค่าดัชนีมวลกายอยู่ต่ำกว่าเกณฑ์ปกติ BMI < 19.8 kg/m2 ควรแบ่งเป็น อาหาร 5 มื้อ ในสัดส่วนเท่ากัน น้ำหนักที่ควรเพิ่มขึ้นตลอดการตั้งครรภ์ จาก 2009 IOM guidelines แนะนำว่าน้ำหนักที่ควรเพิ่มขึ้นในแต่ละ ค่าดัชนีมวลกาย (body mass index, BMI) ค่าดัชนีมวลกายปกติ (BMI 18.5-25 kg/m2) ควรขึ้น 17-25 กิโลกรัม น้ำหนักเกิน (BMI 25-30 kg/m2) ควรขึ้น 14-23 กิโลกรัม โรคอ้วน (BMI > 30 kg/m2) ควรขึ้น 11-19 กิโลกรัม
การตรวจติดตามสุขภาพทารกในครรภ์ (Fetal surveillance) 22
1. Uncomplicated dichorionic
เริ่มตรวจติดตามที่อายุครรภ์ 36 สัปดาห์ สัปดาห์ละ 1 ครั้ง
2. Complicated dichorionic
เริ่มตรวจติดตามตั้งแต่การวินิจฉัย ความถี่ของการติดตามให้พิจารณาเป็นรายบุคคล
3. Uncomplicated monochorionic-diamniotic
เริ่มตรวจติดตามที่อายุครรภ์ 32 สัปดาห์ สัปดาห์ละ 1 ครั้ง
4. Complicated monochorionic-diamniotic
อายุครรภ์ที่เริ่มตรวจติดตามและความถี่ของการติดตามให้พิจารณาเป็นรายบุคคล
5. Monoamniotic
อายุครรภ์ที่เริ่มตรวจติดตามและความถี่ของการติดตามให้พิจารณาเป็นรายบุคคล
Routine monitoring of twin pregnancy with ultrasound 16
1. Uncomplicated dichorionic twin
อัลตราซาวน์ในไตรมาสที่ 1 และไตรมาสที่ 2 หลังจากนั้นควรตรวจติดตามทุก 4 สัปดาห์
2. Uncomplicated monochorionic twin
อัลตราซาวน์ในไตรมาสที่ 1 และตรวจติดตามทุก 2 สัปดาห์ตั้งแต่อายุครรภ์ 16 สัปดาห์ เพื่อเฝ้าระวังภาวะ TTTS และ TAPS
การป้องกันการคลอดก่อนกำหนดในครรภ์แฝด (Preterm prevention)
จากการศึกษาพบว่า การนอนพักตลอดการตั้งครรภ์ การให้ยายับยังการหดตัวของมดลูก การใช้ฮอร์โมนโปรเจสเตอโรน การเย็บผูกปากมดลูก การใช้ห่วงพยุงทางช่องคลอด พบว่าไม่ช่วยลดความเสี่ยงในการคลอดก่อนกำหนดในครรภ์แฝด 23
อายุครรภ์ที่เหมาะสมสำหรับการคลอด (Delivery time) 22
ครรภ์แฝด monochorionic monoamniotic คือ อายุครรภ์ 32-34 สัปดาห์
ครรภ์แฝด monochorionic diamniotic คือ อายุครรภ์ 34-37 สัปดาห์
ครรภ์แฝด dichorionic diamniotic คือ อายุครรภ์ 38-38+6 สัปดาห์
บทสรุป (Conclusion)
การตั้งครรภ์แฝดจัดอยู่ในกลุ่มที่มีความเสี่ยงสูงกว่าครรภ์เดี่ยว เนื่องจากต้องเฝ้าระวังภาวะแทรกซ้อนต่างๆที่สามารถเกิดขึ้นได้มากกว่าครรภ์เดี่ยว การตรวจติดตามระหว่างการฝากครรภ์จึงเป็นสิ่งสำคัญในครรภ์แฝด รวมไปถึงการเข้ารับการฝากครรภ์ที่เร็ว เพื่อที่จะสามารถแยกชนิดของครรภ์แฝดได้ และสามารถเฝ้าระวังภาวะแทรกซ้อนที่จำเพาะในแต่ละชนิดของการตั้งครรภ์แฝด
เอกสารอ้างอิง
- Mathews T, MacDorman MF, Thoma ME. Infant mortality statistics from the 2013 period linked birth/infant death data set. 2015.
- Walker MC, Murphy KE, Pan S, Yang Q, Wen SW. Adverse maternal outcomes in multifetal pregnancies. BJOG: An International Journal of Obstetrics & Gynaecology. 2004;111(11):1294-6.
- Cunningham FG, Leveno KJ, Dashe JS, Hoffman BL, Spong CY, Casey BM. Editors. Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022.
- Palomaki GE, Chiu RW, Pertile MD, Sistermans EA, Yaron Y, Vermeesch JR, et al. International Society for Prenatal Diagnosis Position Statement: cell free (cf) DNA screening for Down syndrome in multiple pregnancies. Prenatal Diagnosis. 2020;41(10):1222-32.
- Nylander PP. The factors that influence twinning rates. Acta geneticae medicae et gemellologiae: twin research. 1981;30(3):189-202.
- Reddy UM, Branum AM, Klebanoff MA. Relationship of Maternal Body Mass Index and Height to Twinning. Obstetrics & Gynecology. 2005;105(3):593-7.
- Carroll SG, Soothill PW, Abdel-Fattah SA, Porter H, Montague I, Kyle PM. Prediction of chorionicity in twin pregnancies at 10-14 weeks of gestation. Bjog. 2002;109(2):182-6.
- Harris AL, Sacha CR, Basnet KM, James KE, Freret TS, Kaimal AJ, et al. Vanishing twins conceived through fresh in vitro fertilization: obstetric outcomes and placental pathology. Obstetrics & Gynecology. 2020;135(6):1426-33.
- Glinianaia S, Rankin J, Wright C. Congenital anomalies in twins: a register-based study. Human Reproduction. 2008;23(6):1306-11.
- Faupel-Badger JM, McElrath TF, Lauria M, Houghton LC, Lim K-H, Parry S, et al. Maternal circulating angiogenic factors in twin and singleton pregnancies. American journal of obstetrics and gynecology. 2015;212(5):636. e1-. e8.
- Martin JA, Hamilton BE, JK OM, Driscoll AK. Births: final data for 2019. 2021.
- Sueters M, Middeldorp J, Lopriore E, Oepkes D, Kanhai H, Vandenbussche F. Timely diagnosis of twin‐to‐twin transfusion syndrome in monochorionic twin pregnancies by biweekly sonography combined with patient instruction to report onset of symptoms. Ultrasound in Obstetrics and Gynecology: The Official Journal of the International Society of Ultrasound in Obstetrics and Gynecology. 2006;28(5):659-64.
- Quintero RA, Morales WJ, Allen MH, Bornick PW, Johnson PK, Kruger M. Staging of twin-twin transfusion syndrome. Journal of Perinatology. 1999;19(8):550-5.
- Roberts D, Neilson JP, Kilby MD, Gates S. Interventions for the treatment of twin‐twin transfusion syndrome. Cochrane Database of Systematic Reviews. 2014(1).
- Robyr R, Lewi L, Salomon LJ, Yamamoto M, Bernard J-P, Deprest J, et al. Prevalence and management of late fetal complications following successful selective laser coagulation of chorionic plate anastomoses in twin-to-twin transfusion syndrome. American journal of obstetrics and gynecology. 2006;194(3):796-803.
- Khalil A, Rodgers M, Baschat A, Bhide A, Gratacos E, Hecher K, et al. ISUOG Practice Guidelines: role of ultrasound in twin pregnancy. Ultrasound Obstet Gynecol. 2016;47(2):247-63.
- Slaghekke F, Kist W, Oepkes D, Pasman S, Middeldorp J, Klumper F, et al. Twin anemia-polycythemia sequence: diagnostic criteria, classification, perinatal management and outcome. Fetal diagnosis and therapy. 2010;27(4):181-90.
- Lee H, Bebbington M, Crombleholme TM, Network NAFT. The North American Fetal Therapy Network Registry data on outcomes of radiofrequency ablation for twin-reversed arterial perfusion sequence. Fetal diagnosis and therapy. 2013;33(4):224-9.
- Gratacos E, Lewi L, Munoz B, Acosta‐Rojas R, Hernandez‐Andrade E, Martinez J, et al. A classification system for selective intrauterine growth restriction in monochorionic pregnancies according to umbilical artery Doppler flow in the smaller twin. Ultrasound in obstetrics & gynecology. 2007;30(1):28-34.
- Hillman SC, Morris RK, Kilby MD. Co-twin prognosis after single fetal death: a systematic review and meta-analysis. Obstetrics & Gynecology. 2011;118(4):928-40.
- Goodnight W, Newman R. Optimal nutrition for improved twin pregnancy outcome. Obstetrics & Gynecology. 2009;114(5):1121-34.
- Preboth M. ACOG guidelines on antepartum fetal surveillance. American family physician. 2000;62(5):1184-8.
- Multifetal Gestations: Twin, Triplet, and Higher-Order Multifetal Pregnancies: ACOG Practice Bulletin, Number 231. Obstet Gynecol. 2021;137(6):e145-e62.





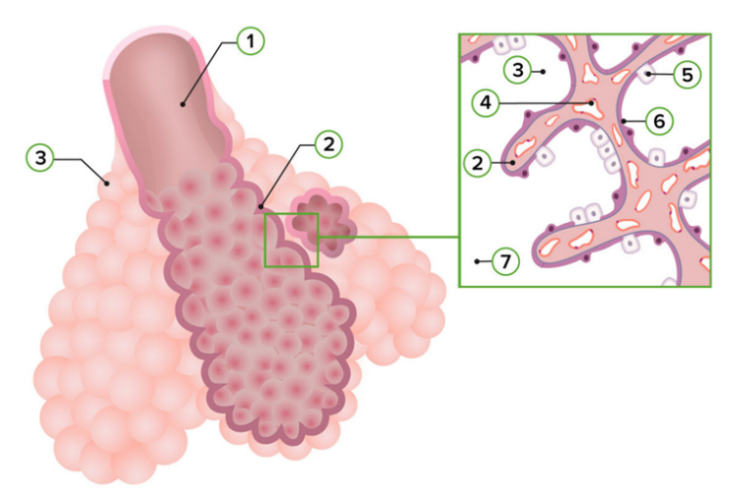
 ภาพที่ 5 แสดงลักษณะเนื้อเยื่อในระยะ Alveolar 5
ภาพที่ 5 แสดงลักษณะเนื้อเยื่อในระยะ Alveolar 5