Adolescent endometriosis
Adolescent endometriosis
นพ.ชาญฤทธิ์ พงศ์พัฒนาวุฒิ
รศ.นพ.อภิชาติ โอฬารรัตนชัย
Introduction
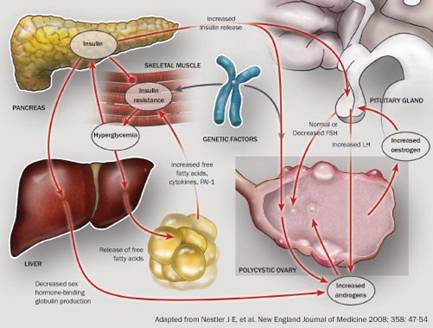
Endometriosis คือภาวะที่เยื่อบุโพรงมดลูกเจริญผิดตำแหน่งที่นอกเหนือจากภายในโพรงมดลูกปกติและสามารถถูกกระตุ้นได้ด้วยฮอร์โมน estrogen, progestin และ androgen มีหลายทฤษฎีที่ได้พยายามอธิบายถึงพยาธิกำเนิดของตัวโรค เช่น Sampson’s theory of retrograde menstruation, Hematogenous and/or lymphatic spread of endometrial tissue, Metaplastic transformation เป็นต้น แต่ก็ยังไม่มีทฤษฎีใดที่สามารถอธิบายถึงสาเหตุของการเกิด endometriosis ได้อย่างสมบูรณ์
ในอดีตเรามักจะคาดการณ์ว่าผู้ป่วยendometriosis มักจะเริ่มแสดงอาการภายหลังจากที่มีประจำเดือนหลายๆปี แต่จากข้อมูลที่มีการศึกษาในปัจจุบันกลับพบ endometriosis ได้ในกลุ่มวัยก่อนมีประจำเดือนและหลังจากเริ่มมีประจำเดือนครั้งแรกเพียง 1-5 เดือน มีการศึกษาที่สนับสนุนว่าในกลุ่มวัยรุ่นที่มีอาการปวดประจำเดือนเป็นประจำและปวดท้องน้อยเรื้อรังเป็น endometriosis ถึงร้อยละ 25-38.3 ดังนั้นการวินิจฉัยและการรักษาที่ถูกต้อง จะสามารถลดผลกระทบในด้านต่างๆ เช่น อาการปวด, การเกิดช็อดโกแลตซีสต์, การมีบุตรยากและเพิ่มคุณภาพชีวิตของกลุ่มผู้ป่วยวัยรุ่นตั้งแต่เริ่มมีอาการได้
Diagnosis of Endometriosis
Characteristics of Endometriosis in Adolescents
มีการศึกษาในกลุ่มวัยรุ่นอายุน้อยกว่า 22 ปี ที่มาด้วยอาการปวดประจำเดือนหรือปวดท้องน้อยเรื้อรัง ที่ไม่ตอบสนองต่อการรักษาโดยยาต้านอักเสบที่ไม่ใช่สเตียรอยด์ (NSAIDs) หรือยาเม็ดคุมกำเนิด (oral contraceptive pills) เมื่อตรวจวินิจฉัยเพิ่มเติมด้วย laparoscopy พบว่าร้อยละ 69.6 เป็น endometriosis และมีอาการแสดงที่หลากหลายอาการปวดพบได้ทั้งแบบcyclic และ acyclic pain ร่วมกับความผิดปกติอื่นๆ เช่น เจ็บที่ลำไส้ตรง, ปัสสาวะเป็นเลือด (Table 1) ซึ่งจะแตกต่างจากผู้ใหญ่ที่อาการปวดมักเป็นแบบ cyclic pain และมาด้วยอาการ dysmenorrhea, dyspareunia, pelvic mass,infertility
{tabulizer:style[gr.alterora.elemental_1_red.css]}
| Both acyclic and cyclic pain | 63% |
| Acyclic pain only | 28% |
| Cyclic pain only | 9% |
| Gastrointestinal pain | 34% |
| Urinary symptoms | 13% |
| Irregular menses | 9% |
| Vaginal discharge | 6% |
Table 1 Symptoms of Adolescents with Endometriosis (Adapted from Laufer, MR, Goitein, L, Bush, M, et al. J Pediatr Adolesc Gynecol 1997; 10:199.)
Evaluation of Pelvic Pain
History takings
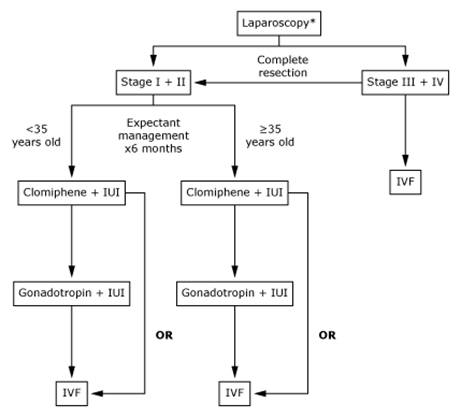
- ประวัติอาการปวดระดู ประวัติระดู ปวดท้องน้อยเรื้อรัง ความถี่และลักษณะของการปวด เพื่อพิจารณาว่ามีความสัมพันธ์กับรอบระดูหรือไม่ (Fig.1)
- อาการอื่นๆ เช่น ประวัติเจ็บลำไส้ตรง กลั้นอุจจาระไม่ค่อยได้ช่วงที่มีระดู เลือดออกทางทวารหนักหรือกระเพาะปัสสาวะในขณะที่มีระดู
- อาการปวดมีผลต่อการดำเนินชีวิตประจำวัน ต้องขาดเรียน ต้องหลีกเลี่ยงกิจกรรมบางประเภทเนื่องจากทำให้อาการปวดเพิ่มขึ้น
- ประวัติคนในครอบครัวเป็น endometriosis
- ประวัติ sexual abuse หรือ physical abuse ซึ่งพบว่าสัมพันธ์กับอาการปวดท้องน้อยเรื้อรัง
Physical examination
- จุดประสงค์ของการตรวจร่างกาย เพื่อหาสาเหตุของอาการปวดและแยกความผิดปกติของเนื้องอกรังไข่หรือความผิดปกติของอวัยวะสืบพันธ์
- ในกลุ่มวัยรุ่นที่ยังไม่เคยมีเพศสัมพันธ์ควรหลีกเลี่ยงการตรวจภายใน แต่ควรตรวจร่างกายผ่านทางหน้าท้องหรือทวารหนักแทน
- Q-tip test เพื่อแยกความผิดปกติทางกายภาพของช่องคลอด เช่น imperforate hymen, transverse vaginal septum
Investigation
- Complete blood count (CBC) และ erythrocyte sedimentation rate (ESR) เพื่อหาสาเหตุการอักเสบว่าเป็นแบบเฉียบพลันหรือเรื้อรัง
- Urinalysis และ urine culture
- Sexually transmitted disease testing เช่น wet smear, VDRL
- CA-125 ใช้ประโยชน์ในการติดตามผลการรักษา มากกว่าใช้ในการวินิจฉัยเพราะ sensitivity ต่ำ ประมาณ ร้อยละ 20-50
- Ultrasound มีประโยชน์ในการช่วยวินิจฉัยและแยกโรค endometriomaแต่พบน้อยในกลุ่มวัยรุ่น
- MRI ใช้ในการวินิจฉัยได้ดีมี sensitivity ร้อยละ 75 และบอกความผิดปกติของอวัยวะสืบพันธ์ได้ แต่ราคาแพงและไม่สะดวกในเชิงปฏิบัติ
- Laparoscopy
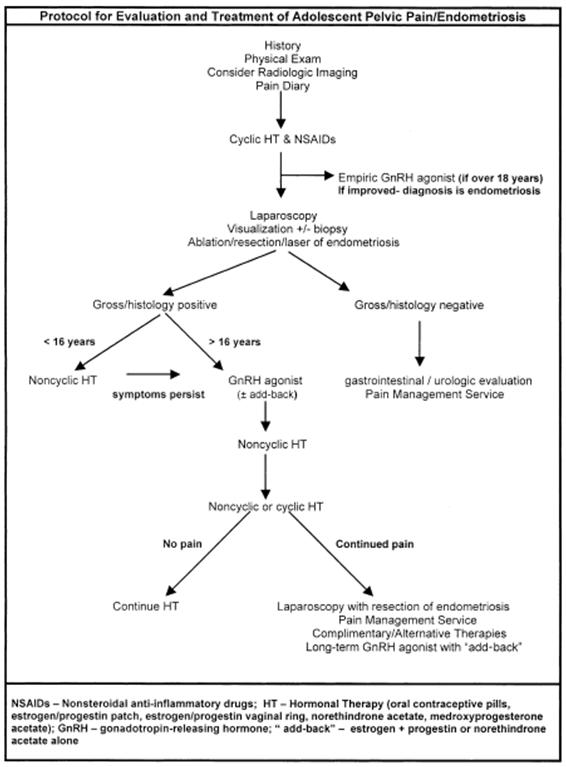
Fig.1 Management algorithm for the evaluation and treatment of pelvic pain/endometriosis
Laparoscopy
- ถือเป็น gold standard ในการวินิจฉัย endometriosis การทำแลพพาโรสโคปในกลุ่มวัยรุ่นต้องคำนึงถึงความสวยงาม หลีกเลี่ยงแผลเป็นหลังทำให้เกิดขึ้นน้อยที่สุด มีผู้แนะนำให้ลงแผลแนวตั้งที่บริเวณสะดือและ 1-2 cm เหนือ pubic symphysis เพื่อให้ pubic hair ปิดบังรอยแผลเป็น
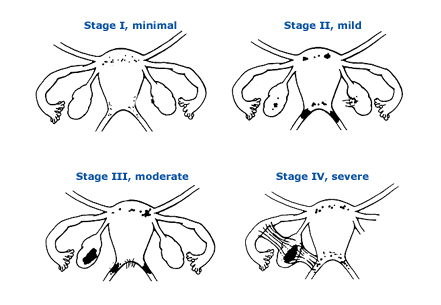
- American Society of Reproductive Medicine (ASRM) ได้แบ่งประเภทของ endometriosis (ภาพที่ 2) เมื่อเปรียบเทียบระหว่างกลุ่มวัยรุ่นและกลุ่มผู้ใหญ่พบว่า
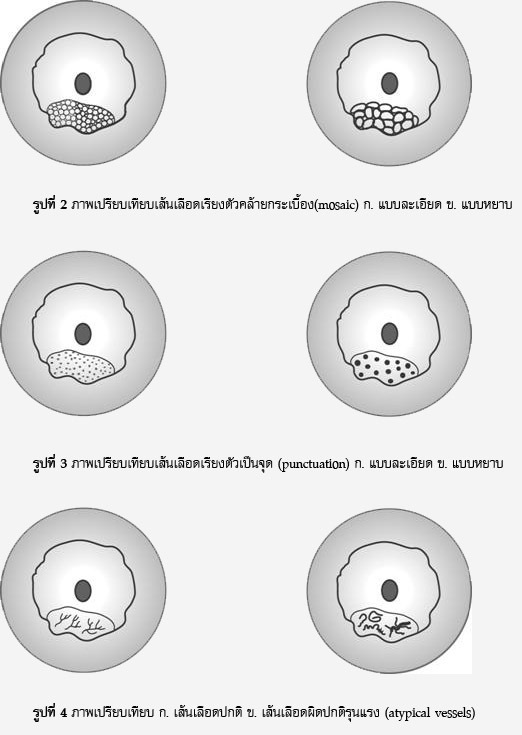
- Red flame lesions และClear lesions พบได้บ่อยในกลุ่มวัยรุ่น ซึ่งแตกต่างจากกลุ่มผู้ใหญ่ที่จะพบแบบ Powder-burn lesions มากกว่า
- ผู้ป่วย endometriosis ที่มี Clear lesions และ red lesions จะพบว่ามีอาการปวดมากที่สุด (Table2)
- Clear lesions อาจมองไม่เห็นจากการส่องแลพพาโรสโคปอาจต้องใช้ liquid distention medium ในการช่วยดูรอยโรค
- ควร biopsy ที่บริเวณ cul-de-sac กรณีที่ไม่เห็น endometriotic lesion เมื่อส่องแลพพาโรสโคป เพื่อแยก microscopic endometriosis
- กำหนดระยะความรุนแรงของ endometriosisตามแนวทางของ revised ASRM Classification of Endometriosis (Fig. 2)เพื่อใช้ประโยชน์ในการติดตามผลการรักษา
- ระยะความรุนแรงของ endometriosis ในวัยรุ่น มักพบเป็นมากในระยะ 1 และ 2 (Table3)
{tabulizer:style[gr.alterora.elemental_1_red.css]}
| Lesion type | Associated with Pain |
| Red | 84 |
| Clear | 76 |
| White | 44 |
| Black | 22 |
| Stage | Occurrence of pain, percent |
| I | 40 |
| II | 24 |
Table 2 Type of Lesion and Pain (Adapted from Demco, L. J Am Assoc Gynecol Laparosc 1998; 5:241.)
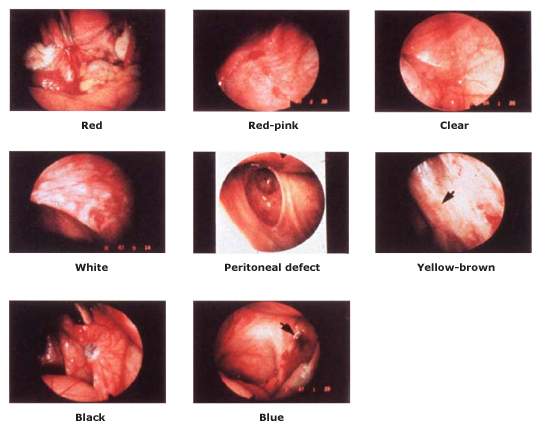
Fig. 2 ASRM classification of endometriotic lesions
{tabulizer:style[gr.alterora.elemental_1_red.css]}
| Stage | Occurrence of pain, percent |
| I | 40 |
| II | 24 |
| III | 24 |
| IV | 12 |
Table 3 Staging and Pain are Unrelated
Treatment of Endometriosis
Empiric treatment
การวินิจฉัยแยกโรคจากอาการปวดท้องน้อยเรื้อรัง สามารถวินิจฉัยโรคได้หลากหลาย เมื่อวินิจฉัยได้ว่าเป็นอาการปวดทางนรีเวชที่ไม่จำเป็นต้องผ่าตัดฉุกเฉิน เช่น primary dysmenorrhea, endometriosis หรือ adhesions สามารถทดลองรักษาด้วย NSAIDs ได้ นอกจากนี้ low-dose oral contraceptive ก็สามารถให้เพื่อลดอาการ dysmenorrhea จากผลการกดฮอร์โมนที่กระตุ้นให้เกิดการตกไข่และลดปริมาณของระดู
ในกรณีที่อาการปวดไม่ดีขึ้นภายหลังทดลองรักษาด้วย NSAIDs หรือ OCP ควรส่องแลพพาโรสโคป เพื่อวินิจฉัยแยกโรค endometriosis ภาวะปวดท้องน้อยเรื้อรังหมายถึงมีอาการปวดท้องน้อย 3-6 เดือน ซึ่งในกลุ่มวัยรุ่นควรวินิจฉัยโรคให้เร็วกว่านั้นไม่จำเป็นต้องรอให้มีอาการตามเกณฑ์ เนื่องจากมีผลต่อการหยุดเรียนหรือการทำกิจกรรมต่างๆ มีการศึกษากลุ่มวัยรุ่นที่มีอาการปวดท้องน้อยเรื้อรังที่รักษาด้วย NSAIDs หรือ OCP ไม่ได้ผล เมื่อส่องแลพพาโรสโคปพบว่าเป็น endometriosis ถึงร้อยละ 69
Surgical treatment
การรักษาโดยการผ่าตัดมักจะเลือกใช้ในรายที่ระยะของโรครุนแรง ผู้ป่วยมีอาการปวดรุนแรง หรือมีอาการฉับพลัน และจำเป็นต้องได้รับการผ่าตัด หรือในรายที่รักษาด้วยยาแล้วไม่ได้ผลในกลุ่มวัยรุ่นควรเลือกการผ่าตัดเชิงอนุรักษ์(conservative) ซึ่งผู้ป่วยจะยังสามารถตั้งครรภ์ได้ สามารถทำได้ทั้งการผ่าตัดผ่านกล้อง (laparoscopy)ซึ่งเป็นที่นิยมและการผ่าตัดเปิดหน้าท้อง (laparotomy) การผ่าตัดผ่านกล้องมีข้อได้เปรียบคือ สามารถให้การรักษาไปในครั้งเดียวกับที่ทำการวินิจฉัยได้ ระยะเวลาการนอนโรงพยาบาลน้อย
วิธีการผ่าตัดทำโดยพยายามขจัดรอยโรคออกให้หมด หรือมากที่สุดเท่าที่จะทำได้ร่วมกับรักษามดลูก ท่อนำไข่ และเนื้อของรังไข่ไว้ให้เหมือนเดิมมากที่สุดโดยวิธี coagulation, ablation หรือ resection ตรงรอยโรคด้วย electrocautery, endocoagulationหรือ laser มีรายงานว่าการรักษาโดยการผ่าตัดสามารถลดอาการปวดจาก endometriosis ได้ร้อยละ 38-100 หลังจากการผ่าตัดยังคงต้องรักษาด้วยยาเพื่อขจัดรอยโรคที่อาจหลงเหลืออยู่หรือมองไม่เห็นจากการผ่าตัด มีการศึกษาถึงผลของการรักษาโดยการผ่าตัดเพียงอย่างเดียว มีอัตราการกลับมาเป็นซ้ำประมาณร้อยละ 50 ใน 1 ปี
Medical treatment
กลุ่มผู้ป่วยวัยรุ่นที่ได้รับการวินิจฉัยว่าเป็น endometriosis ควรได้รับการรักษาด้วยยา จุดประสงค์ของการรักษาด้วยยา เพื่อรักษาอาการปวดและกดรอยโรคที่อาจหลงเหลืออยู่หลังการผ่าตัด การเลือกใช้ยาชนิดใดขึ้นกับ อาการของผู้ป่วย, รอยโรค และความร่วมมือในการใช้ยา นอกจากนี้ต้องทำความเข้าใจกับผู้ป่วยก่อนการรักษา ว่าการใช้ยาไม่ได้ทำให้ตัวโรคหรืออาการปวดหายไปทั้งหมด แต่จะช่วยบรรเทาอาการปวด ทำให้กลับมามีคุณภาพชีวิตที่ดีขึ้น สามารถทำกิจกรรมต่างๆ ได้ตามปกติ
Nonsteroidal Anti-inflamatory Agents
NSAIDs เป็นยาที่ใช้รักษาอาการ dysmenorrhea ดังที่กล่าวข้างต้น และใช้เสริมฤทธิ์ของฮอร์โมน (adjuvant agents) ในการรักษาอาการปวดท้องน้อยเรื้อรังที่มีสาเหตุจาก endometriosis
Hormonal Suppression
การรักษาด้วยยามีจุดประสงค์เพื่อยับยั้งการมีระดู ป้องกันการตกไข่ ทำให้เยื่อบุโพรงมดลูกที่เจริญผิดที่ขาดฮอร์โมนเพศไปหล่อเลี้ยงและฝ่อหายไป ทำให้อาการปวดดีขึ้นเนื่องจากยาที่ใช้ส่วนใหญ่เป็นฮอร์โมน จึงต้องพิจารณาถึงประโยชน์ โทษ และผลข้างเคียงที่อาจเกิดขึ้นในกลุ่มวัยรุ่นด้วย
Combination Estrogen and Progestin Therapy
Oral contraceptives, contraceptive patch และ vaginal ring มีส่วนประกอบของ estrogen และ progestin การให้แบบต่อเนื่องสามารถยับยั้งการหลั่ง FSH, LH ทำให้รังไข่หยุดการทำงาน ชักนำให้เกิดภาวะ pseudo-pregnancy ส่งผลให้การเจริญของเยื่อบุโพรงมดลูกที่เจริญผิดที่ฝ่อลง (atrophy) ใน OCP พบว่าช่วยลดอาการปวดระดูได้ร้อยละ 60-95 เหมาะกับกลุ่มผู้ป่วยวัยรุ่น และความรุนแรงของโรคระยะ 1 และ 2 นอกจากนี้ OCP ยังมีรายงานถึงความปลอดภัยในการใช้ในระยะยาวและไม่เพิ่ม mortality rate ส่วนการรับประทานOCP เป็นรอบนั้นไม่มีหลักฐานว่าสามารถรักษาภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ได้
Danazol
เป็นอนุพันธ์ isoxazoleของ 17 -ethinyl testosteroneมีหลายการศึกษาที่สนับสนุนถึงประสิทธิภาพในการรักษา endometriosis ว่าเทียบเท่ากับ GnRH agonistsกลไกการออกฤทธิ์ของ Danazolสามารถจับกับ sex hormone binding globulin ทำให้มีการเพิ่มขึ้นของ free testosterone ทำให้ร่างกายมีระดับของแอนโดรเจนสูง เอสโตรเจนต่ำ ทำให้ยับยั้งการเจริญของภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ และเกิดภาวะขาดประจำเดือนส่วนผลข้างเคียงของยาเกิดจากระดับของแอนโดรเจนที่สูง เอสโตรเจนที่ต่ำ ที่พบได้บ่อยคือ น้ำหนักเพิ่ม เป็นตะคริว ซึมเศร้า บวมน้ำ มีสิว ผิวมัน ขนดก เสียงแหบ มีอาการร้อนวูบวาบ เต้านมเล็กลง ความต้องการทางเพศลดลง เป็นต้น มีรายงานกลุ่มตัวอย่างร้อยละ 7 หยุดใช้ยาเนื่องจากทนอาการข้างเคียงของยาไม่ไหว และเมื่อเปรียบเทียบกับ GnRH agonists พบว่ากลุ่มตัวอย่างที่ใช้ GnRH agonists มีคุณภาพชีวิตที่ดีกว่า ดังนั้นจึงไม่ควรเลือกใช้ danazolเป็นตัวแรกกับกลุ่มผู้ป่วยวัยรุ่น
Progestins
ยาในกลุ่มนี้ได้แก่ norethindrone acetate (15 mg daily oral), medroxyprogesterone acetate (30-50 mg oral) และ depot medroxyprogesterone acetate (150 mg IM ทุก 1-3 เดือน) สามารถยับยั้งภาวะเยื่อบุโพรงมดลูกเจริญผิดที่ได้ โดยจะทำให้เกิดภาวะ decidualizationแล้วตามด้วยการฝ่อของเยื่อบุโพรงมดลูกที่อยู่ผิดที่ พบว่าสามารถช่วยลดอาการปวดระดูได้ร้อยละ 80-100 อาการข้างเคียงที่พบได้บ่อยของยาในกลุ่มนี้ คือ น้ำหนักเพิ่ม ภาวะเลือดออกผิดปกติจากโพรงมดลูก อึดอัดแน่นท้อง อาการคลื่นไส้ คัดตึงเต้านม บวมน้ำ (fluid retention) และภาวะซึมเศร้า ผลข้างเคียงระยะยาวของการใช้ depot medroxyproges-terone acetate พบว่ามีผลลดความหนาแน่นของมวลกระดูกในผู้ป่วยบางราย ดังนั้นจึงควรมีการติดตามระดับ serum estradiol หรือ bone density เป็นระยะ ส่วนผลต่อระบบหัวใจและหลอดเลือดเมื่อใช้ระยะยาวยังมีการศึกษาน้อย
Gonadotropin-Releasing Hormone Agonsts
ออกฤทธิ์โดยการยับยั้งการหลั่ง gonadotropins ซึ่งจะทำให้รังไข่หยุดทำงานเกิดภาวะที่เรียกว่า medical oophorectomy และยังช่วยลดการเกิดพังผืดโดย ลดการทำงานของ plasminogen activator และ matrix metalloproteinaseเนื่องจากยามีผลลดความหนาแน่นของมวลกระดูก จึงต้องพิจารณาก่อนตัดสินใจใช้ในกลุ่มผู้ป่วยวัยรุ่น อาจเลือกใช้ได้ในผู้ป่วยที่อายุมากกว่า 16 ปี ขึ้นไป
มีการทดลองใช้ depot leuprolideacetate 11.25 mg ฉีดยาเข้ากล้ามทุก 3 เดือน พบผลข้างเคียงจากการใช้ดังนี้คือร้อนวูบวาบ ปวดศีรษะ นอนไม่หลับ ซึมเศร้า ช่องคลอดแห้งและความต้องการทางเพศลดลง ไม่แนะนำให้ใช้ GnRH agonists ในกลุ่มผู้ป่วยที่อายุน้อยกว่า 16 ปีเพราะกระดูกยังเจริญไม่ถึงระยะสูงสุดของการสะสมมวลกระดูก (maximum bone density)ผลข้างเคียงกรณีที่ใช้ยาเป็นระยะเวลานานๆ คือ มีผลลดความหนาแน่นของมวลกระดูกอย่างถาวร ทำให้เกิดภาวะกระดูกพรุน (osteoporosis)
การให้ฮอร์โมนเสริม (add-back therapy) สามารถช่วยลดอาการแทรกซ้อนจากภาวะกระดูกพรุน และ vasomotor symptoms ได้ การให้ฮอร์โมนเสริมอาจใช้เป็นกลุ่มโปรเจสเตอโรน (progestin) เช่น norethindrone acetate 2.5-5 มิลลิกรัมต่อวัน นอกจากโปรเจสเตอโรนแล้ว อาจใช้เป็น tibolone 2.5 มิลลิกรัมต่อวัน หรือ เอสโตรเจนรวมกับโปรเจสเตอโรน เช่น conjugated estrogen 0.625 มิลลิกรัม หรือ estradiol 2 มิลลิกรัม ร่วมกับ medroxyprogesterone acetate 2.5 มิลลิกรัม หรือ norethindrone acetate 5 มิลลิกรัม แต่การศึกษาถึงผลกระทบระยะยาวของการใช้ GnRH agonist ร่วมกับ add-back therapy ยังคงไม่มีการศึกษาในกลุ่มประชากรวัยรุ่น
หากยังคงมีอาการปวดที่ไม่ตอบสนองต่อยาที่ให้เพื่อรักษาอย่างเพียงพอแล้ว ควรนึกถึงการกลับเป็นซ้ำของ endometriosis หรือ มีพังผืดเกาะที่อุ้งเชิงกรานซึ่งเกิดจาก endometriosis หรือการผ่าตัดรักษาก่อนหน้า ควรพิจารณาส่องแลพพาโรสโคปอีกครั้ง เพื่อการวินิจฉัย นอกจากนี้ยังสามารถให้การรักษากรณีเห็นรอยโรค หรือผ่าตัดพังผืดจากการส่องแลพพาโรสโคปในครั้งเดียวกัน
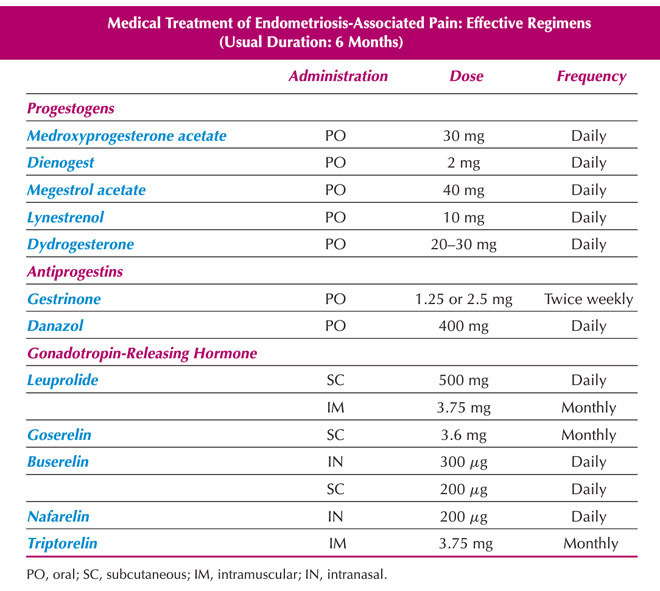
Table 3 Medical Treatment of Endometriosis-Associated Pain (usual Duration : 6 Month)
Conclusions
Endometriosis นอกจากพบได้ในกลุ่มผู้หญิงวัยเจริญพันธ์แล้ว ยังสามารถพบได้ในกลุ่มเด็กและวัยรุ่นโดยควรนึกถึงโรคนี้มากขึ้นในกลุ่มที่มาด้วยอาการปวดท้องน้อยเรื้อรัง รักษาด้วย NSAIDs และ OCP แล้วอาการยังไม่ดีขึ้น การวินิจฉัยโรคให้ได้เป็นกลไกสำคัญ ในการรักษาอาการปวด ลดการรุกรานของโรคและรักษาภาวะเจริญพันธ์ของผู้ป่วยไว้ การผ่าตัดไม่ได้ทำให้หายจากโรคแต่เป็นการเอารอยโรคทั้งหมดที่มองเห็นออกให้ได้มากที่สุดเพื่อลดอาการของโรค หลังผ่าตัดผู้ป่วยยังคงต้องได้ยาเพื่อขจัดรอยโรคที่มองไม่เห็นและป้องกันการกลับเป็นซ้ำ เพื่อยืดระยะเวลาที่ผู้ป่วยไม่มีอาการปวดให้มากที่สุดเท่าที่จะเป็นไปได้ อย่างรัยก็ตาม endometriosis ในกลุ่มวัยรุ่นยังมีอีกหลายคำถามที่ยังต้องรอคำตอบจากงานวิจัยที่จะเกิดขึ้นในอนาคต
เอกสารอ้างอิง
- Buttram VC, Jr., Reiter RC, Ward S. Treatment of endometriosis with danazol: report of a 6-year prospective study. Fertil Steril. 1985 Mar;43(3):353-60.
- Revised American Society for Reproductive Medicine classification of endometriosis: 1996.Fertil Steril. 1997 May;67(5):817-21.
- Berenson AB, Radecki CM, Grady JJ, Rickert VI, Thomas A. A prospective, controlled study of the effects of hormonal contraception on bone mineral density. Obstet Gynecol. 2001 Oct;98(4):576-82.
- Brosens I, Gordts S, Benagiano G. Endometriosis in adolescents is a hidden, progressive and severe disease that deserves attention, not just compassion. Hum Reprod. Aug;28(8):2026-31.
- Cook AS, Rock JA. The role of laparoscopy in the treatment of endometriosis.Fertil Steril. 1991 Apr;55(4):663-80.
- Davis GD, Thillet E, Lindemann J. Clinical characteristics of adolescent endometriosis. J Adolesc Health.1993 Jul;14(5):362-8.
- Demco L. Mapping the source and character of pain due to endometriosis by patient-assisted laparoscopy. J Am Assoc Gynecol Laparosc. 1998 Aug;5(3):241-5.
- Fedele L, Parazzini F, Bianchi S, Arcaini L, Candiani GB. Stage and localization of pelvic endometriosis and pain. Fertil Steril. 1990 Jan;53(1):155-8.
- Laufer MR. Identification of clear vesicular lesions of atypical endometriosis: a new technique. Fertil Steril. 1997 Oct;68(4):739-40.
- Laufer MR. Current approaches to optimizing the treatment of endometriosis in adolescents. GynecolObstet Invest. 2008;66Suppl1:19-27.
- Laufer MR, Goitein L, Bush M, Cramer DW, Emans SJ. Prevalence of endometriosis in adolescent girls with chronic pelvic pain not responding to conventional therapy. J Pediatr Adolesc Gynecol. 1997 Nov;10(4):199-202.
- Laufer MR, Sanfilippo J, Rose G. Adolescent endometriosis: diagnosis and treatment approaches. J Pediatr Adolesc Gynecol. 2003 Jun;16(3Suppl):S3-11.
- Lubianca JN, Gordon CM, Laufer MR. “Add-back” therapy for endometriosis in adolescents. J Reprod Med. 1998 Mar;43(3):164-72.
- Pittaway DE, Fayez JA. The use of CA-125 in the diagnosis and management of endometriosis. Fertil Steril. 1986 Nov;46(5):790-5.
- Propst AM, Laufer MR. Endometriosis in adolescents. Incidence, diagnosis and treatment. J Reprod Med. 1999 Sep;44(9):751-8.
- Redwine DB. Endometriosis persisting after castration: clinical characteristics and results of surgical management. Obstet Gynecol. 1994 Mar;83(3):405-13.
- Redwine DB, Yocom LB. A serial section study of visually normal pelvic peritoneum in patients with endometriosis. Fertil Steril. 1990 Oct;54(4):648-51.
- Sampson JA. Metastatic or Embolic Endometriosis, due to the Menstrual Dissemination of Endometrial Tissue into the Venous Circulation. Am J Pathol.1927 Mar;3(2):93-110 43.
- Sutton CJ, Ewen SP, Whitelaw N, Haines P. Prospective, randomized, double-blind, controlled trial of laser laparoscopy in the treatment of pelvic pain associated with minimal, mild, and moderate endometriosis. Fertil Steril. 1994 Oct;62(4):696-700.
- Templeman C. Adolescent endometriosis. Curr Opin Obstet Gynecol. Oct;24(5):288-92.
- Vercellini P, De Giorgi O, Oldani S, Cortesi I, Panazza S, Crosignani PG. Depot medroxyprogesterone acetate versus an oral contraceptive combined with very-low-dose danazol for long-term treatment of pelvic pain associated with endometriosis. Am J Obstet Gynecol. 1996 Aug;175(2):396-401.
- Vercellini P, Fedele L, Arcaini L, Bianchi S, Rognoni MT, Candiani GB. Laparoscopy in the diagnosis of chronic pelvic pain in adolescent women. J Reprod Med. 1989 Oct;34(10):827-30.
- Yamamoto K, Mitsuhashi Y, Takaike T, Takase K, Hoshiai H, Noda K. Tubal endometriosis diagnosed within one month after menarche: a case report. Tohoku J Exp Med. 1997 Mar;181(3):385-7.
- Ylikorkala O, Viinikka L. Prostaglandins and endometriosis. Acta Obstet Gynecol Scand Suppl. 1983;113:105-7.