ภาวะความดันโลหิตสูงขณะตั้งครรภ์ (Hypertension in Pregnancy)
นพ.รังสรรค์ เดชนันทพิพัฒน์
รศ. พญ. สุชยา ลือวรรณ
ภาวะความดันโลหิตสูงในหญิงตั้งครรภ์ คือ หญิงตั้งครรภ์ที่ตรวจพบความดันโลหิตในขณะหัวใจบีบตัว (Systolic blood pressure; SBP) มีค่ามากกว่าหรือเท่ากับ 140 mmHg และ/หรือตรวจพบค่าความดันโลหิตในขณะหัวใจคลายตัว (Diastolic blood pressure; DBP) มีค่ามากกว่าหรือเท่ากับ 90 mmHg ถือเป็นการตั้งครรภ์ที่มีความเสี่ยงสูง (High risk pregnancy) และ เป็นสาเหตุสำคัญของการเสียชีวิตของมารดาและทารกทั่วโลก Hypertension in pregnancy พบประมาณร้อยละ 2 – 8 ของการตั้งครรภ์ (1)
The American Collage of Obstetrician and Gynecologist; ACOG 2013 (2) ได้แบ่งภาวะ Hypertension in Pregnancy ออกเป็น 4 ประเภท
- Preeclampsia-eclampsia : ภาวะความดันโลหิตสูงที่จำเพาะกับการตั้งครรภ์ (Pregnancy-induced hypertension; PIH) ร่วมกับมีความผิดปกติของร่ายกายในหลายระบบ (multisystem involvement) โดยทั่วไปมักเกิดหลังอายุครรภ์ (Gestational age; GA) 20 สัปดาห์ ร่วมกับตรวจพบโปรตีนในปัสสาวะ (Proteinuria)
- Chronic hypertension : หญิงตั้งครรภ์ที่มีภาวะความดันโลหิตสูงตั้งแต่ก่อนตั้งครรภ์ ไม่ว่าจากสาเหตุใดใดก็ตาม หรือตรวจพบความดันโลหิตสูงก่อนอายุครรภ์ 20 สัปดาห์
- Chronic hypertension with superimposed preeclampsia : Preeclampsia ที่เกิดในหญิงตั้งครรภ์ที่เป็น Chronic hypertension โดยเกิดในมากกว่าหญิงตั้งครรภ์ที่มีความดันโลหิตปกติ 4 – 5 เท่า
- Gestational hypertension : ภาวะความดันโลหิตสูงที่จำเพาะกับการตั้งครรภ์ ที่ตรวจพบหลังอายุครรภ์ 20 สัปดาห์ แต่ไม่พบ Proteinuria
เกณฑ์การวินิจฉัย และความหลากหลายของโรค (Diagnosis and spectrum of diseases) (3)
จาก ACOG 2013 ที่ได้แบ่ง Hypertension in pregnancy ออกเป็น 4 ประเภท ในแต่ละประเภท มีภาวะย่อยที่มีลักษณะจำเพาะอีก ก่อนที่จะทราบเกณฑ์การวินิจฉัยแต่ละภาวะ จำเป็นต้องทราบความหมายของภาวะเหล่านี้ก่อน ได้แก่ New-onset Hypertension, New-onset Proteinuria, และ Severe features
New-onset Hypertension
- SBP ≥ 140 mmHg or DBP ≥ 90 mmHg on two occasions at least 4 hours OR
- SBP ≥ 160 mmHg or DBP ≥ 110 mmHg (confirm within a short interval) (~15 minutes)
New-onset Proteinuria
- • Urine protein 24 hours ≥ 300 mg OR
- • Urine protein/creatinine ratio/index (UPCI) ≥ 0.3 mg/dL OR
- • Urine Dipstick or Urine analysis reading ≥ 2+ (used only quantitative test not available)
Severe features (ONE or MORE)
- SBP ≥ 160 mmHg or DBP ≥ 110 mmHg (confirm within a short interval) (~15 minutes)
- Thrombocytopenia : Platelet < 100,000 x 109/L
- Renal insufficiency : Serum Creatinine; Cr > 1.1 mg/dL OR Doubling of serum Cr in the absence of other renal disease
- Impaired liver function : severe persistent right upper quadrant or epigastric pain unresponsive to medication and not accounted for by alternative diagnoses AND/OR abnormally elevated blood concentrations of liver enzymes (AST AND/OR ALT) to twice the upper limit normal concentration
- New-onset headache unresponsive to medication and not accounted for by alternative diagnoses AND/OR Visual disturbances
- Pulmonary edema
ในที่นี้จะแบ่งโรคต่างๆ ออกเป็น 3 กลุ่ม ตามแนวทางการรักษา ดังนี้
กลุ่มที่ 1 ” Chronic hypertension “
1. Chronic hypertension
• Hypertension ที่ตรวจพบก่อนการตั้งครรภ์ (Pregestational hypertension) หรือ
• New-onset Hypertension ที่เกิดก่อนอายุครรภ์ 20 สัปดาห์ หรือ
• โรคกลุ่ม Hypertension in pregnancy ที่ยังคงตรวจพบความดันสูงหลังคลอด 12 สัปดาห์
*** ต้องไม่มี New-onset Proteinuria : โดยปกติ hypertension สามารถทำให้เกิด hypertensive nephropathy และ proteinuria ได้ตั้งแต่ก่อนตั้งครรภ์ ดังนั้นเมื่อทราบว่าตั้งครรภ์ จะมีการส่งตรวจทางห้องปฏิบัติการ เพื่อวินิจฉัยภาวะแทรกซ้อนของ Hypertension และใช้สำหรับเปรียบเทียบผลตรวจในระหว่างการตั้งครรภ์ โดยส่ง Complete blood count; CBC, Blood urea nitrogen; BUN, Serum Cr, Serum Aspartate transaminase; AST, Serum Alanine aminotransferase; ALT, Urine analysis; UA, UPCI ตั้งแต่ครั้งแรกที่มาฝากครรภ์ (ดีที่สุดควรส่งก่อน อายุครรภ์ 20 สัปดาห์) (4) โดยเฉพาะ UPCI ส่งเพื่อประเมินว่ามี proteinuria อยู่เดิมหรือไม่ หากมี UPCI ≥ 0.3 mg/dL อยู่แล้ว เกณฑ์ New-onset Proteinuria เดิม จะไม่สามารถใช้วินิจฉัย Chronic hypertension with superimposed preeclampsia ได้ ต้องอาศัยการเพิ่มขึ้นของปริมาณโปรตีนในปัสสาวะเทียบกับผลตรวจเดิม ซึ่งปัจจุบัน ยังไม่มีเกณฑ์กำหนดว่า ต้องเพิ่มขึ้นเป็นมากน้อยเท่าไร หรืออาศัยอาการ, อาการแสดงและผลตรวจทางห้องปฏิบัติการอื่นๆ
*** ต้องไม่มี Severe features : Chronic hypertension ที่มี BP เกิน 160/110 mmHg โดยที่ไม่มี New-onset Proteinuria และ ไม่มี Severe features ถือเป็น chronic hypertension ที่คุมความดันโลหิตไม่ดี (Uncontrol chronic hypertension) การรักษาคือ การปรับเพิ่มระดับยาลดความดันโลหิต (Oral antihypertensive drug)
กลุ่มที่ 2 ” Pregnancy-induced hypertension without severe features “
โรคในกลุ่ม Preeclampsia-eclampsia, Chronic hypertension with superimposed preeclampsia และ Gestational hypertension ที่ไม่มีลักษณะของ Severe features ประกอบด้วย
2. Gestational hypertension; GHT
• New-onset Hypertension ที่เกิดหลังอายุครรภ์ 20 สัปดาห์ ร่วมกับ ไม่มี New-onset Proteinuria
*** ต้องไม่มี Severe features
*** BP ต้องไม่สูงเกิน 160/110 mmHg เพราะจะวินิจฉัยเป็น Gestational hypertension with severe-range blood pressure
*** ร้อยละ 50 ของ GHT จะตรวจพบ proteinuria หรือ end-organ dysfunction โดยเฉพาะ GHT ที่วินิจฉัยก่อนอายุครรภ์ 32 สัปดาห์ (5)
3. Preeclampsia without severe features
• New-onset Hypertension ที่เกิดหลังอายุครรภ์ 20 สัปดาห์ ร่วมกับ New-onset Proteinuria
*** ต้องไม่มี Severe features
4. Chronic hypertension with superimposed preeclampsia without severe features
• Chronic hypertension ร่วมกับ New-onset Proteinuria
*** ต้องไม่มี Severe features
กลุ่มที่ 3 ” Pregnancy-induced hypertension with severe features “
โรคในกลุ่ม Preeclampsia-eclampsia, Chronic hypertension with superimposed preeclampsia และ Gestational hypertension ที่มีลักษณะของ Severe features ตามเกณฑ์ข้างต้น หรือมี end-organ dysfunction อื่นๆ ที่เทียบเท่า Severe features เช่น ภาวะชัก (Eclampsia), สมองขาดเลือดหรือมีเลือดออกในสมอง (Stroke or intracranial hemorrhage), กล้ามเนื้อหัวใจขาดเลือดเฉียบพลัน (Acute myocardial infarction), ภาวะเลือดแข็งตัวในหลอดเลือดแบบแพร่กระจาย (Diffuse intravascular coagulation; DIC) เป็นต้น โรคในกลุ่มนี้ ได้แก่
5. Gestational hypertension with severe-range blood pressure
• GHT ที่มี SBP ≥ 160 mmHg or DBP ≥ 110 mmHg วัด 2 ครั้ง ห่างกันในระยะสั้นๆ (ประมาณ 15 นาที)
*** ต้องไม่มี Severe features
*** GHT with severe-range blood pressure ให้วินิจฉัยและรักษา เหมือนเป็น Preeclampsia with severe features (6)
6. Preeclampsia with severe features
• New-onset Hypertension ที่เกิดหลังอายุครรภ์ 20 สัปดาห์ ร่วมกับ New-onset Proteinuria ร่วมกับ Severe features
*** หากมี New-onset Hypertension ร่วมกับ Severe features แม้เพียง 1 ข้อ โดยที่ ไม่มี New-onset Proteinuria ก็ถือเป็น Preeclampsia with severe features ยกเว้น ข้อ ” SBP ≥ 160 mmHg or DBP ≥ 110 mmHg (confirm within a short interval) (~15 minutes) ” จะ ต้องมี New-onset Proteinuria ร่วมด้วย (3)
7. Chronic hypertension with superimposed preeclampsia with severe features
• Chronic hypertension ร่วมกับ New-onset Proteinuria ร่วมกับ Severe features
*** ไม่มี New-onset Proteinuria ก็ได้ เป็นไปในทำนองเดียวกัน กับข้อ 6
8. HELLP syndrome (7)
• เกณฑ์การวินิจฉัย
1. Hemolysis : Serum Lactate dehydrogenase;LDH ≥ 600 U/L หรือ มีหลักฐานอื่นของ Hemolysis เช่น Peripheral blood smear; PBS
2. Elevate Liver enzyme : AST or ALT > 2 เท่า ของ normal upper limit
3. Low Platelet : Plt < 100,000 x 109/L
*** ไม่จำเป็นต้องมี New-onset Proteinuria หรือ Severe features ก็ได้
*** หากภาวะนี้เกิดในการตั้งครรภ์ที่อายุครรภ์น้อย หรือช่วงหลังคลอด(post-partum) มากกว่า 48 ชั่งโมง พิจารณาวินิจฉัยแยกโรคอื่น (Differential diagnosis) เช่น Thrombotic thrombocytic purpura; TTP, Hemolytic uremic syndrome; HUS เป็นต้น
9. Eclampsia (8)
• New-onset tonic-clonic, focal or multifocal seizures in pregnancy (Common in late pregnancy – post-partum 48-72 hr) ที่ไม่ได้เกิดจากสาเหตุอื่น เช่น Epilepsy, cerebral ischemia, intracranial hemorrhage,หรือ drug use
*** ไม่จำเป็นต้องมี New-onset Hypertension หรือ New-onset Proteinuria หรือ Severe features ก็ได้ มีรายงานร้อยละ 20 – 38 ของผู้ป่วย Eclampsia มีอาการชัก โดยที่ไม่เคยมีอาการ hypertension หรือ ตรวจพบ proteinuria มาก่อนเลย (9)
พยาธิกำเนิดของ Preeclampsia (Pathogenesis of preeclampsia) (10, 11)
- พยาธิกำเนิดของ Preeclampsia มีหลากหลายทฤษฎี หลากหลายกลไกที่เกิดร่วมกัน ทำให้เกิดความหลากหลายของอาการและอาการแสดง (Spectrum of diseases)
- Redman (2015) ได้เสนอทฤษฎี ” Two-stage disorder “
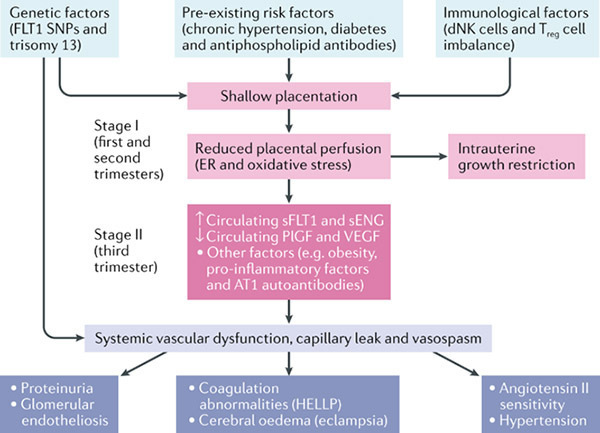
แผนภูมิที่ 1 Two stage disorder theory (10)
- Stage 1 ” Reduced placental perfusion ” เกิดช่วงไตรมาสที่ 1 และ 2 ของการตั้งครรภ์ โดยมี Genetic factors, Pre-existing risk factors และ Immunological factors เป็นปัจจัยเสี่ยง
- Immunological maladaptation : การตอบสนองของระบบภูมิคุ้มกันต่อการตั้งครรภ์ผิดปกติ ใน preeclampsia พบการทำงานของ T-helper 1 lymphocyte มากขึ้น ซึ่งส่งผลให้เกิดการกระตุ้นการสร้างสารชีวโมเลกุลที่ทำให้เกิดกระบวนการอักเสบ (Inflammatory cytokine)
- Genetic factor : preeclampsia เกี่ยวข้องกับหลายๆปัจจัย และมีหลาย gene ที่เกี่ยวข้อง (Multifactorial and polygenic disorder)
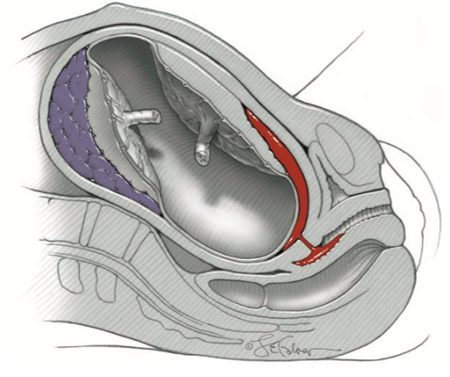
- Abnormal trophoblastic invasion : ภาวะปกติ trophoblast จะรุกล้ำเข้าไปทำลายชั้นกล้ามเนื้อเรียบ (muscular layer) ของผนัง Spiral artery และเข้าไปบุแทนที่ Endothelium ทำให้ Spiral artery ขยายออก เพื่อเพิ่มปริมาณเลือดที่มาเลี้ยงรก อีกทั้ง Spiral artery ยังสูญเสียความสามารถในการหดรัดตัว
- Trophoblastic invasion จะเกิดตลอดความยาวของ Spiral artery ในชั้น Decidua ไปจนถึงด้านใน 1 ส่วน 3 ของชั้น Myometrium แต่ใน Preeclampsia, Trophoblastic invasion จะเกิดเพียงร้อยละ 50 – 70 ของ Spiral artery ทำให้ Spiral artery ขยายน้อยกว่าการตั้งครรภ์ปกติ เลือดที่ไปเลี้ยงรกลดลง รกขาดออกซิเจน (Placental hypoxia)
ภาพที่ 1 แสดง normal and abnormal placental implantation (11)
-
- Antiangiogenic imbalance : ภาวะ placental hypoxia ทำให้เกิดการสร้าง Antiangiogenic factor ออกมา เช่น soluble fms-like tyrosine kinase 1; sFlt-1 ซึ่งสามารถจับกับ Vascular endothelial growth factor; VEGF ทำให้ VEGF ออกฤทธิ์ไม่ได้ (VEGF มีฤทธิ์ Vasodilation) ยิ่งส่งผลให้เกิด placental hypoxia
- Stage 2 ” Clinical manifestation of preeclampsia ” เกิดในช่วงไตรมาสที่สามของการตั้งครรภ์ กลไกที่เกี่ยวข้อง
- Endothelial cell dysfunction : ผลต่อเนื่องจาก Placental hypoxia จะเกิดการสร้าง Inflammatory cytokines และ Antiangiogenic factors จะกระตุ้นให้เกิดสารอนุมูลอิสระ (Reactive oxygen species) และเกิด Oxidative stress ซึ่งจะไปทำลาย Endothelium ทั่วร่างกาย ส่งผลต่างๆ ตามมามากมาย เช่น การสร้าง Nitric oxide ผิดปกติ มีผลต่อการหด-ขยายของหลอดเลือด, การเกิด Foam cell ส่งผลให้เกิด Placental atherosis, กระตุ้น micro vascular coagulation ส่งผลให้เกิด Thrombocytopenia และ เพิ่ม Capillary permeability ทำให้เกิดภาวะบวมน้ำ (edema) และ Proteinuria
การทำนายการเกิด Preeclampsia (Prediction of preeclampsia)
• ในปัจจุบัน ยังไม่มีวิธีการคัดกรองวิธีใดวิธีหนึ่ง (single test screening) ทั้งการตรวจสารชีวเคมีในร่างกาย (biochemical) และ การตรวจร่ายกาย (biophysical) ในช่วงไตรมาสที่ 1 และ 2 ของการตั้งครรภ์ ที่ดีพอในการใช้ทำนายการเกิด Preeclampsia ที่เกิดหลังอายุครรภ์ 34 สัปดาห์ (Late-onset preeclampsia) แต่พอจะใช้ทำนายการเกิด preeclampsia ที่เกิดก่อนอายุครรภ์ 34 สัปดาห์ได้ (Early-onset preeclampsia)
• The Fetal Medicine Foundation; FMF ได้เสนอแนวทางการตรวจคัดกรอง preeclampsia โดยอาศัยการตรวจหลายๆ วิธีร่วมกัน (Combined screening) ในช่วงไตรมาสแรกของการตั้งครรภ์ (GA 11 – 13 wk) ประกอบด้วย
- ประวัติความเสี่ยงของมารดา (Maternal characteristics and history) เช่น Chronic hypertension, Diabetes mellitus, Systemic lupus erythematosus, หรือ มีประวัติครอบครัวเป็น preeclampsia เป็นต้น
- ความดันโลหิตของมารดา (Maternal mean arterial pressure; MAP)
- การตรวจคลื่นความถี่สูงของ Uterine artery (Uterine artery pulsatility index; UTPI)
- การตรวจสารเคมีในเลือดของมารดา (Maternal serum marker) เช่น Placental growth factor; PLGF
นำไปคำนวณร่วมกันและแบ่งหญิงตั้งครรภ์ออกเป็น 2 กลุ่ม
- กลุ่มความเสี่ยงต่ำ (Low-risk group) หมายถึง มีความเสี่ยงต่อการเกิด preeclampsia ก่อนอายุครรภ์ 37 สัปดาห์ น้อยกว่า 1 รายต่อ การตั้งครรภ์ 100 ราย (<1:100)
- กลุ่มความเสี่ยงสูง (High-risk group) หมายถึง มีความเสี่ยงต่อการเกิด preeclampsia ก่อนอายุครรภ์ 37 สัปดาห์ มากกว่าหรือเท่ากับ 1 รายต่อ การตั้งครรภ์ 100 ราย (≥1:100) ซึ่งเป็นกลุ่มที่ได้ประโยชน์จากการใช้ยา Aspirin เพื่อป้องกันการเกิด preeclampsia โดยสามารถลดการเกิด preeclampsia ก่อนอายุครรภ์ 37 สัปดาห์ ได้ถึงร้อยละ 60
การป้องกันการเกิด Preeclampsia (Prevention of preeclampsia) (3)
- การรับประทาน Vitamin C, Vitamin E, Vitamin D, น้ำมันตับปลา (fish oil), กระเทียม (garlic) , Folic acid, การคุมปริมาณเกลือที่รับประทานในแต่ละกัน (sodium restriction) และ การพักผ่อน (bed rest) ไม่ช่วยป้องกันการเกิด preeclampsia
- การกิน Calcium เสริม (Calcium supplementation) สามารถช่วยป้องกัน preeclampsia ได้ แต่เฉพาะในประชากรกลุ่มที่เดิมกิน Calcium น้อย (low-baseline Calcium intake) (12)
- ThromboxaneA2 มีความเกี่ยวข้องกับ pathogenesis ของ preeclampsia จึงให้ Low-dose Aspirin ช่วยป้องกันการเกิด preeclampsia ได้, Low-dose Aspirin เมื่อเริ่มก่อนอายุครรภ์ 16 สัปดาห์ ช่วยป้องการการเกิด preeclampsia(Relative risk; RR 0.81), severe preeclampsia(RR 0.47) และ Intrauterine growth restriction(RR 0.56) (13)
- Recommendation (ACOG, 2019)
จากตารางที่ 1 หญิงตั้งครรภ์ที่มีความเสี่ยงในกลุ่ม High risk factors มากกว่าเท่ากับ 1 ข้อ หรือ มีความเสี่ยงในกลุ่ม Moderate risk factors มากกว่า 1 ข้อ แนะนำให้ เริ่ม Aspirin 81mg ต่อวัน ตั้งแต่อายุครรภ์ 12 – 28 สัปดาห์ (ดีที่สุด เริ่มก่อนอายุครรภ์ 16 สัปดาห์) ให้ไปจนถึงคลอด
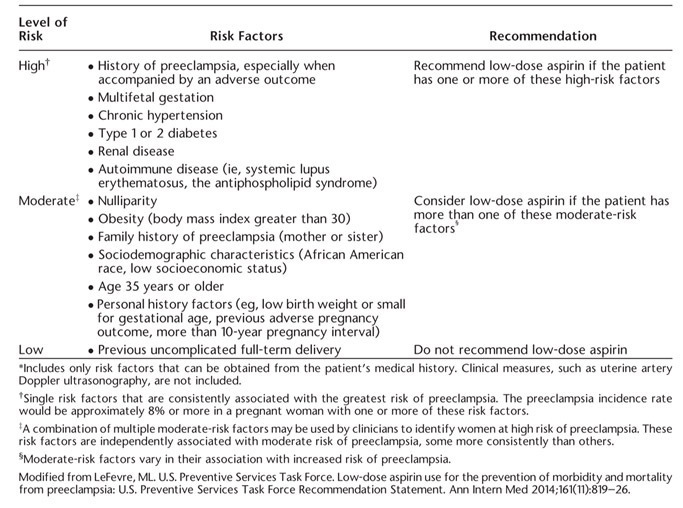
ตารางที่ 1 Clinical Risk Factors and Aspirin Use (3)
แนวทางการรักษา (Management)
กลุ่มที่ 1 ” Chronic hypertension ” (ACOG, 2019)
หลักการรักษา คือ ” ควบคุมความดันโลหิต – เฝ้าระวังการเกิด IUGR – เฝ้าระวังการเกิด superimposed preeclampsia ”
• ระยะก่อนตั้งครรภ์
- ตรวจร่างกายและตรวจทางห้องปฏิบัติการ เพื่อหาสาเหตุของความดันโลหิตสูง (Secondary hypertension), ผลกระทบตามระบบจากความดันโลหิตสูง (end-organ dysfunction) และ โรคร่วม (comorbidities) เช่น ภาวะอ้วนและโรคเบาหวาน (14)
- การควบคุมความดันโลหิตให้ดีตั้งแต่ก่อนตั้งครรภ์ ช่วยลดโอกาสเกิด IUGR และ การเกิด superimposed preeclampsia ได้
• ส่งตรวจทางห้องปฏิบัติการ
- ได้แก่ CBC, BUN, Serum Cr, AST, ALT, UPCI(หรือ Urine protein 24 hours),และ EKG 12 leads
(Echocardiogram พิจารณาเป็นรายๆไป) (15) รวมถึงตรวจหา Secondary hypertension กรณีวินิจฉัยครั้งแรก
- พิจารณาส่งตั้งแต่ครั้งแรกที่มาฝากครรภ์ (ดีที่สุด คือ ก่อนอายุครรภ์ 20 สัปดาห์) ใช้สำหรับประเมิน end-organ dysfunction ที่มีอยู่เดิม ที่อาจต้องได้รับการรักษาและใช้เปรียบเทียบผลตรวจ กรณีที่มีอาการและอาการแสดงที่สงสัย superimposed preeclampsia
• การป้องกันการเกิด superimposed preeclampsia : ให้ Aspirin เนื่องจาก Chronic hypertension เป็นหนึ่งใน High risk factors ต่อการเกิด Preeclampsia
• ปรับยาลดความดันโลหิต (Oral antihypertensive drugs) : ส่งปรึกษาอายุรแพทย์ เพื่อปรับยาลดความดันโลหิตให้เหมาะสมกับหญิงตั้งครรภ์ แนะนำเลือก Nifedipine หรือ Labetalol เป็นยาลำดับแรก ไม่แนะนำยากลุ่ม Angiotensin-Converting Enzyme Inhibitors (ACEI), Angiotensin-Receptor Blockers (ARB), Mineralocorticoid receptor antagonists เนื่องจากยาสามารถลดปริมาณเลือดที่ไปเลี้ยงไตในทารกได้ (fetal renal blood flow) ทำให้เกิดภาวะน้ำคร่ำน้อย (Oligohydramnios) (16)
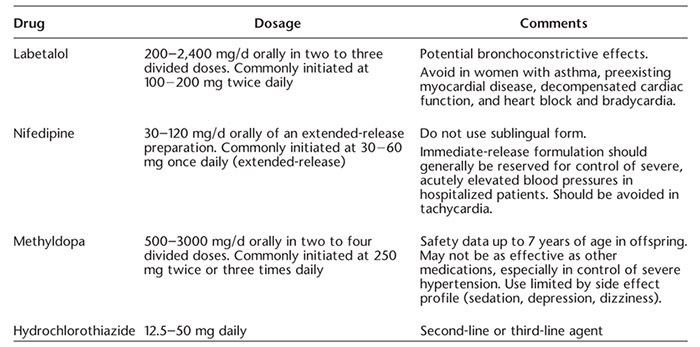
ตารางที่ 2 Common oral antihypertensive agents in pregnancy (3)
• ควบคุมความดันโลหิต
- เป้าหมาย คือ SBP 120 – 160 mmHg และ DBP 80 -110 mmHg
- กรณีที่ตั้งแต่ก่อนตั้งครรภ์ ไม่ได้รับยาลดความดันโลหิตมาก่อน หรือวินิจฉัยครั้งแรกขณะตั้งครรภ์ จะเริ่มยาลดความดันโลหิตก็ต่อเมื่อ ความดันโลหิตสูงกว่า 160/110 mmHg
• หากระหว่างการฝากครรภ์ (Antenatal care; ANC) ตรวจพบ BP ≥ 160/110 mmHg ให้พิจารณารับรักษาในโรงพยาบาล เพื่อตรวจทางห้องปฏิบัติการเพิ่มเติมและเฝ้าระวังการเกิด superimposed preeclampsia และ severe features รายละเอียดดังนี้
- ซักประวัติและตรวจร่างกาย : ประวัติการกินยาลดความดันโลหิต (Compliance), อาการปวดหัว, ตามัว, จุกแน่นลิ้นปี่, หอบเหนื่อย, น้ำหนักเพิ่มขึ้นเร็ว, และแขนขาบวมน้ำ, ตรวจร่างกายตามระบบ, ตรวจ reflex, ภาวะบวมน้ำและการตรวจครรภ์
- ส่งตรวจทางห้องปฏิบัติการ เพื่อวินิจฉัยภาวะ New-onset proteinuria : UPCI หรือ Urine protein 24 hours, ควรส่ง UA เพื่อใช้แยกการปนเปื้อน, มีเม็ดเลือดขาวในปัสสาวะ (Pyuria),หรือ ติดเชื้อในทางเดินปัสสาวะ เพราะเป็นสาเหตุของ Proteinuria ได้
- ส่งตรวจทางห้องปฏิบัติการ เพื่อวินิจฉัยภาวะ Severe features : CBC, BUN, Serum Cr, AST,และ ALT
- ให้ Short acting antihypertensive drug ภายใน 30 – 60 min (รายละเอียดในหัวข้อถัดไป)
- เฝ้าติดตามความดันโลหิต ทุก 2 – 4 ชั่วโมง
- ประเมินทารกและติดตามการเต้นของหัวใจทารก (continuous fetal monitor)
- รับรักษาในโรงพยาบาลอย่างน้อย 24 ชั่วโมง : ภายหลังการตรวจเพิ่มเติมและการเฝ้าติดตามอย่างใกล้ชิด ควรสรุปการวินิจฉัยสาเหตุของความดันโลหิตสูงในครั้งนี้ได้ การวินิจฉัยแยกโรค ได้แก่
- Superimposed preeclampsia หรือ severe features : การตรวจพบระดับกรดยูริกสูง (Hyperuricemia) และ ความเข้มข้นของเม็ดเลือดแดงสูง (Hemoconcentration) จะสนับสนุนการวินิจฉัยนี้ การรักษาจะกล่าวในหัวข้อถัดไป
- Uncontrol Chronic hypertension : ให้พิจารณาปรึกษาอายุรแพทย์ เพื่อปรับเพิ่มยา Oral Antihypertensive drugs, เมื่อสามารถควบคุมความดันได้แล้ว สามารถจำหน่ายผู้ป่วยจากโรงพยาบาลและนัดตรวจฝากครรภ์ต่อไปได้
• การตรวจติดตามทารกในครรภ์ (Antenatal fetal testing) : พิจารณาทำ Non-stress test (NST) ทุก 1 – 2 สัปดาห์ในรายที่เป็น Chronic hypertension ที่ได้รับยา, fetal IUGR, superimposed preeclampsia แต่โดยทั่วไป จะพิจารณาทำ NST ในทุกราย
• เฝ้าระวังการเกิด IUGR : Ultrasound เพื่อประเมินน้ำหนักทารก (US growth) ในช่วงไตรมาสที่ 3 (ประมาณอายุครรภ์ 28 – 32 สัปดาห์) 1 ครั้ง, จะนัดตรวจติดตาม US growth หรือ ตรวจอื่นๆ เพิ่มเติม ให้พิจารณาตามความเหมาะสม
• ช่วงเวลาที่พิจารณาให้คลอด (Timing of delivery) (4)
- Chronic hypertension ที่ไม่ได้รับยาลดความดันโลหิต : ไม่แนะนำให้คลอดก่อนอายุครรภ์ 38 สัปดาห์
- Chronic hypertension ที่ได้รับยาลดความดันโลหิต: ไม่แนะนำให้คลอดก่อนอายุครรภ์ 37 สัปดาห์
กลุ่มที่ 2 ” Pregnancy-induced hypertension without severe features ” (ACOG, 2019)
หลักการรักษา : ” เฝ้าระวังการเกิด severe features – fetal surveillance – คลอดเมื่ออายุครรภ์ ≥ 37 สัปดาห์ ”
• Preeclampsia without severe features, gestational hypertension และ Chronic hypertension with superimposed preeclampsia without severe feature มีแนวทางการรักษาที่คล้ายกัน คือ การเฝ้าระวังการเกิด severe features และ fetal surveillance เท่านั้น ไม่มีการให้ Oral antihypertensive drugs หรือยาอื่นๆ เลย
• พิจารณาให้คลอดเมื่อ
- อายุครรภ์มากกว่าเท่ากับ 37 สัปดาห์ : หากวินิจฉัยที่ GA ≥ 37 wk แนะนำ induction of labor ได้เลย
- เกิด severe features : หาก GA < 34 wk อาจพิจารณารักษาแบบประคับประคองได้ (Expectant Management) ถ้าไม่มีข้อห้าม
- เกิด Maternal หรือ fetal complication : เช่น IUGR, ทารกอยู่ในภาวะเครียดหรือคับขัน (fetal distress)เป็นต้น
• ในระหว่าง ANC หากตรวจพบ New-onset hypertension หลัง อายุครรภ์ 20 สัปดาห์ ให้ปฏิบัติดังนี้
- Admit ทุกราย เพื่อตรวจวินิจฉัยภาวะ severe feature และ เฝ้าสังเกตอาการหญิงตั้งวครรภ์และทารกอย่างใกล้ชิด (maternal and fetal monitoring)
- ซักประวัติและตรวจร่างกาย
- ตรวจวินิจฉัย New-onset proteinuria : UA และ UPCI
- ตรวจวินิจฉัยภาวะ Severe features : ส่ง PIH blood test ได้แก่ CBC, BUN, Serum Cr, AST,และ ALT, ส่วนการตรวจทางห้องปฏิบัติการเพื่อวินิจฉัยภาวะ HELLP syndrome (PBS, LDH, coagulogram) ให้พิจารณาเป็นรายๆไป
- ตรวจประเมินทารก (Fetal evaluation) : NST, US growth, ประเมินปริมาณน้ำคร่ำ (Amniotic fluid index; AFI), US ดูลักษณะของรกลอกตัวก่อนกำหนด (placental abruption), และ Doppler US (พิจารณาเป็นรายๆ ไป) (3) และ Continuous fetal monitor
- การเฝ้าสังเกตอาการ (Monitor) : วัด BP ทุก 2 – 4 ชั่วโมง (หาก BP ≥ 160/110 mmHg, จะให้การรักษาแบบ ” severe features “), อาการปวดหัว, ตามัว, จุกแน่นลิ้นปี่, และหอบเหนื่อย
- กรณีอายุครรภ์ 24 – 33+6 สัปดาห์ : เนื่องจากการดำเนินโรคของ Preeclampsia without severe feature ส่วนใหญ่จะเกิด severe features ภายในเวลาไม่กี่วัน ส่วน gestational hypertension จะ เกิดภายใน 1 – 3 สัปดาห์, หากพิจารณาแล้วหญิงครรภ์มีความเสี่ยงสูงที่จะเกิด severe features อาจพิจารณาให้ Dexamethasone เพื่อกระตุ้นการพัฒนาของปอดทารก
- สังเกตอาการอย่างน้อย 24 hours หากอาการและผลตรวจทางห้องปฏิบัติการปกติ สามารถจำหน่ายออกจากโรงพยาบาลได้
- ข้อสังเกต : ไม่มีการเริ่มยา Oral antihypertensive drugs เพราะจะบดบัง severe features, ส่วน Chronic hypertension with superimposed preeclampsia without severe feature ที่มียา Oral antihypertensive drugs อยู่เดิม ก็ไม่ควรปรับเพิ่มยา
• การดูแลรักษาแบบผู้ป่วยนอก (Outpatient management) : สามารถนัดตรวจติดตามอาการที่แผนกฝากครรภ์ต่อได้ เป็นกลุ่มการตั้งครรภ์ที่มีความเสี่ยงสูง เฝ้าระวัง severe features และตรวจประเมินหญิงตั้งครรภ์และทารกอย่างใกล้ชิด
- Maternal Monitoring
- แนะนำหญิงตั้งครรภ์ให้วัด BP ที่บ้าน ทุกวัน หาก BP ≥ 160/110 mmHg ให้รีบมาโรงพยาบาล
- แนะนำให้สังเกตอาการปวดหัว, ตามัว, จุกแน่นลิ้นปี่, และหอบเหนื่อย
- นัดฝากครรภ์ทุก 1 สัปดาห์ : ประเมิน BP, ส่งตรวจ PIH blood test ทุกครั้ง (ไม่จำเป็นต้องตรวจติดตามภาวะ proteinuria)
- เฝ้าระวังภาวะเจ็บครรภ์คลอดก่อนกำหนด (Preterm labor), ภาวะน้ำเดิน (Premature ruptured of membrane; PROM) และ ภาวะเลือดออกผิดปกติระหว่างตั้งครรภ์ (Antepartum hemorrhage)
- Fetal Monitoring (3)
- NST 1 – 2 ครั้ง ต่อสัปดาห์
- US growth ทุก 3 – 4 สัปดาห์ เฝ้าระวัง IUGR (หากมี IUGR ตรวจติดตาม ตามแนวทางการรักษา IUGR)
- US ประเมิน Amniotic fluid อย่างน้อย 1 ครั้ง ต่อสัปดาห์
- Doppler US ให้พิจารณาเป็นรายๆ ไป
- หากไม่มีภาวะแทรกซ้อน พิจารณาให้คลอดเมื่ออายุครรภ์มากกว่าเท่ากับ 37 สัปดาห์ (3)
• การดูแลรักษาในระยะคลอด (Intra-partum management)
- แนะนำคลอดทางช่องคลอด (vaginal delivery) สามารถชักนำการคลอดหรือเร่งคลอด (induction and Augmentation of labor) ด้วย Prostaglandin และ Oxytocin ได้
- Maternal Monitoring : Observe BP, อาการปวดหัว, ตามัว, จุกแน่นลิ้นปี่, และหอบเหนื่อย
- Continuous fetal monitoring
- ควบคุมรักษาอาการปวด (Adequate labor pain control) : เนื่องจากอาการปวดสามารถกระตุ้นให้เกิดความดันโลหิตสูงได้
- เฝ้าระวังการเกิด severe features, eclampsia, placental abruption,และ fetal distress
กลุ่มที่ 3 ” Pregnancy-induced hypertension with severe features ” (ACOG, 2019)
หลักการรักษา : ” ลดความดัน – ป้องกันชัก – Induction – หมั่นดูเด็ก – เช็คสมดุล ”
Definite treatment ของ Preeclampsia คือ การยุติการตั้งครรภ์ (Termination of pregnancy)
ACOG 2019 recommended
- Severe features ให้คลอด เมื่อวินิจฉัย severe features ที่อายุครรภ์มากกว่าเท่ากับ 34 สัปดาห์
- Severe features ที่อายุครรภ์น้อยกว่า 34 สัปดาห์ สามารถพิจารณารักษาแบบประคับประคอง (Expectant management) ได้ ถ้าไม่มีข้อห้าม
- หากเกิดภาวะ Preterm labor หรือ Preterm PROM ไม่แนะนำให้ยับยั้งการคลอด (Delay delivery) พิจารณาให้ Dexamethasone ตามปกติ
การดูแลรักษาในระยะคลอด (Intra-partum management)
เมื่อวินิจฉัย Severe features ให้รับรักษาในโรงพยาบาลเฝ้าติดตามอาการอย่างใกล้ชิด ไม่แนะนำให้รักษาแบบผู้ป่วยนอก กรณีพิจารณายุติการตั้งครรภ์ในหญิงตั้งครรภ์ที่ถูกวินิจฉัยเป็น severe features มีแนวทางการรักษาดังนี้
• ลดความดันโลหิต
การรักษาโดยใช้ยา (Pharmacologic treatment) : ให้ยาลดความดันโลหิตที่ออกฤทธิ์เร็ว (Short-acting antihypertensive drugs)
- จุดประสงค์ คือ ป้องกันภาวะหัวใจล้มเหลว (Congestive heart failure), myocardial infarction, renal injury,และ ischemic หรือ hemorrhagic stroke (3)
- เมื่อ SBP ≥ 160 mmHg หรือ DBP ≥ 110 mmHg วัด 2 ครั้ง ห่างกันในระยะสั้นๆ (ประมาณ 15 นาที) พิจารณาให้ Short- acting antihypertensive drugs ภายใน 30 – 60 นาที ,รักษาระดับความดันโลหิตให้น้อยกว่า 160/110 mmHg
- ยาที่แนะนำ (Most common use) : Labetalol(IV), hydralazine(IV), Nifedipine(Oral) ซึ่งมีประสิทธิภาพในการลดความดันโลหิต (efficacy) ไม่ต่างกัน (17) มีวิธีการให้และข้อควรระวังดังนี้

ตารางที่ 3 Antihypertensive agents used for urgent blood pressure control in pregnancy (3)
- เลือกให้ยาตามความเหมาะสมกับผู้ป่วย และมีลำดับการให้ดังนี้
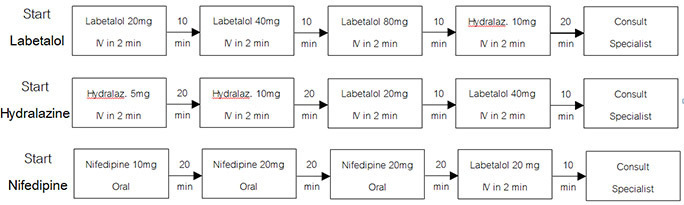
แผนภูมิที่ 2 ลำดับการให้ยา antihypertensive drugs ในการลดความดันโลหิต (18)
เมื่อ BP < 160/110 mmHg : วัด BP ทุก 10 min [1 hour] จากนั้น ทุก 15 min [1 hour] จากนั้น ทุก 30 min [1 hour] จากนั้น ทุก 1 hour [4 hours]
การรักษาแบบไม่ใช้ยา (Non-pharmacologic treatment)
- ประกอบด้วย การลดปัจจัยรบกวน, ให้หญิงตั้งครรภ์ได้พักผ่อน, Pain control, เลี่ยงการตรวจหรือหัตถการที่ทำให้เจ็บปวด เช่น ไม่ควรตรวจภายในขณะที่ยังควบคุมความดันโลหิตไม่ได้, และจัดสภาพแวดล้อมให้เหมาะสม เป็นต้น
• ป้องกันชัก (Seizure prophylaxis)
o การป้องกันการชักในหญิงตั้งครรภ์ที่ถูกวินิจฉัยเป็น preeclampsia : MgSO4 เป็น Drug of choice ในการป้องกันการชัก (RR 0.41) และ ลดการเกิด Placental abruption (RR 0.64) (19), ให้ทันที เมื่อ Diagnosis เป็นผู้ป่วยในกลุ่ม ” Pregnancy-induced hypertension with severe features ”
o Diazepam หรือ Phenytoin พิจารณาให้เป็นยาหยุดชัก (Antiepileptic drug) (กรณีชัก แล้วไม่หยุดชัก) หรือ มีข้อห้ามของการใช้ MgSO4 เช่น myasthenia gravis, hypocalcemia, moderate to severe renal failure, cardiac ischemia, heart block,และ myocarditis
o MgSO4 การบริหารยาและขนาดยา
Preparation : 50%MgSO4(นิยมใช้ผสม IV drip), 20% MgSO4,และ 10% MgSO4(นิยมใช้ IV loading)
- Intravenous route (IV) : MgSO4 4 – 6 g IV loading over 20 – 30 min then IV drip 1 – 2 g/hour เขียนคำสั่งการรักษา ดังนี้
- 10%MgSO4 40 ml(4g) Sig. IV loading over 30 min OR
- 20%MgSO4 20 ml(4g) + NSS up to 30 ml Sig. IV loading over 30 min OR
- 50%MgSO4 8 ml(4g) + NSS up to 30 ml Sig. IV loading over 30 min Then
- 50%MgSO4 80 ml + 5%DW 920 ml Sig. IV drip rate 50 ml/hr (2 g/hr)
*** กรณีมี Renal failure ( Serum Cr 1.0-1.5 mg/dL) หรือ oliguria (urine output < 30 ml/hour) ร่วมด้วย ควร loading 4 – 6 g และ maintenance IV drip 1 g/hour เพื่อป้องกัน Magnesium toxicity
- Intramuscular route (IM) : MgSO4 10 g IM ( 5 g IM in each buttock) loading then 5 g IM q 4 hour (20)
- 50%MgSO4 20 ml(10g) + 2%Xylocaine 2 ml Sig. 11 ml IM in each buttock Then
- 50%MgSO4 10 ml(5g) + 2%Xylocaine 1 ml Sig. IM in buttock q 4 hour
*** พบ Magnesium toxicity มากกว่า IV route, พิจารณาให้ IM route เมื่อไม่สามารถใส่ Intravenous catheter ได้
o MgSO4 Therapeutic level and toxicity
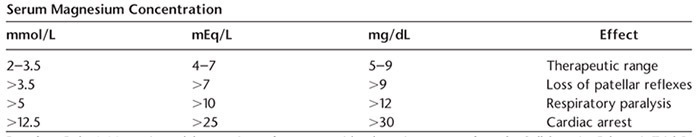
ตารางที่ 4 MgSO4 Therapeutic level and toxicity
Magnesium ขับออกทางปัสสาวะ (renal excretion), ดังนั้นขณะให้ยา มีสิ่งที่ต้องติดตามดังนี้
- Urine output : ควรใส่ Foley catheter, keep urine output > 0.5 ml/kg/hour
- Deep tendon reflex : monitor hyporeflexia/areflexia ที่ Patellar reflex เท่านั้น
- Respiration : keep RR > 14 /min
- Serum Mg : ควรติดตามในรายที่มี renal failure, monitor ทุก 4 hour
o Magnesium toxicity
- กรณีไม่มีอาการ : หาก Serum Mg > 8 mEq/L หยุดการให้ MgSO4 เจาะ Serum Mg ทุก 2 hour จนกว่า Serum Mg จะ < 7 mEq/L จึงพิจารณาเริ่มให้ MgSO4 ใหม่ในอัตราที่ลดลง
- กรณีมีอาการ
- หยุดการให้ MgSO4 เจาะ Serum Mg ทุก 2 hour
- Respiratory depression : อาจต้องใส่ท่อช่วยหายใจ (endotracheal intubation)
- Increased renal excretion : อาจพิจารณาให้ furosemide IV เพื่อขับ Magnesium ออกทางปัสสาวะ
- อาจพิจารณาให้ Anti-dote : 10%Calcium gluconate 10 ml IV over 3 min
• ยุติการตั้งครรภ์ (Termination of pregnancy)
- แนะนำคลอดทางช่องคลอด จะ Cesarean section เมื่อมีข้อบ่งชี้ทางสูติศาสตร์ อื่นๆ เช่น fetal distress, severe placental abruption, หรือ ในขณะที่กำลังรอคลอด หญิงตั้งครรภ์มีการดำเนินโรคที่แย่ลง พิจารณาแล้วคาดว่าใช้เวลานานกว่าจะคลอดเองทางช่องคลอดได้
- เริ่ม Induction หรือ Augmentation หลัง maternal stabilization (ลดความดันโลหิต, MgSO4 IV loading) อย่างน้อย 4 hours, สามารถใช้ Prostaglandin และ Oxytocin ได้ตามปกติ
- พิจารณาการคลอดแบบ Painless labor : Labor pain สามารถกระตุ้น hypertension และ Seizure ได้ แนะนำการทำ Spinal หรือ epidural anesthesia โดยมีโอกาสเกิด epidural hematoma น้อย ในรายที่ Platelet ≥ 70,000 x 109/L, ไม่มี Platelet dysfunction, ไม่มีภาวะ coagulopathy ,และ ไม่ได้กินยา antiplatelet หรือ anticoagulant อยู่ (21)
- Continue MgSO4 : ให้ MgSO4 maintenance ในระหว่าง Induction of labor, progression of labor, 2nd stage of labor ไปจนถึง post-partum 24 hours, สำหรับกรณี Cesarean section แนะนำให้ Continue MgSO4 เช่นกัน ถึงแม้ว่า MgSO4 จะทำให้เกิด prolong muscle relaxation ก็ตาม
- Shortening 2nd stage of labor : อาจพิจารณาใช้หัตถการช่วยคลอด เช่น Forceps extraction หรือ Vacuum extraction เพื่อลดการเบ่งคลอด, ลดการกระตุ้นให้เกิดความดันโลหิตสูง, ป้องกันการชัก แต่ต้องควบคุมอาการปวดให้ดี พิจารณาทำ Pudendal nerve block ก่อนทำหัตถการช่วยคลอด
• Fetal monitoring
Continuous fetal monitor, เฝ้าระวัง fetal distress, และ placental abruption
• Maternal monitoring
- Monitor ทั้งประเด็น progression of disease, progression of labor และ Magnesium toxicity
|
Time
|
Vital signs
|
Intake/Output
|
Lung
|
Clinical
|
UC
|
FHS
(bpm)
|
DTR
|
Mg level
(mg/dL)
|
Treatment
|
|
BP
(mmHg)
|
PR
(/min)
|
RR
(/min)
|
Total IV intake(ml/hr)
|
Urine output(ml/hr)
|
|
24.00
|
185/120
|
86
|
16
|
100
|
–
|
clear
|
ไม่ปวดหัว/
ตามัว/จุกลิ้นปี่
|
I2’-3’,D40-60,
moderate
|
145
|
2+
|
|
–Labetalol 20mg
-load MgSO4
|
|
1.00
|
150/100
|
76
|
15
|
120
|
70
|
clear
|
ไม่ปวดหัว/
ตามัว/จุกลิ้นปี่
|
I7’-9’,D40-60,
mild
|
150
|
2+
|
|
-Oxytocin
|
|
2.00
|
165/115
|
80
|
16
|
130
|
50
|
clear
|
ไม่ปวดหัว/
ตามัว/จุกลิ้นปี่
|
I5’-6’,D40-60,
mild
|
146
|
2+
|
|
–เพิ่มOxytocin
-Labetalol 40mg
|
|
3.00
|
148/90
|
67
|
15
|
142.5
|
45
|
clear
|
ไม่ปวดหัว/
ตามัว/จุกลิ้นปี่
|
I2’-3’,D40-60,
moderate
|
153
|
2+
|
3.25
|
–เพิ่ม MgSO4 (2.5g/hr)
|
|
4.00
|
155/100
|
100
|
28
|
142.5
|
30
|
crep
|
ไม่ปวดหัว/
ตามัว/จุกลิ้นปี่
|
I2’-3’,D40-60,
moderate
|
160
|
2+
|
|
-Intubation
-Lasix
|
ตารางที่ 5 ตัวอย่างการ monitor progression of disease, progression of labor และ Mg toxicity
จากตางรางที่ 5 มีข้อสังเกตและพึงระวัง ดังนี้
- ความดันโลหิต : หลังจากให้ short acting antihypertensive drug จน BP ลงแล้ว ให้ monitor ต่อ หาก BP สูงเกิน 160/110 mmHg กลับขึ้นมาใหม่ พิจารณาให้ยาต่อตามแผนภูมิที่ 2 เช่น Labetalol 20 mg IV คุม BP ได้ ต่อมา พบ BP สูงเกิด 160/110 mmHg จะพิจารณาให้ Labetalol 40 mg IV
- Balance fluid intake/output : ถึงแม้ว่า urine output จะมากกว่า 0.5 ml/kg/hour แต่ Total IV intake จากสารน้ำและยาต่างๆ ที่เยอะมาก จนปริมาณน้ำที่เข้าสู่ร่ายกายมากกว่าปริมาณปัสสาวะ (Fluid balance positive) ไปนานๆ อาจทำให้เกิด pulmonary edema ได้ ป้องกันได้ โดยผสมยาที่ต้องให้ เช่น Oxytocin, MgSO4 ให้เข้มข้นขึ้น เพื่อลดปริมาณ Total IV intake
- Serial PIH blood test : เพื่อดู progression of disease โดยทั่วไปหากอาการคงที่ ช่วงแรกจะส่งตรวจทางห้องปฏิบัติการทุก 6 hours แต่หากมีอาการเปลี่ยนแปลง, HELLP syndrome,หรือ DIC อาจพิจารณาส่งตรวจถี่ขึ้น
HELLP syndrome (3)
- แนวทางการรักษา ไม่แตกต่างจาก การรักษาแบบ ” Pregnancy-induced hypertension with severe features ” แต่ HELLP syndrome มีพยากรณ์โรคที่แย่กว่า ควรส่งตัวผู้ป่วยมารับการรักษาที่โรงพยาบาลระดับตติยภูมิ (Tertiary care)
- HELLP syndrome สามารถเกิดขึ้น หรือมี progression of disease ที่แย่ลงในช่วง post-partum ได้ ควรติดตามอาการ,อาการแสดง, และการตรวจทางห้องปฏิบัติการ (PIH blood test, coagulogram และ serum LDH) อย่างน้อยทุก 12 hours
- ส่วนใหญ่ Platelet และ Liver enzyme จะกลับมาปกติภายใน 7 วันหลังคลอด
- การตรวจพบ AST ≥ 2,000 IU/L และ serum LDH ≥ 3,000 IU/L จะเพิ่ม mortality risk
Eclampsia (3)
• แนวทางการรักษาไม่แตกต่างจากการรักษาแบบ ” Pregnancy-induced hypertension with severe features ”
• แนวทางการรักษาในขณะชัก
- Call for help – prevention of aspiration
- Prevention maternal injury – Oxygen therapy
- Lateral decubitus position – monitoring vital signs
• ขณะชักจะมีการหดรัดตัวของมดลูก (Uterine contraction) เพิ่มขึ้น หรือมีการหดรัดตัวของมดลูกในขณะพัก (baseline tone) สูงขึ้น ร่วมกับเกิดภาวะ maternal hypoxia และ hypercarbia ส่งผลให้ fetal tracing ผิดปกติได้ เช่น recurrent deceleration, tachycardia, reduced variability ซึ่งหลังจากให้การรักษาภาวะชักจนหยุดชักแล้ว fetal tracing สามารถกลับมาปกติได้
• การชักมักเป็นอยู่ประมาณ 1 – 2 นาที หายได้เอง ส่วนกรณีไม่หยุดชัก พิจารณาให้ Antiepileptic drug (Diazepam, phenytoin) ,MgSO4 มีผลในการป้องกันการชักซ้ำ แต่ไม่ได้มีผลในการหยุดชัก
• หากเกิด Eclampsia หรือชักซ้ำ (recurrent seizure) ในขณะที่ได้รับ MgSO4 maintenance อยู่ สาเหตุหนึ่งเกิดจาก Magnesium ยังไม่ถึง Therapeutic level การรักษาคือ
-
- bolus MgSO4 2 – 4 g IV over 5 min
• Refractory seizure คือ การชักที่ไม่ตอบสนองต่อการได้รับ MgSO4 มีเกณฑ์วินิจฉัย คือ เกิดการชักซ้ำหลัง bolus MgSO4 ภายใน 20 min หรือ เกิด recurrent seizure ≥ 2 ครั้ง (22)
- พิจารณาให้
- Sodium amobarbital 250 mg IV in 3 min OR Phenytoin 1,250 mg IV rate 50 mg/min
- ใส่ท่อช่วยหายใจ (Endotracheal intubation)
- ย้ายไปรักษาที่หอผู้ป่วยหนัก (Intensive care unit; ICU)
- Refractory seizure เป็นข้อบ่งชี้ในการส่งตรวจภาพรังสีสมอง (CT brain) เพราะ อาจมีรอยโรคที่สมองได้ เช่น infarction หรือ hemorrhage
• Eclampsia ควรให้คลอดโดยเร็ว แต่ก็ไม่ใช่ข้อบ่งชี้สำหรับ Cesarean section, สำหรับรายที่มีข้อบ่งชี้ในการคลอดแบบ Cesarean section อยู่แล้วก็ควรให้คลอดโดยเร็ว
การรักษาแบบประคับประคองในครรภ์ก่อนกำหนดที่เป็น Severe features (Expectant Management in Preterm preeclampsia with severe features) (3)
• Expectant Management คือ การให้ตั้งครรภ์ต่อ (Prolonged pregnancy) โดยยังไม่ตัดสินใจให้คลอดหรือชักนำการคลอดทันที แต่ก็ไม่ delayed delivery (Inhibit or stop labor) ในกรณีที่เกิด Preterm labor หรือ preterm PROM
• โดยปกติ เมื่อวินิจฉัย severe features, การรักษา คือ การ Termination of pregnancy เพื่อหยุดการดำเนินโรค, แต่ severe features ที่เกิดในอายุครรภ์น้อยกว่า 34 สัปดาห์ หากต้องคลอด จะมีอัตราการเกิดทุกขพลภาพและเสียชีวิตของทารกเพิ่มขึ้น
• จุดประสงค์ของ Expectant Management คือ เพื่อให้ Dexamethasone และยืดอายุครรภ์ไปจนถึง 34 สัปดาห์ แล้วพิจารณาให้คลอด (23) ดังนั้น Expectant Management เป็นแผนการรักษาที่ทำเพื่อ ลด neonatal risk แต่กลับเพิ่ม maternal risk

ตารางที่ 6 Conditions Precluding expectant management (3)
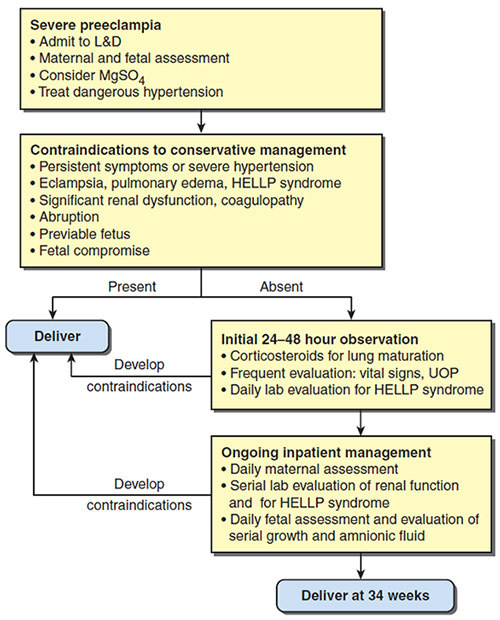
แผนภูมิที่ 3 Clinical mangement algorithm for severe preeclampsia at < 34 weeks (11)
• หลักพิจารณาหญิงตั้งครรภ์ที่เหมาะสมกับการรักษาแบบ Expectant management ได้แก่ (23)
- Maternal condition คงที่พอที่จะ delayed delivery ได้
- Fetal condition คงที่พอที่จะ delayed delivery ได้
- มีประโยชน์จากการได้รับ dexamethasone และ prolong pregnancy
- ข้อห้ามของ Expectant management ดังแสดงในตารางที่ 6
• โรงพยาบาลและบุคลากร ต้องมีความพร้อม สามารถเฝ้าอาการได้อย่างใกล้ชิด, สามารถให้การรักษากรณีเร่งด่วนได้ เช่น ส่งตรวจทางห้องปฏิบัติการได้ตลอดเวลา, สามารถทำ Cesarean section ได้ทันที, และมี Neonatal intensive care unit; NICU ที่มีกุมารแพทย์พร้อมตลอดเวลา
• Expectant Management มีแนวทางปฏิบัติดังนี้
- Admit Labor room หรือ ICU
- Short-acting antihypertensive drug (if indicated)
- MgSO4 IV ให้ 24 – 48 hours เท่านั้น แล้วควรหยุดยา
- Start Dexamethasone (ถ้าเกิด Preterm labor ไม่ควรให้ยายับยั้งการคลอด)
- Fetal and maternal monitoring
- Serial PIH blood test
• ระหว่าง Expectant management เมื่อ Maternal หรือ fetal condition แย่ลง หรืออาการ,อาการแสดง และผลตรวจทางห้องปฏิบัติการมีแนวโน้มแย่ลง, แผนการรักษาควรเปลี่ยนเป็นให้คลอด โดยไม่จำเป็นต้องรอ Dexamethasone ครบ
• หาก Clinical คงที่ เมื่อครบ 48 hours ให้หยุด MgSO4 แล้ว เฝ้าติดตามอาการต่อ แนะนำให้รับรักษาไว้ในโรงพยาบาลตลอดการตั้งครรภ์
• พิจารณาให้คลอด เมื่ออายุครรภ์ครบ 34 สัปดาห์ หรือมีอาการแย่ลง, ก่อนเริ่ม Induction of labor พิจารณาให้ MgSO4 ก่อน ประมาณ 4 hours ให้ไปจนคลอด และถึงหลังคลอด 24 hours ตามปกติ
• ประสานกับกุมารแพทย์ ในการช่วยเหลือดูแล ให้ข้อมูลและคำปรึกษากับหญิงตั้งครรภ์
การดูแลรักษาในระยะหลังคลอด (Post-partum management)
- New-onset hypertension, Exacerbated hypertension, Progression of disease, pulmonary edema,และ stroke สามารถเกิดขึ้นในช่วง Post-partum ได้ เนื่องจาก post-partum physiology และยาที่บ่อยในช่วง Post-partum ทำให้เกิด Volume retention, Sympathomimetic activation, และ direct vasoconstriction ยังมีความจำเป็นต้องเฝ้าระวังอย่างใกล้ชิด
- การป้องกัน Post-partum hemorrhage; PPH : ให้การรักษาเหมือนการป้องกัน PPH ในหญิงตั้งครรภ์หลังคลอดทั่วๆไป แต่ห้ามใช้ Methyergonovine (MethergineR) เนื่องจากกระตุ้นให้ความดันโลหิตสูงได้
- ในรายที่วินิจฉัย severe features ให้ Continue MgSO4 จนถึง 24 hours หลังคลอด หรือ 24 hours หลังวินิจฉัย severe features (กรณีวินิจฉัยในช่วง post-partum)
- Monitor BP, clinical, fluid Intake/output เฝ้าระวัง progression of disease, eclampsia, exacerbated hypertension, และ pulmonary edema
- Pain control ในช่วง post-partum : แนะนำยาแก้ปวดกลุ่ม Non-Steroidal Anti-Inflammatory drugs; NSAIDs มากกว่ายาแก้ปวดกลุ่ม opioids, สามารถใช้ได้อย่างปลอดภัย ไม่มีผลต่อการควบคุมความดันโลหิต (24)
- สังเกตอาการในโรงพยาบาลหลังคลอด อย่างน้อย 72 hours ก่อนจะจำหน่ายผู้ป่วยออกจากโรงพยาบาล, นัดตรวจติดตาม 7-10 วันหลังคลอด เพื่อประเมินความดันโลหิต, อาการ, และผลตรวจทางห้องปฏิบัติการต่างๆ
- ตรวจติดตามหลังคลอด 6 สัปดาห์ ตามปกติ, หาก post-partum 12 สัปดาห์ ยังมี hypertension จะวินิจฉัยเป็น Chronic hypertension
บทสรุป
Hypertension in pregnancy เป็นกลุ่มโรคที่มีความสำคัญ ที่ก่อให้เกิดอันตรายต่อมารดาและทารก ถือเป็นการตั้งครรภ์ที่มีความเสี่ยงสูง ควรดูแลอย่างใกล้ชิดโดยสูติแพทย์ ในปัจจุบันมีแนวทางการคัดกรองหญิงตั้งครรภ์ที่มีความเสี่ยงสูงต่อการเกิด Preterm pre-eclampsia ได้อย่างมีประสิทธิภาพ มีคำแนะนำให้ aspirin ในกลุ่มที่มีความเสี่ยงสูง เพื่อป้องกันการเกิดโรค
โรคในกลุ่มนี้มีหลายระดับความรุนแรง การวินิจฉัยโรคอาศัยเกณฑ์การวินิจฉัยของ New-onset Hypertension, New-onset Proteinuria, และ Severe features แนวทางการรักษาส่วนใหญ่ คือ การเฝ้าระวังการดำเนินโรค ตรวจติดตามมารดาและทารกอย่างใกล้ชิด เมื่อวินิจฉัยภาวะ Severe features การรักษา คือ การยุติการตั้งครรภ์ เนื่องจากมีความเสี่ยงสูงที่จะทำให้เกิดอาการชักและเป็นอันตรายต่อมารดาและทารก
การตรวจติดตามและเฝ้าระวังในช่วงหลังคลอดยังคงมีความสำคัญ เนื่องจากในช่วง 24 – 48 hr แรก onset และ progression ของโรคยังสามารถเกิดได้ เมื่อนัดตรวจติดตามหลังคลอด 12 สัปดาห์ ยังตรวจพบภาวะความดันโลหิตสูง จะวินิจฉัยโรคเป็น Chronic hypertension อีกทั้งผู้ป่วยที่เป็น Hypertension in pregnancy จะเพิ่มความเสี่ยงต่อ Cardiovascular diseases ในอนาคต
เอกสารอ้างอิง
- Steegers EA, von Dadelszen P, Duvekot JJ, Pijnenborg R. Pre-eclampsia. Lancet. 2010;376(9741):631-44.
- American College of O, Gynecologists, Task Force on Hypertension in P. Hypertension in pregnancy. Report of the American College of Obstetricians and Gynecologists’ Task Force on Hypertension in Pregnancy. Obstet Gynecol. 2013;122(5):1122-31.
- ACOG Practice Bulletin No. 202: Gestational Hypertension and Preeclampsia. Obstet Gynecol. 2019;133(1):e1-e25.
- ACOG Practice Bulletin No. 203: Chronic Hypertension in Pregnancy. Obstet Gynecol. 2019;133(1):e26-e50.
- Sibai BM, Stella CL. Diagnosis and management of atypical preeclampsia-eclampsia. Am J Obstet Gynecol. 2009;200(5):481 e1-7.
- von Dadelszen P, Payne B, Li J, Ansermino JM, Broughton Pipkin F, Cote AM, et al. Prediction of adverse maternal outcomes in pre-eclampsia: development and validation of the fullPIERS model. Lancet. 2011;377(9761):219-27.
- Sibai BM. The HELLP syndrome (hemolysis, elevated liver enzymes, and low platelets): much ado about nothing? Am J Obstet Gynecol. 1990;162(2):311-6.
- Brown CE, Cunningham FG, Pritchard JA. Convulsions in hypertensive, proteinuric primiparas more than 24 hours after delivery. Eclampsia or some other cause? J Reprod Med. 1987;32(7):499-503.
- Noraihan MN, Sharda P, Jammal AB. Report of 50 cases of eclampsia. J Obstet Gynaecol Res. 2005;31(4):302-9.
- Phipps EA, Thadhani R, Benzing T, Karumanchi SA. Pre-eclampsia: pathogenesis, novel diagnostics and therapies. Nature Reviews Nephrology. 2019;15(5):275-89.
- Cunningham FG. Williams obstetrics. 25th edition. ed. New York: McGraw-Hill; 2018. p. p.
- Hofmeyr GJ, Belizan JM, von Dadelszen P, Calcium, Pre-eclampsia Study G. Low-dose calcium supplementation for preventing pre-eclampsia: a systematic review and commentary. BJOG. 2014;121(8):951-7.
- Roberge S, Nicolaides K, Demers S, Hyett J, Chaillet N, Bujold E. The role of aspirin dose on the prevention of preeclampsia and fetal growth restriction: systematic review and meta-analysis. Am J Obstet Gynecol. 2017;216(2):110-20 e6.
- ACOG Practice Bulletin No. 203 Summary: Chronic Hypertension in Pregnancy. Obstet Gynecol. 2019;133(1):215-9.
- Meah VL, Cockcroft JR, Backx K, Shave R, Stohr EJ. Cardiac output and related haemodynamics during pregnancy: a series of meta-analyses. Heart. 2016;102(7):518-26.
- Abalos E, Duley L, Steyn DW. Antihypertensive drug therapy for mild to moderate hypertension during pregnancy. Cochrane Database Syst Rev. 2014(2):CD002252.
- Duley L, Meher S, Jones L. Drugs for treatment of very high blood pressure during pregnancy. Cochrane Database Syst Rev. 2013(7):CD001449.
- ACOG Committee Opinion No. 767: Emergent Therapy for Acute-Onset, Severe Hypertension During Pregnancy and the Postpartum Period. Obstet Gynecol. 2019;133(2):e174-e80.
- Duley L, Gulmezoglu AM, Henderson-Smart DJ, Chou D. Magnesium sulphate and other anticonvulsants for women with pre-eclampsia. Cochrane Database Syst Rev. 2010(11):CD000025.
- Altman D, Carroli G, Duley L, Farrell B, Moodley J, Neilson J, et al. Do women with pre-eclampsia, and their babies, benefit from magnesium sulphate? The Magpie Trial: a randomised placebo-controlled trial. Lancet. 2002;359(9321):1877-90.
- Lee LO, Bateman BT, Kheterpal S, Klumpner TT, Housey M, Aziz MF, et al. Risk of Epidural Hematoma after Neuraxial Techniques in Thrombocytopenic Parturients: A Report from the Multicenter Perioperative Outcomes Group. Anesthesiology. 2017;126(6):1053-63.
- Dunn R, Lee W, Cotton DB. Evaluation by computerized axial tomography of eclamptic women with seizures refractory to magnesium sulfate therapy. Am J Obstet Gynecol. 1986;155(2):267-8.
- Balogun OA, Sibai BM. Counseling, Management, and Outcome in Women With Severe Preeclampsia at 23 to 28 Weeks’ Gestation. Clin Obstet Gynecol. 2017;60(1):183-9.
- Wasden SW, Ragsdale ES, Chasen ST, Skupski DW. Impact of non-steroidal anti-inflammatory drugs on hypertensive disorders of pregnancy. Pregnancy Hypertens. 2014;4(4):259-63.
![]()