Management of symptomatic leiomyoma uteri การรักษาเนื้องอกมดลูกที่มีอาการ
พญ. ปาจรีย์ เรือนเป็ง
อ. พญ. วรชร ลัทธิวงศกร
เนื้องอกกล้ามเนื้อมดลูก ( Leiomyoma หรือ myoma uteri) เป็นเนื้องอกชนิดไม่ร้ายแรงของกล้ามเนื้อมดลูกที่พบบ่อยที่สุดในเพศหญิง เป็นสาเหตุสำคัญในการผ่าตัดมดลูกของสตรี1 ซึ่งเป็นการผ่าตัดและรักษาจำเพาะเจาะจงของเนื้องอกกล้ามเนื้อมดลูก เนื้องอกกล้ามเนื้อมดลูกประกอบไปด้วยกล้ามเนื้อมดลูกและเนื้อเยื่อเกี่ยวพัน ลักษณะภายนอกจะมีลักษณะเป็น pseudocapsule หุ้มกล้ามเนื้องอกมดลูกอยู่ สามารถแยกกับมดลูกปกติได้ โดยลักษณะเนื้องอกหากตัดในแนวขวางจะเห็นเป็นลักษณะวง ( whorl-like)
ชนิดของเนื้องอกมดลูก
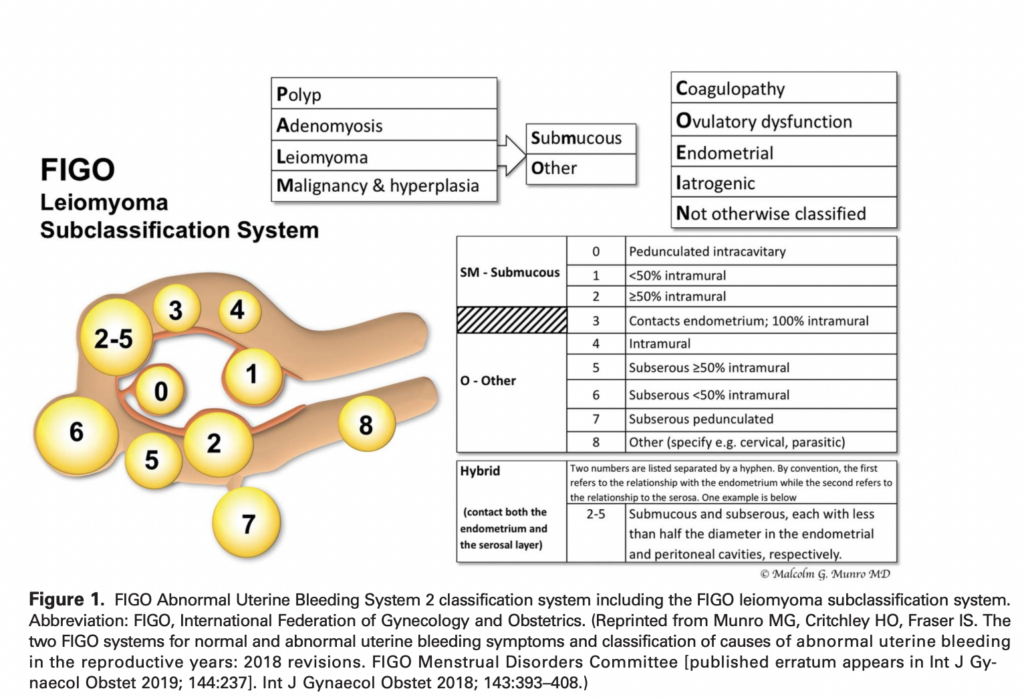
ตำแหน่งและความสัมพันธ์กับเยื่อบุโพรงมดลูกและพื้นผิวสัมผัสในมดลูกสามารถจำแนกชนิดเนื้องอกมดลูกได้ตาม The international Federation of Gynecology and Obstetric (FIGO) ดังภาพ
อุบัติการณ์
เนื้องอกกล้ามเนื้อมดลูกเป็นเนื้องอกที่พบได้บ่อย เกิดได้ประมาณ 70%. ของสตรีก่อนหมดประจำเดือน พบเพิ่มขึ้นตามอายุ และพบมากที่สุดที่อายุ 50 ปี , ไม่พบในระยะก่อนมีระดู และพบลดลงในระยะหมดประจำเดือน โดย อุบัติการณ์พบเนื้องอก 40% ในอายุ 35 ปี และพบมากถึง 70% ในอายุ 50 ปี2อย่างไรก็ตามอุบัติการณ์ที่แท้จริงนั้นยังไม่สามารถประมาณได้เนื่องจากผู้ป่วยที่มีกล้ามเนื้องอกมดลูกส่วนมมากนั้นไม่มีอาการ (asymptomatic) และไม่ได้รับการวินิจฉัย มีเพียงประมาณ 25% เท่านั้นที่มีอาการที่มาพบแพทย์หรือเข้ารับการรักษา เนื้องอกพบมากขึ้นตามอายุ
ปัจจัยเสี่ยง
ปัจจัยสำคัญที่มีผลเพิ่มความเสี่ยงได้แก่
- วัยก่อนหมดประจำเดือน พบว่ามีการเพิ่มขึ้นของฮอร์โมน LH ซึ้งเป็นฮอร์โมนที่มี receptor คล้ายคลึงกับ hCG ที่พบในหญิงตั้งครรภ์ช่วงไตรมาสแรก ที่พบอุบัติการณ์กล้ามเนื้องอกมดลูกเพิ่มขึ้นได้จากผลของฮอร์โมน Estrogen และ Progesterone
- ประวัติครอบครัว
- ระยะห่างระหว่างบุตรคนสุดท้าย พบว่า มีความเสี่ยงเพิ่มขึ้น 2-3 เท่าในคนที่บุตรคนสุดท้ายระยะห่างมากกว่า 5 ปี
- ภาวะความดันโลหิตสูง และ ภาวะอ้วน
ปัจจัยที่มีผลลดความเสี่ยงได้แก่
- จำนวนบุตรที่มาก การศึกษาพบว่า จำนวนที่มากเกินสามคน พบความเสี่ยงการเกิดกล้ามเนื้องอกมดลูกลดลงถึง 5 เท่า 2
- การใช้ยาคุมกำเนิดแบบฮอร์โมน
ลักษณะอาการ
อาการของกล้ามเนื้องอกมดลูกเป็นได้ตั้งแต่ไม่มีอาการไปจนถึงมีอาการมาก อาการแสดงอาจแตกต่างกันขึ้นอยู่กับชนิด ขนาดของก้อน จำนวนของก้อน โดยอาการเลือดระดูออกมากและออกนาน เป็นอาการที่พบได้บ่อยที่สุด เป็นผลตามมาของการที่มดลูกมีขนาดใหญ่ขึ้นจากกล้ามเนื้องอกมดลูก อาการเลือดออกผิดปกติทางช่องคลอดจากกล้ามเนื้องอกมดลูก สามารถเรียกได้ว่า AUB-L อาการที่พบได้บ่อยอีกประการคืออาการจากการกดเบียดในอุ้งเชิงกราน เช่น อาการปัสสาวะบ่อยจากการกดเบียดกระเพาะปัสสาวะ ท้องผูกขับถ่ายลำบากจากการกดเบียดลำไส้ใหญ่ทางด้านหลัง เป็นต้น ผู้ป่วยที่เข้าภาวะหมดระดูมักอาการบรรเทาลง เนื่องจากก้อนมักฝ่อลงไป แต่บางรายอาจมีอาการกลับเป็นอีกได้ จากการใช้ฮอร์โมน
วินิจฉัย
การวินิจฉัยกล้ามเนื้องอกมดลูกเบื้องต้นเริ่มจากการซักประวัติ ตรวจร่างกายโดยเฉพาะการตรวจภายใน การตรวจพิเศษเพิ่มเติมโดยเฉพาะการตรวจอัลตราซาวน์ทางช่องคลอด มีประโยชน์มากในการประเมินลักษณะของกล้ามเนื้องอกมดลูก เช่น saline infusion sonohysterography สามารถช่วยแยกระหว่างกล้ามเนื้องอกมดลูกชนิด submucous ที่ 0,1 และ 2 ได้ การส่องกล้องตรวจโพรงมดลูก (Hysteroscope) ช่วยวินิจฉัยชนิด 2 และ 3 ได้ หรือการส่งตรวจทางรังสีอื่นๆ เช่น MRI มีความแม่นยำสูง สามารถช่วยวินิจฉัยเนื้องอกล้ามเนื้อมดลูกชนิด 4และ 5 ได้ นอกจากนั้นยังช่วยระบุตำแหน่งเนื้องอก ดูเส้นเลือดและ degeneration ได้ แต่เนื่องจากมีค่าใช้จ่ายค่อนข้างสูง จึงพิจารณาเลือกใช้เป็นรายๆไป
ก่อนวินิจฉัยว่าเป็นเนื้องอกกล้ามเนื้อมดลูก จะต้องแยกจากโรคหรือภาวะดังต่อไปนี้
- การตั้งครรภ์ การตรวจพบมดลูกโต หรือคลำได้มดลูกโตบางส่วน อาจแยกย้ายจากการตั้งครรภ์ ควรทำ pregnancy test ในผู้ป่วยที่สงสัย
- มะเร็งเยื่อบุโพรงมดลูก ในรายที่มาพบแพทย์ด้วยเลือดออกผิดปกติทางช่องคลอด ควรได้รับการวินิจฉัยแยกโรคด้วยการขูดมดลูกตรวจ
- Malignant sarcoma อาจพิจารณาลักษณะของเนื้องอกจากภาพอัลตราซาวน์หรือภาพรังสีอื่นๆ เพื่อช่วยประกอบการวินิจฉัย
การรักษา
การรักษาเนื้องอกกล้ามเนื้อมดลูก มีความหลากหลาย ขึ้นอยู่กับอาการและความรุนแรงของผู้ป่วย อายุ และความต้องการมีบุตร การเลือกวิธีการรักษา ต้องเลือกโดยพิจารณาจากผู้ป่วยเป็นสำคัญ มีการแนะนำข้อดีข้อเสียและวางแผนร่วมกันกับผู้ป่วย
- การเฝ้าสังเกตอาการ (Expectant management) ในผู้ป่วยที่พบกล้ามเนื้องอกมดลูกโดยบังเอิญ ไม่มีอาการและไม่มีปัญหาใดๆ การสังเกตอาการเป็นทางเลือกที่เหมาะสม มีการศึกษาเทียบกันในกลุ่มผู้ป่วยที่ไม่มีอาการ ได้รับการรักษาแบบสังเกตุอาการไปก่อน เทียบกับกลุ่มที่ได้รับหัตถการรักษา ผลลัพธ์การรักษาในด้านลักษณะและปริมาณเลือดประจำเดือนที่ออก ระดับ hemoglobin ในเลือด และขนาดก้อนเนื้องอกมดลูกไม่เปลี่ยนแปลงในช่วงระยะเวลา 1 ปี3 ในผู้ป่วยที่ไม่มีอาการ สามารถแนะนำให้สังเกตอาการไปก่อนได้ในระยะยาวและสามารถแนะนำผู้ป่วยให้กลับมารักษาเมื่อมีอาการได้ เหมาะกับผู้ป่วยที่ใกล้หมดประจำเดือน โดยทั่วไปแล้วเมื่อเข้าสู่วัยหมดประจำเดือน หากไม่ได้รับฮอร์โมนบำบัดก้อนมักจะเล็กลง
- การรักษาด้วยยา (Medical management) แนวทางการรักษาด้วยยามีจุดประสงค์ทั้งเพื่อลดอาการเลือดประจำเดือนออกมา และ ทั้งลดขนาดของก้อนเนื้องอกมดลูก การรักษาด้วยยาบางประการสามารถใช้ได้ระยะยาว บางประการใช้เพียงช่วงระยะเวลาหนึ่งเพื่อประสงค์ลดขนาดของก้อนเพื่อนำไปสู่การรักษาด้วยวิธีอื่นเช่น การผ่าตัด หรือรอเวลาเพื่อเข้าสู่ระยะวัยหมดประจำเดือน การรักษาด้วยยาไม่มี 1st line therapy แต่ควรพิจารณาเลือกใช้ยาตามความเหมาะสม อาการของผู้ป่วย และเป้าหมายในการรักษา
- การรักษาด้วยยาเพื่อลดอาการเลือดออก (bleeding symptom)
- GnRH antagonist: การใช้ GnRH antagonist ร่วมกับ add-back therapy สามารถใช้เพื่อรักษาอาการประจำเดือนออกมากได้นานถึง 2 ปี โดยกลไลยับยั้งฮอร์โมน gonadotropin และ ovarian sex hormones โดยการใช้ Elagolix 300 mg twice daily ร่วมกับ add-back therapy ด้วย Estradiol 1 mg และ norethindrone acetate 0.5 mg ซึ่ง FDA ได้รับรองให้สามารถใช้เพื่อรักษาอาการเลือดออกมากจากผลของกล้ามเนื้องอกมดลูกได้ โดยการใช้ add-back therapy เพื่อลดผลข้างเคียงของภาวะ hypoestrogenic state เช่น อาการร้อนวูบวาบ การเพิ่มปริมาณไขมันในกระแสเลือด มวลกระดูกลดลง เป็นต้น โดยมีการศึกษาพบว่าภายใน 12 เดือน ปริมาณเลือดที่ออกลดลงเหลือน้อยกว่า 80 มิลลิลิตรต่อเดือนถึง 87.9 % และอาการดีขึ้นได้ตั้งแต่เริ่มใช้ยาในเดือนแรกๆ 4
- Levonorgestrel-Releasing intrauterine devices การใช้ห่วงอนามัยมีกลการลดปริมาณเลือดระดูได้จาก decidualization and atrophy of endometrium โดยเห็นผลทั้งในผู้ป่วยที่เลือดออกมาจากสาเหตุของกล้ามเนื้องอกมดลูกและสาเหตุอื่นๆ การศึกษาพบว่าผู้ป่วยที่ใส่ห่วงอนามัยมีปริมาณเลือดที่ลดลงชัดเจนหลังใส่ 3 เดือน โดย 40% ของผู้ป่วยเกิดภาวะ amenorrhea และ 95% มีผล hemoglobin level เพิ่มขึ้น5 ปัญหาของการใส่ห่วงอนามัยพบมากในรายที่มีก้อนในมดลูกจนทำให้โพรงมดลูกมีลักษณะเปลี่ยนไป (uterine distortion) ทำให้ห่วงอนามัยหลุดออกจากโพรงมดลูก
- Contraceptive steroid hormones ยาเม็ดคุมกำเนิดยอมรับใช้กันในการช่วยลดปริมาณเลือดประจำเดือนในรายที่ไม่ใช่สาเหตุจากกล้ามเนื้องอกมดลูก แต่ก็ยังพิจารณาใช้ยาเม็ดคุมกำเนิดในการลดปริมาณเลือดประจำเดือนในผู้ป่วยกล้ามเนื้องอกมดลูก ถึงแม้ปัจจุบันยังไม่มีการศึกษาที่ชัดเจน การศึกษาเปรียบเทียบการใช้ยาคุมกำเนิดเทียบกับการใช้ห่วงอนามัยในผู้ป่วยที่มีกล้ามเนื้องอกมดลูกขนาดน้อยกว่า 5 เซนติเมตรพบว่า การใช้ยาเม็ดคุมกำเนิดสามารถช่วยลดปริมาณเลือดประจำเดือนได้ แต่ไม่เท่ากับการใช้ห่วงอนามัย6 ส่วน Depot medroxyprogesterone acetate พบว่าช่วยเรื่องลดปริมาณเลือดประจำเดือนได้เช่นกัน7
- Tranexamic acid ออกฤทธิ์ antifibrinolytic agents ป้องกัน fibrin degradation สามารถช่วยลดปริมาณเลือดได้เช่นกัน
- การรักษาด้วยยาเพื่อลดอาการเลือดออก (bleeding symptom) และลดขนาดก้อน (uterine enlargement)
- GnRH agonist with or without add-back therapy แนะนำสำหรับ short-term treatment เพื่อลดขนาดก้อนสำหรับการรักษาด้วยหัตถการต่อไป (bridge to other treatment) GnRH agonist ทำให้เกิด hypogonadism ทำให้ปริมาณประจำเดือนลดลงจนถึงไม่มีประจำเดือน ผลการรักษาด้วย GnRH agonist มีผลทั้งลดปริมาณประจำเดือน ลดอาการปวดประจำเดือน ลดขนาดกล้ามเนื้องอกมดลูก เพิ่มคุณภาพชีวิต เมื่อหยุดให้ยา GnRH agonist ขนาดก้อนจะกลับมาเท่าเดิมในช่วงระยะ 3-9 เดือนหลังหยุด จึงนิยมใช้เป็นยาก่อนผ่าตัดเพื่อช่วยลดขนาดของก้อนเพื่อ minimal invasive surgical route เพื่อลด morbidity and mortality นอกจากนี้การใช้ GnRH agonist ก่อนการผ่าตัดยังช่วยเรื่องเพิ่ม hemoglobin level โดยเฉลี่ย 0.88 g/dL เนื่องจากผลของ hypoestrogenic state การใช้ GnRH agonist พิจารณาใช้ได้ไม่เกิน 6 เดือนในกรณีไม่มี add-back therapy และ 12 เดือนสำหรับร่วมกับ add-back therapy1
- Selective progesterone Receptor modulators เช่น ulipristal acetate มีผลยับยั้งการตกไข่ มีประสิทธิภาพในการรักษา AUB-L ใช้ระยะสั้น แต่เนื่องจากพบผลข้างเคียงจากการรักษา เช่น ภาวะตับวายรุนแรง ขณะนี้ FDA จึงยังไม่ได้ยอมรับให้รักษาแพร่หลาย ส่วน mifepristone เป็น progesterone antagonist พบว่าสามารถช่วยลดขนาดของเนื้องอกได้ แต่ข้อมูลยังค่อนข้างจำกัดอยู่
- การรักษากล้ามเนื้องอกมดลูกด้วยหัตถการ
- Uterine artery embolization เป็นทางเลือกแนะนำให้ผู้ป่วยที่ต้องการ uterine preservation และต้องการรักษากล้ามเนื้องอกมดลูก แต่ผลด้าน reproductive outcome นั้นยังค่อนข้างจำกัด เทคนิคการทำโดยการใส่สายสวนผ่านเส้นเลือด femoral artery ผ่านไปยัง uterine artery ใช้ embolic agents เพื่อทำให้เนื้องอกเกิด devascularization and involution จากการติดตามพบว่าสามารถช่วยลดขนาดของเนื้องอกมดลูกและขนาดของมดลูกได้นานถึง 5 ปี ลดปริมาณเลือดออก เพิ่มคุณภาพชีวิตเทียบได้กับการผ่าตัด เป็นเทคนิครุกล้ำน้อย เจ็บปวดน้อยกว่า เสียเลือดระหว่างทำหัตถการน้อย ระยะนอนโรงพยาบาลสั้น แต่ยังมีความเสี่ยงในการต้องกลับมา reintervention ด้วยหัตถการลุกล้ำอื่นๆสูงถึง 19-38% 3 ในช่วง 2-5 ปีหลังทำหัตถการ เทียบเป็น 2-5 เท่าเทียบกับการทำการผ่าตัด นอกจากนั้นยังมีความเสี่ยงในการเกิด minor complication มากกว่า เช่น อาการปวด ไข้ อาการคลื่นไส้อาเจียน รวมถึงมีความเสี่ยงการเกิด postembolization syndrome ตกขาวปนเลือด การติดเชื้อบริเวณอุ้งเชิงกราน เป็นต้น
ผลของ UAE ด้าน reproductive outcome นั้นยังจำกัด บางการศึกษาพบว่าไม่มีผลต่อ ovarian reserve แต่บางการศึกษาพบว่า UAE เพิ่มความเสี่ยงต่อการเกิด pregnancy loss, postpartum hemorrhage เป็นต้น
-
- Radiofrequency ablation โดยทำผ่านการส่องกล้อง (laparoscopic radiofrequency ablation) เป็นเทคนิคที่ FDA ยอมรับ ในผู้ป่วยที่ต้องการ uterine preservation แต่ข้อมูลด้าน reproductive outcome ยังจำกัด นอกจากนี้ RFA สามารถทำได้ทั้งทาง transvaginal และ trancscervical approach โดยใช้ ultrasound-guided การทำ RFA กลไกคือกระตุ้นการเกิด coagulative necrosis โดยผลการศึกษาพบว่าสามารถลดขนาดเนื้องอกกล้ามเนื้อมดลูกได้ 32-66% ที่ 12 เดือน และอุบัติการณ์การ reintervention ที่ 3 ปีอยู่ที่ 11.5 %8 ปัจจุบันการทำ RFA ยังไม่แพร่หลายมากนักเนื่องจากต้องใช้เทคโนโลยีและผู้เชี่ยวชาญ
- Focused ultrasound การใช้คลื่นอัลตราซาวน์เฉพาะที่เป็นเทคนิคใหม่ที่มีการลุกล้ำน้อย ใช้ multiple high-intensity ultrasound wave เพื่อให้เกิด coagulative necrosis ที่บริเวณกล้ามเนื้องอกมดลูก ปัจจุบัน MR-guided focused ultrasound ได้รับการยอมรับ FDA อย่างไรก็ตาม ความเสี่ยงในการ reintervention ก็สูงถึง 53.9% ในช่วง 5 ปี
- Endometrial ablation ณ ปัจจุบัน ยังมีข้อมูลจำกัดและยังไม่ได้เป็นที่ยอมรับเรื่องการรักษา AUB-L
- การรักษาด้วยการผ่าตัด ทางเลือกการรักษาด้วยการผ่าตัด อาจพิจารณาในรายที่มีเลือดระดูออกมาก หรือมีอาการกดเบียดอวัยวะข้างเคียงมาก ไม่แน่ใจเรื่องการวินิจฉัย หรือก้อนโตเร็ว ในวัยหมดระดู โอยพิจารณาเลือกการรักษาโดยดูความต้องการ uterine preservation or future pregnancy GnRH agonist มีบทบาทสำคัญในการช่วยลดขนาดของเนื้องอกมดลูกก่อนการผ่าตัด รวมถึงการเตรียมตัวก่อนการผ่าตัดของผู้ป่วย เช่น hemoglobin level ก็มีส่วนสำคัญในการลด morbidity and mortality การพิจารณาผ่า มีทางเลือก ดังนี้
- Myomectomy เลือกผ่าตัดเฉพาะก้อนเนื้องอกมดลูก เพื่อ uterine preservation เพื่อเป้าหมายการตั้งครรภ์ในอนาคต โดยการผ่าตัดสามารถทำได้ทั้งทาง Laparoscopic, robotic or laparotomy (abdominal) technique โดยมีความเสี่ยงในการเสียเลือดและเติมเลือดเท่ากัน เฉลี่ยที่ 0-5% การใช้ dilute vasopressin สามารถลดการเสียเลือดในระหว่างการผ่าตัดได้ โอการการตั้งครรภ์มีความแตกต่างกันขึ้นอยู่กับชนิดของก้อนเนื้องอกมดลูก โดยการศึกษาพบว่า submucous type มีโอกาสตั้งครรภ์สูงกว่า subserosal และ intramural type อย่างไรก็ตามหลังการทำ myomectomy โอกาสกลับเป็นซ้ำมีสูงถึง 25% ที่ 40 เดือนหลังผ่าตัด
- Abdominal myomectomy พิจารณาในรายนี้ก้อนค่อนข้างใหญ่ ไม่สามารถผ่าตัดทางช่องคลอดได้
- Vaginal myomectomy เหมาะกับเนื้องอกที่มีลักษณะยื่นพ้นปากมดลูกออกมา ก้อนเล็ก
- Hysteroscopic myomectomy เหมาะกับ submucous type สามารถทำเป็น outpatient procedure ฟื้นตัวง่าย reintervention rate ประมาณ 7%
- Laparoscopic myomectomy อาศัยความชำนาญ มีโอกาสต้องเปลี่ยนการผ่าตัดเป็นเปิดหน้าท้องถึง 4.5 เท่า ถ้าขนาดก้อนใหญ่มากกว่า 5 เซนติเมตร และดูเข้าถึงค่อนข้างยาก
- Hysterectomy ถือเป็น definitive surgery สำหรับการรักษา AUB-L และอาการกดเบียดอวัยวะข้างเคียง ในผู้ป่วยที่ไม่ต้องการมีบุตรในอนาคต ข้อดีคือ สามารถเพิ่ม hemoglobin level , quality of life และ improve pressure symptom ข้อพิจารณาคือบางราย พิจารณาตัด oophorectomy ร่วมด้วย โดยการศึกษายังไม่สามารถสรุปได้ถึง cardiovascular risk ในรายที่ตัด oophorectomyร่วมด้วย แต่พบว่าไม่มีผลด้านการเพิ่มความเสี่ยงด้าน cardiovascular disease ในรายที่ovarian preservation
- Myomectomy เลือกผ่าตัดเฉพาะก้อนเนื้องอกมดลูก เพื่อ uterine preservation เพื่อเป้าหมายการตั้งครรภ์ในอนาคต โดยการผ่าตัดสามารถทำได้ทั้งทาง Laparoscopic, robotic or laparotomy (abdominal) technique โดยมีความเสี่ยงในการเสียเลือดและเติมเลือดเท่ากัน เฉลี่ยที่ 0-5% การใช้ dilute vasopressin สามารถลดการเสียเลือดในระหว่างการผ่าตัดได้ โอการการตั้งครรภ์มีความแตกต่างกันขึ้นอยู่กับชนิดของก้อนเนื้องอกมดลูก โดยการศึกษาพบว่า submucous type มีโอกาสตั้งครรภ์สูงกว่า subserosal และ intramural type อย่างไรก็ตามหลังการทำ myomectomy โอกาสกลับเป็นซ้ำมีสูงถึง 25% ที่ 40 เดือนหลังผ่าตัด
การพิจารณา route of surgery ขึ้นอยู่กับขนาดของก้อน ลักษณะของ vagina ความชำนาญของผู้ผ่าตัด และความพร้อมของเครื่องมือร่วมด้วย
เอกสารอ้างอิง
1. Management of Symptomatic Uterine Leiomyomas: ACOG Practice Bulletin, Number 228. Obstet Gynecol. 2021;137(6):e100-e15.
2. Pavone D, Clemenza S, Sorbi F, Fambrini M, Petraglia F. Epidemiology and Risk Factors of Uterine Fibroids. Best Pract Res Clin Obstet Gynaecol. 2018;46:3-11.
3. Hartmann KE, Fonnesbeck C, Surawicz T, Krishnaswami S, Andrews JC, Wilson JE, et al. AHRQ Comparative Effectiveness Reviews. Management of Uterine Fibroids. Rockville (MD): Agency for Healthcare Research and Quality (US); 2017.
4. Simon JA, Al-Hendy A, Archer DF, Barnhart KT, Bradley LD, Carr BR, et al. Elagolix Treatment for Up to 12 Months in Women With Heavy Menstrual Bleeding and Uterine Leiomyomas. Obstet Gynecol. 2020;135(6):1313-26.
5. Grigorieva V, Chen-Mok M, Tarasova M, Mikhailov A. Use of a levonorgestrel-releasing intrauterine system to treat bleeding related to uterine leiomyomas. Fertil Steril. 2003;79(5):1194-8.
6. Sayed GH, Zakherah MS, El-Nashar SA, Shaaban MM. A randomized clinical trial of a levonorgestrel-releasing intrauterine system and a low-dose combined oral contraceptive for fibroid-related menorrhagia. Int J Gynaecol Obstet. 2011;112(2):126-30.
7. Venkatachalam S, Bagratee JS, Moodley J. Medical management of uterine fibroids with medroxyprogesterone acetate (Depo Provera): a pilot study. J Obstet Gynaecol. 2004;24(7):798-800.
8. Lin L, Ma H, Wang J, Guan H, Yang M, Tong X, et al. Quality of Life, Adverse Events, and Reintervention Outcomes after Laparoscopic Radiofrequency Ablation for Symptomatic Uterine Fibroids: A Meta-Analysis. J Minim Invasive Gynecol. 2019;26(3):409-16.