ภาวะโลหิตจางในสตรีตั้งครรภ์
ภาวะโลหิตจางในสตรีตั้งครรภ์
พญ. ชลธิชา ตานา
อาจารย์ที่ปรึกษา รศ. นพ. ชเนนทร์ วนาภิรักษ์
บทนำ
ภาวะโลหิตจาง ถือเป็นความผิดปกติทางระบบเลือดที่พบได้บ่อยที่สุดในสตรีตั้งครรภ์ โดยมีอุบัติการณ์เฉลี่ยร้อยละ 42 ของการตั้งครรภ์ แต่ในประเทศที่กำลังพัฒนาพบความชุกมากถึงร้อยละ 35-75 และจะมีความรุนแรงที่มากขึ้นดังมีรายงานการเสียชีวิตของมารดาสัมพันธ์กับภาวะโลหิตจางถึงร้อยละ 20 โดยเฉพาะอย่างยิ่งในแถบแอฟริกา และเอเชียตอนใต้(1) โดยสาเหตุที่พบบ่อยที่สุดเกิดจาก ภาวะขาดธาตุเหล็ก สถานการณ์ภาวะโลหิตจางของสตรีตั้งครรภ์ไทยจากรายงานของกรมอนามัย พบว่ามีแนวโน้มสูงขึ้นทุกปี ร้อยละ 20-30(2)
คำจำกัดความ
ตามข้อกําหนดขององค์การอนามัยโลกภาวะโลหิตจางระหว่างการตั้งครรภ์ ถือเอาที่ระดับ Hb ต่ำกว่า 11 g/dl(1) ส่วน CDC แนะนำให้ถือ Hb หรือ Hct ที่ต่ำกว่าเปอร์เซนไตล์ที่ 5 ของแต่ละอายุครรภ์ คือ ในไตรมาสที่หนึ่งและสาม Hb ต่ำกว่า 11 g/dl Hct ต่ำกว่า 33% และHb ต่ำกว่า 10.5 g/dl Hct ต่ำกว่า 32% ในไตรมาสที่สอง)(2)
ในช่วงตั้งครรภ์จะมีการเปลี่ยนแปลงสรีรวิทยาของระบบโลหิต โดยในครรภ์เดี่ยวจะมีการเพิ่มปริมาณเลือดทั้งหมดประมาณ ร้อยละ 50 (1000 ml) โดยปริมาณเม็ดเลือดแดงเพิ่มขึ้นประมาณ ร้อยละ 25 (300 ml) ซึ่งการที่มีปริมาณพลาสมาเพิ่มขึ้นในอัตราส่วนที่มากกว่า ทำให้เกิดภาวะ hemodilution ซึ่งไม่ใช่ภาวะโลหิตจางที่แท้จริง และ Hb มักไม่ต่ำกว่า 10 g/dl(3)
ผลของภาวะโลหิตจางต่อการตั้งครรภ์
ผลต่อมารดา
- การทำงานของหับใจหนักขึ้น เพิ่มความเสี่ยง heart failure
- โอกาสติดเชื้อต่าง ๆ ง่ายขึ้น
- ช่วงการคลอดและหลังคลอดมีผลกระทบซ้ำเติมต่อมารดาจากการเสียเลือด ทำให้เกิดจากวะช็อก หรือ heart failure ได้
- สัมพันธ์กับการเกิดภาวะซึมเศร้าหลังคลอด (postpartum depression)
ผลต่อทารก
- บางสาเหตุสามารถถ่ายทอดความเสี่ยงไปยังทารกได้ เช่น ธาลัสซีเมีย
- ทารกน้ำหนักน้อยกว่าปกติ หรือทารกโตช้าในครรภ์ เพิ่มอัตราการตายปริกำเนิด และการคลอดก่อนกำหนด
- มีเหล็กสะสมน้อยกว่าปกติ หากไม่ได้รับธาตุเหล็กเสริมหลังคลอด จะมีพัฒนาการและเจริญเติบโตของสมองที่ช้ากว่าเด็กทั่วไป(4)
สาเหตุของภาวะโลหิตจางในสตรีตั้งครรภ์
ความผิดปกติตั้งแต่กำเนิด(hereditary)
- ความผิดปกติของฮีโมโกลบิน เช่น ธาลัสซีเมีย Sickle cell disease
- Hereditary hemolytic anemia เช่น G6PD deficiency
ความผิดปกติที่เกิดขึ้นภายหลัง(acquired)
- การขาดสารอาหาร เช่น ธาตุเหล็ก โฟเลต หรือวิตามินบี12
- การเสียเลือดออกจากร่างกาย เช่น การตกเลือดก่อนคลอด การมีพยาธิปากขอ
- ภาวะโรคเรื้อรัง เช่น มะเร็ง โรคไตวายเรื้อรัง
- Acquired hemolytic anemia เช่น autoimmune hemolytic anemia(AIHA), Paroxysmal Nocturnal hemoglobinuria
- Aplastic anemia
1. ภาวะโลหิตจางจากการขาดธาตุเหล็ก Iron deficiency anemia
โลหิตจางจากการขาดธาตุเหล็กเป็นสาเหตุที่พบบ่อยที่สุดของภาวะโลหิตจางในสตรีตั้งครรภ์ เกือบร้อยละ 80 (3) ซึ่งส่วนใหญ่เกิดจากการได้รับธาตุเหล็กไม่เพียงพอต่อความต้องการที่สูงขึ้นระหว่างการตั้งครรภ์
พยาธิสรีรวิทยา
ความต้องการธาตุเหล็กต่อการตั้งครรภ์ ประมาณ 1000 mg โดย 500 mg สำหรับสร้างเม็ดเลือดแดงที่จะเพิ่มขึ้น 450 ml (1 ml ของเม็ดเลือดแดง ใช้เหล็ก 1.1 mg ในการสร้าง) , 300 mg ให้ทารกและรก , 200 mg สูญเสียไปตาม normal excreation หลักๆคือ GI tract ดังนั้นโดยเฉลี่ยความต้องการธาตุเหล็กประมาณวันละ 6-7 mg ซึ่ง iron storage ในร่างกายมักจะไม่เพียงพอจำเป็นต้องได้รับธาตุเหล็กเสริม และหากได้รับไม่เพียงพอก็อาจเกิดภาวะโลหิตจางในแม่ได้ แต่ทารกจะไม่เกิดโลหิตจางเนื่องจากรกมีความสามารถในการขนส่งธาตุเหล็กไปให้ทารกได้อย่างมีประสิทธิภาพถึงแม้ว่า iron storage ในแม่จะไม่เพียงพอก็ตาม
โรคโลหิตจางจากการขาดธาตุเหล็กแบ่งออกเป็น 3 ระยะ ตามลำดับดังนี้
- Iron stores depletion : เมื่อร่างกายได้รับธาตุเหล็กจากอาหารไม่เพียงพอกับความต้องการธาตุเหล็ก หรือการสูญเสียธาตุเหล็กที่เพิ่มขึ้น ร่างกายจะนำธาตุเหล็กจากแหล่งสะสมในรูป ferritin ที่ไขกระดูก ตับ ม้าม มาใช้ โดยจะวินิจฉัยได้จากการตรวจระดับ ferritin ในไขกระดูกแต่เป็นวิธีการที่รุกล้ำและราคาแพง จึงนิยมตรวจ serum ferritin แทน
- Iron deficiency erythropoiesis : เมื่อธาตุเหล็กสะสมหมดสิ้นลง ปริมาณเหล็กในเลือดเริ่มลดลง ร่างกายตอบสนองโดยกระตุ้นการสร้างโปรตีนที่จับกับเหล็ก (transferrin) ทำให้วิสัยสามารถในการจับเหล็ก (total iron binding capacity: TIBC) เพิ่มขึ้นความอิ่มตัวของทรานสเฟอริน (transferrin saturation) ลดลง
- Iron deficiency anemia : เป็นระยะที่ธาตุเหล็กเหลือไม่เพียงพอต่อการสร้างเม็ดเลือดแดง จนเกิดภาวะโลหิตจางจากการขาดธาตุเหล็ก จะตรวจพบ Hb ตํ่าลง เม็ดเลือดแดงตัวเล็กและติดสีจาง hypochromic-microcytic RBCs จาก peripheral blood smear ค่าดัชนีของเม็ดเลือด เช่น MCV, MCH, MCHC ต่ำกว่าเกณฑ์
แนวทางการวินิจฉัย
- สตรีตั้งครรภ์ทุกรายควรได้รับการตรวจคัดกรองหาภาวะโลหิตจาง ตั้งแต่ครั้งแรกที่มาฝากครรภ์
- หากตรวจคัดกรองพบว่ามีภาวะโลหิตจาง ถึงแม้จะไม่มีอาการก็ควรได้รับการตรวจเพิ่มเติมเพื่อหาสาเหตุและความรุนแรงของโรค โดยการซักประวัติ ตรวจร่างกาย และตรวจเลือดทางห้องปฏิบัติการ
ประวัติ ที่บ่งบอกได้ถึงความรุนแรงของโรค เช่น อาการอ่อนเพลีย เหนื่อยง่าย ซึม เป็นต้น นอกจากนี้ควรซักประวัติเพื่อหาสาเหตุเช่น ภาวะเลือดออกผิดปกติ การผ่าตัดลำไส้ ความผิดปกติของทางเดินอาหาร ประวัติการมีบุตรหลายคน การตั้งครรภ์วัยรุ่น เป็นต้น ซึ่งประวัติเหล่านี้จะทำให้คิดถึงภาวะขาดธาตุเหล็กมากขึ้น
การตรวจร่างกายเพื่อหาอาการแสดงของการขาดธาตุเหล็กอื่น ๆ เช่น glossitis, angular stomatitis
การตรวจทางห้องปฏิบัติการ
1. Primary screening of anemia: CBC (Hb, Hct, MCV)
2. Diagnosis of IDA (5)
- Microcytic-hypochromic (MCV <80fl, MCHC<30% , MCH <30 mch/L, RC <4.1 mil/mm3 , PBS)
- Evidence of depleted iron stores
- Low serum iron < 30 mcg/dl
- High total iron binding capacity (TIBC) > 350 mcg/dl
- Low transferrin saturation < 16 %
- Low serum ferritin <10-15 mcg/L (5)(****the highest sensitivity and specificity for diagnosis)
หมายเหตุ
- ในสถานที่ที่ไม่สามารถตรวจ iron study ได้ให้ทดลองให้การรักษา (therapeutic trial) ด้วยเหล็กขนาดการรักษานาน 30 วันจะมี Hb เพิ่มขึ้น 1 g/dl ซึ่งแสดงว่าขาดธาตุเหล็กจริง ถือเป็นอีกวิธีที่มีประสิทธิภาพสูงในการวินิจฉัยภาวะขาดธาตุเหล็ก (6)
- serum ferritin เป็นตัวชี้วัดการขาดธาตุเหล็กที่มีความไวสูงที่สุด แต่มีผลลบลวงได้บ่อยเนื่องจาก ferritin จะสูงขึ้นเมื่อมีการติดเชื้อหรือการอักเสบ ดังนั้นจึงมักจะตรวจ serum iron และ transferrin ร่วมด้วย
สาเหตุของภาวะโลหิตจางจากการขาดธาตุเหล็กในประชากรไทย
- รับประทานอาหารที่มีธาตุเหล็กไม่เพียงพอ มังสวิรัติ ไม่รับประทานเนื้อสัตว์/เลือด/ตับ หรือรับประทานผักที่มีสารต่อต้านการดูดซึมของธาตุเหล็กเป็นปริมาณมาก เช่น นมถั่วเหลือง ชา กาแฟ เป็นต้น
- การดูดซึมธาตุเหล็กผิดปกติ อาจเกิดจากการมีกรดในกระเพาะอาหารลดลง เช่น รับประทานยาลดกรดในกระเพาะอาหารนาน ๆ หรือผู้สูงอายุ หรือผู้ที่ได้รับการผ่าตัดเอาลําไส้เล็กส่วนต้นออก
- การสูญเสียธาตุเหล็กมากกว่าปกติ มักเกิดจากการเสียเลือดเรื้อรัง ได้แก่ เลือดประจําเดือนมากและนานกว่าปกติในหญิงวัยเจริญพันธุ์ เลือดออกในทางเดินอาหาร (แผลในกระเพาะอาหาร ริดสีดวงทวาร มะเร็งลำไส้ พยาธิปากขอ)
การป้องกัน
- แนะนำให้สตรีตั้งครรภ์ทุกรายควรได้รับการเสริมธาตุเหล็ก 60 mg ทุกวัน ตลอดการตั้งครรภ์ (5)ยกเว้น มีข้อห้ามในการให้ เช่น มีภาวะเหล็กเกินในร่างกาย (hemochromatosis) (6)
- ส่งเสริมการบริโภคอาหารที่อุดมด้วยธาตุเหล็กโดยให้ความรู้โภชนศึกษาแก่หญิงที่มารับบริการคลินิกฝากครรภ์
การรักษา
- ยาเสริมธาตุเหล็กชนิดรับประทาน เพื่อให้ได้เหล็กวันละ 200 mg โดยแบ่งให้วันละ 2-3 ครั้งรับประทานทุกวัน
- ตรวจเลือดติดตามค่า Hb หรือ CBC หลังการรักษา 4 สัปดาห์ หากการรักษาได้ผล Hb ควรสูงขึ้นเกิน 1 g/dl และให้ทานยาต่ออีก 60 วัน แล้วจึงลดขนาดการให้เป็น 60 mg เพื่อป้องกัน ภาวะโลหิตจางจากการขาดธาตุเหล็กซ้ำ
- หากรักษาด้วยการทานเหล็กแล้วไม่ได้ผล แสดงว่าผู้ป่วยอาจจะเป็นโรคโลหิตจางจากสาเหตุอื่น ให้งดการเสริมธาตุเหล็ก และตรวจหาสาเหตุอื่น แต่ต้องมั่นใจว่าผู้ป่วยได้รับประทานยาอย่างถูกต้องแล้วและไม่มีการเสียเลือดเรื้อรังที่ยังไม่ได้รักษาอยู่
- การให้ blood transfusion (6)
- ในช่วง antepartum ไม่ค่อยมีข้อบ่งชี้ ยกเว้นซีดรุนแรง Hb <6 g/dl ซึ่งพบว่าสัมพันธ์กับการเกิดขาดออกซินเจนของทารก ทำให้มี non reassuring fetal heart rate patterns, น้ำคร่ำน้อย, fetal cerebral vasodilatation และเกิดเสียชีวิตในครรภ์ได้ จึงอาจเป็นข้อบ่งชี้ในการให้เลือด
- ในช่วงคลอดหรือหลังคลอดแล้วมีการเสียเลือดมาก เพื่อป้องกันการเกิดหัวใจล้มเหลว
- การให้เหล็กทางเส้นเลือด ให้ได้ในกรณีที่ไม่สามรถ tolerate oral iron กินได้น้อย มีปัญหาการดูดซึม หรือผู้ป่วยโรคไตที่ต้องที่ dialysis เป็นต้น(6) ซึ่งมีความปลอดภัยและจะเพิ่มระดับ Hb ได้เร็วกว่ารูปแบบรับประทานในช่วงสัปดาห์แรก แต่หลัง 40 วันพบว่าผลไม่แตกต่างกัน ในประเทศไทยมี 2 ชนิด คือ ferrous sucrose และ iron dextran ( ร้อยละ 1 เกิดอาการแพ้หลังได้ iron dextran)
ตารางที่1. แสดงร้อยละของ elemental iron ของ ferrous iron salts ชนิดต่าง ๆ (Ineck et al., 2011)
|
Ferrous iron salts |
ปริมาณ iron salts (mg) |
% element iron |
ปริมาณ element iron (mg) |
|
Ferrous sulfate |
300 |
20% |
60 |
|
Ferrous gluconate |
320 |
12% |
36 |
|
Ferrous fumarate |
200 |
33% |
67 |
2. Megaloblastic Anemia
ภาวะโลหิตจางที่พบว่าเม็ดเลือดแดงมีขนาดใหญ่กว่าปกติ (MCV > 100fL) เกิดจากเซลล์ไขกระดูกไม่สามารถสร้าง DNA ได้ตามปกติ แต่ยังคงสร้าง RNA และโปรตีนได้ ทำให้ไซโตพลาสซึมมีนาดใหญ่แต่นิวเคลียสเล็ก เกิด “nuclear-cytoplasmic asynchronism” ซึ่งสาเหตุหลักเกิดจากการขาดวิตามินบี12 และขาดโฟเลต นอกจากนี้สาเหตุอื่น ๆ เช่น hyperlipidemia โรคตับ และการดื่ม alcohol ซึ่งผู้ที่ดื่ม alcohol แล้วมีภาวะ โลหิตจางร่วมด้วยประมาณ 90% จะเป็นโรคโลหิตจางชนิดเม็ดเลือดแดงมีขนาดใหญ่
2.1 Folic Acid Deficiency anemia
ภาวะโลหิตจางจากการขาดโฟเลตเป็นสาเหตุส่วนใหญ่ของ megaloblastic anemia ในสตรีตั้งครรภ์ โดยอุบัติการณ์แตกต่างกันไปทั่วโลก ประมาณร้อยละ1-30 อาการแตกต่างกับโลหิตจางจากการขาดวิตามินบี12 คือจะไม่มีความผิดปกติทางระบบประสาทเกิดขึ้นในโรคโลหิตจางจากการขาดโฟเลต ส่วนผลต่อการตั้งครรภ์พบว่า ไม่ค่อยมีผลทำให้เกิดภาวะโลหิตจางกับทารกในครรภ์ แต่การขาดโฟเลตในช่วงแรกของการตั้งครรภ์จะเพิ่มความเสี่ยงในการเกิด neural tube defect แก่ทารกได้
ร่างกายมนุษย์ไม่สามารถสังเคราะห์ folic acid เองได้ จึงจำเป็นต้องได้รับจากภายนอกเท่านั้น เมื่อรับประทานเข้าไปจะถูกดูดซึมที่ลำไส้เล็กและเก็บสะสม ไว้ในร่างกาย 5-10 mg ที่ตับ ซึ่งปริมาณที่สะสมนี้จะใช้หมดภายใน 2-4 เดือน
สาเหตุ
- ได้รับโฟเลตไม่เพียงพอกับความต้องการที่สูงขึ้นในระหว่างตั้งครรภ์ 400 ไมโครกรัมต่อวัน (คนปกติ 50-100ไมโครกรัมต่อวัน) ซึ่งอาหารที่มีโฟเลตมากได้แก่ ผักใบเขียว ถั่ว เนื้อสัตว์ นม เป็นต้น ส่วนสาเหตุอื่น ๆ เช่น
- ได้รับยาหรือสารบางชนิดที่รบกวนการดูดซึมของโฟเลต เช่น phenytoin phenobarbital sulfasalazine alcohol
- การดูดซึมอาหารบกพร่อง (malabsorption) เช่น sprue
- เพิ่มการใช้โฟเลตมากขึ้นในการแบ่งเซลล์ เช่น chronic hemolytic anemia มะเร็ง โรคเรื้อรังต่าง ๆ เช่น Crohn’s disease, rheumatoid arthritis, psoriasis ผู้ป่วยโรคไตเรื้อรังที่ต้องท่า hemodialysis
- สารยับยั้งการทำงานของเอนไซม์ dihydrofolate reductase ซึ่งมีฤทธิ์ในการเปลี่ยน dihydrofolate (DHF) เป็น active tetrahydrofolate (THF) เช่น methotrexate
การวินิจฉัย
- serum folate < 2.0 mcg/L
- red cell folate concentration <140-160 mcg/L
- การตรวจ PBS จะพบ hypersegmented neutrophils และ macrocytic RBCs โดจจะช่วยในกรณีที่เกิดร่วมกับภาวะโลหิตจางจากการขาดธาตุเหล็ก ซึ่งอาจจะทำให้การตรวจ RBC indices ให้ผลปกติได้ ดังนั้นการตรวจแล้วพบ macrocytes จะช่วยในการวินิจฉัย
- ตรวจไขกระดูกพบ megaloblastic erythropoiesis
- ในรายที่มีการขาดโฟเลตรุนแรงอาจพบ thrombocytopenia leukopenia ร่วมด้วย
การป้องกัน : ควรมีการเสริมโฟเลตวันละ 400 ไมโครกรัม ร่วมกับธาตุเหล็ก ในสตรีตั้งครรภ์ เพื่อป้องกันการเกิด megaloblastic anemia และการให้ก่อนการตั้งครรภ์ 1 เดือน ช่วยลดโอกาสการเกิด neural tube defect (NTD)แก่ทารกได้ แต่หากเคยมีประวัติลูกเป็น NTD แนะนำให้ทานวันละ 4 มก.
การรักษา
- รับประทานโฟเลต ขนาด 1 มก.ต่อวัน ร่วมกับการรับประทานอาหารที่มี folic acid สูง แต่ในรายที่มีภาวะ malabsorption หรือมีความต้องการมาก เช่น ครรภ์แฝด hemolytic anemia หรือ Crohn’s disease ให้รับประทานในขนาด 5 มก.ต่อวัน
- สำหรับผู้ป่วยที่ได้รับยากันชักที่มีผลท่าให้เกิด megaloblastic anemia อาจพิจารณาให้ low dose folic acid (500 ไมโครกรัมต่อวัน) ทุกวันจนกว่าจะหยุดยากันชัก แต่ทั้งนี้ยังไม่มีคำแนะนำที่ชัดเจนเพราะ folic acid อาจลดฤทธิ์ของยากันชักลงโดยการเพิ่มกระบวนการ metabolism (enzyme inducer) ดังนั้นจึงควรติดตามอย่าง ใกล้ชิดจนกว่าจะหยุดยากันชัก
การติดตามการรักษา : อาการของผู้ป่วยควรดีขึ้นตั้งแต่ช่วงแรกของการรักษา ระดับของ reticulocyte ควรจะเพิ่มสูงขึ้นภายใน 5-8 วันหลังจากเริ่มใช้ยา และ Hb จะเพิ่มขึ้นภายใน 2 สัปดาห์และกลับเป็นปกติภายใน 2 เดือน
2.2 Vitamin B12 Deficiency anemia
ภาวะโลหิตจางในสตรีตั้งครรภ์ที่มีสาเหตุจากการขาดวิตามินบี12 พบน้อย แต่มีความสำคัญเนื่องจากพบมีความผิดปกติเกี่ยวกับระบบประสาทและมีอาการทางจิตร่วมด้วยได้ เช่น ชา การทรงตัวผิดปกติ(ataxia) ขาดสมาธิ เป็นต้น จากสมองและ spinal cord ถูกทำลาย
พยาธิสรีรวิทยา
ในสตรีตั้งครรภ์ปกติจะมีระดับของวิตามินบี12 ต่ำลงเนื่องจากการลดลงของ binding proteins ได้แก่ haptocorrin (transcobalamins I) และ transcobalamin II, III โดยจะลดลงต่ำสุดในช่วงใกล้คลอด และหลังคลอดจะกลับมาเท่าระดับปกติก่อนตั้งครรภ์ภายใน 3-5 สัปดาห์
สาเหตุ
รับประทานอาหารที่มีวิตามินB12 ไม่เพียงพอ โดยเฉพาะมังสวิรัติ หรือมีภาวะทุพโภชนาการ
ภาวะบกพร่องในดูดซึมวิตามินB12 เช่น คนไข้ผ่าตัดกระเพาะอาหารออกบางส่วนหรือทั้งหมด มีความผิดปกติของลำไส้เช่น Crohn’s disease หรือ ขาด intrinsic factor ( pernicious anemia ) ซึ่งมีความจำเป็นในการดูดซึมวิตามินบี12
การวินิจฉัย
-serum vitamin B12 ต่ำกว่า 150 พิโคกรัมต่อมล. ร่วมกับการตรวจ RBC indices พบ macrocyte โดยมีค่า MCV มากกว่า 100 fL
-Schilling test เป็นการทดสอบเพื่อใช้ในการวินิจฉัยการดูดซึมที่ผิดปกติ โดยเฉพาะการขาด intrinsic factor หรือ pernicious anemia แต่ไม่แนะนำให้ทำในขณะตั้งครรภ์
การป้องกัน : รับประทานอาหารที่มีวิตามินบี12 คือการป้องกันที่ดีที่สุด ในผู้ป่วยที่ได้รับการผ่าตัดกระเพาะอาหารออกไปทั้งหมดจะต้องได้รับวิตามินบี12 ทางการฉีดเข้ากล้ามเนื้อ 1000 ไมโครกรัมเดือนละครั้ง ไปตลอดชีวิต
การรักษา : ให้รับประทานวิตามินบี12 ขนาด 1-2 มิลลิกรัมต่อวัน ทุกวันเป็น เวลา 1-2 สัปดาห์จนระดับ Hb กลับเป็นปกติ จากนั้นให้วันละ 1 มิลลิกรัมร่วมกับการรับประทานอาหารหรือผลิตภัณฑ์ที่มีวิตามินบี 12 สูง ส่วนอาการทางระบบประสาทจะกลับเป็นปกติได้อาจต้องใช้เวลาหลายเดือนถึงปี
3. ธาลัสซีเมีย (Thalassemia)
โรคโลหิตจางธาลัสซีเมีย (thalassemia) เป็นโรคพันธุกรรมทางโลหิตวิทยา ถ่ายทอดในลักษณะยีนด้อย (autosomal recessive) มีความผิดปกติในการสังเคราะห์ฮีโมโกลบิน ทำให้ผู้ป่วยที่เป็นโรคเกิดภาวะโลหิตจางซึ่งความรุนแรงจะต่างกันไปตามชนิดของธาลัสซีเมีย ตั้งแต่มีอาการเล็กน้อยจนถึงเกิดภาวะโลหิตจางเรื้อรัง มีการเจริญเติบโตไม่สมอายุ เกิดพยาธิสภาพของอวัยวะต่าง ๆ เช่น ตับม้ามโต หัวใจวาย เป็นต้น หากเป็นชนิดรุนแรงมากจะเสียชีวิตตั้งแต่อยู่ในครรภ์ การรักษาส่วนใหญ่เป็นการรักษาตามอาการและรักษาภาวะแทรกซ้อนต่าง ๆ ส่วนการรักษาให้หายขาดในปัจจุบันทำได้โดยการปลูกถ่ายไขกระดูก แต่มีความเสี่ยงถึงขั้นเสียชีวิตได้จึงทำในเฉพาะบางรายเท่านั้น
อุบัติการณ์สูงในประเทศไทย โดยประชากรมียีน alpha (α) thalassemia ร้อยละ 20-30, ยีน beta (β) thalassemia ร้อยละ 3-9 ยีน hemoglobin E (Hb E) ร้อยละ 13 ซึ่งสูงมากขึ้นในภาคอีสานถึงร้อยละ 30-40 ส่วน Hb Constant Spring (Hb CS) พบร้อยละ 1-8 (7)
ชนิดของธาลัสซีเมีย
ที่พบบ่อยแยกตามชนิดของสาย α และ β โกลบิน ได้ดังนี้
Alpha (α) thalassemia
- Hb Bart’s hydrops fetalis หรือ homozygous α-thal 1 มี genotype เป็น α-thal 1/ α-thal 1 หรือเขียนเป็น –/– เป็นจางธาลัสชนิดที่รุนแรงที่สุด ผู้ป่วยจะเสียชีวิตตั้งแต่อยู่ในครรภ์หรือหลังคลอด ปัญหาที่พบขณะตั้งครรภ์คือ ความดันโลหิตสูง บวม และครรภ์เป็นพิษ
- Hb H disease ที่พบบ่อยมี genotype 2 ชนิดใหญ่ๆคือ α -thal 1/ α -thal 2 หรือ –/-α และ α-thal 1/Hb CS หรือ –/ αcsα ผู้ป่วยส่วนใหญ่มีอาการน้อยถึงปานกลาง ได้แก่ อาการซีด เหลือง พบตับม้ามโตเล็กน้อย แต่ถ้ามีภาวะติดเชื้อจะมีภาวะซีดลงอย่างรวดเร็ว
Beta (β) thalassemia
- β thalassemia major หรือ homozygous β thalassemia disease ส่วนใหญ่มี genotype เป็น β0/β0 ผู้ป่วยจะเริ่มมีอาการซีดเร็วภายในอายุ 2 ปี อาการอื่น ๆ ที่พบได้ คือ ตับม้ามโต รูปโครงหน้าเปลี่ยน (thalassemia face) การเจริญเติบโตไม่สมอายุ หากไม่ได้รับเลือดจะมีอาการซีดมาก และหัวใจล้มเหลว แต่ในกลุ่มที่มี genotype β+/β+ มักจะมีอาการไม่รุนแรง
- β thalasemia/Hb E disease มี genotype เป็น β0/βE หรือ β+/βE อาการทางคลินิกพบได้ตั้งแต่ อาการรุนแรงมาก ปานกลาง และน้อย ขึ้นอยู่กับชนิดของ mutation
การแบ่งระดับของความรุนแรงของโรคตามการรักษา
- Thalassemia major (Transfusion-dependent thalassemia: TDT) คือ กลุ่มที่มีอาการรุนแรงจำเป็นต้องได้เลือดเป็นประจำ แต่หากให้การรักษาระดับ Hb ให้อยู่ระหว่าง 9.5-10.5 g/dl ร่วมกับให้ยาขับธาตุเหล็กอย่างสม่ำเสมอ สามารถมีชีวิตอยู่ได้มากกว่า 40 ปี
- Thalassemia intermedia (Non-transfusion-dependent thalassemia: NTDT) คือ กลุ่มที่มีอาการรุนแรงน้อยถึงปานกลาง โดยในภาวะปกติจะมี Hb 7-10 g/dl เมื่อมี stress หรือภาวะติดเชื้อจะทำให้ซีดลง อาจได้รับเลือดเป็นบางครั้ง
ตารางที่ 2 แสดงระดับความรุนแรงของ thalassemia แบ่งตามอาการ ระดับความเข้มข้นของเลือดและชนิดของโรคโลหิตจางธาลัสซีเมีย
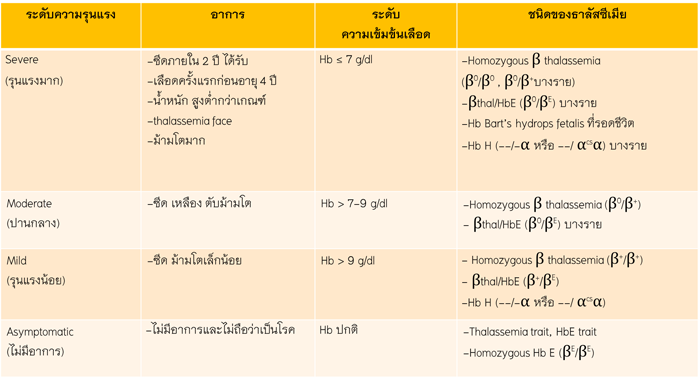
ที่มา : Clinical practice guidelines for diagnosis and management of thalassemia syndromes
การให้คำแนะนำปรึกษาก่อนตั้งครรภ์
หญิงวัยเจริญพันธุ์ที่เป็นโรคโลหิตจางธาลัสซีเมียชนิดรุนแรงหรือ TDT ที่วางแผนตั้งครรภ์ ควรมีระดับ Hb ที่ 10 g/dL จากการได้รับเลือดสม่ำเสมอและได้รับการประเมินการทำงานของหัวใจก่อน และให้คำแนะนำดังนี้
- คู่สามีควรได้รับการตรวจค้นหาการเป็นพาหะหรือเป็นโรคโลหิตจางธาลัสซีเมีย โดยตรวจชนิดของฮีโมโกลบินหรือชนิดของ mutation เพื่อประเมินความเสี่ยงต่อการมีบุตรเป็นธาลัสซีเมีย และหากพบว่ามีความเสี่ยงอาจเลือกหลีกเลี่ยงการมีบุตรเป็นโรคด้วยการวินิจฉัยก่อนคลอด ซึ่งทำได้ดังนี้ คือ
- การเก็บตัวอย่างเซลล์ทารก โดยการเจาะน้ำคร่ำเก็บเซลล์ fibroblast หรือตัดชิ้นเนื้อรก (chorionic villi sampling) เพื่อนำมาวิเคราะห์ความผิดปกติในระดับยีน โดยใช้ recombinant DNA technique หรือ gene mapping
- เก็บตัวอย่างเลือดจากสายสะดือทารกมาตรวจโดยใช้คลื่นความเสี่ยงสูงชี้นำ เพื่อนำมาตรวจ Hb typing
- ให้ความรู้ภาวะแทรกซ้อนต่าง ๆ ที่อาจเกิดขึ้นได้ทั้งต่อตัวแม่และทารกในครรภ์ โดยความเสี่ยงขึ้นกับความรุนแรงของภาวะซีดและอวัยวะภายในที่เสียหน้าที่จากภาวะเหล็กเกินตั้งแต่ก่อนการตั้งครรภ์ เช่น ทำให้อาการซีดรุนแรงมากขึ้น เพิ่มความเสี่ยงในการเกิดหัวใจล้มเหลว การเกิดเบาหวานขณะตั้งครรภ์ การติดเชื้อง่าย การแท้ง การคลอดก่อนกำหนด ความดันโลหิตสูง การทำหัตถการช่วยคลอดหรือการผ่าตัดคลอดสูงขึ้น การตกเลือดหลังคลอดที่มารดาทนต่อการเสียเลือดได้น้อยจากภาวะเลือดจาง และการติดเชื้อหลังคลอด ส่วนภาวะแทรกซ้อนของทารกเหมืนกับโลหิตจางอื่น ๆ
การดูแลรักษาขณะตั้งครรภ์
การดูแลรักษาควรใช้ทีมแพทย์สหสาขาร่วมกัน หลักการดูแลรักษาด้านแม่ มีดังต่อไปนี้
- งดการรักษาด้วยยาขับเหล็ก
- ให้เลือดเพื่อรักษาระดับ Hb ให้อยู่ที่ระดับ ไม่ต่ำกว่า 7-10 g/dl โดยการเลือกเลือดที่ใหควรเปนเลือดที่มีปริมาณเม็ดเลือดขาวนอย leukocyte poored PRC (LPCR) หรือ leukocyte depleted (LDPRC)
- รับประทานกรดโฟลิกเสริม 5 มก.ต่อวัน ทั้งก่อนและระหว่างการตั้งครรภ์ ทานอาหารที่มีโปรตีนสูง งดสูบบุหรี่และสารเสพติด
- เฝ้าระวังการติดเชื้อ เช่น การติดเชื้อในระบบทางเดินปัสสาวะ ให้การดูแลช่องปากและรักษาฟันผุ หลีกเลี่ยงการรับเชื้อจากผู้อื่น และระวังการติดเชื้อจากการรับเลือด
- ตรวจคัดกรองหรือค้นหาภาวะแทรกซ้อนที่อาจเกิดขึ้นได้บ่อยเมื่อตั้งครรภ์ ได้แก่ คัดกรองโรคเบาหวาน (glucose tolerance test) การประเมินการทำงานของหัวใจด้วยคลื่นเสียงสะท้อน ในรายที่ตัดม้ามหรือได้รับเลือดไม่สม่ำเสมอจะเพิ่มความเสี่ยงที่จะเกิดลิ่มเลือดอุดตัน จึงควรพิจารณาให้ยาต้านเลือดแข็งตัวหลังคลอด
- เฝ้าระวังภาวะแทรกซ้อนทางสูติกรรม เช่น การคลอดก่อนกำหนด ความดันโลหิตสูง การตกเลือดหลังคลอด กำหนดเวลาคลอดและวิธีคลอด พยายามให้คลอดทางช่องคลอด ยกเว้น มีข้อบ่งชี้จึงผ่าตัดทำคลอด
- หลังคลอดสามารถให้นมแม่ได้ถ้าแม่ไม่มีการติดเชื้อ เริ่มให้การรักษาด้วยยา ขับเหล็กและแนะนำวิธีการคุมกำเนิดที่เหมาะสม
หลักการดูแลด้านลูก มีดังต่อไปนี้
- วินิจฉัยทารกก่อนคลอดกรณีที่บิดาและมารดาเป็นคู่เสี่ยงต่อการเกิดโรคธาลัสซีเมียชนิดรุนแรง
- เฝ้าระวังการเติบโตและตรวจสุขภาพของทารกในครรภ์เป็นระยะ ทั้งทางคลินิก การตรวจด้วยคลื่นเสียงความถี่สูง และการตรวจคลื่นหัวใจไฟฟ้าทารกในครรภ์ (electronic fetal monitoring; EFM)
- หลังคลอดให้ฉีดวัคซีนป้องกันตับอักเสบบีแก่ทารกแรกเกิด
การเสริมธาตุเหล็กในผูที่เปนธาลัสซีเมีย
- งดการเสริมธาตุเหล็กในผูที่เปนโรคธาลัสซีเมีย เนื่องจากมีความเสี่ยงที่จะเกิดภาวะเหล็กเกินหรืออาจจะมีเหล็กเกินอยู่ก่อนแล้ว
- เสริมธาตุเหล็กในผูที่เปนพาหะธาลัสซีเมีย เนื่องจากมีความเสี่ยงที่จะขาดธาตุเหล็กไดเชนเดียวกับประชากรทั่วไปและไมมีความเสี่ยงที่จะสะสมธาตุเหล็กเกิน โดยปกติ Hb ของคนที่เป็นพาหะธาลัสซีเมียจะอยูในเกณฑปกติ แม้ว่าขนาดของเม็ดเลือดแดงจะเล็ก ดังนั้นหากพบว่าผู้ที่เป็นพาหะธาลัสซีเมียซีดอาจเกิดจากมีภาวะขาดธาตุเหล็กรวมดวย การเสริมธาตุเหล็กจะทําให Hb เพิ่มขึ้นเปนปกติได แต่มีข้อสังเกตคือขนาดเม็ดเลือดจะยังคงเล็กกวาปกติ
ตารางที่ 3 การเสริมธาตุเหล็กในผูที่เปนธาลัสซีเมีย
|
ชนิดธาลัสซีเมีย |
ความชุกในไทย |
ความเสี่ยงขาดเหล็ก |
ความเสี่ยงเหล็กเกิน |
คำแนะนำเสริมเหล็ก |
|
α thalassemia trait |
5-10% |
เสี่ยงขาดธาตุเหล็ก เช่นเดียวกับประชากรทั่วไป |
ไม่เสี่ยงภาวะเหล็กเกิน |
ควรเสริมธาตุเหล็ก |
|
β thalassemia trait |
0.1-7% |
เสี่ยงขาดธาตุเหล็ก เช่นเดียวกับประชากรทั่วไป |
ไม่เสี่ยงภาวะเหล็กเกิน |
ควรเสริมธาตุเหล็ก |
|
Hb E trait |
15-42% |
เสี่ยงขาดธาตุเหล็ก เช่นเดียวกับประชากรทั่วไป |
ไม่เสี่ยงภาวะเหล็กเกิน |
ควรเสริมธาตุเหล็ก |
|
Homozygous HbE |
0.1-16% |
เสี่ยงขาดธาตุเหล็ก น้อยกว่าประชากรทั่วไป |
ไม่เสี่ยงภาวะเหล็กเกิน |
ควรเสริมธาตุเหล็ก |
|
Hb H, Hb H-CS disease |
0.1-2.5% |
มีรายงานขาดธาตุเหล็ก ถ้าเลือดออกเรื้อรัง |
เสี่ยงภาวะเหล็กเกินในวัยกลางคน |
งดเสริมธาตุเหล็ก |
|
β thal-Hb E disease |
0.1-1.2% |
ไม่เสี่ยงขาดธาตุเหล็ก |
เสี่ยงภาวะเหล็กเกินในวัยรุ่น |
งดเสริมธาตุเหล็ก พึงระวังเหล็กเกิน |
|
Homozygous β thalassemia |
0.1-0.5% |
ไม่เสี่ยงขาดธาตุเหล็ก |
เสี่ยงภาวะเหล็กเกินในวัยรุ่น |
งดเสริมธาตุเหล็ก พึงระวังเหล็กเกิน |
ที่มา : Clinical practice guidelines for diagnosis and management of thalassemia syndromes
4.ภาวะโลหิตจางจากเม็ดเลือดแดงแตก (Hemolytic anemia)
Hemolytic anemia คือ ภาวะที่เกิดการทําลายเม็ดเลือดแดงกอนอายุขัย ซึ่งโดยทั่วไปเม็ดเลือดแดงจะมี อายุราว 120 วัน ซึ่งการทําลายเม็ดเลือดแดงนี้อาจเกิดภายในหลอดเลือดหรือที่อวัยวะที่มีหนาที่ทําลายเม็ดเลือดแดง เชน มาม โดยสามารถแบ่งกลุ่มโรคตามสาเหตุการเกิดได้ดังนี้
Hereditary hemolytic anemia
- Membrane disorders เช่น Hereditary spherocytosis, Hereditary stomatocytosis
- Enzyme disorders เชน G-6-PD deficiency, Pyruvate kinase deficiency
- Hemoglobin Disorders เช่น Sickle cell disease, Thalassemia
Acquired hemolytic anemia
- Immune เช่น Autoantibody (Autoimmune hemolytic anemia: AIHA)
- Non-immune เช่น Paroxysmal Nocturnal hemoglobinuria, malaria infection
4.1 Autoimmune Hemolytic anemia
พบได้ไม่บ่อย ประมาณ 1 ต่อ 140,000 ของการตั้งครรภ์ มีโลหิตจางเนื่องจาก 3 ปัจจัย คือ warm-active antibodies (ร้อยละ 80-90) , cold-active antibodies หรือร่วมกันทั้งสองแบบ โดยอาจจะเป็น primary(idiopathic) หรือ secondary จากโรคอื่นเช่น lymphoma, leukemia, connective tissue disease, drug-induced antibodies หรือการติดเชื้อ เป็นต้น สำหรับ cold-agglutinin disease นั้นสัมพันธ์กับการติดเชื้อ mycoplasma หรือ infectious mononucleosis(10)
การตั้งครรภ์อาจมีผลทำให้เพิ่มการแตกตัวของเม็ดเลือดแดงมากขึ้น ทำให้อาการของโรคแย่ลงได้โดยเฉพาะในไตรมาสที่สามของการตั้งครรภ์ และในรายที่เคย remission ไปแล้วอาจจะกลับมา relapse ได้ในช่วงตั้งครรภ์ ตัวของแอนติบอดีย์ IgG สามารถผ่านรกดังนั้นจึงมีผลทำลายเม็ดเลือดแดงของทารกได้
การตรวจ
- peripheral blood พบสิ่งที่บงถึงการทําลายเม็ดเลือดแดง เช่น spherocytosis , polychromasia หรือ nucleated red cell
- Direct antiglobulin test (DAT) หรือ direct Coombs’ test เป็นการตรวจหาแอนติบอดียบนเม็ดเลือดแดง
- Indirect antiglobulin test (IAT) หรือ indirect Coombs’ test เปนการตรวจหาออโตแอนติบอดียอิสระในเซรั่ม
- หากพบ thrombocytopenia ร่วมด้วยจะเรียกว่า Evans syndrome
การรักษา
การรักษาเหมือนกับรายที่ไม่ตั้งครรภ์ รับประทาน prednisone 1 มก.ต่อ กก.ต่อวัน ทางเลือกอื่นที่มีความปลอดภัยในคนตั้งครรภ์แต่ใช้ในกรณีที่การรักษาด้วย prednisolone ไม่ได้ผล เช่น IVIG , azathioprine และ การตัดม้าม แม้ว่า rituximab สามารถผ่านรกได้แต่ในรายงานที่ผ่านมายังไม่พบผลเสียต่อทารกในครรภ์(11,12) ส่วนการให้เลือดนั้นไม่มีความจำเป็นและมักมีปัญหาเม็ดเลือดแดงที่ได้รับถูกทำลายด้วยออโตแอนติบอดีย์ ยกเว้นจะให้ในกรณีที่มีภาวะโลหิตจางรุนแรงและเฉียบพลันอันตรายต่อชีวิต ซึ่งการอุ่นเลือดให้มีอุณหภูมิเท่ากับร่างกาย จะช่วยลดการถูกทำลายจาก cold agglutinin ได้
นอกจากนี้ AIHA ยังเพิ่มความเสี่ยงในการเกิดลิ่มเลือดอุดตัน จึงควรได้รับ thromboprophylaxis ด้วย LMWH ตั้งแต่ในช่วงตั้งครรภ์จนถึงหลังคลอด 6 สัปดาห์ โรคนี้เป็นโรคเรื้อรังและมักจะเป็นรุนแรงมากขึ้นเรื่อย ๆ การตั้งครรภ์หลายๆครั้งจึงไม่เหมาะสม
5. Aplastic anemia
พบน้อยในสตรีตั้งครรภ์แต่จัดว่าเป็นภาวะแทรกซ้อนที่รุนแรงมาก ความผิดปกติอยู่ที่มีการลด stem cells ในไขกระดูกลงอย่างมาก เซลล์ที่ไขกระดูกลดลงทั้งสามชนิด ( เม็ดเลือดแดง เม็ดเลือดขาว และเกล็ดเลือด) วินิจฉัยได้จากการที่พบว่ามีภาวะโลหิตจางร่วมกับเม็ดเลือดขาวต่ำและเกล็ดเลือดต่ำ รวมทั้งการมีจำนวนเม็ดเลือดในไขกระดูกลดลงอย่างมาก aplastic anemia อาจเป็นโดยกกำเนิดหรือเกิดขึ้นภายหลังก็ได้ ชนิดที่เกิดขึ้นภายหลังอาจเกิดจากการได้รับยาหรือสารเคมีบางชนิด การติดเชื้อ โดนรังสี และภูมิคุ้มกันบกพร่อง และรวมถึง Fanconi anemia ซึ่งถ่ายทอดแบบ autosomal recessive
ส่วนใหญ่ของโรคไม่สัมพันธ์กับการตั้งครรภ์แต่ส่วนหนึ่งเกิดจากการตั้งครรภ์มีส่วนชักนำให้เกิดโรค (pregnancy-induced aplastic/ hypoplastic anemia) ประมาณหนึ่งในสามของผู้ป่วยมีอาการดีขึ้นหรือหายได้ภายหลังคลอด และจะกลับมาเป็นอีกครั้งในการตั้งครรภ์ครั้งถัดไป
อันตรายสำคัญที่ต้องระมัดระวังเป็นพิเศษ คือการตกเลือด และการติดเชื้อ ดังนั้นในระหว่างการตั้งครรภ์จะต้องติดตามดูว่ามีการติดเชื้อหรือไม่ และถ้ามีต้องให้ยาปฏิชีวนะที่เหมาะสมทันที หลีกเลี่ยงการเสียเลือดให้มากที่สุดโดยเฉพาะในระยะคลอด
การรักษา
การปลูกถ่ายไขกระดูก (bone marrow transplantation) ได้ผลค่อนข้างดีช่วยยืดอายุได้ การตั้งครรภ์ที่ได้รับการปลูกถ่ายไขกระดูกมักจะไม่มีปัญหา แม้ว่าการ reject จะเพิ่มขึ้นบ้างจาการตั้งครรภ์ แต่ผลลัพธ์โดยรวมถือว่าใกล้เคียงครรภ์ปกติ
การให้ยากดภูมิคุ้มกัน เช่น anti-thymocyte globulin และ cyclosporine มีประสิทธิภาพดีพอสามควร
การให้ granulocyte ควรให้เฉพาะเวลาที่มีการติดเชื้ออย่างเฉียบพลัน
การให้ testosterone หรือ androgen อื่น ๆ ถ้าเป็นไปได้ควรหลีกเลี่ยงขณะตั้งครรภ์
การให้เม็ดเลือดแดงพิจารณาให้เมื่อมีอาการจากภาวะโลหิตจาง
ถ้าเกล็ดเลือดต่ำมากอาจต้องให้เกล็ดเลือด
การคลอดควรหลีกเลี่ยงการเสียเลือดให้มากที่สุด เช่น ให้คลอดทางช่องคลอด หลีกเลี่ยงแผลฉีกขาด ให้ยากระตุ้นให้มดลูกแข็งตัว ระมัดระวังการติดเชื้อ และตรวจรักษาโดยเร็ว
เอกสารอ้างอิง
- World Heath Organization,World wide prevalence of anemia 1993-2005, WHO Global database on anaemia,2008, 7-12.
- CDC criteria for anemia in children and childbearing-aged women. MMWR Morbidity and mortality weekly report. 1989;38(22):400-4.
- Koller O. The clinical significance of hemodilution during pregnancy. Obstet Gynaecol Surv 1982; 37(11):649-652.
- World Health Organization, Method of assessing iron status, Iron Deficiency Anemia Assessment, Prevention, and control A guide for program managers, 2001, 33-43.
- สํานักโภชนาการ กรมอนามัย กระทรวงสาธารณสุข,คูมือแนวทางการควบคุมและปองกันโลหิตจางจากการขาดธาตุเหล็ก, 2556, 2.
- ACOG Practice Bulletin No. 95: Anemia in pregnancy. Obstetrics and gynecology. 2008;108(2):457-64.
- มูลนิธิโรคโลหิตจางธาลัสซีเมียแหงประเทศไทย. Clinical practice guidelines for diagnosis and management of thalassemia syndrome. 2006.
- ธีระ ทองสง,ชเนนทร์ วนาภิรักษ์ . โรคทางโลหิตวิทยาในสตรีตั้งครรภ์. สูติศาสตร์ 2555 ;1:383-403.
- Centers for disease control and prevention, Recommendation to prevent and control iron deficiency in the unites states, MMWR Recomm Rep1998,47(RR-3):1-29.
- British Committee for Standards in Haematology: The Diagnosis and Mangement of Primary Autoimmune Haemolytic Anaemia.
- Chakravarty,E.F., Murray,E.R., Kelman,A., & Farmer,P. (2011) Pregnancy outcomes after maternal exposure to rituximab. Blood, 117, 1499-1506.
- Bussone,G., Ribeiro,E., Dechartres,A., Viallard,J.F., Bonnotte,B., Fain,O., Godeau,B., & Michel,M. Efficacy and safety of rituximab in adults’ warm antibody autoimmune haemolytic anemia: retrospective analysis of 27 cases. American Journal of Hematology, (2009),84, 153-157.