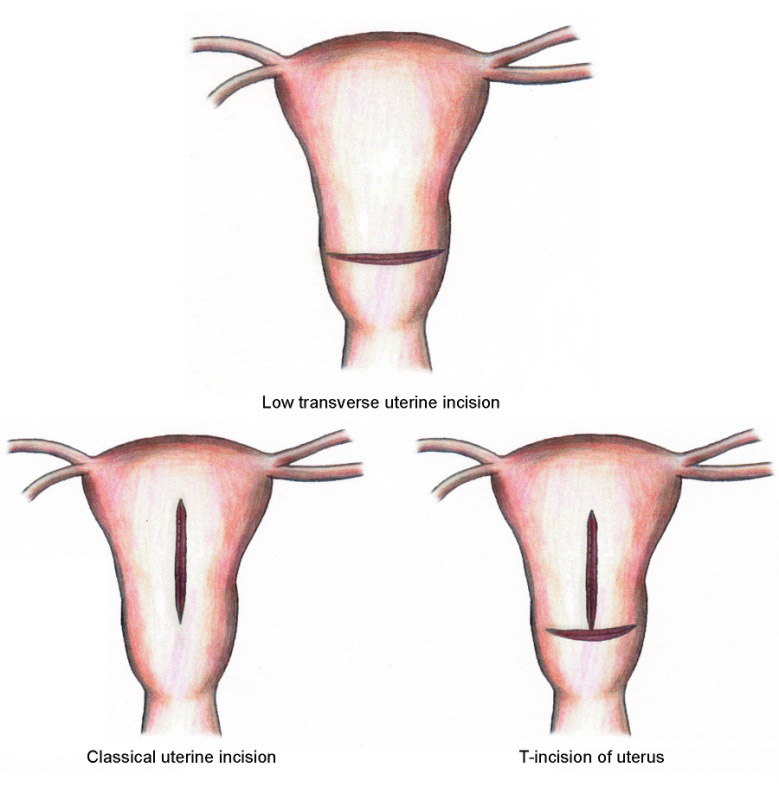
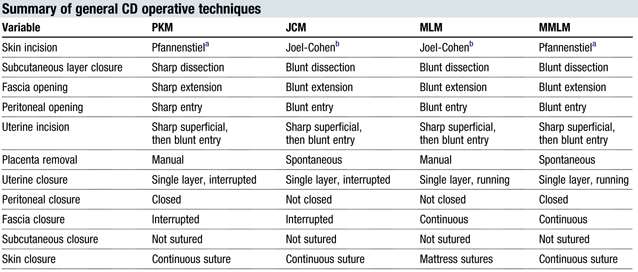
Surgical management in postpartum hemorrhage
Surgical management in PPH
นพ. พิชญ์วิทย์ บุญนำ
อาจารย์ที่ปรึกษา ศ. นพ. จตุพล ศรีสมบูรณ์
Postpartum hemorrhage
คือ เสียเลือดมากกว่าหรือเท่ากับ 1,000 มิลลิลิตร หรือ เสียเลือดร่วมกับอาการหรือสัญญาณชีพของภาวะช็อค(1)
มี 2 แบบ
- Primary (early) เสียเลือดหลังคลอดใน 24 ชั่วโมงแรกหลังคลอด
- Secondary(late) หรือdelay postpartum hemorrhage คือเสียเลือด 24 ชั่วโมงแรก จนถึง 12 สัปดาห์หลังคลอด
หลังจากเสียเลือดมาก มารดามีโอกาสเสียชีวิตได้ หรือมีภาวะแทรกซ้อนอื่นๆตามมาเช่น respiratory distress syndrome , shock, disseminated intravascular coagulation, acute renal failure , loss fertility, Sheehan syndromeได้
Cause of post-partum hemorrhage (1)
Primary cause :
- Uterine atony
- Lacerations
- Retained placenta
- Abnormally adherent placenta (accreta)
- Defects of coagulation (eg. DIC, amniotic fluid embolism, severe preeclampsia, placenta abruption)
- Uterine inversion
Secondary cause
- Subinvolution of the placenta site
- Retained products of conception
- Infection
- Inherited coagulation defects (eg. Von willebrand)
เมื่อพบว่าผู้ป่วย มีภาวะตกเลือดหลังคลอด ควรประเมินหาสาเหตุ โดยอาจจะท่องจำ 4Ts ได้แก่ tone, trauma, tissue, thrombin ซึ่งสาเหตุส่วนใหญ่มาจากปัญหาแข็งตัวของมดลูก (uterine tone)ถึงร้อยละ 70-80(1) การรักษาในปัจจุบันมีทั้งการใช้ยา และ การทำหัตถการ โดยเบื้องต้นการใช้ยาและการทำหัตถการไม่รุนแรงเป็นการรักษาเบื้องต้น ส่วนการรักษาโดยการผ่าตัดมักจะเป็นตัวเลือกสุดท้าย ในหัวข้อนี้จะขออธิบายเพียงแต่การทำหัตถการเท่านั้น
Surgical management of uterine atony
1. Tamponade techniques
พิจารณาทำเมื่อรักษาด้วยยาล้มเหลว และ การทำ bimanual uterine massage ไม่ดีขึ้น มีงานวิจัย(2) ว่าวิธีนี้สามารถลดการผ่าตัดหรือการทำหัตถการอื่นๆได้ถึง 75-86% บอลลูนจะทำหน้าที่กดบริเวณผนังมดลูกและบริเวณที่มีเลือดออก ภาวะแทรกซ้อนจากการใส่ balloon temponade : มดลูกทะลุ หรือ มีบาดเจ็บปากช่องคลอดจากใส่สายบอลลูน นอกจากนี้สามารถมี ไข้ และ การติดเชื้อ แต่อย่างไรก็ตามมีหลายปัจจัยที่นำไปสู่ไข้หลังคลอด ไม่สามารถพิสูจน์ได้ชัดเจนว่ามาจากการใส่บอลลูน
ลักษณะของบอลลูนมีหลายแบบในปัจจุบัน ดังนี้
รูปที่ 1-2 แสดงบอลลูนที่ใช้ แบบต่างๆ
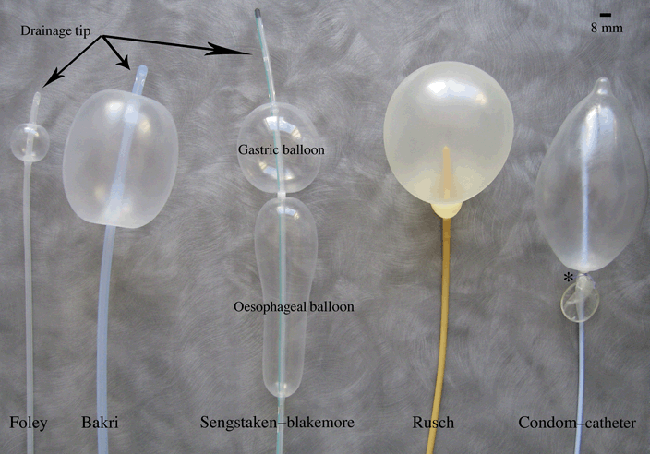

(รูปจาก https://www.semanticscholar.org/paper/Balloon-tamponade-in-the-management-of-postpartum-a-Georgiou/9dac2f3fe4c8197eab53ff206ed2857185e3e0ec?tab=abstract )
1.1 Balloon temponade ในปัจจุบันมีแบบสำเร็จรูปขาย 2 แบบ Bakri balloon , Ebb uterine tamponade system
- Bakri balloon เป็นอุปกรณ์บอลลูน 1 ลูกที่ออกแบบมาเฉพาะเพื่อออกแรงกดผนังมดลูก สามารถทำร่วมกับ Uterine compression suture สามารถหยุดเลือดออกได้ถึง 85 % มีข้อดีคือสามารถทำได้รวดเร็ว และราคาไม่แพง
รูปที่ 3 แสดงตัวอย่างเครื่องมือ Bakri
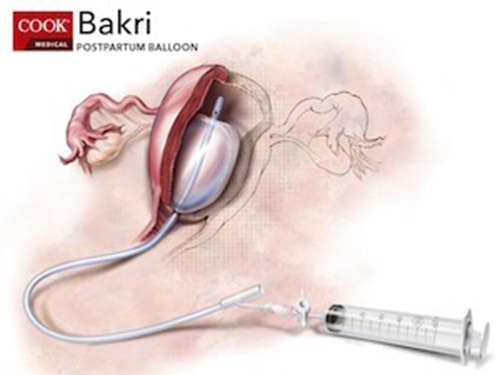
(รูปจาก http://www.mambamart.com/bakri-postpartum-balloon-with-rapid-installation-components-1-ea-cook-medical-j-sosr-100500)
ข้อห้ามทำ (Contraindication) :
- ผู้ป่วยมีภาวะเสียเลือดที่ต้องการการผ่าตัดเปิดตัดมดลูก
- แพ้ สารประกอบในอุปกรณ์
- ความผิดปกติของมดลูก (uterine anomaly)
- สงสัยภาวะมดลูกทะลุ
- ติดเชื้อบริเวณปากมดลูก ช่องคลอด มดลูกอยู่ , มะเร็งปากมดลูก
เทคนิคการใส่บอลลูน
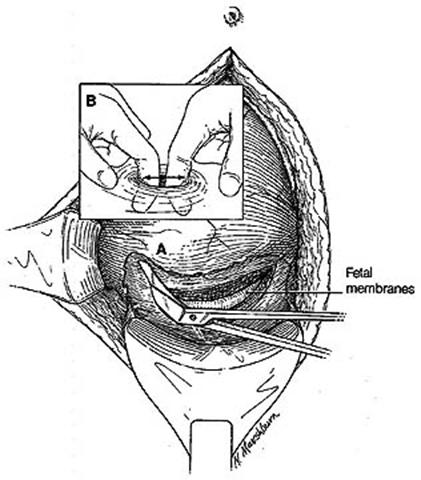
1. หลังคลอดทางช่องคลอด
- ใส่สายสวนปัสสาวะเพื่อให้แน่ใจว่ากระเพาะปัสสาวะไม่มีปัสสาวะอยู่
- ทำความสะอาดช่องคลอด และปากช่องคลอด ด้วยน้ำยาฆ่าเชื้อ เช่น povidine เป็นต้น
- ยืนยันว่า ไม่มีแผลฉีกขาดเลือดออกอยู่, ไม่มีรกค้างในมดลูก
- ใช้ ring forcep จับ anterior lip of cervix จากนั้นจึงใส่บอลลูนเข้ามดลูก โดยไม่ออกแรงมากไป อาจเกิดมดลูกทะลุ ได้
- อาศัย 3 คน คนแรกทำอัลตราซาวน์หน้าท้องระหว่างทำหัตถการ คนที่2 คือน้ำบอลลูนเข้าไปวางในมดลูก คนที่3 คือคนเติมน้ำเข้าไปในบอลลูน โดยสามารถเติมได้ แนะนำ 300-500 ml. (มากสุดได้ถึง 500 ml.) ไม่ควรเติมอากาศหรือแก็สเข้าไป
- ทำ Vaginal packing เพื่อป้องกันไม่ให้เลือด และ balloon ไหลออกทางช่องคลด
- เพื่อหยุดเลือด จากนั้น 12 ชั่วโมง ค่อยนำออก (3)
2.ทางหน้าท้องขณะผ่าตัดคลอด
- ใส่ปลายสายของ สายสวนผ่านแผลมดลูก จากนั้น นำปลายสายผ่านรูปากมดลูก ช่องคลอด ให้ผู้ช่วยออกแรงดึงออกทางปากช่องคลอด
- เย็บปิดมดลูก ระวังไม่ให้โดน balloon
- ให้ผู้ช่วยเติมน้ำเช้าไปในบอลลูน
Periprocedure monitor and care
- ทำ tamponade test ขณะเริ่มทำวางบอลลูน โดยถ้าหลังจากวางไปเลือดออกลดลง ให้ผลบวก จากนั้นจึงเริ่มเติมน้ำเข้าบอลลูกมากขึ้น ช่วยลดการทำหัตถการต่อไป หากBalloon ล้มเหลว การรักษาควรเป็นการผ่าตัดเปิดหน้าท้องต่อไป
- ให้ยาปฏิชีวนะป้องกันติดเชื้อต่อเนื่องระหว่างยังคงใส่สายสวน ลดการติดเชื้อ iatrogenic infection โดยส่วนมากนิยมให้ cephalosporin
- ให้ยากระตุ้นมดลูกแข็งตัว ส่วนใหญ่ใช้ oxytocin iv.drip 6-8 ชั่วโมง โดยอาจให้ร่วมกับยากระตุ้นมดลูกตัวอื่นๆ
- อาจจะถ่วงน้ำหนัก ร่วมกับทำvaginal packing เพื่อเพิ่ม pressure หรืออาจจะไม่ถ่วงก็ได้เช่นกัน(4)
- สวนล้างสายระบายเลือดเป็นระยะ เพื่อป้องกันลิ่มเลือดอุดตันสาย
- หลังจาก สัญญาณชีพคงที่ , ไม่มีเลือดออกเพิ่มเติมและการแข็งตัวของเลือดปกติ สามารถเอาสายสวนออกได้ 2-12 ชั่วโมง มีงานวิจัยเปรียบเทียบระหว่างใส่สายสวน 2 ชั่วโมง กับ 12 ชั่วโมงพบว่าไม่มีความแตกต่างกันในการหยุดเลือดออกจึงแนะนำให้ใส่ 12 ชั่วโมงเป็นอย่างน้อย (5) พยายามหลีกเลี่ยงการใส่นานเกิน 24 ชั่วโมง เพื่อป้องกันการติดเชื้อ การขาดเลือดของเนื้อเยื่อ
- จะค่อยๆ ลดปริมาณในบอลลูน หรือปล่อยในครั้งเดียวก็ได้ หลังจากเอาน้ำออกหมดควรใส่ค้างไว้ 30 นาที เพื่อดูเลือดออกซ้ำ
Ebb uterine tamponade system วิธีใส่เช่นเดียวกับใส่ bakri ballon
มีข้อดีคือ Dual balloon, สามารถเติมน้ำและปรับตำแหน่งballoon ได้ใน uterine balloon รับน้ำได้มากสุด 750 มิลลิลิตร และ vagina balloon รับน้ำได้ มากสุด 300 มิลลิตร ช่วยออกแรงกดภายใน,มีรูสำหรับระบายเลือดภายในโพรงได้ ภาพอีกทั้งมี portสำหรับเติมน้ำเข้า balloon uterine, vagina แยกกัน และมี port สำหรับ irrgate และ drain แยกจากกัน ในประเรื่องประสิทธิจากรายงานหลังจากเติมน้ำในuterine balloon 500 มิลลิลิตร จะช่วยหยุดเลือดได้ถึง 98% (6)
รูปที่ 4 แสดงตัวอย่าง Ebb uterine tamponade
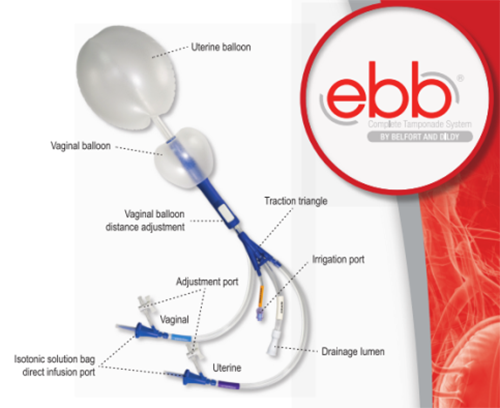
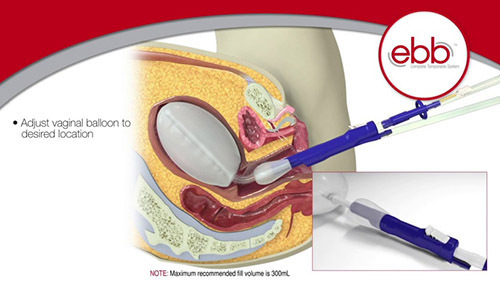
(รูปจาก https://www.superiormedical.com/product/ebb/)
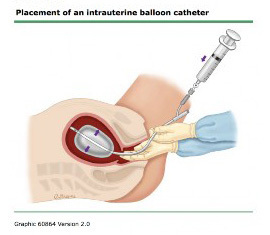
1.2 ใช้สายสวนปัสสาวะ Foley catheter
มีข้อดีคือสามารถทำได้ง่าย ใช้เวลาน้อย ราคาถูก และวัสดุสามารถหาได้ง่าย
โดยปลายบอลลูนของสายขนาด 24F-30F สามารถบรรจุ 60 ml ใน อาจใช้สายFoley หลายอันเพื่อใช้ห้ามเลือด มีข้อดีที่ปลายสายมีรูระบายเลือดจากโพรงมดลูก ช่วยให้สังเกตุการไหลของเลือดได้อีกด้วย ถ้าเลือดหยุดไหลสามารถเอาสายสวนออกได้ตั้งแต่ 12-24 ชั่วโมงหลังคลอด
ขั้นตอนการทำ
- ผู้ป่วยอยู่ในท่า Lithotomy
- ทำความสะอาด vagina ด้วย antiseptic solution
- นำ ring forcep จับ anterior lip of cervix
- ใช้มือหนึ่งสอดเข้าไปเพื่อรอ Guide สาย foley เข้าโพรงมดลูก มืออีกข้างนำสาย foley เข้าไปจนสุดโพรงมดลูก
- ดึงสาย foley สายแรกจากนั้นดึงลงมา 3-4 ซม.จากนั้นเติมน้ำ 60 มิลลิลิตร เพื่อไม่ให้ balloon ถอยออก
- เติมน้ำเข้าไปballoonอีกเส้น 60 มิลลิลิตรเช่นเดียวกัน จากนั้นทำ Gauze packing ใน vagina เพื่อกั้นไม่ให้บอลลูนเลือนหลุดลงมา
รูปที่ 5 แสดงการใช้ foley balloon uterine tamponade
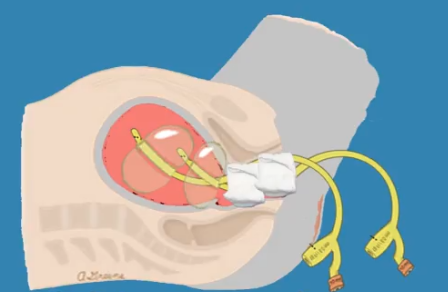
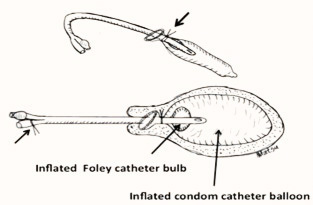
1.3 Double condom intrauterine balloon tamponade
รูปที่ 6 แสดงการทำ Double condom intrauterine balloon tamponade

เตรียมอุปกรณ์ ใช้ ถุงยางอนามัยซ้อนกัน 2 ชั้น ใช้ปลายของสาย Foleyดันจากข้าง โดยถอยปลาย foley cathออกจาก condom 1-2 cm. จากนั้นนำzilk มาผูกห่างจากปลายถุงยางอนามั ยประมาณ 5-7 ซม. ผูก2ชั้น จากนั้นทดสอบการรัวของน้ำก่อน ใช้โดยการใช้ Irrigated Syringe ดูด Serine water ประมาณ 20-30 มิลลิลิตร ดูว่าเลื่อนหลุดหรือไม่
การใส่อุปกรณ์
- ผู้ป่วยอยู่ในท่า Lithotomy
- ล้วง blood clot ที่อยู่ในมดลูกออกให้หมดก่อน
- ใช้นิ้วชี้ละนิ้วกลางของมือด้านที่ถนัดคีบปลาย condom balloon เข้าในโพรงมดลูก โดยใช้มืออีกข้างกดมดลูก ให้cervical os ลงมาใกล้
- ให้ผู้ช่วยเติม sterile water 200-300 ml. ไม่เกิน 500 ml.โดยมือข้างที่ถนัดพยายามอย่าให้ condom balloon เลื่อนหลุดออกจากโพรงมดลูก จนรู้สึกตึงที่ cervical os
- ทำ vagina packing กันไม่ให้balloon เลื่อนหลุด ในทางปฏิบัติค่อนข้างเลื่อนหลุดง่าย โดยเฉพาะหากต้องrefer ต้องให้แพทย์สอดมือเข้าไปเพื่อออกแรงดัน และประคองบอลลูนไว้
- ผูกzilk ปลายสาย foley เพื่อไม่ให้น้ำไหลออก
1.4 Gauze packing
ไม่ค่อยนิยมทำวิธีนี้ เนื่องจากค่อนข้างใช้เวลาทำนาน อีกทั้ง Gauze สามารถชุ่มเลือดได้ง่าย จึงให้แรงกดลดลง ,ไม่มีสายระบายเพื่อเฝ้าระวังเลือดออก, Gauze มีโอกาสติดแน่นกับมดลูก เพิ่มโอกาสติดเชื้อได้ง่าย
ขั้นตอนการทำ
ใช้ก๊อซ ขนาด 4 นิ้ว ผสม Trombin 5000 units ใน saline 5 ml. จากนั้นใส่ในโพรงมดลูก ตั้งแต่บริเวณ Cornu จนถึงอีกข้าง โดยใช้ Ring forcep
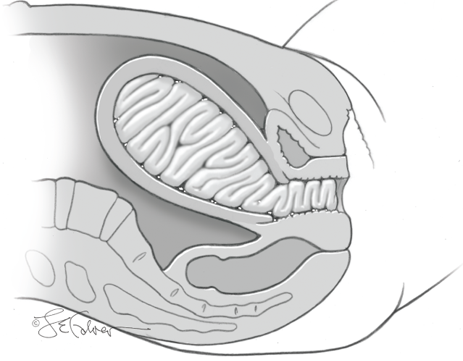
รูปที่ 6 แสดงการทำ Gauze packing
2. Uterine compression suture
ทำเมื่อให้การรักษาด้วยยา และ Non surgical uterine compressionล้มเหลว วิธีนี้จะช่วยออกแรงกดมดลูกลดเลือดออก
มีหลากหลายเทคนิค ที่นิยมใช้คือ B-lynch technique นอกจากนี้มีวิธีอื่นๆ Modifications of B-lynch suture เช่น Cho ,Hayman เป็นต้น ซึ่งจากงานวิจัยให้ประสิทธิภาพใกล้เคียงกัน (5)
ก่อนเริ่มทำการผ่าตัด ควรเตรียมผู้ป่วยอยู่ในท่า Semi-lithotomy(frog leg) position เสมอ ผู้ช่วยอยู่ระหว่างขาจะคอยดูเรื่อง bleeding ได้
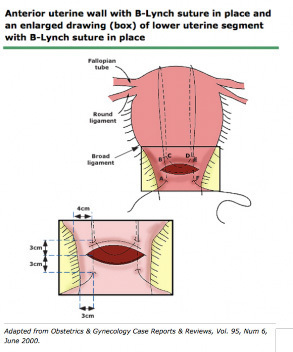
2.1 B-lynch technique
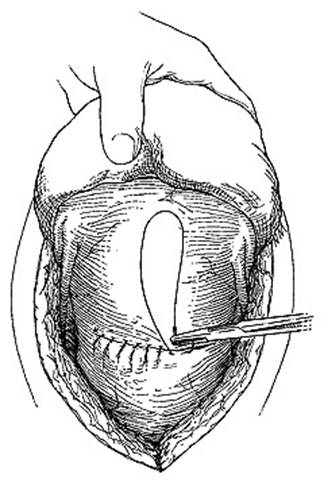
ข้อดีของวิธีนี้ สามารถดูภายในโพรงมดลูกได้ เอาเนื้อเยื่อตกค้างออกได้หมดก่อน , สามารถทำได้ง่ายและรวดเร็ว , สามารถกดบริเวณ Lower segment uterine (โดยเฉพาะกรณีเลือดออกจาก Placenta ผิดปกติ) ,ยังคงสามารถมีบุตรได้, สามารถใช้ร่วมกับ Uterine balloon tamponade เรียกว่า Uterine sandwich technique โดยภายนอกสามารถเย็บเป็น Blynch หรือ Haymanก็ได้ , มีงานวิจัยหลายอันรองรับประสิทธิภาพหยุดเลือดได้ (1)หยุดเลือดออก โดยใช้มือวางหน้า-หลังมดลูก จนถึง Bladder flections หากกดแล้วเลือดหยุดออกทางช่องคลอด โอกาสเย็บแล้วประสบความสำเร็จสูง
ให้ผู้ช่วยใช้มือจับยอดมดลูก ยกมดลูกขึ้นมาที่บริเวณแผลหน้าท้อง ใช้ bladder retractor กันแยกเยื่อบุช่องท้องลงไปทางด้านล่างให้เห็นขอบแผล hysterotomy ชัดเจน
ถ้าผู้ทำถนัดมือขวาให้ยืนด้านขวาของผู้ป่วย เริ่มต้นเย็บจากด้านซ้ายของมดลูกก่อน
- เตรียมเข็ม Monocryl No.1 , straight or shallow curve round ยาว 7 cm. ความยาวsuture 70 cm.อย่างน้อย เนื่องจากมีความคงทน อีกทั้งสามารถดูดซึม ช่วยลดโอกาสเกิด bowel herniation ผ่าน loop suture ได้ (1)
- เข็มแรก ปักตำแหน่ง 3 ซม. ต่ำกว่าขอบล่างของแผลกรีดที่มดลูก ออกมาเหนือขอบบนของแผล 3 ซม. โดยแนวเข็มจะปักห่างจากขอบด้านข้าง 4 ซม.
- อ้อมไปบนยอดมดลูกและด้านหลัง ปักเข้าไปตำแหน่ง Uterosacral ligament เข้าโพรงมดลูก ปักเข้มออกมาตามแนวขวางออกมาอีกข้าง จากนั้น อ้อมขึ้นไปมดลูก
- ปักเข็มด้านหน้ามดลูก ในตำแหน่งเดียวกัน สอดคล้องกับอีกฝั่ง
- รวมปลายไหมทั้งสองข้าง พร้อมกับให้ผู้ช่วยทำ bimanual compression , ให้ผู้ช่วยอีกคนดูว่าเลือดไหลในช่องคลอด ถ้าไม่มีเลือดออกให้ผูกไหมได้ วิธีนี้ สามารถลดการทำ intervention อื่นๆได้ถึง 82% (62ใน75 case)(7)
รูปที่ 7 แสดงการเย็บ B lynch technique
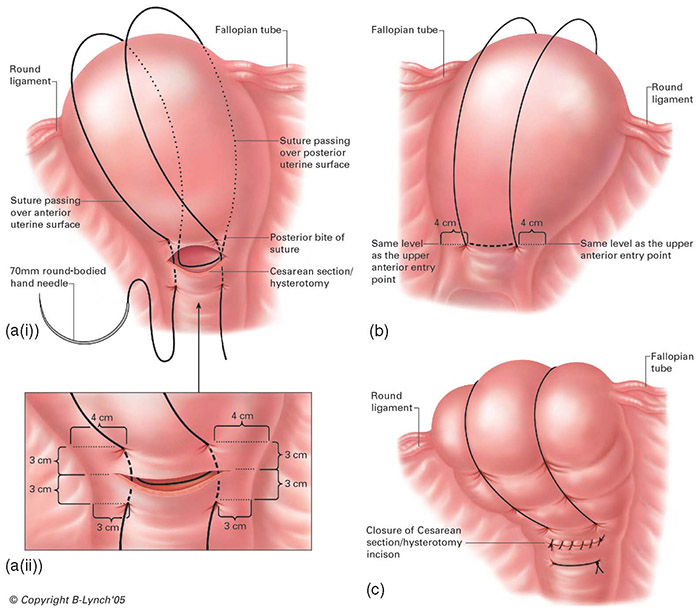
(รูปจาก http://www.cblynch.co.uk/surgical-management-of-intractable-pelvic-hemorrhage )
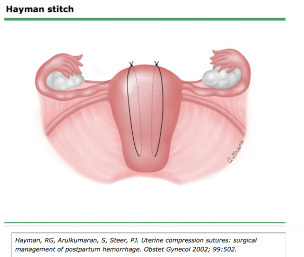
2.2 Hayman technique
ทำได้โดยไม่ต้องเปิดแผลที่มดลูก จึงเหมาะในกรณี Vagina delivery แล้วมี atony, หรือ เย็บแผลhysterotomyไปแล้วก็สามารถใช้ได้เช่นกัน
ใช้ Vicryl หรือ Dexon No.1-2 อาจจะเป็นเข็มตรงจะทำง่ายขึ้น ค่อนข้างทำได้ง่ายเป็นการเย็บแผลแนวตรง 2-4 แนว จากด้านหน้า ถึงด้านหลังของมดลูก จากนั้นให้ผู้ช่วยบีบมดลูก จึงผูก knot กรณีต้องการลดเลือดออกจาก Lower segment สามารถเย็บแผลแนว Transverse cervicoisthmic suture ได้
อย่างไรก็ตามมีข้อจำกัดที่หากทั้ง2ข้างออกแรงผูกปมไม่เท่ากันมีโอกาสเกิด slipping, ischemia ขึ้นได้
รูปที่ 8 แสดงวิธีเย็บ Hayman technique
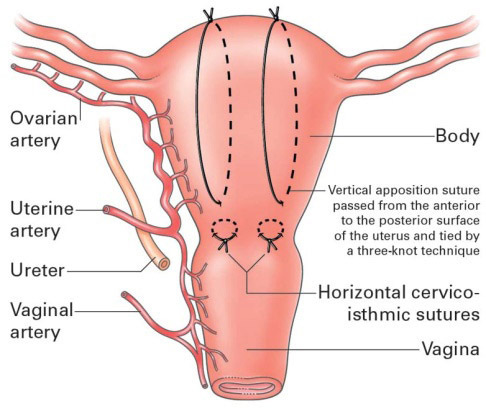
(รูปจาก http://www.cblynch.co.uk/surgical-management-of-intractable-pelvic-hemorrhage )
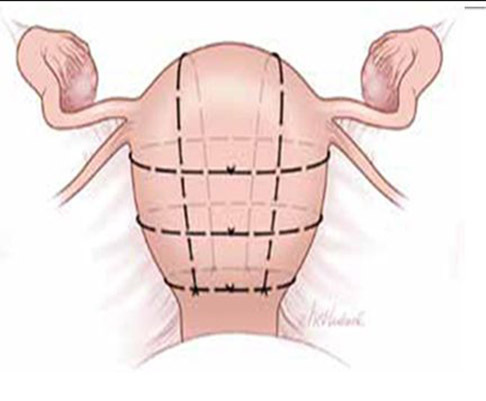
2.3 Cho technique
ทำโดยเย็บเป็นรูปสี่เหลี่ยมจัตุรัส 2-5 ตำแหน่ง โดยปักsuture จาก ด้านหน้าไปด้านหลัง ช่วยลดเลือดออกได้ตรงตำแหน่ง
วิธีนี้ค่อนข้างใช้เวลาในการเย็บนาน ,มีความเสี่ยงที่จะเกิด Pyometraได้ เนื่องจากไม่มีรูระบายออกจากโพรงมดลูก, มีโอกาสเกิด Uterine synechiaeได้
รูปที่ 9 แสดงการเย็บ Cho technique
(รูปจาก http://www.cblynch.co.uk/surgical-management-of-intractable-pelvic-hemorrhage )
2.4 Pereira technique
ใช้ Chromic catgut เบอร์ 1 โดยเย็บผูกรัดมดลูกแนว Transverse และ Longitudinal suture รัดรอบมดลูกปักเข็มบริเวณ Subserosal myometrium โดยไม่เข้าไปในโพรงมดลูก ในแนว Transverse จะปักไปตำแหน่ง Broad ligament หลีกเลี่ยง Blood vessel, Ureter, Fallopian tubes ในแนว Longuitudinal ปักตำแหน่งใกล้กับปากมดลูก
รูปที่ 9 แสดงการเย็บ Cho technique (รูปจาก http://www.cblynch.co.uk/surgical-management-of-intractable-pelvic-hemorrhage )
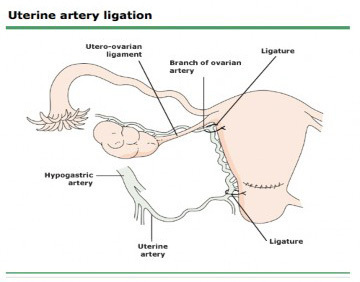
3. Vascular ligation
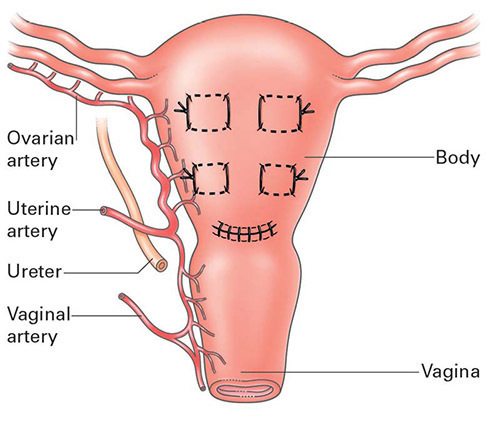
เหมาะสมสำหรับมีการฉีกขาดด้านข้างของแผลที่มดลูก สำหรับเป้าหมายในการรักษาuterine atony คือ การลดเลือดไปยังมดลูก ที่นิยมทำได้แก่ Bilateral uterine artery ligation ( O’Leary sutures) เนื่องจากสามารถทำง่ายและ เป็น90% ของเส้นเลือดที่มาเลี้ยงมดลูกจึงสามารถหยุดเลือดไปยังมดลูกได้ดี(8) ถ้ายังไม่ดีขึ้น สามารถเย็บเส้นเลือดที่มาจาก ovarian a. ผ่านบริเวณ utero ovarian ligament ต่อไปโดยมีรายงานวิจัยเมื่อทำทั้งสองวิธีร่วมกันให้ประสิทธิภาพการรักษาถึง 92 % (9) และไม่ส่งผลต่อการมีบุตรในอนาคตอีกด้วย
สุดท้ายถ้าไม่ดีขึ้น ทำ Internal iliac (hypogastric) artery ligationต่อไป ซึ่งลดเลือดได้ 96%(10) เมื่อกดpressure ช่วยให้เลือดแข็งตัวดีขึ้น การทำวิธีนี้ต้องเปิดทาง retroperitoneal, ระวังบาดเจ็บต่อ ureter, vessleใกล้เคียงจึงได้รับความนิยมทำลดลง และผู้ผ่าตัดไม่ค่อยคุ้นเคยกับเทคนิคนี้
1. Bilateral uterine artery ligation : มีประโยชน์หยุดเลือดที่ออกจาก lower segment uterine เช่น รกเกาะต่ำ, แผลฉีกขาดส่วนล่างมดลูก เป็นต้น
ขั้นตอนการทำ
1.1 Low ligation
- ให้ผู้ช่วยดึงมดลูกขึ้นเหนือแผล ใช้ bladder retractor กันแยกเยื่อบุช่องท้องลงไปทางด้านล่าง
- คล้ำเส้นเลือดเพื่อหาตำแหน่ง uterine artery และ เห็น ureter , โยกกระเพาะปัสสาวะไปด้านหน้า โดยนำมือดันBroad ligament จากข้างหลังให้เห็นชัดเจน
- โยกมดลูกขึ้นบนไปด้านตรงข้ามที่ต้องการผูก ใช้ babcock หนีบ vessel ที่ต้องการ
- ใช้เข็มใหญ่ No. 1 Absorbable suture ผ่านบริเวณ myometrium ด้านmedial 2-3 ซม. ต่อ uterine artery และต่ำกว่า uterine incision (เพื่อหยุดเลือดที่ออกจากintramyometrial ascending branch ร่วมด้วย)
- ปักเข็มออกบริเวณ Avascular area ของ broad ligament , Lateral และขึ้นบน ต่อ uterine a.
- ทำเหมือนกัน ทั้ง 2 ข้าง
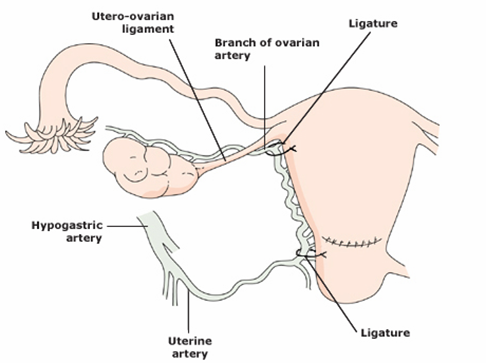
1.2 High ligation (ผูก Brach of ovarian a )
- ปักเข็มใหญ่ No. 1-0 Absorbable suture เข้า myometrium บริเวณ cornu
- ออกด้านข้างที่Broad ligament ที่บริเวณรอยต่อของ utero-ovarian ligament และ uterus
รูปที่ 10 แสดง Bilateral uterine ligation
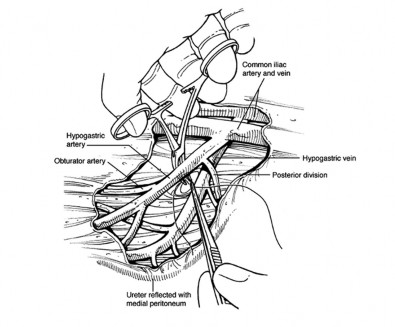
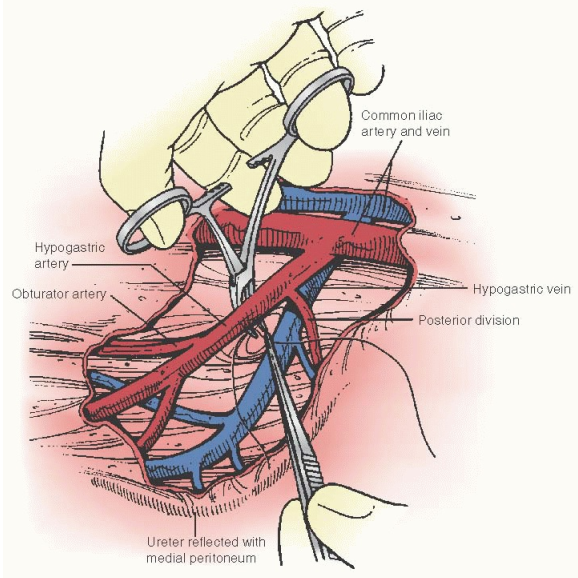
2. Internal iliac artery ligation : เป็นเส้นเลือดหลักเข้ามาเลี้ยงมดลูก ดังนั้นจึงลดโอกาสการผ่าตัด hysterectomyลงได้ จากรายงานการทำ internal iliac a. ligationไม่ส่งผลต่อการมีบุตร(11) อย่างไรก็ตามค่อนข้างทำได้ยากหากยังไม่ชำนาญ
ขั้นตอนการทำ(12)
- เปิด peritoneum ระหว่าง Infundibulopelvic ligament และ Round ligament และแยก ureterออกไปทางด้าน medial เพื่อป้องกันบาดเจ็บ
- คล้ำปลายเส้นเลือด external iliac artery เพื่อยืนยันว่าpulse จริง บริเวณต่ำกว่า inguinal area
- เปิด areolar sheath หุ้ม arteryนำ right angle clamp ผ่านใต้artery จากด้านข้าง ระวังเส้น liac veinที่อยู่ใกล้
- นำ Right-angle clamp ผ่านใต้artery จากด้านข้าง ตำแหน่งที่ 2 ซม. จาก bifurcation of common iliac artery เพื่อหลีกเลี่ยงโดน posterior branch internal iliac a.(หากโดนจะทำให้ Gluteus ขาดเลือด) ใช้ไหม non absorbable zilk 2-0 จำนวน 2 เส้น
รูปที่ 11 แสดง Internal iliac artery ligation
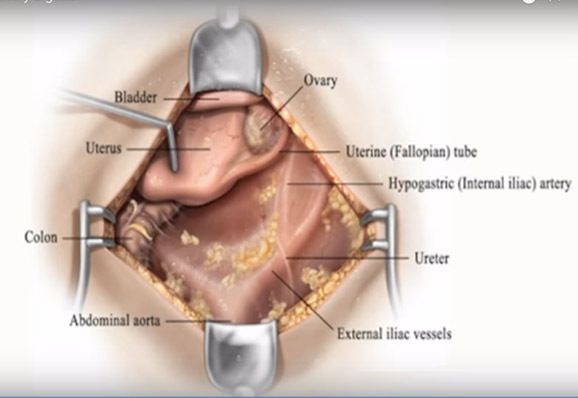
Hysterectomy
สามารถทำได้ทั้งtotal หรือ subtotal เป็นวิธีสุดท้ายที่เลือกใช้ในการรักษา postpartum hemorrhage วิธีนี้เป็นวิธีหยุดเลือดในผู้ป่วยที่มีอาการตกเลือดรุนแรงได้เร็วกว่า
มักใช้กรณีรกเกาะผิดปกติ เช่น รกงอกติดเข้ากล้ามเนื้อมดลูกเป็นต้น และ ภาวะมดลูกไม่แข็งตัวที่รักษาด้วยวิธีอื่นๆล้มเหลว ควรรีบพิจารณาทำอย่างรวดเร็วเมื่อมีข้อบ่งชี้เพื่อลดโอกาสเสียชีวิตของผู้ป่วย จากรายงานการศึกษา World Maternal Antifibrinolytic (WOMAN) trial(13) ใน 21ประเทศ พบว่ามีอัตราทำhysterectomy 5% (1,020/20,017)
ในระหว่างนี้ขณะที่กำลังทำ hysterectomy การทำ aortic compression มีประโยชน์ลดการเสียเลือดขณะทำหัตถการ โดยออกแรงกดบนกระดูกสันหลังตำแหน่งเหนือกว่า Sacral promontory สูงกว่าตำแหน่งBifurcation เป็น common iliac arteries หรือ จะกดตำแหน่งตำกว่า renal arteries ซึ่งจะช่วยลด collateral flow จาก ovarian artery, inferior mesenteric arteries ด้วยจึงช่วยลดเลือดไปมดลูกได้ดีกว่าตำแหน่งแรก
ภาวะแทรกซ้อนของการทำ hysterectomy ได้แก่ เสียเลือดปริมาณมาก , บาดเจ็บต่อทางเดินปัสสาวะและอาหารได้แม้ว่าโอกาสเกิดค่อนข้างน้อย เช่นกระเพาะปัสสาวะ(0.002%) , ท่อปัสสาวะ(0.3/1000) ,สำไส้ (0.001%)เป็นต้น , แผลติดเชื้อ , มีค่าความแข็งตัวของเลือดผิดปกติ (1)
ในกรณีมีบาดเจ็บปากมดลูก หรือส่วนล่างของมดลูก ควรทำ total hysterectomy
Subtotal (Supracervical) hysterectomy
คือการตัดมดลูกเหนือ Uterine artery ligation เหมาะสมในกรณีต้องการลดเวลาผ่าตัด หรือ มีพังพืดเกาะค่อนข้างมาก มีโอกาสบาดเจ็บต่อท่อปัสสาวะสูง อย่างไรก็ตาม มักพบต้อง re operation เนื่องจากมีเลือดออกจากบริเวณ cervixที่เหลืออยู่ ดังนั้นในกรณีที่ชำนาญการตัด total hysterectomy จึงควรทำ totalเพื่อที่จะลด โอกาส hemorrhageได้
ขั้นตอนการผ่าตัดมดลูกเป็นไปตามขั้นตอน gynecological abdominal hysterectomy แต่มีข้อควรระวังได้แก่
- การเปิด peritoneum ควรเปิดเพื่อให้เห็น Ureter ชัดเจน เพื่อหลีกเลี่ยงต่อการบาดเจ็บ เนื่องจาก ureterขณะตั้งครรภ์ จะมีขนาดโต
- Vascular structure ขนาดโต มีโอกาสบาดเจ็บเลือดออกง่าย ขณะที่หนีบ ตัด ผูกเส้นเลือดจึงต้องให้แน่ใจและหลีกเลี่ยงการบาดเจ็บโดยไม่จำเป็น
- ปากมดลูกขณะตั้งครรภ์ นุ่มทำให้แยกตำแหน่งที่ควรตัดได้ยาก อาจหาตำแหน่งโดยใช้มือคล้ำ , หรือกรีดเปิด vertical uterine incision ในระดับเดียวกับ uterine a. จากนั้นไล่ไปจนถึงขอบ cervix
สรุป
การตกเลือดหลังคลอด เป็นภาวะฉุกเฉินสำคัญในสูติศาสตร์ การหาสาเหตุ การรักษาเบื้องต้นควรทำอย่างรวดเร็ว หากจำเป็นที่จะต้องใช้การผ่าตัดเข้ามาช่วย ควรรีบตัดสินใจ เพื่อที่จะช่วยลดความรุนแรง, ลดภาวะแทรกซ้อนและลดอัตราการเสียชีวิตของมารดาหลังคลอดได้
เอกสารอ้างอิง
- Practice Bulletin No. 183: Postpartum Hemorrhage. Obstet Gynecol. 2017;130(4):e168-e86.
- Likis FE, Sathe NA, Morgans AK, et al. Management of Postpartum Hemorrhage [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2015 Apr. (Comparative Effectiveness Reviews, No. 151.).
- Einerson BD, Son M, Schneider P, Fields I, Miller ES. The association between intrauterine balloon tamponade duration and postpartum hemorrhage outcomes. American journal of obstetrics and gynecology. 2017;216(3):300.e1-.e5.
- VITTHALA S, TSOUMPOU I, ANJUM ZK, AZIZ NA. Use of Bakri balloon in post-partum haemorrhage: A series of 15 cases. 2009;49(2):191-4.
- Sathe NA, Likis FE, Young JL, Morgans A, Carlson-Bremer D, Andrews J. Procedures and Uterine-Sparing Surgeries for Managing Postpartum Hemorrhage: A Systematic Review. Obstetrical & gynecological survey. 2016;71(2):99-113.
- Dildy GA, Belfort MA, Adair CD, et al. Initial experience with a dual-balloon catheter for the management of postpartum hemorrhage. Am J Obstet Gynecol 2014;210:136.e1-6.
- Neelam N, Kumar SJ. B-Lynch suture — An experience. Journal of Obstetrics and Gynaecology of India. 2010;60(2):128-134. doi:10.1007/s13224-010-0018-z.
- O’Leary JL, O’Leary JA. Uterine artery ligation in the control of intractable postpartum hemorrhage. American Journal of Obstetrics & Gynecology. 1966;94(7):920-4.
- Halder Atin PS. Uterine and ovarian arteries ligation: A safe technique to control PPH during cesarean section. J Obstet Gynecol India July/August 2008; 58, No. 4.
- Singh A, Kishore R, Saxena SS. Ligating Internal Iliac Artery: Success beyond Hesitation. Journal of Obstetrics and Gynaecology of India. 2016;66(Suppl 1):235-41.
- Nizard J, Barrinque L, Frydman R, Fernandez H. Fertility and pregnancy outcomes following hypogastric artery ligation for severe post-partum haemorrhage. Human reproduction (Oxford, England). 2003;18(4):844-8.
- Salvat J, Schmidt MH, Guilbert M, Martino A. Vascular ligation for severe obstetrical haemorrhage: Review of the literature. J GynecolObstetBiolReprod. 2002;31:629–39.
- Huque S, Roberts I, Fawole B, Chaudhri R, Arulkumaran S, Shakur-Still H. Risk factors for peripartum hysterectomy among women with postpartum haemorrhage: analysis of data from the WOMAN trial. BMC Pregnancy and Childbirth. 2018;18.