Thyroid diseases in pregnancy
Thyroid diseases in pregnancy
นพ.ยศกร พรเกษมศาสตร์
อาจารย์ที่ปรึกษา: รศ.พญ.กุณฑรี ไตรศรีศิลป์ หมื่นพินิจ
บทนำ
ในหญิงตั้งครรภ์ ความผิดปกติของไทรอยด์เป็นภาวะในระบบต่อมไร้ท่อที่พบได้บ่อยเป็นอันดับสอง รองจากเบาหวาน การวินิจฉัยความผิดปกติระหว่างตั้งครรภ์อาจทำได้ยากขึ้นเนื่องจากการเปลี่ยนแปลงทางสรีรวิทยาของหญิงตั้งครรภ์ ความผิดปกติของไทรอยด์นั้นนอกจากส่งผลต่อหญิงตั้งครรภ์แล้ว ยังมีผลต่อพัฒนาการของทารก ดังนั้นการดูแลรักษาความผิดปกติของไทรอยด์ในหญิงตั้งครรภ์ สูติแพทย์จำเป็นต้องมีความรู้ความเข้าใจในกลไกการเกิดโรค และสรีรวิทยาของต่อมไทรอยด์ในขณะตั้งครรภ์
Normal thyroid physiology and adaptation during pregnancy
ในภาวะปกติ การทำงานของไทรอยด์จะถูกควบคุมการสร้างและการหลั่งอย่างเป็นระบบ โดยไฮโปทาลามัสและต่อมใต้สมองส่วนหน้า เรียกว่า hypothalamus-pituitary-thyroid (HPT) axis hypothalamus มีหน้าที่ในการหลั่ง thyrotropin releasing hormone (TRH) เพื่อกระตุ้นต่อมใต้สมองส่วนหน้าในการหลั่ง thyroid-stimulating hormone (TSH) ซึ่งจะกระตุ้นต่อมไทรอยด์ในการสร้างและหลั่งไทรอยด์ฮอร์โมน (thyroxine; T4), (triiodothyronine; T3)
การสร้างไทรอยด์ฮอร์โมนเริ่มต้นจากการที่ไอโอไดด์ (I–) เข้าสู่ไทรอไซต์ (thyrocyte) ผ่านโซเดียมไอโอไดด์ซิมพอร์ตเตอร์ (Na+/I– symporter; NIS) และถูกออกซิเดชันเป็นไอโอดีน ก่อนถูกนำไปเติมกับไทโรซีนที่อยู่บนไทโรโกลบูลิน (thyroglobulin; Tg) รวมกันเป็นโมโนและไดไอโดไทโรซีน (monoiodotyrosine; MIT), (diiodotyrosine; DIT) และเกิดปฏิกิริยาคู่ควบ (coupling reaction) รวมกันเป็น T4 (DIT+DIT), และ T3 (DIT+MIT) โดยกระบวนการนี้อาศัยการทำงานของเอนไซม์ไทโรเพอร์ออกซิเดซ (thyroperoxidase; TPO) หลังจากนั้น Tg จะถูกย่อยและปลดปล่อยออกมาเป็นไทรอยด์ฮอร์โมนในกระแสเลือด โดยไทรอยด์ฮอร์โมนส่วนใหญ่ มากกว่าร้อยละ 99 จะยึดเหนี่ยวกับโปรตีนเพื่อป้องกันการถูกทำลายและเพื่อไปยังอวัยวะส่วนปลาย มีเพียงส่วนน้อยที่อยู่เป็นอิสระ โดยโปรตีนหลักที่ยึดเหนี่ยวกับไทรอยด์ฮอร์โมนจะเป็น thyroxine-binding globulin (TBG), รองลงมาเป็น transthyretin และ albumin
การสร้างไทรอยด์ฮอร์โมนจะมีสัดส่วนในการสร้างที่ไม่เท่ากัน โดยที่ T4 มากกว่า T3 ประมาณ 14 เท่า และ T3 นั้นสามารถถูกทำลายได้ง่ายกว่า แต่ตัวที่ออกฤทธิ์หลักเป็นผลมาจาก T3 ซึ่งมีความสามารถในการจับกับตัวรับที่เนื้อเยื่อต่าง ๆ ได้ดีกว่า T4 ถึง 10 เท่า กล่าวคือ T4 เปรียบเสมือนโพรฮอร์โมน (pro-hormone) และ T3 เปรียบเสมือนแอกทิฟฮอร์โมน (active hormone) โดยที่บริเวณเนื้อเยื่อส่วนปลายจะมีกระบวนการเปลี่ยนรูปแบบของ T4 (peripheral conversion) โดยอาศัยเอนไซม์ดีไอโอดีเนส (deiodinases; D) ซึ่งมีทั้งหมด 3 ชนิด โดยชนิดที่ 1 และ 2 เปลี่ยน T4 เป็น T3 และชนิดที่ 3 เปลี่ยนจาก T4 เป็น reverse T3 ซึ่งเป็นรูปที่ไม่ออกฤทธิ์
การเปลี่ยนแปลงขณะตั้งครรภ์เกิดจากฮอร์โมนอีสโทรเจนที่สูงขึ้น ส่งผลให้ตับมีการสร้าง TBG เพิ่มขึ้นตั้งแต่อายุครรภ์ 7 สัปดาห์สูงที่สุดตอน 16 สัปดาห์ และคงที่หลังจากนั้น ส่งผลให้ระดับ total T4, T3 เพิ่มขึ้น นอกจากนี้ยังมีผลจากระดับ hCG ที่สูงขึ้นในช่วง 8-12 สัปดาห์ซึ่ง hCG มี alpha-subunit เหมือนกับ TSH สามารถจับกับ TSH-receptor ส่งผลให้มีการสร้างไทรอยด์ฮอร์โมน เพิ่มขึ้น และทำให้ระดับ TSH ลดลง แต่ระดับของ FT4, FT3 มีระดับเทียบเท่าก่อนตั้งครรภ์จากผลของ TBG ที่เพิ่มขึ้น
ความสำคัญของไทรอยด์ฮอร์โมนขณะตั้งครรภ์ ในช่วงแรกของการตั้งครรภ์มีผลอย่างมากในการเจริญเติบโตของรก และในช่วงก่อนอายุครรภ์ 12 สัปดาห์ทารกยังไม่สามารถสร้างฮอร์โมนไทรอยด์เองได้ แต่การพัฒนาการของระบบประสาททารกจำเป็นต้องอาศัยไทรอยด์ฮอร์โมน ดังนั้นไทรอยด์ฮอร์โมนในมารดาจึงเป็นส่วนสำคัญ โดยเฉพาะ T4 ที่จะส่งต่อจากรก ไปกระตุ้นการพัฒนาของทารกในครรภ์
การส่งผ่านรกของสารที่เกี่ยวข้องกับไทรอยด์ระหว่างตั้งครรภ์ซึ่งมีส่วนสำคัญต่อภาวะไทรอยด์ของทารกในครรภ์
- ไทรอยด์ฮอร์โมนทั้ง T3 และ T4 สามารถผ่านรกได้ โดย T4 ผ่านได้ดีกว่า T3 ส่วน TSH นั้นไม่สามารถผ่านรกได้ และ TRH แม้ผ่านรกได้ดีแต่ปริมาณในร่างกายนั้นมีขนาดน้อยมาก จึงไม่มีผลต่อทารกในครรภ์
- ยาต้านไทรอยด์สามารถผ่านรกได้ และยานั้นจะมีค่าครึ่งชีวิตในทารกนานกว่าในมารดา ส่งผลให้ยาออกฤทธิ์ในทารกได้ดีกว่ามารดา ซึ่งเป็นเหตุผลสำคัญในเป้าหมายการรักษาภาวะไทรอยด์เป็นพิษในมารดาที่จะต้องให้ FT4 อยู่ในระดับค่าสูงสุดของค่าปกติ
- แอนติบอดีต่างๆ ได้แก่ TRAb Anti-TPO และ Anti-Tg ซึ่งเป็นอิมมูโนโกลบูลินจี (IgG) สามารถผ่านรกได้ โดย TRAb สามารถก่อให้เกิดไทรอยด์เป็นพิษ หรือภาวะพร่องไทรอยด์ในทารกได้
- ไอโอไดด์ และสารกัมมันตรังสีไอโอดีนสามารถผ่านรกได้ จึงเป็นเหตุผลที่หญิงตั้งครรภ์ไม่ควรได้รับการรักษาด้วยการกลืนแร่
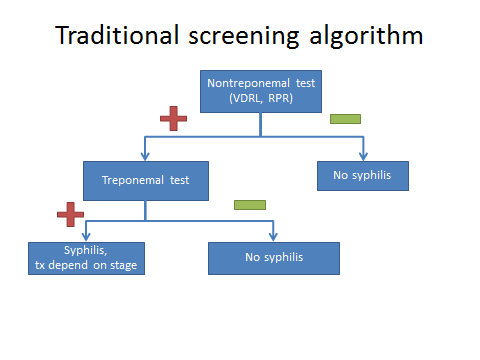
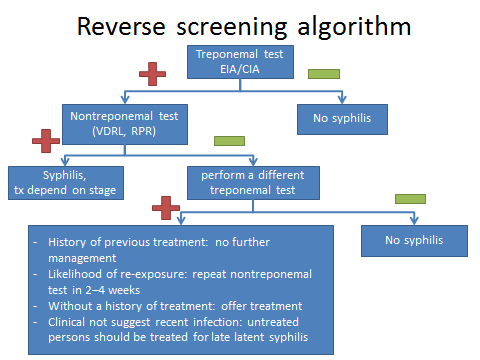
Thyroid function test in pregnancy
เนื่องจากการสร้างและหลั่งไทรอยด์ฮอร์โมนมีการเปลี่ยนแปลงตามกลไกทางสรีรวิทยาของการตั้งครรภ์ดังที่ได้กล่าวไปในข้างต้น การแปรผลการทำงานของไทรอยด์ในช่วงตั้งครรภ์จึงแตกต่างจากคนที่ไม่ตั้งครรภ์ โดยทางสมาคมไทรอยด์แห่งสหรัฐอเมริกา (American Thyroid Association; ATA) แนะนำให้ใช้เกณฑ์อ้างอิงตามแต่ละกลุ่มประชากรและอายุครรภ์นั้น ๆ ในกรณีที่ไม่มีเกณฑ์ดังกล่าว แนะนำให้ลดเกณฑ์ขอบล่างลง 0.4 mIU/L และเกณฑ์ขอบบนลง 0.5 mIU/L สำหรับระดับของ TSH ในไตรมาสแรก ดังนั้นระดับของ TSH ในช่วงไตรมาสแรกจะอยู่ที่ 0.1-3.9 mIU/L และในช่วงไตรมาสที่ 2, 3 ระดับ TSH ใช้เกณฑ์เทียบเท่าในคนที่ไม่ตั้งครรภ์ [1]
การวัดระดับของ FT3, FT4 สามารถทำได้ทั้งทางตรงและทางอ้อม โดยส่วนใหญ่จะใช้วิธีทางอ้อม เนื่องจากการวัดระดับโดยตรงนั้นทำได้ยาก เพราะสัดส่วนของฮอร์โมนอิสระนั้นมีปริมาณน้อยอยู่ในหลักพิโคกรัม การตรวจทางอ้อมจะอาศัยการวัดระดับ TT3, TT4 และคำนวณย้อนกลับด้วย thyroid hormone binding ratio หรือใช้วิธีการวัดระดับจากการแย่งจับของ FT4 เทียบกับ radiolabeled T4 ซึ่งทั้งสองวิธีนี้มีตัวกวนจากระดับของ TBG และ albumin [2] ที่มีการเปลี่ยนแปลงขณะตั้งครรภ์ ส่งผลให้ระดับของ FT3, FT4 ที่ได้มีแนวโน้มต่ำกว่าความเป็นจริง ดังนั้นหากต้องการวัดระดับของ FT3, FT4 ในขณะตั้งครรภ์ควรใช้วิธีทางตรง หรือในกรณีที่ไม่สามารถตรวจได้การแปลผลจะต้องเทียบกับค่าปกติตามแต่ละอายุครรภ์
ระดับของ TT3, TT4 จะมีค่าที่สูงขึ้น จากผลของ TBG ที่เพิ่มขึ้น การแปลผลจึงแบ่งเป็นช่วงตามการเปลี่ยนแปลงของ TBG โดยที่ก่อนอายุครรภ์ 7 สัปดาห์ระดับของ TT3, TT4 จะเท่าคนปกติ หลังจากนั้นในช่วงอายุครรภ์ 7-16 สัปดาห์จะมีค่าเพิ่มขึ้นร้อยละ 5 ต่อสัปดาห์ จนถึงอายุครรภ์ 16 สัปดาห์ที่ค่าจะสูงกว่าคนปกติร้อยละ 50 ไปตลอดการตั้งครรภ์
Thyrotoxicosis
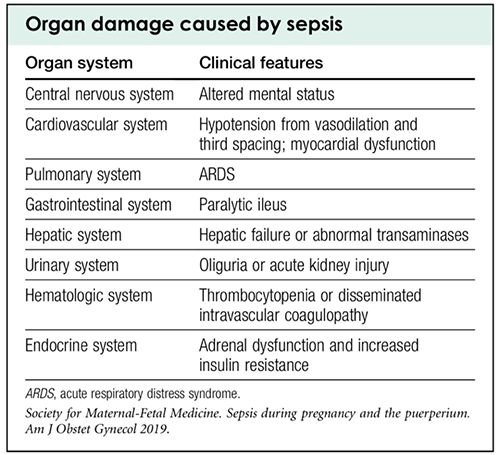
ภาวะไทรอยด์เป็นพิษขณะตั้งครรภ์เป็นภาวะที่พบได้บ่อย ความชุกทั่วโลกอยู่ที่ร้อยละ 0.4-1.7 ตามสถิติของโรงพยาบาลมหาราชนครเชียงใหม่ในปี 2565 พบความชุกอยู่ที่ร้อยละ 2 สาเหตุของไทรอยด์เป็นพิษขณะตั้งครรภ์ ได้แก่
-
Gestational transient thyrotoxicosis
เป็นภาวะที่เกิดจากฮอร์โมน hCG สูงขึ้นขณะตั้งครรภ์ในไตรมาสแรก กระตุ้นต่อมไทรอยด์ในการสร้างไทรอยด์ฮอร์โมน ส่วนใหญ่มักจะไม่มีอาการ หรือมีอาการเล็กน้อย ในบางรายอาจมีอาการรุนแรง หากมีภาวะที่มี hCG สูงขึ้นกว่าปกติ เช่น ครรภ์แฝด ครรภ์ไข่ปลาอุก ภาวะนี้สามารถหายได้เองในช่วงต้นไตรมาสที่สอง (อายุครรภ์ 14-18 สัปดาห์) จากภาวะ hCG ที่เริ่มลดลง ในรายที่มีอาการมากอาจพิจารณารักษาตามอาการด้วยยากลุ่ม beta-blocker ไม่แนะนำในการให้ยาต้านไทรอยด์ [1]
ภาวะนี้ไม่เพิ่มโอกาสการแท้ง ความผิดปกติของทารกในครรภ์ หรือการเกิดครรภ์เป็นพิษ [3]
การวินิจฉัยแยกโรคกับ Graves’ disease ในช่วงไตรมาสแรกของการตั้งครรภ์ ในกรณีพบตาโปน (Graves’ opthalmopathy) หรือการฟังได้ยินเสียงฟู่ที่ไทรอยด์ (thyroid bruit) หรือการตรวจพบ thyrotropin receptor antibody (TRAb) จะช่วยวินิจฉัย Graves’ disease ได้ ส่วนภาวะ gestational transient thyrotoxicosis อาจพบลักษณะของ hyperemesis gravidarum
-
Graves’ diseases
เป็นสาเหตุที่พบได้บ่อยที่สุดของภาวะไทรอยด์เป็นพิษขณะตั้งครรภ์ เกิดจากการมีแอนติบอดีต่อตัวรับของ TSH (thyrotropin receptor antibody; TRAb) ซึ่งมีชนิดที่กระตุ้นการทำงาน (thyroid-stimulating immunoglobulin; TSI) ชนิดที่ยับยั้งการทำงาน (thyrotropin-binding inhibitory immunoglobulin; TBII) และชนิดที่ไม่กระตุ้นหรือยับยั้งการทำงาน (neutral TRAb) แต่อาจทำให้เกิด cell apoptosis ได้ อาการของไทรอยด์เป็นพิษจะเกิดขึ้นเมื่อมีการกระตุ้นจาก TSI มากกว่า TRAb ชนิดอื่น [4]
ผลของการตั้งครรภ์ต่อตัวโรค ในช่วงไตรมาสแรกจะมีอาการแย่ลงจากการกระตุ้นของฮอร์โมน hCG หลังจากนั้นในช่วงไตรมาสที่สองจะดีขึ้น เนื่องจากการตั้งครรภ์มีการเปลี่ยนแปลงของระบบภูมิคุ้มกัน ทำให้เซลล์ทีเฮลเปอร์ชนิดที่ 2 (Th2) มีมากขึ้นส่งผลให้โรคที่เกี่ยวข้องกับภูมิคุ้มกันซึ่งรวมถึง Graves’ disease มีความรุนแรงของโรคที่ลดลง [5]
ผลของโรคต่อการตั้งครรภ์
- ก่อนการตั้งครรภ์: โอกาสในการตั้งครรภ์ไม่แตกต่างกันทั้งในกลุ่มที่มีภาวะไทรอยด์เป็นพิษ หรือไทรอยด์ปกติ ความผิดปกติของไทรอยด์ไม่ได้ส่งผลให้มีบุตรยากขึ้น
- ช่วงไตรมาสแรกของการตั้งครรภ์ ในกรณีที่ควบคุมโรคได้ไม่ดี มีโอกาสแท้งบุตรได้มากขึ้น
- ไตรมาสที่ 2 และ 3 ในกรณีควบคุมโรคได้ไม่ดี เพิ่มความเสี่ยงในการเกิดความดันโลหิตสูงขณะตั้งครรภ์ คลอดก่อนกำหนด ภาวะหัวใจวาย ทารกโตช้าหรือเสียชีวิตในครรภ์ และมีโอกาสเกิดไทรอยด์เป็นพิษวิกฤต (thyroid storm) และมีบางรายงานพบว่าอาจทำให้เกิดโรคลมชักและออทิซึมในเด็กได้เพิ่มขึ้น [6]
- มีโอกาสเกิดความผิดปกติแต่กำเนิดเพิ่มขึ้นจากยาต้านไทรอยด์ แต่ในผู้ที่ได้รับยา methimazole (MMI) มีโอกาสเกิดความผิดปกติที่รุนแรงได้แก่ choanal, esophageal atresia, abdominal wall defect และ aplasia cutis ได้มากกว่าผู้ที่ได้รับยา propylthiouracil (PTU) [7]
- มีโอกาสเกิดไทรอยด์เป็นพิษในทารก จากการที่ TRAb ชนิด TSI ผ่านจากรกไปกระตุ้นต่อมไทรอยด์ของทารก
- มีโอกาสเกิดภาวะพร่องไทรอยด์ในทารก จากการที่ TRAb ชนิด TBII ผ่านจากรกไปยับยั้งการทำงานของต่อมไทรอยด์ หรือเกิดจากการที่มารดาได้รับยาต้านไทรอยด์มากเกินไป
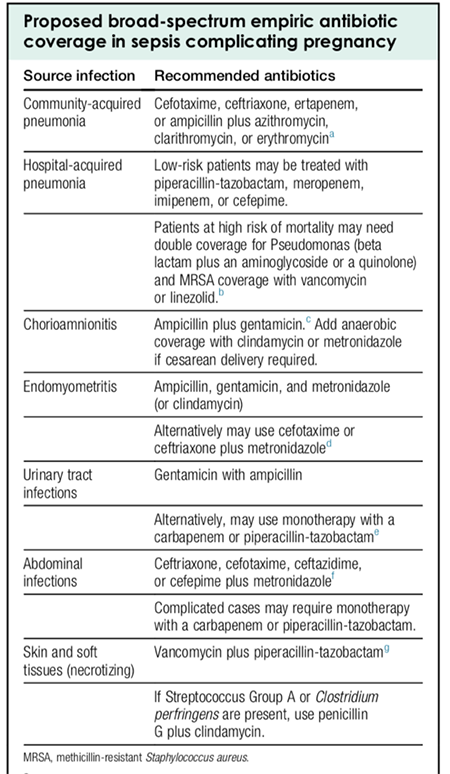
การดูแลก่อนการตั้งครรภ์
- แนะนำให้ตั้งครรภ์เมื่อควบคุมโรคได้อย่างน้อย 1 เดือน และเปลี่ยนยาต้านไทรอยด์เป็นชนิด PTU หรืออาจพิจารณาหยุดยาต้านไทรอยด์ในกรณีที่ใช้ยาขนาดต่ำ (MMI ≤ 5-10 มก./วัน, PTU ≤ 100-200 มก./วัน) ร่วมกับ TRAb เป็นลบ รักษามาเป็นระยะเวลา 12-18 เดือน
- ในกรณีได้รับการรักษาด้วยการกลืนแร่ คณะกรรมาธิการระหว่างประเทศด้านการป้องกันรังสี (International Commission in Radiological Protection; ICRP) แนะนำให้หลีกเลี่ยงการตั้งครรภ์อย่างน้อย 6 เดือนหลังจากการกลืนแร่
การดูแลระหว่างการตั้งครรภ์
- การรักษาด้วยยาต้านไทรอยด์ ในช่วงไตรมาสแรกแนะนำให้ใช้ PTU มากกว่า MMI เนื่องจากลดโอกาสการเกิดความผิดปกติแต่กำเนิดชนิดรุนแรง
- โดยขนาดยาเริ่มต้นสำหรับ MMI = 5-30 มก./วัน และสำหรับ PTU = 100-600 มก./วัน
- เป้าหมายของการรักษาคือการใช้ยาต้านไทรอยด์ขนาดน้อยที่สุดที่สามารถทำให้ FT4/TT4 อยู่ในระดับค่าสูงสุดของค่าปกติ หรือสูงกว่าเล็กน้อย เนื่องจากยาต้านไทรอยด์นั้นออกฤทธิ์ในทารกได้ดีกว่าในมารดา ส่งผลให้ในกรณีที่มารดาได้ยาต้านไทรอยด์จน FT4/TT4 อยู่ในระดับปกติ อาจจะพบว่าทารกมีภาวะพร่องไทรอยด์ได้
- ATA แนะนำให้ใช้ยา PTU ในช่วงไตรมาสแรกจนถึงอายุครรภ์ 16 สัปดาห์ หลังจากนั้นหากยังมีความจำเป็นที่ต้องได้รับยาต่อ ไม่มีคำแนะนำว่าควรใช้ยาชนิดไหน เนื่องจากยาทั้ง 2 ชนิดมีโอกาสก่อให้เกิดผลข้างเคียงรุนแรงต่อตับได้ โดยพบใน PTU ได้มากกว่า แต่การเปลี่ยนชนิดยาจาก PTU เป็น MMI อาจส่งผลให้ควบคุมตัวโรคได้แย่ลงในช่วงแรก ในกรณีเปลี่ยนชนิดยาสามารถคำนวณขนาดยาโดย MMI 1 มก. เทียบเท่า PTU 20 มก.
- ช่วงแรกของการรักษาแนะนำให้ตรวจติดตามระดับ TSH และ FT4/TT4 ทุก 2-4 สัปดาห์ เมื่อคงที่แล้วตรวจติดตามทุก 4-6 สัปดาห์
- เฝ้าระวังผลข้างเคียงของยาต้านไทรอยด์ ได้แก่ ตับอักเสบ และภาวะเม็ดเลือดขาวต่ำระดับรุนแรง (agranulocytosis) ซึ่งโดยทั่วไปมักเกิดขึ้นภายใน 1 เดือนหลังเริ่มยา การเฝ้าระวังประกอบด้วยการสังเกตอาการ เช่น ไข้สูง แผลในปาก การตรวจติดตามทางห้องปฏิบัติการอาจไม่จำเป็น
- การรักษาด้วยการผ่าตัด thyroidectomy ระหว่างตั้งครรภ์ จะพิจารณาในกรณีที่ไม่สามารถใช้ยาต้านไทรอยด์ได้ หรือใช้ยาไม่ได้ผล โดยช่วงเวลาที่เหมาะสมสำหรับการผ่าตัด คือไตรมาสที่ 2 ของการตั้งครรภ์
- การรักษาด้วยการกลืนแร่ การตั้งครรภ์เป็นข้อห้ามในการรักษาด้วยการกลืนแร่ เนื่องจากอายุครรภ์ 10-12 สัปดาห์ต่อมไทรอยด์ของทารกจะเริ่มมีการนำไอโอไดด์เข้าเซลล์ รังสีที่ได้รับจะทำให้เกิดการทำลายของต่อมไทรอยด์ ส่งผลให้เกิดภาวะพร่องไทรอยด์ในทารก
- การตรวจคัดกรองระดับ TRAb มีข้อบ่งชี้ตาม ATA 2017 ดังนี้
- หญิงตั้งครรภ์ที่มีภาวะไทรอยด์เป็นพิษทุกคน
- มีประวัติ Graves’disease ที่เคยรับการรักษาด้วยการผ่าตัด หรือ กลืนแร่มาก่อน
- มีประวัติบุตรคนก่อนมีภาวะไทรอยด์เป็นพิษแต่กำเนิด
- มีประวัติตัดต่อมไทรอยด์เพื่อรักษาไทรอยด์เป็นพิษขณะตั้งครรภ์
โดยแนะนำให้ตรวจคัดกรองตั้งแต่ที่มาฝากครรภ์ครั้งแรก และตรวจติดตามอีกครั้งในช่วงอายุครรภ์ 18-22 สัปดาห์ ถ้าหากยังพบ TRAb ให้ตรวจซ้ำอีกครั้งในช่วงอายุครรภ์ 30-34 สัปดาห์ เพื่อวางแผนในการเฝ้าระวังทารกหลังคลอด
โดยในกรณีที่ TRAb มีค่า ≥ 5 IU/L หรือ ≥ 3 เท่าของค่าสูงสุดค่าปกติ พบว่ามีความไวในการทำนายภาวะไทรอยด์เป็นพิษในทารกแรกเกิดได้ร้อยละ 100 และมีความจำเพาะอยู่ที่ร้อยละ 43
- การตรวจติดตามทารกในครรภ์ด้วยอัลตราซาวนด์ แนะนำให้ทำในกรณีที่ไทรอยด์เป็นพิษที่ไม่สามารถควบคุมโรคได้ หรือพบ TRAb ≥ 3 เท่าของค่าสูงสุดของค่าปกติ โดยการอัลตราซาวนด์จะดูลักษณะของต่อมไทรอยด์ การเจริญเติบโตของทารกในครรภ์ การมีภาวะบวมน้ำ
- ในกรณีวินิจฉัยภาวะไทรอยด์เป็นพิษของทารกในครรภ์จากลักษณะอาการ เช่น อัตราการเต้นของหัวใจทารกมากกว่า 170 ครั้ง/วินาที เป็นเวลามากกว่า 10 นาที ร่วมกับอัลตราซาวนด์พบคอพอก มีภาวะโตช้าในครรภ์ มีอายุกระดูกมากกว่าอายุจริง การรักษาในทารกคือการให้ยาต้านไทรอยด์แก่หญิงตั้งครรภ์ หากในกรณีหญิงตั้งครรภ์มีภาวะพร่องไทรอยด์จากยาต้านไทรอยด์พิจารณาให้การรักษาด้วยฮอร์โมน levothyroxine ได้
- ในกรณีสงสัยภาวะพร่องไทรอยด์ของทารกในครรภ์ โดยอัลตราซาวนด์อาจพบภาวะครรภ์แฝดน้ำ (hydramnios) คอพอก มีการพัฒนาการของกระดูกช้ากว่าอายุจริง พิจารณารักษาด้วยการให้ levothyroxine ทางน้ำคร่ำ แต่ยังไม่มีข้อแนะนำเรื่องขนาดและความถี่ของการให้ยา และในกรณีที่หญิงตั้งครรภ์ได้รับยาต้านไทรอยด์ แนะนำให้หยุดยา
- ในกรณีที่ตรวจพบคอพอกของทารกในครรภ์ โดยอาการไทรอยด์เป็นพิษหรือพร่องไทรอยด์ไม่ชัดเจน อาจพิจารณาตรวจระดับ TRAb จากหลอดเลือดสายสะดือ
- การตรวจติดตามสุขภาพทารกในครรภ์ ในมารดาที่มีภาวะไทรอยด์เป็นพิษ ไม่มีคำแนะนำที่ชัดเจนถึงข้อบ่งชี้ และอายุครรภ์ที่ควรได้รับการตรวจ แนะนำให้ตรวจติดตามเป็นราย ๆ เช่น ในกรณีที่ไม่สามารถควบคุมโรคได้ หรือตรวจพบ TRAb ≥ 3 เท่าของค่าสูงสุดของค่าปกติ [1, 8]
-
Toxic adenoma and toxic multinodular goiter
เป็นภาวะที่มีเนื้องอกของต่อมไทรอยด์ที่สามารถผลิตฮอร์โมนไทรอยด์ได้มากเกินไป ผลของโรคต่อการตั้งครรภ์ไม่แตกต่างกับใน Graves’ disease
แต่การตั้งครรภ์มีผลต่อตัวโรค ทำให้คุมตัวโรคได้ยากขึ้น เนื่องจากในภาวะนี้ไม่มี TRAb ที่ไปกระตุ้นต่อมไทรอยด์ของทารก จึงทำให้การรักษาด้วยยาต้านไทรอยด์ จะทำให้ทารกในครรภ์เกิดภาวะพร่องไทรอยด์ได้ ดังนั้นจึงไม่สามารถใช้ปริมาณยาได้มากนัก และระหว่างตั้งครรภ์ควรตรวจติดตามทารกในครรภ์อย่างใกล้ชิด หากมีภาวะพร่องไทรอยด์ในทารกควรพิจารณาหยุดยาต้านไทรอยด์ และรักษาหญิงตั้งครรภ์ด้วยการผ่าตัดนำเนื้องอกออก [1]
-
Subacute thyroiditis
เป็นภาวะที่พบไม่บ่อย เกิดขึ้นได้จากการติดเชื้อไวรัส ส่งผลให้เกิดการสร้างภูมิคุ้มกันมาทำลายเซลล์ไทรอยด์ ทำให้มีการปลดปล่อยฮอร์โมนไทรอยด์ออกสู่กระแสเลือดในช่วงแรก หลักจากนั้นร่างกายจะเข้าสู่ภาวะพร่องไทรอยด์
การวินิจฉัยภาวะนี้อาศัยอาการแสดงที่มีอาการกดเจ็บบริเวณไทรอยด์ ร่วมกับมีภาวะไทรอยด์เป็นพิษ และการตรวจทางห้องปฏิบัติการเพิ่มเติม คือมี ESR, CRP สูงขึ้นสามารถยืนยันการวินิจฉัยได้ด้วยการตรวจ radioactive iodine uptake (RAIU) โดยจะพบว่ามีการดูดซึมไอโอดีนน้อย แต่ในระหว่างตั้งครรภ์การตรวจ RAIU ไม่สามารถทำได้ อาจใช้การตรวจอัลตราซาวนด์แบบด็อปเปลอร์ (doppler ultrasound) บริเวณต่อมไทรอยด์เพื่อดูปริมาณเลือดที่มาเลี้ยง โดยใน subacute thyroiditis จะพบปริมาณเลือดที่มาเลี้ยงลดลง
ข้อมูลเกี่ยวกับแนวทางการรักษาและผลต่อการตั้งครรภ์มีเพียงจากการรวบรวมเคสรายงาน โดยในช่วงไทรอยด์เป็นพิษให้การรักษาตามอาการ ในผู้ที่มีอาการเจ็บพิจารณาให้การรักษาด้วย prednisolone แบบรับประทาน หรือ hydrocortisone ชนิดทาเฉพาะที่ ไม่แนะนำการให้ยาต้านไทรอยด์ ควรตรวจติดตาม TFT เพื่อเฝ้าระวังภาวะพร่องไทรอยด์ และให้การรักษาด้วยฮอร์โมน levothyroxine จากเคสรายงาน การรักษาด้วยวิธีเหล่านี้ไม่พบการคลอดก่อนกำหนด น้ำหนักน้อยในทารกแรกเกิด หรือครรภ์เป็นพิษ [9]
- สาเหตุอื่น ๆ เช่น TSH-secreting pituitary adenoma, struma ovarii การดูแลรักษาจะเป็นการผ่าตัดตามรอยโรคที่พบ
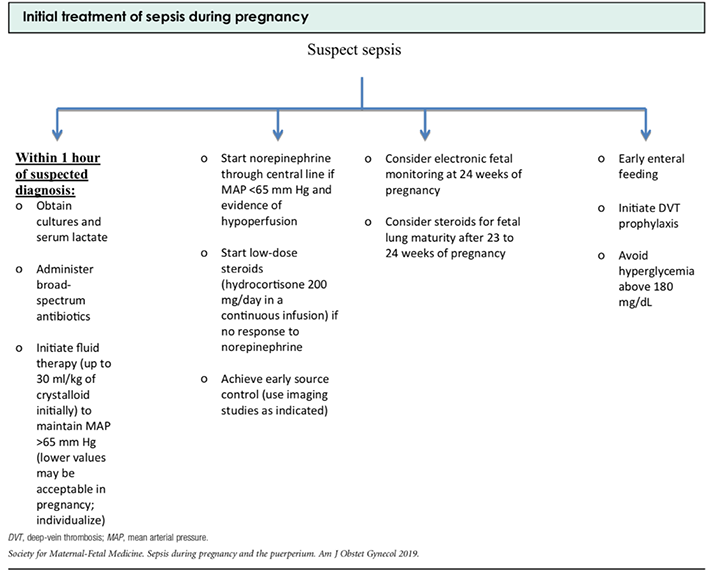
Thyroid strom
ภาวะไทรอยด์วิกฤต เป็นภาวะที่อันตรายถึงแก่ชีวิต เกิดขึ้นในกรณีไทรอยด์เป็นพิษที่ไม่ได้รับการรักษา ร่วมกับมีปัจจัยกระตุ้นเพิ่มเติม เช่น มีการติดเชื้อ การคลอด การผ่าตัด
สามารถวินิจฉัยด้วยอาการทางคลินิก โดยมีอาการไข้สูง อัตราการเต้นของหัวใจเร็วหรือผิดปกติ มีอาการทางระบบประสาท เช่น ซึม หรือสับสน
แนวทางการรักษาเหมือนในคนที่ไม่ได้ตั้งครรภ์ โดยมีเป้าหมายดังนี้
- ยับยั้งการสร้างและหลั่งไทรอยด์ฮอร์โมนด้วยการให้
- PTU 1000 มก. รับประทานทันที และ PTU 200 มก. ทุก 6 ชั่วโมง
- การให้ไอโอดีน ขนาดสูงเพื่อให้เกิด wolff-chaikov effect โดยให้ 1-2 ชั่วโมงหลังจากได้ PTU
-
- sodium iodide 500-1000 มก. ทุก 8 ชั่วโมง หรือ
- supersaturated solution of potassium iodide 5 หยด ทุก 8 ชั่วโมง หรือ
- Lugol solution 10 หยด ทุก 8 ชั่วโมง หรือ
- ในรายที่แพ้ไอโอดีน ให้ lithium carbonate 300 มก. ทุก 6 ชั่วโมง
-
- ยับยั้งการเปลี่ยน T4 เป็น T3
- ด้วยการให้ dexamethasone 2 มก. ทุก 6 ชั่วโมง
- hydrocortisone 100 มก. ทุก 8 ชั่วโมง
- ควบคุมอัตราการเต้นของหัวใจด้วยยากลุ่ม beta-blocker ยาที่แนะนำเป็น bisoprolol, esmolol โดยควบคุมให้อัตราการเต้นของหัวใจอยู่ในช่วง 80-130 ครั้ง/นาที และในกรณีมี atrial fibrilation ให้ digoxin ร่วมด้วย
- รักษาปัจจัยกระตุ้น
Subclinical hyperthyroidism
เป็นภาวะที่ระดับ TSH ต่ำกว่าปกติ และ T3, T4 อยู่ในเกณฑ์ปกติ โดยภาวะนี้ไม่พบว่าส่งผลเสียต่อการตั้งครรภ์ และไม่แนะนำการให้ยาต้านไทรอยด์ในภาวะนี้ เนื่องจากจะส่งผลให้ทารกในครรภ์มีภาวะพร่องไทรอยด์ได้
Overt hypothyroidism
เป็นภาวะที่พบได้ไม่บ่อยระหว่างตั้งครรภ์ อุบัติการณ์อยู่ที่ร้อยละ 0.2-1 ของการตั้งครรภ์ สาเหตุที่ทำให้เกิดภาวะพร่องไทรอยด์ได้แก่
- Hashimoto thyroiditis
เป็นสาเหตุที่พบได้บ่อยที่สุดของภาวะพร่องไทรอยด์ ในพื้นที่ที่ไม่ขาดแคลนไอโอดีน โดยเกิดจากแอนติบอดี anti-TPO, anti-Tg จับกับ TPO หรือ Tg ในไทรอยด์เซลล์ เกิดการทำลายของเซลล์ไทรอยด์ ทำให้ไม่สามารถสร้างไทรอยด์ฮอร์โมนได้เพียงพอ
โดย anti-TPO และ anti-Tg เป็นชนิด IgG สามารถผ่านจากแม่สู่ลูกทางรกได้ แต่ไม่ก่อให้เกิดความผิดปกติในทารก [10]
- Iodine deficiency
ไอโอดีนเป็นส่วนสำคัญในการสร้างไทรอยด์ฮอร์โมน ในรายที่ขาดไอโอดีนอย่างรุนแรงจะทำให้เกิดภาวะพร่องไทรอยด์ได้ และทำให้เกิดโรค cretinism ในทารกได้
ในระหว่างตั้งครรภ์มีความจำเป็นที่ต้องได้รับไอโอดีนเพิ่มขึ้น เนื่องจากมีการสร้างไทรอยด์ฮอร์โมนเพิ่มขึ้นทั้งของมารดาและทารก และระหว่างตั้งครรภ์มีการสูญเสียไอโอดีนทางปัสสาวะได้มากขึ้น
รพ.มหาราชนครเชียงใหม่ได้มีการศึกษาในหญิงตั้งครรภ์ที่ไม่ได้ไอโอดีนเสริมระหว่างตั้งครรภ์ พบว่าร้อยละ 43.6 มีภาวะขาดไอโอดีน
ปัจจุบันสถาบันแพทย์ศาสตร์แห่งอเมริกา (Institute of Medicine: IOM) แนะนำให้มีการบริโภคไอโอดีนอย่างน้อย 150 มคก./วัน ในผู้ที่วางแผนมีบุตร และ 220 มคก./วัน กับ 290 มคก./วัน สำหรับหญิงตั้งครรภ์ และหญิงที่อยู่ระหว่างให้นมบุตร ตามลำดับ ส่วนองค์กรอนามัยโลกแนะนำบริโภค 250 มคก./วัน สำหรับหญิงตั้งครรภ์และให้นมบุตร
ตามคำแนะนำของ ATA เนื่องจากไอโอดีนที่ได้จากอาหารมีปริมาณไม่แน่นอนและไม่เพียงพอ จึงแนะนำให้ผู้ที่วางแผนตั้งครรภ์ได้รับไอโอดีนเสริม 150 มคก./วัน ประมาณ 3 เดือนก่อนตั้งครรภ์ และทานต่อในช่วงตั้งครรภ์และให้นมบุตร และไม่ควรได้รับไอโอดีนมากกว่า 500 มคก./วัน การได้รับไอโอดีนเกินขนาดทำให้เกิดการยับยั้งการทำงานของ TPO ทำให้เกิดภาวะพร่องไทรอยด์เรียกว่า wolff-chaikoff effect โดยทั่วไปจะเกิดขึ้นชั่วคราว เซลล์ไทรอยด์จะมีการปรับตัวโดยการที่ไอโอดีนผ่าน Na/I symporter ลดลง แต่ทารกในครรภ์ต่อมไทรอยด์จะยังทำงานได้ไม่สมบูรณ์ ทำให้ไม่สามารถปรับตัวได้ และเกิดภาวะพร่องไทรอยด์
- Post I-131 ablation or thyroidectomy
หลังการรักษาด้วยการกลืนแร่ หรือการผ่าตัด ทำให้ไม่มีการทำงานของต่อมไทรอยด์ หรือมีเพียงเล็กน้อย ในช่วงตั้งครรภ์ที่ต้องการปริมาณฮอร์โมนเพิ่มขึ้นจะมีอาการแสดงภาวะพร่องไทรอยด์ได้ชัดเจน
ผลของการตั้งครรภ์ต่อภาวะพร่องไทรอยด์ เนื่องจากการตั้งครรภ์มีอัตราเมแทบอลิซึมที่เพิ่มขึ้น มีความต้องการของฮอร์โมนไทรอยด์ที่เพิ่มขึ้น ทำให้ต้องใช้ฮอร์โมนทดแทนปริมาณที่เพิ่มขึ้น โดยมีความต้องการที่เพิ่มขึ้นเรื่อย ๆ ตั้งแต่อายุครรภ์ 4-6 สัปดาห์ และเริ่มคงที่หลังจากอายุครรภ์ 16 สัปดาห์
ผลของโรคต่อการตั้งครรภ์ ก่อนการตั้งครรภ์ส่งผลให้มีบุตรยากขึ้น และเมื่อตั้งครรภ์มีโอกาสพบภาวะแท้ง การคลอดก่อนกำหนด รกลอกตัวก่อนกำหนด ทารกเสียชีวิตในครรภ์ และส่งผลต่อระดับสติปัญญาของทารก
การดูแลให้คำปรึกษาก่อนการตั้งครรภ์
- ก่อนการตั้งครรภ์ ระดับ TSH ควรอยู่ในเกณฑ์ปกติ และมีค่าไม่เกิน 2.5 มล.ยูนิต/ลิตร
- การตั้งครรภ์มีความต้องการฮอร์โมนไทรอยด์มากขึ้น ตั้งแต่อายุครรภ์ 4-6 สัปดาห์ ดังนั้นควรหมั่นตรวจสอบว่าตั้งครรภ์หรือไม่อยู่เสมอ และหากเมื่อทราบว่าตั้งครรภ์ควรรีบพบแพทย์เพื่อปรับขนาดยาเพิ่มขึ้นร้อยละ 20-30 จากเดิม
การดูแลระหว่างตั้งครรภ์
- การใช้ไทรอยด์ฮอร์โมนทดแทน ควรใช้ levothyroxine ไม่ควรใช้ฮอร์โมนในรูปแบบอื่นที่มีส่วนประกอบของ T3 เนื่องจาก T4 มีส่วนสำคัญในการพัฒนาสมองของทารกในครรภ์ การได้รับฮอร์โมนทดแทนที่มี T3 ยิ่งทำให้เกิดการยับยั้งการหลั่ง TSH จากต่อมใต้สมอง ส่งผลให้ T4 ต่ำลง เกิดผลเสียต่อทารกในครรภ์ได้
- ตรวจติดตามระดับ TSH ทุก ๆ 4 สัปดาห์ จนถึงอายุครรภ์ 20 สัปดาห์ หลังจากนั้นตรวจอีกครั้งตอนอายุครรภ์ประมาณ 30 สัปดาห์
- โดยเป้าหมายของระดับ TSH ระหว่างตั้งครรภ์อยู่ที่ครึ่งล่างของเกณฑ์ปกติตามแต่ละอายุครรภ์ โดยหากไม่มีให้ใช้ระดับ TSH < 2.5 มล.ยูนิต/ลิตร
- การตรวจติดตามสุขภาพทารกในครรภ์ไม่ได้จำเป็น หากได้รับการรักษาอย่างเหมาะสม
- หลังคลอดปรับขนาด levothyroxine กลับไปสู่ขนาดเดิมก่อนตั้งครรภ์ หรือหยุดยาในกรณีได้รับยาเฉพาะในช่วงที่ตั้งครรภ์ และตรวจติดตาม TSH ที่ 6 สัปดาห์หลังคลอด
ในบางรายที่สาเหตุพร่องไทรอยด์เกิดจากโรค Hashimoto’s thyroiditis อาจต้องใช้ขนาดยามากกว่าก่อนตั้งครรภ์เนื่องจากโรคมีโอกาสกำเริบได้มากช่วงหลังคลอดใหม่ ๆ
Subclinical hypothyroidism
คือภาวะที่มีระดับ TSH ที่สูงกว่าค่าปกติ โดยที่ T4 อยู่ในเกณฑ์ปกติ ภาวะนี้พบว่ามีผลกระทบต่อการตั้งครรภ์ เพิ่มโอกาสการแท้ง การคลอดก่อนกำหนด ความดันโลหิตสูงขณะตั้งครรภ์ และมีผลกระทบต่อระดับสติปัญญาของเด็กได้
มีการศึกษาในการให้ฮอร์โมนทดแทนในกรณีมีภาวะไทรอยด์ต่ำแบบไม่มีอาการ ร่วมกับไม่มี anti-TPO พบว่าการให้ฮอร์โมนทดแทนในรายที่ TSH อยู่ในช่วง 4-10 มล.ยูนิต/ลิตร สามารถช่วยลดโอกาสการคลอดก่อนกำหนดได้ร้อยละ 62 และในอีกรายงานพบว่าถ้ามี anti-TPO ด้วยการให้ levothyroxine สามารถลดการคลอดก่อนกำหนดได้สูงถึงร้อยละ 70[11]
และในกรณีพบ anti-TPO ร่วมกับ TSH ≥ 2.5 มล.ยูนิต/ลิตร พบว่าการให้ levothyroxine ช่วยลดผลรวมของการเกิดครรภ์เป็นพิษ การแท้ง การคลอดก่อนกำหนดได้
โดยสรุป ATA จึงแนะนำให้การรักษาด้วย levothyroxine ในกรณีดังต่อไปนี้
- TSH > 10 มล.ยูนิต/ลิตร โดยไม่คำนึงถึง anti-TPO
- TSH มากกว่าค่าปกติระหว่างตั้งครรภ์ (≥ 4 มล.ยูนิต/ลิตร) ร่วมกับตรวจพบ anti-TPO
และอาจพิจารณาให้การรักษาได้เมื่อ
- TSH มากกว่าค่าปกติ แต่ตรวจไม่พบ anti-TPO
- TSH ≥ 2.5 มล.ยูนิต/ลิตร ร่วมกับตรวจพบ anti-TPO
ในกรณีที่พบ anti-TPO แต่ไม่มีความผิดปกติของฮอร์โมนไทรอยด์ พบว่าเมื่อตั้งครรภ์ร้อยละ 40 มีโอกาส ที่จะพบความผิดปกติได้ในภายหลัง จึงแนะนำให้ตรวจติดตามระดับ TSH เช่นเดียวกับผู้ที่มีภาวะพร่องไทรอยด์
Isolated hypothyroxinemia
คือภาวะที่มีระดับ TSH ปกติ แต่มี FT4 ต่ำกว่าปกติ (< เปอร์เซ็นไทล์ที่ 2.5-5th) สาเหตุเชื่อว่าเกิดจากการขาดไอโอดีน ทำให้ไทรอยด์ผลิตฮอร์โมนที่มีการใช้ไอโอดีนน้อยกว่า นั่นคือมีการสร้าง T3 เป็นสัดส่วนที่มากขึ้น ทำให้ปริมาณ T4 ลดลง และบางส่วนเชื่อว่าเกิดจากภาวะอ้วน ทำให้ leptin เพิ่มขึ้น มีการเปลี่ยน T4 เป็น T3 เพิ่มขึ้น
ภาวะนี้บางรายงานพบว่ามีผลกับระดับสติปัญญาของเด็ก แต่การให้ฮอร์โมนทดแทนในภาวะนี้ไม่ได้มีประโยชน์เพิ่มขึ้น จึงไม่แนะนำการให้ฮอร์โมนทดแทนในภาวะนี้ [1] (ในกรณีที่มีภาวะขาดไอโอดีนอาจพิจารณาให้การรักษาด้วย levothyroxine ได้ [5])
Postpartum thyroiditis
คือภาวะที่มีการทำงานของไทรอยด์ผิดปกติ ในช่วง 1 ปีแรกหลังคลอดบุตร เกิดจากความผิดปกติของระบบภูมิคุ้มกัน โดยพบมากในผู้ที่ตรวจพบ anti-TPO, anti Tg โดยสาเหตุที่พบในช่วงหลังคลอด เนื่องจากในระหว่างตั้งครรภ์มีการกดการทำงานของภูมิคุ้มกัน และการยับยั้งลดลงในช่วงหลังคลอด
อาการแสดงแบ่งออกเป็น 2 ช่วง โดยช่วงแรกเป็นช่วง hyperthyoidism และช่วงหลังเป็น hypothyroidism
การวินิจฉัยแยกโรคระหว่าง postpartum thyroiditis และ Graves’ disease ในช่วง thyrotoxicosis มีความจำเป็นเนื่องจากการรักษาแตกต่างกัน โดยการแยกกันอาศัยปัจจัยดังต่อไปนี้
- ระยะเวลาที่เริ่มแสดงอาการ โดย postpartum thyroiditis มักเกิดภายใน 3 เดือนแรกหลังคลอดส่วน Graves’ disease เกิดขึ้นหลังคลอด 6.5 เดือน
- การตรวจ TRAb โดยใน Graves’ disease จะตรวจพบ TRAb
- การตรวจพบ Graves’ ophthalmopathy หรือ thyroid bruit บ่งบอกการเป็น Graves’ disease
- สัดส่วนของ T4:T3 เพิ่มมากขึ้น บ่งบอกสาเหตุจาก postpartum thyroiditis
- การตรวจยืนยันสามารถทำได้โดย RAIU แต่ต้องงดให้นมบุตรหลังจากการตรวจเป็นเวลาหลายวัน
การรักษาไม่แนะนำการให้ยาต้านไทรอยด์ เนื่องจากกลไกการเกิดโรคเกิดจากการบาดเจ็บและมีการปลดปล่อยฮอร์โมน ไม่ได้เกิดจากการผลิตฮอร์โมนที่มากเกิน แนะนำให้รักษาประคับประคองด้วยการให้ยา beta-blocker และตรวจติดตาม TSH ทุก 4-8 สัปดาห์ เพื่อเฝ้าระวังช่วงการเปลี่ยนไปเป็น hypothyroidism
ในช่วง hypothyroidism หากมีอาการสามารถให้การรักษาด้วย levothyroxine ได้ และตรวจติดตามระดับ TSH ทุก 6-8 สัปดาห์ และพิจารณาหยุดยาหลังจากคลอดบุตรได้ 1 ปี หลังจากนั้นตรวจติดตามระดับ TSH ทุก 1 ปี เนื่องจากร้อยละ 10-50 ของผู้ป่วยมีความผิดปกติเกิดขึ้นได้ในภายหลัง
Thyroid nodule
ก้อนที่ต่อมไทรอยด์ มีความสำคัญคือมีโอกาสที่จะกลายเป็นมะเร็งได้ โดยพบในก้อนที่ไม่ผลิตฮอร์โมนไทรอยด์ การดูแลรักษาภาวะนี้ในระหว่างตั้งครรภ์ เป้าหมายเพื่อที่จะวินิจฉัยว่าเป็นมะเร็งหรือไม่ โดยอาศัยการซักประวัติครอบครัวว่ามีโรค familial medullary thyroid carcinoma, multiple endocrine neoplasia type 2 (MEN 2), familial papillary thyroid carcinoma หรือไม่ ร่วมกับตรวจระดับการทำงานของไทรอยด์ โดยหากพบ TSH ต่ำตลอดการตั้งครรภ์ สามารถเลื่อนการตรวจวินิจฉัยไปทำช่วงหลังคลอดได้ เนื่องจากมีความเสี่ยงต่ำในการเป็นมะเร็ง
หาก TSH อยู่ในระดับปกติ แนะนำการตรวจอังตราซาวนด์ไทรอยด์ เพิ่มเติม และในกรณีมีความผิดปกติควรได้รับการตรวจต่อด้วย fine needle aspiration (FNA)
โดยหากพบว่าเป็นมะเร็งไทรอยด์ขณะตั้งครรภ์ ในกรณีเป็น papillary thyroid carcinoma (PTC) หรือ follicular thyroid cancer (FTC) สามารถให้การรักษาด้วย levothyroxine เพื่อกดระดับ TSH ให้อยู่ในช่วง 0.3-2.0 มล.ยูนิต/ลิตร และตรวจติดตามขนาดก้อนด้วยอัลตราซาวนด์ ได้ โดยหากพบก้อนมีขนาดโตขึ้นก่อนอายุครรภ์ 24-26 สัปดาห์ หรือพบว่ามีการลุกลามไปต่อมน้ำเหลือง แนะนำให้ผ่าตัดในช่วงไตรมาสที่ 2 แต่หากไม่พบสามารถรอผ่าตัดหลังคลอดได้
แต่หากพบเป็นมะเร็งชนิด medullary carcinoma หรือ anaplastic cancer มีพยากรณ์โรคที่ไม่ดี จึงควรผ่าตัดในระหว่างตั้งครรภ์ [1]
บทสรุป
ความผิดปกติของไทรอยด์เป็นภาวะที่พบได้บ่อย และมีแนวโน้มที่จะพบได้มากขึ้นตามอายุหญิงตั้งครรภ์ที่มีแนวโน้มสูงขึ้น การดูแลรักษา หน้าที่หลักของสูติแพทย์คือการให้ทารกในครรภ์มีภาวะไทรอยด์ปกติ มีพัฒนาการที่ปกติ โดยให้มารดามีอาการน้อยที่สุด และเฝ้าระวังภาวะแทรกซ้อนที่อาจเกิดขึ้นได้ระหว่างตั้งครรภ์ ซึ่งทั้งหมดนี้ต้องอาศัยความเข้าใจในสรีรวิทยาของต่อมไทรอยด์ และกลไกการเกิดโรคตามที่ได้กล่าวมาทั้งหมด
เอกสารอ้างอิง
- 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum. Thyroid®. 2017;27(3):315-89.
- Loscalzo J, Fauci A, Kasper D, et al. Harrison’s Principles of Internal Medicine, 21e. New York, NY: McGraw-Hill Education; 2022.
- Kinomoto-Kondo S, Umehara N, Sato S, et al. The effects of gestational transient thyrotoxicosis on the perinatal outcomes: a case-control study. Arch Gynecol Obstet. 2017;295(1):87-93.
- Morshed SA, Ando T, Latif R, et al. Neutral antibodies to the TSH receptor are present in Graves’ disease and regulate selective signaling cascades. Endocrinology. 2010;151(11):5537-49.
- Lockwood CJ. Creasy and Resnik’s maternal-fetal medicine : principles and practice. Amsterdam: Elsevier; 2022.
- Cunningham FG, Leveno KJ, Dashe JS, et al. Editors. Williams Obstetrics, 26e. New York, NY: McGraw Hill; 2022.
- Andersen SL, Olsen J, Wu CS, et al. Birth Defects After Early Pregnancy Use of Antithyroid Drugs: A Danish Nationwide Study. The Journal of Clinical Endocrinology & Metabolism. 2013;98(11):4373-81.
- Indications for Outpatient Antenatal Fetal Surveillance: ACOG Committee Opinion, Number 828. Obstet Gynecol. 2021;137(6):e177-e97.
- Bai C-F, Shen G-H, Yang Y, et al. Subacute thyroiditis during early pregnancy: a case report and literature review. BMC Pregnancy and Childbirth. 2022;22(1):19.
- van Trotsenburg ASP. Management of neonates born to mothers with thyroid dysfunction, and points for attention during pregnancy. Best Practice & Research Clinical Endocrinology & Metabolism. 2020;34(4):101437.
- Nazarpour S, Ramezani Tehrani F, Simbar M, et al. Effects of levothyroxine treatment on pregnancy outcomes in pregnant women with autoimmune thyroid disease. Eur J Endocrinol. 2017;176(2):253-65.